生长素参与调控植物发育和生长的多个过程,包括籽粒大小和硬度形成[1],其在植物体内的分布主要通过生物合成、降解、结合和运输的方式进行调节[2]。生长素在植物组织中的浓度梯度影响细胞的伸长、分裂和分化等过程,从而调节植物顶端优势的形成、果实成熟、对光和重力的感应等[3]。生长素外排转运蛋白PIN-formed(PIN)在植物生长素极性转运中起关键作用,在细胞膜上呈极性分布,主要负责将细胞内的生长素运送至胞外。PIN蛋白结构包括可变的中央亲水环以及保守的N端和C端疏水跨膜结构域。根据亲水结构特异性可将其分为具有较短亲水区的Short PINs和较长亲水区的Long PINs两类[4-5]。Short PINs蛋白为非经典型PIN蛋白,主要定位在内囊体上,在胞浆和内质网上充当媒介作用;而Long PINs蛋白为经典型PIN蛋白,主要定位在质膜,具有将生长素转运至细胞外的作用[6]。
研究表明,PIN基因表达受外源激素调控。烟草NtPIN4基因可显著响应外源IAA的诱导[7],水杨酸通过调节拟南芥中PIN2基因的表达水平和PIN2蛋白的内吞过程,从而影响植株向重力性根生长和根毛发育[8]。外源GR24和Lovastatin(LVS)处理可降低苹果MdPIN15的表达量,而6-BA处理则提高了MdPIN15的表达量[9]。目前,PIN家族基因已在拟南芥[10]、玉米[11]、番茄[12]、苹果[13]和桃[14]等植物中被鉴定,PIN基因的功能也得到了进一步的研究。生长素运输对果实形成具有重要意义,在番茄中生长素外排运输抑制剂的应用会导致单性果实发育[15]。SlPIN4在番茄果实发育中高表达,RNA干扰(RNAi)技术特异性沉默SlPIN4基因的转基因番茄果实表现出部分或完全单性生殖表型[16],表明PIN基因在果实种子形成过程中发挥重要作用。拟南芥AtPIN1在胚珠早期形成过程中起主要作用,而At‐PIN3通过影响胚珠发生的重要调控因子STK的功能以及调节极性生长素运输和生长素响应来调控胚珠后期发育和雌蕊生长[17]。水稻OsPIN5b可调控植株株型并影响其产量[18]。种子硬度形成的关键是木质素的合成与积累,IAA和GA3能够提高核桃内果皮木质素含量,且IAA对核桃内果皮的硬化具有促进作用[19]。PIN基因在木质素积累过程中具有调控作用,库尔勒香梨PbPIN2基因在番茄中过表达导致转基因番茄植株木质素含量增加[20]。
石榴(Punica granatum L.)是千屈菜科石榴属落叶灌木或小乔木,是集食用、药用和观赏价值于一身的特色经济林树种。籽粒大小及硬度直接影响果实的可食率和口感,软籽石榴食用方便,深受消费者喜爱。石榴籽粒发育受植物体内多种基因协同调控,喷施外源激素如赤霉素、2,4-D等也会导致石榴籽粒硬度增大[21]。种子发育过程高度依赖生长素浓度梯度的调控,然而石榴中PIN基因对IAA运输机制及在石榴生长发育过程中的功能和调节机制尚不清楚。通过对石榴PIN基因家族成员鉴定、理化特性及表达调控机制分析,旨在了解其潜在的生物学功能,进而为石榴籽粒大小和硬度形成机制及遗传调控奠定基础。
1 材料和方法
1.1 植物材料及处理
供试材料为大笨子石榴品种,栽培于安徽省农业科学院岗集农业试验示范基地石榴种质资源圃,植株进行常规化病虫害管理和施肥,树龄为9 a(年)。选取授粉后15 d且长势一致的大笨子幼果为材料,进行外源生长素处理。以100 mg·L-1生长素类似物α-萘乙酸(NAA)喷施果实,以喷施清水为对照,并挂牌标记;3 d后分别对幼果复喷;在授粉后的第30、60、90、120天分别取样并测定相关指标。
用于外源IAA处理的幼苗为大笨子,果实种子经过春化处理后种植于基质中,待植株长到5 cm且生长健壮后将其移入1/2 Hoagland营养液中,置于恒温培养箱中。待石榴幼苗长至约10 cm,用含有0.1 mmol·L-1 IAA的1/2 Hoagland培养液进行处理,以1/2 Hoagland培养液为对照。采集处理6 h和12 h后的根系用于PIN基因的表达分析。
1.2 PIN基因家族的鉴定与理化性质分析
利用大笨子全基因组序列[22]进行石榴PIN基因家族成员鉴定,序列及注释文件来自NCBI(https://www.ncbi.nlm.nih.gov/datasets/genome/GCA_002201585.1/)。利用TAIR数据库(https://www.arabidopsis.org/)下载拟南芥的8个PIN蛋白序列作为参考序列[23],通过本地Blast软件将这些序列与石榴基因组进行同源比对。以PIN蛋白中的PF03547结构域(来自Pfam数据库,http://pfam-legacy.xfam.org/)为查询序列,筛选出石榴基因组中含有跨膜结构域Mem_trans的基因,删除冗余序列后,获得PgrPIN候选基因。利用在线工具ExPASy中的ProtParam(https://www.expasy.org/resources/protparam)预测氨基酸数、等电点、不稳定系数等。利用WoLF PSORT程序预测蛋白质的亚细胞定位。使用Tbtools软件进行基因染色体定位,并根据基因在染色体上的位置依次命名。
1.3 PIN基因家族成员的系统进化树构建
利用ClustalW软件比对分析石榴、拟南芥、巨桉、葡萄和杨树的PIN蛋白序列,并去除明显差异的序列,利用MEGA11软件分析比对结果。利用邻接法(neighbor-joining,NJ)构建5种植物的PIN蛋白序列的系统发育进化树,Bootstrap值设置为1000,采用“p-distance”验证可信度,缺口设置为“Pairwise deletion”[24]。
1.4 PIN基因家族启动子顺式作用元件分析
利用Tbtools软件提取石榴PIN基因家族成员上游2000 bp的启动子序列,将启动子序列提交至在线工具PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/),对顺式作用元件进行预测和分析[25]。
1.5 PIN基因家族的表达谱分析及定量PCR分析
从NCBI SRA(Sequence Read Archive database)数据库中下载硬籽石榴大笨子不同组织(根、叶、花、果皮、内种皮和外种皮等)以及硬籽石榴大笨子和软籽石榴突尼斯不同发育阶段的内、外种皮转录组数据[26](登录号SRP100581和SRP121814),并将各基因表达水平FPKM值转换为log2值后,利用Tbtools软件绘制热图。
取NAA处理的授粉后30、60、90、120 d的果实,使用多糖多酚植物总RNA提取试剂盒(天根生化科技有限公司)提取总RNA,然后用HiScript Ⅲ RT SuperMix for qPCR(+gDNA wiper)试剂盒(南京诺唯赞生物科技有限公司)反转录成cDNA。根据石榴PIN基因家族成员CDS序列,利用Primer 5.0软件设计特异性引物交由通用生物(安徽)股份有限公司合成,具体引物序列见表1。内参基因为PgrActin7,采用2-ΔΔCT计算基因的相对表达量。用SPSS软件的单因素LSD法进行差异显著性分析。使用chiplot在线工具(https://www.chiplot.online/.)进行相关性分析和热图绘制。
表1 qRT-PCR引物序列
Table 1 Primer sequences of qRT-PCR
引物名称 Primer name PgrActin7-F PgrActin7-R PgrPIN1-F PgrPIN1-R PgrPIN2-F PgrPIN2-R PgrPIN3-F PgrPIN3-R PgrPIN5-F PgrPIN5-R PgrPIN14-F PgrPIN14-R碱基序列Nucleobase sequence (5'-3')TATTGTTGGTCGTCCCAGGC CCTCTCTTCGATTGGGCCTC GGGATTTGGAGGGGAGGACTT CGCGACAGCTTTGGGGTCTA TACATGTCGCCATCGTCCAG GCGATCAGCATCCCAAATATG ATCATGGGTTTTGCGCTCTGG TGCTAAGGGAGAAGCCGGTCA CTTCCATCGCCATCGGCTTAC TCACCCCGGTGCTGAGAATG CAGGGGATTGTTCCCTTTGTC GGGAGAGCTATTAGCATACCG
1.6 果实和籽粒生长指标的测定
取NAA处理的授粉后30 d、60 d、90 d和120 d的石榴果实,用天平测定其单果质量、百粒质量、核百粒质量,用游标卡尺测定果实纵径、果实横径、籽粒纵径、籽粒横径、核纵径、核横径。使用TA-XT质构仪测定籽粒硬度,参照秦改花等[27]的测定方法。由于在第30天时石榴籽粒中的内种皮尚未分化形成,故从第60天时测定籽粒硬度。每个处理组选取60粒新鲜籽粒,使用纱布将外种皮搓出后保湿用于籽粒硬度测定。
2 结果与分析
2.1 PIN基因家族的鉴定与理化性质分析
在石榴全基因组中共鉴定出15个PIN基因家族成员,根据其在染色体上的位置分布依次命名为PgrPIN1~PgrPIN15(表2)。PgrPINs基因家族可编码267(PgrPIN4)~667(PgrPIN8)个氨基酸;分子质量为29.62 kDa(PgrPIN4)~74.79 kDa(PgrPIN8);预测等电点范围为6.29(PgrPIN4)~9.80(PgrPIN15)。除PgrPIN4和PgrPIN8为酸性蛋白外,其余13个PgrPIN成员均为碱性蛋白,说明PgrPINs蛋白之间的酸碱差异性较小。蛋白亲水疏水性分析结果表明,仅有PgrPIN13与PgrPIN14为亲水性蛋白,但其亲水性较弱。PgrPIN13的GRAVY值仅为-0.021,PgrPIN14的GRAVY值仅为-0.025,其他皆为疏水性蛋白(GRAVY>0)。石榴PIN蛋白不稳定系数分析表明,PgrPIN1、PgrPIN8及PgrPIN10为不稳定蛋白(不稳定系数>40),其余12个PgrPIN成员皆为稳定蛋白(不稳定系数<40)。除PgrPIN3、PgrPIN4和PgrPIN10外,其余PgrPIN蛋白的亚细胞定位均预测在质膜上。
表2 石榴PIN基因家族成员的理化特征
Table 2 Physical and chemical characteristics of pomegranate PIN gene family members
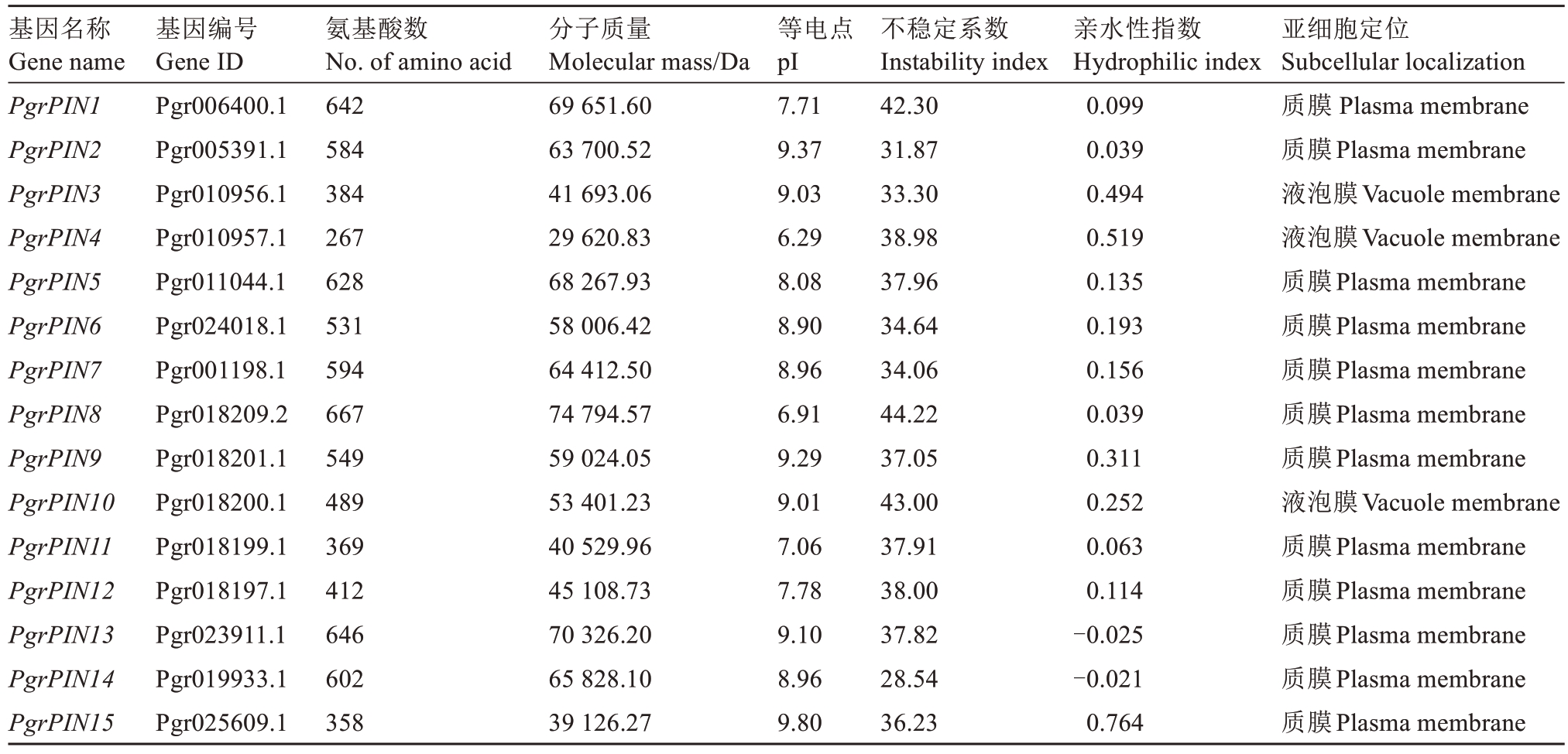
基因名称Gene name PgrPIN1 PgrPIN2 PgrPIN3 PgrPIN4 PgrPIN5 PgrPIN6 PgrPIN7 PgrPIN8 PgrPIN9 PgrPIN10 PgrPIN11 PgrPIN12 PgrPIN13 PgrPIN14 PgrPIN15基因编号Gene ID Pgr006400.1 Pgr005391.1 Pgr010956.1 Pgr010957.1 Pgr011044.1 Pgr024018.1 Pgr001198.1 Pgr018209.2 Pgr018201.1 Pgr018200.1 Pgr018199.1 Pgr018197.1 Pgr023911.1 Pgr019933.1 Pgr025609.1氨基酸数No. of amino acid 642 584 384 267 628 531 594 667 549 489 369 412 646 602 358分子质量Molecular mass/Da 69 651.60 63 700.52 41 693.06 29 620.83 68 267.93 58 006.42 64 412.50 74 794.57 59 024.05 53 401.23 40 529.96 45 108.73 70 326.20 65 828.10 39 126.27等电点pI 7.71 9.37 9.03 6.29 8.08 8.90 8.96 6.91 9.29 9.01 7.06 7.78 9.10 8.96 9.80不稳定系数Instability index 42.30 31.87 33.30 38.98 37.96 34.64 34.06 44.22 37.05 43.00 37.91 38.00 37.82 28.54 36.23亲水性指数Hydrophilic index 0.099 0.039 0.494 0.519 0.135 0.193 0.156 0.039 0.311 0.252 0.063 0.114-0.025-0.021 0.764亚细胞定位Subcellular localization质膜 Plasma membrane质膜Plasma membrane液泡膜Vacuole membrane液泡膜Vacuole membrane质膜Plasma membrane质膜Plasma membrane质膜Plasma membrane质膜Plasma membrane质膜Plasma membrane液泡膜Vacuole membrane质膜Plasma membrane质膜Plasma membrane质膜Plasma membrane质膜Plasma membrane质膜Plasma membrane
2.2 PIN基因家族的系统进化分析
为了进一步分析PIN基因家族成员的进化关系,将石榴PIN蛋白全长序列与模式植物拟南芥、葡萄、巨桉和杨树等物种的PIN基因家族成员进行系统进化分析,根据进化树的分支,可将PIN基因分为两类,经典型(canonical type)和非经典型(noncanonical type)。这5个物种的PIN家族基因均有经典型与非经典型两类PIN蛋白,石榴中经典型PIN蛋白有7个,非经典型PIN蛋白有8个(图1)。在这5个物种中,石榴PIN基因家族与巨桉亲缘关系较近。
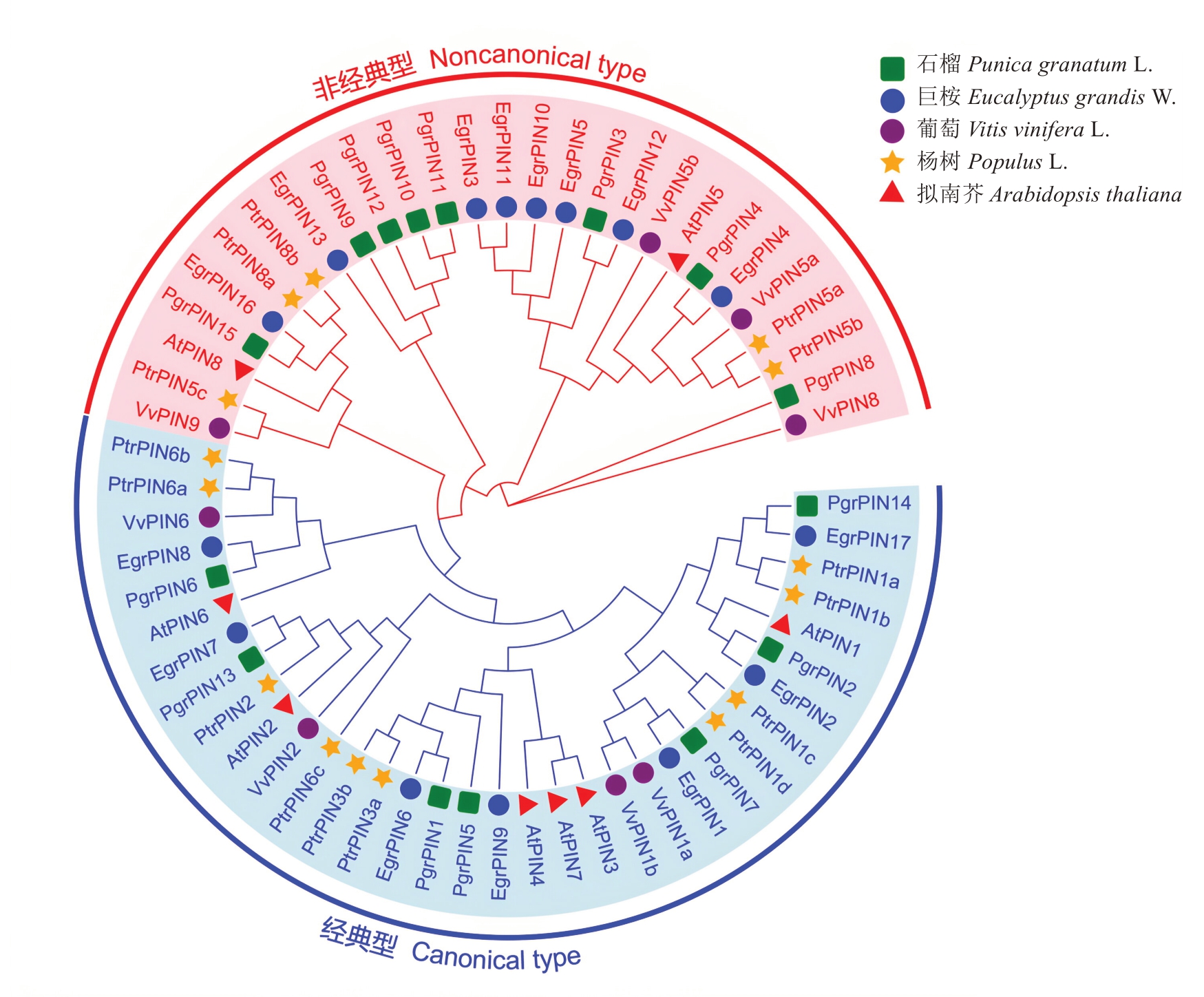
图1 石榴、拟南芥、巨桉、葡萄和杨树PIN蛋白的系统进化分析
Fig. 1 Phylogenetic analysis of PIN protein in pomegranate, Arabidopsis, Eucalyptus grandis, grape, and poplar
2.3 PIN基因家族的时空表达模式分析
为进一步分析石榴PIN基因的表达特性与功能,利用已发表的两组RNA-seq数据对PgrPINs基因的组织表达情况进行分析,结果显示15个PgrPINs基因在6个组织中均有表达,并表现出组织特异性(图2-A)。PgrPIN1、PgrPIN2、PgrPIN5和PgrPIN14主要在根、叶、花、果皮和内种皮中表达;PgrPIN3主要在花和内种皮中特异性表达;PgrPIN7主要在根、叶和花中特异性表达;PgrPIN8主要在花和果皮中特异性表达,这些在特定组织中表现出高表达水平的基因可能在其生长发育过程中发挥重要作用。其余8个PgrPINs基因在石榴6个组织中也有表达,但不同组织间的表达水平相较于上述PgrPINs无明显差异。
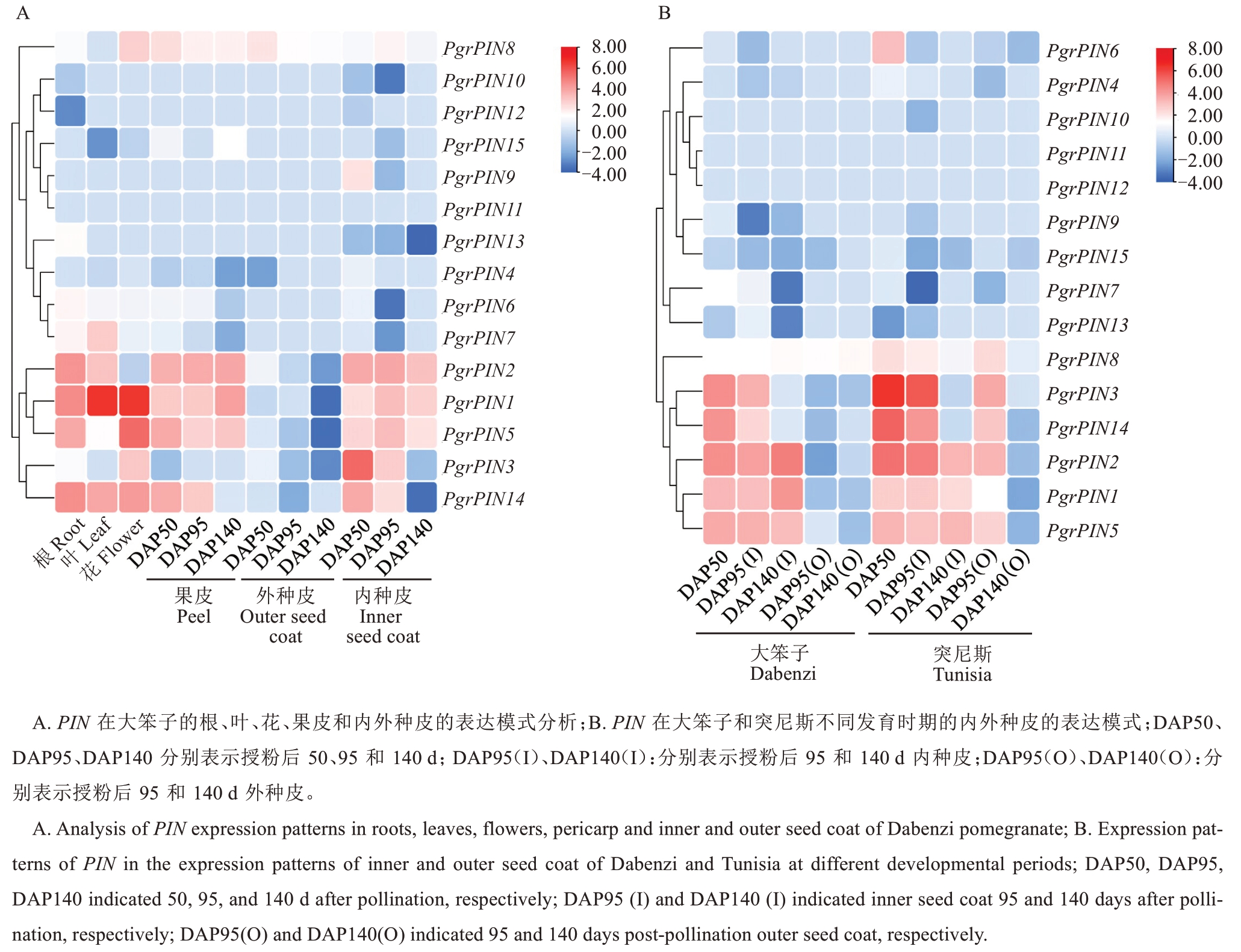
图2 石榴PIN基因家族时空表达模式分析
Fig. 2 Analysis of spatiotemporal expression patterns of pomegranate PIN gene family
对PgrPINs在2个品种内、外种皮3个发育阶段的表达模式进行分析发现,在大笨子和突尼斯2个品种内种皮中高表达的基因有PgrPIN1、PgrPIN2、PgrPIN3、PgrPIN5和PgrPIN14(图2-B),且主要在内种皮中表达,推测这5个基因可能参与调控石榴内种皮的发育。其中PgrPIN1和PgrPIN5在大笨子内种皮中的相对表达水平高于突尼斯,PgrPIN2、PgrPIN3和PgrPIN14在突尼斯内种皮中的相对表达水平高于大笨子。此外PgrPIN1、PgrPIN2主要在大笨子内种皮的发育晚期高水平表达,PgrPIN3和PgrPIN14在大笨子与突尼斯内种皮的发育早期均高表达。因此推测高表达的PgrPIN1、PgrPIN2、PgrPIN3、PgrPIN5和PgrPIN14可能在石榴内种皮发育及硬度形成过程中发挥作用,且在内种皮不同发育时期及不同籽粒硬度的品种中表达水平具有差异。
2.4 PIN基因家族启动子区顺式作用元件分析
为进一步了解PgrPINs基因差异表达的分子机制,对PgrPINs启动子区的顺式作用元件进行分析。结果表明PgrPINs基因包含大量与激素调控、光反应、胁迫诱导及生长发育相关的顺式作用元件(图3),包含与抗逆相关的脱落酸作用元件(ABRE)、茉莉酸甲酯作用元件(CGTCA-motif和TACG-motif)、干旱胁迫反应元件(MBS)、水杨酸作用元件(TCA-element)、抗逆元件(TC-rich repeats)、生长素的顺式作用元件(TGA-element和AuxRRcore)、赤霉素反应元件(P-box和GARE-motif)和低温反应元件(LTR),以及与种子发育相关的胚乳发育元件(GCN4_motif)。其中激素、光和胁迫响应元件占比较高,表明激素信号、光信号和逆境胁迫信号可能调控生长素介导的石榴生长发育过程。此外广泛存在的茉莉酸甲酯作用元件、脱落酸作用元件和抗逆元件可能与石榴自身对逆境的高度耐受有密切关系。与种子发育相关的胚乳发育元件有3个,分别分布在PgrPIN4、PgrPIN7、PgrPIN14。响应生长素的顺式作用元件TGA-element、AuxRR-core,除PgrPIN2、PgrPIN8、PgrPIN13和PgrPIN14外,在PgrPINs启动子区均有分布。
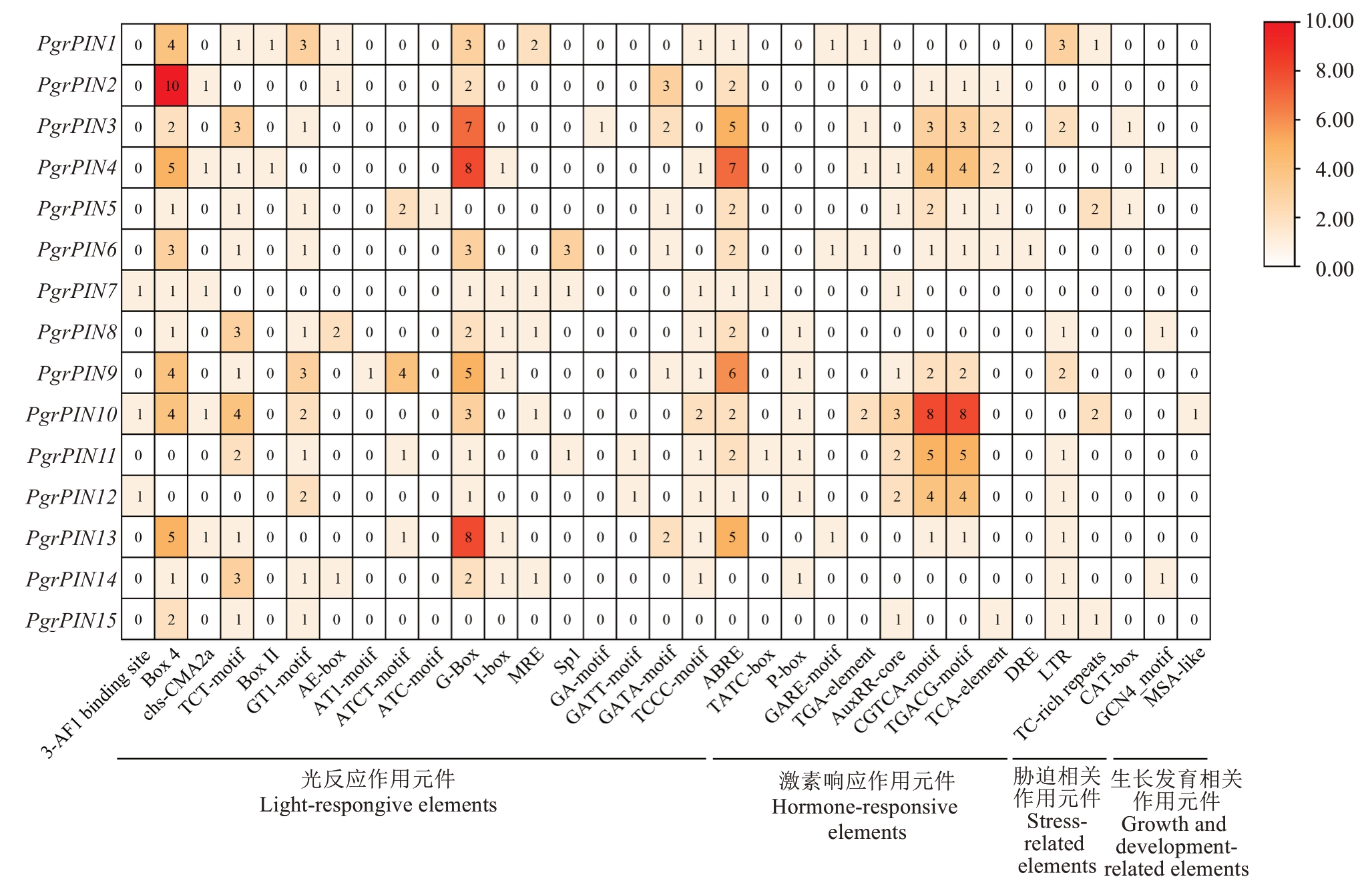
图3 石榴PIN基因家族顺式作用元件数量
Fig. 3 Number of cis-acting elements in the pomegranate PIN gene family
2.5 PIN基因表达对外源IAA的响应
为进一步分析PgrPINs响应生长素的表达模式,对5个候选PgrPINs基因在外源IAA处理的石榴幼苗中的表达水平进行了分析。结果(图4)显示,PgrPIN1、PgrPIN3的表达量在外源IAA处理后12 h时显著增加(P<0.05),PgrPIN5和PgrPIN14的表达量在外源IAA处理12 h时显著下降,PgrPIN2对外源IAA不响应。

图4 石榴PIN基因在IAA处理下的表达分析Fig. 4 Expression analysis of pomegranate PIN gene under IAA treatment
2.6 外源生长素对PIN基因表达及果实与籽粒生长发育的影响
为进一步探究PIN基因对果实与籽粒生长发育的影响,分析了果实发育过程中4个候选PIN基因在内种皮的表达特点,及其对外源生长素的响应模式和对果实与籽粒生长变化的影响。如图5所示,在石榴内种皮发育过程中,PgrPIN1呈现先升高后降低、随后再次上升的变化趋势,而PgrPIN3、PgrPIN5与PgrPIN14在30 d相对表达水平较高,随着种子发育进程表达水平逐渐降低。经过NAA处理后,PgrPIN1和PgrPIN3在30 d时的表达水平显著升高;PgrPIN5的相对表达水平呈现快速上升后下降、随后缓慢上升的变化趋势,在60 d的相对表达水平最高,并高于其他3个时期,且从60 d开始PgrPIN5在NAA处理下的相对表达水平均显著高于对照;PgrPIN14的相对表达水平呈下降趋势,最高表达量出现在内种皮发育早期。因此在NAA处理下,PgrPIN5主要在内种皮的发育后期呈现高水平表达,而对照组主要在早期高表达;PgrPIN14在处理组与对照组中均于内种皮发育早期高表达,这些结果表明PgrPINs可能在外源NAA激素响应中发挥作用,并且在籽粒发育不同时期表达水平存在差异。
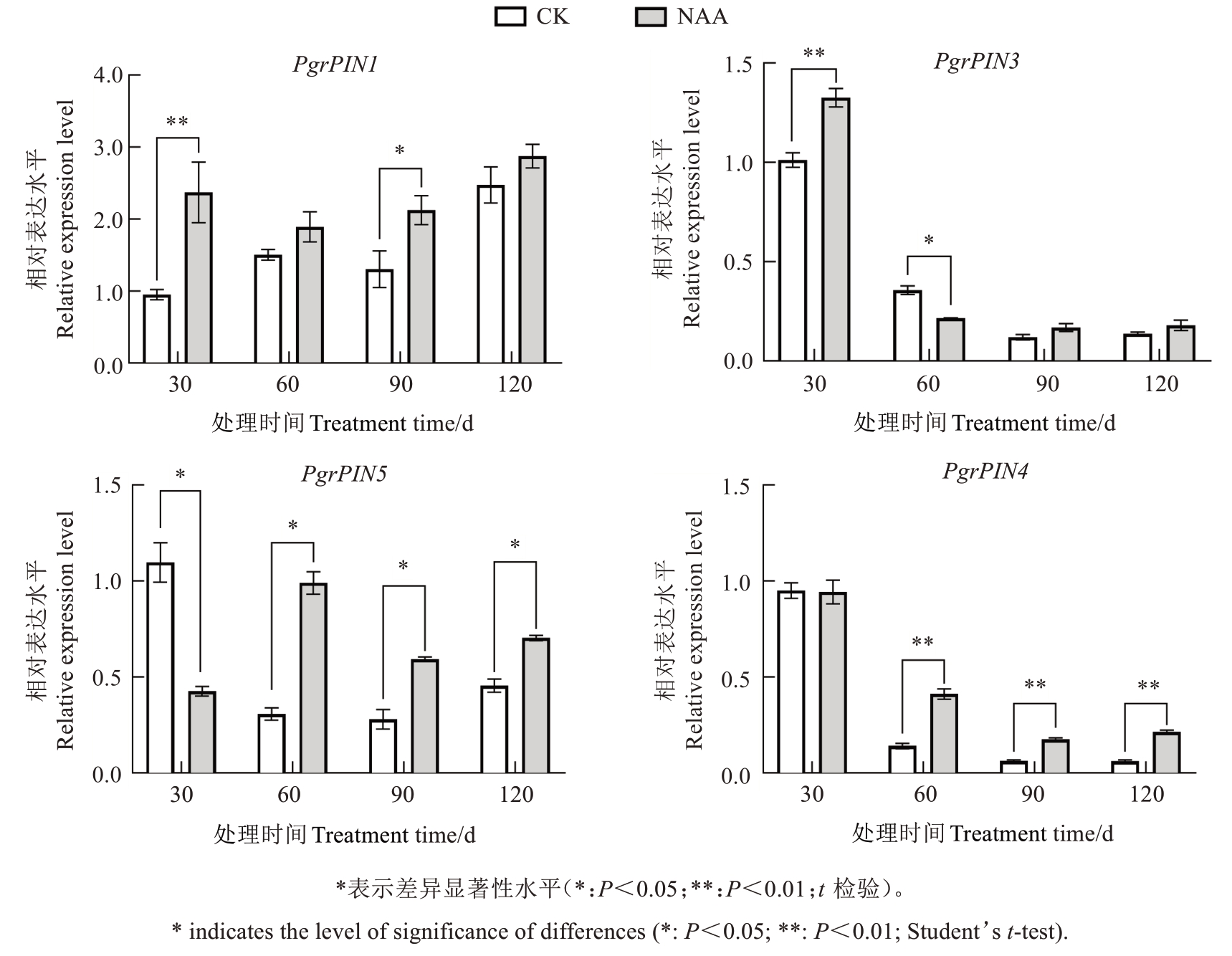
图5 NAA处理果实不同发育阶段内种皮PgrPINs相对表达水平的变化
Fig. 5 Changes in relative expression levels of endodermal PgrPINs during different developmental processes in NAA-treated fruits
对生长素NAA处理后石榴果实单果质量与纵横径的变化趋势进行分析,发现NAA处理后单果质量和百粒质量均呈现显著升高趋势(图6),石榴籽粒纵横径、内种皮百粒质量较对照显著增加,表明外源NAA处理对石榴果实发育及籽粒生长具有促进作用。
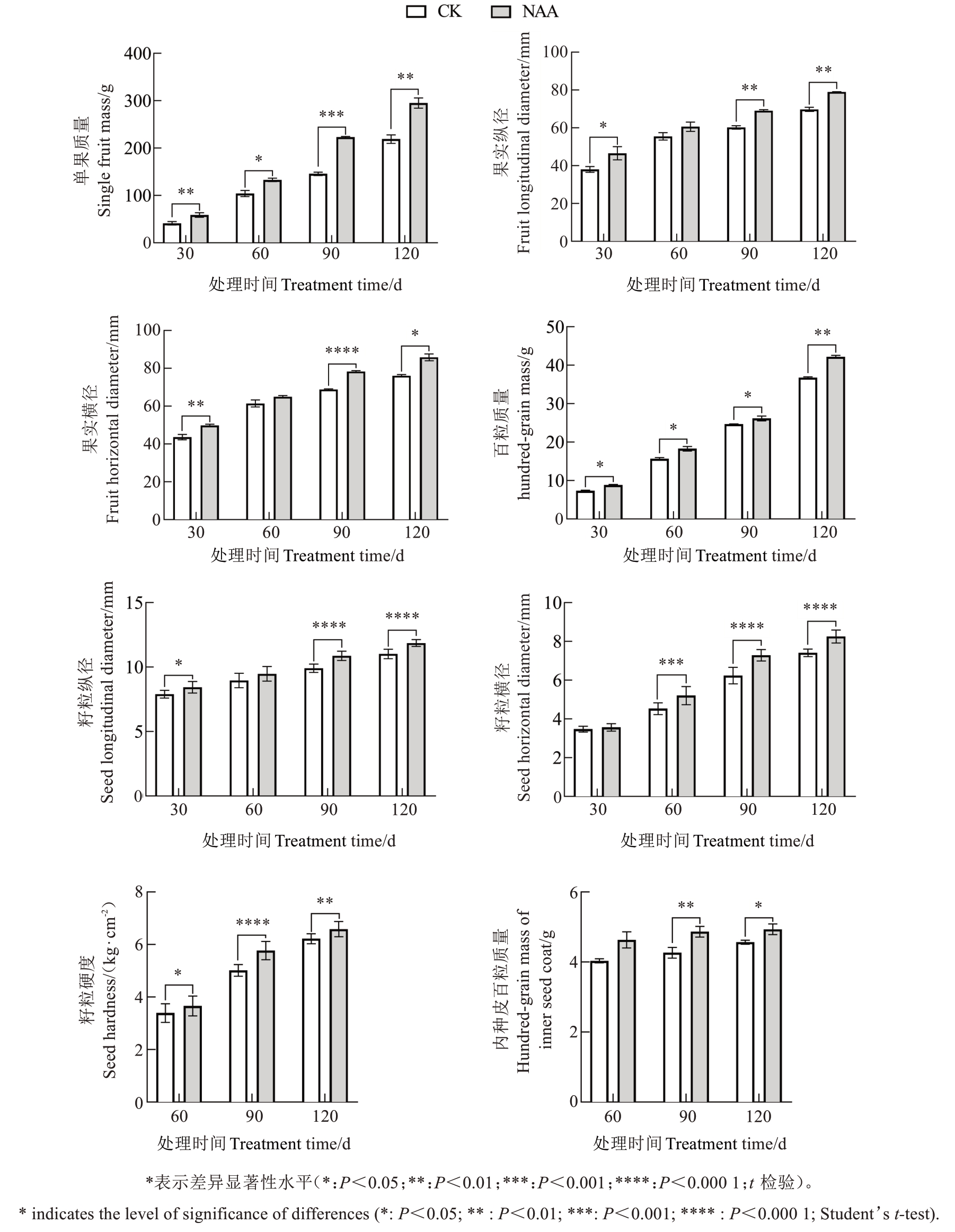
图6 NAA处理对石榴果实及籽粒形态指标的影响
Fig. 6 The effect of NAA treatment on morphological indicators of pomegranate fruits and seeds
NAA处理对石榴种子发育具有显著促进作用(图6)。NAA处理后90 d和120 d的内种皮纵横径及百粒质量均呈现显著增加的趋势。在60 d至90 d期间,籽粒硬度呈现快速增长趋势,在90 d至120 d期间增长速率降低。NAA处理后的籽粒硬度显著高于对照组,第90天时用NAA处理后的籽粒硬度相比对照组的籽粒硬度增幅最大,为10.96%。总体而言,在3个生长时期中NAA处理后籽粒硬度变化均显著增加,其中90 d时经激素处理的籽粒硬度相比对照增长趋势明显,推测60~90 d可能是其硬度形成的关键期。
为了进一步探究PIN候选基因表达水平与种子发育及硬度形成的关系,对4个候选PgrPINs表达水平与果实、籽粒生长相关指标及籽粒硬度进行了相关性分析。结果(图7)表明,PgrPIN1表达水平与果实、籽粒大小及籽粒硬度呈显著正相关,其中PgrPIN1表达水平与百粒质量、内种皮百粒质量和籽粒硬度的相关系数分别为0.87、0.77和0.75。
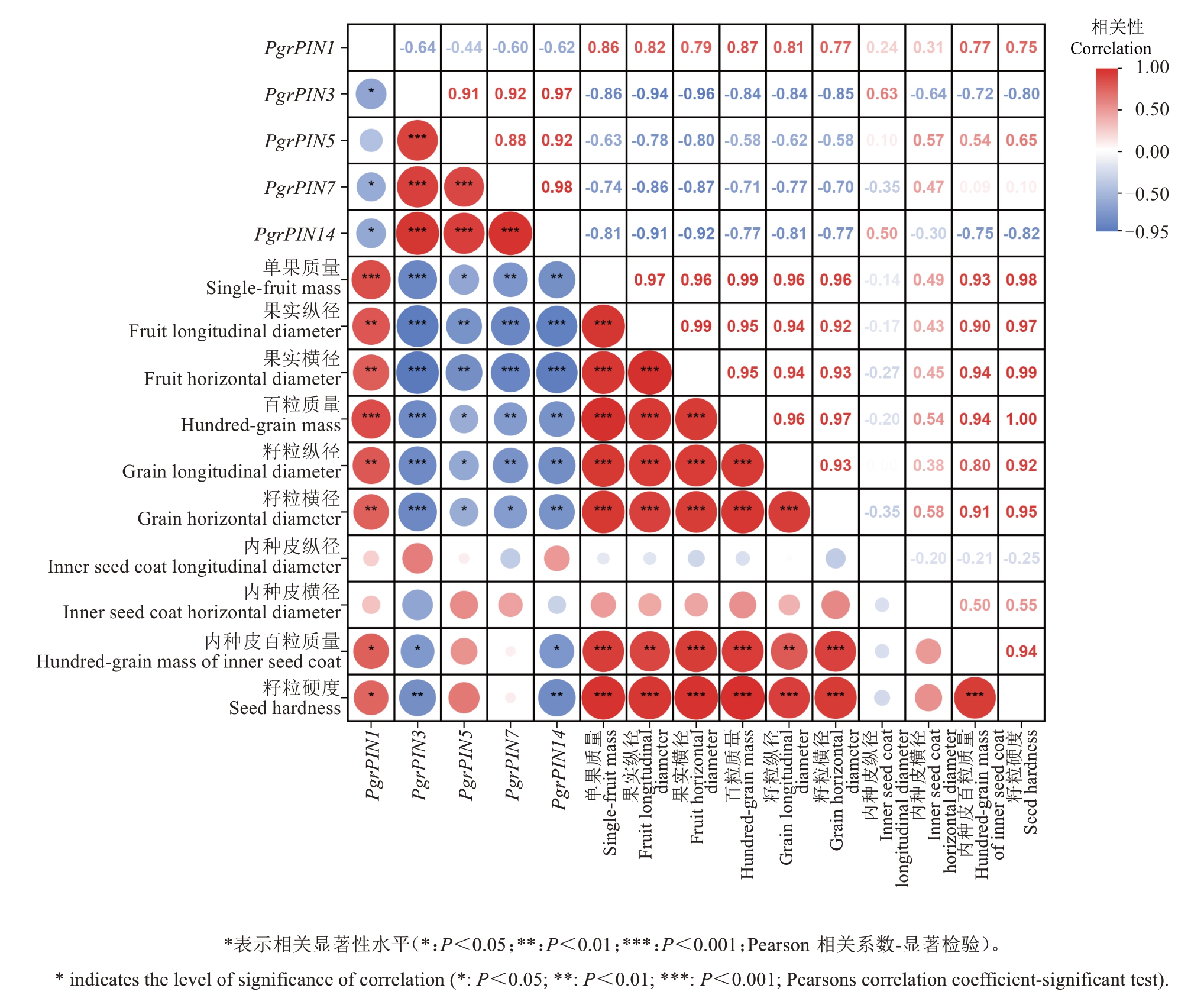
图7 石榴PIN基因相对表达水平与果实发育、种子硬度变化之间的相关性
Fig. 7 The relationship among the relative expression level of pomegranate PIN gene, fruit development and seed hardness changes
3 讨 论
石榴籽粒的发育主要由品种本身的遗传特性决定,同时植物激素与环境因素的改变可起到一定的调节作用。石榴籽粒硬度的形成主要与木质素的合成和积累相关[28]。生长素通过信号转导途径在植物的多方面起着重要作用,包括种子发育与木质素合成。PIN家族蛋白作为生长素转运蛋白,具有维持生长素极性运输和建立生长素浓度梯度的作用,进而调控植物的发育过程[29]。通过生物信息学分析,从石榴基因组中共鉴定到15个PIN基因家族成员,其氨基酸数目存在较大差异,最大的是667个,最小为267个,此现象与拟南芥PIN家族成员的表现相一致[30]。与其他植物中的报道相似,石榴PgrPINs基因编码的蛋白质大多数为碱性蛋白,且大部分定位于质膜上。这些定位于细胞膜上的PIN蛋白对植物体内生长素的运输具有重要作用[31]。13个石榴PIN基因编码的蛋白质为疏水性蛋白,其多肽链表现出较高的疏水性,有助于PIN蛋白介导的生长素跨膜极性运输过程[32]。进化树分析表明,石榴PIN家族蛋白可根据中央亲水环的长短分为经典型和非经典型2个亚组,不同亚家族间基因结构的不同也表明其功能的分化。各亚组成员具有相似的基因结构、保守基序,其功能也可能表现出一定程度的相似性。
PIN基因家族的表达,是植物发育信号整合的重要组成部分。在番茄中SlPIN1和SlPIN2在开花后不久的幼果中表达量最高,而SlPIN3在果实发育的同一阶段表达量较低[33]。在石榴果实发育过程中,PgrPINs基因的差异性表达表明,石榴PIN基因家族成员在石榴果实、籽粒发育过程中可能发挥作用。PIN基因启动子顺式作用元件分析表明,PgrPINs启动子包含光响应、多种激素信号响应及逆境调控元件和生长相关元件,说明PIN基因家族广泛参与植物生理过程。植物体中PIN基因家族成员受到多种激素调控。如生长素可正反馈调控PIN基因的表达;水杨酸可以调控拟南芥PIN2蛋白的内吞过程[34];茉莉酸处理会使PIN7的表达量降低,影响生长素在植物体内的极性运输,从而影响植物根中木质部的生长[35]。外源IAA处理后,石榴幼苗根部PgrPIN1、PgrPIN3、PgrPIN5和PgrPIN14基因呈现不同程度的响应,表明这4个基因可能受到生长素调控。石榴PIN基因家族成员含有大量的生长素、茉莉酸甲酯等响应元件。植物激素广泛参与调节植物的一系列生理活动。本研究表明,喷施植物激素NAA可促进石榴果实的生长发育,并有效提高石榴果实的单果质量、果实纵横径和百粒质量等形态指标,该结果与钱晔等[36]的研究结论一致。在大笨子品种中,从第30天开始,喷施NAA溶液对石榴单果质量、果实纵径、果实横径和百粒质量等指标具有促进作用。在农业生产上,可通过喷施相应浓度的NAA溶液实现石榴增产的目标。在NAA处理下,不同时期PgPINs基因具有不同的表达模式,NAA可能通过诱导PIN基因的表达进而调控石榴果实的生长发育过程。通过对4个基因相对表达水平与果实、籽粒和种子发育进行相关性分析,发现石榴PIN基因在果实发育、种子形态建成和硬度形成中具有不同的调控作用,进一步表明这些基因可能通过正向或负向调控机制参与了这些过程。结合NAA处理下石榴果实的表型分析,推测NAA可能通过诱导PgPIN1基因的表达促进了石榴果实发育和籽粒硬度的形成。本研究结果将为进一步研究石榴PIN基因家族成员的功能奠定理论基础,同时为解析石榴籽粒硬度发育调控机制提供了一定的研究方向。
4 结 论
本研究从石榴基因组中鉴定出15个PIN基因家族成员,系统进化分析结果表明,石榴PIN蛋白分为2类。对PgrPINs基因启动子顺式作用元件分析表明,石榴PIN基因可能受到光、低温、胁迫等环境因素以及生长素、茉莉酸甲酯和赤霉素等多种激素的影响。其中11个基因启动子包含生长素响应元件,表明石榴PIN基因家族成员参与生长素调控石榴果实及籽粒发育的过程。NAA处理可诱导PgrPINs基因的表达,并对石榴果实发育具有显著促进作用。PgrPIN1表达量与石榴籽粒发育及硬度形成呈显著正相关,PgrPIN1在调控果实发育及籽粒硬度形成中发挥一定作用。
[1] CAO J S,LI G J,QU D J,LI X,WANG Y N. Into the seed:Auxin controls seed development and grain yield[J] . International Journal of Molecular Sciences,2020,21(5):1662.
[2] LJUNG K. Auxin metabolism and homeostasis during plant development[J] . Development,2013,140(5):943-950.
[3] YANG C H,WANG D D,ZHANG C,KONG N N,MA H L,CHEN Q. Comparative analysis of the PIN auxin transporter gene family in different plant species:A focus on structural and expression profiling of PINs in Solanum tuberosum[J] . International Journal of Molecular Sciences,2019,20(13):3270.
[4] BENNETT T,BROCKINGTON S F,ROTHFELS C,GRAHAM S W,STEVENSON D,KUTCHAN T,ROLF M,THOMAS P,WONG G K,LEYSER O,GLOVER B J,HARRISON C J. Paralogous radiations of PIN proteins with multiple origins of noncanonical PIN structure[J] . Molecular Biology and Evolution,2014,31(8):2042-2060.
[5] SAUER M,KLEINE-VEHN J. PIN-FORMED and PIN-LIKES auxin transport facilitators[J] . Development,2019,146(15):dev168088.
[6] 邹纯雪,门淑珍. 生长素的外输载体PIN蛋白家族研究进展[J] . 中国细胞生物学学报,2013,35(5):574-582.ZOU Chunxue,MEN Shuzhen. Research advances in auxin efflux carrier PIN proteins[J] . Chinese Journal of Cell Biology,2013,35(5):574-582.
[7] XIE X D,QIN G Y,SI P,LUO Z P,GAO J P,CHEN X,ZHANG J F,WEI P,XIA Q Y,LIN F C,YANG J. Analysis of Nicotiana tabacum PIN genes identifies NtPIN4 as a key regulator of axillary bud growth[J] . Physiologia Plantarum,2017,160(2):222-239.
[8] ZHOU H J,GE H M,CHEN J H,LI X Q,YANG L,ZHANG H X,WANG Y. Salicylic acid regulates root gravitropic growth via clathrin-independent endocytic trafficking of PIN2 auxin transporter in Arabidopsis thaliana[J] . International Journal of Molecular Sciences,2022,23(16):9379.
[9] 刘小杰,樊胜,李国防,檀鸣,默宁,马娟娟,张东,韩明玉. 苹果全基因组PIN成员鉴定及MdPIN15的克隆和在腋芽萌发中的表达分析[J] . 园艺学报,2017,44(11):2041-2054.LIU Xiaojie,FAN Sheng,LI Guofang,TAN Ming,MO Ning,MA Juanjuan,ZHANG Dong,HAN Mingyu. Genome-wide identification of PIN gene family,cloning and expression analysis of MdPIN15 during axillary bud burst in Malus[J] . Acta Horticulturae Sinica,2017,44(11):2041-2054.
[10] PAPONOV I A,TEALE W D,TREBAR M,BLILOU I,PALME K. The PIN auxin efflux facilitators:Evolutionary and functional perspectives[J] . Trends in Plant Science,2005,10(4):170-177.
[11] MOU S J,ANGON P B. Genome-wide characterization and expression profiling of FARL (FHY3/FAR1) family genes in Zea mays[J] . Journal of Genetic Engineering and Biotechnology,2024,22(3):100401.
[12] PATTISON R J,CATALÁ C. Evaluating auxin distribution in tomato (Solanum lycopersicum) through an analysis of the PIN and AUX/LAX gene families[J] . The Plant Journal,2012,70(4):585-598.
[13] 方森,宋雪莲,韩轩轩,宋春晖,焦健,王苗苗,宋尚伟,郑先波,白团辉. 苹果PIN家族基因鉴定及在不定根形成中的表达分析[J] . 果树学报,2023,40(9):1789-1799.FANG Sen,SONG Xuelian,HAN Xuanxuan,SONG Chunhui,JIAO Jian,WANG Miaomiao,SONG Shangwei,ZHENG Xianbo,BAI Tuanhui. Identification and expression analysis of PIN gene family during adventitious root formation in apple[J] . Journal of Fruit Science,2023,40(9):1789-1799.
[14] 谭彬,杨丽萍,陈立川,冯玫侨,连晓东,魏鹏程,程钧,王小贝,冯建灿. 桃PIN蛋白基因家族鉴定及其在不同树型桃中的表达分析[J] . 农业生物技术学报,2020,28(10):1747-1760.TAN Bin,YANG Liping,CHEN Lichuan,FENG Meiqiao,LIAN Xiaodong,WEI Pengcheng,CHENG Jun,WANG Xiaobei,FENG Jiancan. Identification and expression analysis of PIN gene family in different tree architectures of peach (Prunus per‐sica)[J] . Journal of Agricultural Biotechnology,2020,28(10):1747-1760.
[15] SERRANI J C,CARRERA E,RUIZ-RIVERO O,GALLEGOGIRALDO L,PERES L E P,GARCÍA-MARTÍNEZ J L. Inhibition of auxin transport from the ovary or from the apical shoot induces parthenocarpic fruit-set in tomato mediated by gibberellins[J] . Plant Physiology,2010,153(2):851-862.
[16] MOUNET F,MOING A,KOWALCZYK M,ROHRMANN J,PETIT J,GARCIA V,MAUCOURT M,YANO K,DEBORDE C,AOKI K,BERGÈS H,GRANELL A,FERNIE A R,BELLINI C,ROTHAN C,LEMAIRE-CHAMLEY M. Down-regulation of a single auxin efflux transport protein in tomato induces precocious fruit development[J] . Journal of Experimental Botany,2012,63(13):4901-4917.
[17] YU S X,ZHOU L W,HU L Q,JIANG Y T,ZHANG Y J,FENG S L,JIAO Y L,XU L,LIN W H. Asynchrony of ovule primordia initiation in Arabidopsis[J] . Development,2020,147(24):dev196618.
[18] ZENG Y F,WEN J Y,ZHAO W B,WANG Q,HUANG W C.Rational improvement of rice yield and cold tolerance by editing the three genes OsPIN5b,GS3 and OsMYB30 with the CRISPR-Cas9 system[J] . Frontiers in Plant Science,2020,10:1663.
[19] 李义霞,鱼尚奇,郭众仲,付嘉智,鹿宏丽,王红霞,张锐,木塔力甫. 外源IAA对核桃内果皮生长发育的影响[J] . 果树学报,2024,41(5):941-955.LI Yixia,YU Shangqi,GUO Zhongzhong,FU Jiazhi,LU Hongli,WANG Hongxia,ZHANG Rui,Mutellip. Effect of exogenous IAA on the growth and development of walnut endocarp[J] .Journal of Fruit Science,2024,41(5):941-955.
[20] 张倩. 植物生长调节剂对‘库尔勒香梨’石细胞与木质素合成的影响及PIN2基因功能验证[D] . 阿拉尔:塔里木大学,2022.ZHANG Qian. Effects of plant growth regulators on stone cells and synthesis of lignin in ‘Korla fragrant pear’ and functional verification of PIN2 gene[D] . Alar:Tarim University,2022.
[21] 陈利娜,牛娟,刘贝贝,敬丹,骆翔,李好先,夏小丛,杨选文,张富红,曹达,王企,曹尚银. 不同花期喷施植物生长调节剂对石榴坐果及果实品质的影响[J] . 果树学报,2020,37(2):244-253.CHEN Lina,NIU Juan,LIU Beibei,JING Dan,LUO Xiang,LI Haoxian,XIA Xiaocong,YANG Xuanwen,ZHANG Fuhong,CAO Da,WANG Qi,CAO Shangyin. Effects of foliar application of plant growth regulators at different flowering stages on fruit setting and quality in pomegranate[J] . Journal of Fruit Science,2020,37(2):244-253.
[22] QIN G H,XU C Y,MING R,TANG H B,GUYOT R,KRAMER E M,HU Y D,YI X K,QI Y J,XU X Y,GAO Z H,PAN H F,JIAN J B,TIAN Y P,YUE Z,XU Y L. The pomegranate (Pu‐nica granatum L.) genome and the genomics of punicalagin biosynthesis[J] . The Plant Journal,2017,91(6):1108-1128.
[23] KŘEČEK P,SKŮPA P,LIBUS J,NARAMOTO S,TEJOS R,FRIML J,ZAŽÍMALOVÁ E. The PIN-FORMED (PIN) protein family of auxin transporters[J] . Genome Biology,2009,10(12):249.
[24] TAMURA K,STECHER G,PETERSON D,FILIPSKI A,KUMAR S. MEGA6:Molecular evolutionary genetics analysis version 6.0[J] . Molecular Biology and Evolution,2013,30(12):2725-2729.
[25] LESCOT M,DÉHAIS P,THIJS G,MARCHAL K,MOREAU Y,VAN DE PEER Y,ROUZÉ P,ROMBAUTS S. PlantCARE,a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J] . Nucleic Acids Research,2002,30(1):325-327.
[26] QIN G H,LIU C Y,LI J Y,QI Y J,GAO Z H,ZHANG X L,YI X K,PAN H F,MING R,XU Y L. Diversity of metabolite accumulation patterns in inner and outer seed coats of pomegranate:Exploring their relationship with genetic mechanisms of seed coat development[J] . Horticulture Research,2020,7:10.
[27] 秦改花,徐义流,李艳玲,刘春燕,齐永杰,高正辉,潘海发,伊兴凯,刘长华. 石榴籽粒硬度特征及其相关生理指标研究[J] .热带作物学报,2018,39(1):67-71.QIN Gaihua,XU Yiliu,LI Yanling,LIU Chunyan,QI Yongjie,GAO Zhenghui,PAN Haifa,YI Xingkai,LIU Changhua. Characteristics of seed hardness and its relative physiological indexes in pomegranate[J] . Chinese Journal of Tropical Crops,2018,39(1):67-71.
[28] 谢小波,黄云,田胜平,李贵利,曹尚银. 软籽石榴种子硬度发育与种皮细胞壁显微结构的关系研究[J] . 园艺学报,2017,44(6):1174-1180.XIE Xiaobo,HUANG Yun,TIAN Shengping,LI Guili,CAO Shangyin. Relationship of seed hardness development and microstructure of seed coat cell in soft seed pomegranate[J] . Acta Horticulturae Sinica,2017,44(6):1174-1180.
[29] FAROOQ M,JAN R,KIM K M. Gravistimulation effects on Oryza sativa amino acid profile,growth pattern and expression of OsPIN genes[J] . Scientific Reports,2020,10:17303.
[30] SIMON S,SKŮPA P,VIAENE T,ZWIEWKA M,TEJOS R,KLÍMA P,ČARNÁ M,ROLČÍK J,DE RYCKE R,MORENO I,DOBREV P I,ORELLANA A,ZAŽÍMALOVÁ E,FRIML J.PIN6 auxin transporter at endoplasmic reticulum and plasma membrane mediates auxin homeostasis and organogenesis in Arabidopsis[J] . New Phytologist,2016,211(1):65-74.
[31] 刘玉飞,庞丹丹,李友勇,蒋会兵,陈林波. 茶树PIN基因家族的鉴定及表达分析[J] . 分子植物育种,2020,18(23):7700-7710.LIU Yufei,PANG Dandan,LI Youyong,JIANG Huibing,CHEN Linbo. Identification and expression analysis of PIN gene family in Camellia sinensis[J] . Molecular Plant Breeding,2020,18(23):7700-7710.
[32] BANDYOPADHYAY A,BLAKESLEE J J,LEE O R,MRAVEC J,SAUER M,TITAPIWATANAKUN B,MAKAM S N,BOUCHARD R,GEISLER M,MARTINOIA E,FRIML J,PEER W A,MURPHY A S. Interactions of PIN and PGP auxin transport mechanisms[J] . Biochemical Society Transactions,2007,35(Pt 1):137-141.
[33] NISHIO S,MORIGUCHI R,IKEDA H,TAKAHASHI H,TAKAHASHI H,FUJII N,GUILFOYLE T J,KANAHAMA K,KANAYAMA Y. Expression analysis of the auxin efflux carrier family in tomato fruit development[J] . Planta,2010,232(3):755-764.
[34] DUN E A,BREWER P B,BEVERIDGE C A. Strigolactones:Discovery of the elusive shoot branching hormone[J] . Trends in Plant Science,2009,14(7):364-372.
[35] 刘士平,王璐,王继荣,薛艳红,寿惠霞. 高等植物的PIN基因家族[J] . 植物生理学通讯,2009,45(8):833-841.LIU Shiping,WANG Lu,WANG Jirong,XUE Yanhong,SHOU Huixia. PIN gene family in higher plants[J] . Plant Physiology Communications,2009,45(8):833-841.
[36] 钱晔,杨林森,黄铖,王兆成,杨浩,吴爱民. 萘乙酸与多效唑组合喷施对薄壳山核桃幼苗生长和生物量分配的影响[J] . 东北林业大学学报,2023,51(6):64-69.QIAN Ye,YANG Linsen,HUANG Cheng,WANG Zhaocheng,YANG Hao,WU Aimin. Effects of combined administration of naphthalene acetic acid with paclobutrazol on growth and biomass allocation of Carya illinoensis ‘Pawnee’ container seedling[J] . Journal of Northeast Forestry University,2023,51(6):64-69.