无花果(Ficus carica L.),是一种隶属于桑科榕属的开花植物,广泛分布于热带和温带地区,属于亚热带落叶小乔木[1]。无花果的栽培历史极为悠久,可追溯至公元前3000年,是人类最早驯化的果树之一[2]。在中国新疆的阿图什市,有几个村庄因盛产无花果而闻名,包括松他克村、阿孜汗村、铁间村和泰合提云村,这些村庄被誉为“无花果之村”,其无花果种植历史悠久,品质优良[3-7]。无花果树通常高3~4 m,树冠呈圆形或广圆形,全株含有白色乳汁,单叶互生,厚膜质,叶长10~20 cm,呈掌状,具有3~5个裂刻,边缘呈波状齿,叶面粗糙,叶背有短毛[8]。无花果的果实以皮薄无核、肉质松软、风味甘甜而著称,不仅美味,还具有很高的营养和药用价值[9]。
病毒病是影响无花果生产的重要威胁,对无花果病毒病的防控,建立严格的检验制度、保证所使用种苗的健康最为重要[10]。然而,我国针对无花果病毒病防治的高效药剂短缺,且没有研发出高效、廉价的抗病毒药剂。关于无花果茎尖脱毒的研究极少,目前还没有建立脱毒效果较好的再生体系。我国对植物快速繁殖和无病毒种苗生产的研究始于20 世纪70年代,所培养植物的种类也由观赏植物逐渐向大田作物、园艺植物、经济植物和药用植物发展[11]。无花果的繁殖主要依赖于无性繁殖技术,如扦插和压条等方法。这种繁殖方式的一个显著缺点是,一旦母株感染病毒,其后代将不可避免地继承这些病毒。在长期的繁殖过程中,无花果植株容易遭受多种病毒的复合侵染。因此,研究无花果病毒病的防控策略对保障无花果产业的可持续发展具有重要意义。通过高温或低温处理,结合茎尖脱毒可以将茎尖切取大一些,保证较高的脱毒率,但同时导致成活率降低,且超低温脱毒过程较为繁琐,存在脱毒周期长、脱毒效率低等问题。基于这种背景,培育脱毒苗是防治无花果病毒病的最有效方式。笔者利用茎尖分生组织培育脱毒苗,通过高通量测序技术分析最后的脱毒效果,以此建立高效的无花果茎尖脱毒体系,从而有效防止或降低因病毒病感染而造成的经济损失。
1 材料和方法
1.1 样品来源
供试材料取自新疆阿图什市阿扎克镇无花果研究中心,品种为新疆早黄,茎尖脱毒材料为经3次继代培养后组培苗顶端的茎尖生长点,组培室条件为(25±1)℃,14 h光照与10 h 黑暗交替培养。
1.2 无花果病毒初检
本次无花果病毒病检测委托新疆有康生物公司完成,通过高通量测序技术(图1)对无花果苗所带病毒种类进行初步检测,对病毒初检发现,无花果中主要携带Fig badnavirus 1(FBV-1)、Fig badnavirus 2(FBV-2)和Grapevine badna FI virus(GBV)等8种病毒(表1),本试验将针对检测出的病毒进行茎尖脱毒处理。
表1 无花果病毒初检种类
Table 1 Types of fig virus for initial detection
?

图1 高通量测序技术检测过程
Fig.1 Detection process of high-throughput sequencing technology
1.3 无花果茎尖脱毒体系的建立
1.3.1 外植体接种 在超净工作台内通过显微镜的观察用解剖针取位于顶端的茎尖生长点,长度为0.8~1 mm,切下后,将茎尖挑到装有培养基的培养瓶中进行培养,每个培养瓶中接种3个外植体,接种10瓶,试验3 次重复,并做好标记与统计。放至(25±1)℃、每天连续光照14 h的组培室中培养2个月。
1.3.2 TDZ 浓度对愈伤组织诱导的影响 笔者采用MS培养基作为基础培养基,并在其中添加0.1 mg·L-1的NAA(萘乙酸)。为了探究TDZ(噻苯隆)对愈伤组织诱导的影响,设置了0(对照)、0.5、1.0、1.5、2.0 和3.0 mg·L-1共6个浓度(ρ,后同)梯度。试验过程中,外植体首先进行7 d的暗培养,随后转入光照培养箱中进行培养,光照条件设置为14 h·d-1,培养温度维持在(25±1)℃,共接种30个外植体,30 d后,统计各处理组中愈伤组织的形成情况。
1.3.3 植物生长调节剂对愈伤组织分化成不定芽的影响 选取长势良好、状态均一的愈伤组织作为试验材料,将其分别接种于添加不同浓度组合的6-苄氨基嘌呤(6-BA)、NAA 培养基中。每个处理组设置30 个重复,温度(25±1)℃,光照度1500 lx,光照周期14 h·d-1。30 d后,观察并记录各处理组愈伤组织的分化情况。
1.3.4 IBA 浓度对不定芽生根的影响 以1/2 MS为基础培养基,通过添加不同浓度配比的NAA和IBA(吲哚丁酸)来探究其对不定芽生根的影响。试验材料为前期获得的不定芽丛,在无菌操作条件下,使用灭菌刀片将其分割成带单茎叶的独立外植体进行继代培养。每个培养瓶接种3 个外植体,温度(25±1)℃,光照度1500 lx,光照周期14 h·d-1。40 d后,观察并记录各处理组的不定芽生根情况。
1.4 病毒检测
笔者采用高通量测序技术对无花果组培苗进行病毒检测。当无菌苗发育至3~4 枚叶片时,随机选取20株作为检测样本。根据初检结果,针对无花果主要侵染的几种病毒进行高通量测序检测,对比前期数据,分析计算脱毒率。经高通量测序技术检测确认为无病毒感染的种苗,将作为原材料用于无花果组培快繁体系的建立。
脱毒率/%=(脱毒前病毒占比-脱毒后病毒占比)/脱毒前病毒占比×100。
1.5 数据分析
利用Microsoft Excel 2021 对原始数据进行初步整理,采用SPSS 26 软件进行差异显著性分析,显著性水平P<0.05。
2 结果与分析
2.1 不同基础培养基对愈伤组织诱导的影响
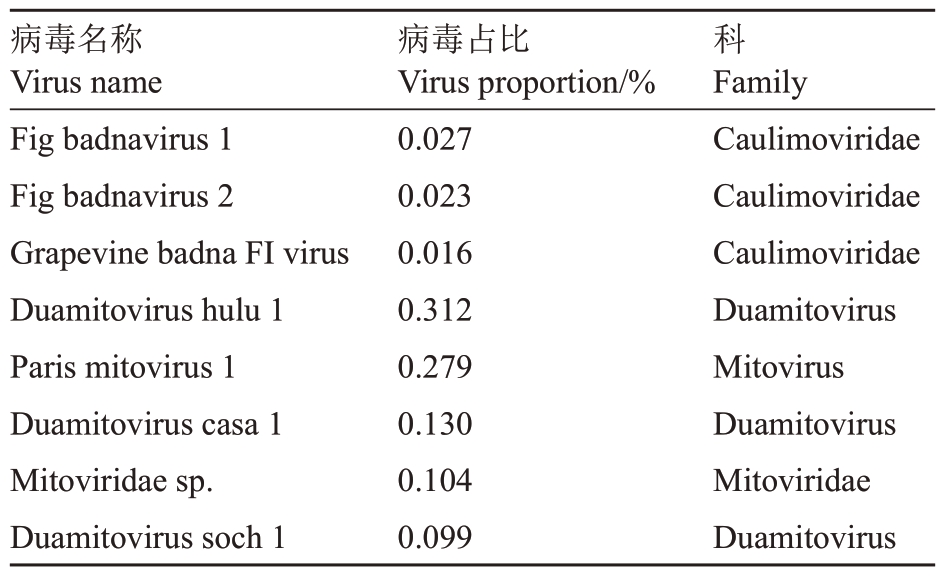
培养基配比对愈伤组织诱导效果具有显著影响。如表2 所示,不同培养基处理下愈伤组织的诱导率存在显著差异。其中,MS 培养基诱导效果最佳,诱导率高达86.40%,诱导生成的愈伤组织多为浅绿色或深绿色,生成部位在外植体内部和切口处,生成量较多,活性强(图2-A1);相比之下,1/2 MS培养基的诱导效果次之,诱导率为64.00%,该培养基诱导产生的愈伤组织多呈白色絮状,主要集中于切口部位,组织活性相对较弱(图2-A2)。而无糖MS培养基的诱导效果最差,诱导率仅为45.97%,且诱导产生的愈伤组织多呈深褐色,生成量较少,组织活性较弱(图2-A3)。
表2 不同基础培养基对愈伤组织诱导的影响
Table 2 Effect of different basal media on callus induction

注:同一列中不同小写字母代表在P<0.05 水平上差异显著。下同。
Note:Different small letters in the same column represent significant difference at P<0.05.The same below.
?
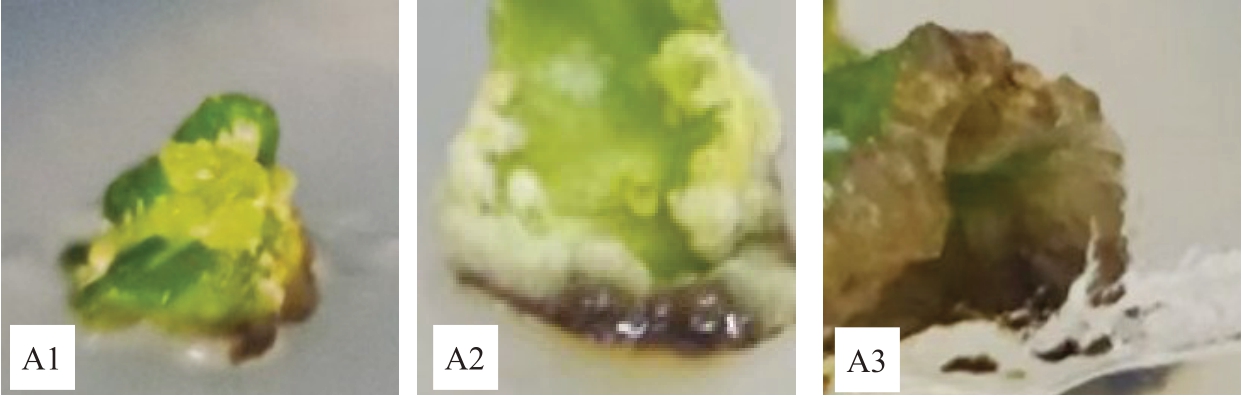
图2 不同基础培养基对愈伤组织诱导的影响
Fig.2 Effects of different basal media on callus induction
2.2 TDZ浓度对愈伤组织诱导的影响
试验结果表明,TDZ在愈伤组织诱导过程中发挥着关键作用。由表3、图3 可知,NAA 浓度一定时,TDZ浓度为1.5 mg·L-1时愈伤诱导效果最好,诱导率为88.60%,愈伤组织形态较好,多为浅绿色,愈伤生成部位多在接触到培养基的外植体内部和切口处(图3-B4),且生成量较多,活性强;其次是TDZ浓度为2.0 mg·L-1,诱导率为66.10%,愈伤多在切口处靠近培养基的部位(图3-B5);TDZ浓度为3.0 mg·L-1时,愈伤颜色为褐色(图3-B6),成活率下降;TDZ浓度为0.5 mg·L-1时,虽然诱导率不低,但愈伤大多为白色(图3-B2),活性弱;不添加TDZ时,未观察到愈伤组织形成(图3-B1)。
表3 TDZ 浓度对无花果愈伤组织诱导的影响
Table 3 Effects of TDZ concentration on callus induction in figs
?

图3 TDZ 浓度对无花果愈伤组织诱导的影响
Fig.3 Effects of TDZ concentration on callus induction in figs
2.3 植物生长调节剂对愈伤组织分化成不定芽的影响
试验结果表明,6-BA 浓度对愈伤组织分化具有显著影响。如表4 所示,不同6-BA 浓度处理下,不定芽的分化率和形态特征存在明显差异。6-BA浓度为3.0 mg·L-1时,愈伤组织分化率最低,不定芽数量很少,颜色呈黄绿色(图4-C4);6-BA 浓度为1.5 mg·L-1时,愈伤组织分化情况较好,不定芽数量较多,但不定芽长势弱且生长慢,颜色呈黄绿色,较细(图4-C1)。添加2.0 mg·L-1的6-BA处理,不定芽颜色为鲜绿色,长势健壮(图4-C2),分化的不定芽数量最多;6-BA浓度为2.5 mg·L-1时,不定芽分化情况较好,但生长速度较慢,颜色呈黄绿色,不定芽较粗壮(图4-C3)。当6-BA浓度低于或高于适宜范围时,不定芽的形态和生理状态均受到显著影响。不定芽多呈现黄色或黄绿色,甚至出现褐化现象。同时,不定芽长势较弱,表现为个体较小,发育不良;其次,本试验添加了一定量的NAA,虽然不添加也能分化出不定芽,但添加后效果更佳。因此,新疆早黄无花果不定芽诱导最适浓度配比为2.0 mg·L-1 6-BA+0.05 mg·L-1 NAA。
表4 植物生长调节剂对无花果不定芽分化的影响
Table 4 Effect of plant growth regulators on adventitious bud differentiation of figs
?

图4 无花果不定芽分化情况
Fig.4 Adventitious bud differentiation of fig
2.4 植物生长调节剂对不定芽生根的影响
适宜的IBA浓度是促进不定芽高效生根的关键因素,浓度偏离最佳范围会导致生根率下降或根系发育不良。如表5、图5 所示,不添加IBA 和NAA时,不定芽也会长出根系,但根系较弱较短,且叶片稀疏(图5-D1);IBA 浓度为0.5 mg·L-1时,生根数量增加,叶片长势良好(图5-D2);IBA浓度为1.5 mg·L-1时,生根情况较好,根系健壮且长,但数量较少,侧根和须根极少(图5-D4);IBA浓度为1.0 mg·L-1时,生根率高达67.68%,平均根数为3.55,根部生长状况良好,且长出来侧根和须根(图5-D3)。在生根阶段,组培苗已经积累了一些糖分,因此不需要太多营养物质,培养基使用1/2 MS 就可以满足生长需求。因此,新疆早黄无花果不定芽生根诱导最适培养基为1/2 MS+1.0 mg·L-1 IBA+0.5 mg·L-1 NAA。
表5 IBA 对不定芽生根的影响
Table 5 EffectS of IBA on adventitious bud rooting
?

图5 不定芽生根情况
Fig.5 Adventitious bud rooting
2.5 无花果茎尖脱毒效果
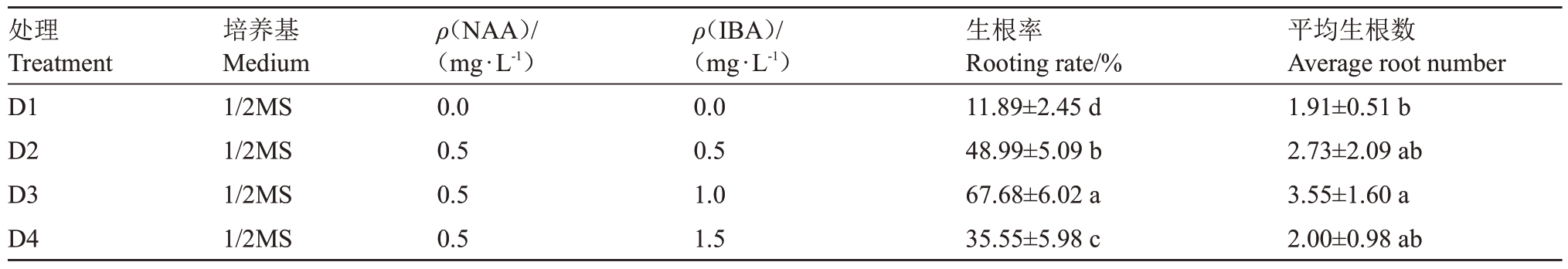
2.5.1 无花果脱毒效果 随机抽取20个茎尖脱毒后的无菌苗叶片,经高通量测序技术检测脱毒苗带毒情况后,发现初检中的8种病毒只有3种病毒占比有所降低,主要是FBV-1、FBV-2 和GBV 这3 种病毒。由表6可知,FBV-1的脱毒效果最好,脱毒率为52%;FBV-2 和GBV 的脱毒率分别是43%、50%。由图6可以看出,除了FBV-1、FBV-2和GBV这3种病毒占比降低外,其他病毒占比都无下降;从Venn 图可以看出,无花果茎尖脱毒前特有微生物1286 种,茎尖脱毒后特有微生物394 种,脱毒前后共同拥有微生物873种,脱毒后微生物种类下降41%。
表6 无花果脱毒检测
Table 6 Detoxification detection of figs

?
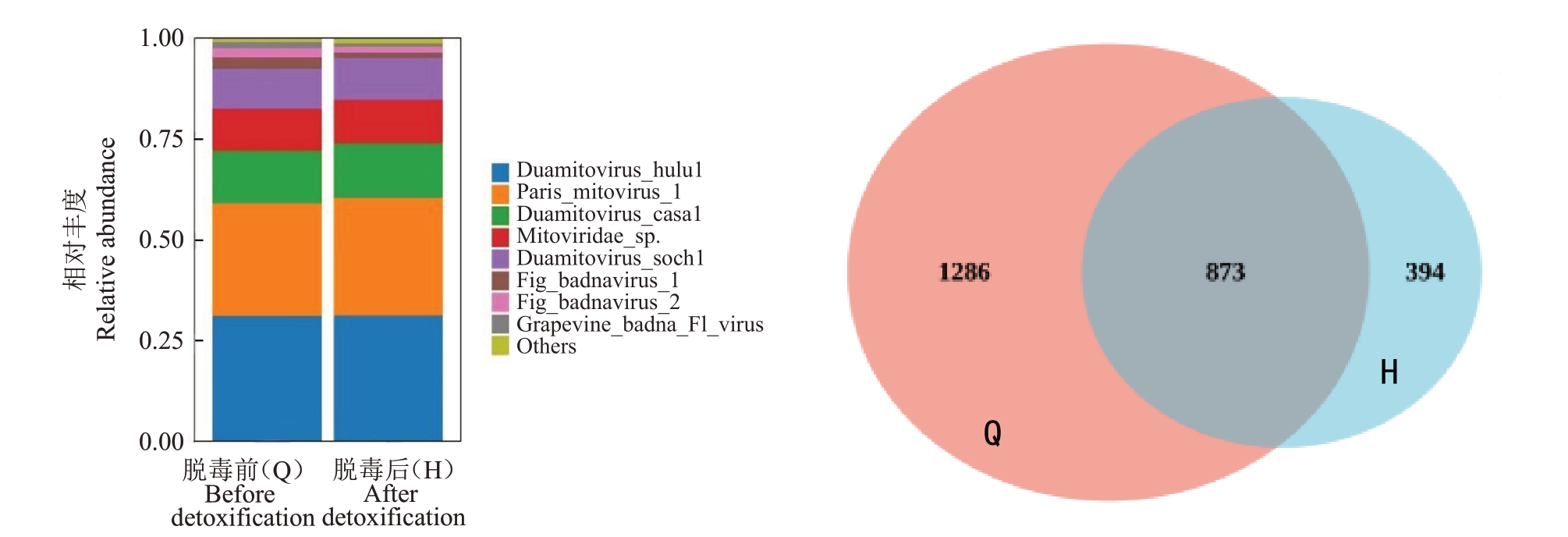
图6 无花果病毒相对丰度和微生物分布Venn 图
Fig.6 Venn plot of relative abundance and microbial distribution of fig virus
2.5.2 脱毒苗生根情况 脱毒检测后筛选出的脱毒苗需进行生根移栽试验,将生根诱导40 d 的无花果组培苗,于温室驯化10 d 后移栽至营养钵中。由表7可知,无花果组培苗在移栽7 d后开始出现死亡现象,随着时间推移死亡增多,移栽30 d 后,死亡情况趋于稳定,成活率为54.86%,存活的植株生长良好,平均株高9 cm,平均根长7 cm;60 d后根部健壮,株高又增长到16 cm,平均根长11 cm,已达到完全固土的情况(图7);移栽70 d 时平均株高19 cm,平均根长12 cm,此时的无花果苗可继续栽培用于组培茎尖脱毒原材料。
表7 脱毒苗生根情况
Table 7 Rooting of detoxified seedlings

?

图7 脱毒苗生根情况
Fig.7 Rooting of detoxified seedlings
3 讨 论
近年来,无花果作为新疆重点发展的稀有果品之一[6],种植面积不断扩大。由于国内针对无花果病毒病的相关研究报道较为匮乏,致使在无花果种植园的规划与栽培管理过程中,病毒病的防控措施未能得到足够重视,进而加剧了病毒病的传播与扩散。目前,无花果病毒病已对新疆地区无花果种植业的可持续健康发展构成了严重威胁。因此,采用茎尖脱毒技术培育无花果脱毒苗成为最为有效的解决方案。通过推广和应用脱毒苗,不仅能够有效遏制病毒病的扩散,还能显著提升无花果的产量与品质,从而为保障我国无花果主产区的经济稳定与产业健康发展提供重要支撑。
3.1 无花果组培茎尖脱毒体系
对于组培技术来说,不论是在工厂化生产中还是在试验研究中,污染问题、玻璃化现象和褐变一直是工作进展的障碍,严重影响着工作效率和生产进展,有时甚至会降低组培快繁中应有的经济效益[12]。对于大多数植物来说,茎尖是用于组织培养的较好部位[13]。
污染问题在组织培养中经常发生,造成污染的原因很多,主要有外植体携带病菌污染、初代培养中外植体消毒不彻底引起的污染、培养基及接种所用器皿灭菌不彻底引起的污染、培养物所在的生长环境不洁引起的污染,以及接种人员自身消毒不严或操作不规范造成组培苗的污染[14]。想要有效控制污染,就必须对外植体材料进行彻底灭菌,通过科学选择消毒剂与杀菌剂,并结合严格的灭菌操作,能够显著提高外植体培养的成功率。董利萍等[15]将预处理后的外植体先用70%乙醇进行体表消毒1 min,用无菌水冲洗3次后,再用0.1%的HgCl2(HgCl2溶液中按10 000∶1的比例添加Tween 20)消毒10 min,最后再用无菌水冲洗3~4次后接种在培养基中。本试验前期的外植体主要采自试验田,由于4—5月病害污染还不严重,所以采回来的茎段经过消毒就可以达到较低的污染率,但从7 月开始,气温和湿度升高,病害污染大量出现,常规的消毒方式已不能实现低污染率。因此后期对外植体的获取方式进行了调整,将采回来的茎段先在无菌条件下进行初代继代培养,然后再对健康的组培苗进行茎尖取材,此方法不仅大大降低了外植体的污染率,还减少了外植体消毒的工作量,培养的组培苗为茎尖组培试验提供了充足的原材料。
玻璃化现象在植物组织培养过程中属于生理性病变。玻璃化苗通常表现为半透明状[16],组织结构脆弱易碎,叶片表面缺乏功能性气孔,且蜡质层缺失或发育不完全。此类苗的分化能力较弱,在继代培养中成活率较低。玻璃化现象的产生主要受环境温湿度的影响,稳定的温湿度是减少玻璃化现象、提高组培苗质量的关键。然而在本试验中玻璃化现象并不明显,因为培养室有精确的温度和湿度控制系统,每天都会观测温湿度变化,保证有一个稳定且适宜的培养条件。
褐化现象是植物组织培养过程中普遍存在的技术难题之一,对其有效控制在植物快繁体系的构建与实际应用中具有重要的实践意义。通过优化培养条件、添加抗氧化剂或调整培养基成分等措施,能够显著减轻褐化现象,从而提高组织培养的成功率,为植物快繁技术的规模化应用奠定基础。孔祥生等[17]对柿树离体繁殖过程中外植体的褐化进行研究时发现,外植体褐变与多酚氧化酶活性有关。另有研究表明,低光照和黑暗处理也可以减轻褐化[18]。同时还发现与不添加活性炭(AC)的培养基相比,添加活性炭的培养基在外植体基部产生的愈伤组织较少甚至不产生愈伤组织,叶色比较浓绿,茎秆粗壮、叶片大、节间短。另外,激素浓度也会影响褐化[19]。研究表明,高浓度细胞分裂素物质会促进甘蔗、巨桉褐化的发生[20]。本试验对褐化问题采取了两种措施:接种前将外植体在浓度为1500 mg·L-1的维生素C 溶液种浸泡30 min;在培养基中添加少量活性炭。接种后如果根部出现褐化现象,可以在继代的时候将组培苗根部褐化的部分切除,继续放在培养基中生长;为了防止愈伤组织褐化,笔者在接种的前7 d进行了暗培养,该方法可以有效减少愈伤组织褐化现象的发生,但暗培养时间不宜过长。
在本试验中,结合前人的方法,用MS作为愈伤诱导试验和不定芽诱导试验的基础培养基都有较好的效果,而1/2MS 在诱导不定芽生成不定根试验中效果较好,研究表明,在组培苗生根初期进行适当的暗培养可提高生根效率。基本培养基只能够保证所培养物的生存和基本的生理活动,只有添加适当的植物生长调节剂后才能够诱导细胞分裂,促进愈伤组织的形成,以及根、芽的分化等[21]。在本试验中,愈伤组织诱导最适浓度配比为MS+1.5 mg·L-1 TDZ+0.1 mg·L-1 NAA;不定芽诱导最适浓度配比为MS+2.0 mg·L-1 6-BA+0.05 mg·L-1 NAA。不定芽生根诱导最适浓度配比为1/2 MS +1.0 mg·L-1 IBA+0.5 mg·L-1 NAA。试验还对炼苗和移栽进行了初步探索,由于时间原因,只研究了部分指标,还有一些课题未探索,如炼苗的温度筛选、移栽时穴盘深度对根长的影响、不同土壤基质配比对生根的影响等,这些都可以作为以后的研究内容。
3.2 无花果茎尖脱毒效果
针对无花果脱毒过程中存在的周期长、效率低等技术瓶颈,通过技术优化与改进,显著缩短了脱毒周期,同时将脱毒成功率提升至100%,这主要得益于无花果组织培养技术的发展[22-27]。取感病植株长度为0.5~0.7 cm 的茎尖作为外植体进行组织培养,并对组培苗实施热处理。这些植株在温室条件下种植一年后未表现出任何病叶症状,表明通过热处理,无花果病毒病相关病原体已被有效脱除或其活性受到显著抑制。PCR 检测结果显示,经过茎尖培养和热处理后,感病植株中的FMV和FLV-1两种病毒基本能够被脱除[28]。然而,该方法对FBV-1 的脱除效果并不明显,表明针对不同病毒需采用差异化的脱毒策略。这可能与FBV-1 能够镶嵌在植物基因组内有关。本研究与前人研究结果不一致,原因可能有以下两点:一是品种差异,笔者建议后期通过对比多个品种进行综合分析,这样才能使数据更有说服力;二是茎尖的剥离程度对脱毒效果有很大影响,茎尖带有叶原基更容易诱导出愈伤,但茎尖的剥离过程费时费力,因此试验中获取的茎尖数量有限,这大大降低了茎尖脱毒的试验效果。
总之,结合组培茎尖脱毒技术和高通量检测技术,并增殖扩繁能够在较短时间内获得大量脱毒苗,从而满足规模化生产的需求。然而,这一过程需要较长的培养周期作为基础,只有通过科学规范的操作流程和严谨的质量把控,才能为无花果产业的可持续发展提供可靠保障。
4 结 论
笔者建立了新疆早黄无花果组培茎尖脱毒体系,愈伤组织诱导最适浓度配比为MS+1.5 mg·L-1 TDZ+0.1 mg·L-1 NAA,诱导率为88.60%;不定芽诱导最适浓度配比为MS+2.0 mg·L-1 6-BA+0.05 mg·L-1 NAA,繁殖系数为3.6;不定芽生根诱导最适浓度配比为1/2 MS+1.0 mg·L-1 IBA+0.5 mg·L-1 NAA,生根率为67.68%,平均根数为3.55。经茎尖脱毒后FBV-1、FBV-2和GBV脱毒率都有明显下降,但这也只是初步数据,后续还要继续追踪这些脱毒苗的生长数据,以及多次的病毒检测来分析脱毒率,才能获得真正健康无毒的无花果苗木。
[1] 李平海,荀咪,杨圣祥,武猛,朱海涛,李国田.喀什岳普湖县无花果产业现状及高质量发展对策[J].落叶果树,2025,57(1):35-39.LI Pinghai,XUN Mi,YANG Shengxiang,WU Meng,ZHU Haitao,LI Guotian. Current situation and high-quality development suggestions of fig industry in Yopurga County of Kashgar[J].Deciduous Fruits,2025,57(1):35-39.
[2] 孔祥蕊,刘爱玲,宋斌,孔祥栋,石爱华.无花果大棚栽培管理技术[J].果农之友,2024(12):56-58.KONG Xiangrui,LIU Ailing,SONG Bin,KONG Xiangdong,SHI Aihua. Fig greenhouse cultivation management technology[J].Fruit Growers’Friend,2024(12):56-58.
[3] 任若玙,任善军.无花果加工品研究进展[J].落叶果树,2024,56(4):46-51.REN Ruoyu,REN Shanjun. Research progress in figs processing products[J].Deciduous Fruits,2024,56(4):46-51.
[4] 苏镘坤,王雪,李晓仪.威海无花果产业发展现状研究:以威海摩天岭无花果种植专业合作社为例[J]. 中国果业信息,2024,41(5):29-31.SU Mankun,WANG Xue,LI Xiaoyi. Research on the development status of Weihai fig industry:A case study of Weihai Motianling Fig Planting Cooperative[J].China Fruit News,2024,41(5):29-31.
[5] 刘亚群,胡单,柏明娥,韩素芳,刘荣昌.38 个无花果品种的初步引种评价研究[J].浙江林业科技,2023,43(6):106-112.LIU Yaqun,HU Dan,BAI Ming’e,HAN Sufang,LIU Rongchang. Preliminary evaluation on 38 introduced cultivars of Ficus carica in Zhejiang[J].Journal of Zhejiang Forestry Science and Technology,2023,43(6):106-112.
[6] 杨光,张金云,阳桂芳,陈伟立,赵秀娟,张方秋,刘姚.20 份无花果种质资源植物学性状和品质性状比较[J].安徽农业科学,2023,51(20):49-53.YANG Guang,ZHANG Jinyun,YANG Guifang,CHEN Weili,ZHAO Xiujuan,ZHANG Fangqiu,LIU Yao.Comparison of botany character and quality traits in 20 Ficus carica Linn. germplasm resources[J]. Journal of Anhui Agricultural Sciences,2023,51(20):49-53.
[7] 李景蕻,刘艳丽.无花果组培中培养条件对外植体褐化的影响[J].北方园艺,2015(14):99-101.LI Jinghong,LIU Yanli. Effect of culture conditions on explants browning of Ficus carica L.[J]. Northern Horticulture,2015(14):99-101.
[8] 张忠会. 山东省诸城市无花果设施栽培技术[J]. 乡村科技,2023,14(23):75-77.ZHANG Zhonghui. Fig facility cultivation technology in Zhucheng City, Shandong Province[J].Rural Science and Technology,2023,14(23):75-77.
[9] 王世镇.无花果栽培及管理综合生产技术[J].现代园艺,2018(9):49-51.WANG Shizhen.Integrated production technology of fig cultivation and management[J].Xiandai Horticulture,2018(9):49-51.
[10] 张海静.无花果栽培管理技术及病虫害防治措施[J].农业知识,2024(5):35-36.ZHANG Haijing. Fig cultivation management technology and pest control measures[J]. Agricultural Knowledge,2024(5):35-36.
[11] 胡文,黄清俊.细叶石斛组培快繁技术的优化[J].应用技术学报,2024,24(4):492-496.HU Wen,HUANG Qingjun. Optimization of tissue culture and rapid propagation technology of Dendrobium hancockii Rolfe[J].Journal of Technology,2024,24(4):492-496.
[12] 师群航,刘艳军,易元慧.丝棉木组培快繁体系的优化[J].天津农学院学报,2024,31(6):39-43.SHI Qunhang,LIU Yanjun,YI Yuanhui. Optimization of tissue culture and rapid propagation system of Euonymus maackii Rupr[J].Journal of Tianjin Agricultural University,2024,31(6):39-43.
[13] 成晓华,赵曙良,张莹,张玉星.玉露香梨组培快繁体系建立研究[J].果树学报,2025,42(1):227-236.CHENG Xiaohua,ZHAO Shuliang,ZHANG Ying,ZHANG Yuxing. Propagation of of Yuluxiang pear (Pyrus bretschneideri Rehd.) through tissue culture[J]. Journal of Fruit Science,2025,42(1):227-236.
[14] 覃换玲,高营营,黄丽辉,陈淑媛,黄天琨,李贤高,周晓璇,关长飞,杨勇.小果甜柿组织培养快繁技术[J].果树学报,2023,40(9):1992-2000.QIN Huanling,GAO Yingying,HUANG Lihui,CHEN Shuyuan,HUANG Tiankun,LI Xiangao,ZHOU Xiaoxuan,GUAN Changfei,YANG Yong.Study on tissue culture and rapid propagation of Xiaoguo Tianshi as a sweet persimmon rootstock[J].Journal of Fruit Science,2023,40(9):1992-2000.
[15] 董利萍,郭振锋,杜瑞卿.不同消毒方法在洋葱组织培养中的应用及优化[J].中国瓜菜,2021,34(7):76-80.DONG Liping,GUO Zhenfeng,DU Ruiqing. Application and optimization of different disinfection methods on onion tissue culture[J].China Cucurbits and Vegetables,2021,34(7):76-80.
[16] 贺强,李小峰,许腾飞,高德航,董振飞,杨芬,李楠,王红清.草莓试管苗玻璃化现象探究及生理特性分析[J].中国农业大学学报,2025,30(2):51-60.HE Qiang,LI Xiaofeng,XU Tengfei,GAO Dehang,DONG Zhenfei,YANG Fen,LI Nan,WANG Hongqing. Vitrification phenomenon exploration and physiological characteristics analysis of strawberry in vitro seedlings[J]. Journal of China Agricultural University,2025,30(2):51-60.
[17] 孔祥生,张妙霞,张益民,王振镒.柿离体繁殖研究[J].果树科学,1998,15(3):232-238.KONG Xiangsheng,ZHANG Miaoxia,ZHANG Yimin,WANG Zhenyi. In vitro propagation of persimmon (Diospyros kaki Linn.)[J].Journal of Fruit Science,1998,15(3):232-238.
[18] 南雅琪,刘娟,齐宇,董飞,王成鹏,马蕾,王烨楠,吕晓惠,朱娇. 高山杜鹃组培快繁关键技术研究[J]. 安徽农业科学,2024,52(22):42-46.NAN Yaqi,LIU Juan,QI Yu,DONG Fei,WANG Chengpeng,MA Lei,WANG Yenan,LÜ Xiaohui,ZHU Jiao.Research on key techniques for tissue culture of Rhododendron lapponicum[J].Journal of Anhui Agricultural Sciences,2024,52(22):42-46.
[19] 王兰兰,李裕荣,陈之林,张朝君,杜致辉,文林宏.佛手瓜茎段组培快繁技术研究[J].中国瓜菜,2023,36(9):30-35.WANG Lanlan,LI Yurong,CHEN Zhilin,ZHANG Chaojun,DU Zhihui,WEN Linhong. Study on tissue culture and rapid propagation via stem section of Schium edule[J]. China Cucurbits and Vegetables,2023,36(9):30-35.
[20] 李解,翟秀明,杨娟,唐敏,侯渝嘉.不同褐化程度茶树组培的转录组分析[J]. 基因组学与应用生物学,2021,40(增刊4):3639-3647.LI Jie,ZHAI Xiuming,YANG Juan,TANG Min,HOU Yujia.Transcriptome analysis of camellia sinensis tissue culture with different browning degrees[J]. Genomics and Applied Biology,2021,40(Suppl.4):3639-3647.
[21] 叶兴枝,程群,张等宏,徐怡,陈巧玲,陈火云.凤头姜组培快繁体系研究[J].湖北农业科学,2020,59(23):156-158.YE Xingzhi,CHENG Qun,ZHANG Denghong,XU Yi,CHEN Qiaoling,CHEN Huoyun. Study on tissue culture and rapid propagation of Zingiber officinale Roscoe cv. Fengtoujiang[J].Hubei Agricultural Sciences,2020,59(23):156-158.
[22] MINAFRA A,SAVINO V,MARTELLI G P. Virus diseases of fig and their control[J].Acta Horticulturae,2017(1173):237-244.
[23] 陈紫玉,巴哈依丁·吾甫尔,任桂霖,魏靖,王梓然.外源IBA对无花果扦插苗抗氧化特性及IAA 生物合成途径的影响[J].西北植物学报,2024,44(7):1046-1054.CHEN Ziyu,Bahayiding · Wufuer,REN Guilin,WEI Jing,WANG Ziran.Effects of exogenous IBA on antioxidant property and IAA biosynthesis pathway in cuttings of Ficus carica[J].Acta Botanica Boreali-Occidentalia Sinica,2024,44(7):1046-1054.
[24] 陈爽,李金平,马会勤,张文. 不同植物生长调节剂对“金傲芬”无花果组培的影响[J].北方园艺,2013(3):109-111.CHEN Shuang,LI Jinping,MA Huiqin,ZHANG Wen. Effect of different plant growth regulators on tissue culture of Ficus carica L.‘Jinao Fen’[J].Northern Horticulture,2013(3):109-111.
[25] 陈伟,薛婷,李亚娟,王瑞鑫,玉山江·麦麦提.无花果病毒CP基因克隆及遗传多样性分析[J].山西农业科学,2023,51(11):1245-1251.CHEN Wei,XUE Ting,LI Yajuan,WANG Ruixin,Yushanjiang·Maimaiti. Cloning and genetic diversity analysis of CP gene of fig viruses[J]. Journal of Shanxi Agricultural Sciences,2023,51(11):1245-1251.
[26] 刘晶.波姬红无花果组织培养与植株再生技术的研究[D].保定:河北农业大学,2014.LIU Jing. Study on tissue culture and plantlet regeneration of BoJihong Ficus carica L.[D]. Baoding:Hebei Agricultural University,2014.
[27] 张倩倩,曾斌,王新兴.新疆早黄无花果茎段组培快繁技术研究[J].果农之友,2024(11):10-13.ZHANG Qianqian,ZENG Bin,WANG Xinxing. Research on fast propagation technology of stem tissue culture of the‘Xinjiang Zaohuang’fig[J].Fruit Growers’Friend,2024(11):10-13.
[28] AL-KAEATH N,ZAGIER S,ALISAWI O,AL FADHAL F,MAHFOUDHI N. High-throughput sequencing identified multiple fig viruses and viroids associated with fig mosaic disease in Iraq[J].Plant Pathology Journal,2024,40(5):486-497.