沙棘(Hippophae rhamnoides L.)属于胡颓子科(Elaeagnaceae)沙棘属(Hippophae)的一种多年生落叶灌木,原产于欧洲和亚洲[1-2],目前在中国西藏、青海、新疆、陕西、内蒙古、河北、甘肃、宁夏等多个省区都有分布[3]。沙棘能够适应贫瘠的土壤和恶劣的生长环境,具有较高的生态价值,在中国西北、东北、华北地区发挥着防止土壤侵蚀、改善土壤性质、治理生态环境和荒山造林绿化等重要作用[4-5]。不仅如此,沙棘也是一种经济树种,具有极高的营养价值和独特的药用价值[6]。沙棘浆果和叶子含有丰富的营养物质和多种活性成分,如维生素、类胡萝卜素、多酚、类黄酮、脂肪酸和植物甾醇等[7]。沙棘果味道微酸,具有开胃的功效,在食品工业中具有很大的潜力,既可以鲜食,也可加工食用,目前多被开发为具有保健功能的饮品[8]。沙棘提取物具有抗氧化、抗癌、抗高血脂、抗炎、抗菌、抗病毒、改善皮肤病、保护神经和保护肝脏等多种保健作用[9]。沙棘在癌症、心血管疾病、胃肠溃疡的治疗和肝脏保护方面也有着很好的应用[10-11]。沙棘种植业受到病虫害的严重威胁,国内外对发生在沙棘叶部和根茎部位的病虫害报道较多,如沙棘枯萎病(Fusarium spp.)[12]、沙棘叶枯病(Rhynchosporium hippophaes)、沙棘根腐病(Rhizoctonia solani)[13]和沙棘木蠹蛾[14]等。针对沙棘果实病虫害的研究目前多集中于沙棘果实虫害,如沙棘绕实蝇(Rhagoletis batava obseuriosa)[15],对沙棘果实发生的病害报道极为有限。然而,随着沙棘种植规模的扩大,其果实病害的潜在威胁逐渐显现。2023年辽宁省朝阳市沙棘种植基地雪地黄品种的果实炭疽病发病率高达20%。
炭疽病是一种传播迅速且种类繁多的常见植物病害,由炭疽菌属(Colletotrichum)真菌引起,在世界范围内可侵染多种农林作物,能够侵染叶片、枝条、花和果实等部位,是世界上十大植物病害之一[16]。2023年6月在辽宁省朝阳市沙棘种植基地调查发现,沙棘品种雪地黄果实出现疑似炭疽病的症状,病果出现凹陷的圆形或椭圆形病斑,中心具有点状物构成的轮纹。尽管炭疽病在其他经济作物中已被广泛研究[17],如在浆果类作物中,炭疽病已对蓝莓(Vaccinium spp.)[18]和柑橘(Citrus spp.)[19]造成严重的经济损失,但沙棘果实炭疽病的病原鉴定、致病机制及生防策略仍未见系统报道,严重限制了该病害的有效防控。笔者通过病原菌致病性验证、形态学和分子生物学鉴定,明确辽宁朝阳市沙棘基地的沙棘果实炭疽病病原菌种类,同时从沙棘根际土壤中分离具有较强拮抗病原菌活性的菌株并进行鉴定,以期为该病害的诊断及生防菌剂的开发与应用提供理论依据。
1 材料和方法
1.1 材料
供试植物样品:2023 年6 月在辽宁省朝阳市沙棘种植基地采集雪地黄的具有典型症状的病果和健康的果实,分别采集20个15~30 cm两种果实的结果枝条,置于便携式冰箱内带回实验室备用。
供试土壤样品:从辽宁省朝阳市沙棘种植基地挑选5 株树龄为4~5 年生的雪地黄品种的健康沙棘果树,在其根部采集0~20 cm深的土壤,过筛去除杂质备用。
供试培养基:马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g、葡萄糖20 g、琼脂15 g、蒸馏水1000 mL;马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基:马铃薯200 g、葡萄糖20 g、蒸馏水1000 mL;LB(luria-Bertani)液体培养基:酵母提取物5 g、胰蛋白胨10 g、氯化钠10 g、蒸馏水1000 mL;LB(luria-Bertani)固体培养基:酵母提取物5 g、胰蛋白胨10 g、氯化钠10 g、琼脂15 g、蒸馏水1000 mL;蛋白酶(proteinase agar,PA)培养基:脱脂牛奶20 g、琼脂15 g、蒸馏水1000 mL[20];纤维素酶(cellulase agar,CA)培养基:羧甲基纤维素钠10 g、酵母粉6 g、胰蛋白胨10 g、磷酸氢二钾1 g、氯化钠5 g、琼脂15 g、蒸馏水1000 mL;β-葡聚糖酶(β-glucanase)培养基:酵母粉5 g、刚果红0.4 g、胰蛋白胨10 g、氯化钠5 g、琼脂15 g、蒸馏水1000 mL[21];几丁质酶(chitinase)培养基:壳聚糖5 g、蛋白胨2 g、磷酸氢二钾0.5 g、七水硫酸镁0.3 g、琼脂15 g、蒸馏水1000 mL。
1.2 沙棘果实炭疽病病原菌的分离及鉴定
1.2.1 病原菌的分离纯化及致病性验证 病原菌的分离采用常规组织分离法,挑选30个具有明显病斑的沙棘果实,在超净工作台中,先用75%乙醇处理30 s,再用1%次氯酸钠溶液消毒10 s,用无菌水清洗3次,最后用无菌滤纸吸干水分,在病健交界处用无菌刀片切取大小约为3 mm×3 mm 组织块,接种至PDA培养基中央,25 ℃恒温培养5 d,待长出菌丝后在新的培养基上进行单孢纯化,将纯化后的菌株接种于PDA斜面,保存在4 ℃条件下备用。
依据柯赫氏法则,采用回接法对已纯化的菌株进行致病性测定。挑选健康且大小均一的沙棘果实,在75%乙醇中进行表面消毒后用无菌水冲洗3次,待其晾干后置于铺有湿润滤纸的培养皿内备用。将分离纯化得到的菌株于PDA培养基上28 ℃培养7 d,用无菌水冲洗菌丝,配成孢子浓度约为1×106个·mL-1的悬浮液,用无菌接种针蘸取孢子悬浮液后用针刺法在健康果实上进行接种,每个处理接种6 个健康的沙棘果实,3 次重复,接种清水作为对照;置于28 ℃恒温培养箱中保湿培养,5 d后观察发病情况,记录结果,并对发病的沙棘果实重新进行组织分离和单孢纯化。
1.2.2 病原菌形态学鉴定 将纯化后的病原菌接种于PDA 培养基中央,置于28 ℃恒温培养箱中培养7 d后取出,观察、记录菌落的形态和颜色,继续培养至14 d 后挑取少量菌丝于载玻片上,滴加1 滴蒸馏水,采用Eclipse Ci-L 光学显微镜(日本东京,尼康)放大200~400 倍观察孢子和分生孢子盘的形态特征,并将有分生孢子的载玻片放入培养箱28 ℃保湿培养36 h后取出,观察附着孢。
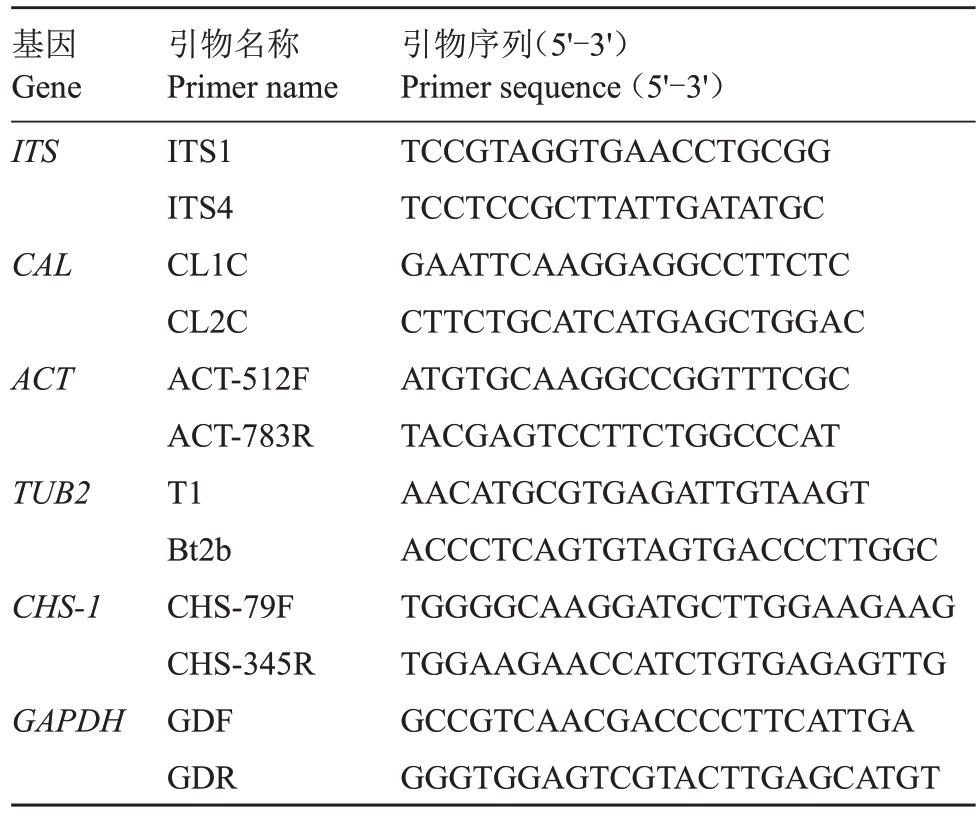
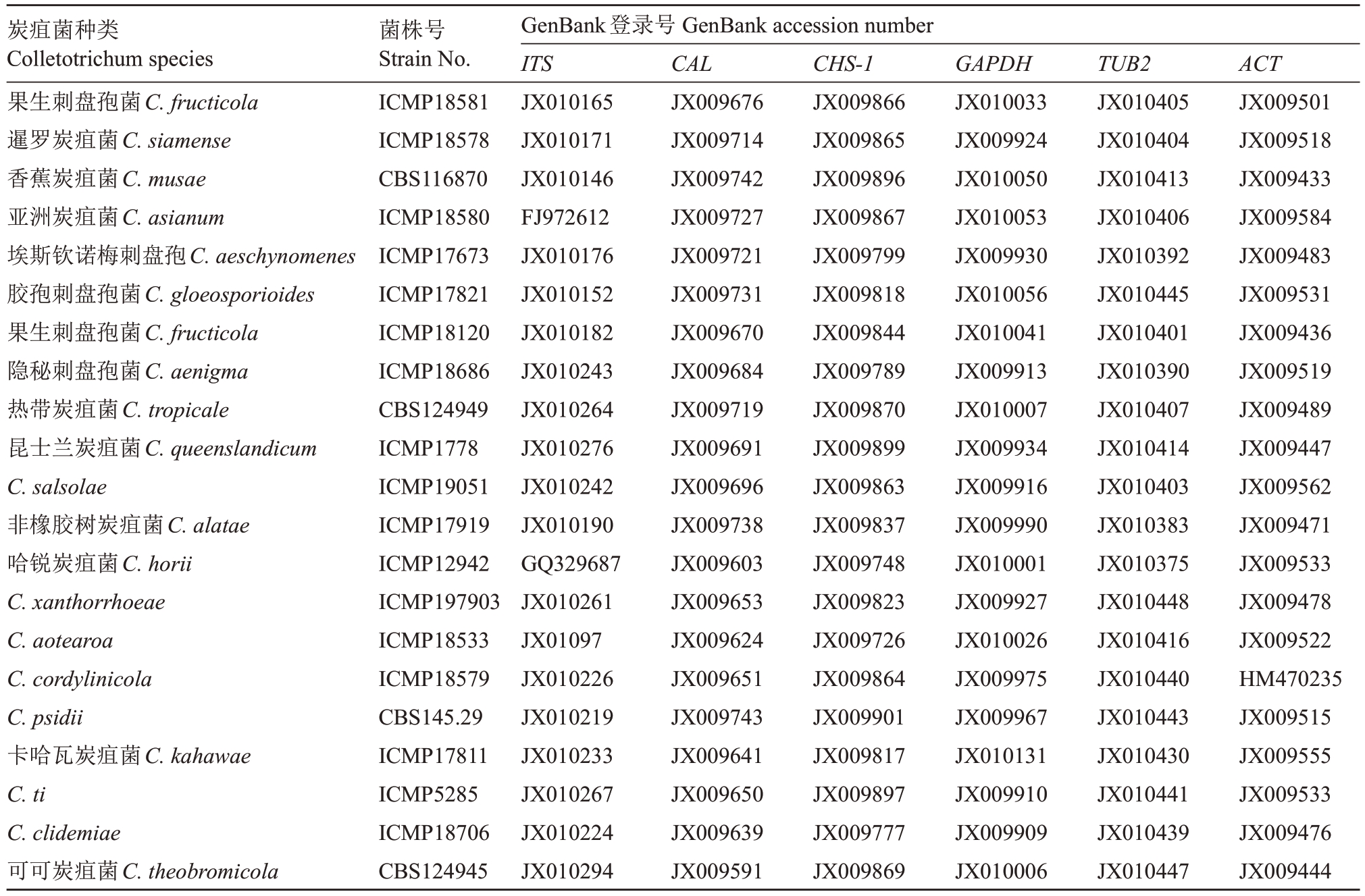
1.2.3 病原菌分子生物学鉴定 在培养7 d 的菌落边缘挑取菌饼于PDB培养基中培养4 d,灭菌纱布过滤菌丝,放入烘箱烘干后在液氮中研磨得到20 mg粉末,采用真菌基因组快速抽提试剂盒提取病原菌DNA,对炭疽菌的ITS(内转录间隔区)、CAL(钙调蛋白基因)、CHS-1(几丁质合成酶基因)、GAPDH(3-磷酸甘油醛脱氢酶基因)、TUB2(β-微管蛋白基因)和ACT(肌动蛋白基因)6个基因进行扩增。扩增的相关基因及对应的引物名称和序列[22]如表1 所示。PCR 扩增体系为(50 µL):2 × Taq PCR Master Mix 25µL,DNA 模板2 µL,上下游引物各1 µL,ddH2O 21µL。PCR 扩增程序:95 ℃预变性4 min;95 ℃变性30 s,各自退火温度下退火30 s,72 ℃延伸45 s,重复35 个循环;72 ℃延伸7 min。退火温度分别为52、59、58、59、52、58 ℃[23]。每次反应均以ddH2O 代替模板DNA 的反应体系作为阴性对照。PCR 产物在1%琼脂糖凝胶电泳上检测,得到目的片段后送至生工(上海)生物工程有限公司测序。将测序结果使用NCBI 进行BLAST 比对分析,在GenBank 中下载同时含有这6个基因序列的同源性较高的菌株及炭疽菌属不同种的菌株和模式菌株序列(表2),按ITS、CAL、CHS-1、GAPDH、TUB2、ACT 顺序首尾拼接后导入到MEGA 7.0 软件,用手工校正后选择最大似然法(maximum likelihood,ML)、自展值(bootstrap)为1000,构建多基因联合病原菌的系统发育树并进行分析。
表1 基因及引物序列
Table 1 Genes and primer sequences
?
表2 用于多基因联合构建系统发育分析的代表性菌株基因登录号
Table 2 Gene accession numbers of representative strains for multi-gene phylogenetic analysis
?
1.3 沙棘果实炭疽病生防细菌的筛选及鉴定
1.3.1 菌株的分离纯化 称取1 g土壤装入有50 mL无菌水的三角瓶,在28 ℃、180 r min-1摇床上振荡30 min,使之充分悬浮,然后用无菌去离子水将土壤悬液稀释至10-2、10-3、10-4;每个浓度各吸取30 μL 至PDA 平板中央,用涂布棒涂匀,3 次重复;将涂好的平板倒置于28 ℃恒温箱中培养2 d。挑取形态、颜色不同的菌落划线培养单菌落,纯化保存备用。
1.3.2 拮抗菌株的筛选 平板初筛:用打孔器沿病原菌菌落的边缘打取6 mm菌饼转接于PDA平板中央,分别吸取2 μL 菌液点接到菌饼上、下、左、右约2.5 cm 处,倒置于28 ℃培养[24];初步筛选对病原菌有拮抗效果的菌株并保存。平板复筛:选取经初筛保存的菌株进一步验证其拮抗效果,采用平板对峙法,将PDA 平板上培养7 d 的沙棘果实炭疽病菌饼(6 mm)置于PDA平板中央,在距离菌饼中心2.5 cm对称划线接种待测菌株,以只接菌饼的平板为对照组,每个处理3 次重复,倒置于28 ℃恒温培养箱中培养3~7 d,观察并测量有明显抑菌带的菌落直径,并计算抑菌率。抑菌率/%=(对照菌落生长直径-处理菌落生长直径)/对照菌落生长直径×100。
1.3.3 生防菌株形态观察及生理生化鉴定 将筛选出的菌株在LB 平板上划线接种,在28 ℃培养箱中培养24~48 h,参照《伯杰细菌鉴定手册》和《常见细菌系统鉴定手册》的方法观察单个菌落的形态、大小、颜色、干湿、透明度及表面光滑或粗糙度等。对拮抗菌进行革兰氏染色,并分别对明胶液化、D-木糖、L-阿拉伯糖、D-甘露醇、淀粉水解,柠檬酸盐、V-P反应、丙酸盐、pH 5.7 生长、硝酸盐还原及7%NaCl生长等生理生化特征进行测定。
1.3.4 生防菌株分子生物学鉴定 将菌株在28 ℃,180 r·min-1摇床上振荡培养22 h,采用细菌基因组快速抽提试剂盒提取菌株的总DNA。对菌株16S rDNA 和gyrB 基因序列进行PCR 扩增,引物分别为27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-GGTTACCTTGTTACGACTT-3′;gyrBF:5′-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3′和gyrBR:5′-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT- 3′[25]。PCR 扩增体系为(50 µL):2 × Taq PCR Master Mix 25µL,DNA 模板2µL,上下游引物各1µL,dd H2O 21µL。PCR 扩增程序:95 ℃预变性4 min;98 ℃变性10 s,54 ℃退火1 min,72 ℃延伸2 min,重复30个循环;72 ℃延伸8 min。将扩增产物进行1%琼脂糖凝胶电泳,得到目的片段后送至生工(上海)生物工程有限公司测序。将基因测序结果在NCBI 通过BLAST 与已有的细菌16S rDNA 和gyrB 序列进行比对分析,获得相似性较高的序列信息,通过MEGA 7.0软件对生防菌株构建系统发育进化树。
1.3.5 生防菌株产胞外酶活性测定 吸取在LB 液体培养基中过夜培养的拮抗菌株10µL分别接种至蛋白酶、纤维素酶、β-葡聚糖酶和几丁质酶检测平板中央的无菌滤纸片上,28 ℃培养3 d后,观察菌落周围有无透明圈。
1.4 数据处理
将试验所得数据采用SPSS 26.0 软件进行正态性检验和方差齐性检验。采用单因素方差分析(one way-ANOVA)进行差异显著性检验,P<0.05为显著差异。
2 结果与分析
2.1 沙棘果实炭疽病病原菌的分离及鉴定
2.1.1 病原菌的分离及致病性验证 沙棘果实炭疽病于6 月末开始发病,发病初期果实的中下部产生针尖大小的淡褐色斑点(图1-A),后期病斑逐渐扩大成深褐色凹陷圆形或椭圆形,大小通常为5 mm左右,病斑中心出现轮纹状小黑点(图1-B)。从沙棘病果共分离纯化得到14株具有代表性的菌株,其中,菌株CY-8离体接种健康果实5 d后,接种部位出现针尖大小的淡褐色斑点(图1-C),与田间初期发病症状相似,而对照未见明显病斑(图1-D)。2024年7月25日在田间活体接种菌株CY-8 20 d后,沙棘果实出现明显的褐色病斑(图1-E),而接种清水的对照果实并未发病(图1-F)。根据柯赫氏法则对接种后的发病果实进行分离并观察,菌落、孢子形态等与菌株CY-8 一致,表明菌株CY-8 是引起沙棘果实炭疽病的病原菌。

图1 沙棘果实炭疽病田间发病症状和柯赫氏法则验证
Fig.1 Field symptoms of sea-buckthorn anthracnose and verification of Koch's rule
A.发病初期;B.发病后期;C.离体接种菌株CY-8 第5 天症状;D.离体接种清水对照;E.田间果实接种菌株CY-8 第20 天症状;F.田间接种清水对照。
A.Early stage of diseases occurrence;B.Late stage of diseases occurrence;C.Symptoms on the 5th day of inoculation with strain CY-8 in vitro; D. Inoculation with clear water in vitro control; E. Symptoms in field fruit inoculated with strain CY-8 at 20th day; F. Field inoculation in water control.
2.1.2 病原菌形态学鉴定 菌株CY-8在PDA培养基上培养7 d后,菌落圆形,正面为气生菌丝绒毛状,中间部分为灰绿色菌丝,边缘菌丝为灰白色(图2-A),部分产生橘色分生孢子堆,反面中心灰绿色,边缘白色(图2-B)。分生孢子无色透明,单胞,椭圆形或近椭圆形,一端钝圆,另一端钝圆或稍尖,大小为(4.42~6.32)μm×(9.71~14.66)μm(图2-C),分生孢子萌发产生褐色附着孢,呈马蹄形(图2-D),有刚毛,刚毛暗褐色(图2-E),分生孢子盘椭圆状,四周散生大量分生孢子(图2-F)。结合《真菌鉴定手册》,初步确定菌株CY-8 与炭疽菌属(Colletotrichum)真菌形态相似。
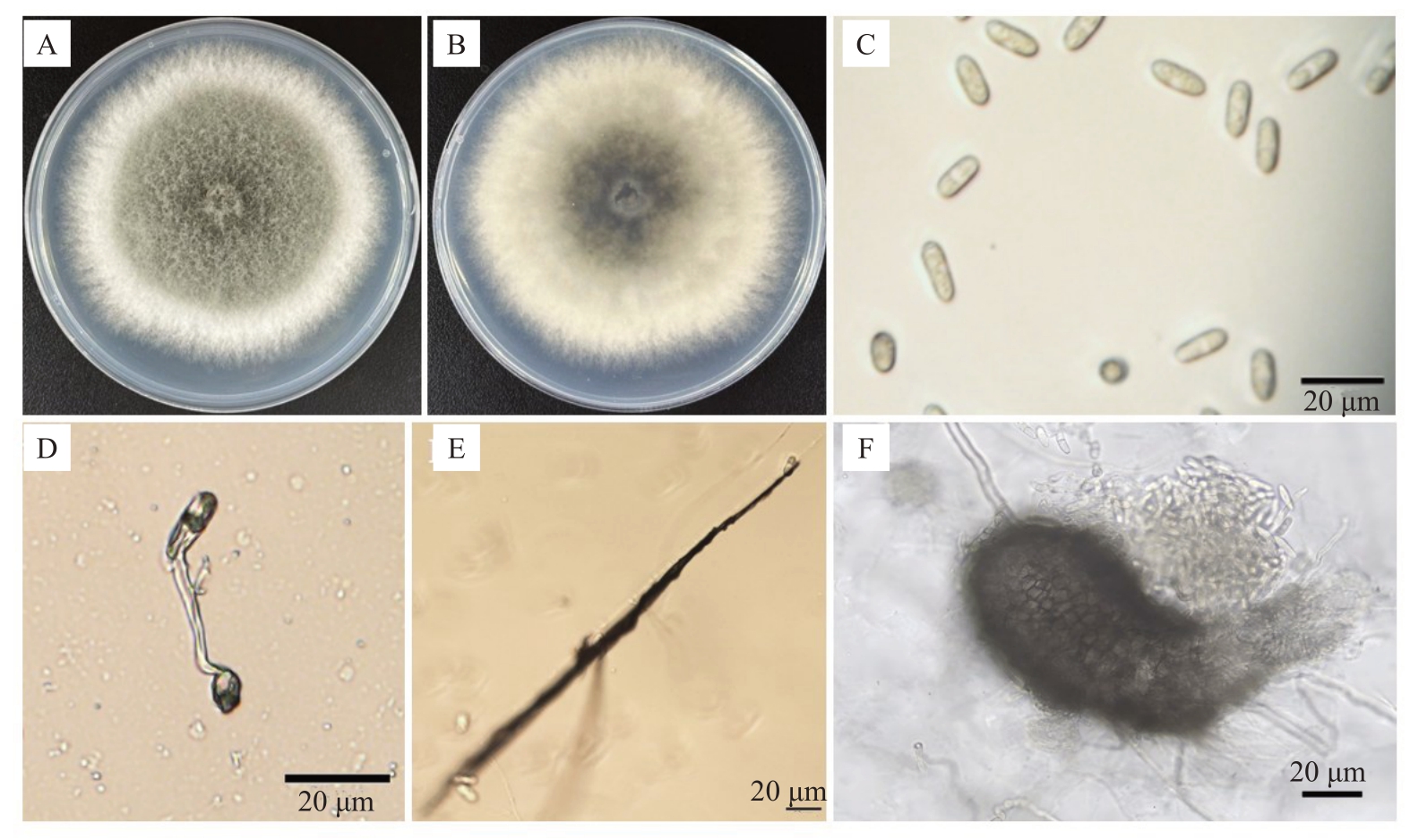
图2 菌株CY-8 的形态特征
Fig.2 Morphological characteristics of strain CY-8
A,B.菌株CY-8 在PDA 平板上7 d 后的菌落正面和反面;C.分生孢子;D.附着孢;E.刚毛;F.分生孢子盘。比例尺=20 μm。
A,B.Front and reverse sides of strain CY-8 colony on PDA plate for 7 days;C.Conidia;D.Appressoria;E.Bristle;F.Acervulus.Bar=20 μm.
2.1.3 病原菌分子生物学鉴定 以菌株CY-8 的DNA 为模板,对其ITS、GAPDH、CHS-1、CAL、TUB2和ACT 6 个基因进行扩增后测序,得到的基因序列长度分别为510、230、272、672、719 和242 bp。将获得的基因序列提交至GenBank 数据库并获得序列号分别为PP 907782、PP 971647、PP 965707、PP 965705、PP 965703 和PP 922179。在NCBI 数据库进行BLAST比对,以C.horii为外群,基于最大似然法(ML)对CY-8 使用MEGA 7.0 构建多基因系统发育树(图3),发现菌株CY-8 以96%的置信值与Colletotrichum fructicola的序列聚在一支。结合形态学特征,将分离得到的CY-8病原菌鉴定为果生刺盘孢菌(C.fructicola)。
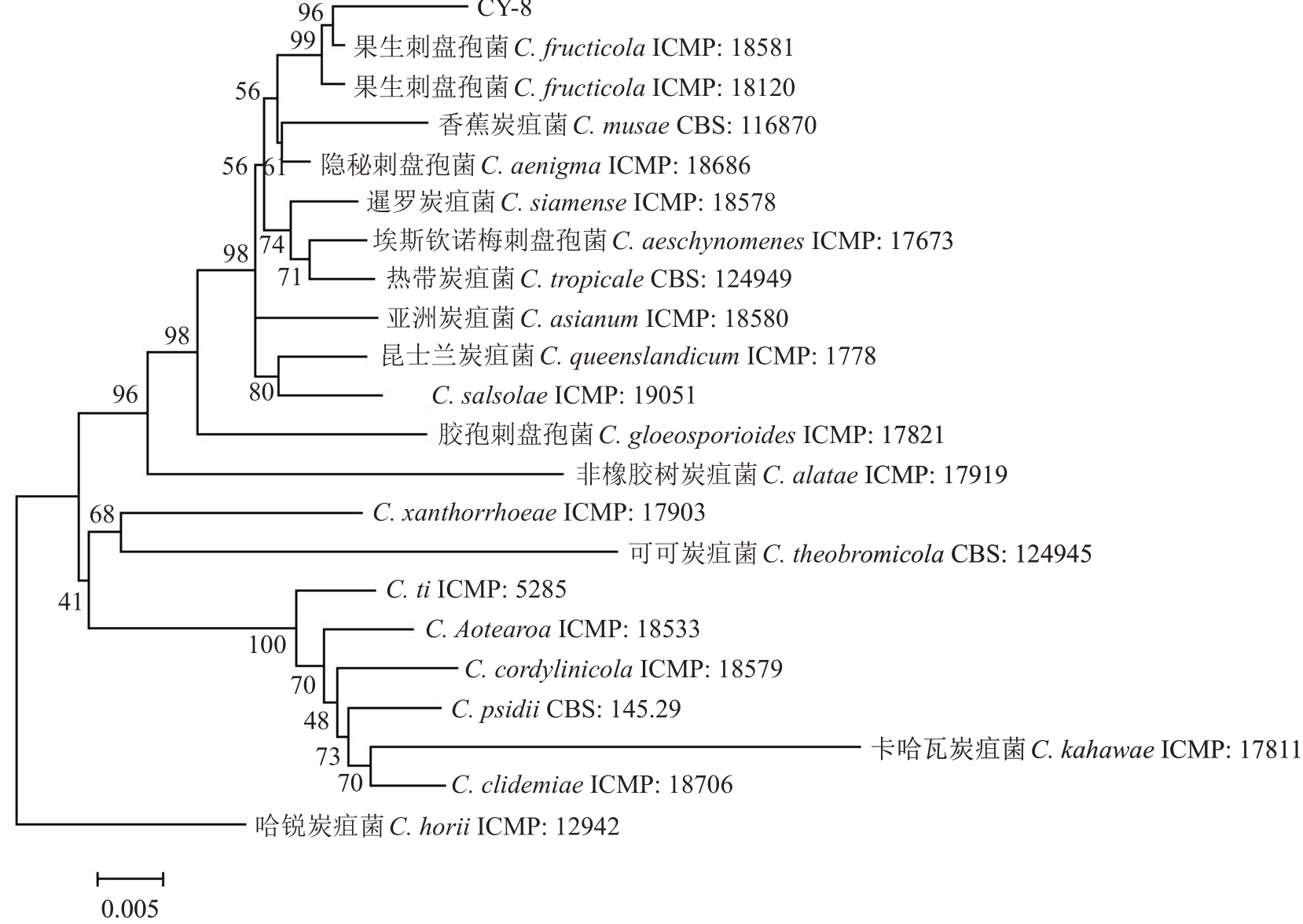
图3 基于CAL、CHS-1、GAPDH、ITS、TUB2和ACT基因序列联合构建的系统发育树
Fig.3 Phylogenetic tree constructed based on CAL,CHS-1,GAPDH,ITS,TUB2 and ACT gene sequences
2.2 沙棘果实炭疽病生防菌株的筛选及鉴定
2.2.1 生防菌株的筛选 从沙棘根际土壤中共分离出27 株有拮抗作用的菌株。将分离出的拮抗菌采用平板对峙法在28 ℃培养5 d,进行3 次重复,以菌株抑菌率≥50%为筛选标准。复筛结果表明,仅有菌株W32、W22满足筛选条件,对沙棘果实炭疽病的拮抗效果较好,抑菌率分别为66.08%和54.76%(图4)。
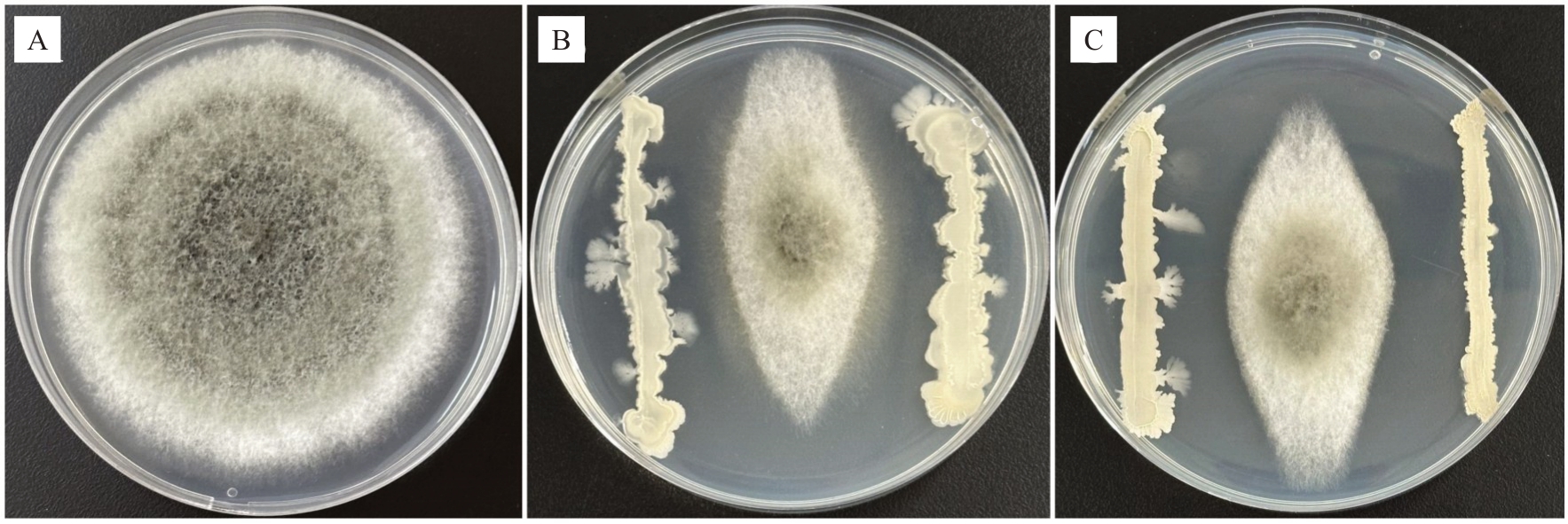
图4 生防菌株对沙棘果实炭疽病病原菌的抑制作用
Fig.4 Inhibition effect of biocontrol strains on C.fructicola
A.对照组;B.菌株W22;C.菌株W32。A.CK;B.Strain W22;C.Strain W32.
2.2.2 生防菌株形态学鉴定及生理生化特征 在LB固体培养基上划线培养1~2 d后,菌株W22菌落乳白色,扁平,形态不规则,表面粗糙不透明,有皱缩,革兰氏呈阳性,菌体呈杆状;菌株W32菌落淡黄色不透明,边缘不整齐,表面湿润、微隆起,质地微黏,革兰氏染色为阳性,菌体呈杆状(图5)。菌株W22 和菌株W32 的生理生化特征见表3,符合枯草芽孢杆菌和贝莱斯芽孢杆菌的生理生化特征。
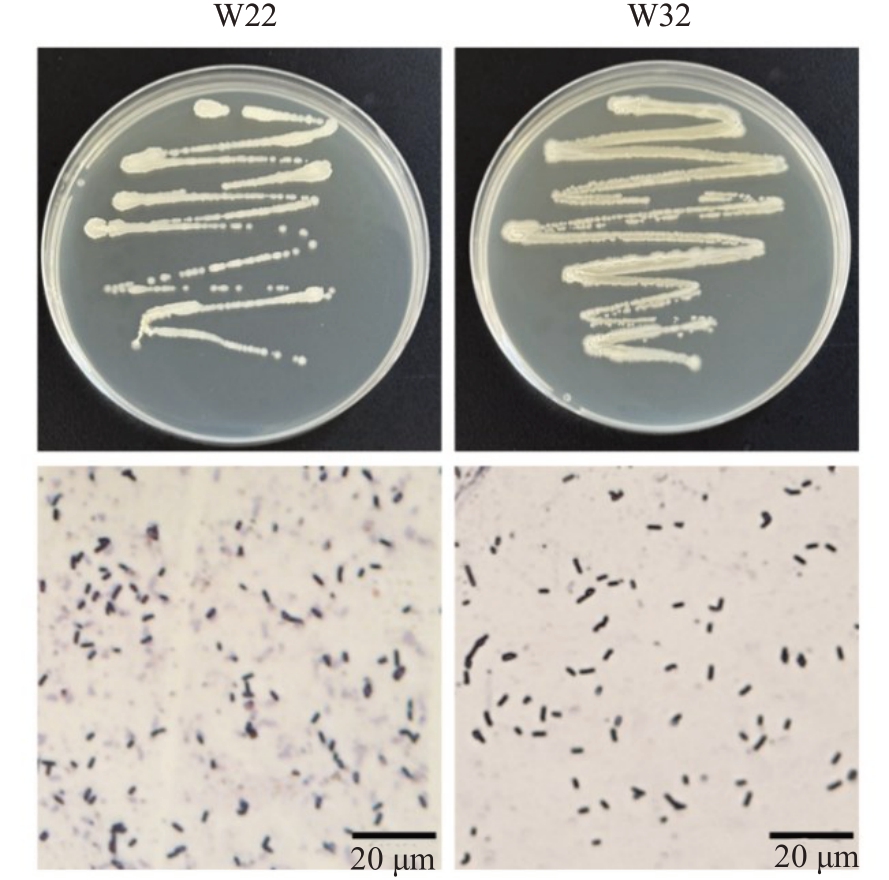
图5 生防细菌的形态特征
Fig.5 Morphological characteristics of biocontrol bacteria
表3 2 种菌株的生理生化特性
Table 3 Physiological and biochemical characteristics of two strains
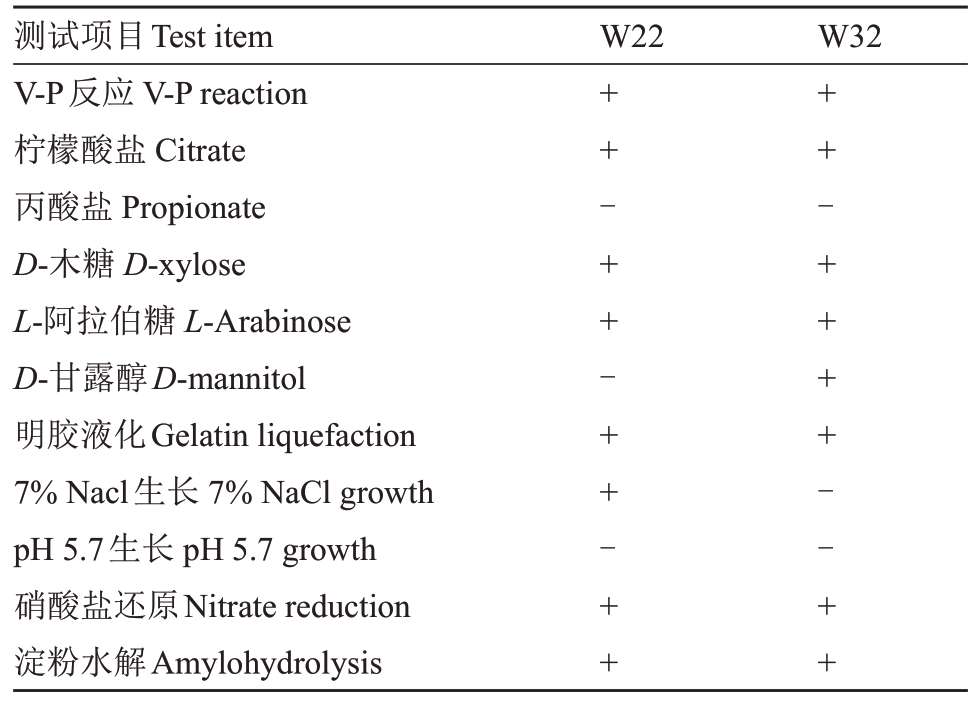
注:+表示为阳性;-表示为阴性。
Note:+indicated that the result was positive;-indicated that the result was negative.
?
2.2.3 生防菌株的分子生物学鉴定 扩增测序得到菌株W22 和W32 的16S rDNA 基因长度分别为1420和1431 bp,将获得的基因序列提交至GenBank数据库并获得序列号分别为PP911599、PP 911600;扩增测序得到菌株W22和W32 的gyrB 基因长度分别为1189 和1187 bp。经GenBank 数据库同源分析后,下载相似度较高的相关菌株序列并构建16S rDNA 系统发育树(图6)和gyrB 系统发育树(图7)。结果表明,菌株W22 与Bacillus subtilis 的多个已知菌株序列聚类为一个独立分支,表明菌株W22属于枯草芽孢杆菌(B. subtilis);菌株W32 与Bacillus velezensis 的多个已知菌株序列聚类为一个独立分支,表明菌株W32 属于贝莱斯芽孢杆菌(B.velezensis)。
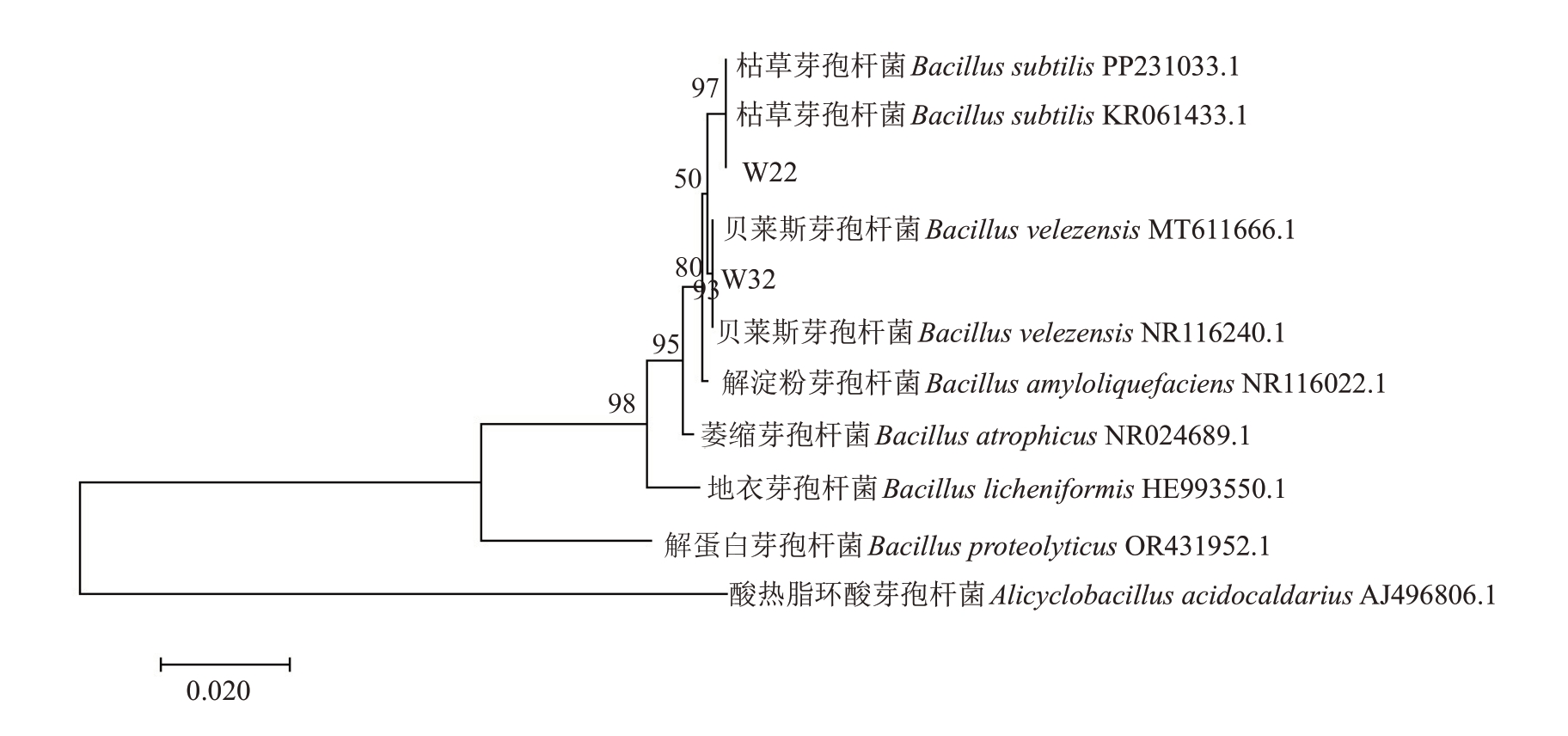
图6 生防菌株的16S rDNA 序列系统发育树
Fig.6 16S rDNA sequence phylogenetic tree of biocontrol strains
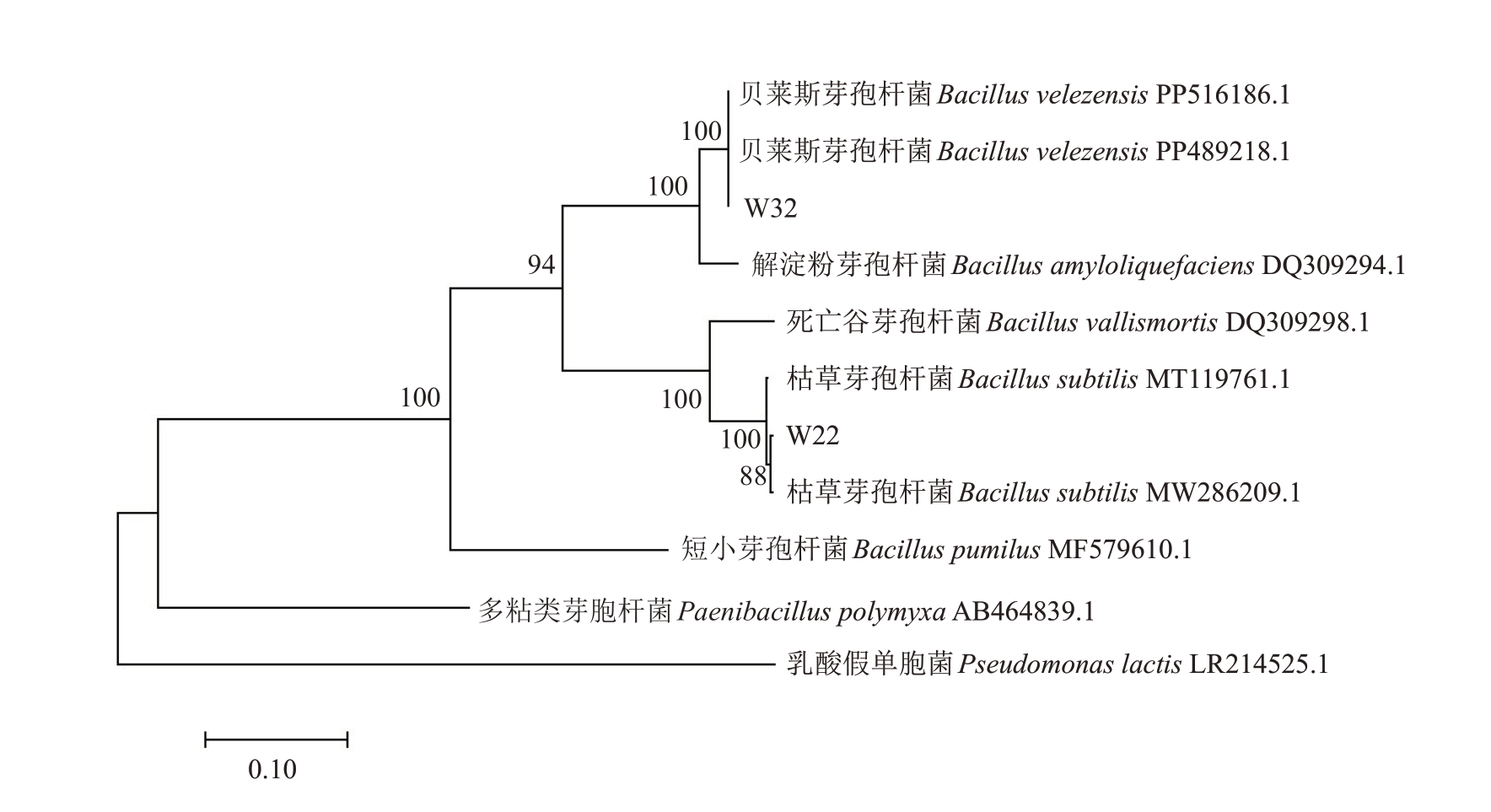
图7 生防菌株的gyrB 序列系统发育树
Fig.7 gyrB sequence phylogenetic tree of biocontrol strains
2.2.4 生防菌株产胞外酶活性测定 仅有蛋白酶和β-葡聚糖酶检测平板中央出现透明圈(图8),说明W22和W32这2株拮抗细菌均能产蛋白酶和β-葡聚糖酶,但均不能产纤维素酶和几丁质酶。
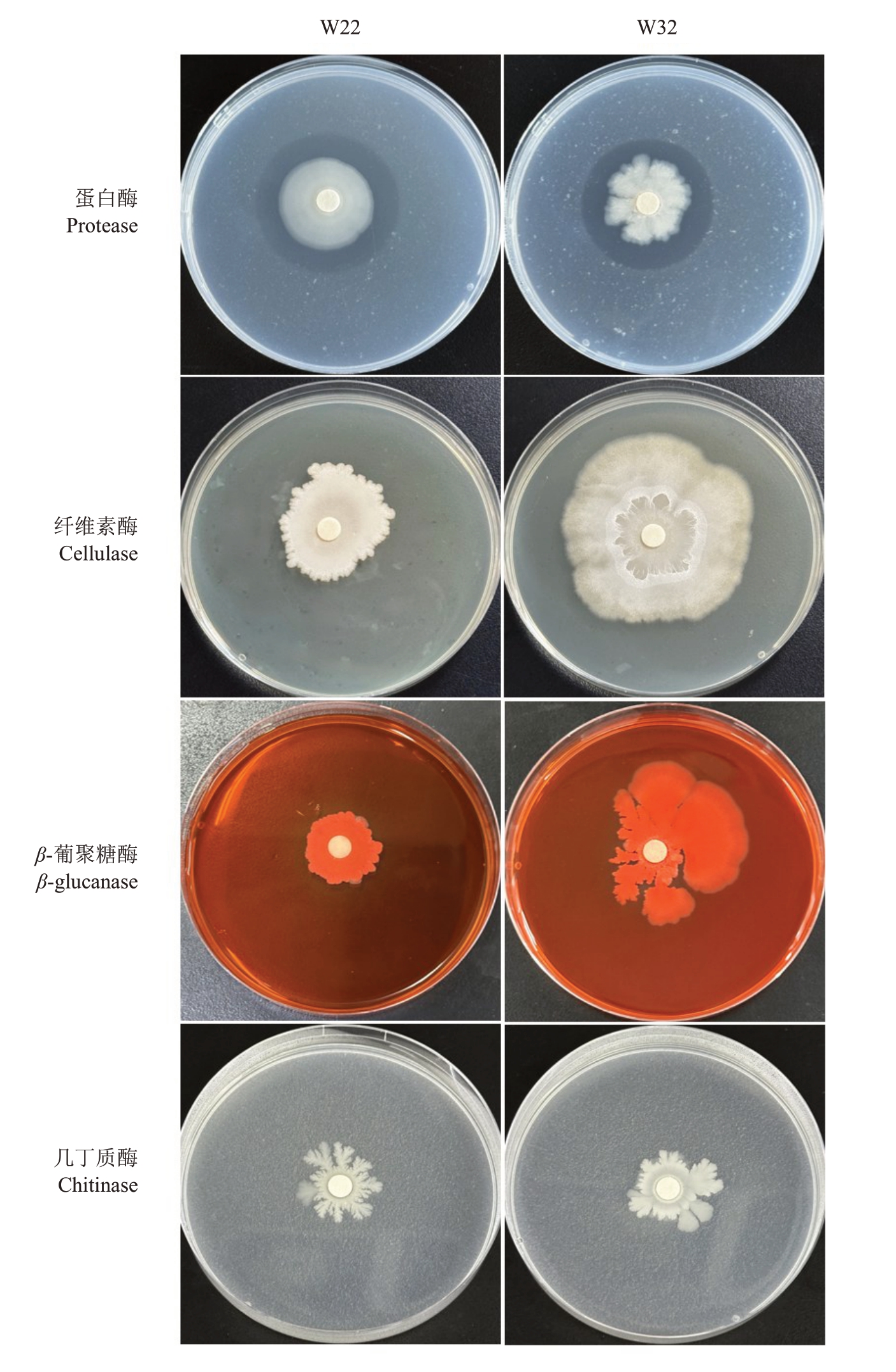
图8 2 株生防菌株产胞外酶活性检测
Fig.8 Detection of extracellular enzyme activity produced by two biocontrol strains
3 讨 论
炭疽病是一种沙棘果实的新病害,严重影响了沙棘的产量和品质。笔者通过对致病菌株进行分离和鉴定,确定了引起辽宁朝阳地区沙棘果实炭疽病的病原菌为果生刺盘孢菌(C.fructicola),属于子囊菌门(Ascomycota)盘菌亚门(Pezizomycotina)粪壳菌纲(Sordariomycetes)肉座菌目(Hypocreales)刺盘孢属(Colletotrichum)的真菌。该病原菌寄主广泛,最初是从咖啡浆果中发现的,可以侵染多种经济作物的果实,如草莓[26]、梨[27]、莲雾[28]、甜柿[29],但在沙棘果实上是首次报道。果生刺盘孢菌也可侵染植物的叶片,是油茶炭疽病的优势致病菌,在中国6个油茶产区通过侵染油茶叶片造成危害[30]。Yan 等[31]首次报道了由果生刺盘孢菌引起的木荷叶片炭疽病,感病率超过30%。
有关炭疽病的防治,生产上以化学药剂防治为主,如戊唑醇、嘧菌酯等[32]。频繁使用化学药剂易产生耐药性,为防治病害带来难度,产生的农药污染也对环境造成了影响。农药的残留使食品安全受到越来越多的关注,因此制定绿色生物防控措施对防治果实类病害具有重要意义。生防细菌是一种有效的绿色防控手段,芽孢杆菌作为微生物优势种群,其防病促生功能和抗逆能力较强[33]。利用芽孢杆菌属菌株防治炭疽病已有不少相关报道。徐伟芳等[34]研究发现,解淀粉芽孢杆菌HX0037菌株对4种瓜果炭疽病菌均有不同程度的抑菌效果,对栝楼炭疽病菌的抑菌效果最好,可达57.59%。李红莉等[35]从茶树根际土壤中分离得到一株贝莱斯芽孢杆菌,对茶树炭疽菌菌丝生长抑制率达到71.5%,经过该菌株处理的炭疽菌菌丝出现畸形、增粗、断裂等现象,孢子萌发率降低,并且它能够分泌β-1,3-葡聚糖酶、蛋白酶、纤维素酶等胞外水解酶。笔者通过平板对峙法,从沙棘根际土壤中筛选生防菌株,试验筛得抑制果生刺盘孢菌拮抗效果较强的菌株,分别是W32 和W22,抑菌率分别为66.08%和54.76%。结合菌株形态特征、生理生化特征及16S rDNA、gyrB 基因系统发育树分析,将菌株W32 鉴定为贝莱斯芽孢杆菌(B. velezensis),菌株W22 鉴定为枯草芽孢杆菌(B.subtili)。
芽孢杆菌通过产生一些具有抗菌特性的代谢物质发挥拮抗作用,如非核糖体途径产生的脂肽类物质表面活性素(surfactin)、伊枯草菌素(iturin)、丰原素(fengycin),还有核糖体途径产生的细菌素和细胞壁降解酶。表面活性素对细菌和病毒具有很强的拮抗活性,伊枯草菌素和丰原素具有较强的真菌抑制活性[36]。细胞壁降解酶可以降解结构多糖和蛋白质聚合物,抑制真菌孢子萌发和菌丝生长,阻碍孢子附着到宿主表面,防止病原真菌如炭疽菌的附着胞形成[37]。试验筛选得到的两株生防细菌W32 和W22能够产生蛋白酶和β-葡聚糖酶,但不能产生纤维素酶和几丁质酶。生防菌产生的蛋白酶和β-葡聚糖酶是重要的胞外降解酶,能够使病原菌细胞壁的蛋白质、葡聚糖这类重要组成部分发生水解,破坏病原菌菌丝的结构形态,导致细胞质渗漏等,从而抑制病原菌的正常生长,发挥生防作用[38]。笔者测定了两种生防菌胞外酶的种类,没有深入解析对病原菌的抑菌机制,二者之间抑菌率的差异可能与酶活性水平相关,或者与其他未检测的代谢产物(如抗生素、脂肽类物质)有关。二者之间的生物防治效果差异还需要在田间试验条件下经多年应用后进行测定和验证。
沙棘作为一种兼具生态与经济价值的优良树种,在中国山西、辽宁、甘肃、新疆和内蒙古等很多地区都广泛种植,并形成了以沙棘果汁、籽油、原浆等有机产品为主的沙棘产业。随着中国沙棘产业规模的不断扩大,沙棘果实病害的绿色防控对沙棘产业的可持续发展具有十分重要的意义。在下一步的研究中,可以继续开展生防菌的田间应用试验,优化菌株的发酵条件并探索复合菌剂的开发与应用,以期为沙棘果实病害的绿色防控提供技术支持。
4 结 论
笔者在本研究中首次明确了发生在朝阳沙棘基地的沙棘果实炭疽病病原菌为果生刺盘孢菌(C.fructicola),并为生物防治沙棘果实炭疽病筛选出2 株高效生防菌株,鉴定为贝莱斯芽孢杆菌(Bacillus velezensis)和枯草芽孢杆菌(Bacillus subtilis)。通过平板检测发现,这2 株生防细菌均能通过产生蛋白酶和β-葡聚糖酶这类胞外酶发挥生防作用。
[1] TENG B S,LU Y H,WANG Z T,TAO X Y,WEI D Z. In vitro anti-tumor activity of isorhamnetin isolated from Hippophae rhamnoides L. against BEL-7402 cells[J]. Pharmacological Research,2006,54(3):186-194.
[2] REN R R,LI N,SU C,WANG Y L,ZHAO X J,YANG L L,LI Y T,ZHANG B,CHEN J Y,MA X Q. The bioactive components as well as the nutritional and health effects of sea buckthorn[J].RSC Advances,2020,10(73):44654-44671.
[3] 乔旭辉,禄亚洲.察隅县野生沙棘果实酵母菌分离鉴定[J].高原农业,2022,6(4):362-368.QIAO Xuhui,LU Yazhou. Isolation and identification of yeasts from wild Hippophae rhamnoides in Chayu county[J]. Journal of Plateau Agriculture,2022,6(4):362-368.
[4] 吕兆林,袁玮琼,张柏林,邢国良.沙棘果实中主要活性成分质量分布[J].北京林业大学学报,2021,43(1):144-152.LÜ Zhaolin,YUAN Weiqiong,ZHANG Bolin,XING Guoliang.A review on mass distribution of active components from Hippophae rhamnoides fruits[J].Journal of Beijing Forestry University,2021,43(1):144-152.
[5] 张隆秀. 沙棘树的栽培要点与开发利用[J]. 农业工程技术,2019,39(29):68.ZHANG Longxiu. Cultivation points and exploitation of sea buckthorn tree[J]. Agricultural Engineering Technology,2019,39(29):68.
[6] RUAN C J,DA SILVA J A T,LI Q,LI H,ZHANG J. Pathogenicity of dried-shrink disease and evaluation of resistance in a germplasm collection of sea buckthorn (Hippophae L.) from China and other countries[J]. Scientia Horticulturae,2010,127(1):70-78.
[7] PINTEAA,VARGAA,STEPNOWSKI P,SOCACIU C,CULEA M,DIEHL H A.Chromatographic analysis of carotenol fatty acid esters in Physalis alkekengi and Hippophae rhamnoides[J]. Phytochemical Analysis,2005,16(3):188-195.
[8] 胡景文,乔璐,李云飞. 沙棘产品收获与加工技术现状与展望[J].农产品加工(学刊),2012(12):101-104.HU Jingwen,QIAO Lu,LI Yunfei. Prospect and current situation of harvest and processing of Hippophae[J].Academic Periodical of Farm Products Processing,2012(12):101-104.
[9] WANG Z,ZHAO F L,WEI P P,CHAI X Y,HOU G G,MENG Q G. Phytochemistry,health benefits,and food applications of sea buckthorn (Hippophae rhamnoides L.):A comprehensive review[J].Frontiers in Nutrition,2022,9:1036295.
[10] YANG B R,KORTESNIEMI M. Clinical evidence on potential health benefits of berries[J]. Current Opinion in Food Science,2015,2:36-42.
[11] 林玉友,王洪江,张海旺,祁崇祝,林则双,赵明优,张东为,祁承宇.沙棘果实成分及影响因素研究进展[J].辽宁林业科技,2022(6):52-56.LIN Yuyou,WANG Hongjiang,ZHANG Haiwang,QI Chongzhu,LIN Zeshuang,ZHAO Mingyou,ZHANG Dongwei,QI Chengyu. Progress of research on the composition and influencing factors of sea buckthorn fruits[J]. Liaoning Forestry Science&Technology,2022(6):52-56.
[12] XIA B,LIANG Y,HU J Z,YAN X L,YIN L Q,CHEN Y,HU J Y,ZHANG D W,WU Y H. First report of sea buckthorn stem wilt caused by Fusarium sporotrichioides in Gansu,China[J].Plant Disease,2021,105(12):4156.
[13] DREVINSKA K,MOROČKO-BIČEVSKA I.Sea buckthorn diseases caused by pathogenic fungi[J]. Proceedings of the Latvian Academy of Sciences Section B Natural,Exact,and Applied Sciences,2022,76(4):393-401.
[14] 宗世祥,姚国龙,骆有庆,许志春,王涛.沙棘主要蛀干害虫种群生态位[J].生态学报,2005,25(12):3264-3270.ZONG Shixiang,YAO Guolong,LUO Youqing,XU Zhichun,WANG Tao.Niche of main boring pests in Hippophae rhamnoidea[J].Acta Ecologica Sinica,2005,25(12):3264-3270.
[15] 魏建荣,苏智,刘明虎,魏柯,董丽君.沙棘果实的重要检疫害虫沙棘绕实蝇的发生与危害[J]. 内蒙古林业科技,2012,38(4):55-57.WEI Jianrong,SU Zhi,LIU Minghu,WEI Ke,DONG Lijun.Occurance and damage of Rhagoletis batava obseuriosa[J]. Journal of Inner Mongolia Forestry Science&Technology,2012,38(4):55-57.
[16] DEAN R,VAN KAN J A L,PRETORIUS Z A,HAMMONDKOSACK K E,DI PIETRO A,SPANU P D,RUDD J J,DICKMAN M,KAHMANN R,ELLIS J,FOSTER G D. The Top 10 fungal pathogens in molecular plant pathology[J]. Molecular Plant Pathology,2012,13(4):414-430.
[17] 朱家君.园林植物炭疽病调查及病原菌果生刺盘孢菌效应蛋白预测及作用机制研究[D].上海:上海应用技术大学,2023.ZHU Jiajun. Investigation on anthracnose of landscape plants and prediction of effectors and mechanisms of Colletotrichum fructicola,the pathogenic fungus[D]. Shanghai:Shanghai Institute of Technology,2023.
[18] FENG W K,WANG C H,JU Y W,CHEN Z X,WU X,FANG D L.Identifying the biological characteristics of anthracnose pathogens of blueberries(Vaccinium corymbosum L.)in China[J].Forests,2024,15(1):117.
[19] 田宇曦,闵勇,陈凌,刘晓艳.柑橘炭疽病分类鉴定和防治研究进展[J].中南农业科技,2023,44(12):230-232.TIAN Yuxi,MIN Yong,CHEN Ling,LIU Xiaoyan. Progress of research on the classification and identification of citrus anthracnose and its control[J]. South-Central Agricultural Science and Technology,2023,44(12):230-232.
[20] 李洁琼,张殿朋,卢彩鸽,吴慧玲,于莉,刘伟成. Collimonas sp.ZL261 蛋白酶基因的克隆、表达及其酶学特性[J].核农学报,2014,28(8):1370-1378.LI Jieqiong,ZHANG Dianpeng,LU Caige,WU Huiling,YU Li,LIU Weicheng. Gene cloning,expression and the characterization of the protease produced by Collimonas sp.ZL261[J].Journal of Nuclear Agricultural Sciences,2014,28(8):1370-1378.
[21] 李蓓蓓. 马铃薯晚疫病生防细菌的筛选鉴定及抗病机制研究[D].呼和浩特:内蒙古大学,2023.LI Beibei. Screening,identification,and biocontrol effect of antagonistic bacteria against Phytophthora Infestans[D]. Hohhot:Inner Mongolia University,2023.
[22] WEIR B S,JOHNSTON P R,DAMM U. The Colletotrichum gloeosporioides species complex[J].Studies in Mycology,2012,73:115-180.
[23] 马骏.山核桃真菌性叶斑病病原菌的分离鉴定及LAMP 检测方法的建立[D].杭州:浙江农林大学,2022.MA Jun. Isolation and identification of fungal leaf spot disease from Carya cathayensis Sarg.and establishment of LAMP detection method[D].Hangzhou:Zhejiang A&F University,2022.
[24] GUO D S,YUAN C H,LUO Y Y,CHEN Y H,LU M H,CHEN G C,REN G W,CUI C B,ZHANG J T,AN D R.Biocontrol of tobacco black shank disease(Phytophthora nicotianae)by Bacillus velezensis Ba168[J]. Pesticide Biochemistry and Physiology,2020,165:104523.
[25] 吴晓晖,谢永丽,D′OVIDIO R,张英,芦光新,辛总秀,MASCI S.3 株分离自高寒草甸根际芽孢杆菌的分子鉴定及其生物活性[J].草业科学,2017,34(12):2454-2463.WU Xiaohui,XIE Yongli,D′OVIDIO R,ZHANG Ying,LU Guangxin,XIN Zongxiu,MASCI S. Molecular identification and biological activity of three Bacillus strains isolated from an alpine meadow rhizosphere in Qinghai province[J].Pratacultural Science,2017,34(12):2454-2463.
[26] 宋丽丽,张丽勍,高清华,段可.草莓果生刺盘孢菌的生物学特性及致病性测定[J].上海农业学报,2019,35(6):88-96.SONG Lili,ZHANG Liqing,GAO Qinghua,DUAN Ke.Biological characteristics and pathogenicity of strawberry Colletotrichum fructicola[J].Acta Agriculturae Shanghai,2019,35(6):88-96.
[27] 周贝贝,高正辉,杨雪,石旺鹏,齐永杰,马娜,阚丽平,徐义流.砀山酥梨炭疽病病原鉴定和检测及致病性分析[J].植物病理学报,2024,54(3):648-653.ZHOU Beibei,GAO Zhenghui,YANG Xue,SHI Wangpeng,QI Yongjie,MA Na,KAN Liping,XU Yiliu. Identification,detection and pathogenicity analysis of‘Dangshan Su’pear anthracnose[J].Acta Phytopathologica Sinica,2024,54(3):648-653.
[28] 李杨秀,吴凡,蒙姣荣,李界秋.广西平果莲雾炭疽病病原菌鉴定[J].中国果树,2018(1):36-40.LI Yangxiu,WU Fan,MENG Jiaorong,LI Jieqiu. Identification of the causal agent causing waxapple anthracnose in Pingguo country,Guangxi[J].China Fruits,2018(1):36-40.
[29] 任立超,谢昀烨,施鹏程,武军,方丽,王汉荣.甜柿炭疽病病原种类及生物学特性比较[J].果树学报,2023,40(2):340-349.REN Lichao,XIE Yunye,SHI Pengcheng,WU Jun,FANG Li,WANG Hanrong. Pathogen identification and biological characteristics of sweet persimmon anthracnose causing by Colletotrichum species[J].Journal of Fruit Science,2023,40(2):340-349.
[30] 李河,周国英,徐建平,朱丹雪.一种油茶新炭疽病原的多基因系统发育分析鉴定[J]. 植物保护学报,2014,41(5):602-607.LI He,ZHOU Guoying,XU Jianping,ZHU Danxue. Pathogen identification of a new anthracnose of Camellia oleifera in China based on multiple-gene phylogeny[J]. Journal of Plant Protection,2014,41(5):602-607.
[31] YAN L Z,SHI J Q,PENG X J,ZHANG S K,ZHOU X D.Characterization of Colletotrichum fructicola causing anthracnose on Schima superba in China[J]. Forest Pathology,2024,54(3):e12863.
[32] 崔一平,宋晓兵,严洁春,黄峰,凌金锋,彭埃天.铁皇冠炭疽病病原鉴定及室内药剂筛选[J].中国农学通报,2023,39(24):120-126.CUI Yiping,SONG Xiaobing,YAN Jiechun,HUANG Feng,LING Jinfeng,PENG Aitian.Pathogen identification and screening of fungicides against Microsorum pteropus anthracnose disease[J]. Chinese Agricultural Science Bulletin,2023,39(24):120-126.
[33] 陈志谊,刘永峰,刘邮洲,张荣胜.植物病害生防芽孢杆菌研究进展[J].江苏农业学报,2012,28(5):999-1006.CHEN Zhiyi,LIU Yongfeng,LIU Youzhou,ZHANG Rongsheng.Research progress in biocontrol of Bacillus spp. against plant diseases[J]. Jiangsu Journal of Agricultural Sciences,2012,28(5):999-1006.
[34] 徐伟芳,李贺宇,张慧,何仔昂,高文恒,谢紫洋,王传文,尹登科.生防细菌HX0037 对栝楼炭疽病的防病能力及其机制[J].生物技术通报,2024,40(4):228-241.XU Weifang,LI Heyu,ZHANG Hui,HE Zaiang,GAO Wenheng,XIE Ziyang,WANG Chuanwen,YIN Dengke. Efficacy and its mechanism of bacterial strain HX0037 on the control of anthracnose disease of Trichosanthes kirilowii Maxim[J]. Biotechnology Bulletin,2024,40(4):228-241.
[35] 李红莉,卢健,赵芸,黄海涛,崔宏春,朱建杰,任国华.茶树炭疽病生防菌的筛选、鉴定及拮抗机制研究[J].浙江农业科学,2024,65(8):1902-1907.LI Hongli,LU Jian,ZHAO Yun,HUANG Haitao,CUI Hongchun,ZHU Jianjie,REN Guohua.Screening,identification and antagonistic mechanism for biological control of tea anthracnose[J].Journal of Zhejiang Agricultural Sciences,2024,65(8):1902-1907.
[36] 吴孔阳,娄亚芳,杨同香,杨伟平.枯草芽孢杆菌功能及相关机制研究进展[J].黑龙江畜牧兽医,2020(23):55-58.WU Kongyang,LOU Yafang,YANG Tongxiang,YANG Weiping. Progress in the study of functions and related mechanisms of Bacillus subtilis[J]. Heilongjiang Animal Science and Veterinary Medicine,2020(23):55-58.
[37] CHOUB V,AJUNA H B,WON S J,MOON J H,CHOI S I,MAUNG C E H,KIM C W,AHN Y S. Antifungal activity of Bacillus velezensis CE 100 against anthracnose disease(Colletotrichum gloeosporioides) and growth promotion of walnut (Juglans regia L.)trees[J].International Journal of Molecular Sciences,2021,22(19):10438.
[38] 陈雪,莫芹,陈一帆,李丹,沈渊,章寅,吕贝贝.大豆土传病害生防菌及其应用研究进展[J]. 中国油料作物学报,2023,45(5):1082-1094.CHEN Xue,MO Qin,CHEN Yifan,LI Dan,SHEN Yuan,ZHANG Yin,LÜ Beibei.Research progress on biocontrol bacteria for soybean soil-borne diseases and its application[J]. Chinese Journal of Oil Crop Sciences,2023,45(5):1082-1094.