植物免疫反应包括病原相关分子模式诱导的免疫反应(Pattern-triggered immunity,PTI)和效应子诱导的免疫反应(Effector-triggered immunity,ETI)。PTI是植物与病原菌相互作用进化过程中形成的第一层次防御系统,即病原菌固有的某些保守的分子(如鞭毛蛋白、几丁质和脂多糖等)或病原菌分解植物细胞壁产生的果胶碎片和低聚半乳糖醛酸(Oligogalacturonides,OGs)等被植物模式识别受体(Pattern recognition receptors,PRRs)识别,并激活植物免疫反应,从而限制病原菌的入侵和扩繁[1]。PRRs是一类位于细胞膜上的受体激酶,可识别病原体入侵并在植物中传递危险信号。细胞壁相关受体激酶(Wall-associated kinase,WAK)以及与其具有类似结构WAK样激酶(Wall-associated kinase-like,WAKL)是一类重要的模式识别受体。WAK/WAKL 参与细胞壁信号传感并将细胞外信号传递到细胞质,从而调节植物生长发育和胁迫反应,在植物中广泛分布。研究表明,WAK/WAKL可以作为OGs的受体,激活丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)磷酸化级联反应,从而将胁迫信号传递到细胞内,导致细胞内活性氧(Reactive oxygen species,ROS)的产生、胼胝体的沉积、钙离子信号的传递、激素的合成以及防御基因的激活,这一系列分子事件能够使植物细胞在很短的时间内对病原菌的入侵采取迅速而有效的抵御[2-3]。玉米的Zm-WAK-RLK1 基因赋予了植株对叶枯病的抗性[4]。在水稻中,过表达OsWAK1 基因可增强植株对稻瘟病菌的抗性,而另一个WAK类型基因Xa4使水稻对白叶枯病具有持久抗性[5-6]。TaWAK6赋予小麦对叶锈病的抗性[7]。棉花GhWAKL可增强植株对黄萎病的抗性[8]。在柑橘中,过表达CsWAKL08可增强植株对细菌性溃疡病的抗性[9]。过表达BrWAK1 可以显著增强白菜对霜霉病菌的抗性[10]。可见WAK/WAKL介导的免疫反应在植物抵抗病原菌侵染的调控过程中发挥了重要作用。
疫病(Phytophthora blight)是甜瓜的主要病害之一,在世界各地的甜瓜产区均有发生,对中国甜瓜产业发展构成严重威胁[11-13]。该病为土传性病害,病原菌寄主范围广,可以卵孢子或厚垣孢子的形式在植物病残株、土壤以及种子上越冬。其中,土壤中的病残株带菌率最高,是翌年的主要初侵染源。疫霉菌可侵染植株的根、茎、叶、花、果各个部位,整个生育期均可发病,在条件适宜的情况下可出现大面积流行,造成整个地块死秧,瓜农损失惨重[14]。引起甜瓜疫病的病原菌有辣椒疫霉(Phytophthora capsici)、瓜类疫霉(Phytophthora melonis)、掘氏疫霉(Phytophthora drechsleri)和烟草疫霉(Phytophthora nicotianae),其中辣椒疫霉在世界各地的甜瓜产区均有报道[15-17]。疫霉菌的致病性强,瓜类作物中高抗资源极其匮乏,导致抗疫病研究进展缓慢。WAK/WAKL 作为重要的模式识别受体,在甜瓜中未见抗病相关报道,也尚未对其基因家族的特征和功能进行全面研究。因此,笔者在本研究中基于甜瓜基因组数据,鉴定了甜瓜WAK/WAKL 家族基因,分析了蛋白理化性质、染色体定位、进化关系、基因结构、保守结构域、启动子顺式作用元件。同时,研究了甜瓜WAK/WAKL家族基因在抗病和感病材料中响应疫霉菌侵染的表达模式,旨在挖掘响应甜瓜疫病侵染的关键WAK/WAKL基因,为进一步明确该基因家族在甜瓜抗病反应过程中的作用和揭示甜瓜抗疫病机制奠定基础。
1 材料和方法
1.1 试验材料
甜瓜材料ZQK9和E31是本实验室通过抗病性鉴定获得的高抗和高感疫病资源[18]。挑选种粒成熟饱满、大小均匀一致且完整无损伤的甜瓜种子,用55 ℃水浸种30 min 后转入室温水中浸种4 h,30 ℃催芽箱催芽16 h后播种到营养土中,营养土为草炭和蛭石按体积比3∶1混合而成。待幼苗长到两叶一心时,采用灌根接种法接种疫霉菌。
疫霉菌是本实验室在海南三亚采集的甜瓜病株中分离获得的,通过菌丝和孢子囊形态学鉴定和核糖体基因内转录间隔区域(Internal transcribed spacer,ITS)序列测序鉴定,证明是辣椒疫霉菌(P.capsici)。
1.2 甜瓜WAK/WAKL家族基因鉴定和理化性质分析
甜瓜基因组数据采用Melon(DHL92)v4 版本(http://cucurbitgenomics.org/v2/)。分别在烟草基因组数据库(https://solgenomics.net/organism/Nicotiana_benthamiana/genome/)、拟南芥基因组数据库(https://www.arabidopsis.org/)和番茄基因组数据库(https://solgenomics.net/organism/Solanum_lycopersicum/genome/)获得其WAK/WAKL 家族基因的蛋白序列。利用TBtools 软件中Blast 功能对烟草、拟南芥、番茄基因家族的蛋白序列与甜瓜的全部蛋白质序列进行比对,对处理结果去除冗余,删除重复项。然后,通过Pfam在线软件(http://pfam.xfam.org/search/sequence)分析确认包含GUB_WAK_bind(PF13947)、EGF(PF00008)和Pkinase(PF00069)结构域。使用ProtParam tool在线软件(https://web.expasy.org/Prot-Param/)分析甜瓜WAK/WAKL 基因家族的氨基酸数、分子质量以及等电点(pI)等理化性质。
1.3 甜瓜WAK/WAKL家族基因定位和系统进化树分析
使用TBtools软件进行染色体定位分析,用Molecular Bioinformatics Center(MBC,https://cello.life.nctu.edu.tw/)进行甜瓜WAK/WAKL 基因的亚细胞定位预测。利用在线软件Protter(http://wlab.ethz.ch/protter/start/)和TMHMM- 2.0(https://services.healthtech.dtu.dk/services/TMHMM-2.0/)进行跨膜结构预测。使用MEGA11.0软件对甜瓜、烟草、拟南芥、番茄WAK/WAKL 基因家族蛋白序列进行对比,采用邻接法(Neighbour-joining,NJ)构建系统进化树,Bootstrap 检验设定1000 次重复,以评价系统进化树的统计可靠性,使用iTOL软件进一步美化进化树。
1.4 甜瓜WAK/WAKL家族基序与启动子顺式作用元件分析
使用CDD 数据库(http://www.ncbi.nlm.nih.gov/cdd/)对保守结构域进行分析,使用TBtools软件进行基因结构分析。在PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)上预测顺式作用元件,使用TBtools软件对预测结果进行可视化。
1.5 甜瓜WAK/WAKL基因家族成员在疫霉菌侵染过程中的表达分析
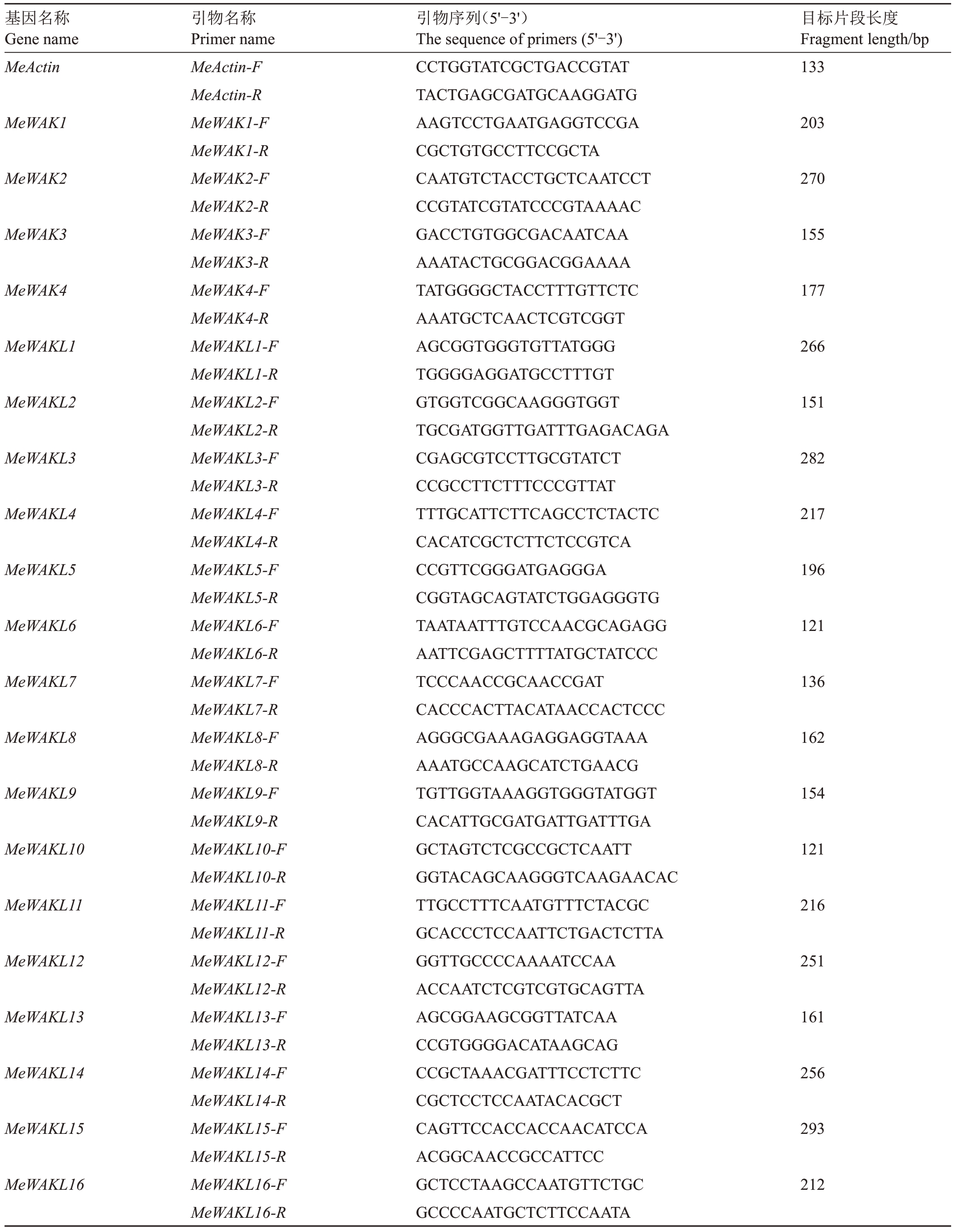
为了解甜瓜WAK/WAKL家族基因在抗疫霉菌侵染中的作用,采用灌根接种法,利用浓度为1×105个·mL-1的孢子悬浮液接种到甜瓜幼苗根部,分别在接菌后0 h、24 h和72 h采集植株根系,用锡箔纸包裹,经液氮速冻后保存于-80 ℃冰箱备用。每个处理设置3次生物学重复。使用天根RNAprep Pure多糖多酚植物总RNA提取试剂盒(DP441)提取RNA,使用天根FastKing 一步法除基因组cDNA 第一链合成试剂盒(KR118)合成cDNA第一链。以甜瓜Actin基因(MELO3C023264)为内参基因,实时荧光定量PCR(realtime quantitative PCR,RT-qPCR)测定各基因在接菌后不同时间点的相对表达量。利用Primer Premier 5软件设计引物(表1)。选用Universal SYBR Green Master荧光定量试剂盒(Roche)在Light Cycler®480Ⅱ(Roche)进行检测。采用2-∆∆CT法计算基因相对表达量。
表1 甜瓜MeWAK/WAKL 家族基因实时荧光定量引物
Table 1 Real-time quantitative primers for MeWAK/WAKL genes
?
2 结果与分析
2.1 甜瓜WAK/WAKL家族基因鉴定及其理化性质分析
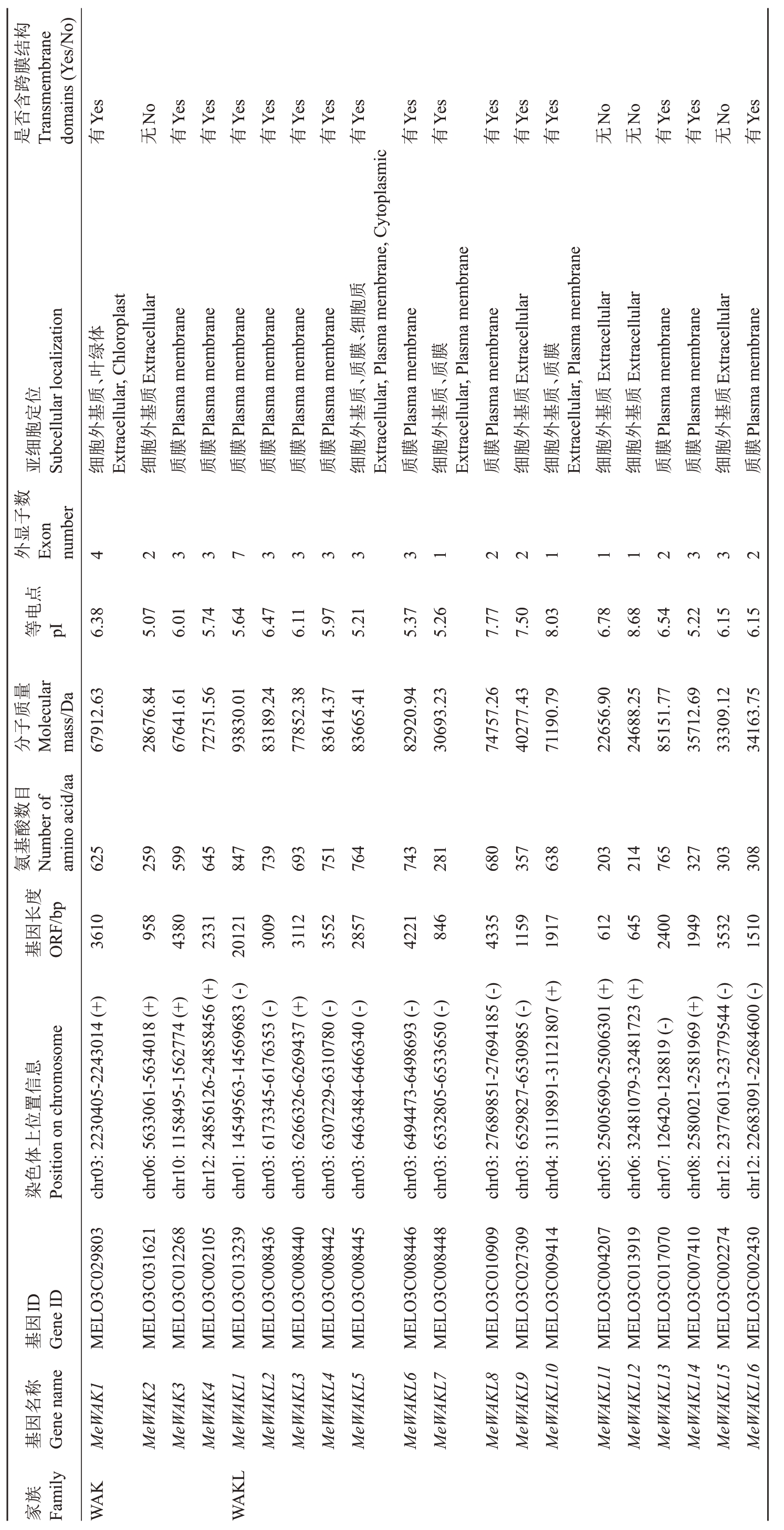
基于烟草、拟南芥和番茄基因组中获得的93个WAK/WAKL家族蛋白序列,通过与甜瓜基因组进行Blast比对,鉴定到20个WAK/WAKL家族基因(包括4个WAK基因和16个WAKL基因),按照其在染色体上的位置顺序分别命名为MeWAK1~MeWAK4 和Me-WAKL1~MeWAKL16(表1)。理化性质分析显示,鉴定到的20个WAK/WAKL蛋白氨基酸数量为203~847,其中MeWAKL11 分子质量最低,为22 656.90 Da;MeWAKL1分子质量最高,为93 830.01 Da。蛋白等电点为5.07(MeWAK2)~8.68(MeWAKL12),其中等电点小于7的蛋白占80%,说明甜瓜WAK/WAKL蛋白大部分是酸性。亚细胞定位结果显示,甜瓜WAK/WAKL家族基因主要定位于细胞外基质或质膜,Me-WAK1可能在叶绿体中也有分布(表2)。
表2 甜瓜 MeWAK/WAKL 基因家族的理化性质
Table 2 Physicochemical properties of MeWAK/WAKL genes in melon
?
2.2 甜瓜MeWAK/WAKL家族基因定位分析
通过染色体定位分析,发现20 个甜瓜Me-WAK/WAKL 家族基因分布在9 条染色体上。在第3号染色体上分布了9条基因,其中7个基因成簇状分布;第12号染色体分布了3个基因;第6号染色体分布2 个基因;在第1、4、5、7、8、10 号染色体上各分布1 个基因;第2、9、11号染色体上无该家族基因(图1)。
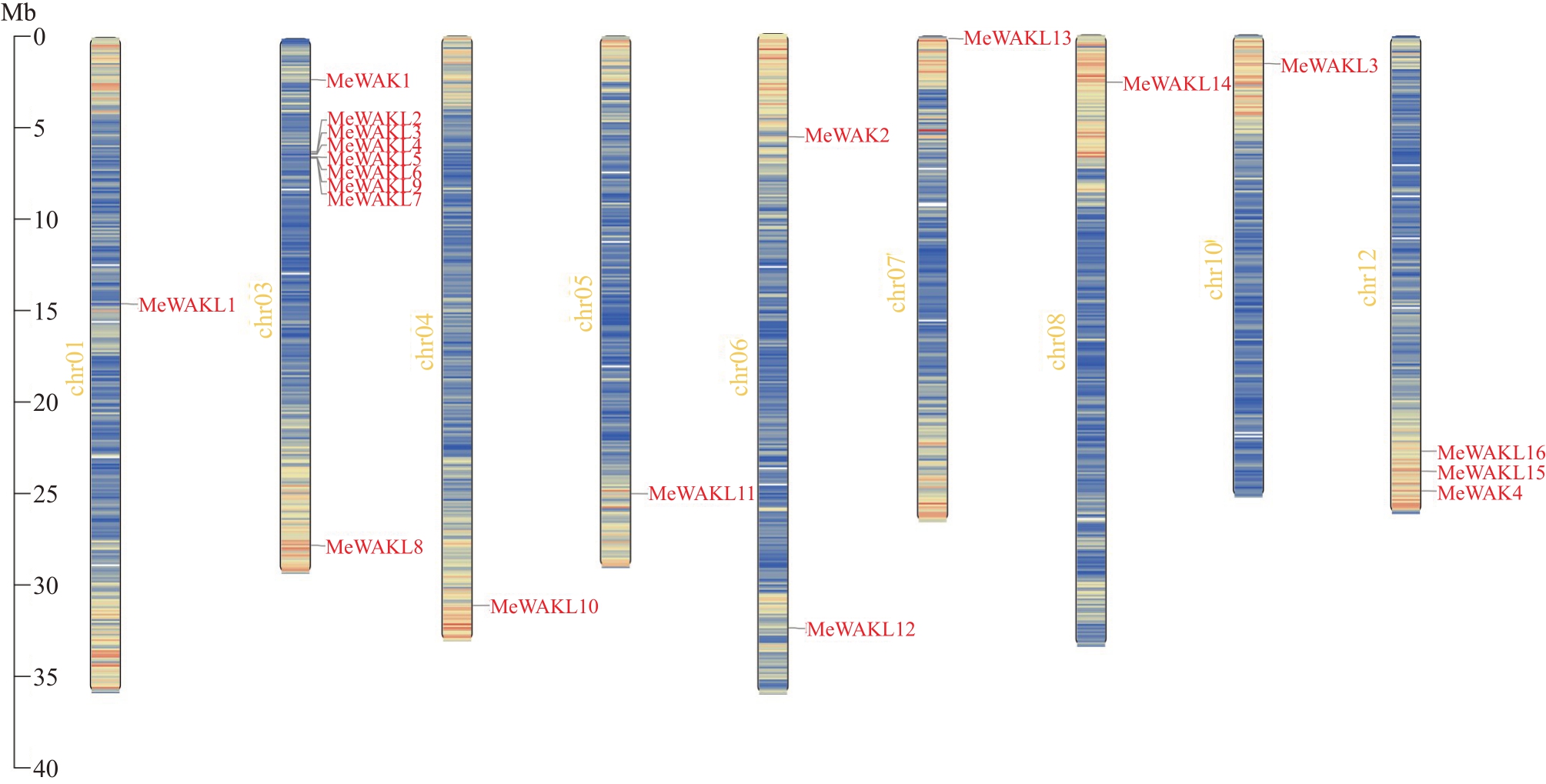
图1 甜瓜MeWAK/WAKL 家族基因的染色体定位
Fig.1 Chromosomal localization of MeWAK/WAKL genes
2.3 甜瓜MeWAK/WAKL 家族成员多序列比对与系统进化树构建
为确定甜瓜MeWAK/WAKL 家族成员之间的进化关系,根据其他模式植物中的同源基因进一步推断其可能的功能。将烟草中的38 个NbWAK/WAKL基因、拟南芥中的26 个AtWAK/WAKL 基因、番茄中的29 个SlWAK/WAKL 基因和甜瓜MeWAK/WAKL 家族基因一起进行系统进化分析,发现113 个基因可分为6 个亚族(图2,表3)。亚族Ⅰ由7 个甜瓜Me-WAKL构成;亚族Ⅱ有17个基因,包含1个MeWAKL基因(MeWAKL13)、9 个NbWAK/WAKL 基因和7 个SlWAK基因;亚族Ⅲ最小,只有2个基因(NbWAKL16和SlWAK8);亚族Ⅳ包含5个AtWAK基因;亚族Ⅴ有18 个基因,包含2 个NbWAK/WAKL 基因(NbWAK11和NbWAKL21)、2 个SlWAK 基因(SlWAK1 和Sl-WAK2)和14 个AtWAK/WAKL 基因;亚群Ⅵ最大,有64 个基因,包含26 个NbWAK/WAKL 基因、19 个Sl-WAK/WAKL基因、7个AtWAKL基因和12个MeWAK/WAKL 基因。甜瓜MeWAK/WAKL 家族基因主要分布在亚族Ⅰ和Ⅵ中,烟草NbWAK/WAKL基因主要分布在亚族Ⅱ和Ⅵ中,拟南芥AtWAK/WAKL 基因主要分布在亚族Ⅳ、Ⅴ和Ⅵ中,番茄SlWAK/WAKL基因主要分布在亚族Ⅱ、Ⅵ中。

图2 甜瓜与本氏烟草、拟南芥、番茄WAK/WAKL 基因家族成员的系统进化树分析
Fig.2 Phylogenetic tree analysis of WAK/WAKLgene family members in melon,N.benthamiana,A.thaliana and S.lycopersicum
Nb.本氏烟草;At.拟南芥;Sl.番茄。
Nb.Nicotiana benthamiana;At.Arabidopsis thaliana;Sl.番茄Solanum lycopersicum.
表3 本氏烟草、拟南芥、番茄WAK/WAKL 家族基因名称
Table 3 The gene name of WAK/WAKL family in N.benthamiana,A.thaliana and S.lycopersicum

?
2.4 甜瓜MeWAK/WAKL 家族成员基因结构和结构域分析
为获得更多关于甜瓜MeWAK/WAKL 基因结构多样性信息,对家族基因的外显子-内含子组成以及基因保守结构域进行分析。甜瓜MeWAK/WAKL 家族基因含有1~7 个外显子(图3)。MeWAKL1 含有7个外显子,而MeWAKL7、MeWAKL11 和MeWAKL12只有1 个外显子。结构域分析结果显示,20 个家族基因中有17 个都含有GUB-WAK-bind(wall-associated receptor kinase galacturonan-binding)结构域,有7 个基因同时包含GUB-WAK-bind(wall-associated receptor kinase galacturonan-binding)结构域、EGF(epidermal growth factor)和丝氨酸苏氨酸激酶结构域,有7 个基因只含有GUB-WAK-bind 结构域,有2个基因只含有EGF结构域和激酶结构域(图4)。
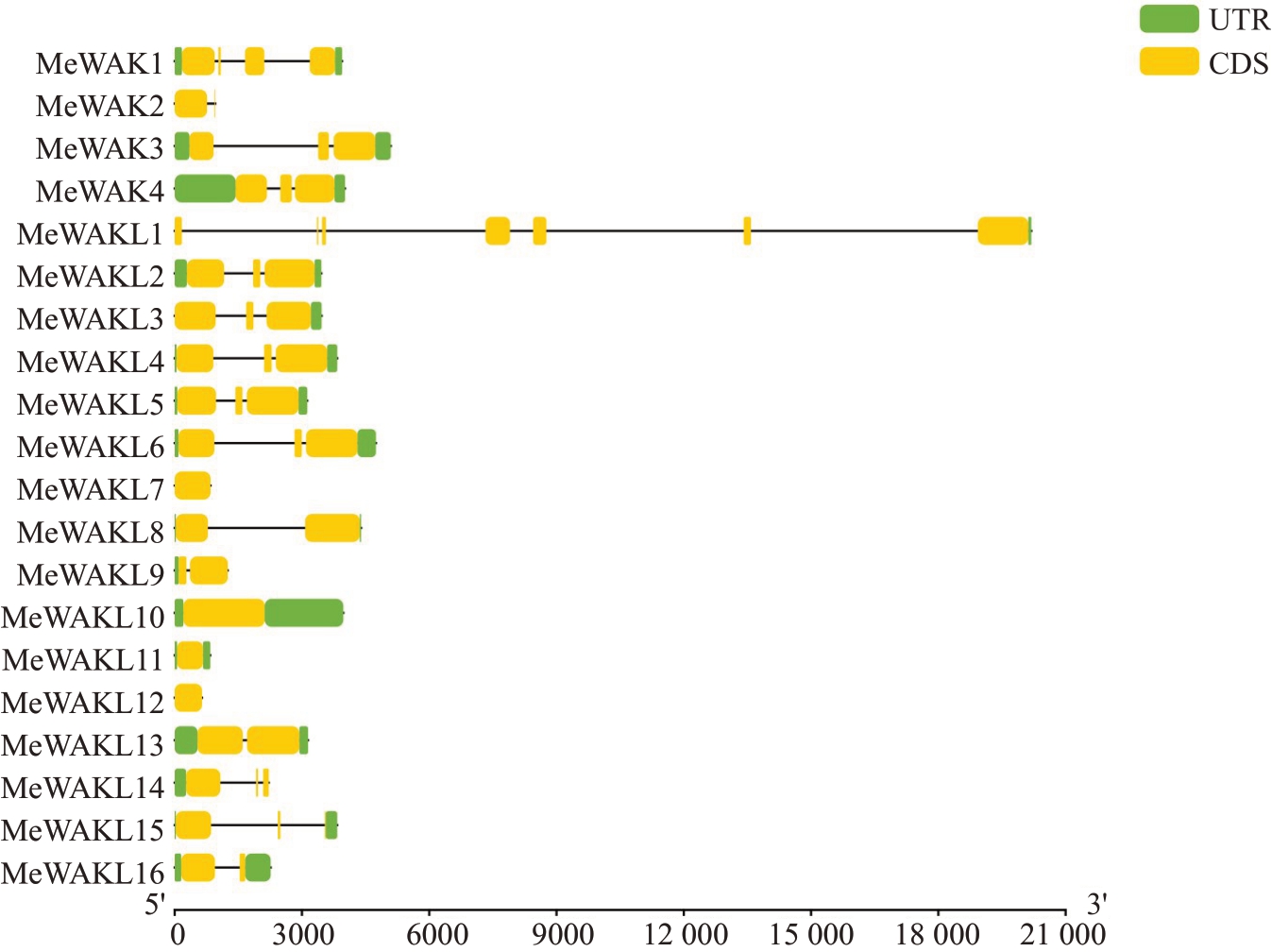
图3 甜瓜MeWAK/WAKL 家族成员基因和外显子-内含子结构
Fig.3 The exon-intron structures of MeWAK/WAKL family members
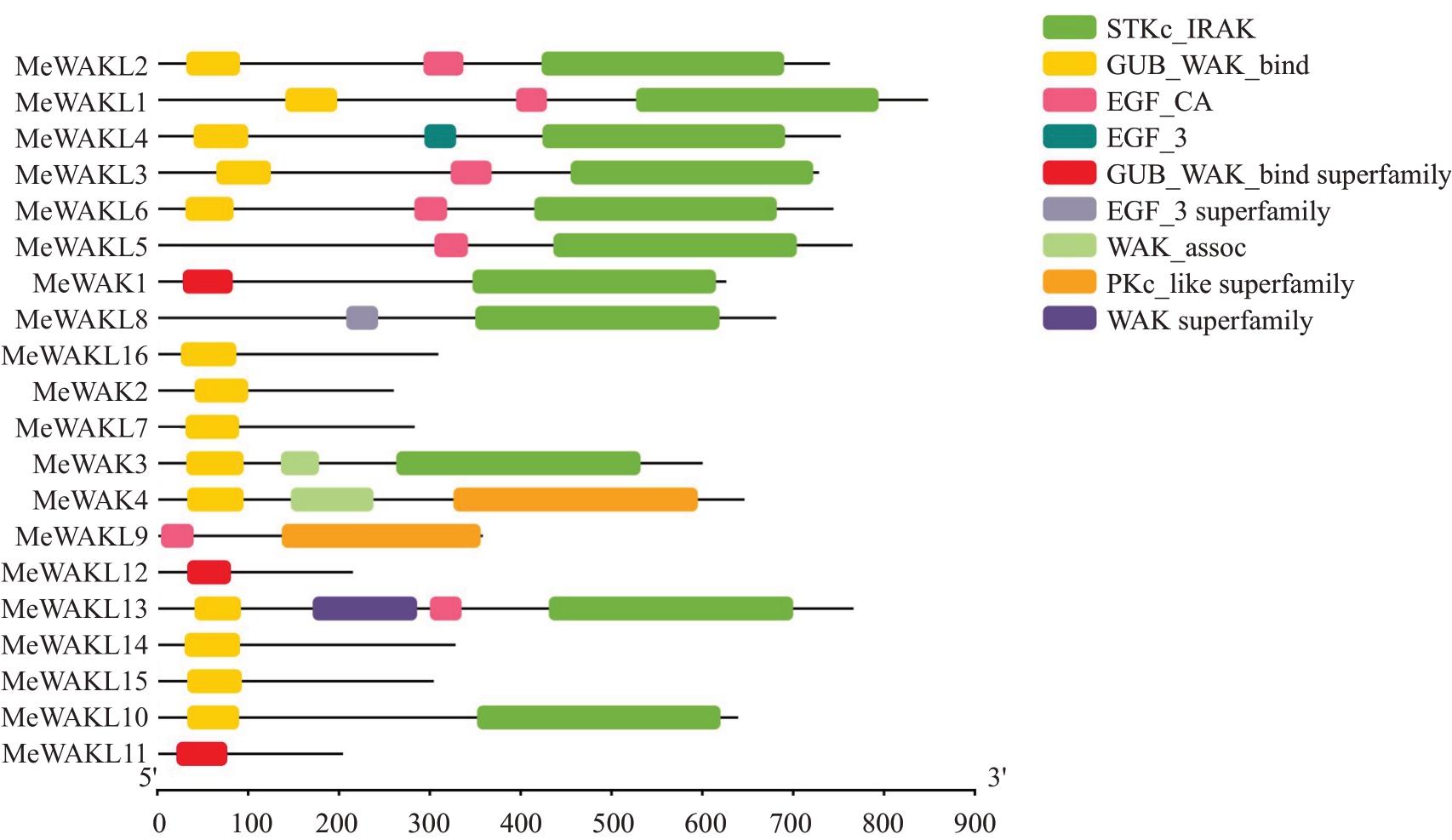
图4 甜瓜MeWAK/WAKL 家族成员保守结构域
Fig.4 The conserved motifs of MeWAK/WAKL family members
2.5 甜瓜MeWAK/WAKL家族成员启动子顺式作用元件分析
为探索甜瓜MeWAK/WAKL 家族基因的潜在功能和调控模式,使用PlantCARE 数据库分析了基因2000 bp启动子序列中的顺式作用元件(图5)。结果显示,与光反应相关的元件(LRE)最多,表明甜瓜MeWAK/WAKL家族基因可能在光合作用或与光照胁迫相关反应中发挥重要作用。同时,茉莉酸(Me-JARE)、水杨酸(SARE)、生长素(AuxRE)、脱落酸(ABRE)、赤霉素(GARE)响应元件也分布较多,表明甜瓜MeWAK/WAKL 家族基因与多个激素信号紧密相关。在多个基因启动子中分布有干旱诱导响应元件(DRE)、抗性和胁迫响应元件(DSRE)、分生组织表达响应元件(MEE),这表明甜瓜MeWAK/WAKL家族基因在甜瓜抗病、抗逆及生长发育方面发挥重要作用。
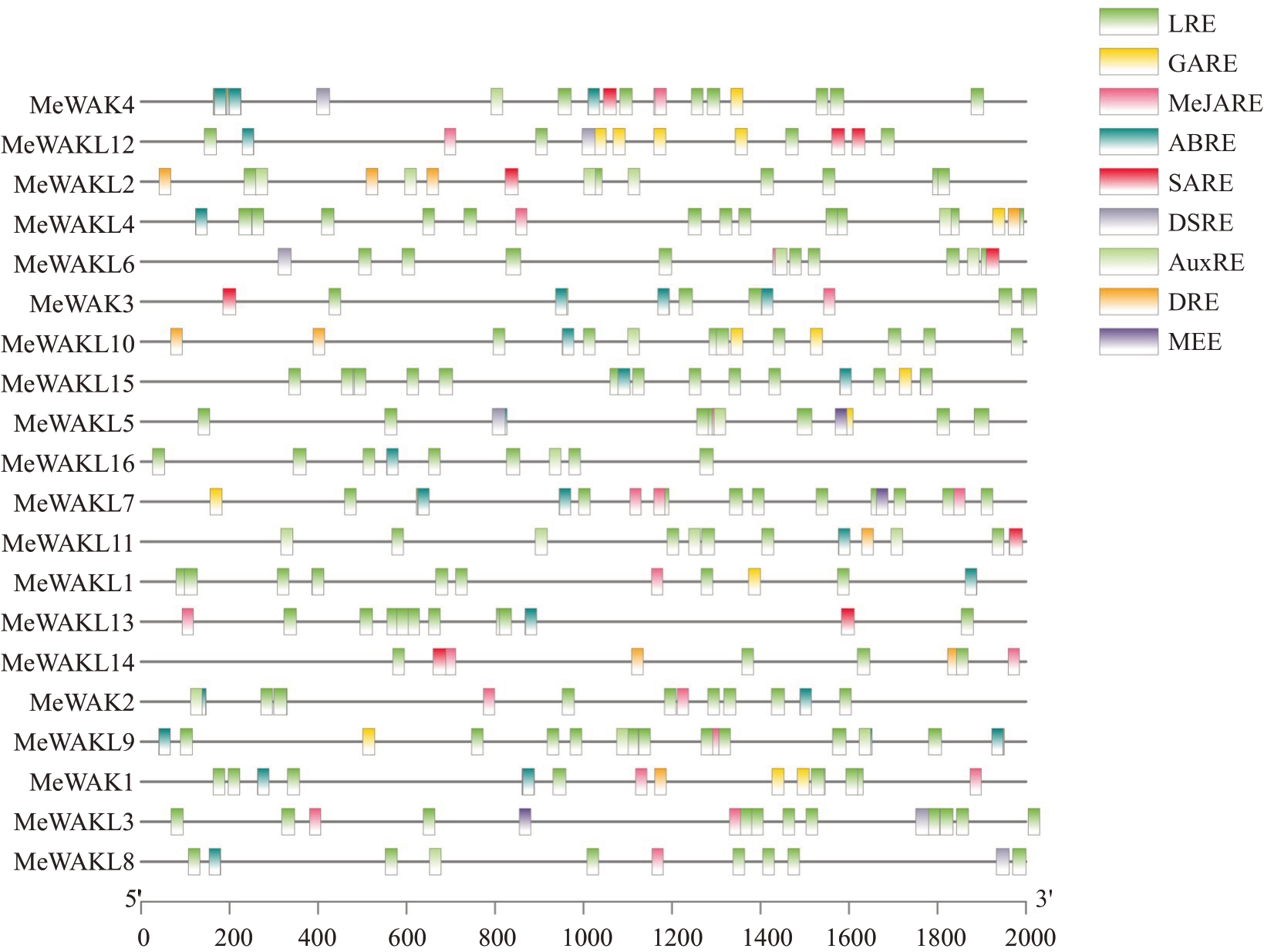
图5 甜瓜MeWAK/WAKL 家族成员启动子顺式作用元件
Fig.5 Cis-elements of MeWAK/WAKL gene family promoters
LRE.光响应元件;GARE.赤霉素响应元件;MeJARE.茉莉酸响应元件;ABRE.脱落酸响应元件;SARE.水杨酸响应元件;DSRE.抗性和胁迫响应元件;AxuRE.生长素响应元件;DRE.干旱响应元件;MEE.分生组织表达响应元件。
LRE.Light response elements;GARE.Cis-acting element involved in Gibberellin response elements;MeJARE.MeJA response elements;ABRE.Abscisic acid response elements;SARE.Salicylic acid response elements;DSRE.Defense and stress responses elements;AxuRE.Auxin response elements;DRE.Droughtstress responses elements;MEE.Meristem expression elements.
2.6 甜瓜MeWAK/WAKL 基因家族成员在疫霉菌侵染过程中的表达分析
为探究甜瓜MeWAK/WAKL 基因家族对疫霉菌侵染的响应机制,利用RT-qPCR 分析了抗病材料ZQK9 和感病材料E31 在接种疫霉菌后0 h、24 h 和72 h 的表达模式,有14 个基因检测到表达量(图6)。MeWAKL4、MeWAKL16在抗病材料接菌后24 h上调表达,在72 h表达量有所下降,在感病材料接菌后表达量没有明显变化;MeWAK3 和MeWAKL6 在抗感材料中表达模式相似,都是在接菌后24 h 上调表达,在72 h 表达量有所下降;MeWAKL3、Me-WAKL10、MeWAKL11、MeWAKL14 和MeWAKL15 在抗感材料接菌后下调表达;MeWAKL12 在抗病材料接菌后表达量没有明显变化,在感病材料接菌后24 h表达量下降,在72 h 表达量上升;MeWAKL5 基因在抗病材料接菌后24 h 显著上调表达,之后表达量下降,但在感病材料中持续上调表达;MeWAK4在抗感材料接菌后24 h 无明显变化,但接菌后72 h 在抗病材料中表达量降低,在感病材料中表达量上升;Me-WAKL8在抗病材料接菌后24 h无明显变化,接菌后72 h 表达量下降,在感病材料接菌后24 h 表达量显著上升,接菌后72 h表达量下降;MeWAKL13在抗感材料接菌后表达量没有明显变化。结合上述表达模式分析,MeWAKL4 和MeWAKL16 在抗病材料接菌后特异性上调表达,而在感病材料接菌后表达量无显著差异,可能参与甜瓜对疫霉菌的抗性反应。

图6 甜瓜MeWAK/WAKL 家族在接种疫霉菌后的表达分析
Fig.6 Expression analysis of the MeWAK/WAKL gene family after P.capsici infection
*表示在P<0.05 差异显著,**表示在P<0.01 差异极显著。下同。
*indicate significant difference at P<0.05,**indicate significant difference at P<0.01.The same below.
3 讨 论
WAK/WAKL基因家族作为一类重要的类受体蛋白激酶,在植物生长发育、抗病、抗逆过程中起着至关重要的作用[19-21]。基于典型的GUB-WAK-bind结构域、WAK_assoc结构域和EGF结构域,在甜瓜基因组中共鉴定出20个WAK/WAKL家族基因,包括4个MeWAK基因和16个MeWAKL基因。WAK/WAKL家族基因的鉴定、进化、结构和功能在多种作物和植物中均有研究报道,如玫瑰[22](Rosa chinensis)有12个、拟南芥[23](Arabidopsis thaliana)有26个、棉花[24](Gossypium hirsutum)有29 个、马铃薯[25](Solanum tuberosum)有29 个、本氏烟草[26](Nicotiana benthamiana)有38 个、番茄[27](Solanum lycopersicum)有39个、谷子[28](Setaria italica)有41个、苹果[29](Malus domestica)有44 个、大麻[30](Cannabis sativa)有53 个、白菜[31](Brassica rapa ssp.pekinensis)有96个、杨树[32](Populus trichocarpa)有175 个、大麦[33](Hordeum vulgare L.)有320个该家族基因。然而,甜瓜中Me-WAK/WAKL 基因家族的结构特征、潜在的生物学功能和调控机制尚不清楚。对甜瓜MeWAK/WAKL 家族基因进行鉴定,利用前期筛选获得的高抗和高感疫病甜瓜种质资源,对该家族基因在疫霉菌侵染下的表达进行了全面分析[18],为进一步挖掘甜瓜Me-WAK/WAKL家族基因在抗疫病中的功能奠定基础。
WAK/WAKL 基因家族作为植物类受体蛋白激酶的重要成员,其结构域在抗病过程中通过多种机制协同发挥作用。GUB-WAK-bind 结构域和EGF结构域是WAK/WAKL 蛋白的典型特征,根据胞外域的不同,各WAK 蛋白可通过连接不同种类的配基促使植物对各种胞外信号产生相应的响应[34]。研究表明,WAK/WAKL 蛋白可通过位于细胞外的结构域识别细胞壁中的OGs、果胶和果胶片段成分,从而感知细胞壁结构变化的信号。通过对甜瓜Me-WAK/WAKL 家族基因进行亚细胞定位和跨膜结构预测,发现除MeWAK1 可能定位于叶绿体和Me-WAKL5可能在细胞质中分布外,其他基因都位于质膜或细胞外基质,说明甜瓜MeWAK/WAKL家族基因可能通过传递胞外信号,从而触发生长发育调控或在抗病抗逆反应中发挥重要作用。通过与模式植物拟南芥、本氏烟草和番茄中的WAK/WAKL家族基因进行系统进化树分析,发现甜瓜MeWAK/WAKL家族主要在亚族Ⅰ和Ⅵ中,其中亚族Ⅰ是由7 个Me-WAKL 基因(MeWAKL1、MeWAKL2、MeWAKL3、Me-WAKL4、MeWAKL5、MeWAKL6和MeWAKL9)独立构成,说明甜瓜MeWAK/WAKL 家族成员在进化过程中,可能受到强烈的自然选择(如极端环境等),存在快速进化的现象[29,35-36]。此外,染色体定位分析显示,在这7 个基因中有6 个(MeWAKL2、MeWAKL3、MeWAKL4、MeWAKL5、MeWAKL6 和MeWAKL9)成簇分布在3 号染色体,推测这些基因可能通过协同表达发挥作用。该现象可能导致功能冗余,但也可降低个体在强烈的外界压力下因染色体断裂等结构变异造成的负面影响,从而在进化中被保留[37-38]。
启动子顺式作用元件分析表明,在甜瓜Me-WAK/WAKL 家族基因启动子中存在很多响应不同激素和胁迫的元件。如茉莉酸(MeJA)、水杨酸(SA)、脱落酸(ABA)、生长素(Auxin)和赤霉素(GA)等激素响应元件,它们同样存在于棉花、核桃、烟草、马铃薯等作物的WAK/WAKL 家族基因启动子中,在调控玉米黑穗病抗性中也发挥重要作用[39]。表达模式分析表明,MeWAKL4 和Me-WAKL16 都是在抗病材料接种疫霉菌后24 h 和72 h特异性上调表达,而在感病材料接菌后表达量无显著差异。通过生物信息学分析发现,MeWAKL4 是一个跨膜蛋白,包含GUB-WAK-bind 结构域、WAK_assoc 结构域和激酶结构域,可能在识别病原菌侵染信号并将信号传递到胞内过程中发挥重要作用。MeWAKL16 蛋白只有一个GUB-WAK-bind结构域,该蛋白定位于质膜,具有跨膜结构。系统进化树分析显示,MeWAKL16 位于第Ⅵ亚族,该亚族中多个成员与抗病相关,其中NbWAKL12(Niben101Scf03939g06023)在烟草响应TYLCV 侵染中发挥重要作用,该基因沉默后会导致植株中病毒含量增加[26]。番茄SlWAKL2(Solyc02g090110)和拟南芥AtWAKL14(AT2G23450)的细胞外结构域能够结合多种形式的果胶,包括果胶寡半乳糖醛酸片段,在植株抵抗病原菌侵染时可能具有积极作用[40]。因此,MeWAKL16 可能在识别病原菌侵染信号中发挥作用,并通过与位于质膜上的其他激酶形成复合体,将信号传到细胞内。这种作用机制在玉米灰斑病抗性通路中已有报道[41],具体调控机制还需进一步试验验证。
4 结 论
笔者共鉴定了20 个MeWAK/WAKL 家族基因,不均匀分布于9条染色体上,其中有7个家族成员成簇分布在3 号染色体上;启动子顺式作用元件分析发现存在很多激素响应元件和胁迫响应元件。在疫霉菌侵染的胁迫过程中,MeWAKL4 和MeWAKL16在抗病材料接种疫霉菌后特异性上调表达,可能参与甜瓜抗疫病信号途径。
[1] 严霞,牛晓磊,陶均.病原菌诱发的植物先天免疫研究进展[J].分子植物育种,2018,16(3):821-831.YAN Xia,NIU Xiaolei,TAO Jun. Research advances on pathogen-induced plant innate immunity[J]. Molecular Plant Breeding,2018,16(3):821-831.
[2] CHINCHILLA D,BOLLER T. Innate immunity:Pattern recognition in plants[M]. MARTIN F,KAMOUN S. Effectors in plant-microbe interactions.Heidelberg:Springer,2011:1-32.
[3] 张蕊,李来庚.植物细胞壁信号研究进展[J].植物生理学报,2018,54(8):1254-1262.ZHANG Rui,LI Laigeng.Research progress of the plant cell wall signaling[J].Plant Physiology Journal,2018,54(8):1254-1262.
[4] HURNI S,SCHEUERMANN D,KRATTINGER S G,KESSEL B,WICKER T,HERREN G,FITZE M N,BREEN J,PRESTERL T,OUZUNOVA M,KELLER B. The maize disease resistance gene Htn1 against northern corn leaf blight encodes a wall-associated receptor-like kinase[J]. Proceedings of the National Academy of Sciences of the United States of America,2015,112(28):8780-8785.
[5] HU K M,CAO J B,ZHANG J,XIA F,KE Y G,ZHANG H T,XIE W Y,LIU H B,CUI Y,CAO Y L,SUN X L,XIAO J H,LI X H,ZHANG Q L,WANG S P. Improvement of multiple agronomic traits by a disease resistance gene via cell wall reinforcement[J].Nature Plants,2017,3:17009.
[6] LI H,ZHOU S Y,ZHAO W S,SU S C,PENG Y L. A novel wall-associated receptor-like protein kinase gene,OsWAK1,plays important roles in rice blast disease resistance[J]. Plant Molecular Biology,2009,69(3):337-346.
[7] SAINTENAC C,LEE W S,CAMBON F,RUDD J J,KING R C,MARANDE W,POWERS S J,BERGÈS H,PHILLIPS A L,UAUY C,HAMMOND-KOSACK K E,LANGIN T,KANYUKA K. Wheat receptor-kinase-like protein Stb6 controls genefor-gene resistance to fungal pathogen Zymoseptoria tritici[J].Nature Genetics,2018,50(3):368-374.
[8] FENG H J,LI C,ZHOU J L,YUAN Y,FENG Z L,SHI Y Q,ZHAO L H,ZHANG Y L,WEI F,ZHU H Q.A cotton WAKL protein interacted with a DnaJ protein and was involved in defense against Verticillium dahliae[J]. International Journal of Biological Macromolecules,2021,167:633-643.
[9] LI Q,HU A H,QI J J,DOU W F,QIN X J,ZOU X P,XU L Z,CHEN S C,HE Y R. CsWAKL08,a pathogen-induced wall-associated receptor-like kinase in sweet orange,confers resistance to citrus bacterial canker via ROS control and JA signaling[J].Horticulture Research,2020,7:42.
[10] ZHANG B,SU T B,XIN X Y,LI P R,WANG J,WANG W H,YU Y J,ZHAO X Y,ZHANG D S,LI D Y,ZHANG F L,YU S C.Wall-associated kinase BrWAK1 confers resistance to downy mildew in Brassica rapa[J].Plant Biotechnology Journal,2023,21(10):2125-2139.
[11] LAMOUR K H,STAM R,JUPE J,HUITEMA E.The oomycete broad-host-range pathogen Phytophthora capsici[J]. Molecular Plant Pathology,2012,13(4):329-337.
[12] 谢大森,赵芹,何晓明,彭庆务.瓜类疫病研究进展[J].热带作物学报,2010,31(3):503-507.XIE Dasen,ZHAO Qin,HE Xiaoming,PENG Qingwu. Research progress on Phytophthora blight wilt attacking cucurbits and its control strategy[J]. Chinese Journal of Tropical Crops,2010,31(3):503-507.
[13] 赵廷昌,宋凤鸣,古勤生,张友军.我国西瓜甜瓜病虫害防控现状、存在问题与发展趋势[J].中国瓜菜,2014,27(6):1-5.ZHAO Tingchang,SONG Fengming,GU Qinsheng,ZHANG Youjun. Status,challenges and trend of watermelon and melon disease and insect control in China[J].China Cucurbits and Vegetables,2014,27(6):1-5.
[14] 谢大森,何晓明,彭庆务.瓜类疫病病原物研究进展[J].农业科技通讯,2009(3):73-75.XIE Dasen,HE Xiaoming,PENG Qingwu. Research advances in pathogens of cucurbit Phytophthora blight[J]. Bulletin of Agricultural Science and Technology,2009(3):73-75.
[15] PADLEY L D,KABELKA E A,ROBERTS P D. Inheritance of resistance to crown rot caused by Phytophthora capsici in Cucurbita[J].HortScience,2009,44(1):211-213.
[16] KIM M J,SHIM C K,KIM Y K,JEE H J,HONG S J,PARK J H,LEE M H,HAN E J. Screening of resistance melon germplasm to Phytophthora rot caused by Phytophthora capsici[J].Korean Journal of Crop Science,2012,57(4):389-396.
[17] DONAHOO R S,TURECHEK W W,THIES J A,KOUSIK C S. Potential sources of resistance in U. S. Cucumis melo PIs to crown rot caused by Phytophthora capsici[J].HortScience,2013,48(2):164-170.
[18] 王平勇,赵光伟,孔维虎,贺玉花,欧点点,张健,徐永阳,徐志红,刘璐璐.甜瓜种质资源对疫病的抗性鉴定研究[J].中国农学通报,2018,34(20):144-150.WANG Pingyong,ZHAO Guangwei,KONG Weihu,HE Yuhua,OU Diandian,ZHANG Jian,XU Yongyang,XU Zhihong,LIU Lulu.Resistance identification of melon germplasms to Phytophthora rot[J]. Chinese Agricultural Science Bulletin,2018,34(20):144-150.
[19] KOHORN B D. Cell wall-associated kinases and pectin perception[J].Journal of Experimental Botany,2016,67(2):489-494.
[20] AMSBURY S.Sensing attack:The role of wall-associated kinases in plant pathogen responses[J]. Plant Physiology,2020,183(4):1420-1421.
[21] STEPHENS C,HAMMOND-KOSACK K E,KANYUKA K.WAKsing plant immunity,waning diseases[J].Journal of Experimental Botany,2022,73(1):22-37.
[22] LIU X T,WANG Z C,TIAN Y,ZHANG S Y,LI D D,DONG W Q,ZHANG C Q,ZHANG Z.Characterization of wall-associated kinase/wall-associated kinase-like(WAK/WAKL)family in rose(Rosa chinensis)reveals the role of RcWAK4 in Botrytis resistance[J].BMC Plant Biology,2021,21(1):526.
[23] VERICA J A,HE Z H. The cell wall-associated kinase (WAK)and WAK-like kinase gene family[J]. Plant Physiology,2002,129(2):455-459.
[24] DOU L L,LI Z F,SHEN Q,SHI H R,LI H Z,WANG W B,ZOU C S,SHANG H H,LI H B,XIAO G H. Genome-wide characterization of the WAK gene family and expression analysis under plant hormone treatment in cotton[J].BMC Genomics,2021,22(1):85.
[25] YU H F,ZHANG W N,KANG Y C,FAN Y L,YANG X Y,SHI M F,ZHANG R Y,WANG Y,QIN S H. Genome-wide identification and expression analysis of wall-associated kinase(WAK) gene family in potato (Solanum tuberosum L.)[J]. Plant Biotechnology Reports,2022,16(3):317-331.
[26] ZHONG X T,LI J P,YANG L L,WU X Y,XU H,HU T,WANG Y J,WANG Y Q,WANG Z Q.Genome-wide identification and expression analysis of wall-associated kinase (WAK)and WAK-like kinase gene family in response to tomato yellow leaf curl virus infection in Nicotiana benthamiana[J].BMC Plant Biology,2023,23(1):146.
[27] SUN Z Y,SONG Y P,CHEN D,ZANG Y D,ZHANG Q L,YI Y T,QU G Q. Genome-wide identification,classification,characterization,and expression analysis of the wall-associated kinase family during fruit development and under wound stress in tomato(Solanum lycopersicum L.)[J].Genes,2020,11(10):1186.
[28] 王雪,孙玉荣,张诺,李忠祥,任志贤,张宝俊.谷子WAK 基因家族全基因组鉴定及表达分析[J]. 山西农业科学,2023,51(10):1153-1161.WANG Xue,SUN Yurong,ZHANG Nuo,LI Zhongxiang,REN Zhixian,ZHANG Baojun. Whole genome identification and expression analysis of WAK gene family in foxtail millet[J]. Journal of Shanxi Agricultural Sciences,2023,51(10):1153-1161.
[29] ZUO C W,LIU Y L,GUO Z G,MAO J,CHU M Y,CHEN B H. Genome-wide annotation and expression responses to biotic stresses of the wall-associated kinase-receptor-like kinase(WAKRLK)gene family in apple(Malus domestica)[J].European Journal of Plant Pathology,2019,153(3):771-785.
[30] SIPAHI H,WHYTE T D,MA G,BERKOWITZ G. Genomewide identification and expression analysis of wall-associated kinase(WAK)gene family in Cannabis sativa L.[J].Plants,2022,11(20):2703.
[31] ZHANG B,LI P,SU T B,LI P R,XIN X Y,WANG W H,ZHAO X Y,YU Y J,ZHANG D S,YU S C,ZHANG F L.Comprehensive analysis of wall-associated kinase genes and their expression under abiotic and biotic stress in Chinese cabbage(Brassica rapa ssp.pekinensis)[J].Journal of Plant Growth Regulation,2020,39(1):72-86.
[32] TOCQUARD K,LAFON-PLACETTE C,AUGUIN D,MURIES B,BRONNER G,LOPEZ D,FUMANAL B,FRANCHEL J,BOURGERIE S,MAURY S,LABEL P,JULIEN J L,ROECKEL-DREVET P,VENISSE J S. In silico study of wall-associated kinase family reveals large-scale genomic expansion potentially connected with functional diversification in Populus[J]. Tree Genetics & Genomes,2014,10(5):1135-1147.
[33] TRIPATHI R K,AGUIRRE J A,SINGH J.Genome-wide analysis of wall associated kinase (WAK) gene family in barley[J].Genomics,2021,113(1):523-530.
[34] 王宏蕾.GbWAK3 在棉花抗黄萎病中的功能研究[D].武汉:华中农业大学,2017.WANG Honglei. Functional analysis of GbWAK3 in cotton responsive to Verticillium dahliae[D]. Wuhan:Huazhong Agricultural University,2017.
[35] LAGERCRANTZ U,AXELSSON T. Rapid evolution of the family of CONSTANS LIKE genes in Plants[J].Molecular Biology and Evolution,2000,17(10):1499-1507.
[36] ALBA R,KELMENSON P M,CORDONNIER-PRATT M M,PRATT L H. The phytochrome gene family in tomato and the rapid differential evolution of this family in angiosperms[J].Molecular Biology and Evolution,2000,17(3):362-373.
[37] POLTURAK G,OSBOURN A.The emerging role of biosynthetic gene clusters in plant defense and plant interactions[J]. PLoS Pathogens,2021,17(7):e1009698.
[38] 刘祖洞,乔守怡,吴燕华,赵寿元.遗传学[M].3 版.北京:高等教育出版社,2013.LIU Zudong,QIAO Shouyi,WU Yanhua,ZHAO Shouyuan.Genetics[M].3rd ed.Beijing:Higher Education Press,2013.
[39] ZUO W L,CHAO Q,ZHANG N,YE J R,TAN G Q,LI B L,XING Y X,ZHANG B Q,LIU H J,FENGLER K A,ZHAO J,ZHAO X R,CHEN Y S,LAI J S,YAN J B,XU M L.A maize wall-associated kinase confers quantitative resistance to head smut[J].Nature Genetics,2015,47(2):151-157.
[40] MA Y X,WANG Z H,HUMPHRIES J,RATCLIFFE J,BACIC A,JOHNSON K L,QU G Q. WALL-ASSOCIATED KINASE Like 14 regulates vascular tissue development in Arabidopsis and tomato[J].Plant Science,2024,341:112013.
[41] ZHONG T,ZHU M,ZHANG Q Q,ZHANG Y,DENG S N,GUO C Y,XU L,LIU T T,LI Y C,BI Y Q,FAN X M,BALINTKURTI P,XU M L. The ZmWAKL-ZmWIK-ZmBLK1-ZmRBOH4 module provides quantitative resistance to gray leaf spot in maize[J].Nature Genetics,2024,56(2):315-326.