苹果(Malus×domestica)在世界各地广泛种植,是消费者日常生活中最常见的水果之一。中国拥有大量可挖掘利用的苹果种质资源[1],广泛分布于中国新疆、陕西、山东等地。果实品质是苹果种质资源可挖掘利用的重要方面,对选育风味优良和功能性的品种具有重要意义[2]。苹果的果实品质包括外在品质和内在品质,外在品质主要与果实大小、果实着色和果面光洁度等有关;果实的内在品质与糖、酸和香气物质的含量有关[3],苹果果实中的可溶性糖主要有果糖、蔗糖、葡萄糖和山梨醇等[4],其中果糖和蔗糖是苹果中含量最多的可溶性糖,不同苹果品种果实的可溶性糖含量有所差异。可溶性糖不仅作为营养物质,也可作为信号分子调控植物的生长发育[5-6]。苹果酸是苹果中最主要的有机酸,约占总有机酸含量的90%[7-8]。苹果酸主要由苹果酸脱氢酶(MDH)从细胞质中的草酰乙酸(OAA)合成,并通过MDH 和NADP-ME 降解为OAA 和丙酮酸[9]。在苹果果实成熟过程中,苹果酸的含量会逐渐降低。苹果中的香气物质成分主要有酯类、醛类、醇类、酸类、酮类和萜烯类,其中酯类是苹果中最丰富的化合物。
酚类物质因具有较强的抗氧化能力受到人们广泛关注[10],苹果中含有大量的酚类物质[11],是苹果的主要营养成分。类黄酮和酚酸是苹果果实中最主要的酚类物质[12]。不同品种和组织中的酚类物质含量及种类不同[13-14],酚类物质在果皮中的含量要高于果肉[14],与白肉苹果相比,红肉苹果的酚类物质含量更丰富[15]。酚类物质具有较强的抗氧化能力,并在预防心血管疾病、癌症等疾病方面有积极作用[16-17]。酚类物质的抗氧化能力与其自由基清除能力有关[18],可以利用DPPH自由基清除能力和ABTS自由基清除能力测定。
笔者在本研究中以西北农林科技大学延安市洛川苹果试验站种质资源圃挖掘到的8份苹果特异种质资源为试验材料,经田间观察表明,8 份材料中P5、L51、C31果实在无袋条件下果面光洁度高,L37果实香味浓郁,LC36 和LC54 红肉表型特异,ZN18果实具有较强的抗褐化能力,对其果实外观、风味、抗氧化能力等品质性状进行全面分析和评价,以期为特异种质资源的生产和育种应用提供参考。研究结果有助于了解不同苹果种质资源果实性状、品质及风味的区别,为苹果种质资源的利用奠定基础。
1 材料和方法
1.1 试验材料
供试8份苹果种质资源P5(Malus asiatica)、L51(M. robusta)、L37(M. hybrid‘DwarfTree’)、LC36(M. hybrid‘Cranberry’)、L7(M. soulardii)、LC54(M.domestica‘Oekonomierat Echter-meyer’)、ZN18(M.domestica,Sciros×Scifresh)和C31(M.domestica‘Trail’)均定植于西北农林科技大学延安市洛川苹果试验站种质资源圃,栽培密度2 m×4 m。
1.2 试验方法
于2021年,采集成熟的果实带回西北农林科技大学果树逆境生物实验室,测定果实单果质量、纵横径、色差、可溶性固形物含量、可滴定酸含量,剩余果实切碎用液氮速冻后储存于-80 ℃冰箱,用于可溶性糖含量等的测定。
1.2.1 果实外观品质的测定 利用AL204 电子分析天平(梅特勒-托利多仪器上海有限公司)测量果实的单果质量,利用MNT-150T游标卡尺(上海美耐特实业有限公司)测量果实纵径和横径,纵径/横径为果形指数,利用CR-400 色差仪(KONICA MINOLTA 公司)测定色差指数L*值(亮度)、a*值(红绿值)和b*值(黄蓝值),每个果实沿赤道方向不同位置测定5 个点,取平均值。并计算色彩纯度C 和综合颜色值H°。
1.2.2 可溶性固形物和可滴定酸含量的测定 利用手持式ATAGO PAL-BXIACID5 糖酸一体机测定可溶性固形物含量,利用酸碱滴定法测定果实的可滴定酸含量[19],计算果实的固酸比,固酸比为可溶性固形物含量与可滴定酸含量的比值。每个苹果种质资源设置3次生物学重复。
1.2.3 可溶性糖及苹果酸含量的测定 参考Wang等[20]的方法,称取0.1 g 冻样,加入1.4 mL 75%甲醇并涡旋10 s,再加入100 μL 核糖醇,混匀后金属浴(70 ℃、950 r·min-1)30 min,11 000 g离心10 min,将上清液转移至10 mL离心管中,加入750 μL氯仿,再加入1400 μL 纯净水,混匀后2000 g 离心15 min,取5 μL上清液于1.5 mL离心管中,抽真空干燥30 min,加入40 μL 5 mg·mL-1 甲氧基胺盐酸盐,金属浴(37 ℃、950 r·min-1)2 h,再加入60 μL 衍生剂MSTFA(N-methyl-N-trimethylsilyl-trifluoroacetamide),金属浴(37 ℃、300 r·min-1)30 min,最后转移至棕色进样瓶,使用TSQ 9000 三重四级杆GC-MS(Thermo Scientific,America)进行可溶性糖和苹果酸含量的测定。每个苹果种质资源设置3次生物学重复。
1.2.4 果实抗坏血酸含量、总类黄酮含量、总酚含量及抗氧化能力的测定 利用相应试剂盒(苏州科铭生物技术有限公司)测定各苹果种质资源果实的抗坏血酸、总类黄酮、总酚含量及抗氧化能力。每个苹果种质资源设置3次生物学重复。
1.2.5 酚类物质含量的测定 参考Jing等[21]的方法,称取100 mg样品于1.5 mL离心管中,加入1 mL提取液(甲醇、水、甲酸体积比25∶24∶1)后超声波(25 ℃,40 Hz,100 W)20 min,再振荡(25 ℃,150 r·min-1)20 min。样品在10 000 g 离心20 min,将上清液经0.22 μm 有机过滤器过滤并稀释5 倍后加入棕色进样瓶,用HPLC-MS 进行酚类物质含量的测定。每个苹果种质资源设置3次生物学重复。
1.2.6 隶属函数的计算 利用各苹果种质资源测定指标的含量进行隶属函数的计算,以评价各苹果种质资源的果实品质。
隶属函数计算公式为:U(X)=(X-Xmin)/(Xmax-Xmin)
式中,U(X)为隶属函数值,X 指某一指标的大小,Xmax指某一指标的最大值,Xmin指某一指标的最小值。
1.3 数据统计分析
使用Excel 2016 对数据进行统计和绘图,使用SPSS 25 进行数据的显著性分析、聚类分析及主成分分析。
2 结果与分析
2.1 果实外观品质分析
从表1可以看出,各苹果种质资源的果实横径、纵径、果形指数和单果质量存在显著差异。在8 份苹果种质资源中,P5、L51、L37、LC36、LC54、C31 均为小型果,ZN18 和L7 为大型果。各苹果种质资源的单果质量为3.62~244.32 g,平均值为74.72 g,变异系数为124.87%。各苹果种质资源的果形指数范围为0.81~1.12,平均值为0.91,变异系数为11.63%,其中L37 和LC36 的果形指数高于平均值,LC36 的果形指数显著高于其他苹果种质资源。
表1 各苹果种质资源果实纵横径及单果质量
Table 1 Fruit vertical and horizontal and single fruit mass of apple germplasm resources
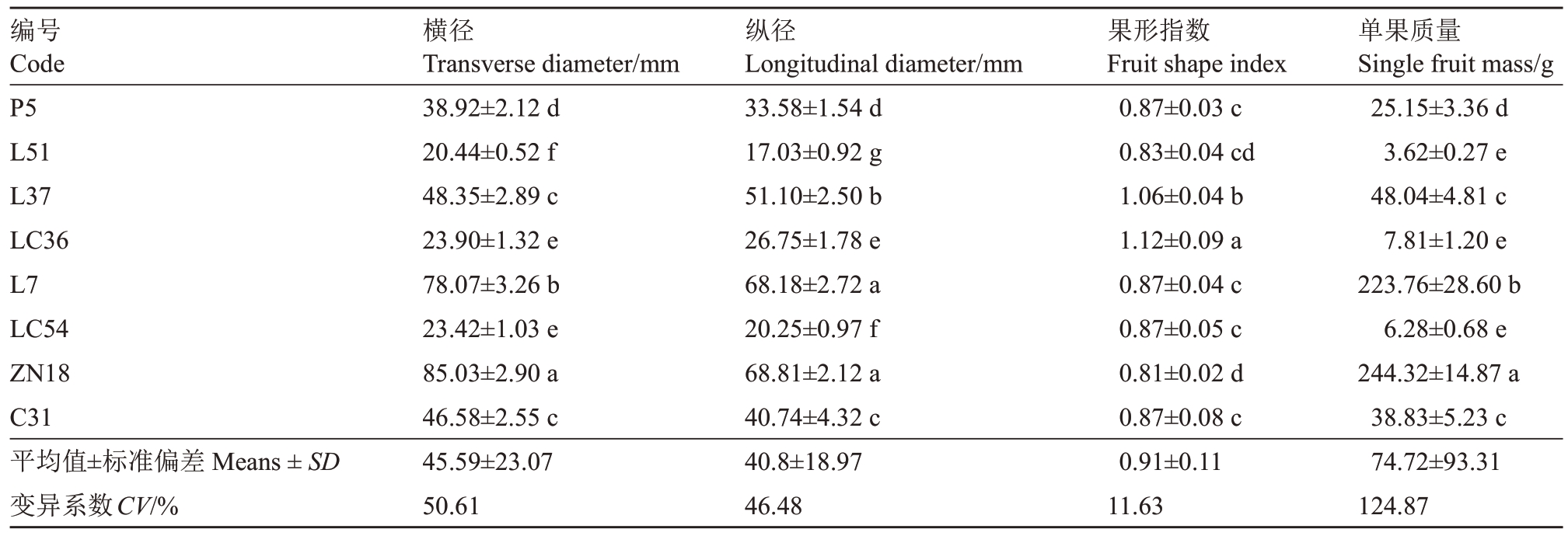
注:P5. Malus asiatica;L51. M. robusta;L37. M. hybrid‘DwarfTree’;LC36. M. hybrid‘Cranberry’;L7. M. soulardii;LC54. M. domestica‘Oekonomierat Echter-meyer’;ZN18.M.domestica(Sciros×Scifresh);C31.M.domestica‘Trail’。数据为平均值±标准差(n=3);不同字母表示各苹果种质资源间有显著差异(P<0.05)。下同。
Note:P5. Malus asiatica; L51. M. robusta; L37. M. hybrid‘DwarfTree’; LC36. M. hybrid‘Cranberry’; L7. M. soulardii; LC54. M. domestica‘Oekonomierat Echter-meyer’;ZN18.M.domestica(Sciros×Scifresh);C31.M.domestica‘Trail’.Data were presented as means±SD(n=3);Different letters indicated significant differences among apple germplasm resources(P<0.05).The same below.
?
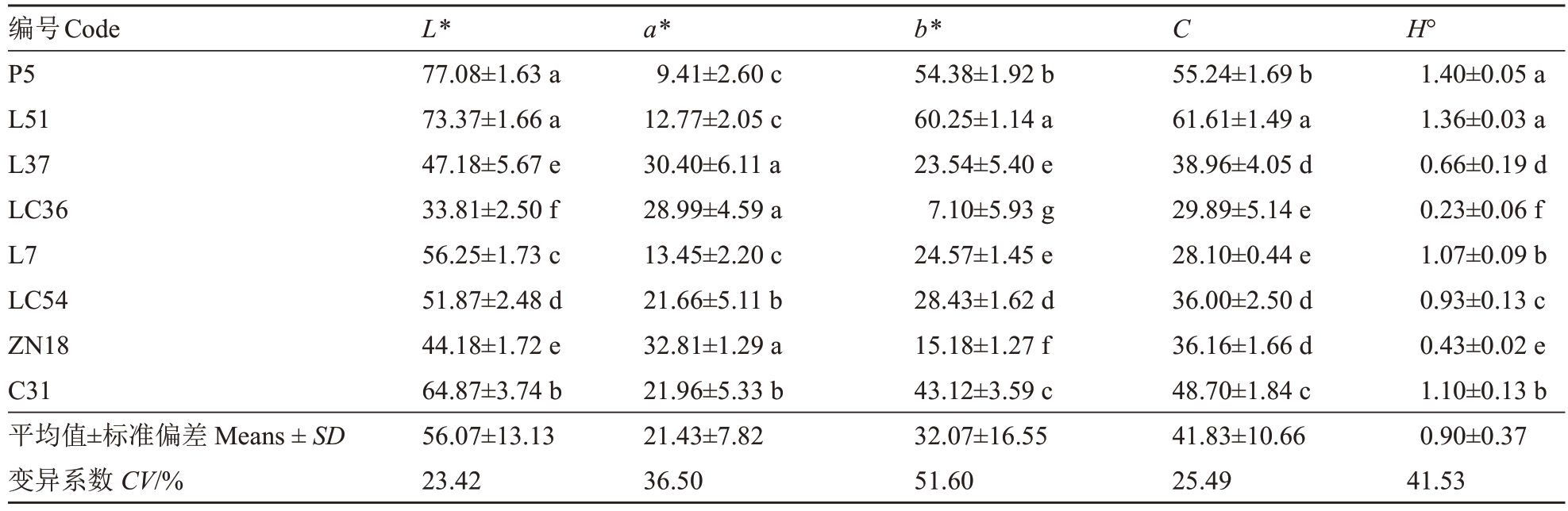
从图1和表2可以看出,各苹果种质资源的果皮颜色也有显著差异。P5 的果实为浅黄色且阳面有红晕,亮度高,蜡质中等,果粉少;L51的果实为深黄色,亮度较高,蜡质中等,果点小且疏;L37的果实为深红色,果粉多,蜡质多,果点小且疏;LC36 的果实为深红色,亮度低,果粉多,蜡质中等;L7 的果实为红色,果点中且密,无果粉,蜡质少;LC54 的果实为红色,果点小且疏,果粉少,蜡质多;ZN18 的果实为深红色,亮度较低,无果粉,蜡质多;C31的果实为红色,果点中,果点密度中,无果粉,蜡质少。

图1 各苹果种质资源果实
Fig.1 Fruits of apple germplasm resources
表2 各苹果种质资源果实色泽
Table 2 Fruit color of apple germplasm resources
?
2.2 果实可溶性固形物和可滴定酸含量分析
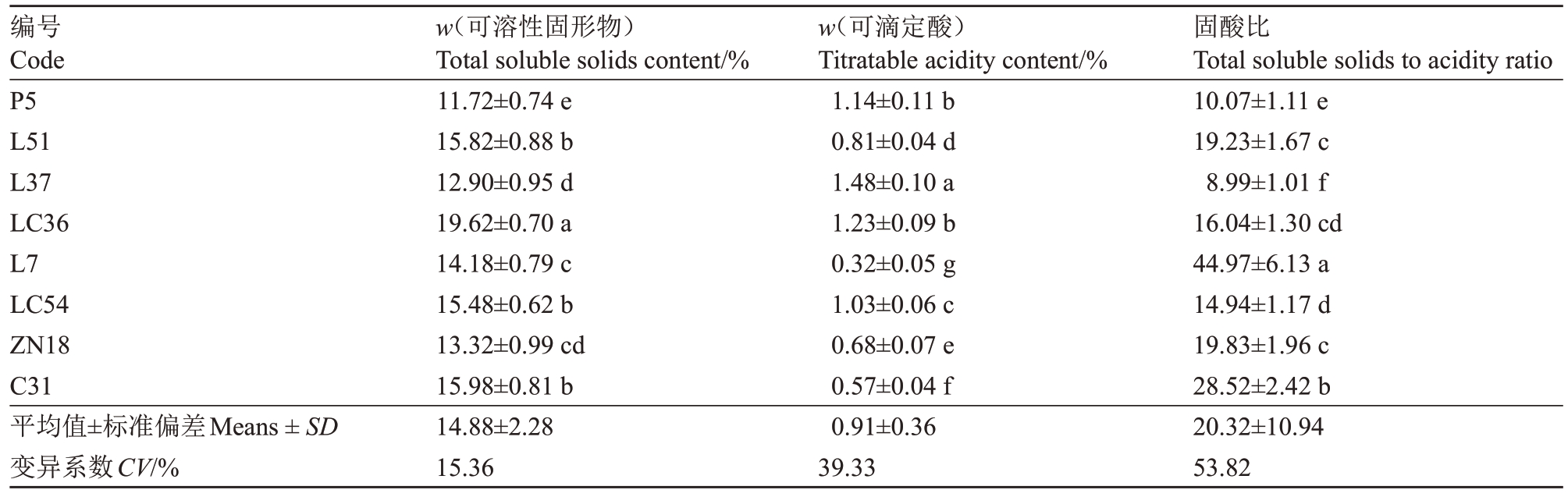
由表3 可知,不同苹果种质资源的可溶性固形物、可滴定酸含量和固酸比之间存在显著差异。在这些种质资源中,可溶性固形物的含量(w,后同)范围为11.72%~19.62%,平均值为14.88%,变异系数为15.36%,其中LC36 的可溶性固形物含量显著高于其他种质资源,P5、L37、L7、ZN18 的可溶性固形物含量低于平均水平。各苹果种质资源的可滴定酸含量范围为0.32%~1.48%,平均值为0.91%,变异系数为39.33%,其中L37 的可滴定酸含量显著高于其他种质资源,L7的可滴定酸含量最低,为0.32%。各苹果种质资源的固酸比范围为8.99~44.97,平均值为20.32,变异系数为53.82%,只有L7和C31的固酸比高于平均水平。
表3 各苹果种质资源果实可溶性固形物、可滴定酸含量及固酸比
Table 3 Soluble solids,titratable acid content and solid-acid ratio of apple germplasm resources fruit
?
2.3 可溶性糖及苹果酸含量分析
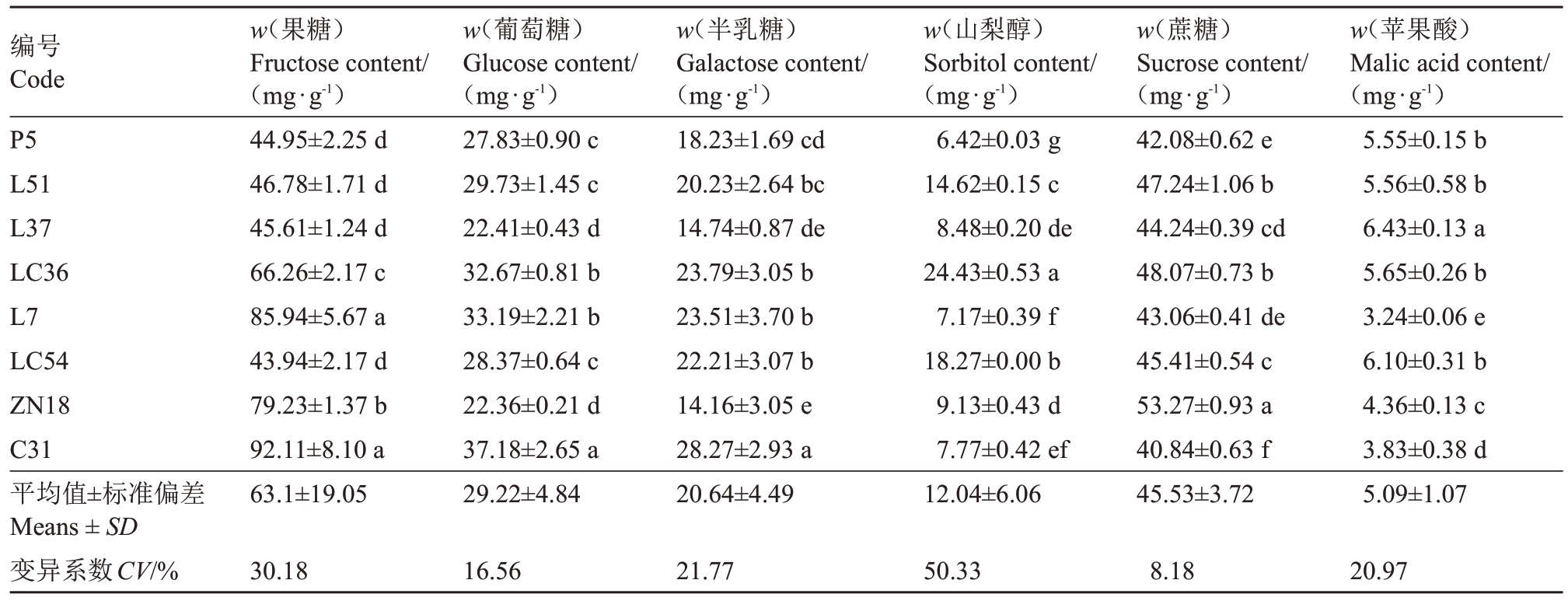
由表4 可知,各苹果种质资源可溶性糖及苹果酸含量存在显著差异。各苹果种质资源果糖的含量范围为43.94~92.11 mg·g-1,平均值为63.10 mg·g-1,变异系数为30.18%,其中C31和L7的果糖含量显著高于其他种质资源。各苹果种质资源葡萄糖的含量范围为22.36~37.18 mg·g-1,平均值为29.22 mg·g-1,变异系数为16.56%,其中C31的葡萄糖含量显著高于其他种质资源,P5、L37、LC54 和ZN18 的葡萄糖含量低于平均值。各苹果种质资源半乳糖的含量范围为14.16~28.27 mg·g-1,平均值为20.64 mg·g-1,变异系数为21.77%,C31 的半乳糖含量显著高于其他种质资源,其含量为28.27 mg·g-1。各苹果种质资源山梨醇的含量范围为6.42~24.43 mg·g-1,平均值为12.04 mg·g-1,变异系数为50.33%,其中LC36的山梨醇含量显著高于其他种质资源,L51、LC36 和LC54的山梨醇含量高于各苹果种质资源平均值。各苹果种质资源蔗糖的含量范围为40.84~53.27 mg·g-1,平均值为45.53 mg·g-1,变异系数8.18%,C31的蔗糖含量显著低于其他种质资源,L51、LC36、ZN18的蔗糖含量高于各苹果种质资源的平均值。各苹果种质资源苹果酸的含量范围为3.24~6.43 mg·g-1,平均值为5.09 mg·g-1,变异系数20.97%,其中L7 的苹果酸含量显著低于其他种质资源。
表4 各苹果种质资源可溶性糖及苹果酸的含量
Table 4 The content of soluble sugar and malic acid in apple germplasm resources
?
2.4 不同苹果种质资源果实的抗坏血酸含量、总类黄酮含量、总酚含量
由图2-A 可知,不同苹果种质资源果实的抗坏血酸含量具有显著差异。各苹果种质资源的抗坏血酸含量范围为0.18~0.81 mg·g-1(鲜质量,下同),平均值为0.44 mg·g-1,变异系数为52.46%,其中LC54和C31 的抗坏血酸含量显著高于其他种质资源,均为0.81 mg·g-1。由图2-B 可知,各苹果种质资源的总类黄酮含量有显著差异。各苹果种质资源的类黄酮含量范围为4.23~44.96 mg·g-1(干质量,下同),平均值为20.52 mg·g-1,变异系数为57.39%,其中L51的总类黄酮含量显著高于其他种质资源。由图2-C可知,各苹果种质资源的总酚含量有显著差异。各苹果种质资源的总酚含量范围为4.96~35.42 mg·g-1,平均值为18.22 mg·g-1,变异系数为53.76%,其中L51的总酚含量显著高于其他种质资源。
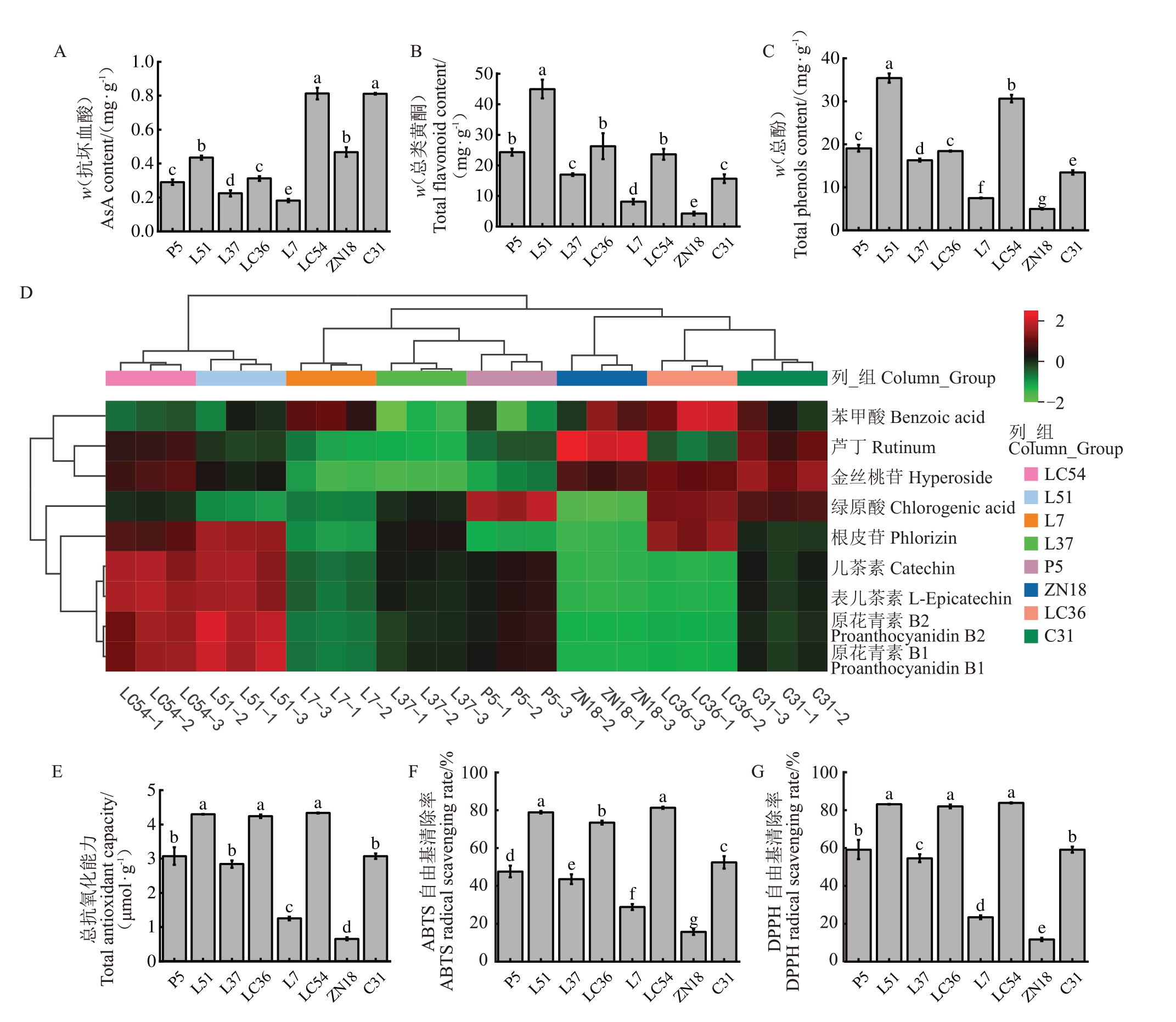
图2 各苹果种质资源酚类物质及其抗氧化能力
Fig.2 Phenolic compounds and antioxidant capacity of apple germplasm resources
A.抗坏血酸含量;B.总类黄酮含量;C.总酚含量;D.酚类物质含量;E.总抗氧化能力;F.ABTS 自由基清除率;G.DPPH 自由基清除率。不同字母代表各苹果种质资源间有显著差异(P<0.05)。
A.Ascorbic acid content; B. Total flavonoid content; C. Total phenol content; D. Phenolic content;E. Total antioxidant capacity; F.ABTS radical scavenging rate; G.DPPH free radical scavenging rate.Different letters indicated significant differences among apple germplasm resources(P<0.05).
2.5 不同苹果种质资源果实酚类物质含量
由图2-D 可知,各苹果种质资源酚类物质中绿原酸的含量最为丰富,远高于其他酚类物质,各苹果种质资源中绿原酸含量范围在108 838.99~447 552.41 ng·g-1 之间,其变异系数为38.31%。其次,在各苹果种质资源酚类物质中芦丁的含量也是较多的,其含量在3 020.89~28 670.71 ng·g-1之间,其变异系数为61.96%。其他酚类物质相较绿原酸和芦丁的含量较少,其中儿茶素的含量范围在279.66~7 066.93 ng·g-1之间,平均值为3 579.85 ng·g-1,变异系数为67.95%。根皮苷的含量在71.45~709.49 ng·g-1之间,平均值为389.82 ng·g-1,变异系数为60.17%,ZN18 的根皮苷含量显著低于其他种质资源。原花青素B1 的含量在209.89~9 413.99 ng·g-1之间,平均值为4 161.29 ng·g-1,变异系数为75.06%,L51 的原花青素B1 的含量显著高于其他种质资源。原花青素B2 的含量在213.00~10 611.75 ng·g-1之间,平均值为4 541.42 ng·g-1,变异系数为77.9%。表儿茶素的含量在259.69~6 669.42 ng·g-1 之间,平均值为3 302.49 ng·g-1,变异系数为68.52%。金丝桃苷的含量在687.36~2 878.32 ng·g-1之间,平均值为1 896.76 ng·g-1,变异系数为42.59%。苯甲酸的含量在789.4~1 220.91 ng·g-1之间,平均值为1 002.58 ng·g-1,变异系数为12.91%。研究结果表明,绿原酸是8 份苹果种质资源中主要的酚类物质。
2.6 不同苹果种质资源果实抗氧化能力
由图2-E~G 可知,不同苹果种质资源果实的抗氧化能力之间有显著差异。各苹果种质资源的DPPH自由基清除率范围为11.75%~83.85%,平均值为57.14%,变异系数为44.7%,其中ZN18 的DPPH自由基清除率显著低于其他种质资源。各苹果种质资源的ABTS 自由基清除率范围为15.65%~81.29%,平均值为52.72%,变异系数为42.33%,其中ZN18 的ABTS 自由基清除率显著低于其他种质资源。研究结果表明,LC54、L51、LC36的抗氧化能力最强,ZN18的抗氧化能力最弱。
2.7 香气成分分析
8 份苹果种质资源共检测出70 种香气物质,其中酯类物质种类最多,有45种,醇类物质有11种,醛类有9种,烯炔类物质有2种,酮类物质也有2种,醚类最少,只有1种。在8份苹果种质资源中,ZN18检测出的香气成分种类最多,共检测出35 种,其中酯类有23 种,醛类6 种,醇类3 种,其他3 种;其次L37检测出来的香气成分种类较多,共检测出31种,L37共检测出酯类16种,醛类3种,醇类8种,其他4种;LC54检测出来的香气成分最少,共检测出来14种香气成分,其中酯类2种,醛类5种,醇类3种,其他4种(图3-A)。各苹果种质资源的香气成分含量存在显著差异,其含量范围为17 741.80~116 950.81 μg·kg-1,平均值为54 678.1 μg·kg-1,变异系数为61.36%。在各苹果种质资源中L7 香气含量最高,LC36 香气含量最低。L7和ZN18的酯类含量在其总香气含量中所占比例较高,P5、L51、LC36 和LC54 的醛类含量在其总香气含量中所占比例较高,L37 和C31 的烯炔类含量在其总香气含量中所占比例较高(图3-B)。
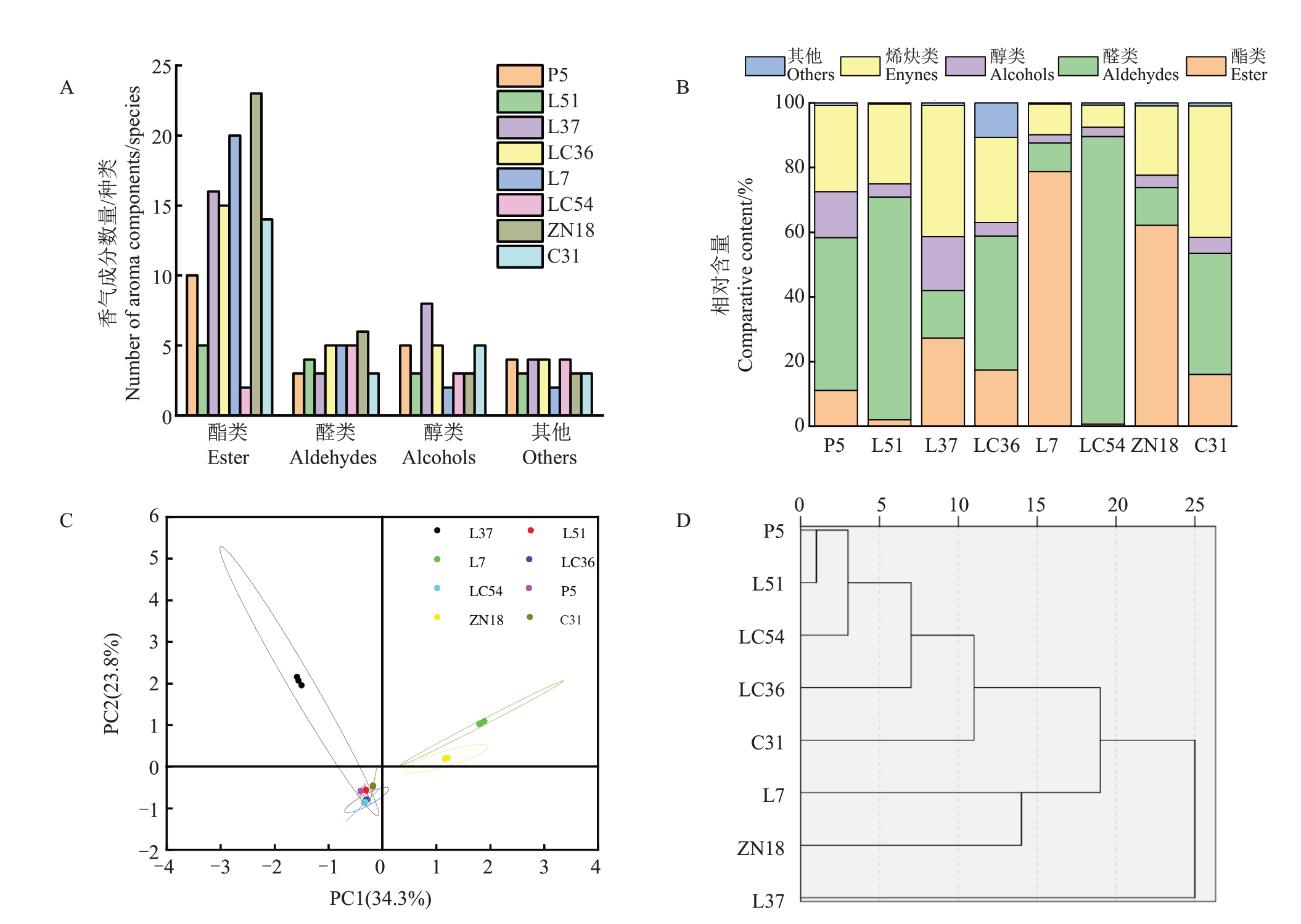
图3 香气成分分析
Fig.3 Analysis of aroma components
A.各苹果种质资源香气成分数量;B.各苹果种质资源香气相对含量;C.主成分分析;D.聚类分析。
A.The number of aroma components of apple germplasm resources;B.Relative aroma content of apple germplasm resources;C.Principal component analysis;D.Cluster analysis.
由表5 可知,在70 种香气成分中,有27 种香气成分是某个苹果种质资源特有的香气成分,其中L37有10种特有香气成分,分别为丁酸丙酯、庚酸乙酯、辛酸乙酯、乙酸乙酯、6-甲基-5-庚烯-2-醇、3-羟基己酸乙酯、2-甲基-4-壬醇、戊酸乙酯、3-羟基丁酸乙酯、异丁酸乙酯;ZN18有5种特有香气成分,分别为丙酸正丙酯、乙酸异丁酯、2-甲基丁酸-2-二甲基丙酯、2-甲基丁酸丙酯、1-辛烯-3-酮;LC36 有4 种特有香气成分,分别为己酸甲酯、3-己烯醛、丁酸异丙基酯、2-甲基丁酸甲酯;C31有3种特有香气成分,分别为辛酸己酯、辛酸异戊酯、乙酸反-2-己烯酯;L7有2种特有香气成分,分别为丙酸丁酯、2-甲基丁酸-1-甲基乙酯;LC54 也有2 种特有香气成分,分别为乙酸叶醇酯、2-甲基-4-戊醛;P5只有正戊醇1种特有香气成分。8份苹果种质资源共有的香气成分有5种,分别为甲基庚烯酮、正己醇、α-法呢烯、正己醛、2-己烯醛。
表5 各苹果种质资源香气成分及含量
Table 5 Aroma components and contents of apple germplasm resources w/( -1 μg·kg )
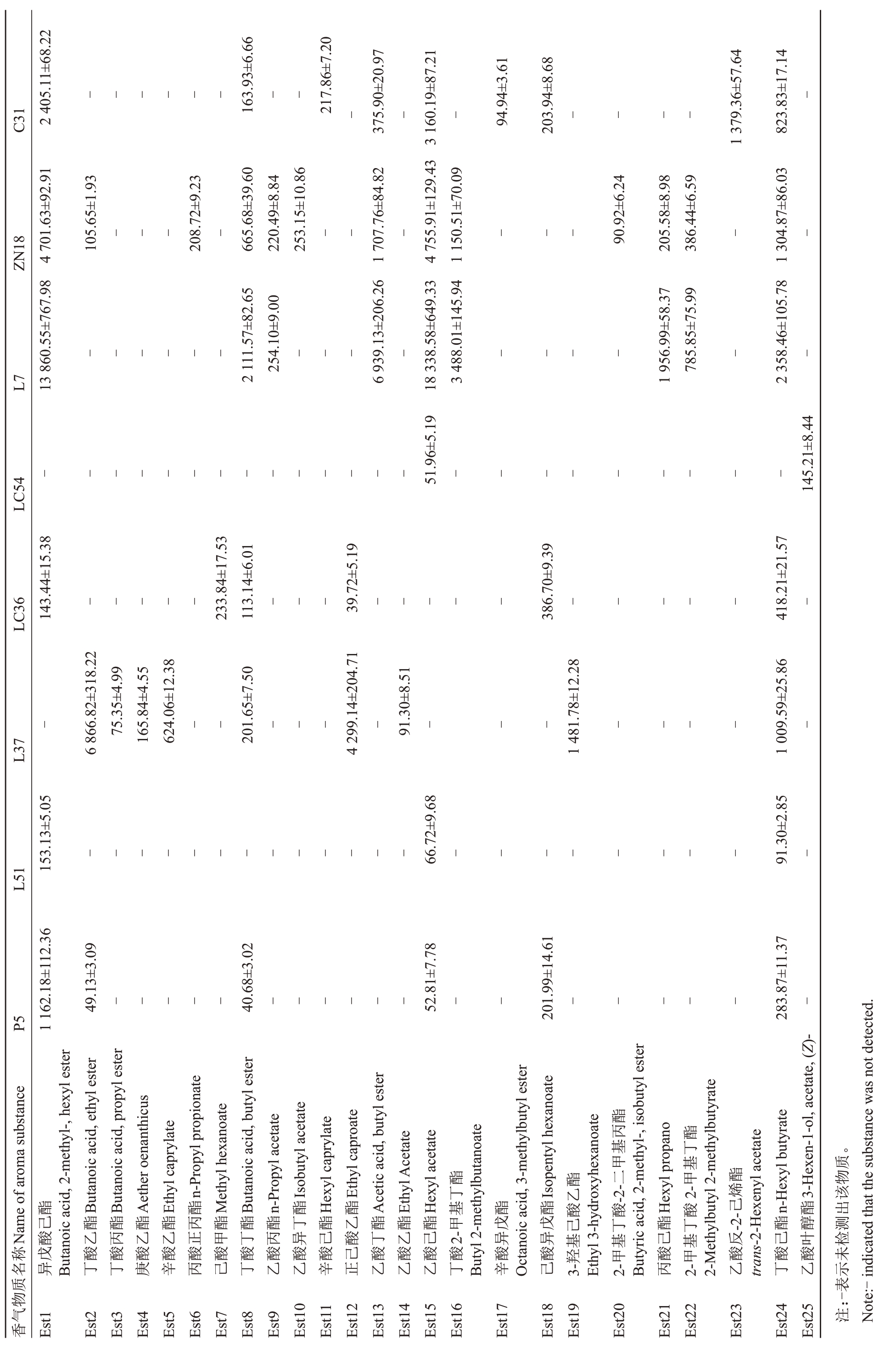
?
表5 (续) Table 5 (Continued) w/( -1 μg·kg )
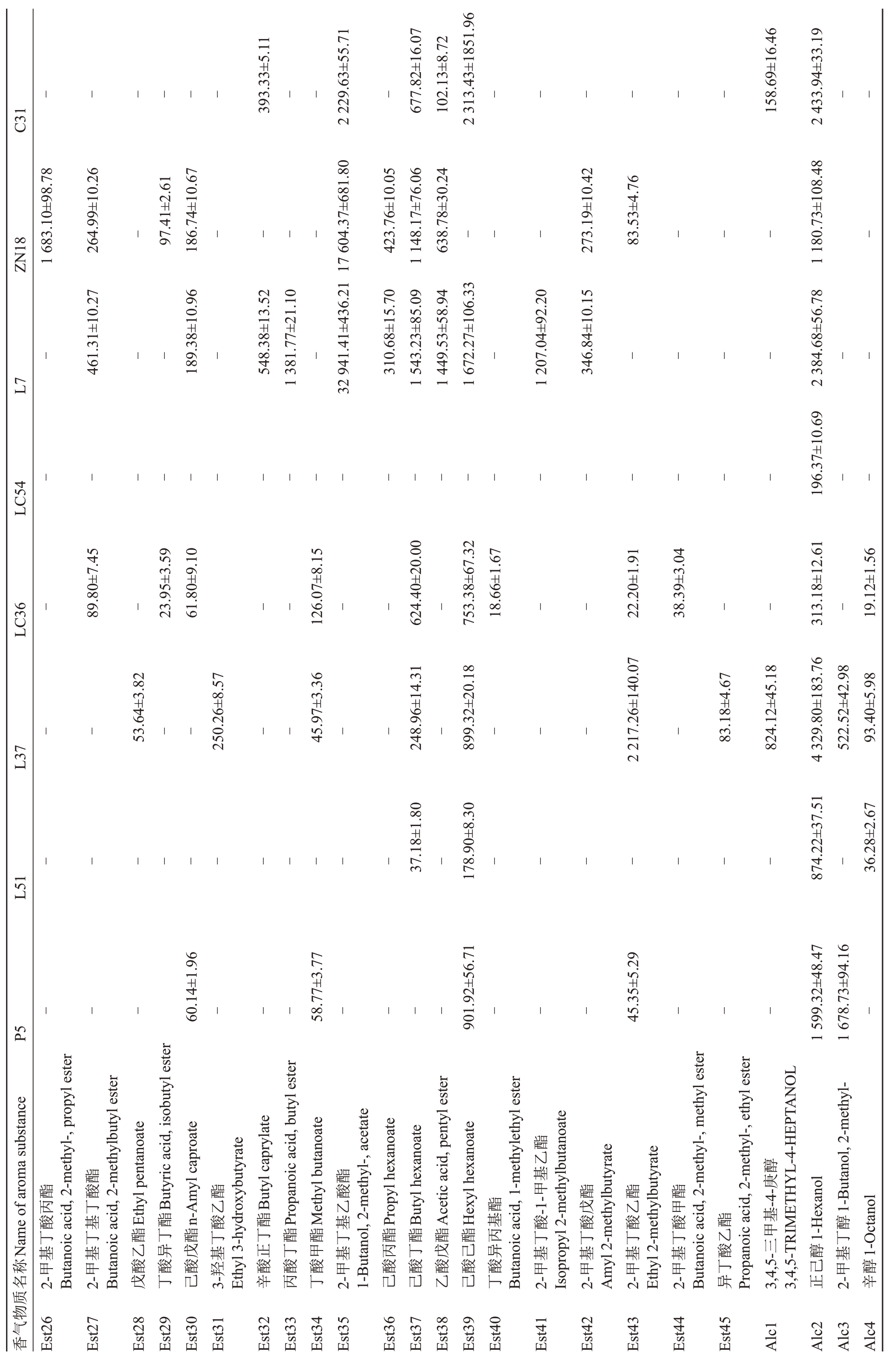
?
表5 (续) Table 5 (Continued) w/( -1 μg·kg )
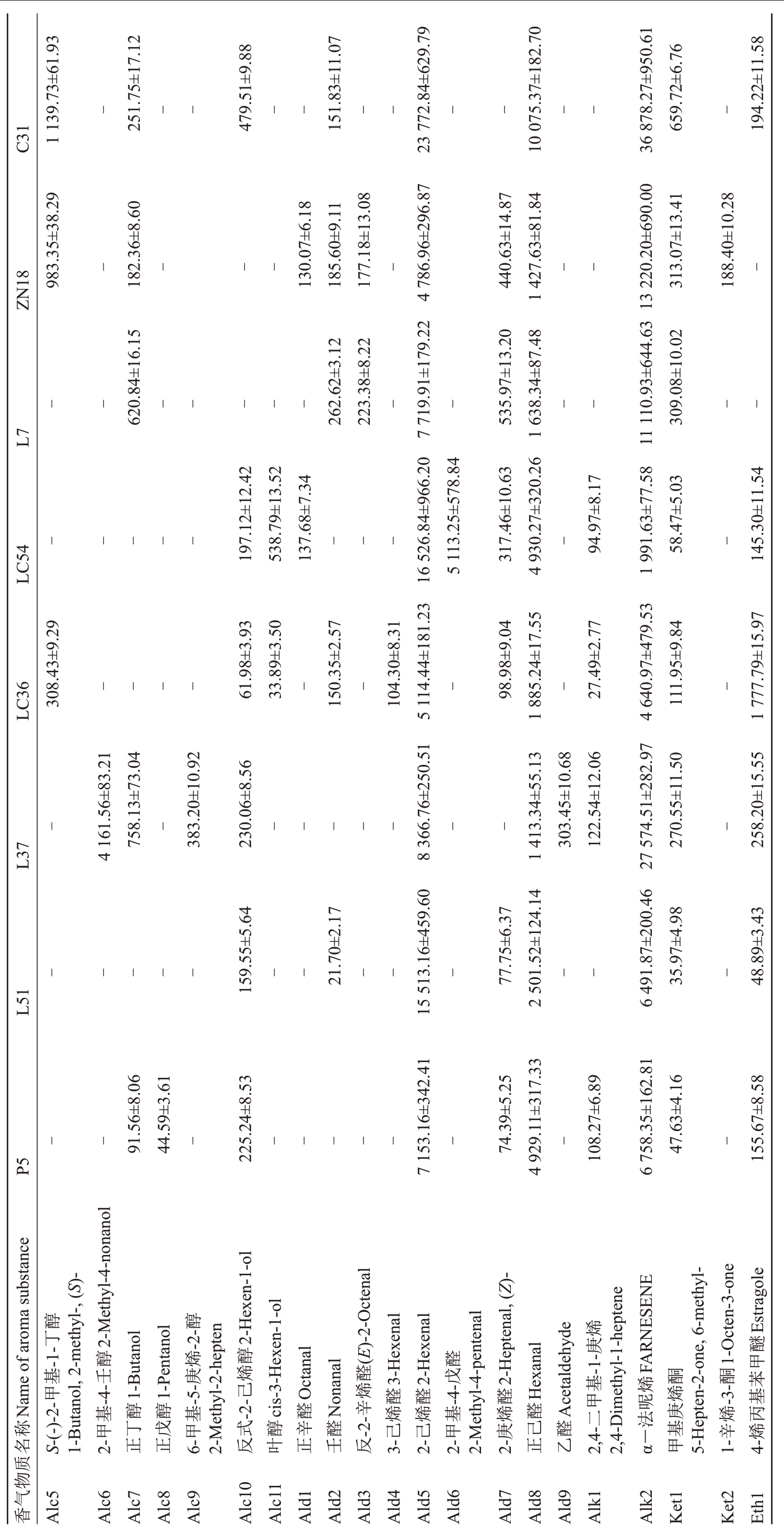
?
对不同苹果种质资源的香气成分含量进行主成分分析(图3-C),在PCA得分图中,PCA1(34.3%)和PCA2(23.8%)累计方差贡献58.1%,能够反映样本的绝大数信息,重复样本被紧密的收集在一起,从而表明该试验是可靠和可重复的。PCA 得分图结果表明8份种质资源被分为3组,这与聚类分析的结果一致(图3-D),进一步证明了L37 的香气成分与其他种质资源有较大的差异。
2.8 隶属函数分析
以各苹果种质资源的果实品质指标计算隶属函数值,以各苹果种质资源的隶属函数值的平均值为依据进行果实品质评价,平均隶属函数值越高,说明果实品质越好。综合果实横径、果实纵径、果形指数、单果质量、L*、a*、b*、C、H、可溶性固形物含量、可滴定酸含量、固酸比、苹果酸含量、果糖含量、葡萄糖含量、半乳糖含量、山梨醇含量、蔗糖含量、儿茶素含量、芦丁含量、根皮苷含量、原花青素B2 含量、表儿茶素含量、原花青素B1含量、金丝桃苷含量、苯甲酸含量、绿原酸含量、抗坏血酸含量、总酚含量、总类黄酮含量、DPPH 自由基清除率、ABTS 自由基清除率、酯类含量、醛类含量、醇类含量、烯炔类含量和其他共计37项指标,笔者计算出了各苹果种质资源的平均隶属函数值(表6),结果表明,L51 的平均隶属函数值最大,表明L51 的平均果实品质最好;ZN18的平均隶属函数值最小,表明ZN18的平均果实品质最差。由此笔者得出各苹果种质资源的果实品质依次为:L51>C31>LC54>LC36>P5>L37>L7>ZN18。
表6 隶属函数分析
Table 6 Membership function analysis table
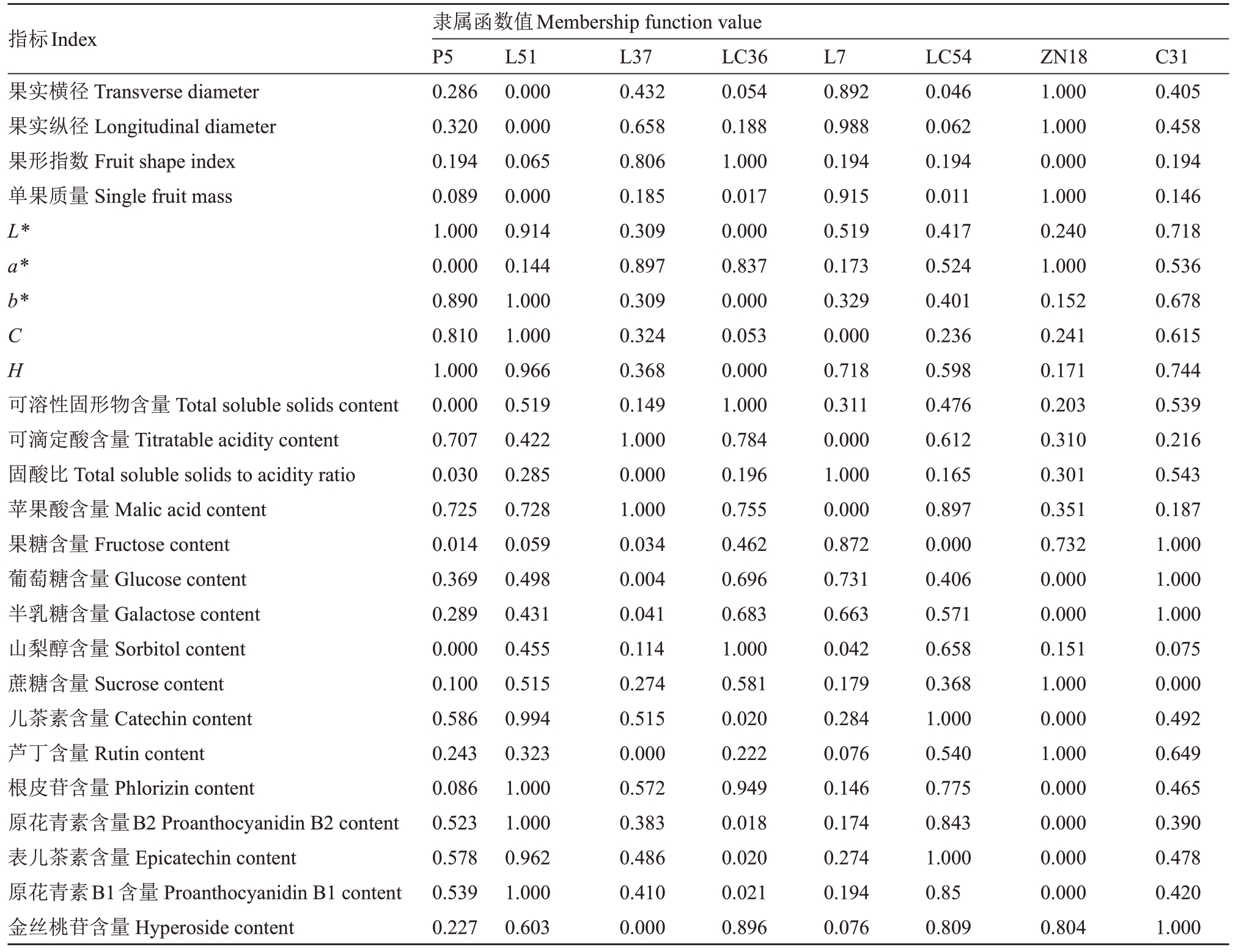
?
表6 (续) Table 6 (Continued)
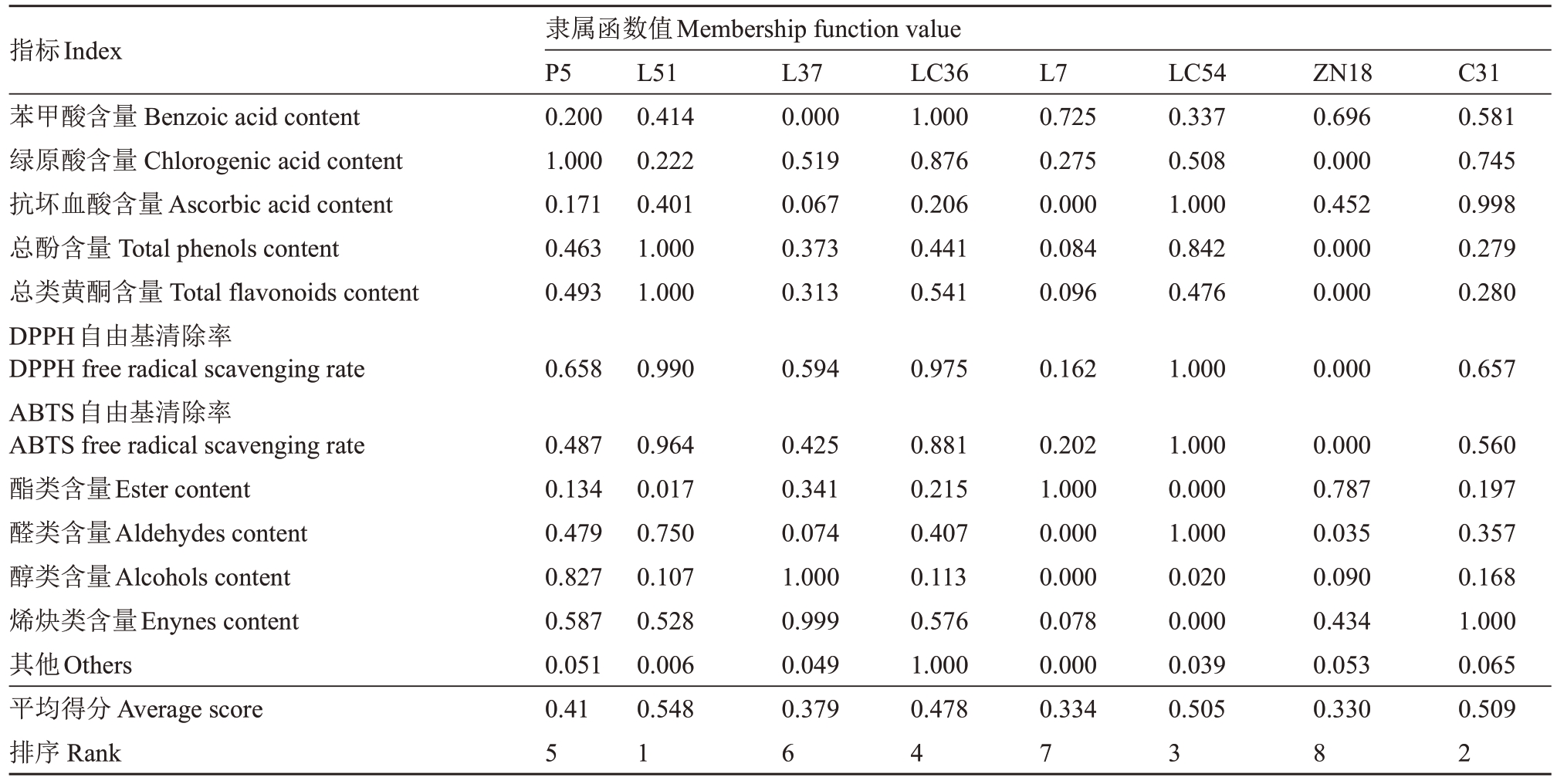
?
3 讨 论
变异系数反映了性状的分散程度,是性状遗传多样性的具体体现[22]。不同遗传背景性状的变异系数越大,说明该性状的分散程度越大,供育种者选择的空间也越大[23]。在本研究中,各苹果种质资源风味及营养物质的变异系数差异显著,分布在8.18%~77.90%之间,各苹果种质资源原花青素B2含量的变异系数最大,蔗糖含量的变异系数最小。各苹果种质资源酚类物质含量的变异系数较糖酸类物质含量的变异系数大。表明本研究中各苹果种质资源的遗传多样性丰富。Zhang 等[24]的研究表明,在11 个梨种质的570 个数量性状中,可滴定酸含量变异系数最大(128.43%),小叶数最小(8.77%),说明梨种质表型差异具有丰富的遗传多样性。以上研究表明,不同基因型间农艺性状的变异系数较大,这与笔者的研究结果相同。
各苹果种质资源的外观品质具有显著差异。ZN18 和L7 为大型果,P5、L51、L37、LC36、LC54、C31 均为小型果,可以作为小型果育种材料。P5 和L51果皮颜色为黄色,亮度高,可作为黄色苹果选育的材料。各苹果种质资源的可溶性固形物含量和可滴定酸含量具有显著差异(表3),笔者研究发现,LC36的可溶性固形物含量显著高于其他种质资源,L37的可滴定酸含量显著高于其他种质资源。已有研究表明,糖酸比在20~60 之间的苹果风味更为优良[25],从本研究结果的糖酸比可以看出(表3),L37的果实最酸,品质较低,L7和C31的果实酸甜适度,品质较好,其他种质资源的果实也偏酸,品质中等。果实的糖酸组分及含量对果实的品质具有重要影响[26],本研究结果表明各苹果种质资源可溶性糖以果糖和蔗糖为主(表4),P5、L51、L37、LC54的果糖含量与蔗糖含量接近,在42.08~47.24 mg·g-1之间,LC36的果糖含量稍高于蔗糖含量,分别为66.26 mg·g-1和48.07 mg·g-1,然而,L7、ZN18 和C31 的果糖含量高于蔗糖含量近2 倍,并且在品尝后发现L7、ZN18 和C31 明显比其他种质资源更甜,故笔者认为苹果间甜度的差异可能主要决定于其果糖含量。前人研究发现果糖是苹果的主要糖组分[10],且果糖含量是蔗糖含量的2 倍左右,这与笔者在L7、ZN18 和C31 等种质资源的糖组分相似,但与其他种质资源的糖组分不同,笔者认为是试验材料的差异。Tsuda等[10]以富士等品种为试验材料,已经过育种者的选育,果实酸甜适中,口感较好,故果糖含量是蔗糖含量的2倍左右,与L7、ZN18 和C31 相似,这也验证了笔者的猜想,苹果的甜度可能主要决定于其果糖的含量。
酚类是苹果的重要营养物质,不同苹果品种的酚类含量不同,不同酚类品种的抗氧化活性也不同[27]。已有研究表明,绿原酸是苹果中含量最丰富的酚类物质,本研究发现,在8份苹果种质资源中绿原酸含量占酚类物质的76.60%~96.46%,是苹果种质资源中含量最丰富的酚类物质,这与前人的研究结果一致。酚类物质具有抗氧化能力,已有研究表明,酚类物质含量与抗氧化能力呈正相关[11],原花青素B2、绿原酸、金丝桃素和槲皮素与其他酚类物质相比具有更强的抗氧化能力[28],且原花青素被证明是抗氧化活性的主要决定因素[29]。
香气是苹果特色风味形成的重要因素之一,苹果中常见的香气化合物主要有酯类、醛类、醇类、酮类、酸类和萜烯类[30],这些香气化合物在不同品种中的成分和含量不同,形成了不同品种特有的香气[31]。在8 份苹果种质资源中,笔者共检测出70 种香气物质,主要有酯类、醛类、醇类、萜烯类和一些其他化学物质,这与前人的研究结果是相同的[31-32]。根据聚类分析和主成分分析,可将8 份苹果种质资源分为3类,P5、L51、LC54、LC36、C31分为第Ⅰ类,L7和ZN18分为第Ⅱ类,L37单独为第Ⅲ类。根据各苹果种质资源的香气物质笔者研究发现P5、L51、LC54、LC36、C31 的香气物质种类较少且香气物质总含量较少,故将这几份苹果种质资源归为第Ⅰ类,L7 和ZN18 的香气物质种类多且香气物质总含量多,故将L7和ZN18归为第Ⅱ类,L37的香气物质与其他种质资源相比差异较大,有10 种特有香气物质,故将L37单独归为第Ⅲ类。
4 结 论
8份苹果种质资源的果实品质具有显著差异且各有其特点,与其他7份种质资源相比,P5果实亮度和绿原酸含量高,山梨醇含量低;L51果实小但根皮苷等酚类物质含量高;L37 苹果酸含量高,芦丁、绿原酸和苯甲酸含量低;LC36 山梨醇和苯甲酸含量高;L7 苹果酸和抗坏血酸含量低;LC54 儿茶素、表儿茶素、抗坏血酸含量高,抗氧化能力最强;ZN18蔗糖和芦丁含量高,抗氧化能力最弱;C31 果糖、葡萄糖、半乳糖含量最高。利用隶属函数法笔者得出各苹果种质资源的果实品质依次为:L51>C31>LC54>LC36>P5>L37>L7>ZN18。
[1] GAO Y,LIU F Z,WANG K,WANG D J,GONG X,LIU L J,RICHARDS C M,HENK A D,VOLK G M. Genetic diversity of Malus cultivars and wild relatives in the Chinese national repository of apple germplasm resources[J]. Tree Genetics & Genomes,2015,11(5):106.
[2] LI C X,ZHAO X H,ZUO W F,ZHANG T L,ZHANG Z Y,CHEN X S. Phytochemical profiles,antioxidant,and antiproliferative activities of four red-fleshed apple varieties in China[J].Journal of Food Science,2020,85(3):718-726.
[3] LIU W J,CHEN Z J,JIANG S H,WANG Y C,FANG H C,ZHANG Z Y,CHEN X S,WANG N. Research progress on genetic basis of fruit quality traits in apple(Malus×domestica)[J].Frontiers in Plant Science,2022,13:918202.
[4] WANG Z Y,MA B Q,YANG N X,JIN L,WANG L,MA S Y,RUAN Y L,MA F W,LI M J. Variation in the promoter of the sorbitol dehydrogenase gene MdSDH2 affects binding of the transcription factor MdABI3 and alters fructose content in apple fruit[J].The Plant Journal,2022,109(5):1183-1198.
[5] YU J Q,GU K D,ZHANG L L,SUN C H,ZHANG Q Y,WANG J H,WANG C K,WANG W Y,DU M C,HU D G.Mdb-HLH3 modulates apple soluble sugar content by activating phosphofructokinase gene expression[J]. Journal of Integrative Plant Biology,2022,64(4):884-900.
[6] ZHU L C,LI B Y,WU L M,LI H X,WANG Z Y,WEI X Y,MA B Q,ZHANG Y F,MA F W,RUAN Y L,LI M J.MdERDL6-mediated glucose efflux to the cytosol promotes sugar accumulation in the vacuole through up-regulating TSTs in apple and tomato[J]. Proceedings of the National Academy of Sciences of the United States of America,2021,118(1):e2022788118.
[7] KHAN S A,BEEKWILDER J,SCHAART J G,MUMM R,SORIANO J M,JACOBSEN E,SCHOUTEN H J. Differences in acidity of apples are probably mainly caused by a malic acid transporter gene on LG16[J].Tree Genetics&Genomes,2013,9(2):475-487.
[8] MA B Q,CHEN J,ZHENG H Y,FANG T,OGUTU C,LI S H,HAN Y P,WU B H.Comparative assessment of sugar and malic acid composition in cultivated and wild apples[J].Food Chemistry,2015,172:86-91.
[9] ZHENG L T,MA W F,DENG J H,PENG Y J,TIAN R,YUAN Y Y,LI B Y,MA F W,LI M J,MA B Q.A MdMa13 gene encoding tonoplast P3B-type ATPase regulates organic acid accumulation in apple[J].Scientia Horticulturae,2022,296:110916.
[10] TSUDA T,WATANABE M,OHSHIMA K,NORINOBU S,CHOI S W,KAWAKISHI S,OSAWA T. Antioxidative activity of the anthocyanin pigments cyanidin 3-O-β-D-glucoside and cyanidin[J]. Journal of Agricultural and Food Chemistry,1994,42(11):2407-2410.
[11] D’ABROSCA B,PACIFICO S,CEFARELLI G,MASTELLONE C,FIORENTINO A.‘Limoncella’apple,an Italian apple cultivar:Phenolic and flavonoid contents and antioxidant activity[J].Food Chemistry,2007,104(4):1333-1337.
[12] KALINOWSKA M,BIELAWSKA A,LEWANDOWSKA-SIWKIEWICZ H,PRIEBE W,LEWANDOWSKI W.Apples:Content of phenolic compounds vs.variety,part of apple and cultivation model,extraction of phenolic compounds,biological properties[J].Plant Physiology and Biochemistry,2014,84:169-188.
[13] WANG M Y,BAI Z Z,ZHU H L,ZHENG T T,CHEN X J,LI P M,ZHANG J,MA F W. A new strategy based on LC-Q TRAP-MS for determining the distribution of polyphenols in different apple varieties[J].Foods,2022,11(21):3390.
[14] DROGOUDI P D,MICHAILIDIS Z,PANTELIDIS G. Peel and flesh antioxidant content and harvest quality characteristics of seven apple cultivars[J]. Scientia Horticulturae,2008,115(2):149-153.
[15] BARS-CORTINA D,MACIÀ A,IGLESIAS I,GARANTO X,BADIELLA L,MOTILVA M J. Seasonal variability of the phytochemical composition of new red-fleshed apple varieties compared with traditional and new white-fleshed varieties[J]. Journal of Agricultural and Food Chemistry,2018,66(38):10011-10025.
[16] SCALBERT A,MANACH C,MORAND C,RÉMÉSY C,JIMÉNEZ L. Dietary polyphenols and the prevention of diseases[J]. Critical Reviews in Food Science and Nutrition,2005,45(4):287-306.
[17] ŚWIERCZEWSKA A,BUCHHOLZ T,MELZIG M F,CZERWIŃSKA M E.In vitro α-amylase and pancreatic lipase inhibitory activity of Cornus mas L.and Cornus alba L.fruit extracts[J].Journal of Food and Drug Analysis,2019,27(1):249-258.
[18] RAN J J,SUN H D,XU Y,WANG T T,ZHAO R X. Comparison of antioxidant activities and high-performance liquid chromatography analysis of polyphenol from different apple varieties[J].International Journal of Food Properties,2016,19(11):2396-2407.
[19] WU H M,XU Y Y,WANG H,MIAO Y Y,LI C Y,ZHAO R R,SHI X W,WANG B. Physicochemical characteristics,antioxidant activities,and aroma compound analysis of seven peach cultivars (Prunus persica L. Batsch) in Shihezi,Xinjiang[J].Foods,2022,11(19):2944.
[20] WANG Y P,ZHANG Z J,WANG X C,YUAN X,WU Q,CHEN S Y,ZOU Y J,MA F W,LI C.Exogenous dopamine improves apple fruit quality via increasing flavonoids and soluble sugar contents[J].Scientia Horticulturae,2021,280:109903.
[21] JING Y Y,ZHAN M H,LI C R,PEI T T,WANG Q,LI P M,MA F W,LIU C H. The apple FERONIA receptor-like kinase MdMRLK2 negatively regulates Valsa canker resistance by suppressing defence responses and hypersensitive reaction[J]. Molecular Plant Pathology,2022,23(8):1170-1186.
[22] TAO J J,WU M T,ZHONG W Q,JIAO X D,CHEN S S,JIA H M,JIA D F,HUANG C H. Changes in fruit quality and sugar components of wild Actinidia eriantha of different varieties(lines)at the ripening stage[J].Horticulturae,2022,8(9):824.
[23] CHENG B X,YU C,FU H L,ZHOU L J,LUO L,PAN H T,ZHANG Q X. Evaluation of the morphological diversity of tea roses (Rosa × odorata) based on phenotypic traits[J]. Plant Genetic Resources:Characterization and Utilization,2020,18(3):149-158.
[24] ZHANG Y,CAO Y F,HUO H L,XU J Y,TIAN L M,DONG X G,QI D,LIU C.An assessment of the genetic diversity of pear(Pyrus L.) germplasm resources based on the fruit phenotypic traits[J]. Journal of Integrative Agriculture,2022,21(8):2275-2290.
[25] BEGIC-AKAGIC A,SPAHO N,GASI F,DRKENDA P,VRANAC A,MELAND M,SALKIC B. Sugar and organic acid profiles of the traditional and international apple cultivars for processing[J]. Journal of Hygienic Engineering and Design,2014,7:190-196.
[26] LI Y J,SUN H X,LI J D,QIN S,YANG W,MA X Y,QIAO X W,YANG B R. Effects of genetic background and altitude on sugars,malic acid and ascorbic acid in fruits of wild and cultivated apples(Malus sp.)[J].Foods,2021,10(12):2950.
[27] LEE K W,KIM Y J,KIM D O,LEE H J,LEE C Y. Major phenolics in apple and their contribution to the total antioxidant capacity[J]. Journal of Agricultural and Food Chemistry,2003,51(22):6516-6520.
[28] BAI X L,ZHANG H W,REN S.Antioxidant activity and HPLC analysis of polyphenol-enriched extracts from industrial apple pomace[J]. Journal of the Science of Food and Agriculture,2013,93(10):2502-2506.
[29] PANZELLA L,PETRICCIONE M,REGA P,SCORTICHINI M,NAPOLITANO A. A reappraisal of traditional apple cultivars from Southern Italy as a rich source of phenols with superior antioxidant activity[J].Food Chemistry,2013,140(4):672-679.
[30] YAN D,SHI J R,REN X L,TAO Y S,MA F W,LI R,LIU X R,LIU C H. Insights into the aroma profiles and characteristic aroma of‘Honeycrisp’apple (Malus × domestica)[J]. Food Chemistry,2020,327:127074.
[31] YANG S B,HAO N N,MENG Z P,LI Y J,ZHAO Z Y.Identification,comparison and classification of volatile compounds in peels of 40 apple cultivars by HS-SPME with GC-MS[J].Foods,2021,10(5):1051.
[32] LU X G,MENG G L,JIN W G,GAO H. Effects of 1-MCP in combination with Ca application on aroma volatiles production and softening of‘Fuji’apple fruit[J]. Scientia Horticulturae,2018,229:91-98.