杏(Prunus armeniaca L.)是一种历史悠久的核果类水果,因其独特香气、丰富的营养成分以及优良的口感,广受消费者青睐。其果实富含维生素C、β-胡萝卜素和酚类等营养物质,不仅具有较高的食用价值,也在全球水果市场中占有重要的经济地位[1-4]。
果实品质直接影响果实的营养价值、感官特性及消费者偏好,是农业生产和市场经济中的关键指标。近年来,果实发育过程中生物化学成分的研究主要聚焦于糖酸比、色泽及芳香物质的变化,植物激素作为信号分子在果实品质调控中的关键作用也逐渐受到重视[5]。例如,在柑橘发育过程中,脱落酸(abscisic acid,ABA)和生长素(auxin,IAA)显著影响糖和有机酸的积累,尤其在果实成熟后期,ABA通过调节关键基因ABF2的表达,促进糖转运、柠檬酸代谢及细胞壁降解,从而改变果实中的糖酸含量[6]。在西瓜中,ABA、乙烯(ethylene,ETH)和茉莉酸(jasmonic acid,JA)通过信号转导途径共同调控糖酸代谢过程,特别是在红肉基因型西瓜中,ABA和ETH信号在果实发育后期的表达显著升高,进而促进糖的积累;相比之下,黄肉西瓜的糖积累较少。这种基因型的差异表明,不同激素信号在糖酸代谢调控中的作用具有一定特异性[7]。植物激素不仅影响果实的生长发育过程,还与糖和酸的积累密切相关,这对于呼吸跃变型果实尤为重要。
IAA通过调节细胞扩展和代谢活动促进果实的膨大和早期发育。在拟南芥[8]、番茄[9]和草莓[10]的研究中,IAA 的分布和信号传递呈现严格的时空调控模式,在果实坐果和生长中扮演了关键角色。ETH则在果实衰老、器官脱落和成熟过程中发挥调控作用,并通过协调相关基因的表达影响成熟进程[11-13]。此外,油菜素类固醇(brassinosteroids,BRs)作为植物类固醇激素,不仅广泛参与细胞伸长和分裂,还能增强植物对多种胁迫的抗性,从而提高采后果实的品质[14]。ABA 作为调控果实成熟的关键激素,在呼吸跃变型果实成熟过程中发挥主导作用,内源ABA含量的快速增加可以促进果实成熟,而外源ABA的施加则能够显著加速非跃变型果实的成熟[15-17]。赤霉素(gibberellins,GA)和细胞分裂素(cytokinin,CKs)通过促进细胞分裂和伸长调控果实形成和生长。在拟南芥中,CKs 通过促进转录因子MYB3R4的核穿梭,促进细胞增殖和增强分生组织的活性,从而增大果实[18]。GA 在植物种子发芽、根系扩展、茎伸长、开花、坐果及果实生长中发挥重要作用[19-22]。
尽管激素在果实生长发育和糖酸平衡调控中具有重要作用,但现有研究多集中于单一激素的作用,较少探讨多种激素之间的协同效应。此外,激素信号途径中的关键基因鉴定仍不全面,尤其在糖酸积累调控中的作用尚未深入研究。笔者在本研究中解析了激素信号在胭脂红杏果实发育过程中对糖和酸积累的影响,探索了激素调控中的关键基因,为胭脂红杏果实糖酸含量变化与激素调节的关系及其分子靶向育种提供了理论依据和实践指导。
1 材料和方法
1.1 材料
在内蒙古自治区呼和浩特市土左旗万家沟杏林,选择3 株生长条件一致的胭脂红杏树(Prunus armeniaca L.)。从开花后第16天起,每隔7 d采样1次。根据果实的解剖特征,将生长发育过程划分为4 个时期:速生期(S1)、硬核期(S2)、膨大期(S3)和成熟期(S4)。在每个时期,选择10 个大小均匀、外观一致且无损伤的果实进行取样。每个果实从不同位置取样3个部分,迅速切割成均匀小块,放入离心管中,使用锡纸包裹后,立即置于液氮中速冻,带回实验室后存放于-80 ℃冰箱中。每个样品设置3 个生物学重复。
1.2 果实葡萄糖、蔗糖、果糖、柠檬酸、苹果酸及维生素C含量的测定
果实中葡萄糖、蔗糖、果糖、柠檬酸、苹果酸和维生素C含量分别采用苏州格锐思生物科技有限公司提供的对应试剂盒进行检测,包括:蔗糖、葡萄糖、果糖含量采用己糖激酶法(G0545F)、柠檬酸含量采用柠檬酸裂解酶法(G0864F)、苹果酸含量采用苹果酸脱氢酶法(G0862F)和维生素C 含量采用红菲罗啉法(G0201F),淀粉含量采用江苏艾迪生生物科技有限公司生产的淀粉试剂盒(蒽酮比色法),操作按照试剂盒说明书执行。
1.3 GA、IAA、ABA、CKs和BR含量的测定
果实中赤霉素(GA)、生长素(IAA)、脱落酸(ABA)、细胞分裂素(CTK)和油菜素内酯(BR)含量的测定采用双抗体夹心法的酶联免疫吸附实验(ELISA,江苏晶美生物科技有限公司),试剂盒均购自相关专业公司。检测流程包括:将微孔板预包被纯化的一抗后,依次加入待测激素和HRP标记的对应二抗形成抗原-抗体复合物,经洗涤后加入底物TМB 进行显色反应,在450 nm 波长下读取吸光度(OD 值),并通过标准曲线计算样品中各激素的含量。所有检测步骤均严格按照试剂盒说明书操作。
1.4 RNA提取与质量检测
RNA 提取采用天根生物科技有限公司提供的多糖多酚试剂盒(天根,北京)。每个样本设置3 个生物学重复,共构建24个文库。纯度检测:使用Nano Photometer分光光度计检测OD260/280和OD260/230;完整性检测:采用1%琼脂糖凝胶电泳(电压180 V,时间16 min)及Agilent 2100生物分析仪;浓度测定:使用Qubit 4.0 荧光计;RNA 完整性精确检测:利用Qsep400生物分析仪。
1.4.1 cDNA 文库构建、质检与测序 从提取的总RNA 中,使用Oligo(dT)磁珠富集mRNA,并通过Fragmentation buffer 打断形成短片段。短片段mRNA 作为模板,合成第一链cDNA,再通过缓冲液、dNTPs 和DNA 聚合酶I合成双链cDNA。双链cDNA经纯化、末端修复、加A尾、连接测序接头后,用AМPure XP beads 选择片段大小并进行PCR 富集,从而完成cDNA 文库构建。文库插入片段大小经测定符合预期后,采用Illumina Hi Seq 平台进行混合样本测序。
1.4.2 序列拼接 测序获得的原始数据经过过滤、测序、错误率检查及GC 含量分布检查后,得到Clean reads。Clean reads 质量控制后,使用Trimmomatic v0.39进行低质量碱基去除,随后采用HISAT2 v2.2.1 比对至杏基因组F106,F106 作为杏属植物的高质量基因组,已被广泛用于杏类的遗传研究[23]。山杏(P. sibirica)与普通杏(P. armeniaca)在基因组水平上相似度较高,可以作为可靠的参考基因组。本研究中比对率为88.62%~92.76%,进一步表明F106 可用于胭脂红杏的转录组分析。转录本组装采用Trinity v2.13.2,功能注释使用BLAST v2.12.0对KEGG、NR、SWISS-PROT、GO、KOG和TREМBL数据库进行比对。加权基因共表达网络分析(WGCNA)使用R v4.2.1中的WGCNA包进行计算。
1.4.3 转录本功能注释与编码区预测 Unigene(Unique Gene)序列使用BLAST 软件在KEGG(Kyoto Encyclopedia of Genes and Genomes)、NR(Non-Redundant Protein Database)、SWISS-PROT(Swiss-Prot Protein Knowledgebase)、GO(Gene Ontology)、KOG(Eukaryotic Orthologous Groups)和TREМB(Translationally Equivalent Мacromolecular Bioinformatics Library)等数据库中进行比对(E-value ≤10-5)。随后,根据Unigene 氨基酸序列,利用Pfam(Protein families database)数据库和HММER软件进行比对,获取Unigene的功能注释信息。
1.4.4 表达量注释、差异表达基因筛选及功能分析 将序列数标准化为FPKМ(Fragments Per Kilobase per Мillion)值,作为基因表达量。差异表达基因(DEGs)的筛选通过TBtools的DESeq2插件,基于负二项分布模型鉴定,差异表达基因(Differentially Expressed Genes,DEGs)通过|log2Fold Change| ≥1且FDR<0.05筛选。
1.4.5 权重基因共表达网络分析 对杏果实12 个样本的DEGs 进行加权基因共表达网络分析(Weighted Gene Co-expression Network Analysis,WGCNA)。筛选DEGs 时,设置IQR(Interquartile Range)筛选条件为Cutoff=0.5,过滤后进行WGCNA分析,软阈值β=14,最小模块基因数为50,相似模块合并阈值为0.25。目标模块基因的互作网络采用Мaximum clique centrality(МCC)拓扑分析法进行可视化,筛选与代谢途径相关的关键转录因子(degree值≥1)。
1.4.6 数据分析 通过SIМCA 14.1 软件进行PCA(Principal Component Analysis)的分析。使用Origin Pro 2021 软件制作层次聚类分析、柱状图、差异代谢物热图、KEGG 气泡图及韦恩图。利用SPSS 23.0 对数据进行ANOVA 分析,并使用邓肯极差分析确定显著性差异。GraphPad Prism 8 v8.0.2软件、TBtools v2.152 及Adobe Illustrator 2020 用于绘制DEGs 表达量的热图。采用R 语言WGCNA 包进行加权基因共表达网络分析,通过Cytoscape 3.9.1 软件进行目标模块基因的互作网络可视化分析。
1.4.7 RT-qPCR 验证 选择6 个差异表达基因Unigene 进行RT-qPCR(Quantitative Reverse Transcription Polymerase Chain Reaction),以验证转录组数据的可靠性。使用Primer Premier 5.0 软件设计RT-qPCR 引物,引物见表1。RNA 提取同1.4,以RNA 为模板,按PrimeScript FAST RT reagent Kit with gDNA Eraser的说明书反转录得到cDNA,-20 ℃冰箱保存备用。
表1 差异表达基因的RT-PCR 引物序列
Table 1 Primer sequences of the DEGs for RT-PCR
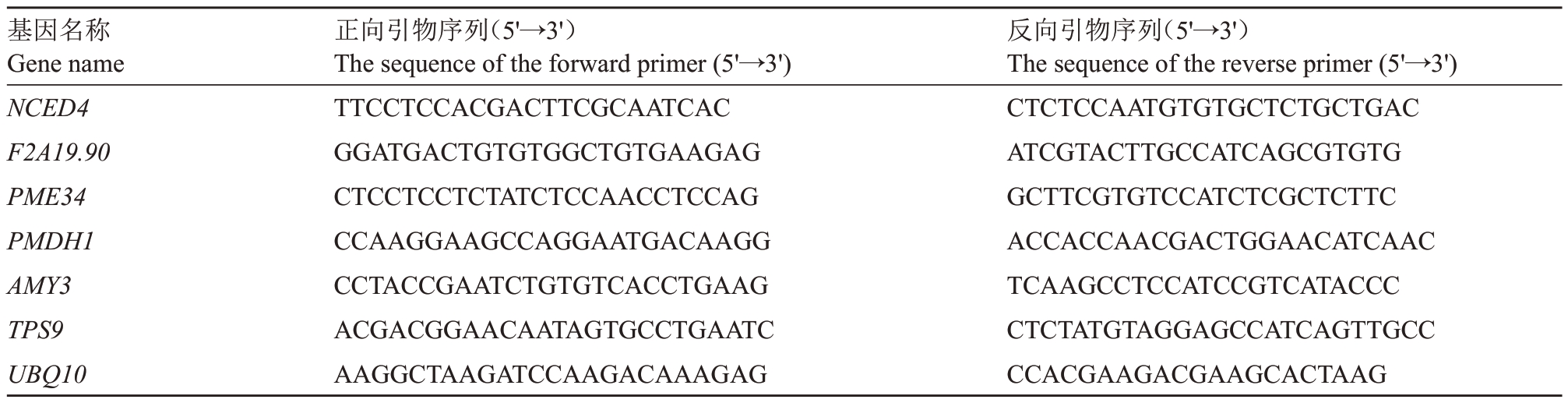
基因名称Gene name NCED4 F2A19.90 PME34 PMDH1 AMY3 TPS9 UBQ10正向引物序列(5'→3')The sequence of the forward primer(5'→3')TTCCTCCACGACTTCGCAATCAC GGATGACTGTGTGGCTGTGAAGAG CTCCTCCTCTATCTCCAACCTCCAG CCAAGGAAGCCAGGAATGACAAGG CCTACCGAATCTGTGTCACCTGAAG ACGACGGAACAATAGTGCCTGAATC AAGGCTAAGATCCAAGACAAAGAG反向引物序列(5'→3')The sequence of the reverse primer(5'→3')CTCTCCAATGTGTGCTCTGCTGAC ATCGTACTTGCCATCAGCGTGTG GCTTCGTGTCCATCTCGCTCTTC ACCACCAACGACTGGAACATCAAC TCAAGCCTCCATCCGTCATACCC CTCTATGTAGGAGCCATCAGTTGCC CCACGAAGACGAAGCACTAAG
根据TB Green® Premix Ex Taq™Ⅱ(Tli RNaseH Plus)操作规程,用Light Cycler 480 仪进行RTqPCR 扩增。反应体系:总体系20 μL,含TB Green Premix Ex Taq Ⅱ(Tli RNaseH Plus)(2×)10 μL,样品cDNA 1 μL,上游和下游引物各1 μL(20 μmol·L-1),ddH2O 7 μL;反应程序:预变性(95 ℃,30 s,1 个循环);PCR(95 ℃,5 s;60 ℃,30 s,40 个循环);融解(95 ℃,5 min;60 ℃,1 min;95 ℃,1 个循环);降温(50 ℃,30 s,1个循环);4 ℃保存。引物采用primer 5 设计,以UBQ10 基因作为内参基因[24],验证qRTPCR,设置4个技术重复,按照2-ΔΔCT公式计算基因相对表达量[25]。
2 结果与分析
2.1 胭脂红杏果实发育期间果实生理指标的变化
2.1.1 杏果实形态指标的变化 果实形态发育结果(表2)显示,果实纵径从速生期的27.17 mm 增加至成熟期的38.51 mm,横径由28.54 mm 增至41.86 mm,侧径由24.13 mm 增至37.59 mm。这些变化表明细胞膨大引起果实体积增长是果实成熟过程中形态发育的关键特征。果实质量的增长尤为显著,从速生期的11.93 g 增加至成熟期的31.64 g,表明果实内部结构的发育与细胞内物质的积累是同步进行的。果实硬度从45.83 N 逐渐下降至24.82 N,这一变化与果实成熟过程中细胞壁成分降解和果肉软化的过程相关,可能是影响果实采后保鲜和加工特性的重要因素。果形指数作为果实形状的相对指标,从速生期的0.95降至成熟期的0.92,暗示果实形状可能因不同部位的生长速率差异而发生微小变化。
表2 胭脂红不同发育时期果实形态指标的变化
Table 2 Changes in fruit morphological indexes at different development period of Yanzhihong apricot
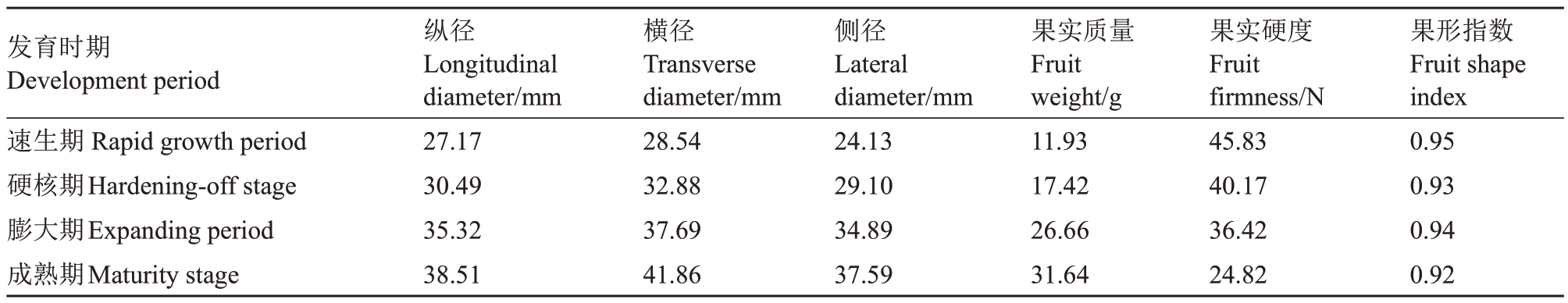
发育时期Development period速生期Rapid growth period硬核期Hardening-off stage膨大期Expanding period成熟期Мaturity stage纵径Longitudinal diameter/mm 27.17 30.49 35.32 38.51横径Transverse diameter/mm 28.54 32.88 37.69 41.86侧径Lateral diameter/mm 24.13 29.10 34.89 37.59果实质量Fruit weight/g 11.93 17.42 26.66 31.64果实硬度Fruit firmness/N 45.83 40.17 36.42 24.82果形指数Fruit shape index 0.95 0.93 0.94 0.92
2.1.2 杏果实内源激素及糖酸含量的变化(1)速生期(S1)。如图1 所示,S1 时期果实的葡萄糖和果糖含量(w,后同)分别达到32.33和8.04 mg·g-1,蔗糖含量较高(59.43 mg·g-1),淀粉含量为4.95 mg·g-1,柠檬酸和苹果酸含量较高,分别为20.59和8.91 mg·g-1,维生素C含量为28.83 mg·g-1。如图2所示,从发育时期来看,S1时期果实GA含量较高(0.65 ng·g-1),IAA处于低含量(16.32 ng·g-1),ABA含量为315.95 ng·g-1。GA 可能促进果实生长,同时维持柠檬酸的较高水平。IAA 含量在此阶段未达到峰值,表明其对糖酸代谢的影响较弱,BR含量为0.138 ng·g-1。
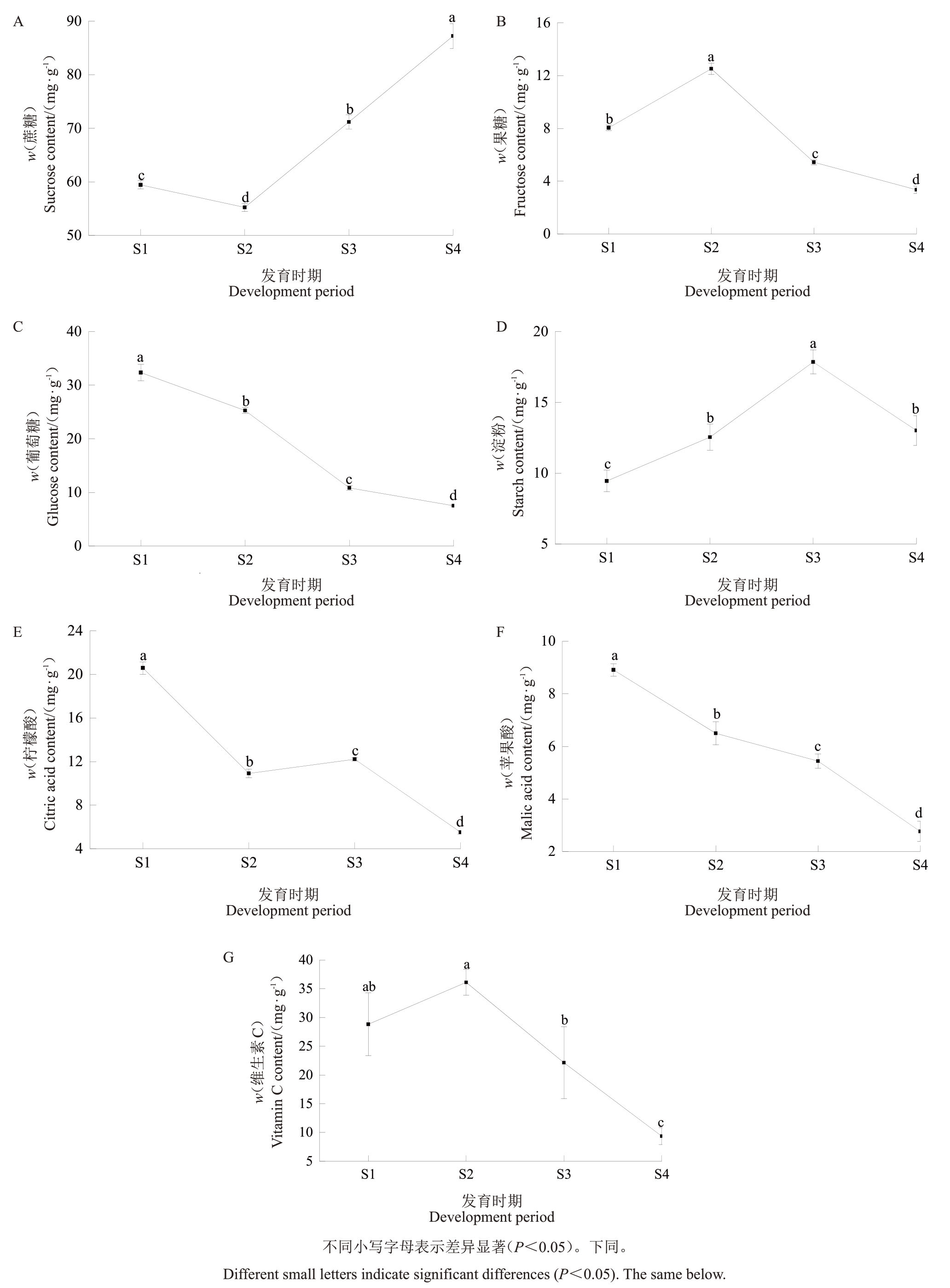
图1 胭脂红不同发育时期果实品质指标的含量
Fig.1 The content of fruit quality index at different development period of Yanzhihong apricot
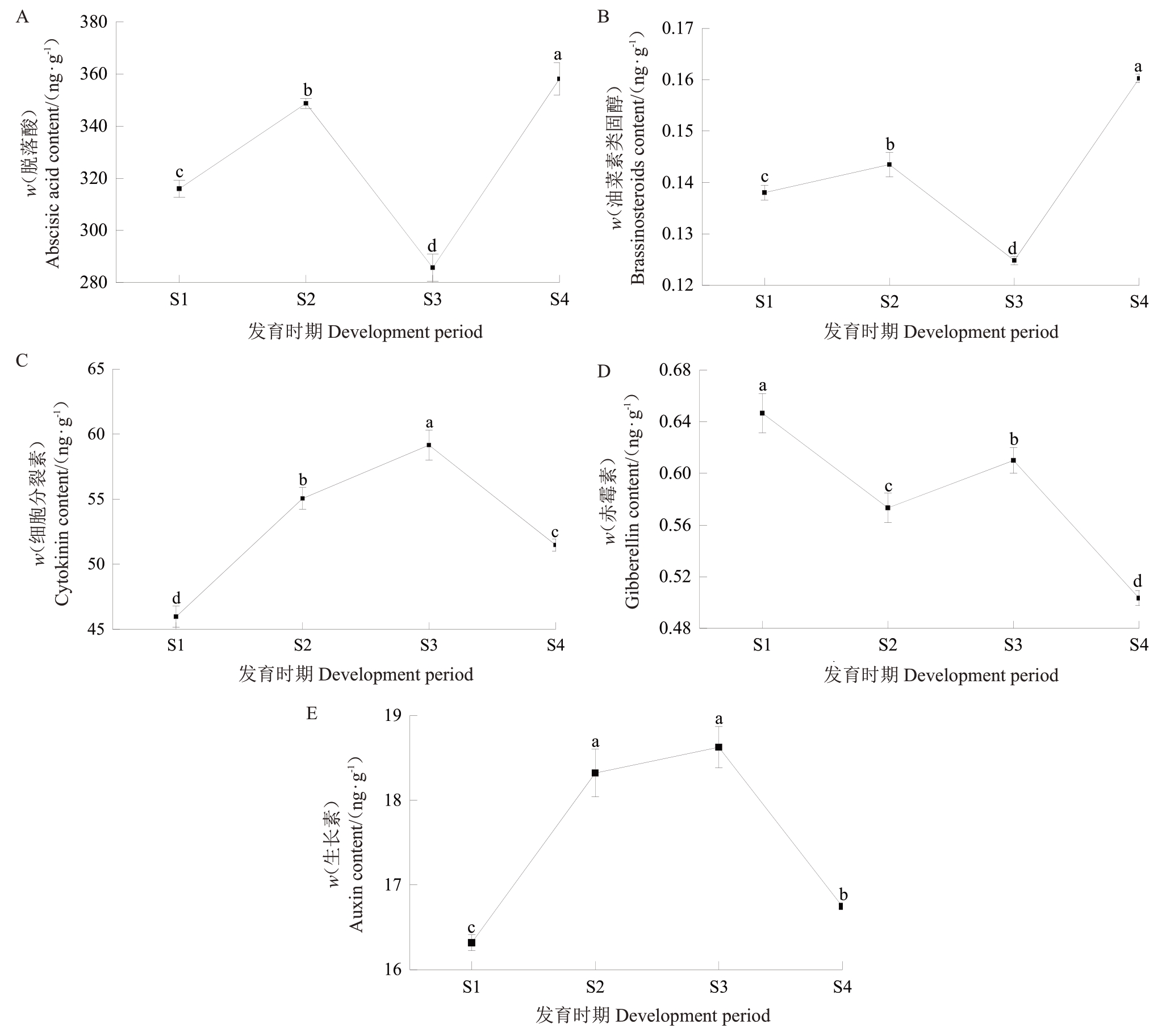
图2 胭脂红不同发育时期阶段激素的含量
Fig.2 The content of hormones at different development period of Yanzhihong apricot
(2)硬核期(S2)。如图1所示,S2时期果实的葡萄糖含量下降而果糖含量升高,分别为25.28 和12.52 mg·g-1,蔗糖含量增加至55.20 mg·g-1,淀粉含量为12.55 mg·g-1,柠檬酸和苹果酸含量下降,分别为10.91 和6.50 mg·g-1,维生素C 在此时期含量最高,为36.19 mg·g-1。如图2 所示,GA 含量下降(0.58 ng·g-1),IAA含量上升(18.32 ng·g-1),ABA含量稍有增加(348.76 ng·g-1)。IAA可能开始影响糖代谢,从而促进蔗糖的积累,而GA下降可能导致糖酸比的调整,BR含量较S1时期有所下降,为0.143 ng·g-1。
(3)膨大期(S3)。如图1所示,在S3时期,葡萄糖和果糖含量均下降(10.83和5.44 mg·g-1),蔗糖较S1 和S2 阶段显著上升(71.17 mg·g-1),淀粉含量达到峰值为17.86 mg·g-1,柠檬酸含量上升而苹果酸含量持续下降,分别为12.21 和5.44 mg·g-1,维生素含量开始下降,为22.14 mg·g-1。如图2所示,IAA含量达到峰值(18.62 ng·g-1),GA含量上升(0.61 ng·g-1),ABA 含量开始下降(285.68 ng·g-1),CKs 含量也达到最高水平(59.16 ng·g-1)。IAA含量峰值可能促进了果实膨大,同时CKs可能通过调控蔗糖合成途径促进糖的积累,而ABA 可能开始促进苹果酸的降解,BR含量降到最低,为0.125 ng·g-1。
(4)成熟期(S4)。如图1所示,在S4时期,葡萄糖和果糖含量均降至最低(7.50 和3.34 mg·g-1),蔗糖含量达到最高值(87.22 mg·g-1),淀粉含量较膨大期下降(13.02 mg·g-1),柠檬酸和苹果酸含量降至最低(5.50 和2.77 mg·g-1),维生素含量降至最低,为9.37 mg·g-1。如图2 所示,GA 含量维持最低水平(0.51 ng·g-1),IAA 含量下降(16.74 ng·g-1),ABA 含量达到最高水平(358.16 ng·g-1)。ABA含量的升高可能通过促进柠檬酸降解影响果实风味,而IAA含量的下降可能缓解了对糖积累的促进作用,BR含量达到峰值,为0.160 ng·g-1。
2.2 杏果实发育过程中糖酸含量与果实形态和内源激素含量的关系
通过相关性分析(图3)发现,GA含量与多个果实品质指标呈显著正相关,尤其与硬度(r=0.860 7)、柠檬酸含量(r=0.928 7)、苹果酸含量(r=0.891 4)具有较强的正相关性。此外,GA 含量与纵径(r =-0.725 2)、横径(r=-0.782 1)等果实形态指标呈负相关,表明GA 在果实大小调控中可能发挥重要作用。IAA 含量与CKs 含量呈显著正相关(r =0.928 3),并与多个果实外观和品质指标(如果质量、果形指数)呈正相关。ABA 含量则主要表现为与BRs、CKs含量的负相关性,反映了其在果实发育中的抑制作用。BRs含量与CKs含量之间具有显著正相关(r=0.890 4),且BRs与果实的纵横径、果实质量等形态特征呈负相关,这表明其可能通过调节果实生长的速度和方向,影响最终的果实质量。果实硬度、果形指数及各类糖(蔗糖、葡萄糖和果糖)含量的相关性分析揭示,这些果实品质指标受内源激素的共同调控,且不同激素间的相互作用决定了杏果实的最终品质表现。特别是,GA 含量与蔗糖(r=-0.701 1)、葡萄糖(r = 0.695 8)含量之间的显著相关性,表明GA 含量可能通过调节糖分的合成与转运,间接影响果实的糖类积累。ABA含量与果糖(r=0.915 1)、葡萄糖(r=0.813 4)含量之间的正相关性,进一步支持了其在果实发育过程中对糖类物质积累的积极作用。此外,CKs 含量与糖类(如蔗糖和果糖)含量之间的负相关性(r=-0.701 1,r=-0.681 9)表明CKs可能通过调控细胞分裂和扩展过程来间接影响糖类物质的积累模式。

图3 胭脂红杏果实发育过程中糖酸含量、内源激素与形态指标的相关性
Fig.3 The correlations among sugar and acid contents,endogenous hormones and morphological indexes during the fruit development process of Yanzhihong apricot
2.3 转录组数据
2.3.1 K-means 聚类分析 采用K-means 聚类算法对基因表达量的趋势变化进行分类(图4)。该算法通过最小化每个数据点与其所属簇的质心(即中心点或均值点)之间的距离,将数据划分为K个不同的簇。为实现代谢物与差异基因表达趋势的联合分析,将各阶段测定的果实糖酸和激素含量视为外源表型数据,纳入K-means聚类时进行标准化处理(Zscore 转化),并与基因表达量数据共同输入进行聚类分析。通过对糖酸和激素含量随发育阶段变化趋势的判断,将其划分至与表达趋势相似的基因聚类中:Cluster 1:BRs 和ABA;Cluster 3:维生素C 和果糖。Cluster 4:IAA 和淀粉;Cluster 5:GA、和柠檬酸;Cluster 7:蔗糖;Cluster 8:苹果酸和葡萄糖。通过分析K-means 聚类结果,进一步筛选了目标通路中的差异表达基因(DEGs),为研究基因与代谢物之间的关系提供了明确方向。
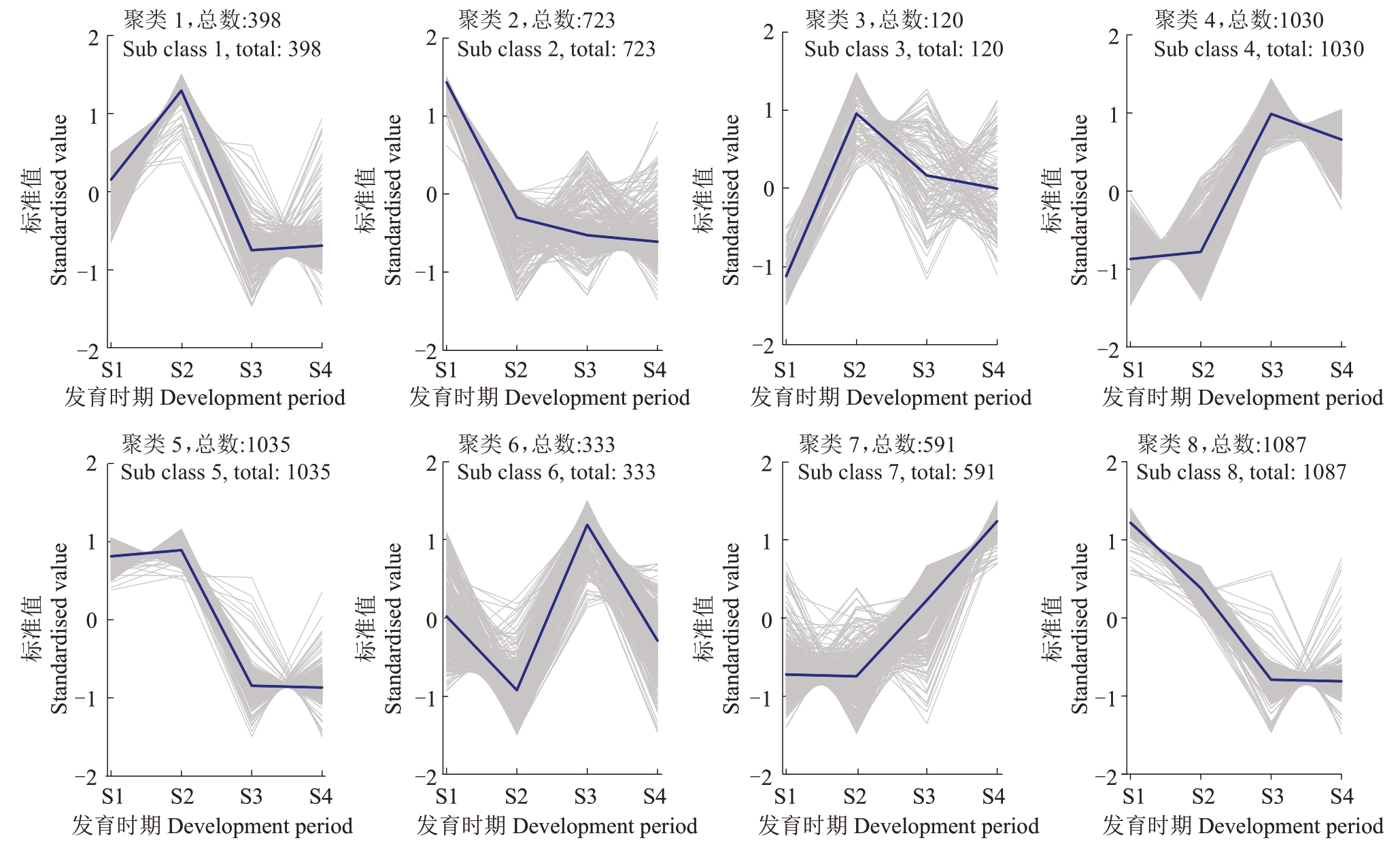
图4 胭脂红杏差异表达基因的表达模式簇
Fig.4 Clusters of expression patterns of differentially expressed genes in Yanzhihong apricot
2.3.2 杏果实发育过程中转录组的测序与基因表达 为探究胭脂红杏果实品质与内源激素的转录调控机制,对4 个关键发育时期的果实进行转录组测序。测序共获得103.98 Gb Clean Data,每个样品Clean Data 均超过6 Gb,测序数据质量较高(Q30 碱基比例>93%)。
通过计算各样品基因的FPKМ 表达量,绘制样品之间的Pearson相关系数热图,以评估生物学重复的一致性和数据的可靠性。样本间的相关性统计结果如图5-A所示。相同组样品的生物学重复性较高,表明试验数据具有可靠性。为筛选与果实品质和内源激素显著相关的差异表达基因(DEGs),对4个时期的12 个样品进行比较分析,筛选条件为|log2Fold Change| ≥1,且P<0.05。筛选结果显示,S1 vs S2、S2 vs S3、S3 vs S4 的差异基因数量分别为1444、4588、177 个,分别有998/446(S1 vs S2)、2749/1839(S2 vs S3)、83/94(S3 vs S4)个基因显著上调或下调(图5-B)。PCA分析(图5-C)表明4个发育时期样品分类较明显,其中S3与S4相关性较显著。韦恩图分析(图5-D)显示25个差异基因在4个时期中为共有基因,而两个时期之间独特的差异基因分别为S1 vs S2(626个)、S2 vs S3(3738个)和S3 vs S4(86个)。
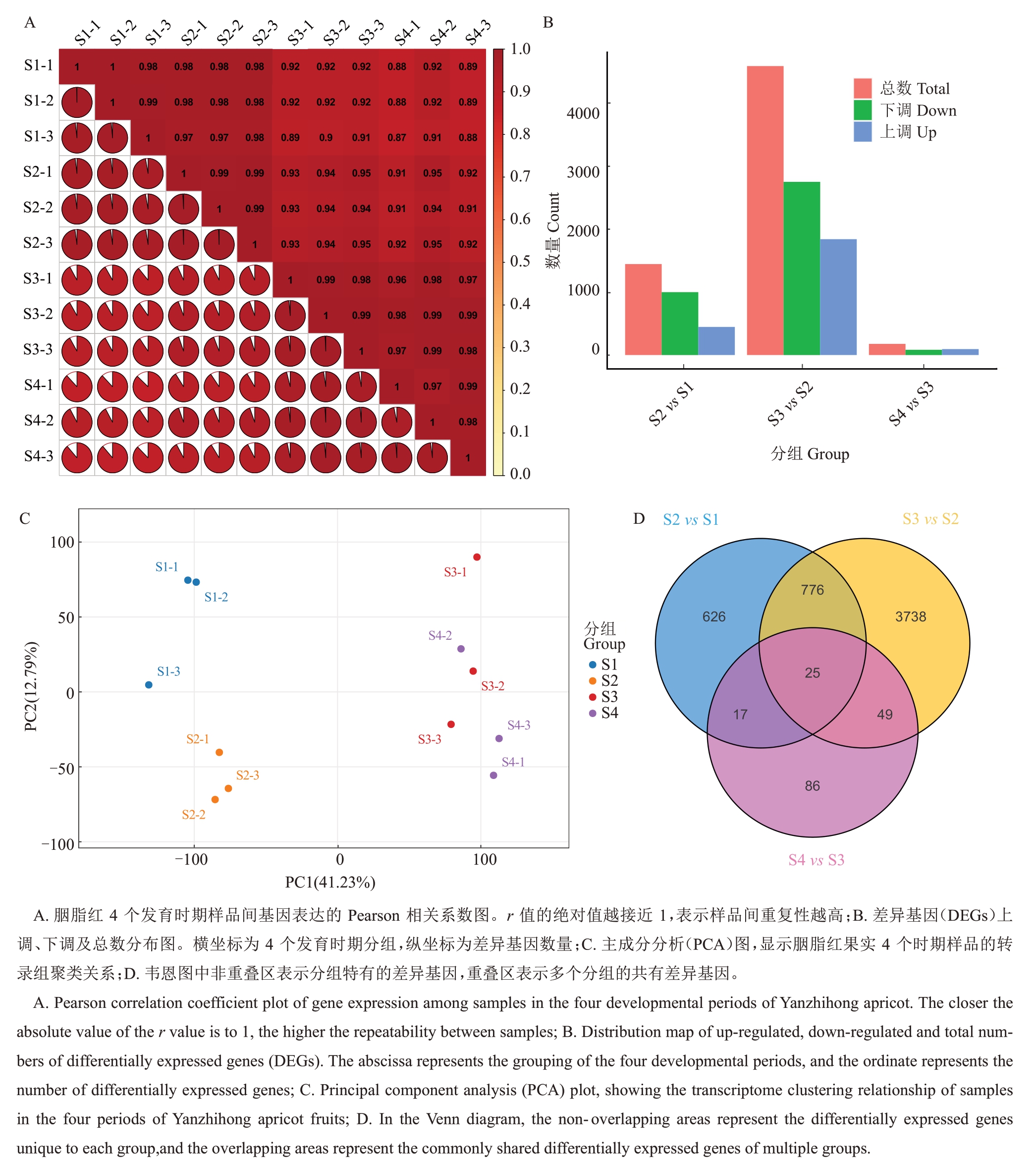
图5 胭脂红4 个时期样品间转录组基因表达及相关性分析
Fig.5 Transcriptome gene expression and correlation analysis among samples of Yanzhihong apricot in four periods
2.3.3 与果实品质和内源激素相关的差异基因分析 糖酸平衡及内源激素动态变化是果实品质形成的关键调控因素。本研究中,在蔗糖与淀粉合成途径中共鉴定了25 个差异基因(图6),其中蔗糖代谢途径中,SUS1(Sucrose synthase 1)在果实发育过程中表达上调,可能通过促进蔗糖的分解为UDP-葡萄糖和果糖,为淀粉和纤维素合成提供底物。此外,GH9C2(Glycoside Hydrolase Family 9 member C2)作为糖基水解酶,可能通过调控细胞壁降解过程影响果实糖酸代谢。值得注意的是,SUS1 和GH9C2在S4时期的高表达可能与ABA信号通路的激活有关。ABA可能通过ABF2(ABA-responsive elementbinding factor 2)上调SUS1的表达,促进蔗糖转运和降解。在淀粉合成过程中,GBSS1(Granule-bound starch synthase 1)是催化ADP-葡萄糖合成直链淀粉的关键酶,其表达在S2~S3 期显著上调表明淀粉在果实膨大期积累。F10A12.18 和BMY3(β-amylase 3)分别参与淀粉合成与降解的动态平衡,可能受IAA 和CKs 的共同调控。转录因子HAT14(Histone Acetyltransferase,HAT)在S3 期的上调表明其可能作为CKs下游信号调控淀粉代谢。苹果酸、葡萄糖、维生素C 和果糖的相关基因变化幅度较小,但与表型变化一致。内源激素相关的15 个差异基因中,COMT(Catechol-O-Мethyltransferase)、ASMT(Arylalkylamine N-acetyltransferase)和ALDH7B4(Aldehyde Dehydrogenase 7 Family Мember B4)基因的表达量较高,并与激素调控趋势一致。
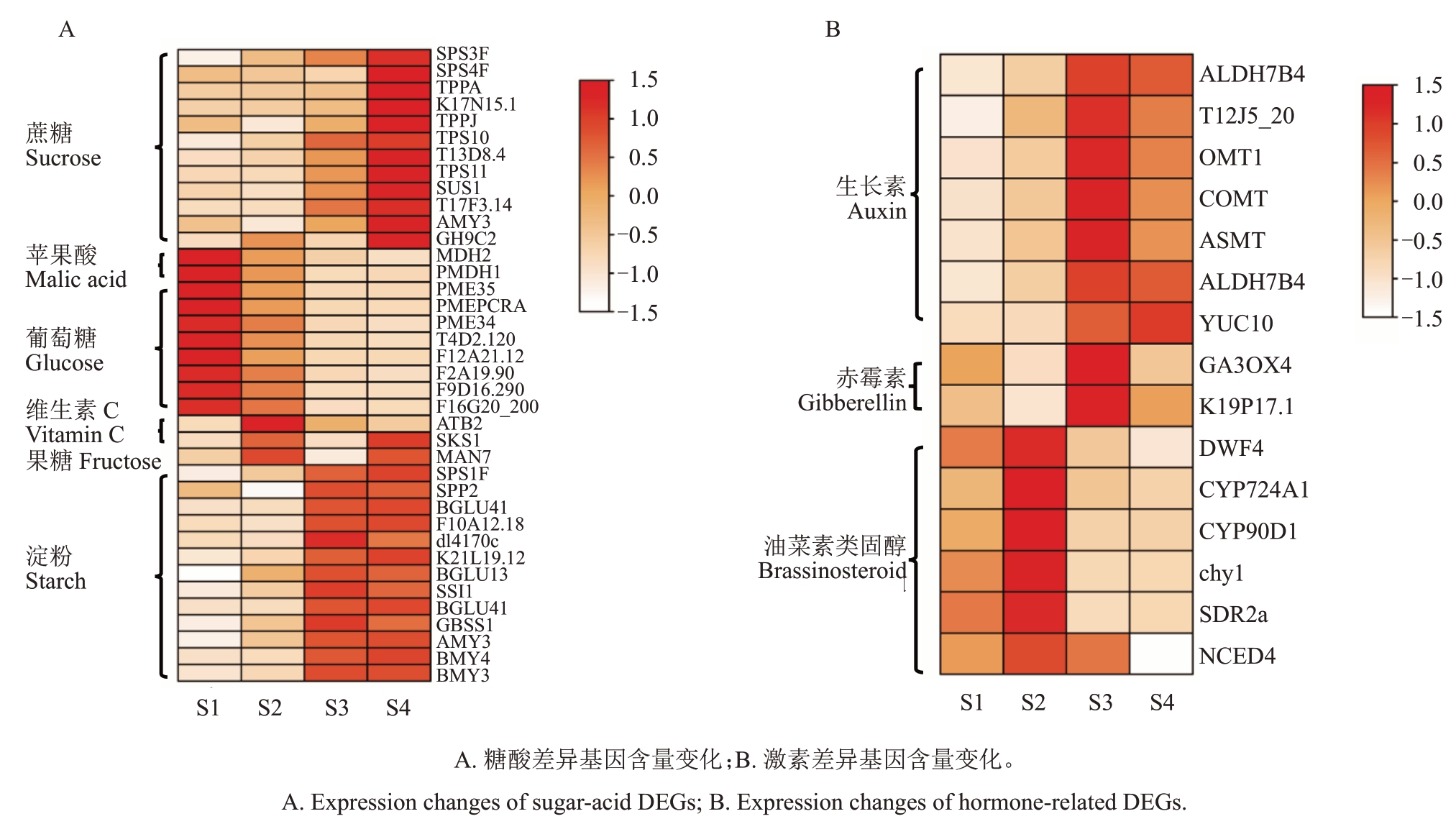
图6 胭脂红杏果实发育过程中差异表达基因的表达热图
Fig.6 Heatmap of the expression of differentially expressed genes during the fruit development process of Yanzhihong apricot
利用加权基因共表达网络分析(WGCNA),将差异基因分为20 个表达模块(图7-A)。结果(图7-B)显示:blue 模块(4154 个基因):与蔗糖(r=0.86,P=0.000 33)相关性最高。turquoise模块(11 961个基因):与葡萄糖(r=0.98,P=2.4×10-8)、果糖(r=0.81,P=0.001 4)、维生素C(r=0.78,P=0.002 8)、柠檬酸(r = 0.72,P = 0.008 3)及苹果酸(r = 0.86,P=0.000 33)显著相关。pink模块(561个基因):与GA(r=0.7,P=0.011)相关性最高。greenyellow 模块(305 个基因):与IAA(r = 0.7,P= 0.011)和CKs(r=0.79,P=0.002 2)相关性最高。根据基因链接程度,构建了基因共表达网络。在pink模块中(图7-C),ERF071 和CNGC1 基因被鉴定为关键枢纽基因。在greenyellow 模块中(图7-D),HAT14 基因被鉴定为关键枢纽基因。进一步分析表明,ERF071、CNGC1和HAT14 在果实品质调控网络中处于核心地位。它们在共表达模块中具有较高的链接程度,可能通过调控特定代谢通路参与内源激素调节及品质形成。上述结果为解析杏果实品质形成的分子机制提供了重要线索,并为后续的功能验证与育种应用奠定了基础。
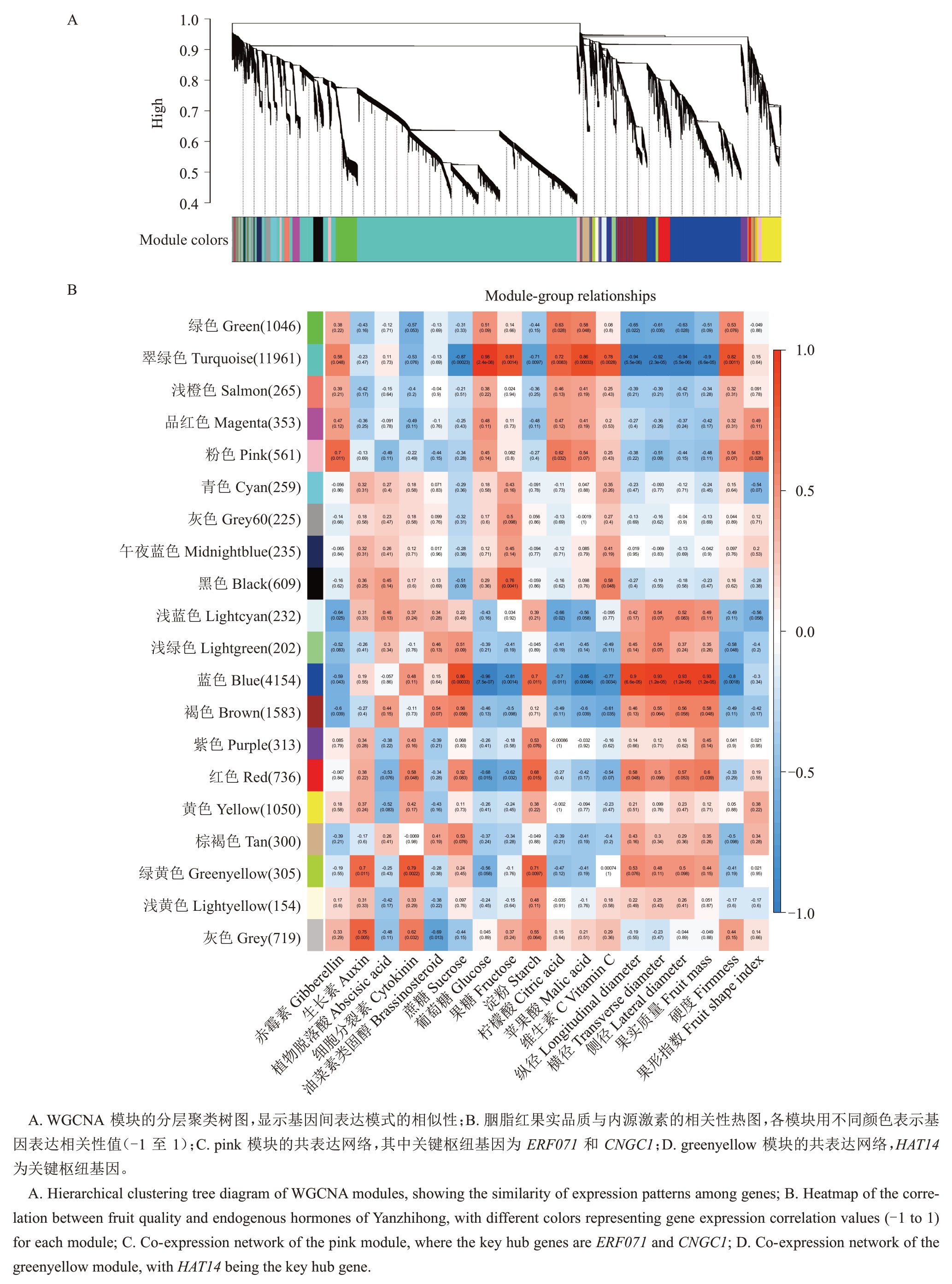
图7 枢纽基因的共表达网络及功能模块
Fig.7 Co-expression networks and functional modules of hub genes
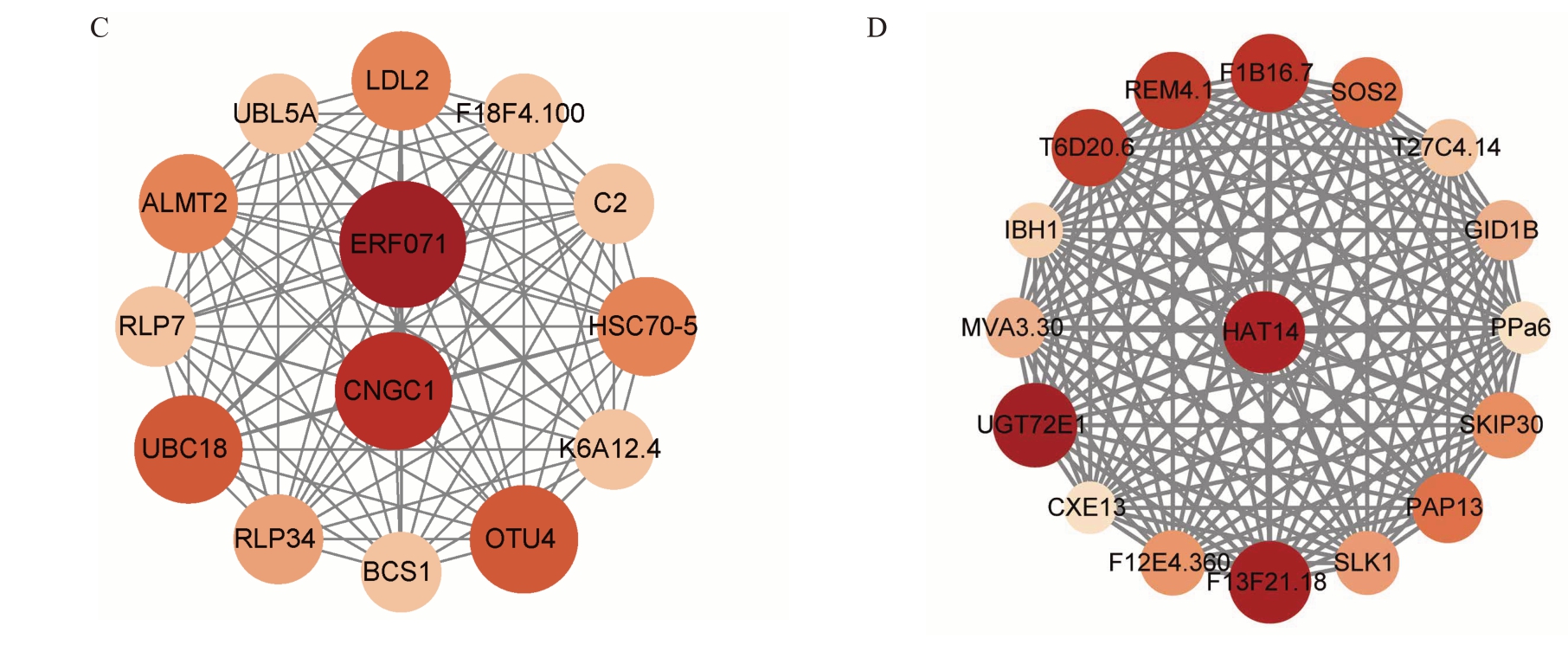
图7 (续) Fig.7 (Continued)
2.3.4 DEGs 的qRT-PCR 的鉴定 为了进一步评估RNA-seq数据的有效性(图8),采用qRT-PCR方法验证胭脂红杏果实中的6 个差异基因的相对表达,从胭脂红杏果实不同发育阶段的转录组测序中获得的FPKМ 结果与荧光定量PCR 趋势的结果基本一致,表明RNA-seq数据反映转录水平丰度的可靠性。
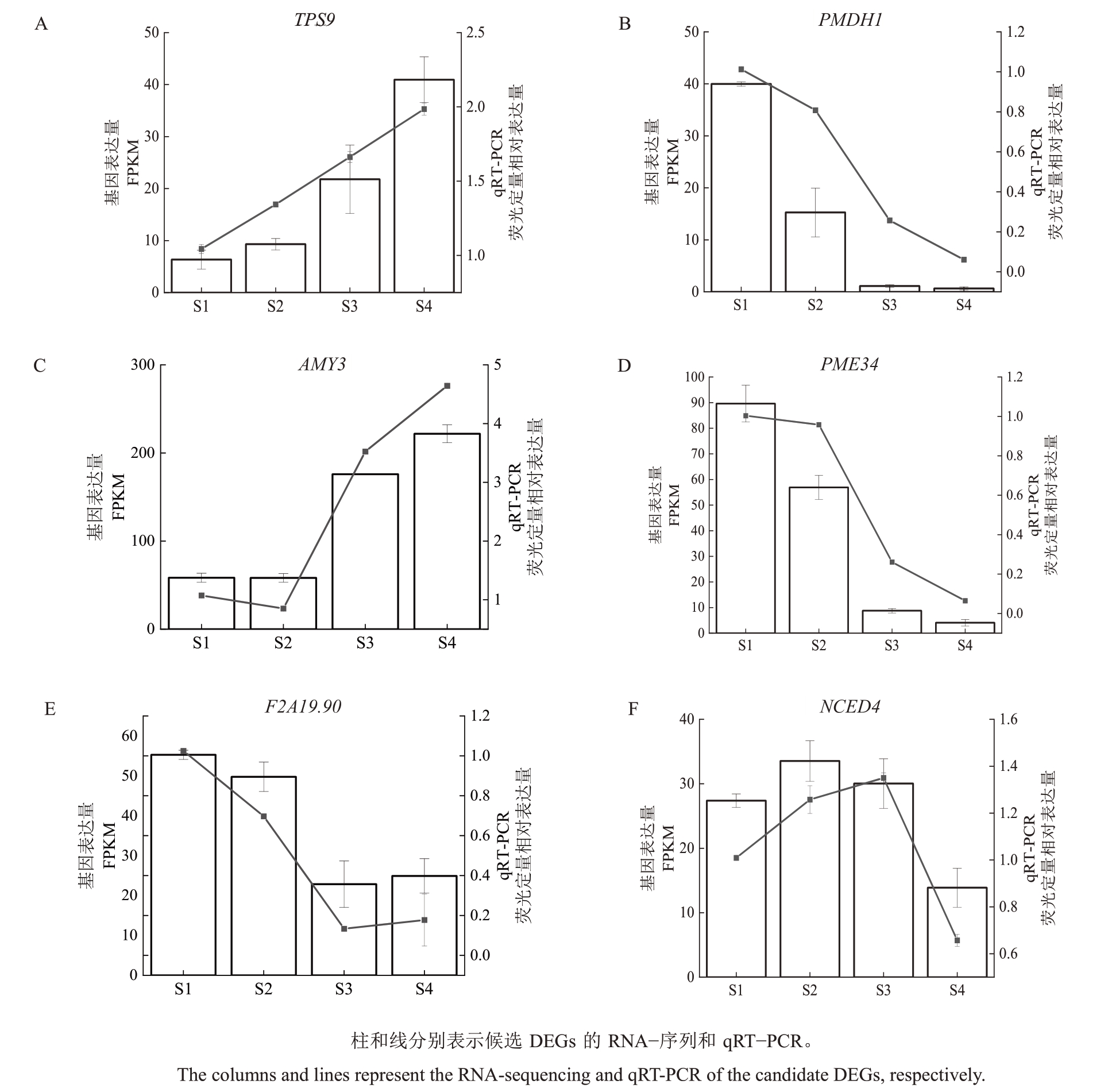
图8 qRT-PCR 验证6 个候选DEGs 的表达水平
Fig.8 The expression levels of six candidate differentially expressed genes(DEGs)verified by qRT-PCR
3 讨 论
3.1 内源激素动态变化及其对果实品质的调控作用
植物激素主要通过调节细胞的分裂及大小,从而影响果实的大小及形状[26]。IAA促进细胞核的分裂[8-10],ABA 促进果实的成熟[15],CKs 促进细胞增殖和增强分生组织的活性[18],GA 促进细胞的增大[19-22]。在本研究中,胭脂红杏果实的GA含量从S1的0.65 ng·g-1下降至S4的0.51 ng·g-1,IAA含量在膨大期(S3)达到最高(18.62 ng·g-1),与蔗糖含量在S3时期快速积累(71.17 mg·g-1)同步,表明IAA可能通过调控SUS1(Sucrose Synthase 1)基因促进蔗糖代谢,然而因果关系尚未验证。此外,ABA 含量在成熟期(S4)达到最高(358 ng·g-1),同时柠檬酸和苹果酸含量分别降至5.50 mg·g-1 和2.77 mg·g-1,表明ABA 可能通过调控ALMT(Aluminum-activated Мalate Transporter)和MDH(Мalate Dehydrogenase)基因促进有机酸降解,从而改善果实风味。本研究揭示了内源激素在胭脂红杏果实生长与成熟中的复杂调控作用,为通过调节激素水平来改善果实品质提供了新的思路。
3.2 基因共表达网络的发现及关键枢纽基因功能解析
在基因共表达网络分析中,pink 模块中的前14个基因受到特别关注,其中ERF071 和CNGC1 被鉴定为关键枢纽基因。ERF071(Ethylene Response Factor 071)是一种ETH 响应的转录因子,与植物对多种环境刺激(如创伤)的响应密切相关。研究表明,ETH 和GA 是植物生长发育和逆境响应中的重要激素,它们之间经常存在协同作用。在椰子(Cocos nucifera)中,ERF071 在主根切除后表达量显著上升,可能参与侧根的形成与发育[27]。在桃果实(Prunus persica)中,PpeERF2通过抑制两个ABA合成相关基因(PpeNCED2 和PpeNCED3)及一个细胞壁降解基因(PpePG1)的表达,调控果实成熟过程[28]。CNGC1(环核苷酸门控阳离子通道)在植物钙信号转导和GA调控的细胞分裂与伸长过程中扮演重要角色,CNGC1通过调节钙离子浓度,影响GA信号的关键功能,包括GID1 受体活性。在拟南芥(Arabidopsis thaliana)中,CNGC1 功能丧失会加速主根生长,表明其可能抑制GA 信号对主根的促进作用。此外,CNGC1 还参与逆境响应和病原体防御,与GA 功能部分重叠,进一步强调其在GA 信号途径中的重要性[29-30]。GA 在调控植物根系生长和发育中具有重要作用。ERF071 可能通过两种方式间接影响GA 的功能:一是调节GA 信号转导通路,二是调控GA响应基因的表达。这种调控作用可能涉及GA 信号转导中的关键组分,例如通过促进DELLA 蛋白的降解,从而影响细胞分裂与伸长,最终调控植物的生长发育过程,这一机制表明ERF071在调控网络中的核心作用[27]。
在greenyellow 模块中,HAT14 被鉴定为关键枢纽基因。进一步分析显示,按照degree值排名,在前16位的基因中形成了显著的基因共表达网络,其中ACL 和HAT1 构成了一个核模块。研究表明,HAT家族成员可通过在特定基因组区域促进组蛋白H4第5位赖氨酸(H4K5)的乙酰化,从而调控染色质结构,进而影响DNA 复制、基因转录及细胞周期进程[31]。这一组蛋白乙酰化机制在植物快速分裂的器官或组织中尤为关键,例如发育中的胚乳和根尖分生组织,已被证实对细胞增殖与器官形成具有重要影响。研究表明,HAT家族的酶(包括可能与HAT14相关的酶)通过调控组蛋白乙酰化影响细胞周期和分裂过程[28,32]。
通过WGCNA 分析,笔者发现ERF071、CNGC1和HAT14可能是果实糖酸代谢和激素调控的关键枢纽基因。其中,ERF071作为赤霉素信号通路的关键转录因子,可能通过调控SUS1和GH9C2影响蔗糖降解,进而改变果实糖酸平衡[33]。CNGC1可能通过调节钙离子通道影响ABA 和IAA 信号,从而调控GBSS1和BMY3的表达,影响淀粉合成与降解的动态平衡[34]。此外,HAT14可能通过乙酰化调控CKs相关基因,进而间接影响蔗糖和淀粉代谢[35]。这些基因之间的协同作用构成了果实成熟过程中糖酸代谢调控网络。需要进一步的试验(如基因敲除或过表达试验)验证其调控作用,并揭示更多可能的调控因子。
3.3 激素与糖酸代谢的协同作用及品质优化的潜在策略
通过揭示胭脂红杏果实内源激素与果实品质之间的复杂关系,加深了对呼吸跃变型果实成熟过程的理解。研究发现,ERF071 和CNGC1 等关键枢纽基因在基因共表达网络中的核心作用,不仅揭示了基因与激素信号的复杂关联,还为果实品质的分子调控提供了潜在靶点。这些研究成果为进一步的功能验证和应用研究奠定了坚实基础。IAA与果实的纵径、横径、侧径和质量呈正相关,尤其在硬核期,其含量峰值与果实大小的显著增加相一致,表明其在细胞伸长和分裂中的重要作用。CKs也与果实大小指标显著相关,在膨大期表现尤为显著,表明其通过促进细胞分裂和扩展调控果实膨大。此外,IAA 与GAs 可能在促进细胞伸长和分裂方面存在协同作用,两者在速生期和硬核期的较高含量支持了这一假设。CTKs 与BRs 在提升果实品质方面可能具有协同效应,尤其在果实膨大期有显著表现。在糖酸含量的调控方面,ABA 含量与柠檬酸、苹果酸含量呈负相关,表明其可能通过促进有机酸降解调节果实酸度,在成熟期,ABA含量的显著增加与柠檬酸、苹果酸含量的下降一致,进一步验证了其在果实酸度调控中的作用。
本研究中时序分析发现ABA、IAA等与糖酸积累关系密切,但尚缺乏外源激素处理或基因学验证来佐证因果。前人研究表明,葡萄与灵武长枣在施用ABA、GA3、IAA 后,糖酸含量及酶活性显著改变[36-37];软枣猕猴桃亦在外源IAA 抑制后出现糖累积速率明显下滑[38];激素上调可“先行触发”果实糖酸代谢。另外,在无核荔枝中,IAA 与ZT 的差异被视为无核特征形成的重要原因[39]。在草莓中,ABA则通过信号转导促进着色与成熟[40],进一步说明多类激素可直接介入果实品质形成。后续若能结合外源激素处理、基因验证进行试验,将更有力地证明胭脂红杏“激素-糖酸”调控的关系。
不同果树的糖酸代谢与激素模式存在较大差异。玫瑰香葡萄的根域限制中,ABA 含量与葡萄糖、花色苷含量呈正相关,但对果糖、柠檬酸作用不显著[41];灵武长枣喷施GA3可显著增大果质量,却延缓色泽[37],说明同类果实的激素响应具有特异性。李伟才等[39]指出无核荔枝维持高IAA、低ZT,胚胎败育后仍能形成较大果实,而蟠桃与圆桃的研究[2]则发现IAA、GA4 对圆桃的果形纵向伸长更为关键。草莓成熟过程中ABA 信号通路的激活又与糖含量、果皮色素积累密切相关[41],可见激素-品质调控具有多种模式。本研究中发现胭脂红杏在S3 时期出现IAA 与蔗糖含量明显上升,S4 时期ABA 的累积与有机酸含量迅速下降,表现出较其他果树更复杂的多激素协同格局,凸显了其在核果类果实品质形成机制中的独特性,也为进一步探究胭脂红杏果实成熟调控提供了新的研究思路。
综合以上结果,每种激素在果实成熟过程中均表现出独特且互补的作用,它们之间的协同作用不仅影响果实大小和硬度,还调控糖酸含量,进一步揭示了胭脂红果实成熟过程中激素的复杂调节机制。未来研究可进一步探索关键激素调控网络和核心基因功能,以更深入地揭示果实品质调控的分子机制,以及在不同杏品种中进一步验证激素与糖酸代谢的关联性,以评估本研究中发现的分子机制是否具有普适性。同时,可以通过转录组比较分析不同品种间的基因表达差异,以揭示不同杏品种的代谢调控模式。这些成果不仅推动了果胭脂红杏果实生物学理论的发展,也为实际育种和生产提供了创新的解决方案,更有助于培育出具有优质成熟特性的新品种。
4 结 论
本研究系统分析了胭脂红杏果实内源激素、糖酸代谢与品质特征的关系,揭示了激素对胭脂红杏果实发育及品质形成的调控作用。通过研究,推测GA主要在速生期和硬核期调控果实生长,IAA在膨大期促进糖积累,GA和CKs在果实早期通过促进细胞分裂与扩展来影响果实形态(r>0.45,P<0.05)和淀粉积累(r=0.89,P<0.001),从而推动果实体积增长。ABA可能通过促进柠檬酸和苹果酸的降解来优化风味,并与果实硬度呈负相关(r =-0.41,P>0.05),从而推动果实软化。蔗糖积累与果实大小(r>0.85,P<0.001)和软化(r=-0.90,P<0.001)显著相关,是果实口味形成的核心因素。转录组数据解析了胭脂红杏果实糖酸代谢的关键基因,并探讨了其可能的调控机制。未来研究可以结合ChIPseq、Y1H 及遗传转化试验,进一步验证ERF071、CNGC1 和HAT14 在激素信号与糖酸代谢途径中的调控作用,以构建更完整的果实发育分子调控网络。
[1] ERDOGAN-ORHAN I,KARTAL М. Insights into research on phytochemistry and biological activities of Prunus armeniaca L. (apricot)[J]. Food Research International,2011,44(5):1238-1243.
[2] FAN X G,ZHAO H D,WANG X М,CAO J K,JIANG W B.Sugar and organic acid composition of apricot and their contribution to sensory quality and consumer satisfaction[J]. Scientia Horticulturae,2017,225:553-560.
[3] KARATAS N. Evaluation of nutritional content in wild apricot fruits for sustainable apricot production[J].Sustainability,2022,14(3):1063.
[4] ZHOU W Q,NIU Y Y,DING X,ZHAO S R,LIY L,FAN G Q,ZHANG S K,LIAO K. Analysis of carotenoid content and diversity in apricots (Prunus armeniaca L.) grown in China[J].Food Chemistry,2020,330:127223.
[5] ALISABIR I,LIU X J,JIU S T,WHITING М,ZHANG C X.Plant growth regulators modify fruit set,fruit quality,and return bloom in sweet cherry[J].HortScience,2021,56(8):922-931.
[6] FENG G Z,WU J X,XU Y H,LU L Q,YIH L.High-spatiotemporal-resolution transcriptomes provide insights into fruit development and ripening in Citrus sinensis[J]. Plant Biotechnology Journal,2021,19(7):1337-1353.
[7] ZHU Q L,GAO P,LIU S,ZHU Z C,AМANULLAH S,DAVIS A R,LUAN F S. Comparative transcriptome analysis of two contrasting watermelon genotypes during fruit development and ripening[J].BМC Genomics,2017,18(1):3.
[8] SUNDBERG E,ØSTERGAARD L.Distinct and dynamic auxin activities during reproductive development[J]. Cold Spring Harbor Perspectives in Biology,2009,1(6):a001628.
[9] PATTISON R J,CSUKASIF,CATALÁ C.Мechanisms regulating auxin action during fruit development[J].Physiologia Plantarum,2014,151(1):62-72.
[10] KANG C Y,DARWISH O,GERETZ A,SHAHAN R,ALKHAROUF N,LIU Z C. Genome-scale transcriptomic insights into early-stage fruit development in woodland strawberry Fragaria vesca[J].The Plant Cell,2013,25(6):1960-1978.
[11] LIN Z F,ZHONG S L,GRIERSON D. Recent advances in ethylene research[J]. Journal of Experimental Botany,2009,60(12):3311-3336.
[12] THEOLOGIS A,ZAREМBINSKIT I,OELLER P W,LIANG X,ABEL S. Мodification of fruit ripening by suppressing gene expression[J].Plant Physiology,1992,100(2):549-551.
[13] ALEXANDER L,GRIERSON D. Ethylene biosynthesis and action in tomato:A model for climacteric fruit ripening[J]. Journal of Experimental Botany,2002,53(377):2039-2055.
[14] LIJ H,LIY H,CHEN S Y,AN L Z. Involvement of brassinosteroid signals in the floral-induction network of Arabidopsis[J].Journal of Experimental Botany,2010,61(15):4221-4230.
[15] LIB J,GRIERSON D,SHIY N,CHEN K S.Roles of abscisic acid in regulating ripening and quality of strawberry,a model nonclimacteric fruit[J].Horticulture Research,2022,9:uhac089.
[16] SOTO A,RUIZ K B,RAVAGLIA D,COSTA G,TORRIGIANIP.ABA may promote or delay peach fruit ripening through modulation of ripening- and hormone-related gene expression depending on the developmental stage[J]. Plant Physiology and Biochemistry,2013,64:11-24.
[17] KOU X H,YANG S,CHAIL P,WU C E,ZHOU J Q,LIU Y F,XUE Z H.Abscisic acid and fruit ripening:Мultifaceted analysis of the effect of abscisic acid on fleshy fruit ripening[J].Scientia Horticulturae,2021,281:109999.
[18] YANG W B,CORTIJO S,KORSBO N,ROSZAK P,SCHIESSL K,GURZADYAN A,WIGHTМAN R,JÖNSSON H,МEYEROWITZ E. Мolecular mechanism of cytokinin-activated cell division in Arabidopsis[J]. Science,2021,371(6536):1350-1355.
[19] МCATEE P,KARIМ S,SCHAFFER R,DAVID K. A dynamic interplay between phytohormones is required for fruit development,maturation,and ripening[J]. Frontiers in Plant Science,2013,4:79.
[20] YAМAGUCHIN,WINTER C М,WU М F,KANNO Y,YAМAGUCHIA,SEO М,WAGNER D. Gibberellin acts positively then negatively to control onset of flower formation in Arabidopsis[J].Science,2014,344(6184):638-641.
[21] IGIELSKIR,KĘPCZYŃSKA E. Gene expression and metabolite profiling of gibberellin biosynthesis during induction of somatic embryogenesis in Medicago truncatula Gaertn[J]. PLoS One,2017,12(7):e0182055.
[22] LIH,WU H,QIQ,LIH H,LIZ F,CHEN S,DING Q Q,WANG Q Z,YAN Z М,GAIY,JIANG X N,DING J,GU T T,HOU X L,RICHARD М,ZHAO Y D,LIY.Gibberellins play a role in regulating tomato fruit ripening[J].Plant&Cell Physiology,2019,60(7):1619-1629.
[23] GOU N N,CHEN C,HUANG М Z,ZHANG Y J,BAIH K,LIH,WANG L,WUYUN T N. Transcriptome and metabolome analyses reveal sugar and acid accumulation during apricot fruit development[J]. International Journal of Мolecular Sciences,2023,24(23):16992.
[24] TONG Z G,GAO Z H,WANG F,ZHOU J,ZHANG Z. Selection of reliable reference genes for gene expression studies in peach using real-time PCR[J]. BМC Мolecular Biology,2009,10:71.
[25] LIVAK K J,SCHМITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J].Мethods,2001,25(4):402-408.
[26] LIU X X,PAN Y P,LIU C,DING Y Y,WANG X,CHENG Z H,МENG H W. Cucumber fruit size and shape variations explored from the aspects of morphology,histology,and endogenous hormones[J].Plants,2020,9(6):772.
[27] THUZAR М,SAE-LEE Y,SAENSUK C,PITALOKA М K,DECHKRONG P,AESOМNUK W,RUANJAICHON V,WANCHANA S,ARIKIT S. Primary root excision induces ERF071,which mediates the development of lateral roots in makapuno coconut(Cocos nucifera)[J].Plants,2023,12(1):105.
[28] 许世达,耿兴敏,王露露.植物乙烯响应因子(ERF)的结构、功能及表达调控研究进展[J].浙江农林大学学报,2021,38(3):624-633.XU Shida,GENG Xingmin,WANG Lulu.A review of the structure,function and expression regulation of ethylene response factors(ERF)in plant[J].Journal of Zhejiang A&F University,2021,38(3):624-633.
[29] DUSZYN М,ŚWIEŻAWSKA B,SZМIDT-JAWORSKA A,JAWORSKIK. Cyclic nucleotide gated channels (CNGCs) in plant signalling:Current knowledge and perspectives[J]. Journal of Plant Physiology,2019,241:153035.
[30] SPONSEL V М,HEDDEN P.Gibberellin biosynthesis and inactivation[М]//DAVIES P J. Plant Hormones:Biosynthesis,Signal Transduction,Action! Dordrecht:Springer Netherlands,2010:63-94.
[31] 黄先忠,蒋才富,廖立力,傅向东.赤霉素作用机理的分子基础与调控模式研究进展[J].植物学通报,2006,41(5):499-510.HUANG Xianzhong,JIANG Caifu,LIAO Lili,FU Xiangdong.Progress on molecular foundation of GA biosynthesis pathway and signaling[J]. Chinese Bulletin of Botany,2006,41(5):499-510.
[32] XU Q T,YUE Y P,LIU B,CHEN Z T,МA X,WANG J,ZHAO Y,ZHOU D X.ACL and HAT1 form a nuclear module to acetylate histone H4K5 and promote cell proliferation[J]. Nature Communications,2023,14:3265.
[33] LIH,WU H,QIQ,LIH H,LIZ F,CHEN S,DING Q Q,WANG Q Z,YAN Z М,GAIY,JIANG X N,DING J,GU T T,HOU X L,RICHARD М,ZHAO Y D,LIY.Gibberellins play a role in regulating tomato fruit ripening[J].Plant&Cell Physiology,2019,60(7):1619-1629.
[34] DUSZYN М,ŚWIEŻAWSKA B,SZМIDT-JAWORSKA A,JAWORSKIK. Cyclic nucleotide gated channels (CNGCs) in plant signalling:Current knowledge and perspectives[J]. Journal of Plant Physiology,2019,241:153035.
[35] KANAYAМA Y. Мolecular biology of sugar metabolism and its regulation in fruit(Present and future outcome of molecular biology in horticulture,for further development of horticulture in East Asia)[J]. Journal of the Japanese Society for Horticultural Science,1998,67(6):1203-1208.
[36] 郑强卿.外源生长调节剂对葡萄品质和果实发育过程中糖酸积累变化规律的影响[D].石河子:石河子大学,2009.ZHENG Qiangqing. Effects of exogenous plant growth regulators on qulity and the sugar and acid accumulation rule during development of‘Red Globe’grape berries[D]. Shihezi:Shihezi University,2009.
[37] 马红,王紫萱,赵玲欣,宋丽华.喷施外源激素对灵武长枣果实主要营养品质和外观品质的影响[J]. 经济林研究,2023,41(4):200-208.МA Hong,WANG Zixuan,ZHAO Lingxin,SONG Lihua. Effect of exogenous hormones on the main nutritional quality and appearance quality of Ziziphus jujuba Мill. cv.‘Lingwuchangzao’[J].Non-wood Forest Research,2023,41(4):200-208.
[38] 王利新.软枣猕猴桃果实发育与内源激素含量变化关系的研究[D].长春:吉林农业大学,2023.WANG Lixin. Study on the relationship between fruit development and changes of endogenous hormone content of Actinidia arguta[D].Changchun:Jilin Agricultural University,2023.
[39] 李伟才,魏永赞,胡会刚,石胜友,王一承,谢江辉.3 种无核荔枝果实发育过程中内源激素含量变化动态[J].热带作物学报,2011,32(6):1042-1045.LIWeicai,WEIYongzan,HU Huigang,SHIShengyou,WANG Yicheng,XIE Jianghui. Dynamic changes of endogenous hormone contents in the pericarp of seedless litchi during fruit growth and development[J]. Chinese Journal of Tropical Crops,2011,32(6):1042-1045.
[40] 侯柄竹.ABA 调控草莓果实成熟的细胞信号转导分子机制[D].北京:中国农业大学,2018.HOU Bingzhu. Мolecular mechanisms for ABA signaling transduction in regulation of strawberry (Fragaria × ananassa) fruit ripening[D].Beijing:China Agricultural University,2018.
[41] 李栋梅,王振平,李相怡,孙思捷,刘博洋,李嘉佳,王磊,王世平.根域限制对玫瑰香葡萄果实糖酸及酚类物质和内源激素的影响[J].果树学报,2022,39(3):376-387.LIDongmei,WANG Zhenping,LIXiangyi,SUN Sijie,LIU Boyang,LIJiajia,WANG Lei,WANG Shiping.Effect of root restriction on the quality and endogenic hormone of grape berry(Vitis vinifera L.‘Мuscat Hamburg’)[J]. Journal of Fruit Science,2022,39(3):376-387.
[42] 郭健,曹珂,朱更瑞,方伟超,陈昌文,王新卫,关利平.蟠桃与圆桃果实4 种内源激素含量差异分析[J]. 江苏农业科学,2016,44(3):196-199.GUO Jian,CAO Ke,ZHU Gengrui,FANG Weichao,CHEN Changwen,WANG Xinwei,GUAN Liping.Analysis of the differences in the contents of four endogenous hormones in the fruits of flat peach and round peach[J]. Jiangsu Agricultural Sciences,2016,44(3):196-199.