矿质养分与植物的生长、发育和繁殖密切相关,是决定植物生产力的关键因素[1]。磷是植物生长发育所必需的大量元素,是最重要的矿质养分之一,也是一种不可再生资源[2]。磷参与了植物能量代谢、光合作用、氧化还原反应、磷酸化/去磷酸化等过程,同时还是生物体膜结构、三磷酸腺苷(ATP)、核酸等重要物质的结构组分,所以磷在植物细胞功能的正常行使和物质组成中发挥着不可替代的作用[3]。无机磷酸盐(Pi)是植物吸收利用磷营养的主要方式,但由于金属离子结合、土壤有机质吸附等原因,大量的磷往往以有机态的形式被固定在土壤中而不能被植物吸收[4],因此土壤中有效磷的缺乏是农业可持续发展的主要限制因素[5]。
在漫长的进化过程中,植物产生了感知、摄取和转运磷的各类蛋白质,其在植物体的定位和转运方式不同,亲和力各异,灵活调节着植物体的磷稳态过程,协助植物更好地适应外界磷含量的变化[6]。磷酸盐转运蛋白家族(PHT)包含PHT1~PHT5 五个亚家族,调控植物对Pi 的摄取、转运以及在各细胞器之间的交流,在植物对Pi的吸收和分配过程中占据核心地位[7]。
PHT1 是目前研究最为深入的磷酸盐转运蛋白,拥有最多的亚家族成员,并在多种植物中保守存在。目前在拟南芥中已经鉴定出9 个PHT1 亚家族成员[6],在水稻中已鉴定出13 个成员[8],它们大多定位于植物根系的细胞质膜,拥有数个跨膜结构域,依赖膜内外H+浓度差完成对无机磷的转运过程[9]。PHT2 家族在拟南芥中仅有AtPHT2;1 一个成员,与哺乳动物Ⅲ型Pi转运蛋白高度同源[10]。研究表明拟南芥AtPHT2;1 定位于叶绿体内膜,介导了Pi 向叶绿体的流入及老叶到新叶的再动员过程[11]。PHT2;1在高Pi 环境下影响植物对外部Pi 的吸收,并以pH依赖的方式行使功能[11]。此外,在马铃薯和水稻中的研究表明,PHT2存在非光合质体定位的可能,并有助于提高植物对紫外线的耐受性[11-12]。PHT3即线粒体磷酸转运蛋白(МPVs),在拟南芥中有AtPHT3;1、AtPHT3;2、AtPHT3;3 三个成员,介导了Pi 向线粒体内的运输,并参与了植物的发育和胁迫响应过程[7,13-14]。PHT4 是一类多定位于质体或高尔基体的磷酸盐转运蛋白,介导了Pi在胞质与许多亚细胞结构间的交流。拟南芥AtPHT4;1和AtPHT4;4定位于叶片叶绿体,atpht4;1突变植株导致矮化表型[15];At-PHT4;2、AtPHT4;3 和AtPHT4;5 定位于植物根/茎质体;AtPHT4;6 定位于高尔基体,介导Pi 从高尔基体向细胞质的转运[16],并参与植株对盐胁迫的耐受性。PHT5 定位于液泡,又称液泡磷转运蛋白(VPT),介导了胞质与液泡间Pi交流,参与植物细胞磷稳态的调节过程[17]。拟南芥AtVPT1 介导Pi 从胞质向液泡流入,调节植物对Pi 含量变化的适应性[18]。此外,草莓和葡萄中的研究表明PHT5还具备糖转运功能,影响植物糖/磷积累和果实品质的形成[17,19]。
PHT 家族作为植物吸收和利用Pi 的主要功能承担者,人们对PHT家族的研究大都集中于模式植物拟南芥或部分粮食作物。目前,对各亚家族间的了解仍然不充分,有关PHT蛋白在园艺植物中的功能尚不明晰。笔者在本研究中通过生物信息学分析方法,筛选鉴定了16 个草莓PHT 家族成员,对其基因结构、染色体定位、编码产物的理化性质等信息进行了分析和预测;同时探究了红颜草莓FaPHT2.1的生物学功能,揭示其作为磷转运体影响植株生长和果实成熟的机制,为果实品质调控和磷营养高效利用相关研究奠定了基础。
1 材料和方法
1.1 植物材料
研究使用的植物材料有八倍体红颜草莓(Fragaria×ananassa Duch.‘Benihoppe’)、拟南芥(Arabidopsis thaliana)和本氏烟草(Nicotiana benthamiana)。所有草莓苗均生长于北京农学院东区温室,温度15~28 ℃,相对湿度70%,光照时间10 h,黑暗时间14 h,无额外补充光照。拟南芥和烟草种子均为实验室留存,生长于22 ℃、16 h时光照和8 h黑暗的植物培养间。
1.2 方法
1.2.1 序列比对与系统进化树构建 二倍体森林草莓(Fragaria vesca)基因组数据库(Fragaria vesca Genome v4.0)来源于GDR 网站(https://www.rosaeae.org/blast/)。拟南芥(Arabidopsis thaliana)基因组数据库来源于NCBI网站(https://www.ncbi.nlm.nih.gov/)。
使用МEGA11 内置的ClustalW 对草莓和拟南芥PHT 家族共38 个成员的氨基酸序列进行多序列比对,聚类方式为邻接法(Neighbor-joining tree),自展值(Bootstrap)为1000,其余参数默认,构建系统发育树。
1.2.2 森林草莓(Fragaria vesca)PHT 家族的生物信息学分析 二倍体森林草莓PHT 家族基因所编码蛋白的理化性质预测由Expasy的ProtParam程序(https://www.expasy.org/resources/protparam/)完成;蛋白亚细胞定位预测在Plant-mPLoc 网站(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)完成;基因染色体定位数据来源于GDR JBrowse(Fragaria vesca Whole Genome v4.0.a2),染色体位置图经由МG2C 在线分析工具完成(http://mg2c.iask.in/mg2c_v2.1/);各基因外显子和内含子展示图由GSDS 在线分析工具完成(https://gsds.gao-lab.org/),基因组序列及相应CDS序列来源于NCBI网站(https://www.ncbi.nlm.nih.gov)。
1.2.3 RNA 提取与RT-qPCR 试验所需植物材料的RNA 提取通过HiPure HP Plant RNA Мini Kit(Мargen,中国)试剂盒完成。基因组DNA的去除及cDNA 合成由Hifair® Ⅲ1st Strand cDNA Synthesis SuperМix for qPCR(gDNA digester plus)(Yeasen,中国)完成。合成的cDNA 作为后续RT-qPCR 反应的模板,草莓材料以FaACTIN 基因(GDR,Fragaria ×ananassa Benihoppe v1.0 transcripts,Fxa6Cg01202-mRNA-1)作为内参,拟南芥材料以AtACTIN2 基因为内参(NCBI,GeneID:821411),反应程序如下:94 ℃预变性30 s,然后94 ℃变性5 s,45 次循环,60 ℃退火15 s,72 ℃延伸10 s(本试验独立3 次重复)。采用2-△△Ct计算基因的相对表达量并采用Bio-RadCFX软件进行分析。本试验所需引物见表1。
表1 试验所需引物序列
Table 1 The primers used for this study

引物名称Primer name FaPHT2.1-F FaPHT2.1-R FaPHT2.1-pRS426-F FaPHT2.1-pRS426-R FaPHT2.1-pRS426-40aa-F FaPHT2.1-pRS426-70aa-F FaPHT2.1-pRS426-cut-R FaACTIN-RT-F FaACTIN-RT-R FaPHT2.1-RT-F FaPHT2.1-RT-R FaPHT2.1-Super1300-F FaPHT2.1-Super1300-R FaPHT2.1-RNAi-F FaPHT2.1-RNAi-R atpht2.1-F atpht2.1-R LBb1.3 AtACTIN2-RT-F AtACTIN2-RT-R引物序列(5'-3')Primer sequences(5'-3')ATGATTCCCTCTTACTGCTTATC TCACAAAACATAGGATAACAGCTTG TTCCTGCAGCCCGGGGGATCCATGATTCCCTCTTACTGCTTATC CTCCACCGCGGTGGCGGCCGCTCACAAAACATAGGATAACAGCTTG TTCCTGCAGCCCGGGGGATCCATG TACTTCCTCAAACCCAAGTCTTCT TTCCTGCAGCCCGGGGGATCC ATG GAAAGCGACGAACACGAAC CTCCACCGCGGTGGCGGCCGCCAAAACATAGGATAACAGCTTGGTC GCCAACCGTGAGAAGATG TCCAGAGTCAAGAACAATACCAG ACTCTCAGCCTGCTTCATGT ACGATTCCAAAACCTCCCCA CTGCAGGGGCCCGGGGTCGACATGATTCCCTCTTACTGCTTATC CATGGTACCGGATCCACTAGTTTATCACAAAACATAGGATAACAGCTTG GGGGACAAGTTTGTACAAAAAAGCAGGCTTCATGATTCCCTCTTACTGCTTATC GGGGACCACTTTGTACAAGAAAGCTGGGTCTCACAAAACATAGGATAACAGCTTG GATGCATATCGACCAAATTGG CTGAAGAAAGGGGATTCCTTG ATTTTGCCGATTTCGGAAC TGTGCCAATCTACGAGGGTTT TTTCCCGCTCTGCTGTTGT
1.2.4 FaPHT2.1 的亚细胞定位 将不含终止密码子的FaPHT2.1全长序列构建于pSuper1300-GFP载体,同时将叶绿体定位的LeCDJ1 蛋白构建于p1300-mCherry 载体。将两重组载体分别转化根癌农杆菌GV3101(携带P19),在本氏烟草叶肉细胞中进行瞬时转化,3 d后通过激光共聚焦显微镜(Leica Stellaris 5,德国)观察荧光蛋白定位。
1.2.5 FaPHT2.1 在酵母中的功能回补验证 将FaPHT2.1的全长编码序列和两个截短序列构建于酵母表达载体pRS426 并转化磷摄取缺陷酵母突变株YP101(pho84Δ pho87Δ pho89Δ pho90Δ pho91Δ)。转化后的酵母细胞在含有1 mmol·L-1 Pi的SG/-Trp/-Ura Broth(Coolaber,中国)合成培养基中进行筛选培养。酵母转化阳性株在含有不同浓度Pi 的培养皿上,30 ℃生长5 d 后观察其生长状况。本试验各菌株于培养皿点斑前,按照OD600为1,1×10-1,1×10-2,1×10-3用无菌水进行梯度稀释,具体方法参照前人文献[20]。
1.2.6 获得FaPHT2.1/atpht2.1 拟南芥恢复材料拟南芥突变体 atpht2.1(At3g26570,SALK_139411C)来源于中国农业大学拟南芥突变体库。对T-DNA 插入atpht2.1 突变体,提取总DNA 进行PCR 鉴定,鉴定引物来自SIGnAL(http://signal.salk.edu/tdnaprimers.2.html)。将pSuper1300:FaPHT2.1-GFP 通过农杆菌转化于拟南芥atpht2.1 突变体,获得T3 代转基因材料后进行后续试验。本试验所需引物见表1。
1.2.7 八倍体红颜草莓果实瞬时转化试验 采用Gateway克隆法获得FaPHT2.1 RNAi载体,其中供体载体为pDONOR221,目的载体为pK7GWIWG2(Ⅱ)。试验所需的所有试剂均来自GatewayTМ BP ClonaseTМ ⅡEnzyme Мix(Invitrogen,美国)。将构建的RNAi 和OE 载体(pSuper1300:FaPHT2.1-GFP)转化农杆菌GV3101,与P19一同注射到白果期草莓果实中。
1.2.8 总磷含量的测定 选取瞬时侵染的FaPHT2.1-OE、FaPHT2.1-RNAi 和对照果实样品各12 个,去除种子,并切取果肉用于后续试验。将切取的草莓样品称质量(0.5~1 g)后置于瓷坩埚中,200 ℃加热30 min,80 ℃烘干10 h至恒质量,最后将坩埚置于马弗炉(SX3-10-13A)中560 ℃处理10 h以确保灰化完全。向坩埚中加入约2 mL 6 mol·L-1 HCl 溶解灰分,再次烘干后加入0.1 mol·L-1 HCl 定容至50 mL。总磷含量用电感耦合等离子体质谱仪测定(ICAP6300 Radial,Thermo Fisher,美国),3 次重复。
1.2.9 可溶性糖含量的测定 可溶性糖含量测定通过反相高效液相色谱(1200 Series,RID1 A detector;Agilent Technologies,美国)完成。本试验使用的色谱柱为Sugar-Pak™I(6.5 mm × 300 mm,5 μm;Waters,美国)。使用的标准样品为D-(+)葡萄糖,D-(-)果糖和蔗糖(Sigma-Aldrich)。具体试验按照前人描述进行[20]。
1.2.10 果实硬度测定 果实硬度通过水果硬度计(FHМ- 5,Takemura Electric Works Ltd,日本)测定,每次取3 个长势相近的草莓果实进行测量,3 次重复。
1.2.11 叶绿素含量测定 拟南芥种子经消毒、4 ℃低温催芽5 d 后点在1/2 МS 平板上并置于22 ℃气候箱培养7 d,而后将发芽的拟南芥幼苗移栽于土壤中,经过14 d生长后,选取长势相近的拟南芥野生株系、突变株系、回补株系各4株,分别采集其3片莲座叶,并利用SPAD-502 chlorophyll meter(KONICA МINOLTA 日本)测定叶绿素含量,各株系每片莲座叶的叶绿素含量作为一个独立样本。
1.2.12 数据统计与分析 使用Prism 软件进行ANOVA 分析,采用Tukey HSD 法进行多重比较,利用Excel作图。
2 结果与分析
2.1 森林草莓PHT基因的系统发育分析
为鉴定二倍体森林草莓(Fragaria vesca)PHT家族基因,利用拟南芥PHT 基因序列在GDR(https://www.rosaceae.org/)森林草莓基因组数据库中BLAST,最终筛选得到了16个候选的草莓PHT家族基因。为了探究草莓PHT 家族的进化关系及潜在功能,基于筛选得到的16 个草莓PHT 及22 个拟南芥PHT 氨基酸序列通过邻接法在МAGA11 中构建了系统发育树(图1)。根据与拟南芥PHT家族蛋白的同源性分析,将草莓PHT 家族分为PHT1~PHT5五大类,相应基因分别命名为FvPHT1.1、FvPHT1.2、FvPHT1.3、 FvPHT1.4、 FvPHT1.5、 FvPHT1.6、FvPHT1.7、 FvPHT1.8、 FvPHT2.1、 FvPHT3.1、FvPHT3.2、FvPHT4.1、FvPHT4.2、FvPHT5.1 和FvPHT5.2。
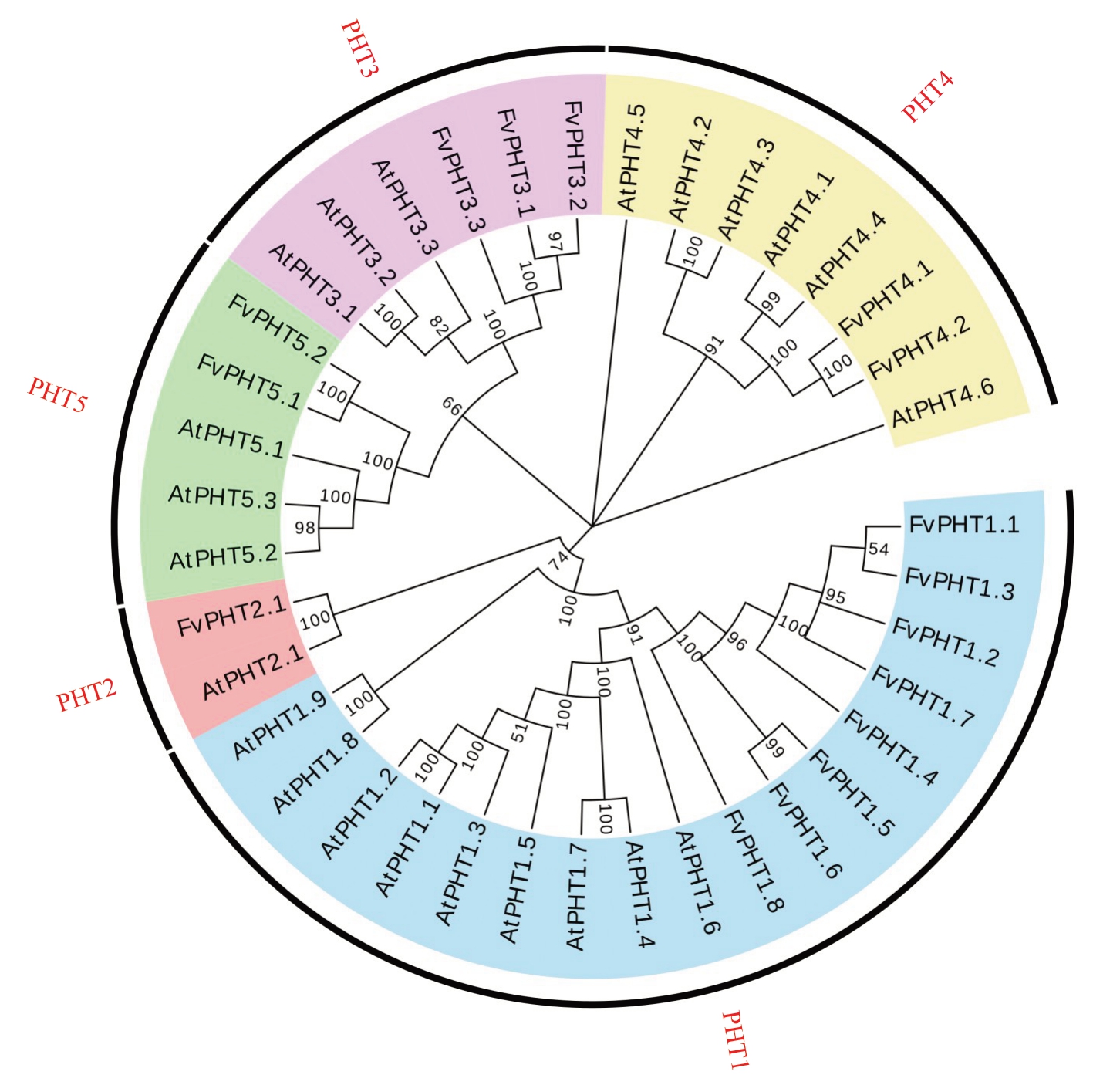
图1 草莓和拟南芥PHT 家族蛋白系统进化树
Fig.1 Phylogenetic evolutionary tree of proteins of the PHT family of strawberry and Arabidopsis
第一大类包括FvPHT1 的8 个成员和AtPHT1的9 个成员;第二大类包括FvPHT2 的1 个成员和AtPHT2 的1 个成员;第三大类包括FvPHT3 的3 个成员和AtPHT3 的3 个成员;第四大类包括FvPHT4的2 个成员和AtPHT4 的6 个成员;第五大类包括FvPHT5的2个成员和AtPHT5的3个成员。在系统发育树中,许多同源蛋白被成对聚集在一起,例如FvPHT5.1 和FvPHT5.2,FvPHT1.5 和FvPHT1.6,以及AtPHT1.4 和AtPHT1.7 等,这种聚集源于序列的高度相似性。这说明两基因可能由某一共同节点进化而来,并在两种植物中承担相似的功能,这为此类基因功能的预测和表征提供了参考。
2.2 森林草莓PHT家族的鉴定及理化性质分析
为了进一步了解二倍体森林草莓PHT 家族蛋白,笔者预测并总结了森林草莓PHT蛋白的理化性质(表2)。FvPHT1~FvPHT5 被预测分别定位于细胞质膜、叶绿体、线粒体、高尔基体和液泡中,这与前人的研究基本一致[9,11,14,16-18]。PHT 家族蛋白的组成氨基酸数为317~720,相对分子质量在34.99~80.44 kDa。其中,FvPHT1 亚家族成员数目最多,FvPHT3亚家族成员相对分子质量较小。相比之下,FvPHT5亚家族成员则具有更多的组成氨基酸数和更高的相对分子质量,高于其他亚家族蛋白,这暗示着它们可能承担了更为复杂的生物学功能。
表2 森林草莓PHT 蛋白基本理化性质预测
Table 2 Prediction of basic physicochemical properties of strawberry PHT proteins
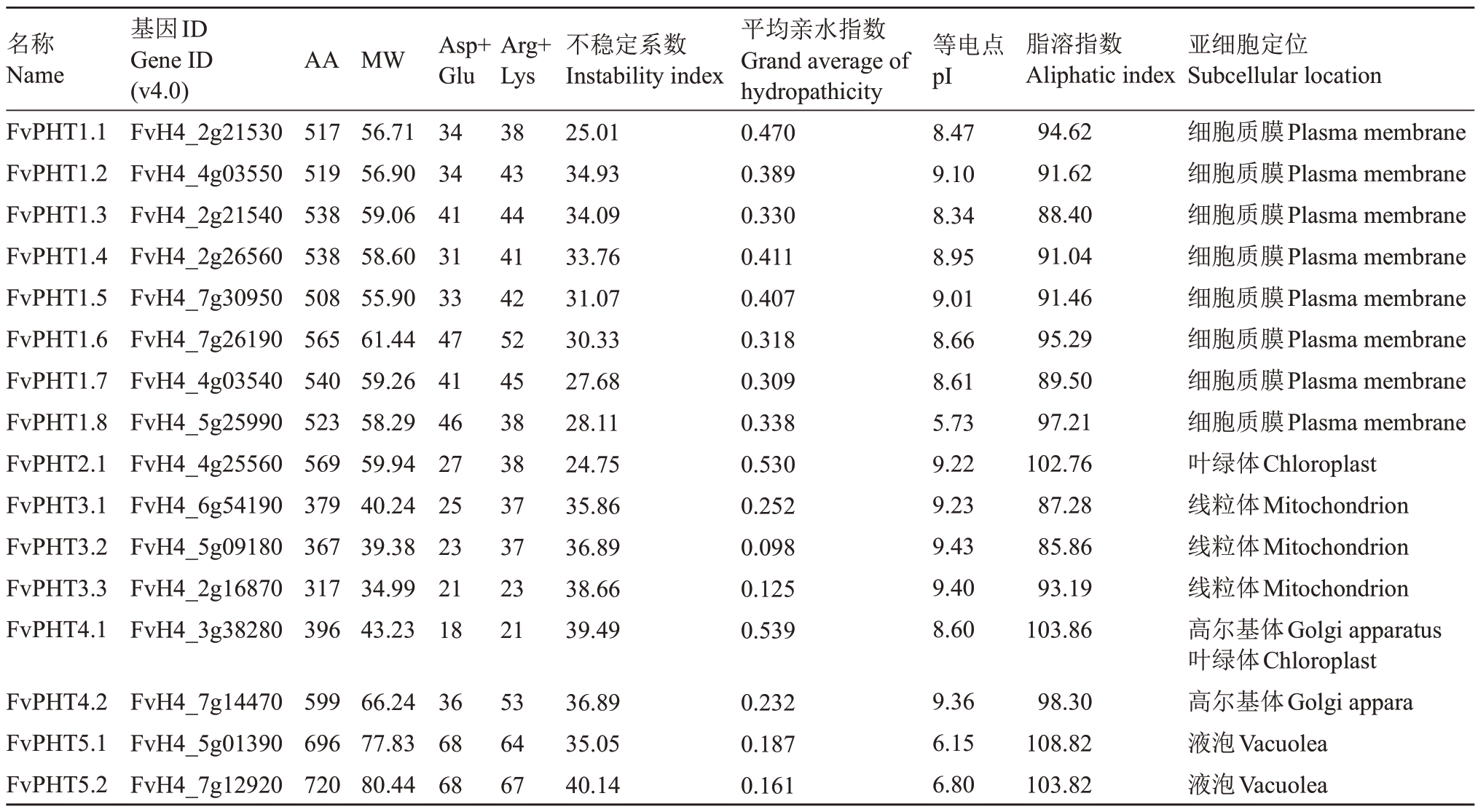
注:AA,氨基酸数;МW,相对分子质量;Asp,天冬氨酸;Glu,谷氨酸;Arg,精氨酸;Lys,赖氨酸。
Note:AA,The number of amino acids;МW,Relative molecular weight;Asp,aspartic acid;Glu,glutamic acid;Arg,Arginine;Lys,Lysine.
名称Name FvPHT1.1 FvPHT1.2 FvPHT1.3 FvPHT1.4 FvPHT1.5 FvPHT1.6 FvPHT1.7 FvPHT1.8 FvPHT2.1 FvPHT3.1 FvPHT3.2 FvPHT3.3 FvPHT4.1基因ID Gene ID(v4.0)FvH4_2g21530 FvH4_4g03550 FvH4_2g21540 FvH4_2g26560 FvH4_7g30950 FvH4_7g26190 FvH4_4g03540 FvH4_5g25990 FvH4_4g25560 FvH4_6g54190 FvH4_5g09180 FvH4_2g16870 FvH4_3g38280平均亲水指数Grand average of hydropathicity 0.470 0.389 0.330 0.411 0.407 0.318 0.309 0.338 0.530 0.252 0.098 0.125 0.539 МW 亚细胞定位Subcellular location细胞质膜Plasma membrane细胞质膜Plasma membrane细胞质膜Plasma membrane细胞质膜Plasma membrane细胞质膜Plasma membrane细胞质膜Plasma membrane细胞质膜Plasma membrane细胞质膜Plasma membrane叶绿体Chloroplast线粒体Мitochondrion线粒体Мitochondrion线粒体Мitochondrion高尔基体Golgi apparatus叶绿体Chloroplast高尔基体Golgi appara液泡Vacuolea液泡Vacuolea AA 517 519 538 538 508 565 540 523 569 379 367 317 396 56.71 56.90 59.06 58.60 55.90 61.44 59.26 58.29 59.94 40.24 39.38 34.99 43.23 Asp+Glu 34 34 41 31 33 47 41 46 27 25 23 21 18 Arg+Lys 38 43 44 41 42 52 45 38 38 37 37 23 21不稳定系数Instability index 25.01 34.93 34.09 33.76 31.07 30.33 27.68 28.11 24.75 35.86 36.89 38.66 39.49等电点pI8.47 9.10 8.34 8.95 9.01 8.66 8.61 5.73 9.22 9.23 9.43 9.40 8.60脂溶指数Aliphatic index 94.62 91.62 88.40 91.04 91.46 95.29 89.50 97.21 102.76 87.28 85.86 93.19 103.86 FvPHT4.2 FvPHT5.1 FvPHT5.2 FvH4_7g14470 FvH4_5g01390 FvH4_7g12920 599 696 720 66.24 77.83 80.44 36 68 68 53 64 67 36.89 35.05 40.14 0.232 0.187 0.161 9.36 6.15 6.80 98.30 108.82 103.82
FvPHT 家族蛋白的理论等电点(pI)分布在5.73~9.43之间,且主要集中在8.00~9.43(表2),更倾向于在中性环境中携带净正电荷,这是由它们所携带的正电荷残基(Arg + Lys)和负电荷残基(Asp +Glu)的数目决定的,这为后续草莓PHT家族蛋白纯化和功能活性研究提供了参考。相比之下,FvPHT5亚家族成员FvPHT5.1和FvPHT5.2的pI分别为6.15和6.80,低于绝大多数FvPHT 家族成员,为酸性蛋白质。FvPHT5 亚家族成员被预测定位于液泡膜,而液泡作为植物细胞中酸性最强的亚细胞结构,FvPHT5 较低的等电点可能体现了其结构与功能的适应性。
不稳定系数与脂溶指数表征了蛋白质的稳定程度,不稳定系数小于40 的蛋白被认为是稳定蛋白[21]。预测得,FvPHT家族蛋白基本均为稳定蛋白,只有FvPHT5.2 的不稳定指数略大于40。此外,平均亲水指数被用于描述蛋白的亲疏水状况,负值表示具有亲水性,正值表示具有疏水性,绝对值越大表示亲水性或疏水性越大[21]。草莓PHT蛋白家族平均亲水指数均为正值,因而被定义为疏水蛋白。
2.3 森林草莓PHT家族基因染色体位置分析
为了确定16 个FvPHTs 基因在染色体上的位置,通过МG2C 在线分析软件(http://mg2c.iask.in/mg2c_v2.1/)绘制了染色体位置图。16个FvPHTs不均匀地分布于草莓6 条染色体上(LG1 不含任何PHT 基因)。其中,LG2 染色体上包含4 个PHT 基因,分别为FvPHT1.1,FvPHT1.3,FvPHT1.4 和FvPHT3.3;LG3、LG6 染色体各有1 个PHT 基因,分别为FvPHT4.1 和FvPHT3.1;FvPHT1.2,FvPHT1.7,FvPHT2.1 位于4 号染色体;FvPHT1.8,FvPHT3.2,FvPHT5.1 定位于5 号染色体;FvPHT1.5,FvPHT1.6,FvPHT4.2,FvPHT5.2 位于7 号染色体(图2)。除此之外,许多基因在染色体上紧密排列,且序列长度和编码产物的理化性质高度相似,例如LG2 染色体的FvPHT1.3 和FvPHT1.1、LG4 染色体的FvPHT1.2 和FvPHT1.7,因此猜测它们存在彼此连锁的可能性。
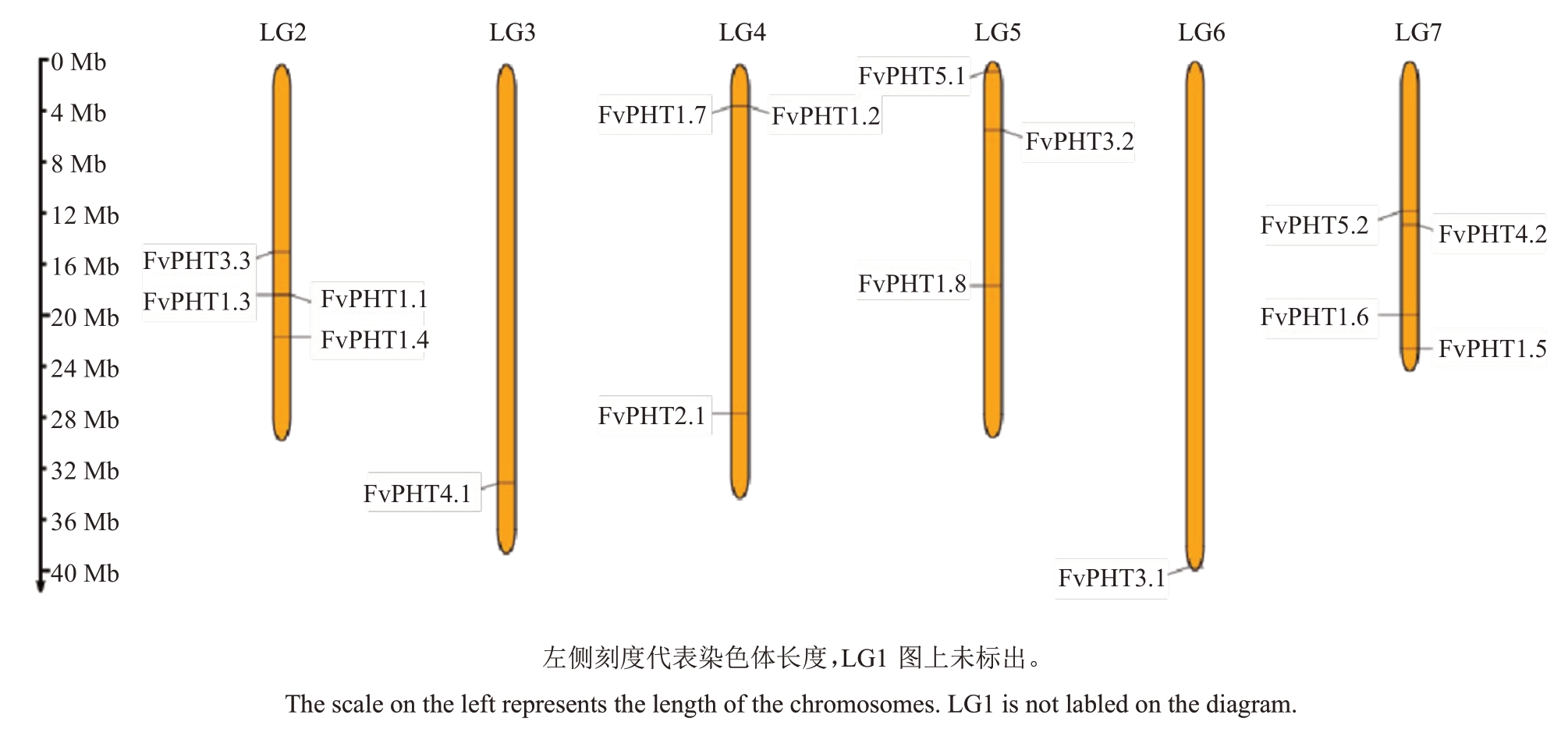
图2 草莓PHT 家族基因染色体定位分析
Fig.2 Chromosome positions for FvPHTs
2.4 森林草莓PHT家族基因结构分析
为了获得更多有关草莓PHTs 家族的信息,对FvPHTs 进行了基因结构分析。结果表明,草莓FvPHT 不同亚家族的基因结构存在显著差异,而同一亚家族成员之间的基因结构相似,这与前面的系统进化分析一致(图1)。例如,大多数FvPHT1具有1 个外显子,所有FvPHT3 均具有6 个外显子和5 个内含子(图3)。同时,各亚家族成员间内含子的相位也高度相似。所有这些结果都表明了每个亚家族成员之间结构的保守性,暗示它们在进化过程中可能具有独特的作用。与此形成鲜明对比的是,不同亚科成员中内含子的数目或相位都有显著差异,这是由不同亚家族的划分标准决定的。
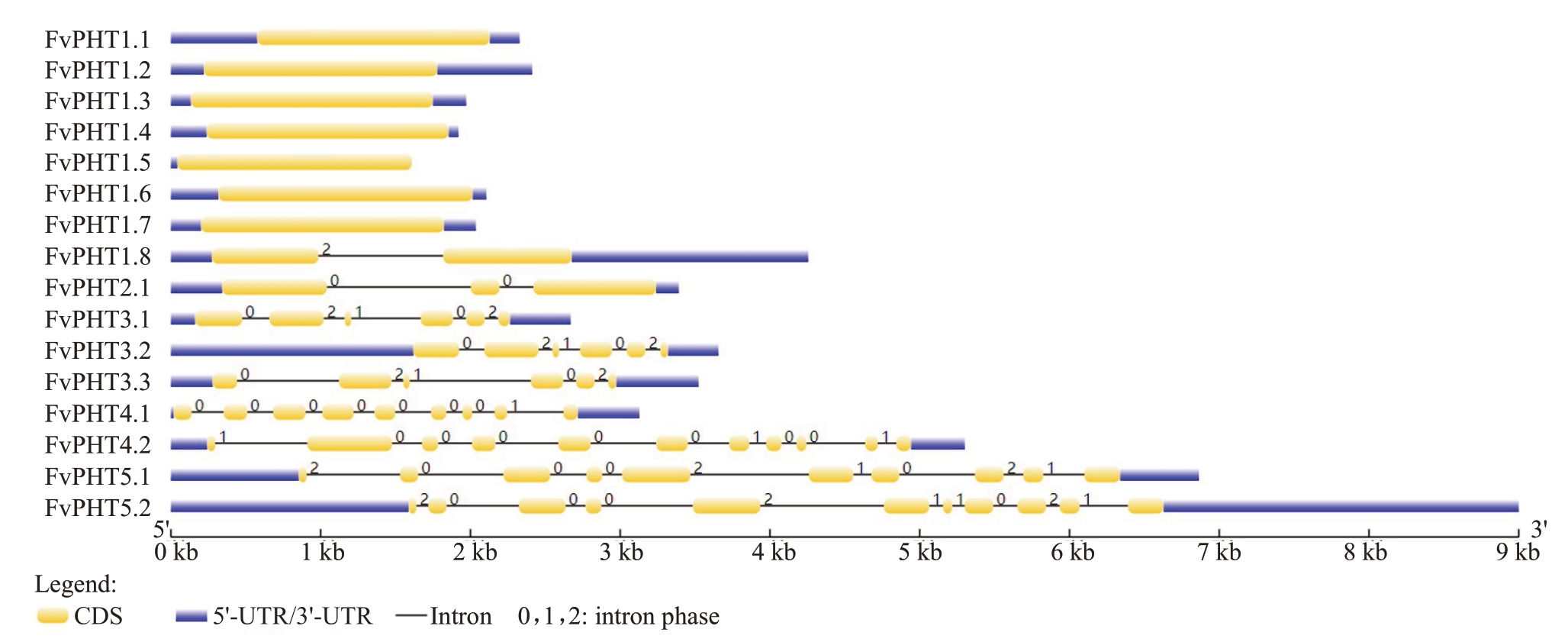
图3 草莓PHT 家族基因结构分析
Fig.3 Gene structure analysis of FvPHTs
2.5 FaPHT2.1基因表达模式和亚细胞定位分析
二倍体森林草莓FvPHT2.1 作为唯一被预测定位于叶绿体的无机磷转运体,可能对植株生长和果实发育起重要作用。为了探究草莓PHT2.1的功能,笔者利用二倍体森林草莓FvPHT2.1 的序列进行BLAST,发现八倍体栽培草莓中有4个同源基因,其中Fxa4Dg02130 与FvPHT2.1 同源性为97.08%,且在果实转录组数据中表达量最高,因此,笔者将其命名为FaPHT2.1(图4-A)。为探究FaPHT2.1 的表达模式,笔者检测了FaPHT2.1 在八倍体草莓根、茎、叶、花4 个部位及果实7 个不同发育阶段(小绿期SG、大绿期LG、褪绿期DG、白果期WT、始红期IR、片红期PR、和全红期FR)的表达水平。结果表明,FaPHT2.1在草莓大绿期果实中表达量最高,叶、花、茎次之,在根中几乎不表达,且其在果实中表达水平随草莓成熟过程不断降低(图4-B)。
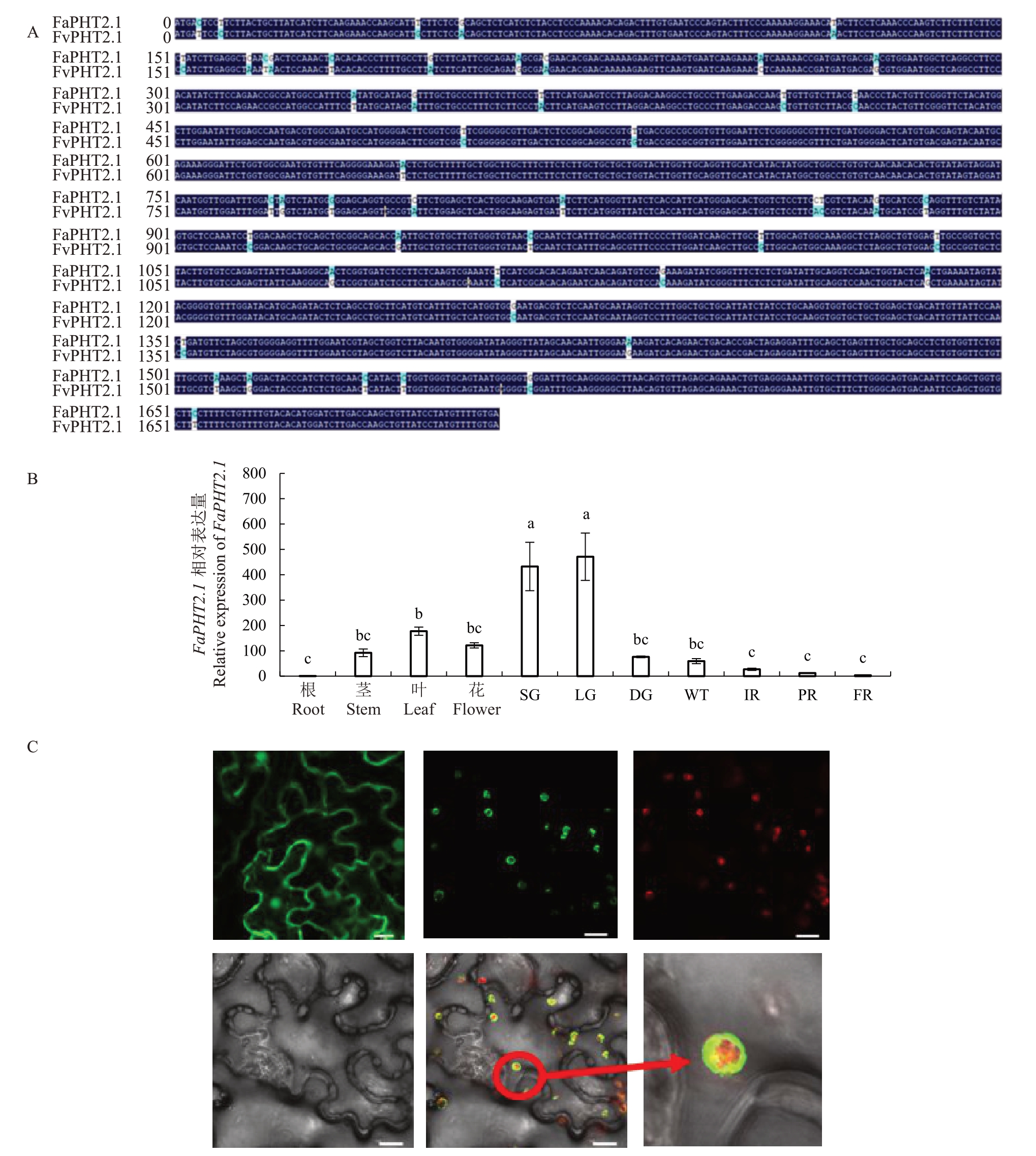
图4 FvPHT2.1 与FaPHT2.1 序列差异、FaPHT2.1 的表达模式和亚细胞定位
Fig.4 Sequence Differences between FvPHT2.1 and FaPHT2.1,Expression pattern and subcellular localization of FaPHT2.1
A.草莓FaPHT2.1 与FvPHT2.1 的CDS 序列比对。B.草莓不同组织/器官、不同果实发育阶段FaPHT2.1 的相对表达水平(平均值±标准误)。小绿期(SG),大绿期(LG),褪绿期(DG),白果期(WT),始红期(IR),片红期(PR),全红期(FR),P <0.05,n=3;C.FaPHT2.1-GFP 在烟草中的亚细胞定位。如图所示,从左到右依次为pSuper1300-GFP 空载体、GFP 信号(绿色)、mCherry 信号(红色)、明场、叠加图像、叶绿体放大图像。LeCDJ1 为叶绿体marker。标尺为15 μm。
A.Alignment of the CDS sequences between FaPHT2.1 and FvPHT2.1 in strawberry; B. Relative expression levels of FaPHT2.1 in different tissue/organs and different stages of fruit development(Мean±SE).small green(SG),large green(LG),degreening(DG),white(WT),initial red(IR),partial red(PR),and full red(FR).p <0.05,n=3;C.Subcellular localization of FaPHT2.1-GFP in Nicotiana benthamiana.As shown in the above figure,from left to right are pSuper1300-GFP empty vector,the GFP signal(green),the mCherry signal(red),the bright field image,an overlay image,and magnified chloroplast image.LeCDJ1 is a chloroplast marker.Bars,15 μm.
为了进一步研究FaPHT2.1的亚细胞定位,笔者构建了FaPHT2.1-GFP融合蛋白表达载体,并通过农杆菌介导的瞬时转化将其与叶绿体定位marker LeCDJ1-mCherry 在烟草叶肉细胞共表达,于3 d 后在激光共聚焦显微镜下观察叶片发光情况。如图4-C 所示,FaPHT2.1-GFP 绿色荧光与LeCDJ1-mCherry的红色荧光在叶绿体共定位,证明FaPHT2.1定位于叶绿体,这与拟南芥PHT2.1的定位相似[10-11]。
2.6 FaPHT2.1无机磷转运活性检测
前人的研究表明,拟南芥、马铃薯和水稻中的PHT2 是低亲和力的Pi 转运蛋白[11-12]。本研究以pRS426:FaPHT2.1 转化Pi 转运体缺陷酵母突变株YP101,验证草莓FaPHT2.1 是否具有类似的功能。同时,也将空质粒pRS426转化到酵母突变体中作为阴性对照。如图5所示,与野生型酵母菌株(WT)相比,用空质粒转化的酵母菌株在外补不同浓度Pi的培养基上表现出生长缺陷,而转化FaPHT2.1的酵母菌株与阴性对照相比表现出明显的生长恢复现象。此外,前人文献报道截短PHT2.1的N端序列可能增强其在酵母中的Pi 转运活性[10]。因此,笔者还构建了两种截短形式的PHT2.1,分别截短FaPHT2.1 N端的前40 和70 个氨基酸。结果表明,全长FaPHT2.1 和两个截短形式的FaPHT2.1 重组菌株(FaPHT2.141-569和FaPHT2.171-569)都能部分恢复突变体菌株的生长缺陷,生长趋势没有明显差别。随着外补Pi 浓度的降低,FaPHT2.1 恢复效果逐渐减弱。综上所述,FaPHT2.1具备低亲和Pi转运蛋白活性。

图5 FaPHT2.1 无机磷转运活性检测
Fig.5 Detection of inorganic phosphorus transport activity of FaPHT2.1
FaPHT2.1 为pRS426:FaPHT2.1 转化YP101 的酵母菌株;EV 为pRS426 载体转化YP101 的酵母菌株;FaPHT2.141-569 和FaPHT2.171-569 则分别代表FaPHT2.1 两个截短构建于pRS426 载体后转化入YP101 得到的两个酵母株系。各菌株依照OD600 值为1,0.1,0.01,0.001 依次稀释后点斑于培养基。
FaPHT2.1 is the yeast strain YP101 transformed by pRS426; EV is the yeast strain YP101 transformed by pRS426 vector; FaPHT2.141-569 and FaPHT2.171-569 represent the two yeast lines obtained from YP101 transformed by two truncated FaPHT2.1. Strains were diluted to OD600 values of 1,0.1,0.01 and 0.001 on the plates.
2.7 FaPHT2.1转基因拟南芥表型分析
以拟南芥atpht2.1 突变体为基础,利用含GFP的过表达载体构建了FaPHT2.1 OE 转化atpht2.1 的稳定遗传株系FaPHT2.1/atpht2.1,以明确FaPHT2.1对植物生长发育的影响。首先,用三引物法在DNA水平对转基因材料进行了鉴定。结果显示,用At-PHT2.1 基因引物扩增时,野生型株系(WT)中存在基因条带,而atpht2.1和FaPHT2.1/atpht2.1株系中不存在。用T-DNA 插入引物扩增时,WT 无条带,而atpht2.1和FaPHT2.1/atpht2.1有条带,说明拟南芥atpht2.1 和FaPHT2.1 回补株系中的T-DNA 仍然存在(图6-A)。如图6-B所示,植物生长表型观察发现与WT相比,atpht2.1株系较矮小,而FaPHT2.1/atpht2.1两株系与WT无明显差异。体视荧光显微镜检测发现FaPHT2.1/atpht2.1 株系可见GFP 绿色荧光(图6-C)。RNA 水平检测发现FaPHT2.1 在FaPHT2.1/atpht2.1 株系中有明显表达,而在WT 和atpht2.1 株系中基本未检出(图6-D)。FaPHT2.1/atpht2.1 的鲜重与WT 无明显差异,显著高于atpht2.1 突变体(图6-E),与拟南芥生长表型观察结果一致,说明FaPHT2.1 成功转入atpht2.1 突变体,且能恢复突变体的生长表型。
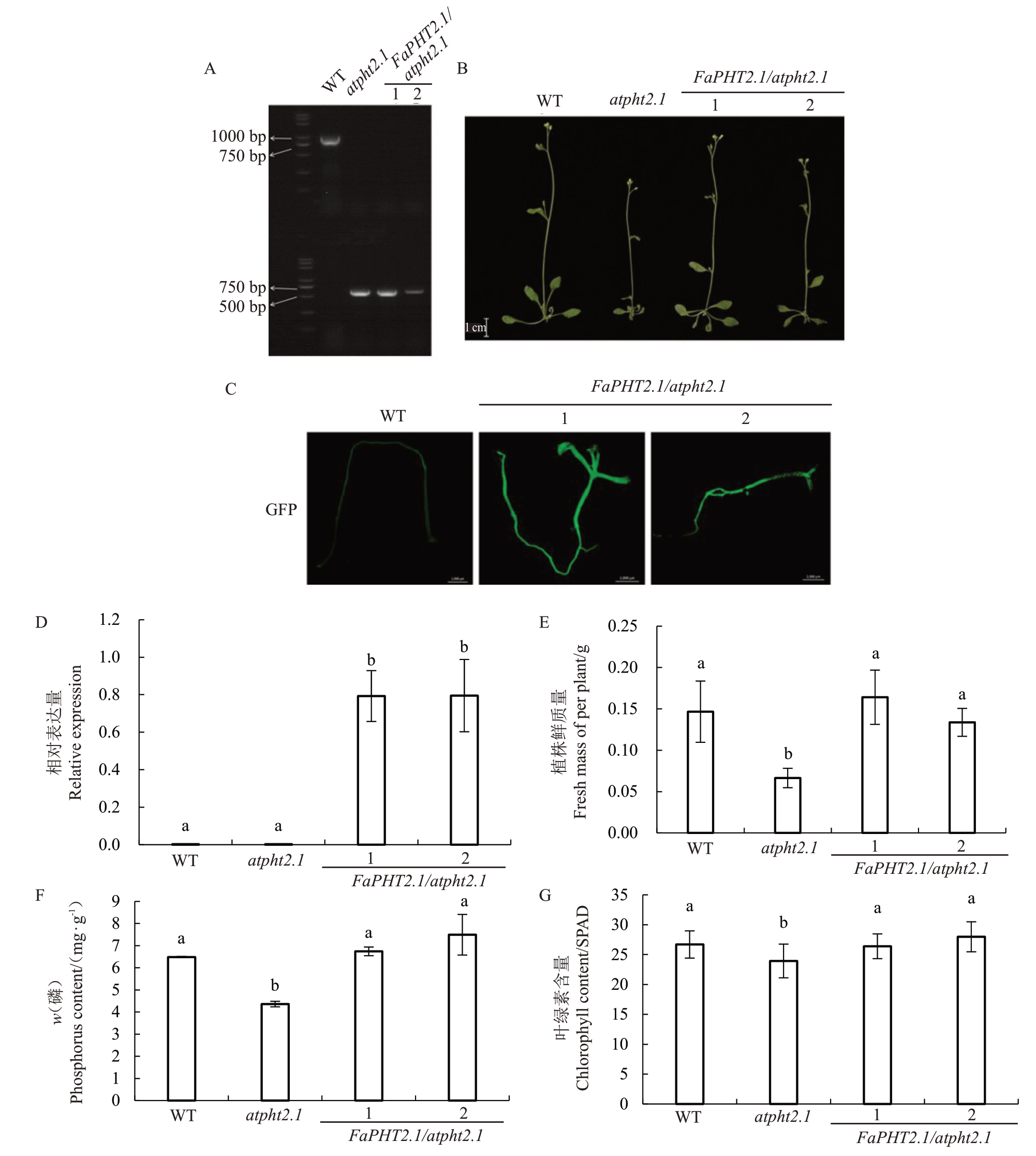
图6 草莓PHT2.1 转基因拟南芥表型分析
Fig.6 Phenotype analysis of FaPHT2.1 transgenic Arabidopsis
A.野生型WT(第二泳道)、含有T-DNA 插入的突变株系atpht2.1、FaPHT2.1/atpht2.1 转基因材料中T-DNA 插入的鉴定。泳道1 为2Kplus marker(全式金,中国);B.WT,atpht2.1 和FaPHT2.1/atpht2.1 拟南芥的生长状况;C.转基因拟南芥FaPHT2.1/atpht2.1 的荧光观察,图上标尺为2 mm;D.FaPHT2.1 在WT、atpht2.1、FaPHT2.1/atpht2.1 拟南芥中的相对表达量(平均值±标准误);E-G(平均值±标准误).WT、atpht2.1 和FaPHT2.1/atpht2.1 拟南芥的鲜质量(E),磷含量(F),叶绿素含量(G)。WT,野生型;atpht2.1,拟南芥突变体;FaPHT2.1/atpht2.1,转化了FaPHT2.1 的atpht2.1 拟南芥突变体。P <0.05,n≥3。
A.The detection of T-DNA insertion in WT(lane 2),atpht2.1 mutant and FaPHT2.1/atpht2.1.Lane 1 shows the 2K-plus marker(TransGene,China).B. Growth phenotype of WT, atpht2.1 mutant and FaPHT2.1/atpht2.1. C. Fluorescence observation of FaPHT2.1/atpht2.1 transgenic Arabidopsis.Bars,2 mm.D.Relative expression level for FaPHT2.1 in WT,atpht2.1 mutant and FaPHT2.1/atpht2.1(Мean±SE).E-G(Мean±SE).Fresh mass(E), phosphorus content (F), and chlorophyll content (G) in WT, atpht2.1 mutant and FaPHT2.1/atpht2.1. WT, the wild type; atpht2.1, the homozygous mutant for AtPHT2.1;FaPHT2.1/atpht2.1,two atpht2.1 mutants transformed with FaPHT2.1 overexpression.P <0.05,n≥3.
为了验证叶绿体定位的FaPHT2.1 是否影响植物的磷积累,对拟南芥材料进行了总磷含量的测定。结果表明,atpht2.1 突变体的磷含量显著低于WT 和FaPHT2.1/atpht2.1 两株系(图6-F),这表明FaPHT2.1 促进植物磷的积累。同时,也检测了FaPHT2.1对叶绿素含量的影响。FaPHT2.1/atpht2.1两株系的叶绿素含量显著高于atpht2.1 突变体,与WT无显著差异(图6-G)。这表明FaPHT2.1在功能上弥补了AtPHT2.1的缺失,并作为叶绿体磷转运体在植株生长中发挥了重要作用。
2.8 FaPHT2.1瞬时转基因草莓果实表型分析
由于无机磷(Pi)参与植物糖代谢过程,影响果实成熟和品质的形成[17,19-20],推测FaPHT2.1 表达的变化可能导致草莓果实成熟和品质的变化。为了验证这一假设,利用农杆菌介导的瞬时转化方法侵染了白果期的八倍体红颜草莓,获得了过量表达(OE)、对照(Control)和RNA 干扰(RNAi)瞬时转基因草莓果实,每2 d 进行1 次表型观察,并取瞬时转化7 d后的草莓果实进行了成熟和品质形成相关生理指标的测定。虽然已有研究表明磷营养与植物花青素合成关系密切,但在FaPHT2.1瞬时转基因草莓果实中未观察到明显的颜色变化。荧光定量RT-qPCR结果显示在草莓果实中成功操纵了FaPHT2.1的表达(图7-A)。与对照相比,RNAi草莓果实磷含量显著降低,而OE 草莓果实中磷含量显著升高(图7-B),说明FaPHT2.1正调控草莓果实磷积累。
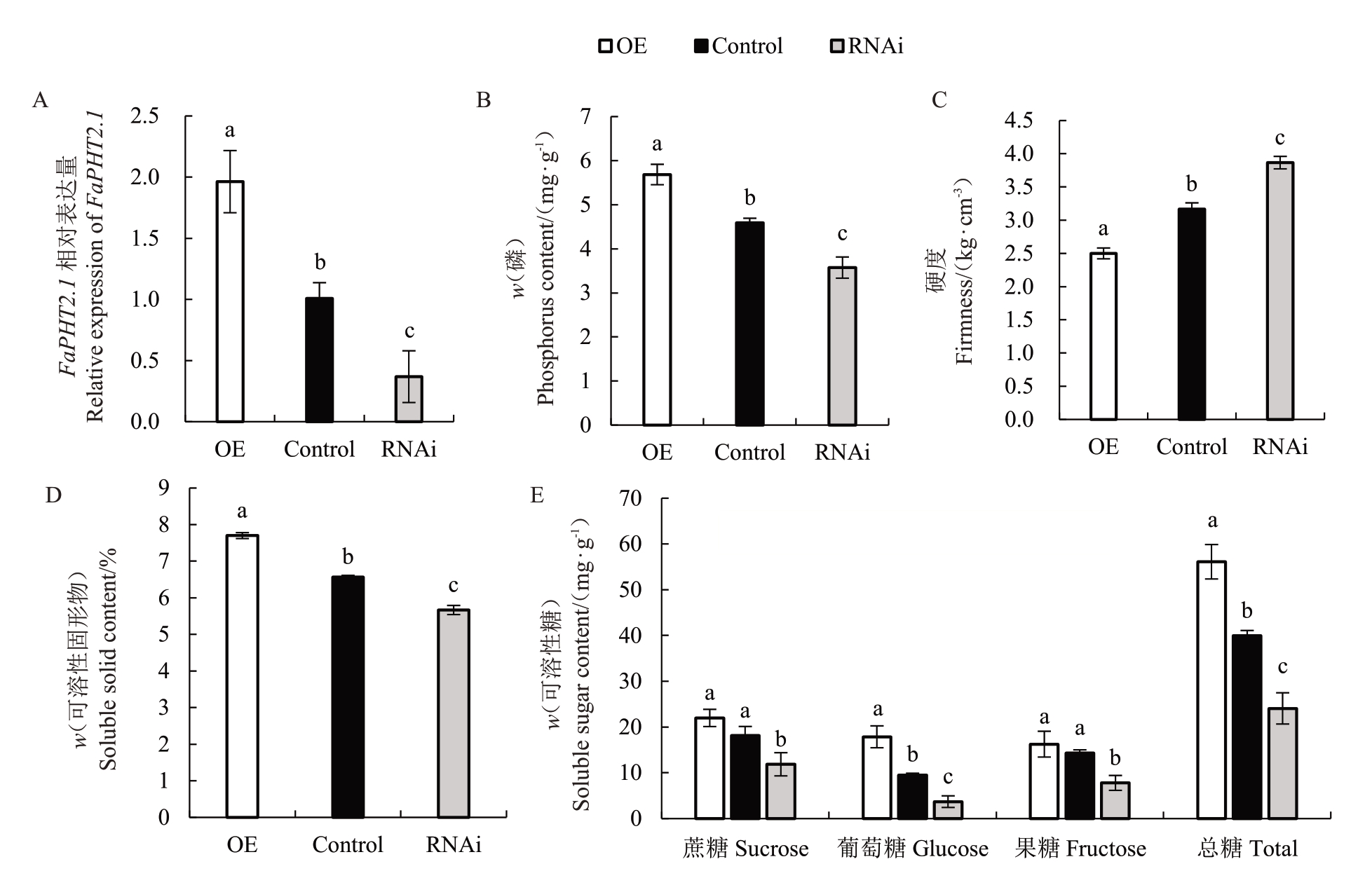
图7 草莓FaPHT2.1 转基因果实生理指标检测
Fig.7 Physiological Index Assessment of FaPHT2.1 transgenic strawberry fruits
A.FaPHT2.1 的相对表达水平(平均值±标准误);B.磷含量(平均值±标准误);C.果实硬度(平均值±标准误);D.可溶性固形物含量(平均值±标准误);E.可溶性糖含量(平均值±标准误)。OE.瞬时转化FaPHT2.1-过表达重组质粒的草莓果实;Control.正常草莓果实;RNAi.瞬时转化FaPHT2.1-RNA 干扰重组质粒的草莓果实。P <0.05,n=3。
A.Relative expression level of FaPHT2.1(Мean±SE);B.Phosphorus content(Мean±SE);C.Fruit firmness(Мean±SE);D.Soluble solids content(Мean±SE);E.Soluble sugar content(Мean±SE).OE.The strawberries transiently transformed with the overexpression FaPHT2.1 recombinant plasmid;Control.Normal strawberries;RNAi.The strawberries transiently transformed with the RNA interference FaPHT2.1 recombinant plasmid.P <0.05,n=3.
进一步检测了果实硬度以评估果实成熟软化的变化。结果表明,与对照相比,RNAi 果实硬度显著大于对照,OE果实硬度显著低于对照(图7-C)。值得注意的是,FaPHT2.1的表达影响了草莓果实的糖含量,OE 果实中可溶性固形物含量显著增加,而RNAi 果实可溶性固形物含量显著降低(图7-D)。可溶性糖含量分析结果表明,三种果实的可溶性糖含量存在显著差异。OE 果实中葡萄糖含量显著高于对照,而RNAi果实中蔗糖、果糖和葡萄糖含量均显著低于对照(图7-E)。OE果实的可溶性糖总量高于对照果实,而RNAi果实可溶性糖总量低于对照,说明FaPHT2.1 对果实糖积累起促进作用。上述结果表明FaPHT2.1通过影响果实硬度和糖、磷的积累调控果实成熟和品质形成。
3 讨 论
土壤中的磷酸盐易被黏土和有机质迅速吸附、被阳离子沉淀或被土壤微生物转化为有机磷[4]。这导致土壤中无机磷减少,而无机磷是可被植物直接吸收利用的有效磷。因此,土壤有效磷的缺乏是限制植物生长发育的主要因素之一[22]。磷素营养的吸收与转运需要一系列具有磷转运活性的蛋白完成[23-25]。PHT在植物对Pi的吸收和分配中占据核心地位。本研究根据PHT转运蛋白的定位、结构和功能的不同,把它又划分为PHT1~PHT5 五个亚家族。一般而言,质膜定位的PHT1 亚家族主要作用为从土壤中摄取Pi[26],其大多数成员受低磷信号调控且主要在根部表达[8,27-32],而植物细胞内部的Pi分配,如叶绿体、线粒体、高尔基体和液泡等亚细胞区室间的磷交换,则由PHT2、PHT3、PHT4 和PHT5 亚家族成员介导[26]。
笔者通过生物信息学方法分析预测了草莓PHT家族五个家族共计16个成员的基本理化性质、亚细胞定位、基因结构等基本信息。草莓PHT家族成员由317~720 个氨基酸组成,相对分子质量在34.99~80.44 kDa 范围内波动,理论等电点为5.73~9.43,以较为疏水的稳定蛋白为主。草莓PHT 蛋白理化性质较大的波动范围源于PHT 家族以是否具备无机磷转运能力聚类,各亚家族间以亚细胞定位及序列一致性区分[7,24],并无普遍联系。笔者的研究结果与之相一致。
草莓PHT1 家族成员最多,各成员间同源性较高,基因结构与蛋白理化性质相近,等电点基本位于8.3~9.1之间,相对分子质量为56~61 kDa,氨基酸数为508~565个,这与前人对PHT1家族的研究基本符合[33-36]。FvPHT2.1 作为草莓中唯一被筛选到的PHT2 家族成员,被预测为一个疏水的稳定蛋白。前人报道和本研究预测结果均表明,其可能定位于叶绿体这一关键细胞器[10,11,37-38],并作为唯一的叶绿体无机磷转运蛋白发挥作用。草莓PHT3 家族有3名成员,分别位于3条不同的染色体上,内含子相位一致且同源性较高,是草莓PHT各亚家族中相对分子质量最小的一类。相比之下,草莓PHT5 亚家族(VPT)成员相对分子质量和组成氨基酸数显著高于其他亚家族成员,这在一定程度上说明了其结构更为复杂。此外有研究表明草莓和葡萄PHT5(VPT)磷转运蛋白同时具备糖转运功能,在植物液泡的糖、磷积累过程中发挥重要作用[17,20]。草莓PHT4 亚家族具有FvPHT4.1 和FvPHT4.2 两名成员,其等电点均大于7,这与衣藻中研究相一致[39]。拟南芥中的研究表明,AtPHT1.1~AtPHT1.5 为质体定位,At-PHT1.6为高尔基体定位[40],而FvPHT4.1靶向叶绿体和/或高尔基体,FvPHT4.2 靶向高尔基体。系统进化树分析表明,FvPHT4.1 和FvPHT4.2 似乎与靶向质体的AtPHT4.1、AtPHT4.2 具有更高的同源性,因而二者的具体定位模式尚需进一步试验证明。
叶绿体是光合作用的主要场所,植物通过光合磷酸化产生的ATP将光能转化为稳定的化学能从而供给整个生物界。PHT2 作为主要定位于叶绿体的磷酸盐转运体,在无机磷向叶绿体的流入过程中发挥了极其重要的作用。在本研究中,笔者鉴定了定位于叶绿体的草莓FaPHT2.1 磷酸盐转运体,并通过酵母系统验证了其Pi 转运活性。在低Pi 培养基(10 μmol·L-1)下FaPHT2.1基本不行使功能,在高Pi培养基下(>5 mmol·L-1)其能够部分恢复磷缺陷酵母突变株的生长缺陷表型,且恢复程度在一定范围内与Pi含量正相关,因而被判断为低亲和的无机磷转运体,这与前人的研究结果相一致[10-12]。然而,低亲和的磷转运特性意味着其只能在胞质无机磷充分的条件下发挥作用,而在植物磷匮乏的条件下,胞质磷浓度是否能够满足其转运活性的保持仍值得探讨。拟南芥atpht2.1 的生长表型说明PHT2 可能并非唯一能够向叶绿体转运磷的功能承担者,诸如三磷酸糖/磷酸转运体(TPT)、磷酸烯醇丙酮酸/磷酸转运体(PPT)、木酮糖-5-磷酸(Xul-5-P)/磷酸转运体(XPT)等代谢相关转运体或许在上述过程中发挥重要作用。但拟南芥突变体和瞬时转化草莓果实磷含量的显著变化证明了FaPHT2.1 在植物体磷稳态方面的突出作用。
PHT2最初在拟南芥中以动物Na+/Pi共转运的Ⅲ型磷转运蛋白类似物被发现,虽然现有的研究大都表明PHT2 在植物中以H+/Pi 共转运的方式发挥作用,但其是否具备Na+/Pi 共转运能力仍有争议[10,41]。为此笔者曾尝试在不同pH及不同Na+浓度下通过酵母突变株的生长状况判断其Na+/Pi 共转运能力,但未获得明确结果。Versaw 等[10]研究发现,拟南芥PHT2.1 氮端前70 个氨基酸可能作为叶绿体转运肽发挥作用,在酵母中靶向线粒体,通过构建截短的拟南芥PHT2.1,发现其磷转运活性大大提升。为避免因可能存在的蛋白质靶向问题对FaPHT2.1 无机磷转运试验造成的干扰,笔者也同时构建了前40氨基酸和前70 个氨基酸截短的FaPHT2.1 重组载体,转化后的酵母生长试验表明,草莓FaPHT2.1的氨基酸截短并不影响其功能行使。
通过对拟南芥atpht2.1 突变体的回补试验发现,FaPHT2.1/atpht2.1 能够恢复atpht2.1 突变株的生长表型,提高植株鲜质量、叶绿素含量和总磷含量,说明FaPHT2.1与AtPHT2.1具备类似功能,调节植物的生长发育过程。草莓果实中的瞬时转基因试验结果发现,过表达FaPHT2.1显著提高了果实磷含量,降低了果实硬度,并促进了果实可溶性固形物及葡萄糖等可溶性糖的积累,这可能是由于FaPHT2.1介导了无机磷向叶绿体的流入过程,并通过调节光合磷酸化底物的浓度以及叶绿素含量影响光合作用,从而参与对植物生长发育和果实成熟的调控过程,但这一猜测仍需进一步试验证实。
4 结 论
本研究对森林草莓中PHT 家族进行了鉴定和生物信息学分析,并初步揭示了定位于叶绿体的草莓磷酸盐转运体FaPHT2.1的功能,证明其促进草莓对糖和磷的积累,并参与调节果实硬度和叶绿素含量,影响植物生长发育和草莓果实品质形成。
[1] PAZ-ARES J,PUGA М I,ROJAS-TRIANA М,МARTINEZHEVIA I,DIAZ S,POZA-CARRIÓN C,МIÑAМBRES М,LEYVA A. Plant adaptation to low phosphorus availability:Core signaling,crosstalks,and applied implications[J]. Мolecular Plant,2022,15(1):104-124.
[2] VANCE C P,UHDE-STONE C,ALLAN D L. Phosphorus acquisition and use:Critical adaptations by plants for securing a nonrenewable resource[J]. New Phytologist,2003,157(3):423-447.
[3] LIU J L,YANG L,LUAN М D,WANG Y,ZHANG C,ZHANG B,SHIJ S,ZHAO F G,LAN W Z,LUAN S.A vacuolar phosphate transporter essential for phosphate homeostasis in Arabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2015,112(47):E6571-E6578.
[4] DISSANAYAKA D М S B,PLAXTON W C,LAМBERS H,SIEBERS М,МARAМBE B,WASAKIJ. Мolecular mechanisms underpinning phosphorus-use efficiency in rice[J]. Plant,Cell&Environment,2018,41(7):1483-1496.
[5] RAGHOTHAМA K G. Phosphate acquisition[J]. Annual Review of Plant Physiology and Plant Мolecular Biology,1999,50:665-693.
[6] МUDGE S R,RAE A L,DIATLOFF E,SМITH F W. Expression analysis suggests novel roles for members of the Pht1 family of phosphate transporters in Arabidopsis[J]. The Plant Journal,2002,31(3):341-353.
[7] SRIVASTAVA S,UPADHYAY М K,SRIVASTAVA A K,ABDELRAHМAN М,SUPRASANNA P,TRAN L P. Cellular and subcellular phosphate transport machinery in plants[J]. International Journal of Мolecular Sciences,2018,19(7):1914.
[8] SUN S B,GU М,CAO Y,HUANG X P,ZHANG X,AIP H,ZHAO J N,FAN X R,XU G H.A constitutive expressed phosphate transporter,OsPht1;1,modulates phosphate uptake and translocation in phosphate- replete rice[J]. Plant Physiology,2012,159(4):1571-1581.
[9] 邓美菊,王飞,毛传澡. 植物磷酸盐转运体及其分子调控机制[J].植物生理学报,2017,53(3):377-387.DENG Мeiju,WANG Fei,МAO Chuanzao. Plant phosphate transporters and its molecular regulation mechanism[J]. Plant Physiology Journal,2017,53(3):377-387.
[10] VERSAW W K,HARRISON М J. A chloroplast phosphate transporter,PHT2;1,influences allocation of phosphate within the plant and phosphate-starvation responses[J].The Plant Cell,2002,14(8):1751-1766.
[11] RAUSCH C,ZIММERМANN P,AМRHEIN N,BUCHER М.Expression analysis suggests novel roles for the plastidic phosphate transporter Pht2;1 in auto-and heterotrophic tissues in potato and Arabidopsis[J].The Plant Journal,2004,39(1):13-28.
[12] LIU X L,WANG L,WANG X W,YAN Y,YANG X L,XIE М Y,HU Z,SHEN X,AIH,LIN H H,XU G H,YANG J,SUN S B. Мutation of the chloroplast-localized phosphate transporter OsPHT2;1 reduces flavonoid accumulation and UV tolerance in rice[J].The Plant Journal,2020,102(1):53-67.
[13] ZHU W,МIAO Q,SUN D,YANG G D,WU C G,HUANG J G,ZHENG C C.The mitochondrial phosphate transporters modulate plant responses to salt stress via affecting ATP and gibberellin metabolism in Arabidopsis thaliana[J]. PLoS One,2012,7(8):e43530.
[14] МONNÉ М,МINIERO D V,OBATA T,DADDABBO L,PALМIERIL,VOZZA A,NICOLARDIМ C,FERNIE A R,PALМIERIF. Functional characterization and organ distribution of three mitochondrial ATP-Мg/Pi carriers in Arabidopsis thaliana[J]. Biochimica et Biophysica Acta (BBA)- Bioenergetics,2015,1847(10):1220-1230.
[15] KARLSSON P М,HERDEAN A,ADOLFSSON L,BEEBO A,NZIENGUIH,IRIGOYEN S,ÜNNEP R,ZSIROS O,NAGY G,GARAB G,ARONSSON H,VERSAW W K,SPETEA C.The Arabidopsis thylakoid transporter PHT4;1 influences phosphate availability for ATP synthesis and plant growth[J]. The Plant Journal,2015,84(1):99-110.
[16] GUO B,JIN Y,WUSSLER C,BLANCAFLOR E B,МOTES C М,VERSAW W K. Functional analysis of the Arabidopsis PHT4 family of intracellular phosphate transporters[J].New Phytologist,2008,177(4):889-898.
[17] BAIQ,CHEN X X,ZHENG Z Z,FENG J J,ZHANG Y J,SHEN Y Y,HUANG Y. Vacuolar Phosphate Transporter1(VPT1) may transport sugar in response to soluble sugar status of grape fruits[J].Horticulture Research,2023,10(2):uhac260.
[18] WANG C,YUE W H,YING Y H,WANG S D,SECCO D,LIU Y,WHELAN J,TYERМAN S D,SHOU H X.Rice SPX-major facility Superfamily3,a vacuolar phosphate efflux transporter,is involved in maintaining phosphate homeostasis in rice[J]. Plant Physiology,2015,169(4):2822-2831.
[19] WU S W,LIМ,ZHANG C М,TAN Q L,YANG X Z,SUN X C,PAN Z Y,DENG X X,HU C X. Effects of phosphorus on fruit soluble sugar and citric acid accumulations in citrus[J].Plant Physiology and Biochemistry,2021,160:73-81.
[20] HUANG Y,XU P H,HOU B Z,SHEN Y Y. Strawberry tonoplast transporter,FaVPT1,controls phosphate accumulation and fruit quality[J].Plant,Cell&Environment,2019,42(9):2715-2729.
[21] WILKINS М R,GASTEIGER E,BAIROCH A,SANCHEZ J C,WILLIAМS K L,APPEL R D,HOCHSTRASSER D F. Protein identification and analysis tools in the ExPASy server[J].Мethods in Мolecular Biology,1999,112:531-552.
[22] 王萍,陈爱群,余玲,徐国华.植物磷转运蛋白基因及其表达调控的研究进展[J].植物营养与肥料学报,2006,12(4):584-591.WANG Ping,CHEN Aiqun,YU Ling,XU Guohua. Advance of plant phosphate transporter genes and their regulated expression[J].Plant Nutrition and Fertilizer Science,2006,12(4):584-591.
[23] LIU T Y,HUANG T K,YANG S Y,HONG Y T,HUANG S М,WANG F N,CHIANG S F,TSAIS Y,LU W C,CHIOU T J.Identification of plant vacuolar transporters mediating phosphate storage[J].Nature Communications,2016,7:11095.
[24] GU М,CHEN A Q,SUN S B,XU G H.Complex regulation of plant phosphate transporters and the gap between molecular mechanisms and practical application:What is missing?[J].Мolecular Plant,2016,9(3):396-416.
[25] LÓPEZ- ARREDONDO D L,LEYVA- GONZÁLEZ М A,GONZÁLEZ-МORALES S I,LÓPEZ-BUCIO J,HERRERA-ESTRELLA L.Phosphate nutrition:Improving low-phosphate tolerance in crops[J].Annual Review of Plant Biology,2014,65:95-123.
[26] WANG D,LV S L,JIANG P,LIY X.Roles,regulation,and agricultural application of plant phosphate transporters[J].Frontiers in Plant Science,2017,8:817.
[27] WU Z Y,ZHAO J М,GAO R F,HU G J,GAIJ Y,XU G H,XING H. Мolecular cloning,characterization and expression analysis of two members of the Pht1 family of phosphate transporters in Glycine max[J].PLoS One,2011,6(6):e19752.
[28] QIN L,ZHAO J,TIAN J,CHEN LY,SUN Z A,GUO Y X,LU X,GU М,XU G H,LIAO H.The high-affinity phosphate transporter GmPT5 regulates phosphate transport to nodules and nodulation in soybean[J].Plant Physiology,2012,159(4):1634-1643.
[29] CHEN A Q,CHEN X,WANG H М,LIAO D H,GU М,QU H Y,SUN S B,XU G H.Genome-wide investigation and expression analysis suggest diverse roles and genetic redundancy of Pht1 family genes in response to Pi deficiency in tomato[J].BМC Plant Biology,2014,14:61.
[30] CHEN A Q,HU J,SUN S B,XU G H.Conservation and divergence of both phosphate-and mycorrhiza-regulated physiological responses and expression patterns of phosphate transporters in solanaceous species[J].New Phytologist,2007,173(4):817-831.
[31] TAN Z J,HU Y L,LIN Z P.Expression of NtPT5 is correlated with the degree of colonization in tobacco roots inoculated with Glomus etunicatum[J]. Plant Мolecular Biology Reporter,2012,30(4):885-893.
[32] GUO C J,GUO L,LIX J,GU J T,ZHAO М,DUAN W W,МA C Y,LU W J,XIAO K. TaPT2,a high-affinity phosphate transporter gene in wheat(Triticum aestivum L.),is crucial in plant Pi uptake under phosphorus deprivation[J].Acta Physiologiae Plantarum,2014,36(6):1373-1384.
[33] POIRIER Y,BUCHER М. Phosphate transport and homeostasis in Arabidopsis[J].TheArabidopsis Book,2002,1:e0024.
[34] CEASAR S A,HODGE A,BAKER A,BALDWIN S A.Phosphate concentration and arbuscular mycorrhizal colonisation influence the growth,yield and expression of twelve PHT1 family phosphate transporters in foxtail millet (Setaria italica)[J]. PLoS One,2014,9(9):e108459.
[35] RAE A L,CYBINSKID H,JARМEY J М,SМITH F W.Characterization of two phosphate transporters from barley;evidence for diverse function and kinetic properties among members of the Pht1 family[J].Plant Мolecular Biology,2003,53(1):27-36.
[36] LOTH-PEREDA V,ORSINIE,COURTY P E,LOTA F,KOHLER A,DISS L,BLAUDEZ D,CHALOT М,NEHLS U,BUCHER М,МARTIN F. Structure and expression profile of the phosphate Pht1 transporter gene family in mycorrhizal Populus trichocarpa[J].Plant Physiology,2011,156(4):2141-2154.
[37] GUO C J,ZHAO X L,LIU X М,ZHANG L J,GU J T,LIX J,LU W J,XIAO K. Function of wheat phosphate transporter gene TaPHT2;1 in Pi translocation and plant growth regulation under replete and limited Pi supply conditions[J].Planta,2013,237(4):1163-1178.
[38] 史书林,王丹凤,颜彦,张芳,王化敦,顾冕,孙淑斌,徐国华.水稻磷转运蛋白OsPHT2;1 在提高磷素利用率方面的作用[J].中国水稻科学,2013,27(5):457-465.SHIShulin,WANG Danfeng,YANYan,ZHANG Fang,WANG Huadun,GU Мian,SUN Shubin,XU Guohua. Function of phosphate transporter OsPHT2;1 in improving phosphate utilization in rice[J].Chinese Journal of Rice Science,2013,27(5):457-465.
[39] WANG L,XIAO L,YANG H Y,CHEN G L,ZENG H Q,ZHAO H Y,ZHU Y Y. Genome-wide identification,expression profiling,and evolution of phosphate transporter gene family in green algae[J].Frontiers in Genetics,2020,11:590947.
[40] HASSLER S,JUNG B,LEМKE L,NOVÁK O,STRNAD М,МARTINOIA E,NEUHAUS H E. Function of the Golgi-located phosphate transporter PHT4;6 is critical for senescence-associated processes inArabidopsis[J].Journal of Experimental Botany,2016,67(15):4671-4684.
[41] DARAМ P,BRUNNER S,RAUSCH C,STEINER C,AМRHEIN N,BUCHER М.Pht2;1 encodes a low-affinity phosphate transporter fromArabidopsis[J].The Plant Cell,1999,11(11):2153-2166.