葡萄(Vitis vinifera L.)作为全球广泛种植的重要果树作物,具有极高的经济价值,不仅可鲜食,还能用于酿酒、制作葡萄干等加工产品。夏黑葡萄(V. vinifera‘Summer Black’),属欧美杂交种,三倍体品种,因其具有早熟、无核、高糖低酸、香味浓郁、肉质细脆、硬度中等、抗病丰产、耐贮运等诸多优良特性,在我国葡萄产业中占据重要地位,成为深受消费者喜爱与种植户青睐的优质葡萄品种[1]。
低温胁迫是影响葡萄生长发育、产量和品质的关键环境因素之一。在葡萄的生长周期中,如春季萌芽期、秋季果实成熟期以及冬季休眠期,都可能遭遇不同程度的低温危害。低温胁迫对葡萄植株造成一系列生理损伤,影响葡萄的正常生长和发育,导致果实产量降低、品质下降。此外,低温还可能引发葡萄的冷害和冻害,严重时甚至导致植株死亡,给葡萄产业带来巨大的经济损失[2-3]。
为了应对低温胁迫,植物在长期进化过程中形成了复杂的防御机制,其中抗坏血酸-谷胱甘肽(AsA-GSH)循环在植物抵御低温胁迫中发挥着至关重要的作用。AsA-GSH 循环是植物细胞内重要的抗氧化系统,主要由抗坏血酸(AsA)、谷胱甘肽(GSH)、脱氢抗坏血酸还原酶(DHAR)、单脱氢抗坏血酸还原酶(MDHAR)和谷胱甘肽还原酶(GR)等组成。在正常生理条件下,植物细胞内活性氧(ROS)的产生和清除处于动态平衡状态。但当植物受到低温胁迫时,ROS 的产生会急剧增加,打破这种平衡,过多的ROS 会对细胞造成氧化损伤。此时,AsA-GSH循环被激活,通过一系列酶促反应,将ROS 还原为水,从而维持细胞内的氧化还原平衡,保护植物细胞免受氧化损伤[4-5]。
茉莉酸甲酯(methyl jasmonate,MeJA)作为一种重要的植物激素,在植物生长发育和应对逆境胁迫过程中发挥着关键作用,可以通过激活植物体内的防御基因表达,诱导植物产生一系列生理生化变化,提高植物对低温、干旱、病虫害等逆境胁迫的抗性[6]。已有研究表明,外源喷施MeJA能够有效提高多种植物的抗寒性。刘德帅等[7]研究表明,MeJA处理可以提高葡萄的抗寒性;冯斗等[8]以威廉斯香蕉幼苗为试验材料,叶面喷施不同浓度的MeJA,然后进行低温胁迫,结果发现以0.2 mmol·L-1的MeJA处理诱导香蕉幼苗的抗寒效应最佳;齐付国等[9]以豫麦18为材料,研究发现MeJA处理可以显著提高低温胁迫下小麦幼苗细胞内抗氧化酶的活性,维持细胞质膜的完整性,增强小麦植株抵抗低温胁迫的能力;马岩[10]研究发现,当葡萄植株受到低温胁迫时,外源施加MeJA能够被细胞感知,进而启动一系列复杂的信号转导过程。目前关于MeJA提高植物抗寒性的研究取得了一定进展[4-5,11],但在葡萄尤其是夏黑葡萄上,外源MeJA调控AsA-GSH循环对低温胁迫响应的具体机制仍有待深入研究。深入探究这一机制,不仅有助于揭示植物响应低温胁迫的调控网络,丰富植物抗寒理论,还能为葡萄的抗寒栽培和品种改良提供理论依据和技术支持,具有重要的理论意义和实践价值。
1 材料和方法
1.1 材料
以夏黑葡萄的1 年生自根苗为试验材料,采用盆栽方式,盆口直径40 cm、高35 cm。每盆园土、珍珠岩、腐殖质体积比=1∶1∶1。每盆种植1株。
1.2 方法
1.2.1 试验设计 夏黑葡萄植株生长至具有7~8枚成熟叶片时,选择生长状况均匀一致的植株开展各种处理,试验采用完全随机设计,设置不同浓度MeJA处理组和低温胁迫处理组,以探究外源MeJA 调控夏黑葡萄AsA-GSH 循环对低温胁迫的响应。具体设计如下:
(1)茉莉酸甲酯处理:将选取的1 年生夏黑葡萄植株随机分为5组,每组10株。分别用0(CK,喷施蒸馏水作为对照)、50、100、150、200 μmol·L-1的MeJA 溶液对葡萄植株进行叶面喷施处理,喷施量以叶片表面均匀湿润且不滴水为宜。喷施时间选择在晴天的傍晚,以减少溶液的蒸发和光解,提高处理效果。处理后,将葡萄植株置于正常生长环境(温度25 ℃,相对湿度60%~70%,光照度2000~3000 lx,光照时间16 h·d-1)中培养24 h,使茉莉酸甲酯充分被植株吸收和利用。
(2)低温胁迫处理:在MeJA 处理24 h 后,将每组葡萄植株再随机分为2 个亚组,其中一个亚组继续置于正常生长环境中作为常温对照,另一个亚组则转移至低温胁迫环境(温度0 ℃,相对湿度60%~70%,光照度2000~3000 lx,光照时间16 h·d-1)中进行低温胁迫处理。低温胁迫处理时间分别设置为0(处理前取样作为初始对照)、1、3、5 d。在每个处理时间点,分别从常温对照组和低温胁迫处理组中随机选取3株葡萄植株,采集其功能叶片(从植株顶部往下数第3~5 枚完全展开的叶片)用于各项指标测定(试验设计详见表1)。采集的叶片样品迅速用液氮冷冻,并保存于-80 ℃冰箱中备用。
表1 试验设计
Table 1 Experimental design
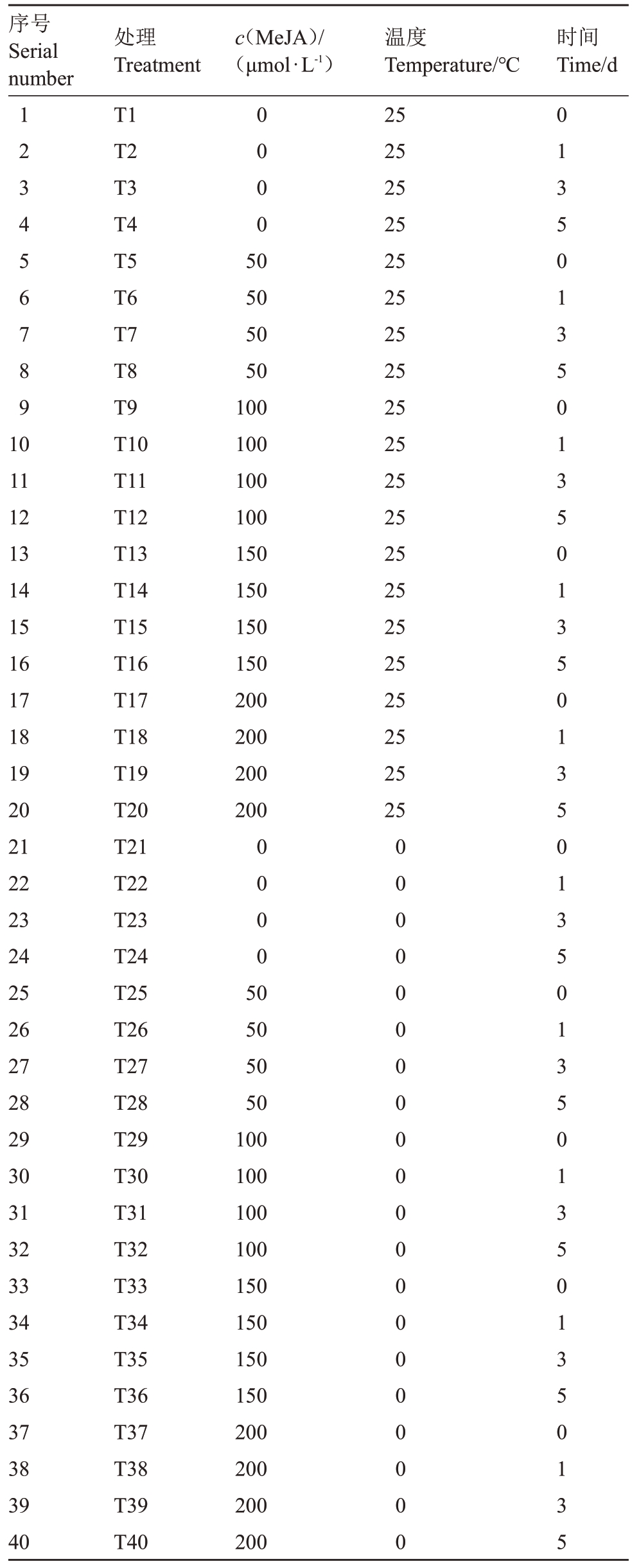
序号Serial number c(MeJA)/(μmol·L-1)时间Time/d 1 2 3 4 5 6 7 8 9 0 0 0 0 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40处理Treatment T1 T2 T3 T4 T5 T6 T7 T8 T9 T10 T11 T12 T13 T14 T15 T16 T17 T18 T19 T20 T21 T22 T23 T24 T25 T26 T27 T28 T29 T30 T31 T32 T33 T34 T35 T36 T37 T38 T39 T40 50 50 50 50 100 100 100 100 150 150 150 150 200 200 200 200温度Temperature/℃25 25 25 25 25 25 25 25 25 25 25 25 25 25 25 25 25 25 25 25 0 0 0 0 50 50 50 50 100 100 100 100 150 150 150 150 200 200 200 200 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 3 5 0 1 3 5 0 1 3 5 0 1 3 5 0 1 3 5 0 1 3 5 0 1 3 5 0 1 3 5 0 1 3 5 0 1 3 5
1.2.2 指标测定(1)生长指标测定:用直尺测量葡萄幼苗新梢基部到顶端生长点的距离为株高,单位为cm;采用游标卡尺(DEGUQMNT,上海)测量新梢基部上部2 cm处的茎粗,单位为mm。
(2)光合参数测定:采用便携式光合仪(CIRAS-3)设定大气CO2浓度为(360±6.0)μmol·mol-1,温度为25~28 ℃,相对湿度为(60±4.0)%。光合仪自动记录净光合速率(Pn)、胞间CO2浓度(Ci)、气孔导度(Gs)、蒸腾速率(Tr)等光合作用参数。试验当天每个处理分别选3 株苗,展开使其完全暴露在晴朗天气下进行充分的光适应,于08:30—11:30测定。
(3)生理指标测定:参考杨海燕等[11]的方法测定叶绿素含量。参考Foyer 等[12]和Zhu 等[13]的方法测定谷胱甘肽还原酶(GR)、脱氢抗坏血酸还原酶(DHAR)和单脱氢抗坏血酸还原酶(MDHAR)活性。参考Zhang 等[14]的方法测定AsA 含量,参考Rahman 等[15]的方法测定谷胱甘肽(GSH)含量。每个指标类型重复测定3次。
1.3 数据分析
采用SPSS 22.0 统计分析软件对数据进行处理和分析;采用单因素方差分析(One-way ANOVA)方法,对不同茉莉酸甲酯浓度处理组和不同低温胁迫时间处理组之间的各项指标进行差异显著性检验,确定不同处理对各项指标的影响是否显著,若方差分析结果显示差异显著(P<0.05),则进一步采用Duncan氏新复极差法进行多重比较,以明确各处理组之间的具体差异情况;采用Pearson相关性分析方法,计算各指标之间的相关系数,分析他们之间的相关性。
2 结果与分析
2.1 外源茉莉酸甲酯对低温胁迫下夏黑葡萄生长指标的影响
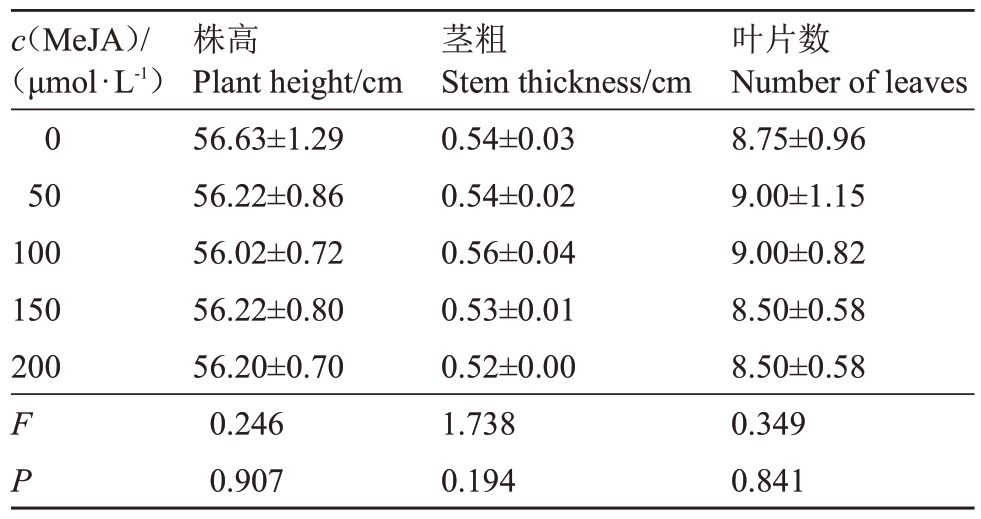
2.1.1 常温下不同浓度MeJA 处理的夏黑葡萄株高、茎粗及叶片数量比较 由表2 可知,常温下,0、50、100、150、200 μmol·L-1 MeJA不同浓度处理下的夏黑葡萄株高、茎粗及叶片数量差异不显著。
表2 常温下不同浓度MeJA 处理的夏黑葡萄株高、茎粗及叶片数比较
Table 2 Comparison of plant height,stem diameter,and leaf quantity of Summer Black grapes treated with different concentrations of MeJA at room temperature
注:数据表示为平均值±SD(n=3)。下同。
Note:data were mean±SD(n=3).The same below.
c(MeJA)/(μmol·L-1)0 50 100 150 200 F P叶片数Number of leaves 8.75±0.96 9.00±1.15 9.00±0.82 8.50±0.58 8.50±0.58 0.349 0.841株高Plant height/cm 56.63±1.29 56.22±0.86 56.02±0.72 56.22±0.80 56.20±0.70 0.246 0.907茎粗Stem thickness/cm 0.54±0.03 0.54±0.02 0.56±0.04 0.53±0.01 0.52±0.00 1.738 0.194
2.1.2 低温下不同浓度MeJA 处理的夏黑葡萄株高、茎粗及叶片数量比较 由表3 可知,低温胁迫下,0、50、100、150、200 μmol·L-1 MeJA 不同浓度处理下的夏黑葡萄株高、茎粗及叶片数量差异不显著,但100 μmol·L-1 MeJA 处理下的夏黑葡萄茎粗高于其他浓度处理,组间比较差异显著(P<0.05),100 μmol·L-1 MeJA 处理下的夏黑葡萄叶片数量高于0 μmol·L-1及200 μmol·L-1 MeJA 处理,组间比较差异显著(P<0.05)。
表3 低温胁迫下不同浓度MeJA 处理的夏黑葡萄株高、茎粗及叶片数量比较
Table 3 Comparison of plant height,stem diameter,and leaf quantity of Summer Black grapes treated with different concentrations of MeJA under low temperature stress
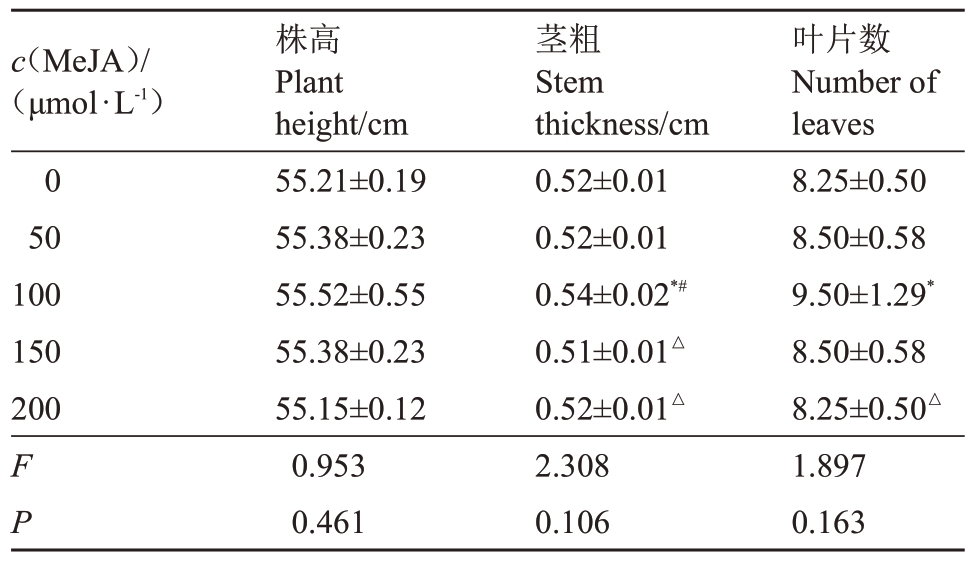
注:*表示与0 μmol·L-1 浓度比较差异显著(P<0.05);#表示与50 μmol·L-1 浓度比较差异显著(P<0.05);△表示与100 μmol·L-1 浓度比较差异显著(P<0.05)。下同。
Note:*indicated significant difference compared with 0 μmol·L-1 concentration (P<0.05); # indicated significant difference compared with 50 μmol·L-1 concentration(P<0.05);△indicated significant difference compared with 100 μmol·L-1 concentration (P<0.05). The same below.
c(MeJA)/(μmol·L-1)0 50 100 150 200叶片数Number of leaves 8.25±0.50 8.50±0.58 9.50±1.29*8.50±0.58 8.25±0.50△1.897 0.163 F P株高Plant height/cm 55.21±0.19 55.38±0.23 55.52±0.55 55.38±0.23 55.15±0.12 0.953 0.461茎粗Stem thickness/cm 0.52±0.01 0.52±0.01 0.54±0.02*#0.51±0.01△0.52±0.01△2.308 0.106
2.2 外源茉莉酸甲酯对低温胁迫下夏黑葡萄光合特性的影响
2.2.1 常温下不同浓度MeJA处理对叶绿素含量的影响 由表4可知,常温下,0、50、100、150、200 μmol·L-1 MeJA不同浓度处理下的夏黑葡萄叶绿素a、叶绿素b及叶绿素(a+b)含量差异不显著。
表4 常温下不同浓度MeJA 处理对叶绿素含量的影响
Table 4 Effects of different concentration methyl jasmonate on chlorophyll of Summer Black grape at room temperature(mg·g-1)
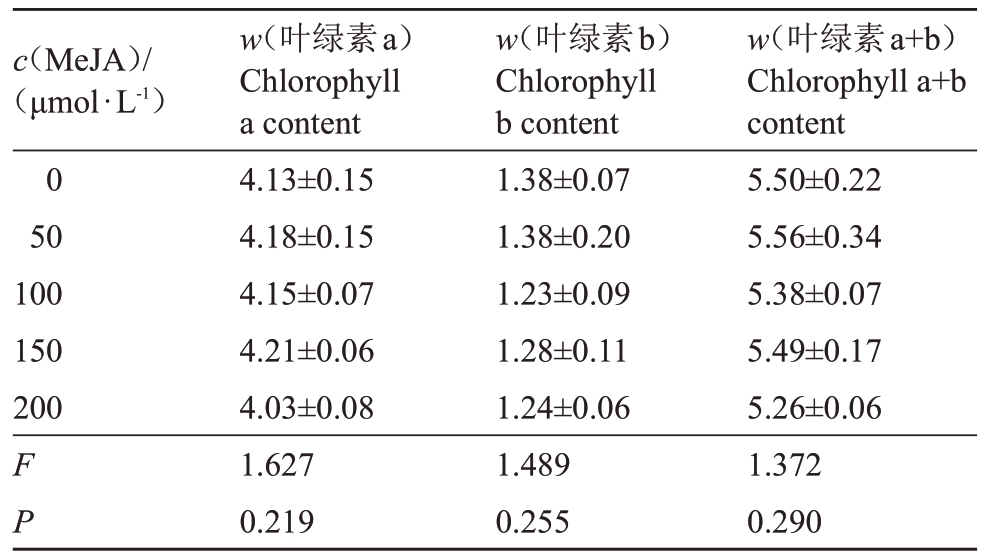
c(MeJA)/(μmol·L-1)0 50 100 150 200 F P w(叶绿素a)Chlorophyll a content 4.13±0.15 4.18±0.15 4.15±0.07 4.21±0.06 4.03±0.08 1.627 0.219 w(叶绿素b)Chlorophyll b content 1.38±0.07 1.38±0.20 1.23±0.09 1.28±0.11 1.24±0.06 1.489 0.255 w(叶绿素a+b)Chlorophyll a+b content 5.50±0.22 5.56±0.34 5.38±0.07 5.49±0.17 5.26±0.06 1.372 0.290
2.2.2 低温下不同浓度MeJA处理对叶绿素含量的影响 由表5 可知,低温胁迫下,0、50、100、150、200 μmol·L-1 MeJA 不同浓度处理下的夏黑葡萄叶绿素a、叶绿素b 及叶绿素(a+b)含量差异显著(P<0.05),其中100 μmol·L-1MeJA 浓度处理下,夏黑葡萄的叶绿素a、叶绿素b 及叶绿素(a+b)含量均显著高于其他浓度处理。
表5 低温下不同浓度MeJA 处理对叶绿素含量的影响
Table 5 Effects of different concentration Methyl Jasmonate on chlorophyll of Summer Black grape under low temperature(mg·g-1)

注:@表示与150 μmol·L-1 浓度比较差异显著(P<0.05)。下同。
Note:@indicated significant difference compared with 150 μmol·L-1 concentration(P<0.05).The same below.
c(MeJA)/(μmol·L-1)0 50 100 150 200 F P w(叶绿素a+b)Chlorophyll a+b content 0.70±0.22 2.42±0.19*4.41±0.28*#3.40±0.35*#△2.44±0.19*△@117.011<0.001 w(叶绿素a)Chlorophyll a content 0.53±0.16 1.80±0.14*3.24±0.25*#2.51±0.25*#△1.80±0.13*△@104.068<0.001 w(叶绿素b)Chlorophyll b content 0.17±0.06 0.61±0.05*1.17±0.07*#0.89±0.10*#△0.64±0.06*△@113.707<0.001
2.2.3 常温下不同浓度MeJA处理对夏黑葡萄光合指标的影响 由表6 可知,常温下,0、50、100、150、200 μmol·L-1 MeJA 不同浓度处理下的夏黑葡萄净光合速率、气孔导度、胞间二氧化碳浓度及蒸腾速率差异不显著。
表6 常温下不同浓度MeJA 处理的夏黑葡萄净光合速率、气孔导度、胞间二氧化碳浓度及蒸腾速率比较
Table 6 Comparison of Pn,Gs,Ci and Tr of Summer Black grape treated with different concentrations of MeJA at room temperature
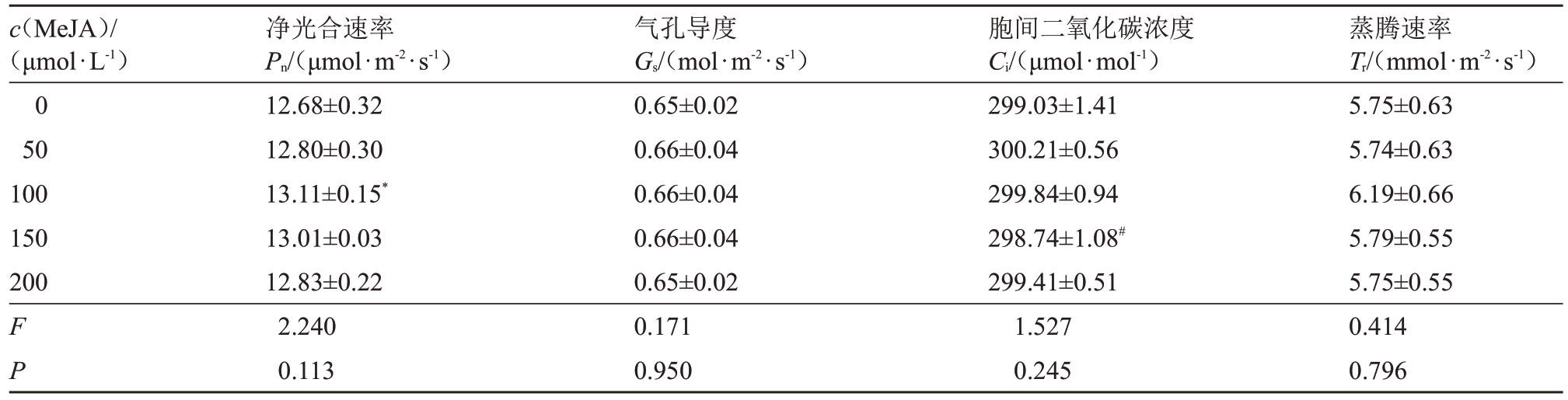
c(MeJA)/(μmol·L-1)0 50 100 150 200 F P净光合速率Pn/(μmol·m-2·s-1)12.68±0.32 12.80±0.30 13.11±0.15*13.01±0.03 12.83±0.22 2.240 0.113气孔导度Gs/(mol·m-2·s-1)0.65±0.02 0.66±0.04 0.66±0.04 0.66±0.04 0.65±0.02 0.171 0.950胞间二氧化碳浓度Ci/(μmol·mol-1)299.03±1.41 300.21±0.56 299.84±0.94 298.74±1.08#299.41±0.51 1.527 0.245蒸腾速率Tr/(mmol·m-2·s-1)5.75±0.63 5.74±0.63 6.19±0.66 5.79±0.55 5.75±0.55 0.414 0.796
2.2.4 低温下不同浓度MeJA处理对夏黑葡萄光合指标的影响 由表7 可知,低温胁迫下,0、50、100、150、200 μmol·L-1 MeJA 不同浓度处理下的夏黑葡萄净光合速率、气孔导度、胞间二氧化碳浓度及蒸腾速率差异显著(P<0.05),其中100 μmol·L-1浓度下夏黑葡萄的净光合速率、气孔导度及胞间二氧化碳浓度均高于其他浓度处理,蒸腾速率低于其他浓度,组间比较差异显著(P<0.05)。
表7 低温胁迫下不同浓度MeJA 处理的夏黑葡萄净光合速率、气孔导度、胞间二氧化碳浓度及蒸腾速率比较
Table 7 Comparison of Pn,Gs,Ci and Tr of Summer Black grape treated with different concentrations of MeJA under low temperature stress
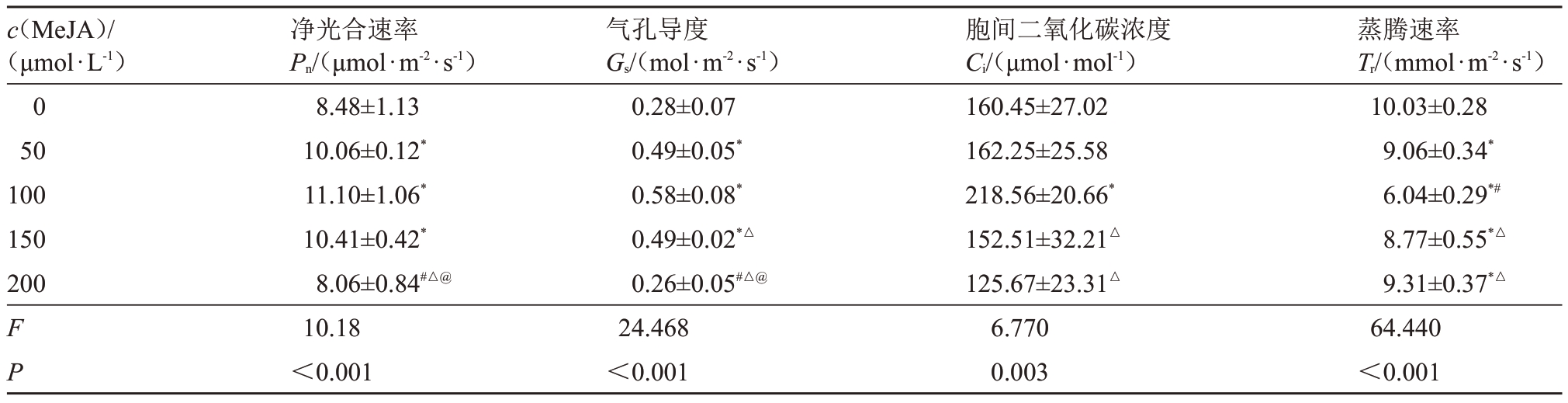
c(MeJA)/(μmol·L-1)0 50 100 150 200 F P净光合速率Pn/(μmol·m-2·s-1)8.48±1.13 10.06±0.12*11.10±1.06*10.41±0.42*8.06±0.84#△@10.18<0.001气孔导度Gs/(mol·m-2·s-1)0.28±0.07 0.49±0.05*0.58±0.08*0.49±0.02*△0.26±0.05#△@24.468<0.001胞间二氧化碳浓度Ci/(μmol·mol-1)160.45±27.02 162.25±25.58 218.56±20.66*152.51±32.21△125.67±23.31△6.770 0.003蒸腾速率Tr/(mmol·m-2·s-1)10.03±0.28 9.06±0.34*6.04±0.29*#8.77±0.55*△9.31±0.37*△64.440<0.001
2.3 外源茉莉酸甲酯对低温胁迫下夏黑葡萄AsAGSH循环调控的影响
AsA-GSH 循环在植物应对低温胁迫中起关键作用,能够有效清除植物细胞内的活性氧(ROS),维持细胞内的氧化还原平衡,从而保护植物细胞免受氧化损伤。
2.3.1 常温下不同浓度MeJA对夏黑葡萄AsA-GSH循环调控的影响 由表8 可知,常温下,0、50、100、150、200 μmol·L-1 MeJA 不同浓度处理下的夏黑葡萄ASA 含量、DHAR 活性、MDHAR 活性、GR 活性及GSH含量差异不显著。
表8 常温下不同浓度MeJA 对夏黑葡萄AsA-GSH 循环调控的影响
Table 8 Effects of different concentrations MeJA on the AsA-GSH cycling in Summer Black grape at room temperature
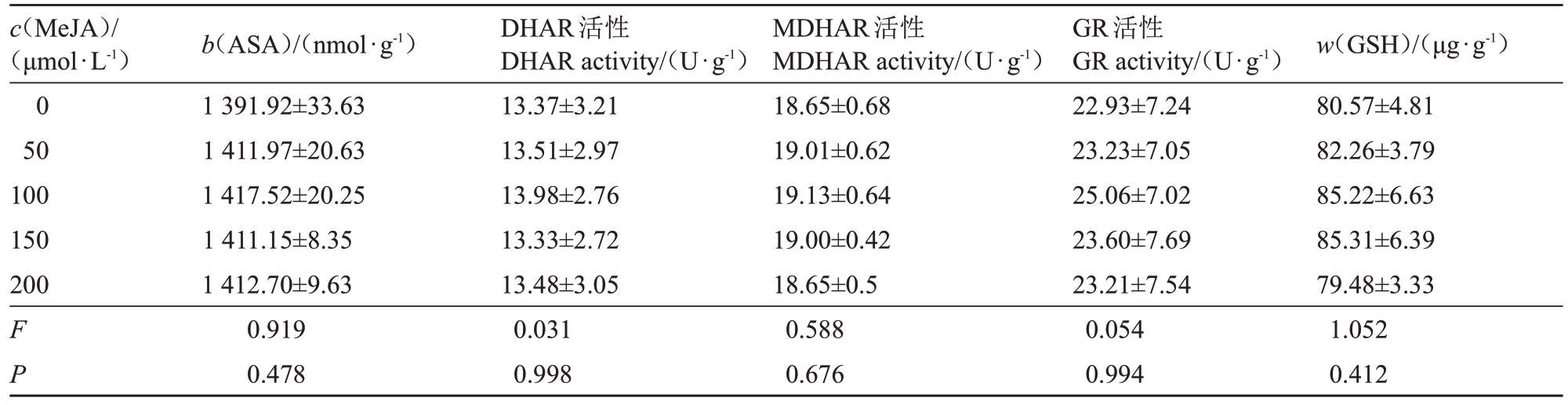
c(MeJA)/(μmol·L-1)0 50 100 150 200 F P b(ASA)/(nmol·g-1)1 391.92±33.63 1 411.97±20.63 1 417.52±20.25 1 411.15±8.35 1 412.70±9.63 0.919 0.478 DHAR活性DHAR activity/(U·g-1)13.37±3.21 13.51±2.97 13.98±2.76 13.33±2.72 13.48±3.05 0.031 0.998 MDHAR活性MDHAR activity/(U·g-1)18.65±0.68 19.01±0.62 19.13±0.64 19.00±0.42 18.65±0.5 0.588 0.676 GR活性GR activity/(U·g-1)22.93±7.24 23.23±7.05 25.06±7.02 23.60±7.69 23.21±7.54 0.054 0.994 w(GSH)/(μg·g-1)80.57±4.81 82.26±3.79 85.22±6.63 85.31±6.39 79.48±3.33 1.052 0.412
2.3.2 低温下不同浓度MeJA对夏黑葡萄AsA-GSH循环调控的影响 由表9 可知,低温胁迫下,0、50、100、150、200 μmol·L-1 MeJA 不同浓度处理下的夏黑葡萄ASA 含量、DHAR 活性、MDHAR 活性、GR 活性及GSH 含量差异显著(P<0.05),其中100 μmol·L-1 MeJA 浓度处理下夏黑葡萄的DHAR活性、MDHAR活性、GR活性及GSH含量均高于其他浓度处理,组间比较差异显著(P<0.05)。
表9 低温下不同浓度MeJA 对夏黑葡萄AsA-GSH 循环调控的影响
Table 9 Effects of different concentrations MeJA on the AsA-GSH cycling in Summer Black grape under low temperature
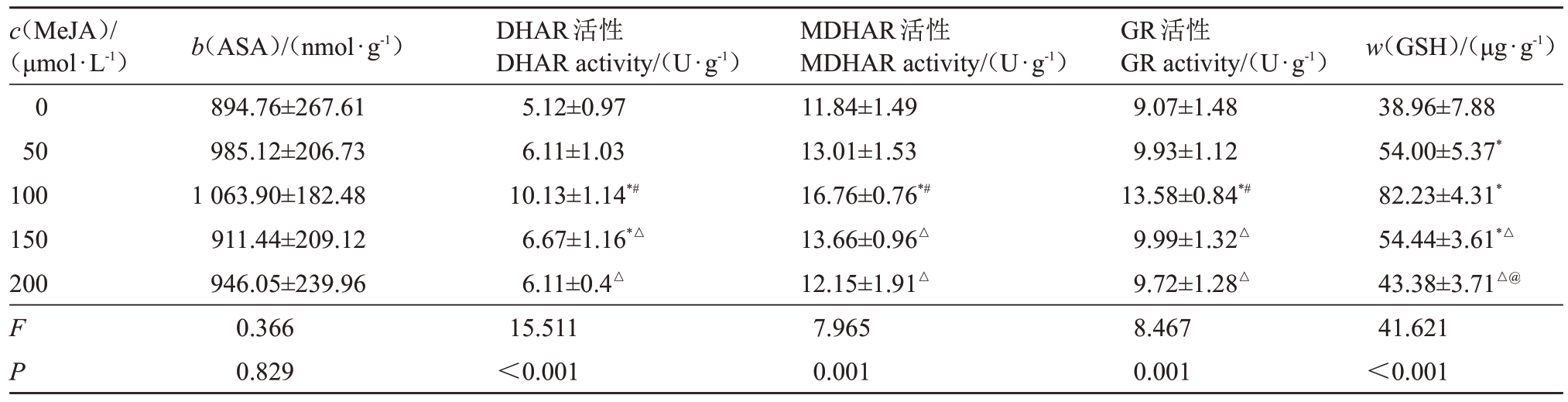
c(MeJA)/(μmol·L-1)0 50 100 150 200 F P b(ASA)/(nmol·g-1)894.76±267.61 985.12±206.73 1 063.90±182.48 911.44±209.12 946.05±239.96 0.366 0.829 DHAR活性DHAR activity/(U·g-1)5.12±0.97 6.11±1.03 10.13±1.14*#6.67±1.16*△6.11±0.4△15.511<0.001 MDHAR活性MDHAR activity/(U·g-1)11.84±1.49 13.01±1.53 16.76±0.76*#13.66±0.96△12.15±1.91△7.965 0.001 GR活性GR activity/(U·g-1)9.07±1.48 9.93±1.12 13.58±0.84*#9.99±1.32△9.72±1.28△8.467 0.001 w(GSH)/(μg·g-1)38.96±7.88 54.00±5.37*82.23±4.31*54.44±3.61*△43.38±3.71△@41.621<0.001
2.4 外源茉莉酸甲酯处理下夏黑葡萄各指标的相关性分析
由表10可知,经外源MeJA处理后,各指标间存在显著相关性。AsA 含量与DHAR 活性、MDHAR活性、GR 活性、GSH 含量、Pn等指标均呈显著正相关(r 分别为0.795、0.892、0.762、0.742、0.811,P<0.001)。这表明经外源MeJA 处理后,有助于增强AsA-GSH 循环关键酶活性,提升AsA 含量,促进GSH 合成,提高光合效率,增强葡萄抗氧化能力与光合作用,从而抵御低温胁迫。
表10 外源茉莉酸甲酯处理下夏黑葡萄各指标的相关性分析
Table 10 Correlation analysis of various indicators in Summer Black grapes treated with exogenous methyl jasmonate

?
DHAR活性、MDHAR活性和GR活性之间也呈极显著正相关(r 分别为0.915、0.84、0.966,P<0.001),说明它们在AsA-GSH 循环中协同作用,共同维持循环高效运转,清除活性氧,保护细胞免受氧化损伤。GSH与净光合速率、气孔导度呈极显著正相关(r分别为0.924、0.937,P<0.001),说明GSH含量的增加,有利于光合气体交换,提升光合作用效率,保障植株在低温下的生长。
叶绿素a 含量、叶绿素b 含量与Pn、Gs呈极显著正相关(r 范围为0.871~0.998,P<0.001),与Tr呈极显著负相关(r 分别为-0.914、-0.887,P<0.001),表明叶绿素含量的增加能增强光能捕获与转化能力,促进光合作用,同时降低蒸腾作用效率,减少水分散失,适应低温环境。
此外,株高、茎粗和叶片数量等生长指标与部分光合及抗氧化指标存在一定相关性,如株高与AsA含量、叶绿素a 含量呈显著正相关(r 分别为0.77、0.601,P<0.05),说明植株生长与光合作用、抗氧化防御紧密相连,在低温胁迫下,茉莉酸甲酯处理可通过调节这些指标间的关系,促进植株生长发育,提高抗寒性。
3 讨 论
葡萄在冬季严寒或早春气温较低时,枝蔓或根系会受到损伤,这种损伤会导致葡萄植株在冬季死亡以及春季萌芽晚、萌芽不整齐,甚至新梢生长势弱、花芽分化不良、坐果率低等一系列问题。为了减轻低温对葡萄萌芽的影响,可以采取一系列防冻和补救措施[16]。车莉莉[17]、解振宇[18]研究发现,MeJA处理能提高葡萄幼苗的抗寒性,促进了幼苗生长。本试验研究低温胁迫下,喷施不同浓度的MeJA 对夏黑葡萄1年生植株的影响,结果表明,在低温胁迫下,外源MeJA 处理能够显著影响夏黑葡萄的生长指标,缓解低温对葡萄生长的抑制作用。
在光合作用促进方面,光合作用是植物生长发育的基础,为植物提供能量和物质基础。低温胁迫会对植物的光合作用产生显著的抑制作用,这主要是由于低温影响了光合色素的合成和稳定性、光合酶活性以及气孔的开闭等多个环节。本试验研究表明,MeJA处理后,植物叶片中的叶绿素a和叶绿素b含量均有所增加,这为光合作用提供了更多的光能捕获位点;此外,MeJA还可通过调节气孔的开闭,增加二氧化碳的供应,进一步增强光合作用,说明喷施MeJA可以缓解低温引发葡萄幼苗光合系统的损伤。这与李蔚[19]、高琦等[20]和徐颖欢[21]关于喷施MeJA可以提高不同逆境下植物光合效率的研究结果一致。
低温胁迫下,夏黑葡萄的AsA-GSH循环会发生一系列复杂的响应,这些响应对葡萄抵御低温伤害、维持细胞正常生理功能至关重要。在AsA-GSH 循环中,AsA 和GSH 作为重要的抗氧化物质,其含量变化直接反映了葡萄的抗氧化能力。DHAR、MDHAR和GR作为AsA-GSH循环中的关键酶,他们的活性变化直接影响循环的运转效率。在本研究中,低温胁迫初期,对照组夏黑葡萄的AsA和GSH含量有所上升,这可能是葡萄自身的一种应激反应,通过增加AsA和GSH的含量来增强抗氧化防御能力,然而,随着低温胁迫时间的延长,AsA 和GSH 含量逐渐下降,这表明在低温胁迫下,葡萄自身的AsAGSH 循环受到了一定程度的破坏,AsA 的再生能力不足,GSH 的消耗大于合成,导致AsA 和GSH 含量降低。另外,低温胁迫初期,对照组夏黑葡萄的DHAR、MDHAR 和GR 活性均迅速升高,这是葡萄细胞为了增强抗氧化能力而做出的适应性反应,然而,随着低温胁迫时间的进一步延长,这些酶活性逐渐下降,酶活性降低使AsA-GSH循环的运转效率下降,ROS 的清除能力减弱,进一步加剧了细胞的氧化损伤。然而经MeJA 处理后,低温胁迫下夏黑葡萄叶片中DHAR、MDHAR 和GR 活性均显著(P<0.05)提高,这说明MeJA能够有效地调节AsA-GSH循环中关键酶的活性,促进AsA 和GSH 的再生,增强葡萄的抗氧化能力,从而提高葡萄对低温胁迫的耐受性。这与王萍等[5]、罗娅等[22]、Gao等[23]的研究结果一致。说明外源MeJA 可以调控夏黑葡萄AsAGSH 循环,增强葡萄对低温胁迫的抗性,为葡萄在低温环境下的生长和发育提供了重要的保护机制。
4 结 论
常温下MeJA处理对夏黑葡萄影响不明显。低温胁迫时,100 μmol·L-1 MeJA处理夏黑葡萄效果最佳,能促进植株生长、提升光合效率、增强抗氧化能力。本研究明确了MeJA 的调控效果,为葡萄抗寒栽培提供一定的理论依据,后续可深入研究其调控通路。
[1] 赵胜建,郭紫娟. 三倍体无核葡萄育种研究进展[J]. 果树学报,2004,21(4):360-364.ZHAO Shengjian,GUO Zijuan.Advances in research of breeding seedless triploid grapes[J].Journal of Fruit Science,2004,21(4):360-364.
[2] 张利鹏,刘怀锋,辛海平.葡萄抗寒机制研究进展[J].果树学报,2023,40(2):350-362.ZHANG Lipeng,LIU Huaifeng,XIN Haiping. Research progress in cold tolerance mechanism of grape[J]. Journal of Fruit Science,2023,40(2):350-362.
[3] HOU Y J,WONG D C J,LI Q Y,ZHOU H M,ZHU Z F,GONG L Z,LIANG J,REN H S,LIANG Z C,WANG Q F,XIN H P. Dissecting the effect of ethylene in the transcriptional regulation of chilling treatment in grapevine leaves[J]. Plant Physiology and Biochemistry,2023,196:1084-1097.
[4] 韩敏,曹逼力,刘树森,徐坤.低温胁迫下番茄幼苗根穗互作对其抗坏血酸-谷胱甘肽循环的影响[J].园艺学报,2019,46(1):65-73.HAN Min,CAO Bili,LIU Shusen,XU Kun. Effects of rootstock and scion interactions on ascorbate-glutathione cycle in tomato seedlings under low temperature stress[J]. Acta Horticulturae Sinica,2019,46(1):65-73.
[5] 王萍,李彦慧,张雪梅,李保国,姚飞飞.低温对仁用杏雌蕊抗坏血酸—谷胱甘肽循环的影响[J].园艺学报,2013,40(3):417-425.WANG Ping,LI Yanhui,ZHANG Xuemei,LI Baoguo,YAO Feifei. Effects of low temperature stress on ascorbate-glutathione cycle in kernel apricot pistil[J]. Acta Horticulturae Sinica,2013,40(3):417-425.
[6] 李清清,李大鹏,李德全.茉莉酸和茉莉酸甲酯生物合成及其调控机制[J].生物技术通报,2010,26(1):53-57.LI Qingqing,LI Dapeng,LI Dequan. The research progress in biosynthesis and regulation of jasmonates[J]. Biotechnology Bulletin,2010,26(1):53-57.
[7] 刘德帅,冯美,孙雨桐,王烨,迟敬楠,姚文孔. 葡萄VvGAI1与VvJAZ9 蛋白互作及低温下的表达模式分析[J].中国农业科学,2023,56(15):2977-2994.LIU Deshuai,FENG Mei,SUN Yutong,WANG Ye,CHI Jingnan,YAO Wenkong. Analysis of the interaction between VvGAI1 and VvJAZ9 proteins in grape and its expression pattern under low temperature[J]. Scientia Agricultura Sinica,2023,56(15):2977-2994.
[8] 冯斗,禤维言,黄政树,邓付园,谭湘.茉莉酸甲酯对低温胁迫下香蕉幼苗的生理效应[J].果树学报,2009,26(3):390-393.FENG Dou,XUAN Weiyan,HUANG Zhengshu,DENG Fuyuan,TAN Xiang. Effects of MeJA on cold tolerance of banana seedlings[J].Journal of Fruit Science,2009,26(3):390-393.
[9] 齐付国,李建民,段留生,李召虎.冠菌素和茉莉酸甲酯诱导小麦幼苗低温抗性的研究[J]. 西北植物学报,2006,26(9):1776-1780.QI Fuguo,LI Jianmin,DUAN Liusheng,LI Zhaohu. Inductions of coronatine and MeJA to low-temperature resistance of wheat seedlings[J]. Acta Botanica Boreali-Occidentalia Sinica,2006,26(9):1776-1780.
[10] 马岩.燕山葡萄脱水素基因VyDHN1 抗逆分子机制的研究[D].济南:齐鲁工业大学,2022.MA Yan.Study on the molecular mechanism of stress resistance of VyDHN1 gene in Yanshan grape[D].Jinan:Qilu University of Technology,2022.
[11] 杨海燕,吴文龙,闾连飞,黄正金,李维林.干旱胁迫对‘波尼’薄壳山核桃叶片生理特性的影响[J].中国南方果树,2022,51(3):130-135.YANG Haiyan,WU Wenlong,LÜ Lianfei,HUANG Zhengjin,LI Weilin. Effect of drought stress on physiological characteristics of the leaves of‘Pawnee’Carya illinoensis[J].South China Fruits,2022,51(3):130-135.
[12] FOYER C H,HALLIWELL B.The presence of glutathione and glutathione reductase in chloroplasts:A proposed role in ascorbic acid metabolism[J].Planta,1976,133(1):21-25.
[13] ZHU J,LI C Y,SUN L,CHENG Y,HOU J B,FAN Y T,GE Y H.Application of γ-aminobutyric acid induces disease resistance in apples through regulation of polyamine metabolism,GABA shunt and reactive oxygen species metabolism[J].Scientia Horticulturae,2022,291:110588.
[14] ZHANG X Y,ZHANG G C,LI P X,YANG Q Y,CHEN K P,ZHAO L N,APALIYA M T,GU X Y,ZHANG H Y. Mechanisms of glycine betaine enhancing oxidative stress tolerance and biocontrol efficacy of Pichia caribbica against blue mold on apples[J].Biological Control,2017,108:55-63.
[15] RAHMAN I,KODE A,BISWAS S K.Assay for quantitative determination of glutathione and glutathione disulfide levels using enzymatic recycling method[J]. Nature Protocols,2007,1(6):3159-3165.
[16] 金欢淳,张培安,毛娟,张军翔,王海波,房经贵.葡萄栽培防寒措施研究进展[J].北方园艺,2025(2):102-108.JIN Huanchun,ZHANG Peian,MAO Juan,ZHANG Junxiang,WANG Haibo,FANG Jinggui.Progress research on cold protection measures for grape cultivation[J]. Northern Horticulture,2025(2):102-108.
[17] 车莉莉.茉莉酸甲酯诱导VvJAZ13 参与葡萄抗寒的分子机制研究[D].兰州:甘肃农业大学,2024.CHE Lili. Molecular mechanism of methyl jasmonate-induced VvJAZ13 involved in cold resistance in grape[D].Lanzhou:Gansu Agricultural University,2024.
[18] 解振宇.茉莉酸甲酯对高寒地区设施延后栽培葡萄生理特性的影响[D].兰州:甘肃农业大学,2016.XIE Zhenyu. Effect of methyl jasmonate on physiology of delayed culture grape under cultivating in alpine greenhouse[D].Lanzhou:Gansu Agricultural University,2016.
[19] 李蔚.外源茉莉酸甲酯调控‘贵人香’葡萄品质机制研究[D].兰州:甘肃农业大学,2020.LI Wei. Mechanism of exogenous methyl jasmonate in regulating grape (Vitis vinifera L. cv. Italian Riesling) quality[D]. Lanzhou:Gansu Agricultural University,2020.
[20] 高琦,刘亚敏,刘玉民,代崇雯,李力,周凡博,张钰林.外源调节物质对干旱胁迫红椿苗木形态及光合生理的影响[J].西北农林科技大学学报(自然科学版),2024,52(7):53-63.GAO Qi,LIU Yamin,LIU Yumin,DAI Chongwen,LI Li,ZHOU Fanbo,ZHANG Yulin. Effects of exogenous substances on morphology and photosynthetic physiology of Toona ciliata seedlings under drought stress[J]. Journal of Northwest A & F University(Natural Science Edition),2024,52(7):53-63.
[21] 徐颖欢.茉莉素对杂柑光合作用的影响[D].雅安:四川农业大学,2019.XU Yinghuan. Effect of jasmonate on photosynthesis of hybrid citrus[D].Yaan:Sichuan Agricultural University,2019.
[22] 罗娅,汤浩茹,张勇.低温胁迫对草莓叶片SOD 和AsA-GSH循环酶系统的影响[J].园艺学报,2007,34(6):1405-1410.LUO Ya,TANG Haoru,ZHANG Yong.Effect of low temperature stress on activities of SOD and enzymes of ascorbate-glutathione cycle[J].Acta Horticulturae Sinica,2007,34(6):1405-1410.
[23] GAO F,SHI Y J,WANG R R,TRETYAKOVA I N,NOSOV A M,SHEN H L,YANG L. Exogenous glutathione promotes the proliferation of Pinus koraiensis embryonic cells and the synthesis of glutathione and ascorbic acid[J].Plants,2022,11(19):2586.