梨(Pyrus spp.)属于蔷薇科(Rosaceae)苹果亚科(Malinae),在全世界拥有悠久的栽培历史,种质资源丰富,基于地理分布一般被分为东方梨和西方梨,两者的果实性状具有较大差异[1]。其中,砂梨作为东方梨之一,在中国长江流域及以南地区广泛栽培,果实肉质细脆,多为圆形的绿皮或褐皮果;而西洋梨原产自欧洲,果实采后通常需后熟软化才能食用,多为葫芦形[2]。
果实性状不仅是果树品种的核心特征,也是决定其市场价值的关键因素。通过深入研究果实性状的遗传规律以及各性状之间的相关性,不仅有助于解析果树品种间性状的复杂相互关系,还有助于揭示其遗传基础,为优化果树遗传育种的技术、定位果实性状的数量性状位点(QTL)以及鉴定相关关键基因提供重要的理论依据和科学指导。
目前,在桃[3-4]、柑橘[5-6]、枇杷[7-8]、苹果[9-10]等果树中已有关于果实性状遗传特征及相关性分析的研究报道。在梨中,刘娟等[11]利用砀山酥梨×苹果梨F1代群体进行果实性状遗传趋势的分析,发现单果质量、果形指数、可溶性固形物含量等性状呈正态分布,属于数量遗传性状;Dondini等[12]利用Max red Bartlett、Cascade 和California 群体研究欧洲梨(Pyrus communis L.)红色果皮性状的遗传规律,发现该性状为单基因显性遗传;Qin等[13]利用Niitaka×Hongxiangsu群体探究了18 个梨果实相关性状与梨果肉性状之间的相关性。然而,利用亲缘关系远且性状差异显著的亲本用于杂交育种,例如东方砂梨与西洋梨杂交后代果实性状遗传及相关性分析研究鲜有报道。笔者在本试验中旨在进一步丰富梨果实杂交后代遗传规律,通过比较砂梨翠玉与西洋梨早红考密斯亲本及杂交后代果实性状并进行通径分析,旨在为梨的遗传育种和果实性状QTL定位提供理论基础。
1 材料和方法
1.1 试验材料
笔者选用典型的砂梨品种翠玉与西洋梨品种早红考密斯的杂交F1代群体为试验材料。该杂交组合于2013年完成人工授粉,于2014年获得杂交种子并播种在浙江省农业科学院杨渡科研创新基地,于2023年从F1代群体中选择136株已进入稳定结果期的实生树作为研究对象。在栽培过程中,对杂交群体实施标准化管理,包括常规肥水管理、冬季修剪以及疏花疏果等措施,确保植株正常生长发育以供试验所需。
1.2 性状测定指标与方法
于2023年6—9月梨果实成熟期采样,每株树各采3组重复,每组至少3颗果实供调查研究。果实成熟判断标准为:根据《中国梨遗传资源》[14]中对果实底色的分类,群体中果实底色从绿色开始转黄变为黄绿色,且果肉生涩感消失,即判定为果实成熟。测定指标有:单果质量、果实横径、果实纵径、果梗长度、果梗粗度、果肉硬度、可溶性固形物含量、果皮颜色及红色占比、果实形状。标准参考《梨种质资源描述规范和数据标准》[15],所有指标均为果实采收当天测定。
单果质量使用天平(精度0.1 g)测定,取平均值;果实纵径、横径与果梗粗度、长度均使用游标卡尺测量(精度0.01 mm),取平均值;果实硬度使用Brookfield CT3-25K 质构仪测定,取平均值;可溶性固形物含量使用ATAGO PAL-1 型手持式数显折光仪测定;果皮红色面积占比使用浙江省农业科学院“浙样型”作物表型精准鉴定与智能应用平台进行表型数据采集[16-17],并结合肉眼观测的果皮红晕面积数据,将果皮红晕着色情况分为无明显红晕着色(红晕面积占全果面<2%)、小面积红晕着色(红晕面积占全果面≥2%且≤15%)、较大面积红晕着色(红晕面积占全果面>15%)。
1.3 数据统计与处理
使用Microsoft Excel 2019 进行数据统计、整理并进行表格绘制;使用IBM SPSS Statistics 27.0对梨F1代群体果实性状进行K-S Test理论整体拟合性检验与S-W Test正态性检验、频率分布直方图绘制、相关性分析、多元线性回归以及通径分析等数据分析。其中,K-S Test适用于大样本(n>50),S-W Test适用于小样本(n≤50)。本研究样本量适用于K-S Test(n=136>50),因此以S-W Test 检验结果为准。对轻度正偏态分布的数据进行平方根变换后纳入后续分析,SPSS 语句为:COMPUTE x_new = SQRT(x)(SQRT为开平方根Square Root缩写)。
进行K-S Test与S-W Test正态性检验时,当P>0.05 时,可认为资料服从标准正态分布;若P≤0.05,需结合直方图分布曲线与正态Q-Q图等判断数据是否符合正态或偏态分布。当P=0.2时,达到SPSS软件统计的真显著性下限,实际P值会更高。
通径分析需检验模型VIF值(方差扩大因子)排除模型共线性影响模型可信度问题。当VIF>1 且≤5 时,表明模型共线性问题较轻,不影响模型可信度;当VIF>5 且≤10 时,表明模型存在一定的共线性问题,可能会影响模型可信度;当VIF>10 或为inf 时,代表模型存在严重的共线性问题,模型可能不具有可信度。
相关计算公式:中亲值=(亲本A+亲本B)/2;变异系数/%=(标准偏差/平均值)×100;遗传传递力/%=(子代性状均值/中亲值)×100;优势率/%=(平均值-中亲值)/中亲值×100;超高亲率/%=(高于高亲表型值的F1 单株数/F1 单株总数)×100;低低亲率/%=(低于低亲表型值的F1单株数/F1单株总数)×100;果形指数=果实纵径/果实横径。其中,遗传传递力反映子代相对于双亲平均值的遗传表现,优势率衡量杂种优势程度。
2 结果与分析
2.1 果实性状分析
2.1.1 单果质量遗传分析 从表1 可知,翠玉与早红考密斯F1代群体单果质量性状呈现广泛分离,分离范围为82.80~430.00 g,变异系数为33.31%,遗传传递力为79.75%,优势率为-20.25%;群体中超高亲率为12.50%,低低亲率为69.85%。通过K-S Test与S-W Test正态性检验显示P<0.001,结合图1分布曲线的峰度与偏度、频率直方图和正态Q-Q 图分析可得单果质量分布规律呈正态分布,表明单果质量性状为多个基因共同控制的数量性状,整体呈现趋小变异的遗传倾向。其中,较大的分离范围与少量超高亲植株的存在,表明该性状具有较大的遗传改良潜力。
表1 翠玉×早红考密斯F1代群体的单果质量遗传变异统计分析
Table 1 Statistical analysis of genetic variation in single fruit weight of the F1 generation from the cross of Cuiyu×Doyenne du Comice
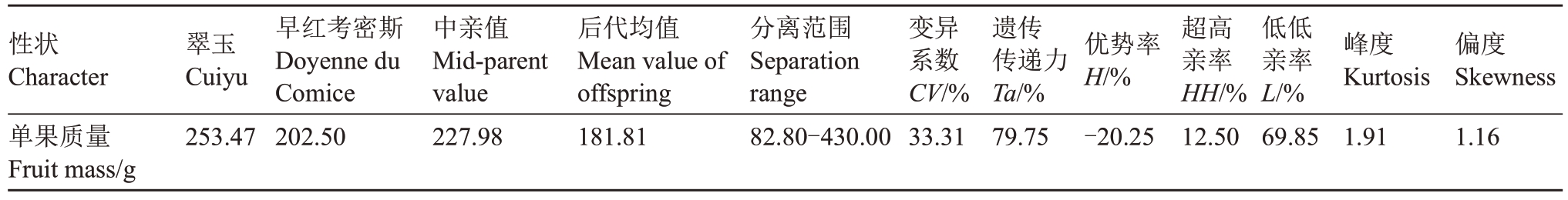
性状Character单果质量Fruit mass/g翠玉Cuiyu 253.47早红考密斯Doyenne du Comice 202.50中亲值Mid-parent value 227.98后代均值Mean value of offspring 181.81分离范围Separation range 82.80-430.00变异系数CV/%33.31遗传传递力Ta/%79.75优势率H/%-20.25超高亲率HH/%12.50低低亲率L/%69.85峰度Kurtosis 1.91偏度Skewness 1.16
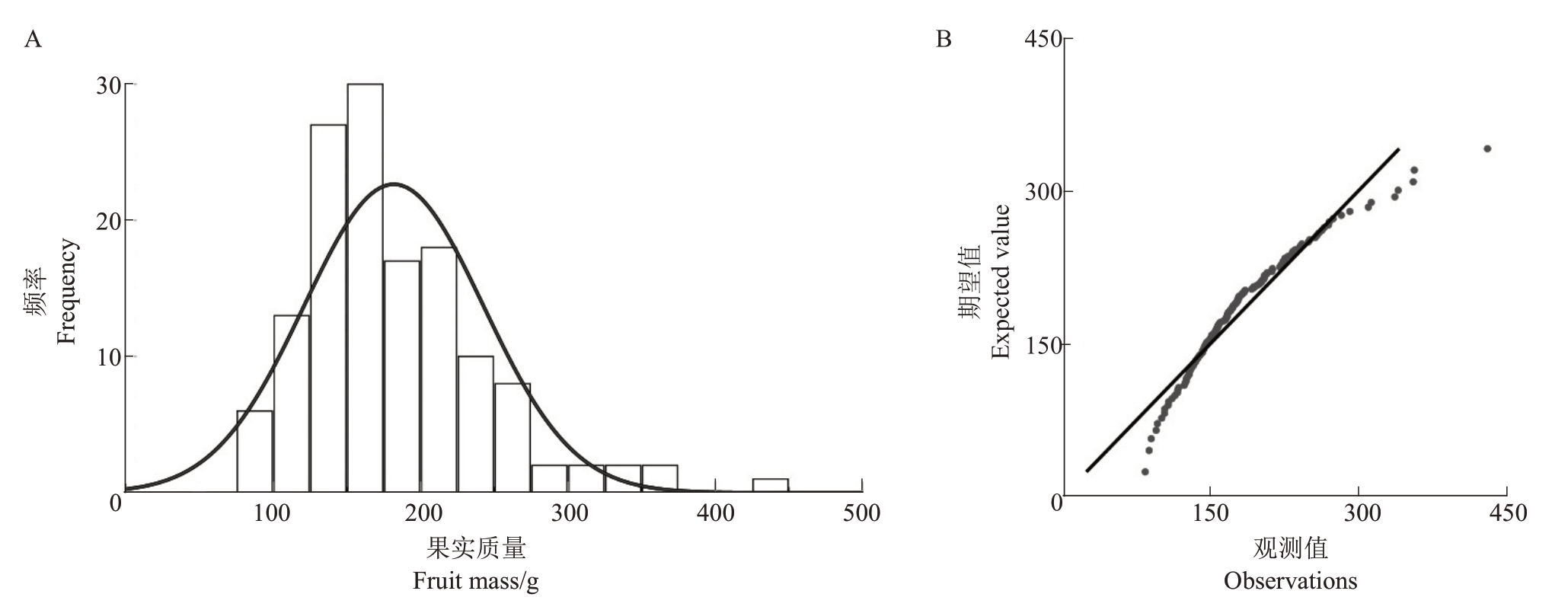
图1 翠玉×早红考密斯F1代群体单果质量频率统计直方图(A)及正态Q-Q 图(B)
Fig.1 Frequency histogram(A)and normal Q-Q plot(B)of single fruit mass for the F1 generation population of Cuiyu×Doyenne du Comice
2.1.2 果实横径遗传分析 从表2 可知,翠玉与早红考密斯F1代果实横径性状呈现广泛分离,分离范围为37.08~94.88 mm,变异系数为11.41%,遗传传递力为82.78%,优势率为-17.22%;群体中超高亲率仅为0.74%,低低亲率为77.94%。通过K-S Test 与S-W Test 正态性检验显示P= 0.085,结合图2 分布曲线的峰度与偏度、频率直方图和正态Q-Q 图分析可得,果实横径分布规律呈正态分布,表明果实横径性状为多个基因共同控制的数量性状,整体呈现趋小变异的遗传倾向。
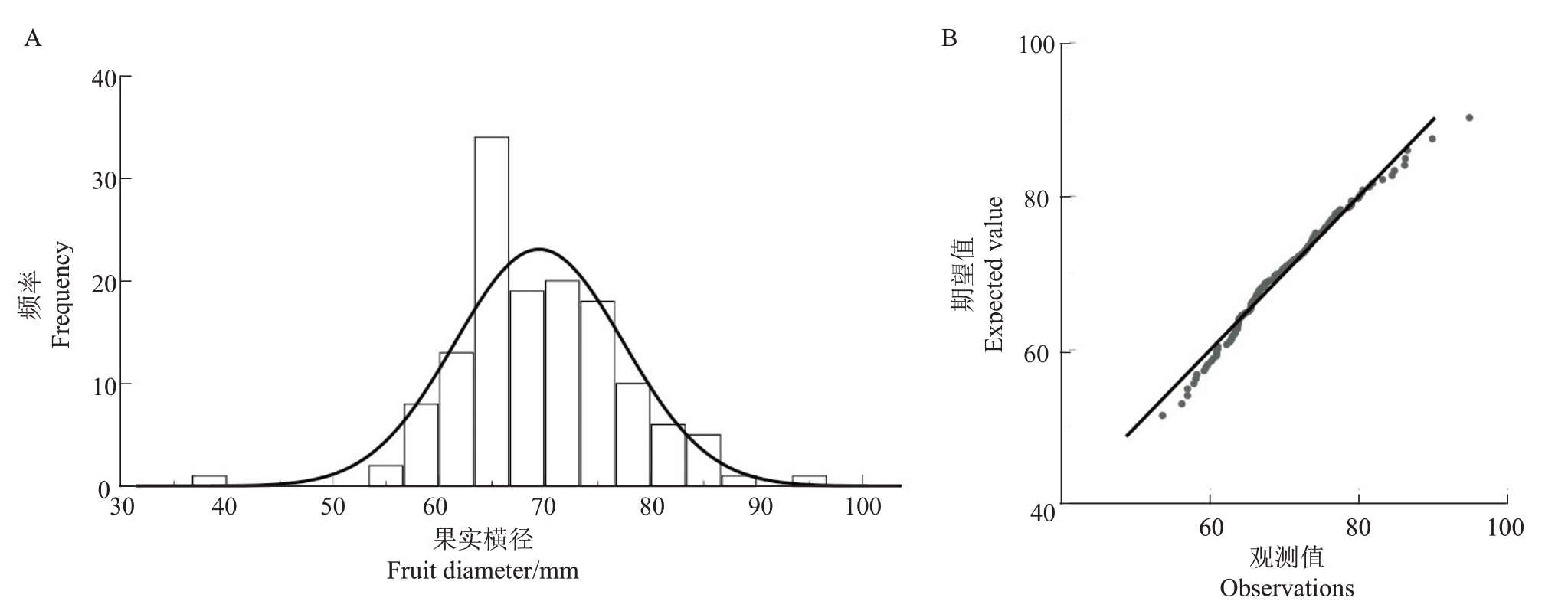
图2 翠玉×早红考密斯F1代群体的果实横径频率直方图(A)及正态Q-Q 图(B)
Fig.2 Frequency histogram(A)and normal Q-Q plot(B)of fruit diameter frequency in the F1 generation population of Cuiyu×Doyenne du Comice
表2 翠玉×早红考密斯F1代群体的果实横径遗传变异统计分析
Table 2 Statistical analysis of genetic variation in fruit transverse diameter of the F1 generation population of Cuiyu×Doyenne du Comice

性状Character果实横径Fruit diameter/mm翠玉Cuiyu 93.37早红考密斯Doyenne du Comice 74.50中亲值Mid-parent value 83.93后代均值Mean value of offspring 69.48分离范围Separation range 37.08-94.88变异系数CV/%11.41遗传传递力Ta/%82.78优势率H/%-17.22超高亲率HH/%0.74低低亲率L/%77.94峰度Kurtosis 1.76偏度Skewness 0.06
2.1.3 果实纵径遗传分析 从表3 可知,翠玉与早红考密斯F1代果实平均纵径同样呈现广泛分离,分离范围为39.47~89.85 mm,变异系数为13.65%,遗传传递力为72.68%,而优势率为-27.32%;群体低低亲率为78.57%,超高亲率为0,表明后代所有果实纵径小于父本早红考密斯。通过K-S Test与S-W Test正态性检验显示P=0.082,结合图3分布曲线的峰度与偏度、频率直方图和正态Q-Q图分析可得,F1代果实纵径分布规律呈标准的正态分布,表明该性状为受多个基因共同控制的数量性状。果实纵径总体呈现显著的趋小变异的遗传倾向,且性状分离范围较大。
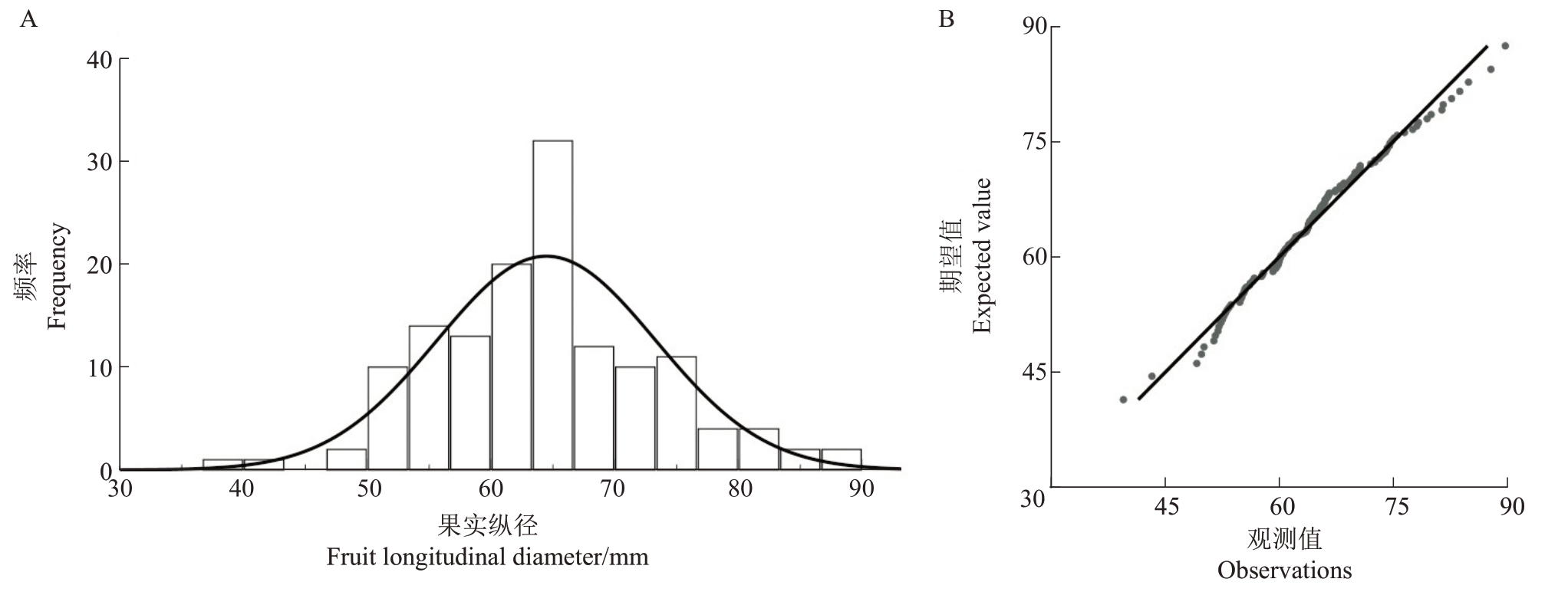
图3 翠玉×早红考密斯F1代群体果实纵径频率直方图(A)及正态Q-Q 图(B)
Fig.3 Frequency histogram(A)and normal Q-Q plot(B)of longitudinal diameter frequency of fruits in the F1 generation of Cuiyu×Doyenne du Comice
表3 翠玉×早红考密斯F1代群体的果实纵径遗传变异统计分析
Table 3 Statistical analysis of genetic variation in fruit longitudinal diameter of the F1 generation population of Cuiyu×Doyenne du Comice
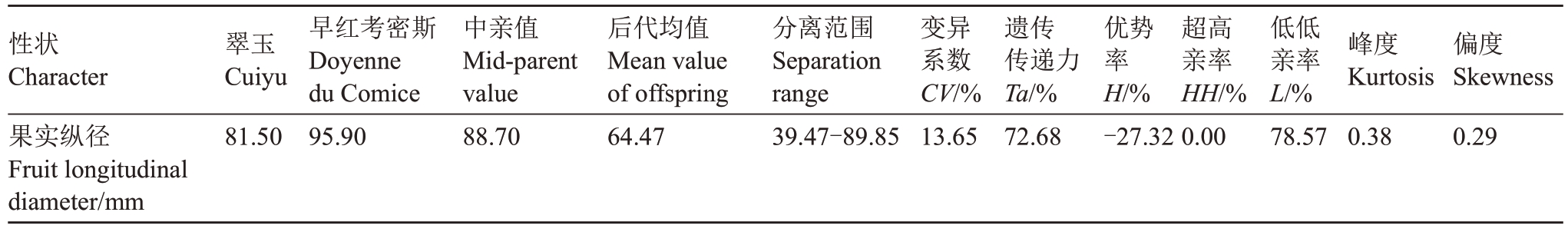
性状Character果实纵径Fruit longitudinal diameter/mm翠玉Cuiyu 81.50早红考密斯Doyenne du Comice 95.90中亲值Mid-parent value 88.70后代均值Mean value of offspring 64.47分离范围Separation range 39.47-89.85变异系数CV/%13.65遗传传递力Ta/%72.68优势率H/%-27.32超高亲率HH/%0.00低低亲率L/%78.57峰度Kurtosis 0.38偏度Skewness 0.29
2.1.4 果梗长度遗传分析 由表4 可得,翠玉与早红考密斯F1代果实平均果梗长度同样也呈现广泛分离,分离范围为15.2~48.3 mm,变异系数为25.19%,遗传传递力为99.39%,优势率为-0.61%;超高亲率为28.57%,低低亲率为32.14%,表明F1代平均果梗长度低于中亲值但高于低亲值,具有显著的遗传分离。通过K-S Test 与S-W Test 正态性检验可得P=0.003,结合图4分布曲线的峰度与偏度、频率直方图和正态Q-Q 图分析可得,F1代果梗长度分布规律呈正态分布,表明为受多个基因共同控制的数量性状。果梗长度呈现略微趋小变异的遗传倾向,性状分离范围较大,且超高亲率较高,表明该性状具有较大的遗传改良潜力。
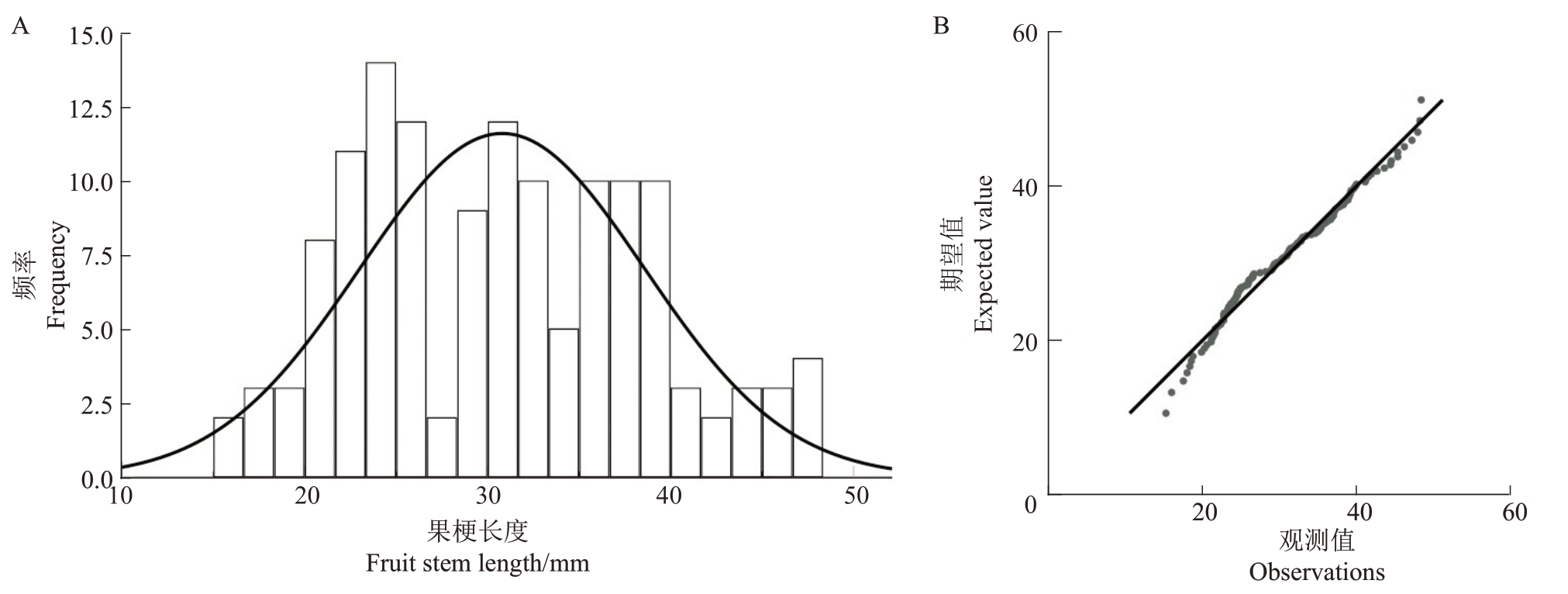
图4 翠玉×早红考密斯F1代群体果梗长度频率直方图(A)及正态Q-Q 图(B)
Fig.4 Frequency histogram(A)and normal Q-Q plot(B)of fruit stem length in the F1 generation of Cuiyu×Doyenne du Comice
表4 翠玉×早红考密斯F1代群体的果梗长度遗传变异统计分析
Table 4 Statistical analysis of genetic variation in fruit stem length of F1 population of Cuiyu×Doyenne du Comice

性状Character果梗长度Fruit stem length/mm翠玉Cuiyu 27.87早红考密斯Doyenne du Comice 34.10中亲值Mid-parent value 30.98后代均值Mean value of offspring 30.79分离范围Separation range 15.20-48.30变异系数CV/%25.19遗传传递力Ta/%99.39优势率H/%-0.61超高亲率HH/%28.57低低亲率L/%32.14峰度Kurtosis-0.70偏度Skewness 0.26
2.1.5 果梗粗度遗传分析 由表5 可知,翠玉与早红考密斯F1代果实平均果梗粗度低于中亲值与低亲值,性状呈现广泛分离,分离范围为2.41~6.25 mm,变异系数为16.49%,遗传传递力为72.9%,优势率为-27.1%,超高亲率为0.60%,低低亲率为73.21%。通过K-S Test与S-W Test正态性检验可得P=0.006,结合图5 分布曲线的峰度与偏度、频率直方图和正态Q-Q 图分析,F1代果梗粗度分布规律呈偏正态分布;使用平方根变换处理偏态数据后可得K-S Test正态性检验P=0.065,符合正态分布,表明该性状是由多个基因共同控制的数量性状。果梗粗度呈显著趋小变异的遗传倾向,性状的分离范围较大,且超高亲率较低,表明该性状遗传改良潜力有限。
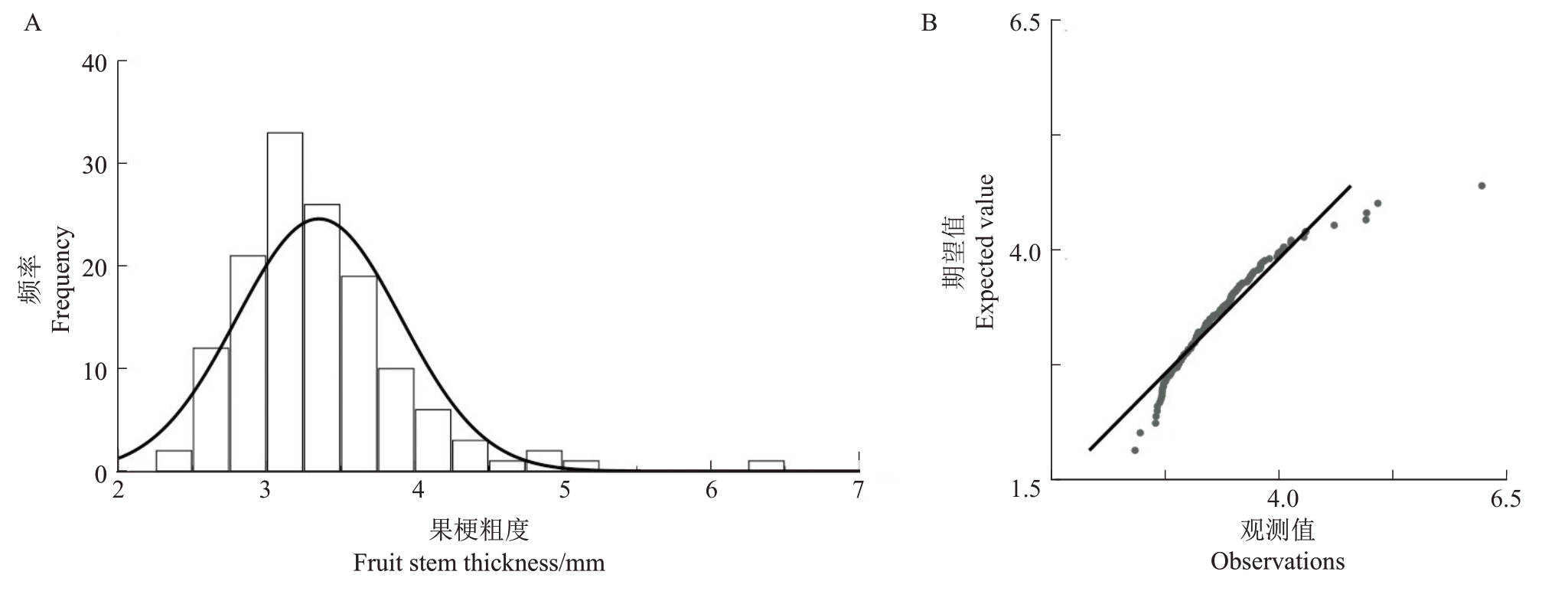
图5 翠玉×早红考密斯F1代群体的果梗粗度频率直方图(A)及正态Q-Q 图(B)
Fig.5 Frequency histogram(A)and normal Q-Q plot(B)of fruit stem thickness in the F1 generation of Cuiyu×Doyenne du Comice
表5 翠玉×早红考密斯F1代群体的果梗粗度遗传变异统计分析
Table 5 Statistical analysis of genetic variation in fruit stem thickness of F1 population of Cuiyu×Doyenne du Comice
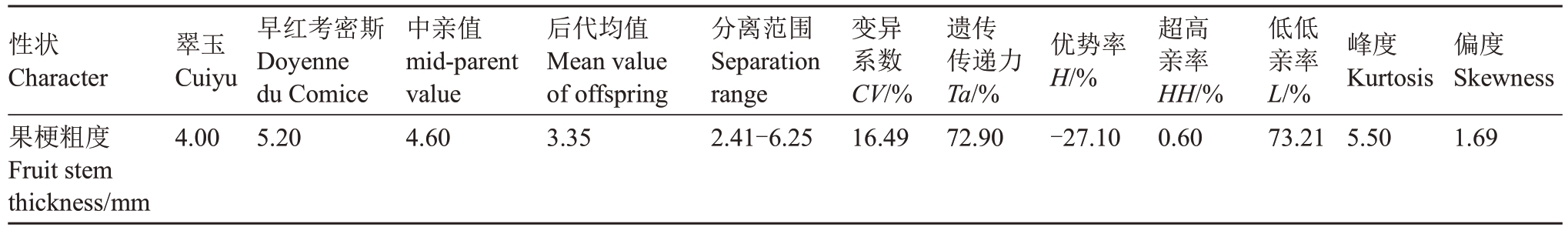
性状Character果梗粗度Fruit stem thickness/mm翠玉Cuiyu 4.00早红考密斯Doyenne du Comice 5.20中亲值mid-parent value 4.60后代均值Mean value of offspring 3.35分离范围Separation range 2.41-6.25变异系数CV/%16.49遗传传递力Ta/%72.90优势率H/%-27.10超高亲率HH/%0.60低低亲率L/%73.21峰度Kurtosis 5.50偏度Skewness 1.69
2.1.6 果实硬度遗传分析 从表6 可得,翠玉与早红考密斯F1代果实平均硬度高于中亲值与低亲值,性状呈现广泛的分离,分离范围为4.53~35.96 N,变异系数为35.23%,遗传传递力高达124.35%,优势率为24.35%;超高亲率为8.93%,低低亲率为0,表明F1代所有果实硬度高于父本早红考密斯。通过K-S Test 与S-W Test 正态性检验可得P=0.013,结合图6分布曲线的峰度与偏度、频率直方图和正态Q-Q图分析可得,F1代果实硬度分布规律呈正态分布,表明该性状是由多个基因共同控制的数量性状。果实硬度呈趋高变异的遗传倾向,性状分离范围较大,虽然硬度高于低亲与中亲,但超高亲率偏低,超高亲植株数量较少。
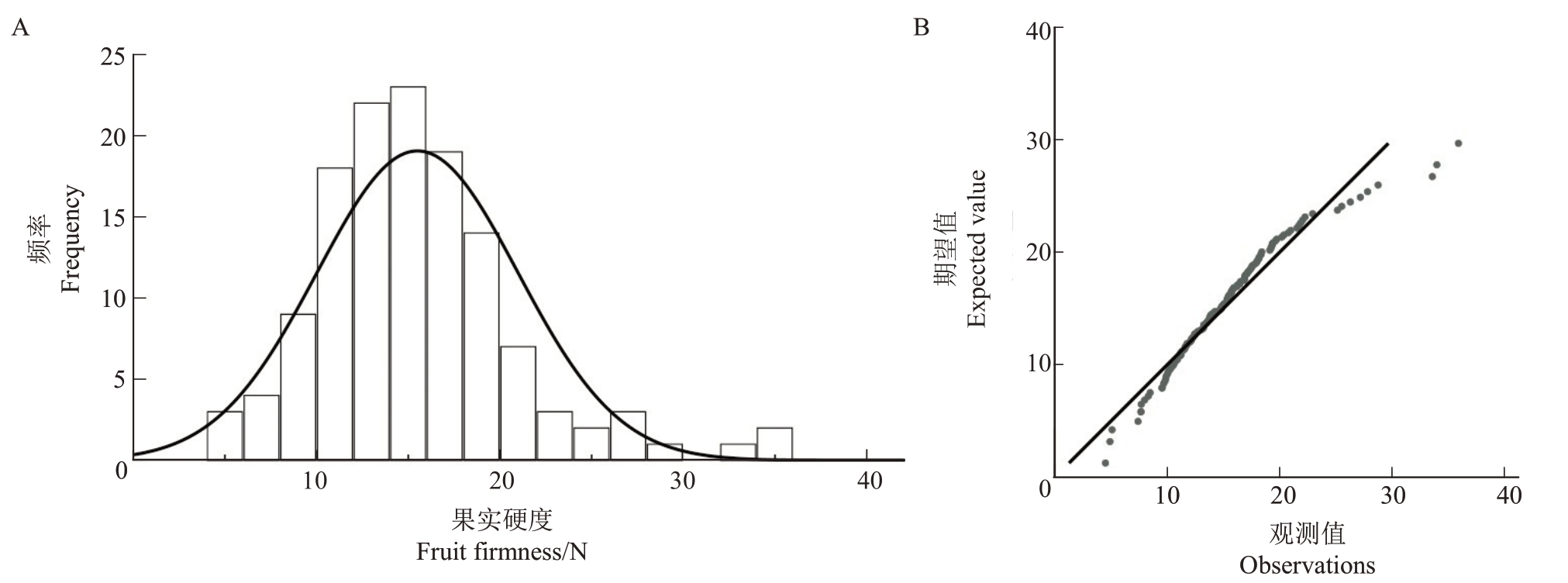
图6 翠玉×早红考密斯F1代群体的果实硬度频率直方图(A)及正态Q-Q 图(B)
Fig.6 Frequency histogram(A)and normal Q-Q plot(B)of fruit hardness in the F1 generation population of Cuiyu×Doyenne du Comice
表6 翠玉×早红考密斯F1代群体的果实硬度遗传变异统计分析
Table 6 Statistical analysis of genetic variation in fruit hardness of F1 population of Cuiyu×Doyenne du Comice
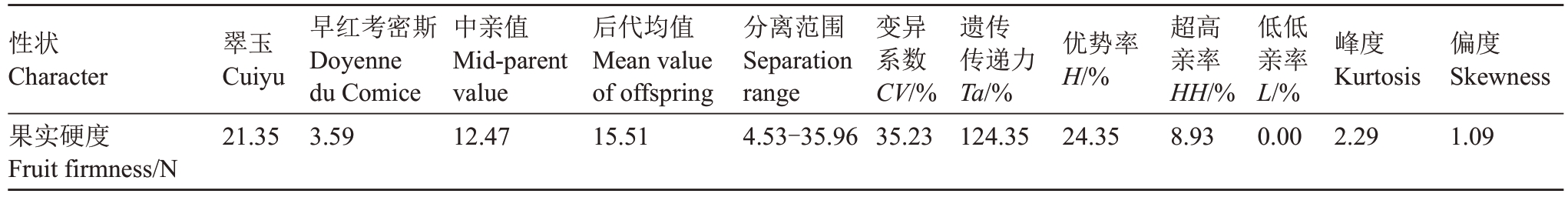
性状Character果实硬度Fruit firmness/N翠玉Cuiyu 21.35早红考密斯Doyenne du Comice 3.59中亲值Mid-parent value 12.47后代均值Mean value of offspring 15.51分离范围Separation range 4.53-35.96变异系数CV/%35.23遗传传递力Ta/%124.35优势率H/%24.35超高亲率HH/%8.93低低亲率L/%0.00峰度Kurtosis 2.29偏度Skewness 1.09
2.1.7 可溶性固形物含量遗传分析 从表7 可得,翠玉与早红考密斯F1代的平均可溶性固形物含量低于中亲值与低亲值,且性状呈现广泛分离,分离范围为5.96%~13.2%,变异系数为15.69%,遗传传递力为83.34%,优势率为-16.66%;超高亲率为1.79%,低低亲率为59.52%。通过K-S Test与S-W Test正态性检验可得P>0.2,结合图7分布曲线的峰度、偏度以及频率直方图和正态Q-Q 图分析可得,F1代可溶性固形物含量分布规律为标准的正态分布,表明该性状是由多个基因共同控制的数量性状。虽然F1代果实可溶性固形物含量普遍较低,但超高亲后代仍具培育高糖品种的潜力。
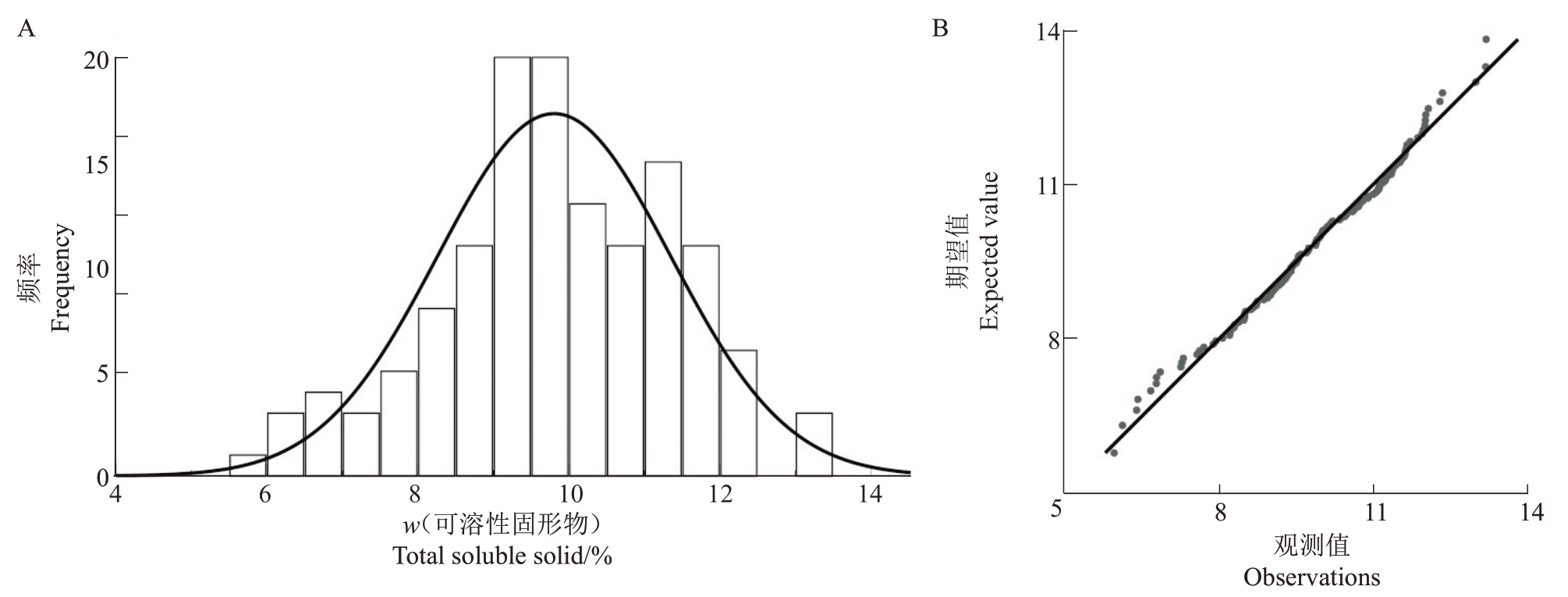
图7 翠玉×早红考密斯F1代群体的可溶性固形物含量频率直方图(A)及正态Q-Q 图(B)
Fig.7 Frequency histogram(A)and normal Q-Q plot(B)of total soluble solids in the F1 generation population of Cuiyu×Doyenne du Comice
表7 翠玉×早红考密斯F1代群体的可溶性固形物含量遗传变异统计分析
Table 7 Statistical analysis of genetic variation in soluble solids mass fraction of F1 population of Cuiyu×Doyenne du Comice

性状Character可溶性固形物Total soluble solid/%翠玉Cuiyu 11.03早红考密斯Doyenne du Comice 12.50中亲值Mid-parent value 11.76后代均值Mean value of offspring 9.80分离范围Separation range 5.96-13.20变异系数CV/%15.69遗传传递力Ta/%83.34优势率H/%-16.66超高亲率HH/%1.79低低亲率L/%59.52峰度Kurtosis-0.22偏度Skewness-0.25
2.1.8 果实形状分布规律 杂交群体母本翠玉果实为圆形,父本早红考密斯为葫芦形,观察统计发现,F1后代的果实果形大致可分为三种形状,分别为扁圆形,圆形和葫芦形(图8)。如图9 所示,杂交群体中果实扁圆形果形株数为47株,占杂交群体植株总数比率为34.56%;圆形果形株数为82 株,占比为60.29%;葫芦形果形株数为7 株,占比为5.15%。通过对F1代群体果形指数分析可得(图10),F1代大部分果实果形指数集中分布在0.85~1.0 之间,果形更倾向于母本翠玉(0.87)而非父本早红考密斯(1.29)。综上结果表明,翠玉与早红考密斯杂交F1代果实的形状更偏向于母本翠玉。
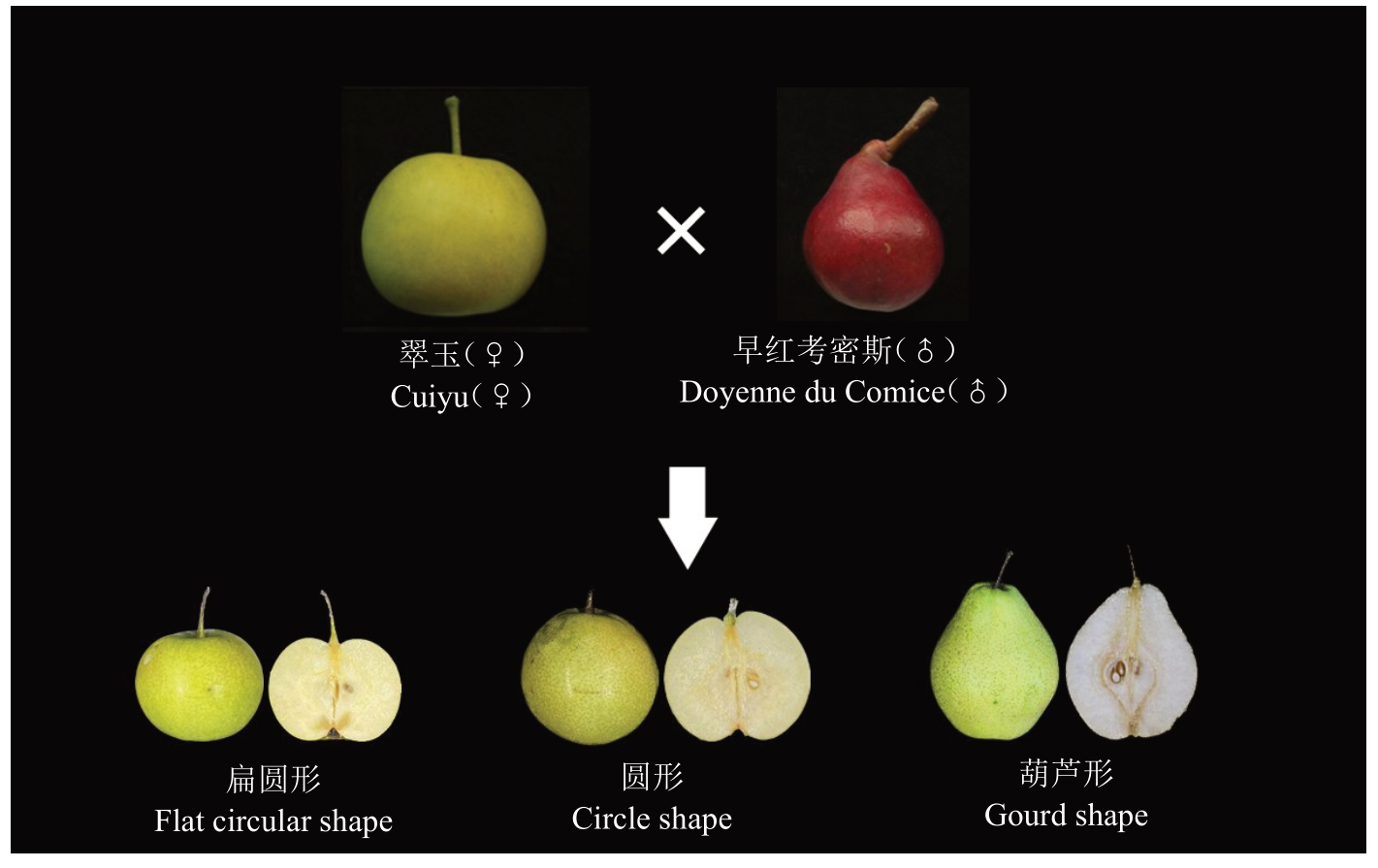
图8 翠玉×早红考密斯F1代群体的果实形状分类标准
Fig.8 Classification criteria for fruit shape of F1 generation population of Cuiyu×Doyenne du Comice
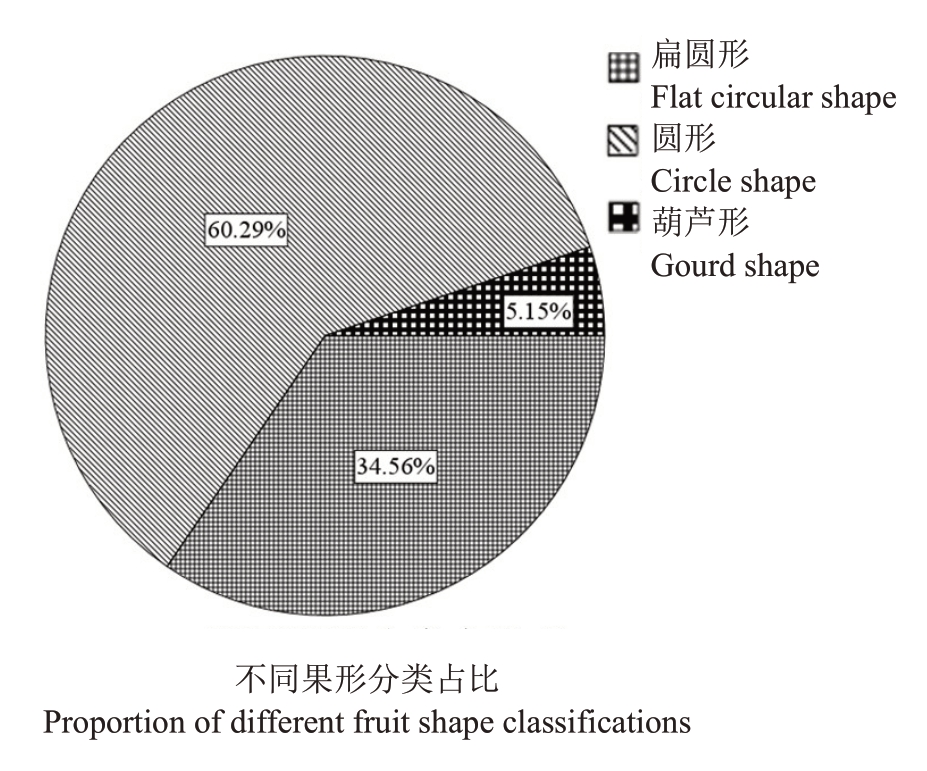
图9 翠玉×早红考密斯F1代群体的不同果形分类占比
Fig.9 Proportion of different fruit shape classifications in the F1 generation of Cuiyu×Doyenne du Comice
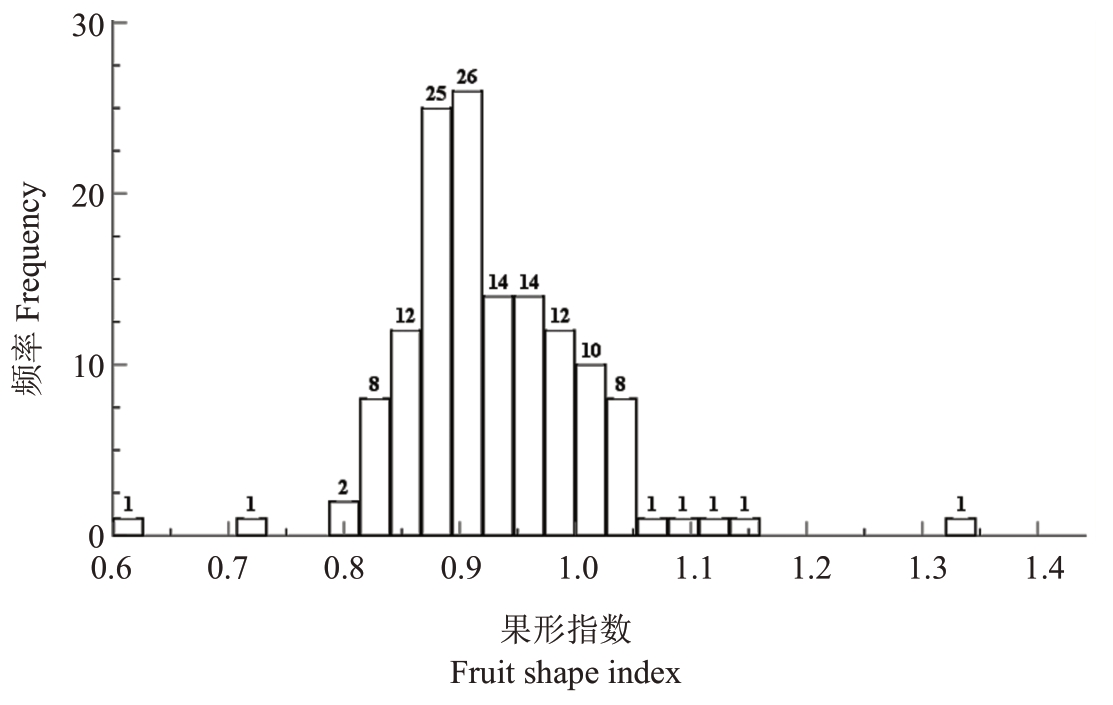
图10 翠玉×早红考密斯F1代群体的群体果形指数频率图
Fig.10 Frequency chart of group fruit shape index for the F1 generation of Cuiyu×Doyenne du Comice
2.1.9 果皮红色面积占比分布规律 如图8 所示,本研究所用杂交群体亲本为果皮呈现纯绿色的翠玉与近乎全红的早红考密斯。杂交后代果皮红色面积占比统计结果见图11和图12,后代皮色以纯黄绿色居多,为84 株,占总数的61.64%;有红晕着色的有52 株,占总数的38.36%。其中,果面带有小面积红晕(红晕面积占果面2%~15%)的有46株,占总数的34.25%;果面带有较大面积的红晕(红晕面积占果面15%以上)有6株,占总数的4.11%。该结果表明,翠玉与早红考密斯杂交F1代果实颜色同样更偏向于母本翠玉的黄绿色,有着色的后代可作为后续红皮梨育种的储备资源。

图11 翠玉×早红考密斯F1代群体的果皮红色面积占比直观图
Fig.11 Classification of the proportion of red skin area in the F1 generation of Cuiyu×Doyenne du Comice
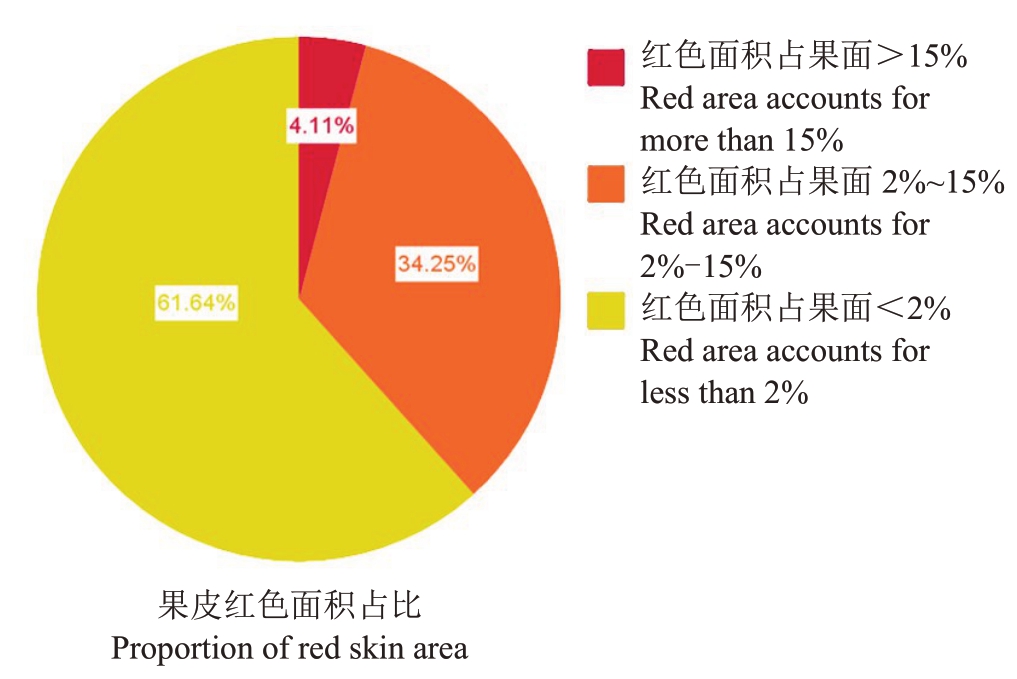
图12 翠玉×早红考密斯F1代群体的果皮红色面积占比
Fig.12 Fan shaped statistical chart of the proportion of red skin area in the F1 generation of Cuiyu×Doyenne du Comice
2.2 果实性状间的相关性分析
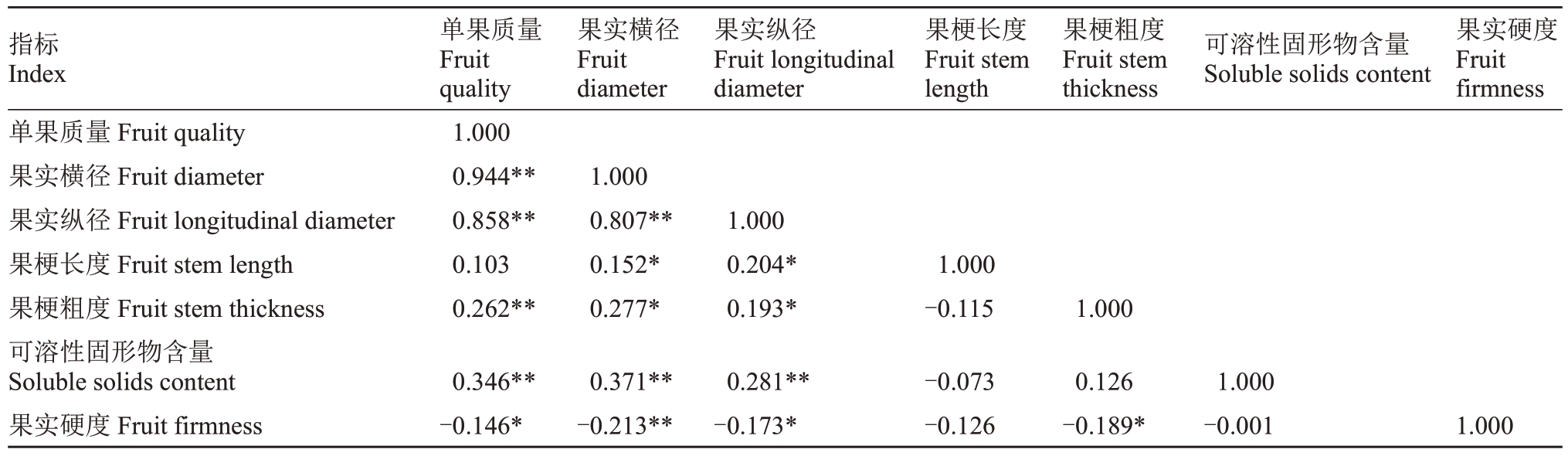
进一步对翠玉与早红考密斯F1代单果质量、果实横径、果实纵径、果梗长度、果梗粗度、可溶性固形物含量、果实硬度等7 个性状进行相关性分析(表8)。结果显示,单果质量与果实横径、果实纵径、果梗粗度以及可溶性固形物含量呈极显著正相关(P<0.01),与果实硬度呈显著负相关(P<0.05);果实横径与果实纵径及可溶性固形物含量呈极显著正相关,与果梗长度、果梗粗度呈显著正相关,与果实硬度呈极显著负相关;果实纵径与可溶性固形物含量呈极显著正相关,与果梗长度、果梗粗度呈显著正相关,与果实硬度呈显著负相关;果梗粗度与果实硬度呈显著负相关,其余性状间的相关性不显著。对于相关性较强的性状,其QTL位置可能相近。
表8 翠玉×早红考密斯F1代群体的果实性状相关性
Table 8 Correlation of fruit characteristics between the F1 population of Cuiyu×Doyenne du Comice
注:*表示显著相关(P<0.05),**表示极显著相关(P<0.01)。
Note:*indicates significant correlation(P<0.05);**indicates extremely significant correlation(P<0.01).
指标Index单果质量Fruit quality果实横径Fruit diameter果实纵径Fruit longitudinal diameter果梗长度Fruit stem length果梗粗度Fruit stem thickness可溶性固形物含量Soluble solids content果实硬度Fruit firmness单果质量Fruit quality 1.000 0.944**0.858**0.103 0.262**果实横径Fruit diameter果实纵径Fruit longitudinal diameter果梗长度Fruit stem length果梗粗度Fruit stem thickness可溶性固形物含量Soluble solids content果实硬度Fruit firmness 1.000 0.807**0.152*0.277*1.000 0.204*0.193*1.000-0.115 1.000 0.346**-0.146*0.371**-0.213**0.281**-0.173*-0.073-0.126 0.126-0.189*1.000-0.001 1.000
2.3 果实性状间多元线性回归以及通径分析
通过以上数据分析表明,翠玉与早红考密斯F1代果实性状间存在一定相关性。为进一步研究果实性状间的关系,通过构建多元线性回归方程,可以更好地预测果实性状的未来趋势。本研究以单果质量(Y)为因变量,果实横径(X1)、果实纵径(X2)、果梗长度(X3)、果梗粗度(X4)、可溶性固形物含量(X5)和果实硬度(X6)为自变量,采用逐步回归分析法,得到关于单果质量的最优多元线性回归方程:

回归方程的相关系数为R2=0.919,剩余通径系数为e=0.285,各自变量VIF值分别为2.972、2.839、1.087,表明该方程可信度与拟合度较高,且已考虑到影响单果质量的主要因素。果实横径(X1)、果实纵径(X2)、果梗粗度(X4)是影响单果质量的主要因素,与表9的结果一致。在逐步回归分析中,果梗长度(X3)、可溶性固形物含量(X5)、果实硬度(X6)对单果质量影响较小,故直接剔除。
表9 翠玉×早红考密斯F1代群体的单果质量与其他果实性状间的通径分析
Table 9 Path analysis between single fruit quality and other fruit traits of the F1 generation population of Cuiyu×Doyenne du Comice
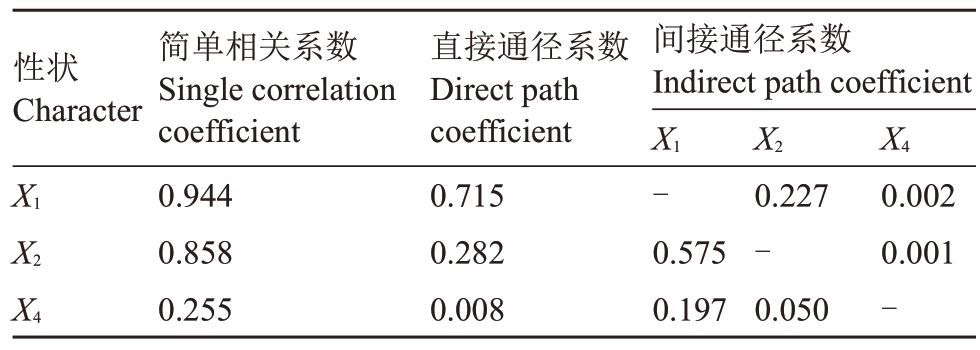
性状Character间接通径系数Indirect path coefficient X1 X2 X4 X1-X2 X4简单相关系数Single correlation coefficient 0.944 0.858 0.255直接通径系数Direct path coefficient 0.715 0.282 0.008 0.575 0.197 0.227-0.050 0.002 0.001-
由表9可知,简单相关系数表明,各个影响因素与单果质量的相关性大小排列为果实横径(0.944)>果实纵径(0.858)>果梗粗度(0.255),表明果实横径对单果质量直接作用最大,其次是果实纵径,最后是果梗粗度,影响均为正相关。直接通径系数显示,直接对单果质量产生影响的因素相关性自大到小为果实横径(0.715)>果实纵径(0.282)>果梗粗度(0.008)。
果实横径对单果质量的影响主要包括直接作用(0.715),也包括与果实纵径(0.227)、果梗粗度(0.002)等性状通过间接作用影响单果质量。其中果实横径与果实纵径、果梗粗度的间接作用均呈现的增强作用,尤其是果实横径,对单果质量直接增强作用最强(0.715),并且直接增强作用显著强于对单果质量第二大影响因素果实纵径(0.282)。
果实纵径对单果质量的影响主要通过直接作用(0.282)以及通过与果实横径(0.575)、果梗粗度(0.001)等性状的间接作用影响单果质量,果实横径、果实横径与果梗粗度的间接作用均呈现增强作用。
果梗粗度对单果质量(0.008)的影响除了直接作用以外,也通过与果实横径(0.197)、果实纵径(0.050)等因素发挥较明显的间接增强作用。
综上,果实横径是影响单果质量的最关键因素,具有最强的直接作用和显著的正面间接作用,其次是果实纵径、果梗粗度,这些因素通过不同程度的直接和间接作用,共同影响着果实的单果质量。
3 讨 论
梨果实品质是决定其市场竞争力的重要因素,由多种性状共同决定。梨单果质量、果实横径、果实纵径、果梗长度、果梗粗度、果实形状以及可溶性固形物含量等均为受多基因控制的数量性状[18-20];果皮色泽同样作为果实重要经济性状,其遗传模式为质量性状遗传[21];而果实硬度作为确定果树成熟度的重要性状之一,是判断果实是否耐贮运的决定性指标之一[22]。梨种间或品种间杂交后代性状常出现广泛分离,大部分性状的杂交表现倾向均为趋小性[23],部分性状甚至存在远低于低亲值的极端单株,这一现象在本文所选用的F1代群体中尤为明显。究其原因,在于杂交群体的亲本均为人工或自然杂交选育品种,遗传背景高度杂合。因此,F1代群体性状分离广泛,非加性效应显著[24-25]。本研究采用的F1代群体虽普遍存在性状劣变,但通过双亲微效基因的累积效应,仍筛选出具有超高亲性状的优异单株。群体中显著的性状分离现象为果实性状QTL 定位提供了理想材料,该遗传特征兼具种质创新与基因定位双重研究价值。
果实性状遗传分析结果显示,翠玉×早红考密斯梨F1代群体后代中,单果质量、果实横径、果实纵径、果梗粗度、可溶性固形物含量5个性状都表现为平均值低于中亲值和低亲值,遗传传递力介于72.68%~99.39%,均显著低于100%,优势率为负,几乎没有杂种优势,且遗传倾向表现为趋小遗传,性状出现明显衰退,劣变率很高,与郭凯丽等[26]利用库尔勒香梨×晋蜜梨与库尔勒香梨×黄冠梨F1代群体得出的单果质量遗传规律、单果质量与果实横纵径显著相关的结论一致,但与玉露香×晋蜜梨F1代群体的单果质量遗传规律相反;可溶性固形物含量、果梗粗度性状劣变率显著高于郭凯丽等[26]的研究结果。在本研究中,果实纵径性状的衰退表现最为严重,低低亲率高达78.57%,超高亲率为0;而单果质量相对于上述其他性状变异系数较大,性状衰退表现较轻,并且超高亲率相对较高,存在少量超高亲类型的植株,与白牡丹等[27]、王宇霖等[28]研究基本一致。F1代可溶性固形物含量性状超高亲率仅为1.79%,几乎没有优于西洋梨父本早红考密斯的单株,与张莹等[29]提出的梨种质资源中西洋梨可溶性固形物含量普遍高于脆肉型梨的规律一致,推测其遗传模式可能涉及糖转运蛋白基因的杂合性表达或表观修饰干扰,需结合转录组数据验证。
翠玉×早红考密斯梨F1代群体后代果梗长度、果实硬度两个性状都表现为平均值高于低亲值,其中果实硬度平均值高于中亲值且遗传传递力高达124.35%,优势率为24.35%,超高亲率为8.93%,表现出较强的杂种优势,遗传倾向为趋高遗传。由于亲本早红考密斯梨为西洋梨品种,肉质软溶,硬度远低于肉质松脆的亲本翠玉梨,因此其F1代群体果实硬度性状表现为普遍高于早红考密斯梨而低于翠玉梨,表现出果实硬度趋高遗传的倾向,这与卢明艳等[30]在研究中发现果梗长度趋中偏高遗传、西洋梨与其他父本组配后代果肉类型分离的现象一致,同时也表明后代耐贮性有增强的趋势。果梗长度性状平均值表现出高于低亲值但低于中亲值的趋小遗传现象,整体趋向于短果梗遗传,与白牡丹等[27]在玉露香梨×黄冠梨F1代研究中果梗长度的遗传倾向结果类似。
早红考密斯梨作为果皮几乎全红的红皮梨,其与绿皮的翠玉梨杂交后代中未出现与早红考密斯一样几乎全果面着色的单株。后代最高着色面积占比为34.92%,而有红晕着色植株占总数的38.36%,意味着红色性状实际由显性基因控制,但存在其他抑制因素。邓俭英等[31]在冬瓜果皮颜色研究中发现,冬瓜深绿色(显性)与黄绿色(隐性)为3:1分离。若红色性状为隐性,则F1代红晕比例应接近25%,而实际为38.36%,可能存在更复杂的多基因互作。另外,该性状在田间调查过程中通过肉眼观察发现其受太阳光照度、光照面积影响较大,与黄春辉等[32]研究基本一致,表现出不完全显性关系。果皮表面红色物质主要是由花青苷等物质组成的,其合成需要光照激活关键酶(如Phenylalanine Ammonia-Lyase,PAL 等)发挥作用,光照度、时间等因素均会影响果皮着色[32-33]。该性状的遗传机制比较复杂,黄文江等[34]认为果皮红色性状遗传可能涉及花青素合成通路中PAL、ANS(Anthocyanidin Synthase)、UFGT(UDP-glucose:flavonoid 3-O-glucosyltransferase)等关键酶的多基因协同调控;Yao 等[35]和Yang 等[36]鉴定到多个调控花青苷合成的转录因子PyMYB10/MYB114、PybHLH3、PyMYB107、PyERF3 协同调控了梨果皮着色。由于缺乏对F1代群体果实成熟过程中具体的光照度、光照时长等环境因素对果实红晕着色影响的调查,关于F1代果实红晕着色面积调查结果只能作为一种现象去描述。但从与F1代群体在同一种植园种植的父本早红考密斯梨全果面为红色现象来看,F1代群体果实无几乎全果面着色的单株这一客观事实仍值得深入研究。
F1代群体果实形状均为圆形、扁圆形和葫芦形,均与葫芦形的父本早红考密斯梨或圆形的母本翠玉梨果形相同或相似,表明果形的遗传表现相对稳定。其中,F1代圆形果占60.29%,高于父本的葫芦形(5.15%),表明母本翠玉的圆形性状可能由显性基因控制,这与蟠桃研究中圆形对扁平形为隐性性状的结论不同[37],推测梨果形遗传可能遵循显性单基因模型,显性基因抑制葫芦形相关基因的表达。
本研究中,梨单果质量、果实横径、果实纵径、果梗长度、果梗粗度以及可溶性固形物含量6 个性状在杂交后代中均呈现正态或偏正态分布,为多基因控制的数量性状,与前人研究基本一致[18-20];此外,梨果实硬度呈现连续正态分布,符合数量性状遗传规律。但若将硬度简化为“脆肉”与“软肉”时,沙广利等[21]认为其表现为由两对主效基因(A/B)控制的质量性状遗传模式,与本文研究不符。这种矛盾可能源于两方面原因:一方面是当硬度以“单位面积承受压力”的连续数值表征时(如本研究采用质构仪测定),其本质反映细胞壁果胶含量、石细胞密度等复合生理指标[38]。此类指标受多基因微效累加作用,并与环境因素显著相关[39]。而“脆肉/软肉”二元分类则基于肉质感官特性,其关键阈值可能由特定主效基因决定。例如PbrNSC基因已被Gong等[40]证实通过调控木质素合成酶(如PbrLAC4)表达,影响石细胞形成。另一方面是脆肉表型需满足两对主效基因的隐性纯合条件(aabb),而硬度数值变异则受PAL 等微效基因调控[38]。本研究F1代群体出现的“面状肉质”,可能源于亲本西洋梨(AABb)与脆肉品种(aabb)杂交导致的显性基因不完全表达[18]。
相关性分析结果显示,单果质量与果实横径、果实纵径、果梗粗度、可溶性固形物含量均呈现极显著正相关,且果实横径对单果质量影响最大,最优回归方程为:Y=-326.279+5.446X1+1.964X2+0.91X4(Y 是单果质量,X1是果实横径、X2是果实纵径、X4是果梗粗度),表明影响单果质量的主要因素为果实横径、果实纵径、果梗粗度3个性状。通径分析结果显示,影响单果质量的主要因素与多元线性回归分析结果一致,且3 个性状对单果质量直接影响力从大到小依次为果实横径、果实纵径、果梗粗度,表明果实横径对单果质量影响最大,果梗粗度影响最小。值得一提的是,虽然相关性分析显示果实横径对单果质量影响最大,但笔者认为果梗粗度对单果质量的影响更值得关注。果梗是连接树体与果实的纽带,是树体与果实进行物质运输的重要桥梁。孙昊琪等[41]、李劲等[42]、Bustan 等[43]分别在梨、柑橘、葡萄上研究发现果梗粗度与单果质量呈显著正相关;Setiamihardja 等[44]在辣椒上发现果梗粗度与果实直径呈正相关,与本文研究基本一致。因此笔者认为,在梨杂交育种中关注果梗粗度较优的树种,将更有利于选育出质量更高、果实更大的品种。
值得一提的是,在梨果实遗传育种中,酸性性状同样也是重要品质性状之一。梨果实酸度直接影响糖酸比,是决定风味的关键因素[45]。董秀娟等[46]利用鄂梨2号×华梨2号F1代群体,发现可滴定酸含量的变异系数高达39.78%且受母本影响较大,显著高于其他性状。这种高变异意味着通过杂交重组可筛选出极端表型(如超高亲低酸或高酸株系),为定向改良提供丰富遗传资源。笔者所选用的亲本酸性性状差异显著,通过调查筛选出F1代酸性极端表型的可能性较大,但在性状调查中未能将酸性性状列入调查范围内,存在局限性,有待后续进一步研究。
综上所述,梨作为拥有自交不亲和特性的果树树种,遗传背景相当复杂,基因高度杂合,基因非加性效应占比较高,因此其有性杂交后代非加性效应解体现象较为普遍,性状出现复杂而又广泛的分离,劣变率较高,但不妨碍群体中出现部分性状超高亲植株。F1代群体存在超亲植株且性状广泛分离的现象,不仅为选育优良品种提供树种,也为后续定位关键性状基因提供数据支撑。
本研究基于F1代超高亲单株的育种筛选策略总结与建议如下:依据性状遗传特征建立量化筛选体系。其中,单果质量筛选以横径为核心指标,再结合果实纵径与果柄粗度构建三维选择模型;针对遗传比较复杂的果形性状,使用回交育种以强化其遗传稳定性;基于果皮红色性状的不完全显性特征(34.25%小面积着色),对红晕面积>15%的6 株进行转录组分析,筛选红皮相关调控基因;筛选果梗粗度>6.25 mm 的极端单株(分离上限),结合其与单果质量的正相关性(r=0.262**),开发具有强输导能力的砧木材料;对38.36%红晕株系进行不同光照度处理,验证环境与遗传互作对红皮性状的影响机制。
4 结 论
单果质量、果实横径、果实纵径、果梗长度、果梗粗度、可溶性固形物含量的遗传倾向呈趋低遗传,果实硬度的遗传倾向呈趋高遗传;果实横径和果实纵径是影响单果质量的关键性状(直接通径系数分别为0.715和0.282),在新品种选育中需要关注;相关性分析与通径分析显示,果梗粗度性状与单果质量呈正相关,但影响不大(直接通径系数0.008)。由于果梗是树体与果实进行物质运输的重要桥梁,因此在选育过程中果梗粗度性状可作为次选性状关注。另外,果皮红色性状在遗传过程中表现出不完全显性,可能存在多种基因型;而果形性状遗传表现相对稳定。
[1] 张绍铃.梨学[M].北京:中国农业出版社,2013.ZHANG Shaoling. Pear science[M]. Beijing:China Agriculture Press,2013.
[2] 刘松忠,刘军,孙奇,鲁韧强.西洋梨品种间糖酸及风味物质含量差异性比较[J].中国农学通报,2015,31(1):88-92.LIU Songzhong,LIU Jun,SUN Qi,LU Renqiang. Comparison of content of sugar,acid and aroma components in different pear cultivars[J]. Chinese Agricultural Science Bulletin,2015,31(1):88-92.
[3] 宋海岩,刘俊宏,江国良,涂美艳,孙淑霞,李靖,王玲利,徐子鸿,银登贵,陈栋,龚荣高.10 个桃杂交组合F1代主要果实性状遗传倾向分析与优势亲本筛选[J]. 四川农业大学学报,2022,40(6):812-819.SONG Haiyan,LIU Junhong,JIANG Guoliang,TU Meiyan,SUN Shuxia,LI Jing,WANG Lingli,XU Zihong,YIN Denggui,CHEN Dong,GONG Ronggao. Genetic predisposition analysis of main fruit traits and screening of dominant parents in F1 generation of 10 peach cross combinations[J]. Journal of Sichuan Agricultural University,2022,40(6):812-819.
[4] DE SOUZA V A B,BYRNE D H,TAYLOR J F.Heritability,genetic and phenotypic correlations,and predicted selection response of quantitative traits in peach:II. An analysis of several fruit traits[J]. Journal of the American Society for Horticultural Science,1998,123(4):604-611.
[5] 张文龙.四个柑橘杂交组合F1代果实基本性状遗传分析及无核优株筛选[D].重庆:西南大学,2022.ZHANG Wenlong. Genetic analysis of major traits and selection of seedless superior lines in F1 population from four hybrid combinations in citrus[D].Chongqing:Southwest University,2022.
[6] ASINS M J,RAGA V,BERNET G P,CARBONELL E A. Genetic analysis of reproductive,vegetative and fruit quality traits to improve citrus varieties[J]. Tree Genetics & Genomes,2015,11(6):117.
[7] 赵崇斌,郭乙含,李舒庆,徐红霞,黄天启,林顺权,陈俊伟,杨向晖.宁海白×大房枇杷F1 杂交群体果实性状的相关性及遗传分析[J].果树学报,2021,38(7):1055-1065.ZHAO Chongbin,GUO Yihan,LI Shuqing,XU Hongxia,HUANG Tianqi,LIN Shunquan,CHEN Junwei,YANG Xianghui. Correlation and genetic analysis of fruit traits in F1 hybrid population of loquat generated from Ninghaibai × Dafang[J].Journal of Fruit Science,2021,38(7):1055-1065.
[8] BESADA C,SALVADOR A,SDIRI S,GIL R,GRANELL A.A combination of physiological and chemometrics analyses reveals the main associations between quality and ripening traits and volatiles in two loquat cultivars[J]. Metabolomics,2013,9(2):324-336.
[9] 刘大亮,王进,张艳敏,宋君,高利平,陈学森.新疆野苹果F1代果实性状的相关分析和主成分分析[J]. 山东农业科学,2013,45(8):19-24.LIU Daliang,WANG Jin,ZHANG Yanmin,SONG Jun,GAO Liping,CHEN Xuesen. Correlation and principal component analysis on fruit characters of Malus sieversii f. neidzwetzkyana F1 progeny[J]. Shandong Agricultural Sciences,2013,45(8):19-24.
[10] LIU W J,CHEN Z J,JIANG S H,WANG Y C,FANG H C,ZHANG Z Y,CHEN X S,WANG N. Research progress on genetic basis of fruit quality traits in apple(Malus×domestica)[J].Frontiers in Plant Science,2022,13:918202.
[11] 刘娟,郭凯丽,杨盛.‘砀山酥梨’与‘苹果梨’杂交后代果实性状遗传趋势研究[J].中国南方果树,2023,52(3):130-133.LIU Juan,GUO Kaili,YANG Sheng. Study on the genetic trend of fruit traits of hybrids between‘Dangshan’pear and‘Apple’pear[J].South China Fruits,2023,52(3):130-133.
[12] DONDINI L,PIERANTONI L,ANCARANI V,D’ANGELO M,CHO K H,SHIN I S,MUSACCHI S,KANG S J,SANSAVINI S.The inheritance of the red colour character in European pear(Pyrus communis) and its map position in the mutated cultivar‘Max Red Bartlett’[J].Plant Breeding,2008,127(5):524-526.
[13] QIN M F,LI L T,SINGH J,SUN M Y,BAI B,LI S W,NI J P,ZHANG J Y,ZHANG X,WEI W L,ZHANG M Y,LI J M,QI K J,ZHANG S L,KHAN A,WU J.Construction of a high-density Bin-map and identification of fruit quality-related quantitative trait loci and functional genes in pear[J]. Horticulture Research,2022,9:uhac141.
[14] 曹玉芬,张绍铃. 中国梨遗传资源[M]. 北京:中国农业出版社,2020.CAO Yufen, ZHANG Shaoling. Genetic resources of pears in China[M].Beijing:China Agriculture Press,2020.
[15] 曹玉芬,刘凤之,胡红菊,张冰冰.梨种质资源描述规范和数据标准[M].北京:中国农业出版社,2006.CAO Yufen,LIU Fengzhi,HU Hongju,ZHANG Bingbing. Descriptors and data standard for pear (Pyrus spp.)[M]. Beijing:China Agriculture Press,2006.
[16] ZHANG X B,ZHU Y H,SU Y L,XIE B L,GU Q,ZHENG K F. Quantitative extraction and analysis of pear fruit spot phenotypes based on image recognition[J].Computers and Electronics in Agriculture,2021,190:106474.
[17] ZHU Y H,GU Q,ZHAO Y Y,WAN H J,WANG R Q,ZHANG X B,CHENG Y.Quantitative extraction and evaluation of tomato fruit phenotypes based on image recognition[J]. Frontiers in Plant Science,2022,13:859290.
[18] 李秀珍,马慧丽,刘保国,张益民,蔺合华,郭利静.梨果实性状遗传研究进展[J].河南科技大学学报(农学版),2004,24(2):59-62.LI Xiuzhen,MA Huili,LIU Baoguo,ZHANG Yimin,LIN Hehua,GUO Lijing.Advances in research on the genetics of pear fruit characters[J]. Journal of Henan University of Science and Technology(Agricultrual Science),2004,24(2):59-62.
[19] 李俊才,伊凯,刘成,隋洪涛,王家珍.梨果实若干性状的遗传倾向[J].园艺学报,2002,29(4):307-312.LI Juncai,YI Kai,LIU Cheng,SUI Hongtao,WANG Jiazhen.Studies on inheritance tendency of some characters of pears[J].Acta Horticulturae Sinica,2002,29(4):307-312.
[20] LUPI A C D,LIRA B S,GRAMEGNA G,TRENCH B,ALVES F R R,DEMARCO D,PERES L E P,PURGATTO E,FRESCHI L,ROSSI M. Solanum lycopersicum GOLDEN 2-LIKE 2 transcription factor affects fruit quality in a light- and auxin-dependent manner[J].PLoS One,2019,14(2):e0212224.
[21] 沙广利,李光玉,郭长城.梨果实肉质遗传模式的探讨[J].遗传,1997,19(5):21-23.SHA Guangli,LI Guangyu,GUO Changcheng. Genetic analysis of flesh texture in pear[J].Hereditas(Beijing),1997,19(5):21-23.
[22] 宋健坤,刁孟贤,王然.黄金梨与砀山酥梨杂交后代果实性状遗传趋势的初步研究[J].北方园艺,2014(14):28-30.SONG Jiankun,DIAO Mengxian,WANG Ran. The primary research on genetic trend of pear fruit characters on hybrid progenies from Pyrus pyrifolia Nakai cv.‘Whangkeumbae’pear and Pyrus bretschneideri Rehd. cv.‘Dangshansu’[J]. Northern Horticulture,2014(14):28-30.
[23] 沈德绪.果树育种学[M].北京:农业出版社,1992.SHEN Dexu.Fruit tree breeding[M].Beijing:Agriculture Press,1992.
[24] 李先明,秦仲麒,涂俊凡,杨夫臣,朱红艳,伍涛.梨果实若干经济性状遗传倾向研究[J].西北农业学报,2014,23(11):85-91.LI Xianming,QIN Zhongqi,TU Junfan,YANG Fuchen,ZHU Hongyan,WU Tao. Study on the inheritance of some characters of pear fruit[J]. Acta Agriculturae Boreali-Occidentalis Sinica,2014,23(11):85-91.
[25] 刘针杉,涂红霞,周荆婷,马艳,柴久凤,王旨意,杨鹏飞,杨小芹,ABBAS K,王浩,王燕,王小蓉.中国樱桃正反交F1代果实主要性状的遗传分析[J].中国农业科学,2023,56(2):345-356.LIU Zhenshan,TU Hongxia,ZHOU Jingting,MA Yan,CHAI Jiufeng,WANG Zhiyi,YANG Pengfei,YANG Xiaoqin,ABBAS K,WANG Hao,WANG Yan,WANG Xiaorong. Genetic analysis of fruits characters in reciprocal cross progenies of Chinese cherry[J].Scientia Agricultura Sinica,2023,56(2):345-356.
[26] 郭凯丽,刘娟,余小梅,杨盛.梨杂交后代果实主要性状遗传倾向的初步研究[J]. 西北农林科技大学学报(自然科学版),2024,52(9):97-108.GUO Kaili,LIU Juan,YU Xiaomei,YANG Sheng. A preliminary study on genetic tendency of main fruit traits of pear crossbred offspring[J]. Journal of Northwest A& F University (Natural Science Edition),2024,52(9):97-108.
[27] 白牡丹,郝国伟,张晓伟,杨盛,郭黄萍.‘玉露香梨’与‘黄冠’梨杂交后代果实性状遗传倾向的初步研究[J].中国果树,2017(增刊1):13-16.BAI Mudan,HAO Guowei,ZHANG Xiaowei,YANG Sheng,GUO Huangping. Primary research on genetic tendency of fruit characters in hybrid progenies between‘Yuluxiangli’and‘Huangguan’pear cultivars[J].China Fruits,2017(Suppl.1):13-16.
[28] 王宇霖,魏闻东,李秀根.梨杂种后代亲本性状遗传倾向的研究[J].果树科学,1991,8(2):75-82.WANG Yulin,WEI Wendong,LI Xiugen. Studies on the trends of inheritance of commercial characteristics of crossed Chinese pear parents in their progenies[J]. Journal of Fruit Science,1991,8(2):75-82.
[29] 张莹,曹玉芬,田路明,董星光,齐丹,霍宏亮,徐家玉,刘超,王立东.梨种质资源果实若干数量性状评价指标研究[J].果树学报,2023,40(6):1053-1063.ZHANG Ying,CAO Yufen,TIAN Luming,DONG Xingguang,QI Dan,HUO Hongliang,XU Jiayu,LIU Chao,WANG Lidong.Evaluating standards of some fruit quantitative traits of pear genetic resources[J].Journal of Fruit Science,2023,40(6):1053-1063.
[30] 卢明艳,王强,闫兴凯,武春昊,赵滢,张茂君.梨杂交F1 果实性状遗传倾向分析[J].植物遗传资源学报,2024,25(2):294-302.LU Mingyan,WANG Qiang,YAN Xingkai,WU Chunhao,ZHAO Ying,ZHANG Maojun.Analysis of fruit trait genetics in F1 plants of Pyrus species[J].Journal of Plant Genetic Resources,2024,25(2):294-302.
[31] 邓俭英,万正林,武鹏,刘朝安,邓杰玲,李立志,周艳霞.冬瓜果皮颜色的遗传规律研究[J].安徽农业科学,2015,43(25):40-41.DENG Jianying,WAN Zhenglin,WU Peng,LIU Chao’an,DENG Jieling,LI Lizhi,ZHOU Yanxia. Study on the inheritance of fruit color in wax guard[J].Journal of Anhui Agricultural Sciences,2015,43(25):40-41.
[32] 黄春辉,俞波,苏俊,舒群,程在全,曾黎琼,滕元文.红色砂梨2 个品种着色过程中的外观变化及其解剖学结构观察[J].果树学报,2009,26(1):19-24.HUANG Chunhui,YU Bo,SU Jun,SHU Qun,CHENG Zaiquan,ZENG Liqiong,TENG Yuanwen. A study of the visual changes of the skin color and fruit transection structure of two Chinese red skinned pear cultivars during fruit coloring process[J].Journal of Fruit Science,2009,26(1):19-24.
[33] 阮美颖,叶青静,周国治,王荣青,姚祝平,李志邈,万红建,杨悦俭.不同颜色樱桃番茄果实成熟过程中色素的变化[J].浙江农业科学,2013,54(5):526-528.RUAN Meiying,YE Qingjing,ZHOU Guozhi,WANG Rongqing,YAO Zhuping,LI Zhimiao,WAN Hongjian,YANG Yuejian. Changes of pigments in different color cherry tomato fruits during ripening[J]. Journal of Zhejiang Agricultural Sciences,2013,54(5):526-528.
[34] 黄文江,张绍铃,肖长城,张全军,秦改花,吴俊.早红考密斯及其芽变果实中花青素含量与相关酶活性变化的研究[J].西北植物学报,2011,31(7):1428-1433.HUANG Wenjiang,ZHANG Shaoling,XIAO Changcheng,ZHANG Quanjun,QIN Gaihua,WU Jun. Relationship between anthocyanin biosynthesis and related enzyme activities in Pyrus communis L.cv.‘Early Red Comice’and its green bud mutant[J].Acta Botanica Boreali-Occidentalia Sinica,2011,31(7):1428-1433.
[35] YAO G F,MING M L,ALLAN A C,GU C,LI L T,WU X,WANG R Z,CHANG Y J,QI K J,ZHANG S L,WU J. Mapbased cloning of the pear gene MYB114 identifies an interaction with other transcription factors to coordinately regulate fruit anthocyanin biosynthesis[J]. The Plant Journal,2017,92(3):437-451.
[36] YANG G Y,XUE Z L,KUI L W,CHEN G S,ZHAO Y Q,CHANG Y J,XU S Z,SUN M Y,XUE C,LI J M,ALLAN A C,ESPLEY R V,WU J.An‘activator-repressor’loop controls the anthocyanin biosynthesis in red-skinned pear[J]. Molecular Horticulture,2024,4(1):26.
[37] 姜全,郭继英,郑书旗,赵剑波.蟠桃果形遗传分析[J].果树科学,2000,17(增刊1):1-4.JIANG Quan,GUO Jiying,ZHENG Shuqi,ZHAO Jianbo.A genetic analysis on fruit shape of flat peach[J].Journal of Fruit Science,2000,17(Suppl.1):1-4.
[38] 刘艳,鲁晓燕,黄学东,杨玉琼,岳英,唐娇.梨石细胞含量与PAL 活性和果实硬度的相关性研究[J].新疆农业科学,2011,48(9):1597-1601.LIU Yan,LU Xiaoyan,HUANG Xuedong,YANG Yuqiong,YUE Ying,TANG Jiao. Study on correlation among stone cell content,PAL activity and fruit hardness of pear[J]. Xinjiang Agricultural Sciences,2011,48(9):1597-1601.
[39] 殷晨,田路明,徐钰清,曹玉芬,董星光,刘超.不同类型梨果肉质地发育动态比较分析[J].山西农业大学学报(自然科学版),2025,45(1):73-84.YIN Chen,TIAN Luming,XU Yuqing,CAO Yufen,DONG Xingguang,LIU Chao. Comparative analysis of dynamic development of flesh texture in different types of pear fruits[J]. Journal of Shanxi Agricultural University(Natural Science Edition),2025,45(1):73-84.
[40] GONG X,QI K J,ZHAO L Y,XIE Z H,PAN J H,YAN X,SHIRATAKE K,ZHANG S L,TAO S T. PbAGL7-PbNAC47-Pb-MYB73 complex coordinately regulates PbC3H1 and PbHCT17 to promote the lignin biosynthesis in stone cells of pear fruit[J].The Plant Journal,2024,120(5):1933-1953.
[41] 孙昊琪,王南南,柳伟杰,马春晖.梨果柄特征及其与果实主要经济性状的相关性分析[J].西北植物学报,2019,39(8):1416-1424.SUN Haoqi,WANG Nannan,LIU Weijie,MA Chunhui.Analysis of pedicel characteristics and its correlation with main economic characters of pear (Pyrus spp.)[J].Acta Botanica Boreali-Occidentalia Sinica,2019,39(8):1416-1424.
[42] 李劲,李学柱.锦橙结果枝及果梗维管组织的分化发育[J].中国柑桔,1992,21(4):24.LI Jin,LI Xuezhu. Differentiation and development of vascular tissue in fruit bearing branches and fruit stems of Jincheng[J].South China Fruits,1992,21(4):24.
[43] BUSTAN A,ERNER Y,GOLDSCHMIDT E E. Interactions between developing Citrus fruits and their supportive vascular system[J].Annals of Botany,1995,76(6):657-666.
[44] SETIAMIHARDJA R,KNAVEI D E. Association of pedicel length and diameter with fruit length and diameter and ease of fruit detachment in pepper[J]. Journal of the American Society for Horticultural Science,1990,115(4):677-681.
[45] MIAO S X,WEI X Y,ZHU L C,MA B Q,LI M J. The art of tartness:The genetics of organic acid content in fresh fruits[J].Horticulture Research,2024,11(10):uhae225.
[46] 董秀娟,杨晓平,杜威,范净,胡红菊.梨F1代果实品质性状遗传规律分析[J].北方园艺,2022(7):23-29.DONG Xiujuan,YANG Xiaoping,DU Wei,FAN Jing,HU Hongju. Analysis of heredity of pear fruit F1 generation quality traits[J].Northern Horticulture,2022(7):23-29.