枣(Ziziphus jujuba Mill.)是鼠李科(Rhamnaceae)枣属(Ziziphus Mill.)植物,是中国重要的特色经济林树种,其优良品种的培育对实现优质、高产、高效栽培具有关键作用。因此,通过不同育种手段培育出综合性状优良的品种成为枣树生产上迫切需要解决的问题[1]。在植物育种领域,花药离体培养技术作为一种重要的手段,可以进一步获得纯合植物,能够有效提高育种选择效率,也可为枣品种改良和新品种选育提供有力支持[2-3]。
关于离体花药培养的报道始于1964年,印度德里大学学者在毛叶曼陀罗植物[4]上进行并获得单倍体植株。之后逐渐应用于水稻[5]、水葫芦[6]、草莓[7]、茄子[8]和麻风树[9]等植物上。中国花药培养育种开始于20 世纪70 年代,先后在滇杨[10]、苹果[11]、桑树[12]等植物上应用并得到再生植株。目前有多个枣品种建立了花药组织培养技术体系,冬枣、辣椒枣、月光枣、赞皇大枣、阜平大枣[13]、苹果枣、酸枣、骏枣[14]、长红枣、金丝小枣[15-16]等十几个枣品种获得花药再生植株,其中王震星等[15]的金丝小枣和武晓红[13]的冬枣和阜平大枣得到了单倍体植株。
尽管在枣树花药培养方面取得了一定进展,但不同基因型枣树之间的组培体系存在显著差异,愈伤组织诱导率与再生植株分化率普遍偏低,培养体系存在染色体倍性混杂显著、单倍体发生率不理想等突出问题[17-18]。现有技术体系的低效性已成为制约该技术应用于育种的关键因素,急需优化培养体系的稳定性和重复性。在生产中,冬枣是主要的鲜食品种,骏枣是优质的制干品种,而七月鲜则是早熟且鲜食与制干兼用的品种,3 个枣品种对枣产业发展均具有重要产业价值,深入研究枣树花药愈伤组织诱导和再生培养体系,对推动枣树育种进程具有重要意义。除此之外,骏枣的花药培养技术研究基础较为薄弱,再生植株分化率低,还有待进一步优化,而七月鲜花药离体培养技术未见报道。因此,笔者在本研究中选用冬枣、骏枣和七月鲜3 个主栽优良枣品种进行花药离体培养,旨在建立高效且完善的离体花药再生体系,为枣树花药离体再生研究提供技术支撑。
1 材料和方法
1.1 试验材料
研究于2022年5月中下旬在西北农林科技大学清涧红枣试验站进行。选取生长健壮、无病虫害的枣树(以酸枣做砧木),采集冬枣、骏枣和七月鲜处于绿色到黄绿色期间的幼嫩花蕾(花粉处于单核靠边期)。将花蕾在自来水下冲洗0.5~1.0 h 后置于超净工作台上,用75%的乙醇浸泡30~60 s,用0.1%的HgCl2 溶液浸泡杀菌10 min,再用无菌水冲洗4~6次,最后在培养皿中剥开花蕾,将花药接种到不同培养基上进行培养观察。
1.2 试验设计
对3个品种枣花药进行不同时间的低温预处理和不同种类浓度的碳源、激素组合等多个因素设计对比,研究这些因素对枣花药愈伤诱导、增殖和分化培育的影响。
1.2.1 花药愈伤诱导培养基筛选 采用L9(34)正交试验设计[19],形成9种不同种类激素组合的MS培养基,所有培养基均添加30 g·L-1麦芽糖和6 g·L-1琼脂,pH=5.8。将3 个枣品种的花药接种到各培养基上,每个处理接种3 个培养皿(共约50 个花药),每组试验3次重复,25 ℃暗培养,30 d后统计不同枣花药处理的愈伤诱导率。
为进一步优化碳源,选择3 种碳源(麦芽糖、蔗糖和葡萄糖)分别加到MS+1.0 mg·L-1 2,4-D+0.4 mg·L-1 TDZ+0.4 mg·L-1 NAA的诱导培养基中,糖源设定4个水平质量浓度(20 g·L-1、30 g·L-1、40 g·L-1、60 g·L-1),共12 个处理,每个处理接种3 个培养皿(共约50 个花药),3 次重复,暗培养30 d(25±2 ℃)后统计愈伤诱导率。
1.2.2 花药预处理 低温处理可以提高花药愈伤组织的诱导率[20],因此,在诱导过程中也对花药进行低温预处理,探究其效果。将冲洗过的花蕾放在4 ℃的冰箱中进行低温预处理试验,设定6 个低温处理时间长度:0、1、3、5、7、9 d。将预处理过的花药接种到MS+1.0 mg·L-1 2,4-D+0.4 mg·L-1 TDZ+0.4 mg·L-1 NAA 的培养基上进行诱导培养。每个处理接种约30个花药并3次重复,接种后的所有花药置于25 ℃条件下暗培养30 d,30 d 后统计各个处理的愈伤诱导率。
1.2.3 愈伤组织增殖培养基筛选 将诱导出的愈伤组织块接入到不同浓度激素的MS 培养基中,添加30 g·L-1麦芽糖,6 g·L-1琼脂,pH=5.8。每盘接种10个花药愈伤组织块,共接3 盘,每个处理3 次重复,在(25±2)℃条件下暗培养20 d 后统计愈伤增殖系数。
1.2.4 愈伤分化基本培养基筛选 选用MS 和WPM两种基本培养基,在不同分化培养基上,添加20 g·L-1的麦芽糖[21],接种生长良好的各基因型花药愈伤组织,共设计18 种处理组合(表1)。每盘接种9~10个花药愈伤组织块(0.5~1 cm),共接种5盘,每个处理3 次重复,26 ℃光照条件下培养,光照度2000 lx,光照时间16 h·d-1,50 d 后统计不同处理的愈伤组织分化率。
表1 花药愈伤组织诱导培养基激素组合设计
Table 1 Plant growth regulator combination and concentrations in the induction medium for jujube
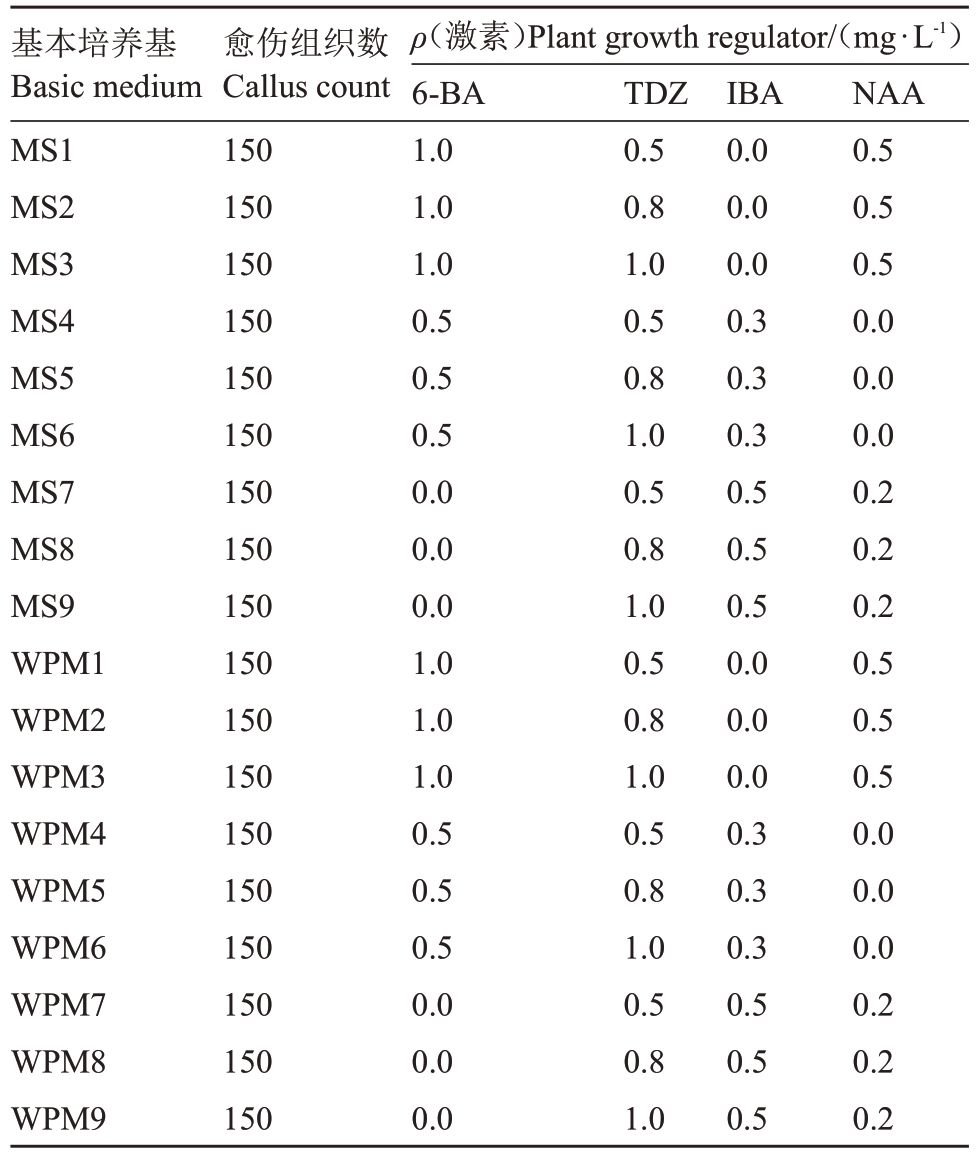
基本培养基Basic medium MS1 MS2 MS3 MS4 MS5 MS6 MS7 MS8 MS9 WPM1 WPM2 WPM3 WPM4 WPM5 WPM6 WPM7 WPM8 WPM9愈伤组织数Callus count 150 150 150 150 150 150 150 150 150 150 150 150 150 150 150 150 150 150 ρ(激素)Plant growth regulator/(mg·L-1)6-BA 1.0 1.0 1.0 0.5 0.5 0.5 0.0 0.0 0.0 1.0 1.0 1.0 0.5 0.5 0.5 0.0 0.0 0.0 TDZ 0.5 0.8 1.0 0.5 0.8 1.0 0.5 0.8 1.0 0.5 0.8 1.0 0.5 0.8 1.0 0.5 0.8 1.0 IBA 0.0 0.0 0.0 0.3 0.3 0.3 0.5 0.5 0.5 0.0 0.0 0.0 0.3 0.3 0.3 0.5 0.5 0.5 NAA 0.5 0.5 0.5 0.0 0.0 0.0 0.2 0.2 0.2 0.5 0.5 0.5 0.0 0.0 0.0 0.2 0.2 0.2
1.2.5 再生植株倍性检测 取3种基因型枣组培苗幼嫩叶片各2份,每份叶片30~50 mg,用流式细胞仪进行倍性鉴定,倍性测试参考王利虎等[22]和田新民等[23]的方法并进行了部分改进,选择WPB裂解液进行细胞裂解。
1.2.6 生根培养基筛选 选取冬枣继代培养中长势良好且一致的2 cm左右带芽茎段,接种到添加不同质量浓度IBA(0.2、0.4、0.6 mg·L-1)的1/2MS培养基中,共3 个处理,每个处理4 瓶,每瓶2 根茎段,培养30 d后观察生长状况,统计生根率,筛选最适IBA质量浓度。
1.3 数据统计处理
采用单因素方差分析(ANOVA)进行数据比较,利用Duncan新复极差法检验处理间差异显著性水平(p <0.05),使用SPSS 26.0统计软件进行数据分析。
2 结果与分析
2.1 培养基的激素种类及浓度对枣花药愈伤组织诱导的影响
3 个品种花药暗培养30 d 后统计了9 个处理的愈伤组织诱导率(表2)。
表2 激素种类浓度对枣花药愈伤组织诱导的影响
Table 2 Effect of phytohormones on callus induction from jujube anthers

注:**表示差异极显著,p ≤0.01;*表示差异显著,p ≤0.05;表中小写字母表示差异显著性,p ≤0.05。下同。
Note:**indicates a highly significant difference at p ≤0.01;*indicates a significant difference at p ≤0.05;Small letters in the Table denote significant differences at p ≤0.05.The same below.
培养基编号Medium number 123456789 ρ(2,4-D)/(mg·L-1)0.5 0.5 0.5 1.0 1.0 1.0 1.5 1.5 1.5Ⅲ类平方和Type Ⅲsum of squares 2 097.210 556.899 569.788 126.988 331.941 24 507.000 ρ(TDZ)/(mg·L-1)0.2 0.4 0.8 0.2 0.4 0.8 0.2 0.4 0.8源Source ρ(NAA)/(mg·L-1)0.8 0.0 0.4 0.8 0.4 0.0 0.4 0.0 0.8自由度Degrees of freedom 2,4-D TDZ NAA品种Variety误差Error总计Total 2222骏枣花药愈伤诱导率Anther callus induction rate of Junzao/%31.33±2.52 c 28.67±1.15 cd 32.67±3.06 c 51.33±1.53 b 64.00±1.00 a 33.33±2.08 c 27.33±2.31 cd 22.67±1.53 d 23.33±2.52 d F值F-value 227.449 60.397 61.795 13.772七月鲜花药愈伤诱导率Anther callus induction rate of Qiyuexian/%30.00±1.73 bc 21.33±3.06 c 20.67±2.89 c 40.00±2.65 b 58.67±0.58 a 29.33±2.08 bc 25.33±2.52 bc 22.00±1.73 c 12.67±2.08 d显著性Significance******72 81冬枣花药愈伤诱导率Anther callus induction rate of Dongzao/%28.00±1.73 c 27.33±1.53 c 30.67±2.08 bc 45.33±0.58 b 59.33±1.15 a 34.67±2.52 bc 26.67±1.53 c 25.33±2.08 cd 16.67±2.89 d均方Mean square 1048.605 278.449 284.894 63.494 4.610
结果表明,3 个枣品种的花药在各处理中都能够诱导出愈伤组织。方差分析结果表明,不同激素和基因型对愈伤诱导率的影响均显著,3 种激素对愈伤诱导率影响的主次顺序为:2,4-D,NAA,TDZ。在1.0 mg·L-1 2,4-D+0.4 mg·L-1 TDZ+0.4 mg·L-1 NAA 的激素组合中冬枣、骏枣、七月鲜花药诱导率均最高,骏枣花药的愈伤组织诱导率高于冬枣和七月鲜,其中冬枣、七月鲜在1.5 mg·L-1 2,4-D+0.8 mg·L-1 TDZ+0.8 mg·L-1 NAA 中诱导率最低,骏枣花药在1.5 mg·L-1 2,4-D+0.4 mg·L-1 TDZ 中诱导率最低,不同基因型的花药在相同培养基上诱导结果差异较为明显。因此,在枣花药诱导培养过程中,以添加1.0 mg·L-1 2,4-D 最佳,TDZ 和NAA 以0.4 mg·L-1最佳。
2.2 花药愈伤诱导中碳源的影响
由表3 可以看出,不同碳源与浓度对枣花药愈伤组织诱导的效果差异显著。方差分析结果表明,3个影响因素均显著,各因素对愈伤诱导率影响的主次顺序为:碳源种类、碳源浓度、枣花药品种,其中碳源种类对愈伤诱导率影响最大。正交试验结果表明:冬枣、骏枣和七月鲜花药在以麦芽糖为碳源的培养基上愈伤组织诱导率显著高于其他两种碳源,其中冬枣为52.00%,骏枣为57.33%、七月鲜为54.00%,蔗糖次之,葡萄糖最低,且葡萄糖质量浓度为60 g·L-1时3个基因型花药均没有诱导出愈伤组织。以蔗糖为碳源诱导愈伤时,愈伤褐化严重,生长较为缓慢,并逐渐褐化死亡。添加麦芽糖诱导出的愈伤颜色多数呈黄白色,生长速度快,在质量浓度为30 g·L-1时,愈伤组织诱导率最高,其中骏枣在40 g·L-1麦芽糖中诱导率高于30 g·L-1,但愈伤褐化率也高,愈伤质地较硬。因此,麦芽糖更适合作为诱导枣花药愈伤的碳源,30 g·L-1的质量浓度最佳。
表3 碳源种类浓度对枣花药愈伤组织诱导的影响
Table 3 Effect of carbon types on callus induction from jujube anther

处理号Treatment number糖源种类Sugar source type ρ/(g·L-1)颜色Color颜色Color颜色Color 1234567891 0麦芽糖Maltose 20冬枣Dongzao愈伤组织诱导率Callus induction rate/%42.00±1.00 b骏枣Junzao愈伤组织诱导率Callus induction rate/%46.67±1.53 b 黄白Yellowish-white七月鲜Qiyuexian愈伤组织诱导率Callus induction rate/%50.00±2.00 a 3052.00±1.73 a 53.33±2.08 a 白色White 54.00±1.73 a黄白Yellowishwhite白色White 4027.33±1.53 c 57.33±0.58 a 黄白Yellowish-white 37.33±0.58 b 6012.67±0.58 d 34.67±2.08 c 黄白Yellowish-white 15.33±2.52 c蔗糖Sucrose 2012.00±2.00 a 38.67±1.53 a 黄白Yellowish-white 14.00±1.00 a 3014.67±2.08 a 34.00±1.00 a 黑黄Blackish-yellow 16.67±1.53 a 408.00±2.65 ab 26.67±1.53 b 黑褐Blackish-brown 11.30±2.08 ab 606.00±1.00 b 17.33±2.08 c 黑褐Blackish-brown 5.33±3.06 b黄白Yellowishwhite黄白Yellowishwhite黄白Yellowishwhite黄褐Yellowishbrown黑褐Blackishbrown黑褐Blackishbrown葡萄糖Glucose 203.33±2.89 a 2.67±1.15 a 黑黄Blackish-yellow 0.00±0.00 a 302.00±1.00 a 0.00±0.00 b 0.00±0.00 a 11401.33±1.15 a 0.00±0.00 b 0.00±0.00 a 12源Source 0.00±0.00 b黄白Yellowishwhite黄白Yellowishwhite黄白Yellowishwhite黄褐Yellowishbrown黄褐Yellowishbrown黑褐Blackishbrown黑褐Blackishbrown黑褐Blackishbrown黄白Yellowishwhite黑黄Blackishyellow黑黄Blackishyellow-自由度Degrees of freedom 0.00±0.00 b均方Mean square---0.00±0.00 a F值F-value----显著性Significance种类Type浓度Concentration品种Variety糖源×浓度Sugar source × Concentration糖源×品种Sugar source×Variety糖源×品种Sugar source×Variety糖源×浓度×品种Sugar source × Concentration×Variety误差Error总体Total 60Ⅲ类平方和Type Ⅲsum of squares 7051.722 900.667 596.222 616.722 3 525.861 300.222 298.111 102.787 1 394.846 118.769 117.934 40.663********384.88996.22238.066**60.000 232646 10.0003.956*275.7781222.9819.092**182.000 20 160.000 72 108 2.528
2.3 花药愈伤诱导中低温预处理的影响
在本研究中探讨了4 ℃低温预处理时间对冬枣、骏枣和七月鲜花药愈伤组织诱导率的影响(表4)。结果显示,冬枣花药在低温处理1~3 d时诱导率较高,其中3 d诱导率达66.67%,而处理5 d后诱导率显著下降至36.67%,9 d 时最低,仅为13.33%。骏枣花药诱导率在不同低温处理时间下变化较小,整体维持在47%左右,处理5 d与1 d、3 d时诱导率差异分别为9.33%和3.33%,说明低温处理对其诱导率影响有限。七月鲜花药诱导率在低温处理3 d 时最高,为63.33%,而1 d 和9 d 时诱导率分别为60.00%和10.67%,表明其最佳低温处理时间为3 d。综上,不同枣品种花药对低温预处理的响应存在差异,适宜的低温处理时间可显著影响愈伤组织诱导率。
表4 低温(4 ℃)预处理对诱导花药愈伤组织的影响
Table 4 Effect of low temperature(4 ℃)pretreatment on induction of anther callus
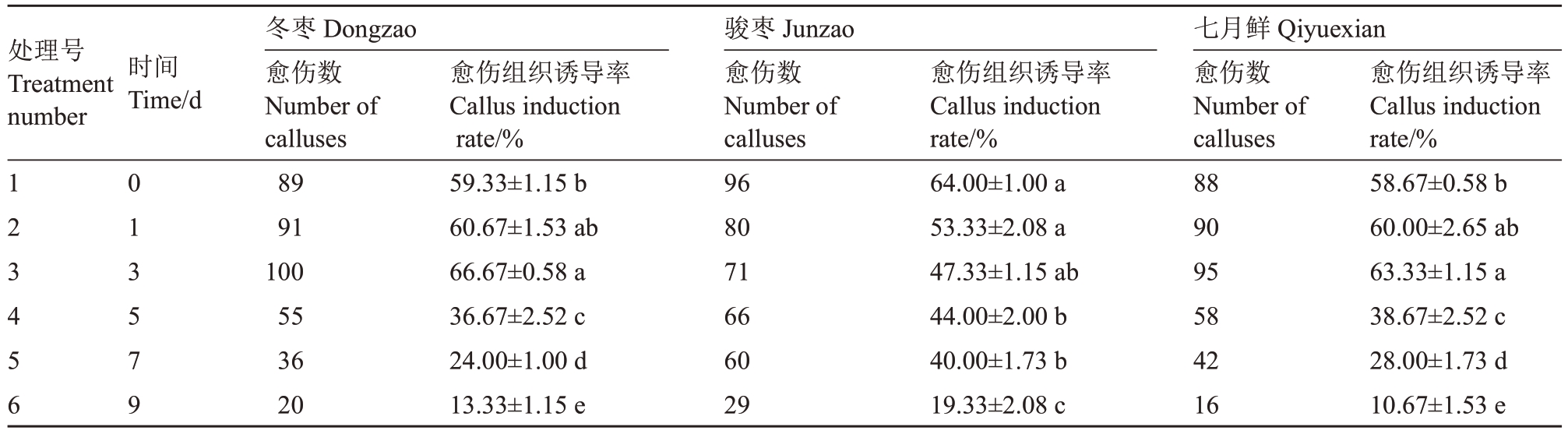
处理号Treatment number时间Time/d 123456 013579冬枣Dongzao愈伤数Number of calluses 89 91 100 55 36 20愈伤组织诱导率Callus induction rate/%59.33±1.15 b 60.67±1.53 ab 66.67±0.58 a 36.67±2.52 c 24.00±1.00 d 13.33±1.15 e骏枣Junzao愈伤数Number of calluses 96 80 71 66 60 29愈伤组织诱导率Callus induction rate/%64.00±1.00 a 53.33±2.08 a 47.33±1.15 ab 44.00±2.00 b 40.00±1.73 b 19.33±2.08 c七月鲜Qiyuexian愈伤数Number of calluses 88 90 95 58 42 16愈伤组织诱导率Callus induction rate/%58.67±0.58 b 60.00±2.65 ab 63.33±1.15 a 38.67±2.52 c 28.00±1.73 d 10.67±1.53 e
2.4 激素种类及浓度对花药愈伤组织增殖的影响
在愈伤组织增殖试验中以MS为基本培养基,添加30 g·L-1麦芽糖、6 g·L-1琼脂和不同的激素组合,将诱导出的愈伤组织块接种在各增殖培养基上。每块愈伤约0.5 cm大小,3种愈伤组织每盘接10 块、每组3 盘、3 次重复,每个处理共接90 块愈伤。暗培养20 d 后统计愈伤增殖系数(表5)。统计后发现,冬枣在MS+2.5 mg·L-1 TDZ+0.4 mg·L-1 IBA+0.1 mg·L-1 NAA+30 g·L-1麦芽糖+6 g·L-1琼脂中愈伤增殖系数最高为88.89%,且褐化率低;骏枣在MS+1.0 mg·L-1 TDZ+0.8 mg·L-1 IBA中愈伤增殖效果最好,愈伤组织增殖系数为81.11%;七月鲜在MS+1.5 mg·L-1 TDZ+0.8 mg·L-1 IBA 中愈伤增殖系数最高,达到78.89%,在2.5 mg·L-1 TDZ+1.2 mg·L-1 IBA+0.3 mg·L-1 NAA 的激素组合中增殖系数最低,只有40.00%。
表5 不同增殖培养基对枣愈伤组织增殖的影响
Table 5 Effects of different media on callus proliferation of jujube
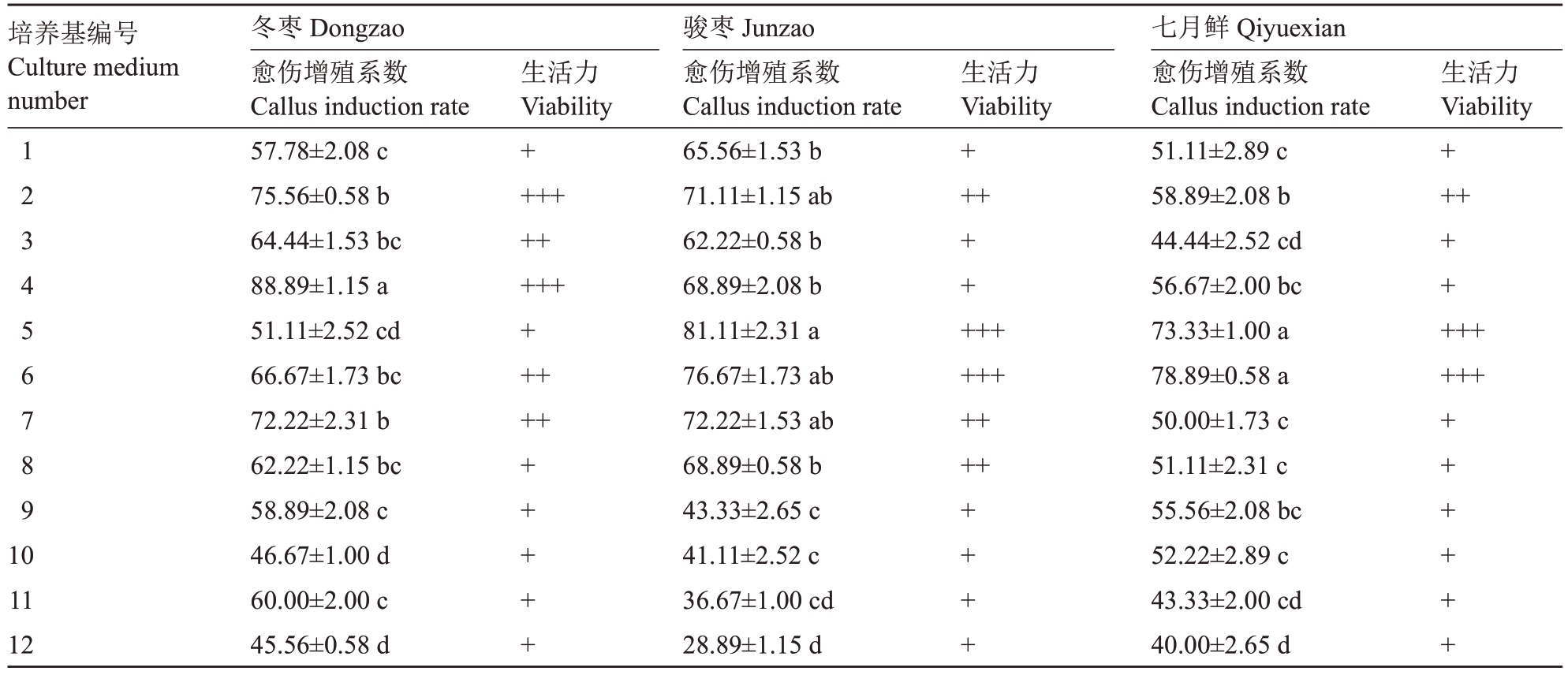
注:愈伤增殖用+表示,+号越多表示愈伤组织发生量越多。
Note:Callus proliferation is indicated by the“+”symbol,where a greater number of“+”symbols denotes a higher amount of callus tissue formation.
培养基编号Culture medium number 123456789生活力Viability++++++++++++++生活力Viability+++生活力Viability+++冬枣Dongzao愈伤增殖系数Callus induction rate 57.78±2.08 c 75.56±0.58 b 64.44±1.53 bc 88.89±1.15 a 51.11±2.52 cd 66.67±1.73 bc 72.22±2.31 b 62.22±1.15 bc 58.89±2.08 c 46.67±1.00 d 60.00±2.00 c 45.56±0.58 d骏枣Junzao愈伤增殖系数Callus induction rate 65.56±1.53 b 71.11±1.15 ab 62.22±0.58 b 68.89±2.08 b 81.11±2.31 a 76.67±1.73 ab 72.22±1.53 ab 68.89±0.58 b 43.33±2.65 c 41.11±2.52 c 36.67±1.00 cd 28.89±1.15 d++++++++++10 11 12+++++++++++++++++++七月鲜Qiyuexian愈伤增殖系数Callus induction rate 51.11±2.89 c 58.89±2.08 b 44.44±2.52 cd 56.67±2.00 bc 73.33±1.00 a 78.89±0.58 a 50.00±1.73 c 51.11±2.31 c 55.56±2.08 bc 52.22±2.89 c 43.33±2.00 cd 40.00±2.65 d++++++
2.5 基本培养基和植物生长调节剂对花药愈伤组织分化的影响
愈伤组织的分化培养基以MS 和WPM 两种基本培养基进行试验,选用6-BA、TDZ、IBA 和NAA 4 种植物激素,研究枣花药愈伤组织分化中基本培养基与不同激素组合对其的影响(表6,图1)。结果表明,3个枣品种愈伤在WPM培养基中分化率普遍高于MS,其中冬枣在WPM+0.8 mg·L-1 TDZ+0.5 mg·L-1IBA+0.2 mg·L-1 NAA 中分化率最高,达到48.00%;骏枣在WPM+1.0 mg·L-1 6-BA+0.5 mg·L-1 TDZ+0.5 mg·L-1 NAA 中分化率最高,达到29.33%;七月鲜在WPM+1.0 mg·L-1 TDZ+0.5 mg·L-1 IBA+0.2 mg·L-1 NAA中分化率最高,达到33.33%。相比之下,冬枣较骏枣和七月鲜更易分化,骏枣分化率最低,并且冬枣成苗数多于骏枣和七月鲜(图2)。

图1 花药愈伤的分化
Fig.1 Bud differentiation from anther callus
A.愈伤经光照开始变绿;B.愈伤转绿开始增殖;C~D.愈伤出现芽点,开始分化不定芽;E~H.不定芽伸长与增殖。
A.Callus turned green when exposure to light;B.Callus turned green;C-D.Bud differentiation;E-H.Adventitious buds developments.

图2 不同枣品种花药诱导愈伤不定芽的分化Fig.2 Differentiation of adventitious buds from callus generated from jujube anthers
A.冬枣花药愈伤光照培养;B.骏枣花药愈伤光照培养;C.七月鲜花药光照培养;D.冬枣愈伤不定芽分化;E.骏枣愈伤不定芽分化;F.七月鲜不定芽分化。
A.Anther callus of Dongzao;B.Anther callus of Junzao;C.Anther callus of Qiyuexian;D.Adventitious bud differentiation of Dongzao callus;E.Adventitious bud differentiation from callus of Junzao;F.Qiyuexian adventitious bud differentiation.
表6 不同分化培养基对枣愈伤组织不定芽分化的影响
Table 6 Effect of medium on adventitious bud differentiation from jujube callus
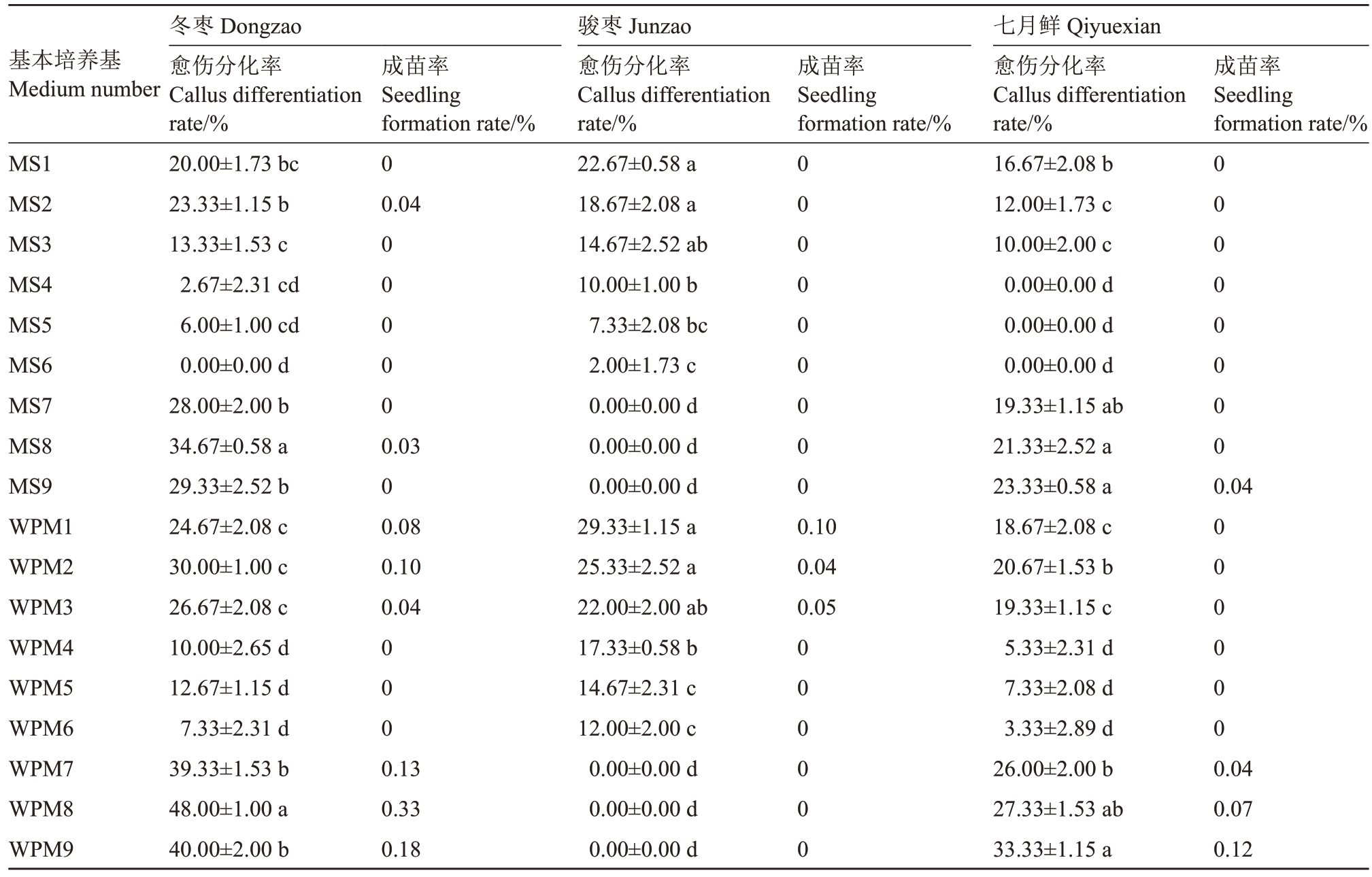
基本培养基Medium number成苗率Seedling formation rate/%成苗率Seedling formation rate/%MS1 MS2 MS3 MS4 MS5 MS6 MS7 MS8 MS9 WPM1 WPM2 WPM3 WPM4 WPM5 WPM6 WPM7 WPM8 WPM9冬枣Dongzao愈伤分化率Callus differentiation rate/%20.00±1.73 bc 23.33±1.15 b 13.33±1.53 c 2.67±2.31 cd 6.00±1.00 cd 0.00±0.00 d 28.00±2.00 b 34.67±0.58 a 29.33±2.52 b 24.67±2.08 c 30.00±1.00 c 26.67±2.08 c 10.00±2.65 d 12.67±1.15 d 7.33±2.31 d 39.33±1.53 b 48.00±1.00 a 40.00±2.00 b成苗率Seedling formation rate/%0 0.04 00000 0.03 0 0.08 0.10 0.04 000000000 00000000骏枣Junzao愈伤分化率Callus differentiation rate/%22.67±0.58 a 18.67±2.08 a 14.67±2.52 ab 10.00±1.00 b 7.33±2.08 bc 2.00±1.73 c 0.00±0.00 d 0.00±0.00 d 0.00±0.00 d 29.33±1.15 a 25.33±2.52 a 22.00±2.00 ab 17.33±0.58 b 14.67±2.31 c 12.00±2.00 c 0.00±0.00 d 0.00±0.00 d 0.00±0.00 d 0.04 0.10 0.04 0.05 000 000000 0.13 0.33 0.18 000000七月鲜Qiyuexian愈伤分化率Callus differentiation rate/%16.67±2.08 b 12.00±1.73 c 10.00±2.00 c 0.00±0.00 d 0.00±0.00 d 0.00±0.00 d 19.33±1.15 ab 21.33±2.52 a 23.33±0.58 a 18.67±2.08 c 20.67±1.53 b 19.33±1.15 c 5.33±2.31 d 7.33±2.08 d 3.33±2.89 d 26.00±2.00 b 27.33±1.53 ab 33.33±1.15 a 0.04 0.07 0.12
2.6 再生植株倍性鉴定
以二倍体酸枣组培苗为对照,对各品种花药再生植株进行倍性鉴定,图3为再生植株倍性的峰值,图4为各品种花药的再生植株。由图3可知,横轴表示荧光的通道值,纵轴表示测定样品的相对细胞数。通过荧光信号的强度和位置,可准确判断样品的倍性特征。在检测不同处理的样品时,如果发现荧光通道值在大约100 处呈现峰值,那么这些样品就是单倍体;随着荧光通道值向右移动至约200 的位置时,测定的样品中则为二倍体;若样品在100和200 这两个位置上都出现了荧光峰,那么这种情况下的样品将被视为混倍体,代表该样品包含两个或多个染色体组的混合倍性。经流式细胞仪检测,36株冬枣再生植株中有33 株二倍体,3 株单倍体和二倍体的嵌合体,二倍体占比92%,嵌合体占比8%;5株骏枣均为二倍体,二倍体占比100%;8 株七月鲜再生植株中有6 株二倍体,两株单倍体(图5),二倍体占比75%,单倍体占比25%。

图3 流式细胞仪检测再生植株倍性
Fig.3 Ploidy detection of the regenerated plants from anther callus
A.冬枣二倍体;B.冬枣单倍体、二倍体的嵌合体;C.骏枣二倍体;D.七月鲜二倍体;E.七月鲜单倍体;F.酸枣二倍体。
A.Dongzao diploid;B.Dongzao haploid and diploid chimera;C.Junzao diploid;D.Qiyuexian diploid;E.Qiyuexian haploid;F.Suanzao diploid.

图4 再生植株增殖培养
Fig.4 Proliferation culture of regenerated plants
A.冬枣再生植株;B.骏枣再生植株;C.七月鲜再生植株。
A.Dongzao regeneration plant;B.Junzao regeneration plant;C.Qiyuexian regeneration plant.

图5 七月鲜的二倍体和单倍体植株
Fig.5 Diploid and haploid plants of Qiyuexian
A.二倍体植株;B.单倍体植株。A.Diploid plant;B.Haploid plants.
2.7 IBA不同质量浓度对冬枣组培苗生根的影响
为筛选出适宜诱导冬枣组培苗生根的培养基,在1/2MS 培养基中添加不同质量浓度的IBA,观察其诱导效果。由观察统计结果(表7)可以看出,当IBA 质量浓度为0.4 mg·L-1时,冬枣生根率最高,达到87.5%,诱导生根效果最佳。
表7 不同质量浓度IBA 对冬枣茎段诱导生根的影响
Table 7 Effect of IBA on root induction from Dongzao shoot in vitro
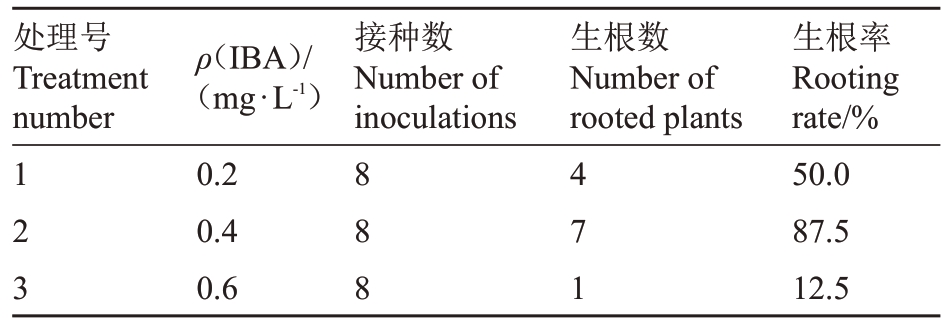
处理号Treatment number接种数Number of inoculations生根数Number of rooted plants 123 ρ(IBA)/(mg·L-1)0.2 0.4 0.6 888 471生根率Rooting rate/%50.0 87.5 12.5
3 讨 论
研究表明,低温预处理可以阻止纺锤丝的形成,提高花药愈伤组织或胚状体的诱导率[24]。金丝小枣在低温条件下处理5 d 后可提高愈伤诱导率[16],冬枣花药低温预处理3 d 时愈伤诱导率最高[21]。在本研究中,低温预处理3 d有利于提高冬枣和七月鲜枣花药愈伤组织诱导率。以不同种类和浓度的糖作为碳源,为枣花药愈伤提供能量,调节渗透压,在组织培养中具有重要作用[19]。长期以来,蔗糖一直被视为植物组织培养的标准碳源而被广泛应用。赞皇大枣和苹果枣花药在添加30 g·L-1蔗糖时愈伤组织诱导率较高[25]。但是近年来发现麦芽糖能够代替蔗糖促进花药培养效率。鲁枣2号和鲁枣6号花药愈伤培养也是以麦芽糖为碳源,得到了黄白色致密型愈伤组织[26]。笔者在本研究中发现麦芽糖是冬枣、骏枣和七月鲜花药愈伤组织培养的最适碳源。添加30 g·L-1麦芽糖时诱导效果最佳,愈伤颜色多数呈黄白色,生长速度快,愈伤组织形态好,诱导率也明显提高。
选用适宜的培养基是组织培养成功的关键[27],刘晓光等[28]在冬枣花药培养中采用TDZ 和NAA 达到16.67%愈伤诱导率;武晓红等[29]只使用2,4-D愈伤诱导率达到57.81%。在本研究中,以MS培养基为基本培养基,选择2,4-D、TDZ、NAA 三种激素复配使用,利用正交设计筛选出1.0 mg·L-1 2,4-D+0.4 mg·L-1 TDZ+0.4 mg·L-1 NAA更适合冬枣、骏枣和七月鲜花药愈伤组织诱导,诱导率分别达到59.33%、64.00%和58.67%,高于单独使用2,4-D和只使用TDZ、NAA的激素组合诱导率,不同生长素组合和低浓度细胞分裂素复配使用更加适合枣花药愈伤诱导培养。笔者在本研究中选用了两种生长素IBA、NAA和细胞分裂素6-BA、TDZ 共4 种激素,以WPM 和MS 为基本培养基,共设计9 种激素组合,18 个不同处理,筛选出了适合各品种花药愈伤分化的最适培养基。研究发现在相同条件下,不同基因型枣花药愈伤组织诱导率、增殖系数和不定芽分化率均有差异,愈伤增殖率和分化率的数据差异较为明显,冬枣、骏枣、七月鲜的愈伤增殖率分别为88.89%、81.11%、78.89%,分化率分别为48.00%、29.33%和33.33%。其中,冬枣的诱导率和分化率均最高,花药愈伤状态良好,与骏枣和七月鲜相比,更容易诱导愈伤和不定芽,且再生植株生长旺盛。因此,在离体花药不定芽诱导中,基因型是重要影响因素之一。
生长素的种类和浓度对组培苗的生根率、根长等具有显著影响。房立媛等[30]的研究结果表明,枣属植物的生根培养通常以1/2MS 作为基本培养基,添加单一或复合生长素即可取得较好的生根效果。赵汗青等[31]研究发现,采用改良1/2MS 培养基并添加0.8 mg·L-1 IBA的组合,能够使京枣39达到最佳生根效果。陈蕊红等[32]在1/2MS培养基中添加0.6 mg·L-1 IBA和0.5%活性炭,可使骏枣不定芽的生根率达到86.89%。在本研究中,以继代培养后生长状况良好的冬枣组培苗带芽茎段为材料,选用1/2MS 基本培养基,并添加不同质量浓度的IBA 和0.3 g·L-1的活性炭进行生根诱导。结果表明,当IBA 质量浓度为0.4 mg·L-1时,冬枣的生根率达到87.5%,生根诱导效果最佳。笔者在本研究中使用更低质量浓度的IBA,但生根效率得到有效提高。未来研究可进一步探讨不同生长素组合及活性炭浓度对冬枣生根的影响,以优化其生根培养体系,为枣树组培苗的高效繁殖提供理论依据和技术支持。
目前,国内外在不同植物花药培养技术方面已取得了显著进展,如在水稻、小麦等作物上已经建立了成熟的花药培养体系,但枣树花药培养技术方面仍存在短板和不足。笔者在本研究中通过对不同基因型枣花药进行低温预处理、设计不同碳源,激素组合等对比试验,成功建立了冬枣、骏枣、七月鲜花药培养及植株再生体系,得到了七月鲜单倍体植株和冬枣再生植株,筛选的培养基效果稳定。未来的研究将进一步探索不同基因型枣树花药培养的差异,优化培养条件,提高愈伤诱导率和再生植株数量,为枣树育种提供更多的优良品种资源。
4 结 论
以冬枣、骏枣及七月鲜单核靠边期花药为外植体,低温预处理3 d对冬枣和七月鲜花药诱导有明显促进作用,对骏枣花药影响不显著。花药愈伤诱导的最适激素组合为:1.0 mg·L-1 2,4-D+0.4 mg·L-1 TDZ+0.4 mg·L-1NAA。花药增殖的最适激素组合为:冬枣(2.5 mg·L-1 TDZ+0.4 mg·L-1 IBA+0.1 mg·L-1 NAA);骏枣(1.0 mg·L-1 TDZ+0.8 mg·L-1 IBA);七月鲜(1.5 mg·L-1 TDZ+0.8 mg·L-1 IBA)。花药愈伤分化的最适基本培养基为WPM培养基,适宜的激素组合为:冬枣(0.8 mg·L-1 TDZ+0.5 mg·L-1 IBA+0.2 mg·L-1 NAA);骏枣(1.0 mg·L-1 6-BA+0.5 mg·L-1 TDZ+0.5 mg·L-1 NAA);七月鲜(1.0 mg·L-1 TDZ+0.5 mg·L-1 IBA+0.2 mg·L-1NAA),获得了冬枣、骏枣、七月鲜的花药再生植株,其中七月鲜诱导出单倍体植株。冬枣生根率在IBA质量浓度为0.4 mg·L-1时达最高,获得完整的冬枣再生植株。
[1] 刘晓光.枣愈伤组织诱导和原生质体分离研究[D].保定:河北农业大学,2006.LIU Xiaoguang.Studies on callus induction and protoplast isolation on Ziziphus jujuba Mill.[D]. Baoding:Hebei Agricultural University,2006.
[2] CHIANCONE B,GERMANÀ M A. Microspore embryogenesis through anther culture in Citrus clementina Hort. ex Tan[J].Methods in Molecular Biology,2016,1359:475-487.
[3] 王万奇,李文龙,王媛媛,廖栩,穆丹.植物花药组织培养技术的研究[J].黑龙江农业科学,2015(10):177-179.WANG Wanqi,LI Wenlong,WANG Yuanyuan,LIAO Xu,MU Dan. Research on tissue culture technology of plant anther[J].Heilongjiang Agricultural Sciences,2015(10):177-179.
[4] GUHA S,MAHESHWARI S C. In vitro production of embryos from anthers of Datura[J].Nature,1964,204(4957):497.
[5] GREWAL D,MANITO C,BARTOLOME V. Doubled haploids generated through anther culture from crosses of elite Indica and Japonica cultivars and/or lines of rice:Large-scale production,agronomic performance,and molecular characterization[J].Crop Science,2011,51(6):2544-2553.
[6] RAKHA M T,METWALLY E I,MOUSTAFA S A,ETMAN A A,DEWIR Y H. Evaluation of regenerated strains from six Cucurbita interspecific hybrids obtained through anther and ovule in vitro cultures[J].Australian Journal of Crop Science,2012,6(1):23-30.
[7] SHAHVALI-KOHSHOUR R,MOIENI A,BAGHIZADEH A.Positive effects of cold pretreatment,iron source,and silver nitrate on anther culture of strawberry (Fragaria × ananassa Duch.)[J].Plant Biotechnology Reports,2013,7(4):481-488.
[8] CALABUIG-SERNAA,PORCEL R,CORRAL-MARTÍNEZ P,SEGUÍ-SIMARRO J M.Anther and isolated microspore culture in eggplant (Solanum melongena L.)[J]. Methods in Molecular Biology,2021,2288:235-250.
[9] AROCKIASAMY S,PATIL M,YEPURI V,SHRIVASTAVA V,MADAN N,HADOLE S,SARKAR P.Anther culture in Jatropha curcas L.:A tree species[J].Methods in Molecular Biology,2021,2289:221-233.
[10] 张茂钦,李达孝,董福美.滇杨花药培育产生植株[J].云南林业科技通讯,1978,7(1):1-4.ZHANG Maoqin,LI Daxiao,DONG Fumei.Plants produced by flowering drug cultivation of Poplar[J]. Yunnan Forestry Science and Technology,1978,7(1):1-4.
[11] 吴绛云.苹果花药培养获得单倍体植株[J].园艺学报,1981,8(4):36-78.WU Jiangyun.Obtaining haploid plantlets of crab apple from anther culture in vitro[J].Acta Horticulturae Sinica,1981,8(4):36-78.
[12] 林寿康,计东风. 桑树花药培养获得单倍体植株[J]. 蚕桑通报,1985,16(3):45-46.LIN Shoukang,JI Dongfeng. Haploid plants from mulberry anther culture[J].Bulletin of Sericulture,1985,16(3):45-46.
[13] 武晓红.枣花药再生植株及单倍体的获得[D].保定:河北农业大学,2008.WU Xiaohong. Plant regeneration from anther and acquirement of haploid in Chinese jujube[D]. Baoding:Hebei Agricultural University,2008.
[14] 牛瑜菲.枣及酸枣原生质体分离与花药培养的研究[D].保定:河北农业大学,2010.NIU Yufei.Isolation of protoplasts and anther culture in Chinese jujube and wild jujube[D]. Baoding:Hebei Agricultural University,2010.
[15] 王震星,张磊.枣花药培养再生植株及其染色体倍性研究[J].北方果树,1998(2):5-6.WANG Zhenxing,ZHANG Lei. Study on regenerated plants and chromosome ploidy of jujube anther culture[J]. Northern Fruits,1998(2):5-6.
[16] 韩晶,王玖瑞,代丽,刘颖,肖京,刘孟军.‘长红枣’和‘金丝小枣’离体花药不定芽的诱导[J]. 河北农业大学学报,2014,37(6):38-42.HAN Jing,WANG Jiurui,DAI Li,LIU Ying,XIAO Jing,LIU Mengjun. In vitro induction of adventitious buds from anther in Ziziphus jujuba Mill.‘Changhongzao’and Z. jujuba Mill.‘Jinsixiaozao’[J].Journal of Agricultural University of Hebei,2014,37(6):38-42.
[17] 王利虎,胡兰,李登科,刘平,刘孟军.枣不同基因型在体愈伤芽再生能力评价与同质多倍体新种质创制[J].植物遗传资源学报,2017,18(1):164-170.WANG Lihu,HU Lan,LI Dengke,LIU Ping,LIU Mengjun. In vivo bud regeneration ability and homogeneous polyploid induction via callus of different jujube genotypes[J]. Journal of Plant Genetic Resources,2017,18(1):164-170.
[18] 段元杰,刘海刚,孟富宣,杨玉皎,周军.枣树花药组织培养研究进展[J].江西农业学报,2016,28(11):47-50.DUAN Yuanjie,LIU Haigang,MENG Fuxuan,YANG Yujiao,ZHOU Jun. Research progress in tissue culture of Chinese jujube anther[J].Acta Agriculturae Jiangxi,2016,28(11):47-50.
[19] 马村艺,张黎.基于正交设计的露薇花组培苗增殖及瓶内开花[J].分子植物育种,2022,20(2):494-498.MA Cunyi,ZHANG Li. Proliferation and flowering in vitro of tissue culture seedlings of Lewisia cotyledon based on orthogonal design[J].Molecular Plant Breeding,2022,20(2):494-498.
[20] 陈纪鹏,彭嗣亮,卢禹,刘小林.预处理和激素对草莓花药离体培养的影响[J].核农学报,2016,30(11):2144-2150.CHEN Jipeng,PENG Siliang,LU Yu,LIU Xiaolin. Effect of pretreatment and hormone on anther culture of strawberry Fragaria ananassa cv. Hongjia in vitro[J]. Journal of Nuclear Agricultural Sciences,2016,30(11):2144-2150.
[21] 贾际平,吴丽萍,曹明,孔德仓,李颖岳,庞晓明.高效冬枣花药愈伤组织培养体系的建立[J].分子植物育种,2018,16(3):948-953.JIA Jiping,WU Liping,CAO Ming,KONG Decang,LI Yingyue,PANG Xiaoming. Establishment of a high-efficiency anther callus culture system of Dongzao(Ziziphus jujuba Mill.)[J]. Molecular Plant Breeding,2018,16(3):948-953.
[22] 王利虎,吕晔,罗智,刘平,刘孟军.流式细胞术估测枣染色体倍性和基因组大小方法的建立及应用[J].农业生物技术学报,2018,26(3):511-520.WANG Lihu,LÜ Ye,LUO Zhi,LIU Ping,LIU Mengjun.Establishment and application of a method for chromosome ploidy identification and genome size estimation using flow cytometry in Ziziphus jujuba[J]. Journal of Agricultural Biotechnology,2018,26(3):511-520.
[23] 田新民,周香艳,弓娜.流式细胞术在植物学研究中的应用:检测植物核DNA 含量和倍性水平[J].中国农学通报,2011,27(9):21-27.TIAN Xinmin,ZHOU Xiangyan,GONG Na. Applications of flow cytometry in plant research:Analysis of nuclear DNA content and ploidy level in plant cells[J]. Chinese Agricultural Science Bulletin,2011,27(9):21-27.
[24] 聂园军,冯丽云,张春芬,邓舒,肖蓉,侯丽媛,赵菁,曹秋芬.苹果花药培养不定胚形成的细胞学观察[J].果树学报,2020,37(3):322-329.NIE Yuanjun,FENG Liyun,ZHANG Chunfen,DENG Shu,XIAO Rong,HOU Liyuan,ZHAO Jing,CAO Qiufen.A cytological observation on the development of embryoid in cultured anther of apple[J].Journal of Fruit Science,2020,37(3):322-329.
[25] 王艳.枣、酸枣离体培养研究[D].保定:河北农业大学,2011.WANG Yan. Studies on in vitro culture of Chinese jujube and sour jujube[D].Baoding:Hebei Agricultural University,2011.
[26] 关秋竹,张琼,孙红雁,周广芳,孙清荣.‘鲁枣2 号’和‘鲁枣6号’花药愈伤组织诱导及不定芽分化[J].河北科技师范学院学报,2017,31(3):10-14.GUAN Qiuzhu,ZHANG Qiong,SUN Hongyan,ZHOU Guangfang,SUN Qingrong. Callus induction of anther and differentiation of adventitious buds in jujube cultivars‘Luzao 2’and‘Luzao 6’[J]. Journal of Hebei Normal University of Science &Technology,2017,31(3):10-14.
[27] 王敬东,陈晓军,张丽,石磊,马洪爱,李苗,甘晓燕,宋玉霞.宁夏枣树花药离体培养再生体系的建立[J].中国农学通报,2011,27(31):174-178.WANG Jingdong,CHEN Xiaojun,ZHANG Li,SHI Lei,MA Hongai,LI Miao,GAN Xiaoyan,SONG Yuxia. The anther of Ningxia Chinese jujube culturing in vitro and establishment of regeneration system[J]. Chinese Agricultural Science Bulletin,2011,27(31):174-178.
[28] 刘晓光,刘孟军,宁强,彭艳芳,苗利军,秦子禹.冬枣花药愈伤组织的诱导及原生质体分离[J]. 中国农学通报,2009,25(2):100-104.LIU Xiaoguang,LIU Mengjun,NING Qiang,PENG Yanfang,MIAO Lijun,QIN Ziyu. Studies on callus induction and protoplast isolation on Ziziphus jujuba Mill. cv. Dongzao[J]. Chinese Agricultural Science Bulletin,2009,25(2):100-104.
[29] 武晓红,王玖瑞,刘孟军,代丽.不同预处理对枣花药愈伤组织诱导的影响[J].华北农学报,2008,23(增刊1):43-45.WU Xiaohong,WANG Jiurui,LIU Mengjun,DAI Li. Effects of different pretreatments on callus induction from anther of Chinese jujube[J]. Acta Agriculturae Boreali-Sinica,2008,23(Suppl.1):43-45.
[30] 房立媛,林敏娟.枣属植物组织培养研究进展[J/OL].分子植物育种,2024:1-21.(2024-06-02).https://kns.cnki.net/kcms/detail/46.1068.S.20240531.1444.012.html.FANG Liyuan,LIN Minjuan. Research in tissue culture of jujube[J/OL].Molecular Plant Breeding,2024:1-21.(2024-06-02).https://kns.cnki.net/kcms/detail/46.1068.S.20240531.1444.012.html.
[31] 赵汗青,王强,庞晓明,薄文浩,李颖岳.‘京枣39’离体多倍体诱导及其增殖、生根培养体系优化[J]. 北京林业大学学报,2024,46(6):118-126.ZHAO Hanqing,WANG Qiang,PANG Xiaoming,BO Wenhao,LI Yingyue. In vitro polyploid induction and optimization of its proliferation and rooting culture system for‘Jingzao 39’[J].Journal of Beijing Forestry University,2024,46(6):118-126.
[32] 陈蕊红,汪海花,郭天然,徐崇崇,解冰芊,李云飞,黄建.骏枣组培快繁体系及菌根化育苗技术研究[J].西北林学院学报,2025,40(1):111-118.CHEN Ruihong,WANG Haihua,GUO Tianran,XU Chongchong,XIE Bingqian,LI Yunfei,HUANG Jian. Establishment of rapid propagation in vitro and mycorrhizal seedling system of Ziziphus jujuba‘Junzao’[J]. Journal of Northwest Forestry University,2025,40(1):111-118.