柿(Diospyros kaki Thumb)为柿科(Ebenaceae)柿属落叶果树,原产于中国。作为重要的经济果树,中国柿树栽培面积达96.6万hm2,年产量343万t,是全世界最大柿生产国(联合国粮农组织,2021 年)。甜柿鲜食性好,商品价值高,更消除了消费者对涩柿易诱发的“柿结石”的担忧,而且采后无需经过人工脱涩处理,更加方便贮运[1],由此成为当前全球重点发展的柿品种类型以及遗传改良的首要目标[2-3]。阳丰甜柿风味独特,色泽诱人,深受消费者欢迎,是中国发展的主要甜柿品种之一[4]。由于柿果营养丰富,富含多酚、黄酮、抗坏血酸等多种功能成分,具有抗肿瘤、抗衰老、降血压等保健作用[5-6],且随着人们对柿药用价值认识的深入和对高质鲜果需求的增加,其在采后贮藏过程中的品质保持也日益受到重视[7]。
低温贮藏是最常用的延长果蔬保鲜时间的技术措施,适宜的低温环境对维持其品质起着尤为重要的作用。阳丰甜柿属于呼吸跃变型果实,对乙烯十分敏感,常温条件(20 ℃)下很快软化和品质劣变[8-9],低温虽能延长其贮藏期,但甜柿属冷敏性果实,在冷藏期间极易发生冷害,出现果肉褐变、凝胶化以及加速软化等冷害症状而失去商品价值,每年由此造成的经济损失巨大[10-11]。不同品种柿果的采后生理特性存在差异,Novillo等[12]认为Rojo Brillante 柿贮藏在15 ℃以下条件下都易发生冷害;Nam等[13]研究表明Cheongdobansi 柿的冷害发生的低温临界值为8 ℃;Woolf 等[14]则证实Fuyu 甜柿在0~4 ℃之间贮藏会出现冷害症状。然而,目前国内外对阳丰甜柿采后的研究报道较少,其在不同温度条件下的贮藏生理特性还尚不明确。为此,笔者在本研究中以阳丰甜柿为试材,以20 ℃常温贮藏为对照,研究果实在低温条件(0 ℃、5 ℃、10 ℃和15 ℃)下的生理和品质指标的变化,旨在确定适宜的冷藏温度,为后续阳丰甜柿贮藏保鲜技术体系的建立提供理论依据。
1 材料和方法
1.1 试验材料
阳丰甜柿(Diospyros kaki L. cv.Youhou),采自山西省运城市临猗县角杯乡过卓村果园中,选择没有虫害、病害和机械损伤的果实,并立即运回实验室,再按照果形端正、成熟度一致、大小均一的标准进行筛选。
1.2 试验方法
1.2.1 果实处理方法 选取5个贮藏温度:以20 ℃作为常温对照,设置0 ℃、5 ℃、10 ℃和15 ℃4个低温处理组,每个处理随机选取500个果实,并分别设3次重复。将各处理果实置于内衬有PE保鲜袋的塑料周转箱中(10 kg·箱-1),敞口预冷12 h后扎口,于不同贮藏温度下、相对湿度95%以上条件下贮藏30 d。在贮藏期间,每3 d 从各处理中随机取样,每次用量30 个果实,分别用于测定乙烯释放速率、呼吸强度、出汁率、硬度、可溶性固形物含量、果皮色泽和相对电导率。同时将果肉组织冷冻于液氮中,保存于-80 ℃,以备后续的丙二醛(malondialdehyde,MDA)、H2O2以及抗氧化营养物质含量测定。另外,每3 d 将30 个果实从贮藏环境转移至20 ℃常温货架下5 d,以评估冷害指数。
1.2.2 冷害指数的统计 甜柿的冷害指数以果肉和果皮褐变程度作为统计依据[15]。根据果实褐变比例,将冷害严重程度分为0~4 级:0(无冷害症状)、1(轻度冷害,褐变比例1%~25%)、2(中度冷害,褐变比例25%~50%)、3(重度冷害,褐变比例50%~75%)、4(严重冷害,褐变比例75%~100%)。冷害指数的计算公式为:[Σ(冷害等级)×(该冷害级别的果实数量)]÷(冷害总等级)×(调查的果实总数量)。
1.2.3 乙烯释放速率和呼吸强度的测定 采用静置法测定果实的乙烯释放速率和呼吸强度[16]。在贮藏温度条件下,将5个果实放置于3 L密封玻璃容器中4 h,收集气体样品,用日本岛津GC-14C气相色谱仪测定乙烯含量(外标法),结果换算成乙烯释放速率,以μL·kg-1·h-1计;使用美国Felix 公司F-950 型果蔬气体分析仪检测容器中CO2浓度,结果换算成呼吸强度,以mg·kg-1·h-1计。
1.2.4 出汁率、硬度和可溶性固形物含量的测定出汁率:每重复随机选取5个果实,削皮后在赤道线区域均匀取果肉10 g,充分研磨,再于16 000×g条件下离心30 min 后(Allegra X-30R 离心机,美国Beckmancoulter 公司),收集并称取上清液质量m,以m/10 计算果实的出汁率,单位为%;硬度:每重复随机选取6个果实,每个果实沿着赤道线选取两点,削皮后,利用TA-XT-plus 质地分析仪进行硬度测定(英国SMS 公司)。质构仪测定条件:P/5 圆柱形探针,探头下降速度1 mm·s-1、测试速度0.5 mm·s-1、测后速度10 mm·s-1、测试距离8 mm。硬度记录为最大压力,单位为g;可溶性固形物含量:将果实粉碎后,收集果汁后用于可溶性固形物含量测定,测定仪器采用PAL-1 型手持式折光仪(日本爱宕公司),单位用百分比表示。
1.2.5 果皮色泽的测定 使用CR400 色差仪(日本柯尼卡公司)在果实相对的两个面测量果皮色泽,记录每重复3个果实的平均值,用L*(亮度)、a*(负值:绿色;正值:红色)、b*(负值:蓝色;正值:黄色)和色度角(H*=tan-1b*/a*)表示果皮色泽参数。
1.2.6 相对电导率、MDA 和H2O2含量的测定 相对电导率的测量参考Zhao等[4]的方法,并略作修改。用打孔器从果实赤道线区域切下1 cm3左右的果肉,然后切成2 mm厚的薄片。从中随机选取30片,置于40 mL蒸馏水中,25 ℃振荡2 h后,用上海雷磁DDS-11A型电导率仪测定初电导率EM0;随后,将溶液煮沸15 min,并重新补充至40 mL,测定电导率EMt。相对电导率计算公式为:(EM0/EMt)×100%。
MDA含量的测定参照Li等[17]的方法,并略作修改。称取1 g 冷冻组织样品,用4 mL 5%(w/V)三氯乙酸溶液冰浴匀浆后,在4 ℃、12 000×g条件下离心20 min,取2 mL上清液和3 mL 0.67%硫代巴比妥酸溶液进行混合,然后将混合物煮沸15 min,立刻冷却,12 000×g条件下继续离心10 min后,收集上清液,利用Ultrospec 2000型紫外分光光度仪(瑞士Amersham Pharmacia Biotech 公司)分别在450、532 和600 nm处测量其吸光度。果实MDA 含量计算公式为:6.45×(A532-A600)-0.56×A450。结果以μmol·g-1表示。
果实H2O2含量使用H2O2检测试剂盒(A064-1-1,南京建成生物公司)进行测定。
1.2.7 总酚、总黄酮和抗坏血酸含量的测定 甜柿总酚含量的测定参考Bagheri等[18]的方法,并略作修改。先将每个重复冷冻的组织样品(1 g)在50 mL蒸馏水中匀浆,加热至100 ℃并保持30 min。溶液经冷却过滤后,收集滤液作为提取液,重新调整至50 mL。然后将10 mL 提取液与2.5 mL Folin-Ciocalteu试剂和7.5 mL 20%(w/V)Na2CO3溶液混合,于75 ℃条件反应10 min,记录其在760 nm处的吸光度,结果以每克鲜果质量的没食子酸毫克质量(mg·g-1)表示。没食子酸原液质量浓度为10 mg·mL-1,建立标准曲线,其质量浓度范围为0、0.2、0.4、0.6、0.8、1.0 mg·mL-1。
总黄酮含量的测定方法参考Niazi等[19]的方法,并略作修改。首先,每个重复取1 g 冷冻组织样品,用5 mL 70%乙醇溶液匀浆超声提取,再将1.5 mL提取液与0.3 mL 5%(w/V)NaNO2溶液、0.30 mL 10%(w/V)Al(NO3)3溶液以及1.4 mL 10%(w/V)NaOH溶液充分混合。混合物在25 ℃的水浴中反应15 min后,在510 nm 处测量吸光度,结果以每克鲜果质量的芦丁毫克质量(mg·g-1)表示。芦丁原液质量浓度为1 mg·mL-1,建立标准曲线,其质量浓度范围为0、0.02、0.04、0.06、0.08、0.10 mg·mL-1。
抗坏血酸含量的测定采用了Fawole等[20]报道的方法。结果以每100克鲜果质量所含抗坏血酸质量表示(mg·100 g-1)。
1.3 数据处理
所有试验均设3个重复,结果以平均数±标准差(SD)表示。用origin作图,利用SPSS 23.0对数据进行ANOVA 分析,并使用邓肯极差分析确定差异显著性。
2 结果与分析
2.1 不同贮藏温度对甜柿冷害指数及冷害症状的影响
果皮和果肉褐变是甜柿典型的冷害症状,在低温贮藏过程中不易被察觉,但往往会发生在柿果转移至常温(20 ℃)货架时期[10-11,17]。从图1-A和图1-B中可以看出,随着低温贮藏时间的延长,柿果的褐变呈不断加重的趋势。在果肉横切方向,褐变症状是从果皮向果核位置不断发展;在纵切方向,褐变症状则从果顶逐渐发展并延伸到果脐处。除在20 ℃(常温)条件下外,甜柿在不同低温条件下贮藏后的货架时期(常温5 d后)均发生了冷害,其中5 ℃下最早发生,在贮藏第12 天就出现冷害症状,安全贮藏期仅有9 d,且冷害症状发展迅速,冷害指数在24 d 时就达到了100%,显著高于其他处理(p<0.05);10 ℃和15 ℃处理组果实的冷害发生时间则分别延迟了6 d和12 d;0 ℃处理组果实仅在贮藏30 d 时出现轻微冷害症状,在贮藏前27 d均未发生,安全贮藏期长达27 d。在贮藏末期,5个温度处理组的果实间冷害指数差异显著(p<0.05),5 ℃最高,依次为10 ℃和15 ℃,0 ℃较低,而20 ℃没有出现冷害症状。
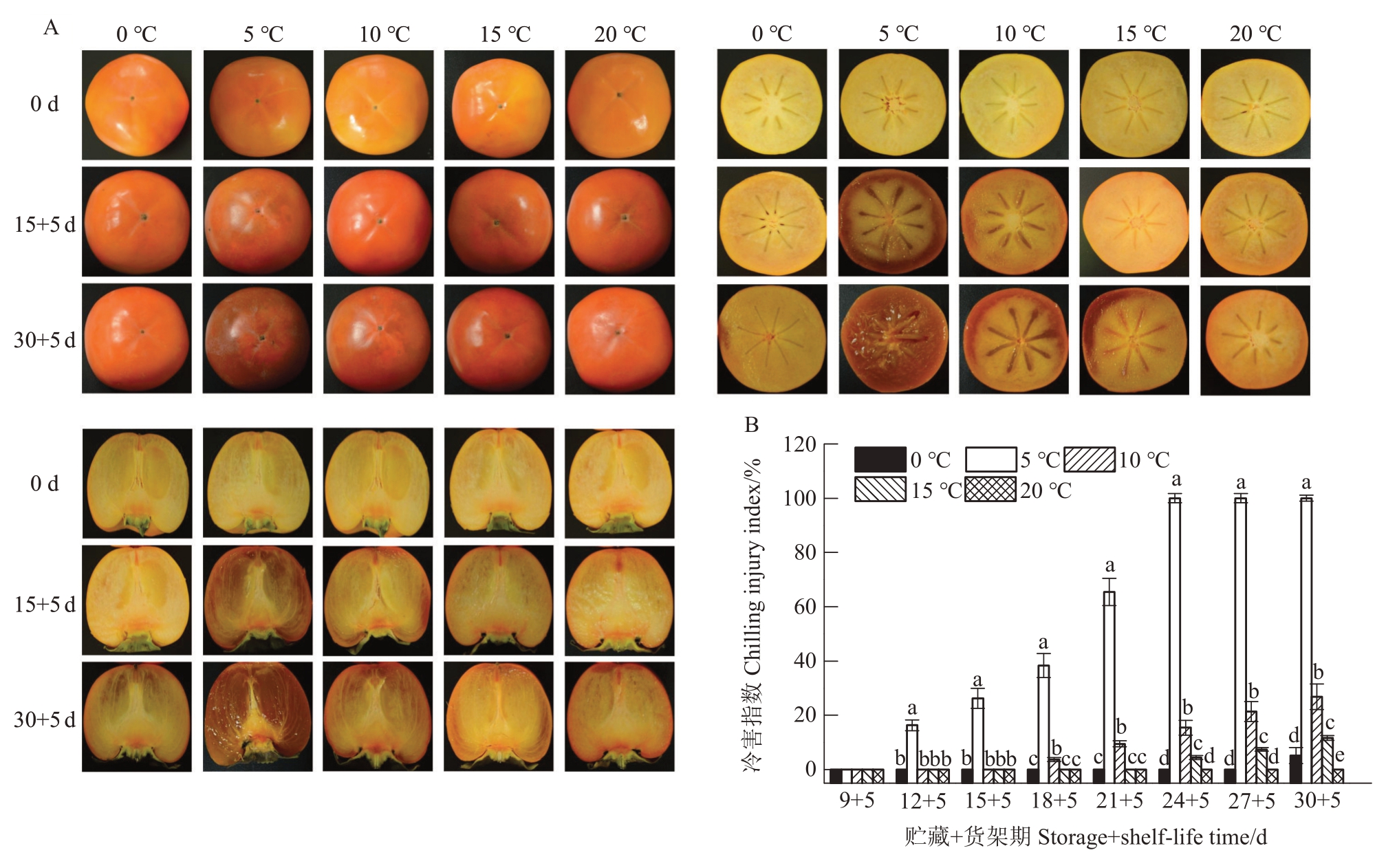
图1 在不同温度条件下贮藏的阳丰甜柿货架(20 ℃)5 d 后的照片(A)和冷害指数(B)
Fig.1 Photograph(A)and CI index(B)of Youhou sweet persimmons on 20 ℃shelf for 5 d after storage at different temperature
不同小写字母表示统计差异(p<0.05)。下同。
Different small letters indicate statistical differences(p<0.05).The same below.
2.2 不同贮藏温度对甜柿乙烯释放速率和呼吸强度的影响
如图2-A 所示,不同温度贮藏条件下果实的乙烯释放速率差异明显:10 ℃、15 ℃和20 ℃下的果实乙烯释放主要集中在贮藏前期,后期的释放较为平缓;0 ℃和5 ℃条件下却呈现出相反的趋势,即贮藏前期的乙烯释放速率一直维持在低水平,而在贮藏后期具有较大的波动。10 ℃、15 ℃和20 ℃处理组果实的乙烯释放速率高峰出现在第6天,其中20 ℃的峰值最高,为0.149 μL·kg-1·h-1,高于10 ℃的0.088 μL·kg-1·h-1和15 ℃的0.103 μL·kg-1·h-1,三者差异达到显著水平(p<0.05)。相比于上述3 个处理,5 ℃和0 ℃分别将乙烯释放速率高峰延迟了9 d 和15 d,且在贮藏后期果实呈现出更高的乙烯释放速率。

图2 阳丰甜柿在不同温度贮藏期间的乙烯释放速率(A)和呼吸强度(B)
Fig.2 Ethylene production(A)and respiration rate(B)of Youhou sweet persimmons during storage at different temperature
由图2-B 可知,甜柿在贮藏过程中的呼吸强度呈上升趋势。相比于20 ℃处理,0 ℃处理显著抑制了果实呼吸强度的上升,在整个贮藏期变化最为平缓,没有出现明显的呼吸高峰;10 ℃处理组果实最早达到呼吸高峰(提前了6 d),且在贮藏后期仍保持着最高的呼吸强度;15 ℃将呼吸高峰出现时间延迟了3 d;5 ℃处理组的果实在贮藏前9 d的呼吸强度上升较快,呼吸高峰出现在第21 天,但峰值和在贮藏中后期的呼吸强度整体都低于10 ℃、15 ℃和20 ℃处理,但高于0 ℃处理。
2.3 不同贮藏温度对甜柿出汁率、硬度和可溶性固形物含量的影响
在贮藏期间,不同温度条件下的甜柿的出汁率均在不断下降(图3-A)。相比于常温20 ℃处理组,0 ℃处理组果实出汁率的变化呈现出相似的规律,均是下降较为平缓,在贮藏前后损失了21.22%,略高于20°条件下的16.81%;而5 ℃、10 ℃和15 ℃处理均明显加快了出汁率的下降,自贮藏第18 天起,就与0 ℃和20 ℃处理之间呈现出显著差异(p<0.05)。贮藏到30 d 时,5 ℃处理组果实出汁率下降幅度最大,高达85.79%,而10 ℃和15 ℃果实为70.79%和37.40%,三者分别比0 ℃条件下降低64.57%、49.57%和16.18%。将贮藏后的甜柿转移至常温货架后,进一步加剧了低温处理组果实(0~15 ℃)出汁率的降低,其中仍然5 ℃最严重,10 ℃次之,0 ℃最轻(图3-B)。在贮藏30 d+货架5 d 时,20 ℃处理组果实出汁率降低22.58%,而0 ℃、5 ℃、10 ℃和15 ℃条件下分别降低33.31%、91.28%、81.38%和45.89%,不同处理间差异显著(p<0.05)。
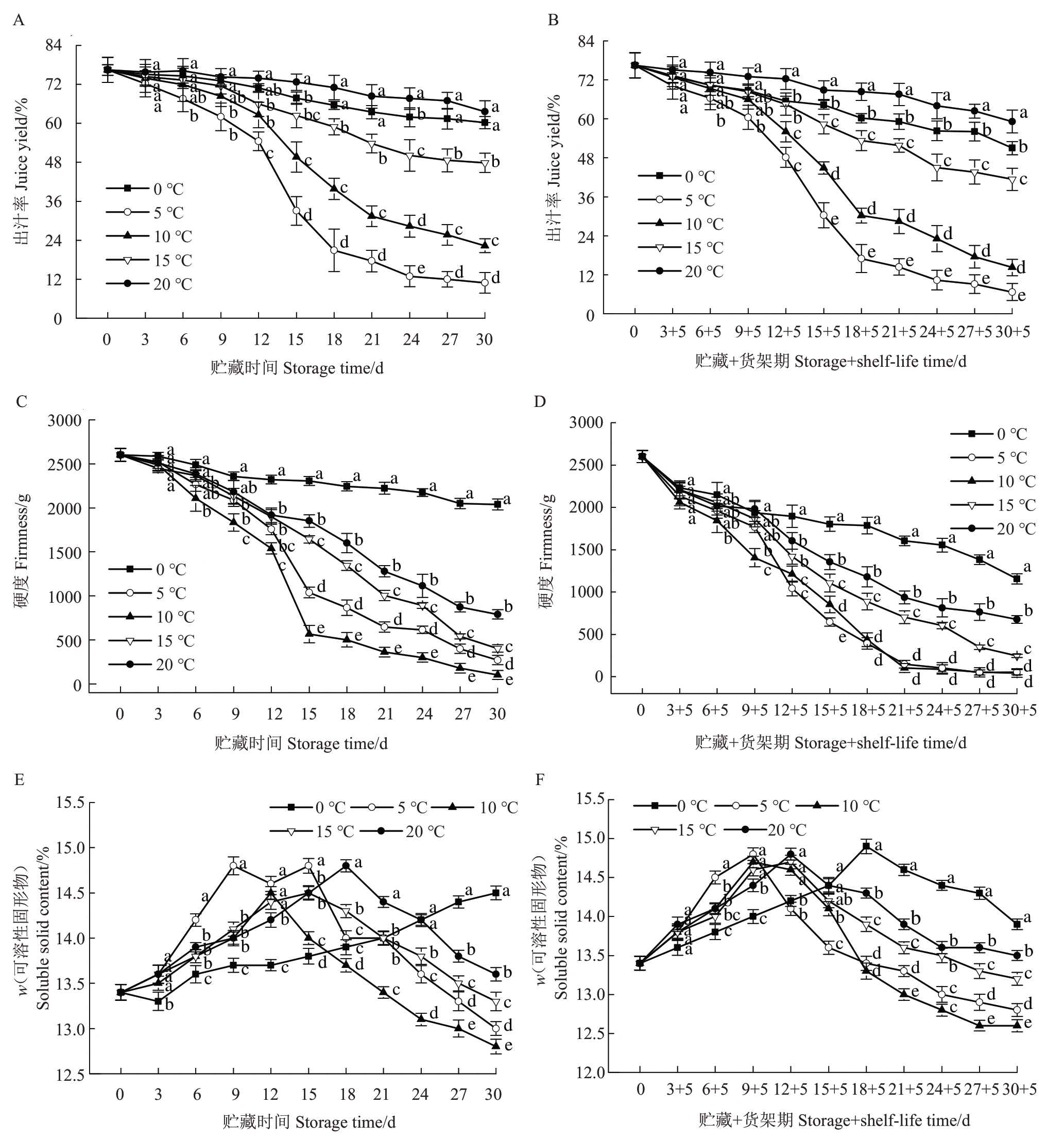
图3 阳丰甜柿在不同温度贮藏期间和货架(20 ℃)5 d 后的出汁率(A、B)、硬度(C、D)和可溶性固形物含量(E、F)
Fig.3 Juice yield(A,B),firmness(C,D),Soluble solid content(E,F)of Youhou sweet persimmons during storage at different temperature and shelf-life period at 20 ℃for 5 d
从图3-C可以看出,随着贮藏时间的延长,所有处理的果实硬度均呈下降趋势。在10 ℃条件下,果实质地迅速软化,保脆期仅能维持在15 d左右;相比于20 ℃处理,0 ℃显著抑制了果实硬度的下降速率,贮藏前后没有发生明显的软化;5 ℃、10 ℃和15 ℃均加速了硬度降低,其中10 ℃条件下果实硬度下降速率最快,其次为5 ℃。不同贮藏温度下的果实硬度具有明显差异,自贮藏15天起就达到显著水平(p<0.05)。由图3-D 可知,相比于贮藏阶段,货架期间明显加速了低温处理组果实的软化进程,其中5 ℃和10 ℃条件下最快,在贮藏18 d+货架5 d后已基本完全软化;0 ℃仍最慢,自贮藏12 d+货架5 d 起,该条件下的果实硬度就一直显著高于其他4个处理(p<0.05)。
由图3-E 可知,甜柿的可溶性固形物含量在0 ℃条件下持续上升,在贮藏30 d 时达到最高值,但在其他4 个温度条件下则表现出先升高后降低的趋势。5 ℃条件下果实的可溶性固形物含量在贮藏前期上升速率最快,然后快速下降;10 ℃、15 ℃和20 ℃下的果实可溶性固形物含量分别比5 ℃晚了3、6 和9 d 到达最高值,但10 ℃表现出了最快的下降速率。在贮藏末期,0 ℃条件保持了最高的可溶性固形物含量,其次为20 ℃、15 ℃、5 ℃,最低为10 ℃,5 个处理间差异显著(p<0.05)。不同温度条件下的甜柿在货架期间的可溶性固形物含量都表现出先升高后降低的趋势,0 ℃最晚到达最高值,在货架末期同样维持了最高的可溶性固形物含量(p<0.05),其他温度条件下的果实可溶性固形物含量的高低排序也与贮藏期间的相一致(图3-F)。
2.4 不同贮藏温度对甜柿果皮色泽的影响
由图4-A 可知,与20 ℃相比,5 ℃、10 ℃和15 ℃处理加速了甜柿果皮L*值的下降,其中5 ℃处理最为明显,贮藏第12天起就与其他4个处理达到显著差异水平(p<0.05),其次为10 ℃;0 ℃显著抑制了L*值的下降,贮藏至30 d时,其L*值与初始值相比变化不大,并显著高于其他处理(p<0.05)。如图4-B所示,货架期间显著加速了所有低温处理组果实果皮L*值的下降,5 ℃和10 ℃的下降最为明显。在贮藏30 d+货架5 d时,0 ℃处理组的果实L*值低于20 ℃处理组,差异不显著(p>0.05);但仍显著高于15 ℃、10 ℃和5 ℃处理组(p<0.05)。

图4 阳丰甜柿在不同温度贮藏期间和货架(20 ℃)5 d 后的L*(A、B)、a*(C、D)和色度角H*(E、F)值
Fig.4 L*(A,B),a*(C,D),and hue angle H*(E,F)of Youhou sweet persimmons during storage at different temperature and shelf-life period at 20 ℃for 5 d
如图4-C,在贮藏过程中,甜柿果皮的a*值呈逐渐上升的趋势,20 ℃、15 ℃和10 ℃处理组果实的上升速率明显高于5 ℃和0 ℃处理,自贮藏第6 天起就达到显著差异水平(p<0.05)。相比于20 ℃处理,10 ℃和15 ℃处理加速了a*值的上升,其中10 ℃上升幅度最大,在贮藏末期a*值显著高于其他处理(p<0.05),但与15 ℃处理差异不显著(p>0.05);0 ℃和5 ℃处理均减缓了a*值的上升,其中0 ℃最明显,果实a*值在整个贮藏期的变化很小,二者从贮藏第9天开始便呈显著差异(p<0.05)。由图4-D可知,与贮藏阶段相比,不同低温条件下的果实果皮在货架期间的a*值上升更快,其中10 ℃最快,15 ℃次之,0 ℃最慢。在货架末期,各处理间的a*值高低排序与贮藏期间相一致。
在20 ℃条件下,甜柿果皮的H*值随贮藏期延长而不断下降(图4-E);0 ℃处理明显抑制了果实H*值的下降,自贮藏第9 天起便维持了最高的H*值,显著高于其他4个处理(p<0.05);5 ℃、10 ℃和15 ℃处理促进了H*值的下降,其中5 ℃处理果实在贮藏前期下降较慢,但从15 d起快速下降,导致在贮藏结束后显著低于其他处理(p<0.05),其次为10 ℃和15 ℃。在货架期间,甜柿果皮的H*值也呈不断下降的趋势,且0~15 ℃的4个低温处理组的下降幅度明显高于贮藏期间(图4-F)。在货架末期,各处理组果实之间的H*值差异显著(p<0.05),从高到低分别为0 ℃、20 ℃、15 ℃、5 ℃和10 ℃。
2.5 不同贮藏温度对甜柿相对电导率、MDA 和H2O2含量的影响
甜柿在不同温度条件下贮藏期间的相对电导率和MDA 含量均呈持续升高趋势(图5-A,B),常温20 ℃处理组果实的增长幅度仅高于0 ℃处理,明显低于其他低温处理组,其相对电导率和MDA 含量分别自第12 天和第15 天就开始显著低于5 ℃、10 ℃和15 ℃处理组(p<0.05);5 ℃和10 ℃是增长最快的两个处理组,前者的相对电导率和MDA 含量更高,二者在贮藏中后期就呈现显著差异(p<0.05);0 ℃处理组则明显延缓了增长,两个指标在大多数贮藏时间均显著低于其他4个处理(p<0.05)。
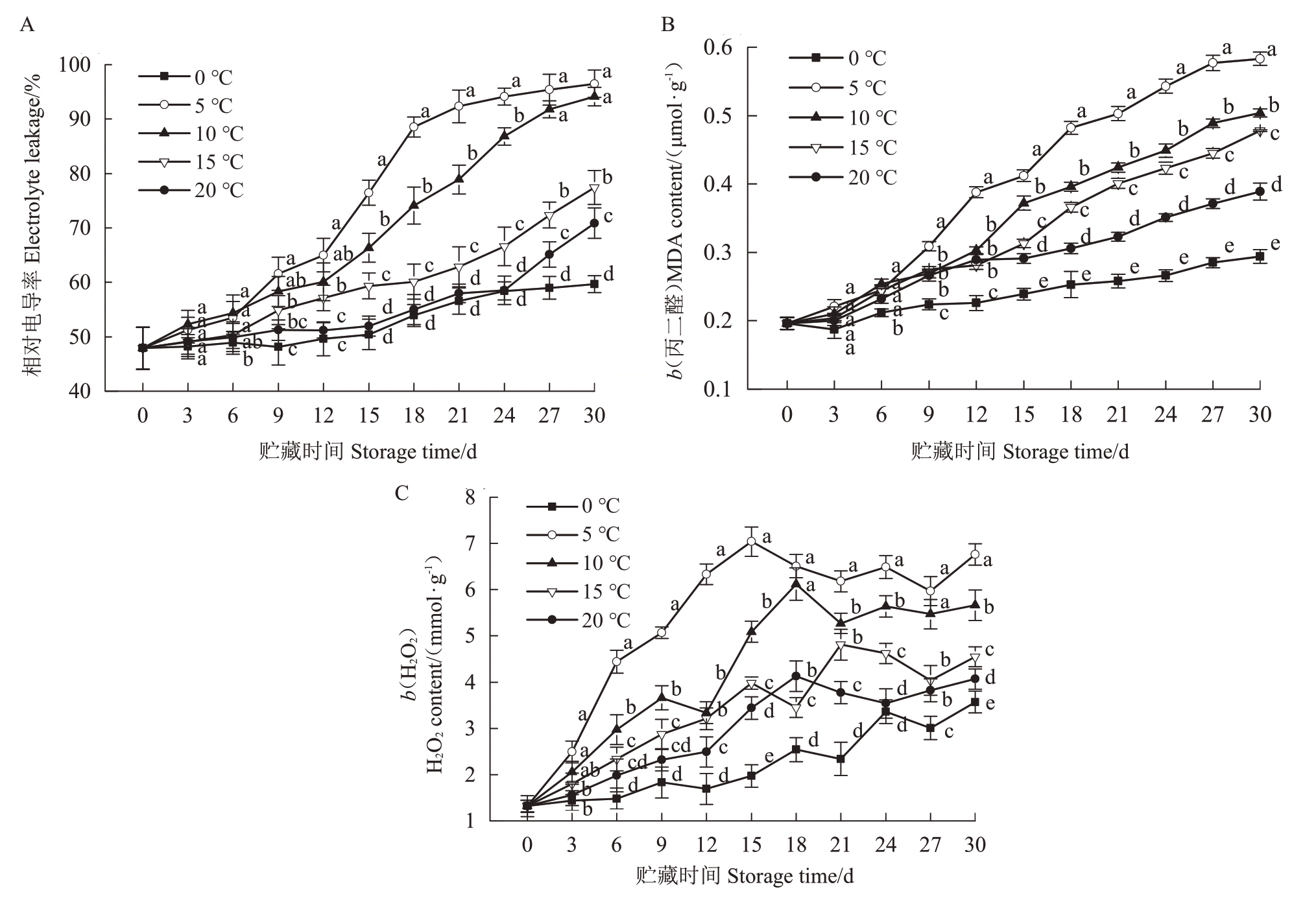
图5 甜柿在不同温度贮藏期间的相对电导率(A)、丙二醛(B)和H2O2含量(C)
Fig.5 Lectrolyte leakage(A),malondialdehyde concentration(MDA)(B),and H2O2 concentration(C)of Youhou sweet persimmons during storage at different temperature
如图5-C所示,在贮藏期间,甜柿果实中的H2O2含量逐渐增加。与20 ℃处理组果实相比,0 ℃处理明显减缓了果实H2O2的积累速率;而5 ℃、10 ℃和15 ℃处理则均加剧了H2O2的积累,其中5 ℃条件下果实表现出了最快的H2O2上涨速率,依次高于10 ℃和15 ℃处理。贮藏至30 d 时,5 个温度处理组果实之间的H2O2含量差异显著(p<0.05),从低到高分别为0 ℃、20 ℃、15 ℃、10 ℃和5 ℃。
2.6 不同贮藏温度对甜柿总酚、总黄酮和抗坏血酸含量的影响
如图6-A 所示,甜柿果实总酚含量在贮藏期间呈现先增加后降低的趋势。10 ℃、15 ℃和20 ℃处理组果实的总酚含量均在贮藏第15天到达最高值,而后快速下降(速率10 ℃>15 ℃>20 ℃),而5 ℃处理组最早达到峰值(12 d),但下降速率最快。0 ℃处理组变化较为平缓,贮藏第30 天时,果实总酚含量高达0.736 mg·g-1,分别比20 ℃、15 ℃、10 ℃、5 ℃多保留了3.94%、5.29%、9.38%和13.72%,差异均达到显著水平(p<0.05)。与贮藏期间相比,甜柿在货架期间的总酚含量的变化呈现出相似的趋势,但下降速率明显更快,其中仍然5 ℃最快,0 ℃最慢(图6-B)。在贮藏30 d+货架5 d 时,0 ℃处理组果实总酚含量为0.702 mg·g-1,分别比20 ℃、15 ℃、10 ℃、5 ℃多保留了3.42%、8.12%、13.39%和19.09%,不同处理间差异显著(p<0.05)。

图6 阳丰甜柿在不同温度贮藏期间和货架(20 ℃)5 d 后的总酚(A、B)、总黄酮(C、D)和抗坏血酸含量(E、F)
Fig.6 Total phenolic(A,B),total flavonoid(C,D),and ascorbic acid(E,F)contents of Youhou sweet persimmons during storage at different temperature and shelf-life period at 20 ℃for 5 d
甜柿果实的总黄酮含量在贮藏期间呈波动下降的趋势(图6-C)。与20 ℃处理相比,0 ℃明显减缓了黄酮物质的下降速率,而5 ℃、10 ℃和15 ℃均加速了其损耗,其中10 ℃最快,5 ℃次之。贮藏至第30天时,相比于初始总黄酮含量,0 ℃处理组果实损失了23.61%,而20 ℃、15 ℃、5 ℃和10 ℃下分别损失了29%、32.34%、34.87%和37.68%,差异显著(p<0.05)。如图6-D所示,货架期间也同样加速了甜柿总黄酮的损耗。在贮藏30 d+货架5 d 时,0 ℃处理组果实总黄酮含量的损失为26.54%,分别显著低于20 ℃、15 ℃、10 ℃和5 ℃下的31.19%、39.23%、43.48%和46.46%(p<0.05)。
从图6-E可以看出,与20 ℃一样,5 ℃、10 ℃和15 ℃处理组果实的抗坏血酸含量表现为先上升后下降的趋势,其中10 ℃处理组果实在贮藏前期上升速率最快,5 ℃最慢,而在贮藏后期,5 ℃处理组果实抗坏血酸含量下降最快,其次为10 ℃和15 ℃,20 ℃最慢;0 ℃处理果实的抗坏血酸含量则在贮藏期间呈不断上升趋势。在贮藏至30 d 时,5 个温度处理之间的果实抗坏血酸含量存在显著差异,0 ℃最高,其次分别是20 ℃、15 ℃、10 ℃和5 ℃(p<0.05)。货架期间,所有处理组的甜柿抗坏血酸含量都呈现先增长后下降的趋势,其中0 ℃最晚到达峰值,且下降幅度最为平缓,而5 ℃、10 ℃下降最快(图6-F)。在货架的中后期,0 ℃处理组都保留了最高含量的抗坏血酸。
3 讨 论
低温贮藏是保持果蔬贮藏品质的有效办法,但不适宜的低温会加速冷敏型果实冷害的发生。本研究结果表明,阳丰甜柿在15 ℃以下的低温贮藏时均会发生冷害,其中5 ℃最严重,这与Orihuel-Iranzo等[21]在Rojo Brillante柿和Collins等[22]在Suruga柿上的发现相一致,而Macrae 等[23]和Zhang 等[24]认为Fuyu 甜柿最严重的冷害温度为4 ℃。不同果蔬的冷害发生规律有所差异,茄子[25]、哈密瓜[26]的贮藏温度越低,冷害越严重,而甜柿在0 ℃条件下的冷害严重程度却要显著低于5~15 ℃,这与桃[27]和番木瓜[28]等水果相似。
低温会加速H2O2等活性氧的生成,其过量积累对细胞膜造成的损伤被认为是果实发生冷害的主要原因[29-30]。相对电导率能够反映细胞膜通透性,而MDA是细胞膜脂质过氧化的产物,与细胞膜损伤的严重程度密切相关。笔者在本研究中发现,相比于20 ℃处理,5~15 ℃都加剧了果实细胞膜的损伤,其中5 ℃条件下的甜柿相对电导率、MDA和H2O2含量最高,导致其冷害程度最严重;而0 ℃由于显著抑制了这3个指标的上升,维持了更稳定的质膜系统,使得在30 d贮藏期间只出现了轻微的冷害症状;在0~15 ℃的低温区间,甜柿细胞膜的完整性越低,冷害严重程度就越高(5 ℃>10 ℃>15 ℃>0 ℃)。这与Li 等[15]和Zhao 等[4]的研究发现相一致,其采用的1-MCP处理降低了阳丰甜柿细胞膜的损伤,由此减轻了果实的冷害。
出汁率、硬度和可溶性固形物含量直接关系着甜柿的鲜食体验,是消费者最为关注的品质指标。果实发生冷害后会导致出汁率的下降,这被认为是由于低温诱导了果胶的代谢紊乱,导致甲氧基果胶含量升高,果肉以凝胶形态束缚了更多自由水[31-32]。本研究结果也证实了这一点,常温(20 ℃)条件下,果实由于未发生冷害,从而保留了最高的出汁率;而在低温贮藏条件下,甜柿冷害程度越高,出汁率越低,其中5 ℃果肉凝胶化最严重,10 ℃次之。呼吸作用与果实的成熟衰老进程密切相关,在贮藏过程中会促进果实软化,也会将可溶性固形物作为呼吸底物进行消耗[33]。本研究结果表明,在所有温度处理中,10 ℃最早到达呼吸高峰,且保持更高的呼吸强度水平,果实成熟进程最快,因而其硬度和可溶性固形物含量降幅明显高于其他处理;0 ℃由于强烈抑制了果实的呼吸作用,在贮藏末期维持了最高的硬度和可溶性固形物含量。此外,一般认为低温能够抑制果实的呼吸作用,但甜柿在10 ℃下却比20 ℃具有更高的呼吸强度,这可能是由于10 ℃果实发生冷害后所引起的呼吸强度异常上升所致。类似于本研究的结果,Tessmer 等[34]发现了10 ℃加速了Giombo柿的成熟进程,导致其硬度快速下降。也有研究认为快速软化是柿果冷害的另一种症状表现[24,35],而低温诱导的果实细胞壁物质代谢异常是其主要原因[36-37]。
果皮色泽是果实新鲜品质的直接反映。在贮藏过程中,甜柿果皮颜色会由黄橙再到红橙,L*(果肉颜色变暗)会逐渐下降,并伴随着a*值的增加(颜色转红)和H*值的减小(b*降低,黄色减少),颜色指标的变化能够直接反映果实的成熟衰老进程。在本研究中,10 ℃处理组果实的a*值上升最快,H*值下降最快,在贮藏末期与20 ℃之间差异显著,再次证明了10 ℃加速了果实成熟衰老进程;15 ℃也表现出一定的促进作用,但不如10 ℃明显;0 ℃由于强烈抑制了果实的成熟进程,使得果实色泽转变程度最低。L*值的降低表明果皮变暗,被认为可能由冷害所引起[38]。本研究结果表明,甜柿L*值的降低与冷害严重程度密切相关:5 ℃冷害最严重,L*下降程度显著高于其他处理;0 ℃冷害最轻微,维持的L*值仅低于没有发生冷害的20 ℃。
柿子所富含的多酚、黄酮和抗坏血酸等抗氧化成分可以清除活性氧的氧化伤害,从而减少对细胞膜和细胞内结构的破坏,在果实体内的抗氧化系统中起着重要的平衡作用[39-40]。在贮藏过程中,抗氧化物质含量的增加与果实成熟过程有关,而其下降则与在低温胁迫下清除活性氧自由基的消耗有关[41-42]。在本研究中,相比于20 ℃处理,0 ℃处理有效延迟了果实的成熟衰老进程,活性氧含量较低,从而减少了上述抗氧化成分的消耗,因此保留了最高的含量;其他低温条件下,由于成熟衰老进程加速,且积累了更多的活性氧,使得果实响应了更显著的氧化应激压力,从而消耗了更多的抗氧化物质,降低了营养品质,其中5 ℃和10 ℃贮藏组果实损失最多。
乙烯是一种能促进成熟衰老的激素,低温信号可诱导乙烯释放量的上升,这与果实冷害的发生有密切的关系[43-44]。本研究结果表明,5 ℃和10 ℃两个冷害温度均引起了甜柿在贮藏期间乙烯释放的波动,但并非在整个贮藏期都高于常温条件,这可能是甜柿在不同温度下对乙烯敏感性强弱不同所造成的,也有可能甜柿冷害的发生是由包括乙烯在内的多信号分子途径共同调控的结果,这都有待于进一步深入研究。此外,笔者在本研究中发现甜柿在5 ℃和10 ℃两个温度下的冷害症状的表现和严重程度有所差异,前者主要是果肉凝胶化和褐变,而后者则更多是促进了果实的成熟衰老进程,表现为快速软化和果皮转色。因此,通过深入比较这两个温度下甜柿的生理和分子代谢过程以揭示甜柿冷害的发生机制,以及甜柿在低温诱导的异常成熟和正常成熟的机制区别,这些也都有待于进一步探究。
4 结 论
与常温20 ℃相比,5 ℃、10 ℃和15 ℃低温条件加剧了甜柿的品质劣变,并造成不同程度的冷害,出现果肉褐变和胶凝化、软化以及抗氧化物质快速损耗问题,其中5 ℃和10 ℃贮藏组果实冷害最严重,15 ℃次之,果实安全贮藏期分别仅为9、15 和21 d;0 ℃显著抑制了果实的乙烯释放速率和呼吸强度,减缓了成熟衰老进程,推迟了果皮转色,减缓了硬度和可溶性固形物含量的损失,降低了H2O2的积累,维持了更高的细胞膜完整性和抗氧化物质含量,有利于保持更好的贮藏品质,且显著减缓了冷害的发生(相比于其他低温条件),安全贮藏时间长达27 d,是较适宜的贮藏温度。
[1] 裴忺,张青林,郭大勇,刘继红,罗正荣.完全甜柿遗传改良研究进展[J].果树学报,2015,32(2):313-321.PEI Xian,ZHANG Qinglin,GUO Dayong,LIU Jihong,LUO Zhengrong. Development of genetic improvement in Chinese PCNA persimmon[J].Journal of Fruit Science,2015,32(2):313-321.
[2] 罗正荣.国内外柿产业现状与发展趋势[J].落叶果树,2018,50(5):1-4.LUO Zhengrong. Status and development trend of persimmon industry in China and abroad[J]. Deciduous Fruits,2018,50(5):1-4.
[3] SATO A,YAMADA M. Persimmon breeding in Japan for pollination-constant non-astringent (PCNA) type with marker-assisted selection[J].Breeding Science,2016,66(1):60-68.
[4] ZHAO Q X,JIN M J,GUO L Y,PEI H H,NAN Y Y,RAO J P.Modified atmosphere packaging and 1-methylcyclopropene alleviate chilling injury of‘Youhou’sweet persimmon during cold storage[J].Food Packaging and Shelf Life,2020,24:100479.
[5] KIM Y M,PARK Y S,PARK Y K,HAM K S,KANG S G,SHAFREEN R M B,LAKSHMI S A,GORINSTEIN S.Characterization of bioactive ligands with antioxidant properties of kiwifruit and persimmon cultivars using in vitro and in silico studies[J].Applied Sciences,2020,10(12):4218.
[6] DIREITO R,ROCHA J,SEPODES B,EDUARDO-FIGUEIRA M. From Diospyros kaki L. (persimmon) phytochemical profile and health impact to new product perspectives and waste valorization[J].Nutrients,2021,13(9):3283.
[7] NASR F,RAZAVI F,RABIEI V,GOHARI G,ALI S,HANO C. Attenuation of chilling injury and improving antioxidant capacity of persimmon fruit by arginine application[J]. Foods,2022,11(16):2419.
[8] LIN S H,CHANG C K,LIN C T,GAVAHIAN M,LI P H,TSAI S Y,YUDHISTIRA B,HSIEH C W.Pulse electric field pretreatment delays the texture deterioration of sweet persimmon(Diospyros kaki L.) during postharvest storage[J]. LWT-Food Science and Technology,2024,191:115711.
[9] KOU J J,ZHAO Z H,WANG W J,WEI C Q,GUAN J F,FERENCE C. Comparative study of ripening related gene expression and postharvest physiological changes between astringent and nonastringent persimmon cultivars[J]. Journal of the American Society for Horticultural Science,2020,145(3):203-212.
[10] 赵倩兮,郭乐音,裴哗哗,吕燕荣,饶景萍.自发性气调包装对‘阳丰’甜柿贮藏期冷害及相关指标的影响[J].中国果树,2019(3):28-33.ZHAO Qianxi,GUO Leyin,PEI Huahua,LÜ Yanrong,RAO Jingping. Effects of modified atmosphere packaging on chilling injury and its correlation physiological indexes of‘Youhou’sweet persimmon during storage[J]. China Fruits,2019(3):28-33.
[11] JIAO X,DENG B,ZHANG L X,GAO Z F,FENG Z H,WANG R F. Melatonin and 1-methylcyclopropene improve the postharvest quality and antioxidant capacity of‘Youhou’sweet persimmons during cold storage[J]. International Journal of Fruit Science,2022,22(1):809-825.
[12] NOVILLO P,SALVADOR A,NAVARRO P,BESADA C. Involvement of the redox system in chilling injury and its alleviation by 1-methylcyclopropene in‘Rojo Brillante’persimmon[J].HortScience,2015,50(4):570-576.
[13] NAM H J,JE B I,LEE Y J. Effect of storage temperature on chilling injury of‘Cheongdobansi’,an astringent persimmon of Korea[J]. Horticulture,Environment,and Biotechnology,2023,64(6):987-1000.
[14] WOOLF A B,BALL S,SPOONER K J,LAY-YEE M,FERGUSON I B,WATKINS C B,GUNSON A,FORBES S K. Reduction of chilling injury in the sweet persimmon‘Fuyu’during storage by dry air heat treatments[J]. Postharvest Biology and Technology,1997,11(3):155-164.
[15] LI J Y,HAN Y,HU M,JIN M J,RAO J P. Oxalic acid and 1-methylcyclopropene alleviate chilling injury of‘Youhou’sweet persimmon during cold storage[J]. Postharvest Biology and Technology,2018,137:134-141.
[16] 于宛婷,王文辉,张鑫楠,阎维巍,孙晓楠,贾晓辉.外源褪黑素对玉露香梨常温贮藏品质和生理特性的影响[J].果树学报,2023,40(8):1583-1591.YU Wanting,WANG Wenhui,ZHANG Xinnan,YAN Weiwei,SUN Xiaonan,JIA Xiaohui. Effects of exogenous melatonin on fruit quality and physiological characteristics during room temperature storage in Yuluxiang pear[J]. Journal of Fruit Science,2023,40(8):1583-1591.
[17] LI D,WANG D,FANG Y D,BELWAL T,LI L,LIN X Y,XU Y Q,CHEN H J,ZHU M,LUO Z S.Involvement of energy metabolism and amino acid metabolism in quality attributes of postharvest Pleurotus eryngii treated with a novel phase change material[J]. Postharvest Biology and Technology,2021,173:111427.
[18] BAGHERI M,ESNA-ASHARI M. Effects of postharvest methyl jasmonate treatment on persimmon quality during cold storage[J].Scientia Horticulturae,2022,294:110756.
[19] NIAZI Z,RAZAVI F,KHADEMI O,AGHDAM M S. Exogenous application of hydrogen sulfide and γ-aminobutyric acid alleviates chilling injury and preserves quality of persimmon fruit(Diospyros kaki,cv.Karaj)during cold storage[J].Scientia Horticulturae,2021,285:110198.
[20] FAWOLE O A,ATUKURI J,ARENDSE E,OPARA U O. Postharvest physiological responses of pomegranate fruit (cv. Wonderful)to exogenous putrescine treatment and effects on physicochemical and phytochemical properties[J].Food Science and Human Wellness,2020,9(2):146-161.
[21] ORIHUEL-IRANZO B,MIRANDA M,ZACARÍAS L,LAFUENTE M T.Temperature and ultra low oxygen effects and involvement of ethylene in chilling injury of‘Rojo Brillante’persimmon fruit[J].Ciencia y Tecnologia de Los Alimentos Internacional,2010,16(2):159-167.
[22] COLLINS R J,TISDELL J G.Predicting the storability of Suruga persimmons[J].Postharvest Biology and Technology,1996,7(4):351-357.
[23] MACRAE E A. Development of chilling injury in New Zealand grown‘Fuyu’persimmon during storage[J]. New Zealand Journal of Experimental Agriculture,1987,15(3):333-344.
[24] ZHANG Z K,ZHANG Y,HUBER D J,RAO J P,SUN Y J,LI S S. Changes in prooxidant and antioxidant enzymes and reduction of chilling injury symptoms during low-temperature storage of‘Fuyu’persimmon treated with 1-methylcyclopropene[J].HortScience,2010,45(11):1713-1718.
[25] 郭雨萱,郝利平,卢银洁,李志刚.不同贮藏温度对茄子冷害发生及质构特性的影响[J].核农学报,2016,30(9):1763-1769.GUO Yuxuan,HAO Liping,LU Yinjie,LI Zhigang. Effect of different storage temperature on texture characteristics and chilling injury of eggplant[J].Journal of Nuclear Agricultural Sciences,2016,30(9):1763-1769.
[26] NING M,TANG F X,ZHANG Q,ZHAO X X,YANG L P,CAI W C,SHAN C H. The quality of Gold Queen Hami melons stored under different temperatures[J]. Scientia Horticulturae,2019,243:140-147.
[27] ZHU Y C,WANG K,WU C X,HAO Y T,ZHANG B,GRIERSON D,CHEN K S,XU C J.DNA hypermethylation associated with the development of temperature- dependent postharvest chilling injury in peach fruit[J]. Postharvest Biology and Technology,2021,181:111645.
[28] PAN Y G,JIANG Y,HUANG Q,ZHU Y,NIE Y D,YUAN R,ZHANG Z K.Abnormal chilling injury of postharvest Papaya is associated with the antioxidant response[J].Journal of Food Biochemistry,2022,46(10):e14272.
[29] ZHANG W L,ZHAO H D,JIANG H T,XU Y,CAO J K,JIANG W B. Multiple 1-MCP treatment more effectively alleviated postharvest nectarine chilling injury than conventional onetime 1-MCP treatment by regulating ROS and energy metabolism[J].Food Chemistry,2020,330:127256.
[30] TOSSI V,REGALADO J,MARTÍNEZ J,GALVÁN A,MARTINEZ TOSAR L,PITTA-ALVAREZ S I,REBOLLOSO M M,JAMILENA M. UV-B alleviates postharvest chilling injury of zucchini fruit associated with a reduction in oxidative stress[J].Postharvest Biology and Technology,2024,212:112850.
[31] ZHOU H W,BEN-ARIE R,LURIE S. Pectin esterase,polygalacturonase and gel formation in peach pectin fractions[J]. Phytochemistry,2000,55(3):191-195.
[32] BEN-ARIE R,LAVEE S. Pectic changes occurring in elberta peaches suffering from woolly breakdown[J]. Phytochemistry,1971,10(3):531-538.
[33] 秦琛强,李方束,傅娆,梅雅欣,彭郁,李茉,倪元颖,温馨.芝麻油脂体可食用膜的制备及其在草莓保鲜中的应用[J].食品科学,2024,45(7):243-251.QIN Chenqiang,LI Fangshu,FU Rao,MEI Yaxin,PENG Yu,LI Mo,NI Yuanying,WEN Xin.Preparation of edible film containing sesame oleosomes and its application in strawberry preservation[J].Food Science,2024,45(7):243-251.
[34] TESSMER M A,APPEZZATO-DA-GLÓRIA B,KLUGE R A.Evaluation of storage temperatures to astringency‘Giombo’persimmon:Storage at 1 ℃combined with 1-MCP is recommended to alleviate chilling injury[J]. Scientia Horticulturae,2019,257:108675.
[35] BESADA C,NOVILLO P,NAVARRO P,SALVADOR A. Effect of a low oxygen atmosphere combined with 1-MCP pretreatment on preserving the quality of‘Rojo Brillante’and‘Triumph’persimmon during cold storage[J]. Scientia Horticulturae,2014,179:51-58.
[36] KHADEMI O,BESADA C,MOSTOFI Y,SALVADOR A.Changes in pectin methylesterase,polygalacturonase,catalase and peroxidase activities associated with alleviation of chilling injury in persimmon by hot water and 1-MCP treatments[J].Scientia Horticulturae,2014,179:191-197.
[37] ZHU Q N,ZHANG K Y,CHEN W X,LI X P,ZHU X Y.Transcriptomic and metabolomic analyses reveal key factors regulating chilling stress-induced softening disorder in Papaya fruit[J].Postharvest Biology and Technology,2023,205:112534.
[38] TIAN J X,XIE S Y,ZHANG P,WANG Q,LI J K,XU X B.Attenuation of postharvest peel browning and chilling injury of banana fruit by Astragalus polysaccharides[J]. Postharvest Biology and Technology,2022,184:111783.
[39] RASTEGAR S,KHANKAHDANI H H,RAHIMZADEH M.Effects of melatonin treatment on the biochemical changes and antioxidant enzyme activity of mango fruit during storage[J]. Scientia Horticulturae,2020,259:108835.
[40] JIANG L,HAN Z H,LIU J L,XIANG Y,XU X B,JIANG Y M,JIANG G X,ZHANG Z K.Intermittent stepwise cooling and warming ameliorate chilling injury and improve quality in postharvest‘Guifei’mango fruit[J]. LWT-Food Science and Technology,2023,181:114740.
[41] MPHAHLELE R R,STANDER M A,FAWOLE O A,OPARA U L.Effect of fruit maturity and growing location on the postharvest contents of flavonoids,phenolic acids,vitamin C and antioxidant activity of pomegranate juice (cv. Wonderful)[J]. Scientia Horticulturae,2014,179:36-45.
[42] NASER F,RABIEI V,RAZAVI F,KHADEMI O. Effect of calcium lactate in combination with hot water treatment on the nutritional quality of persimmon fruit during cold storage[J].Scientia Horticulturae,2018,233:114-123.
[43] VERA-GUZMAN A M,LAFUENTE M T,AISPURO-HERNANDEZ E,VARGAS-ARISPURO I,MARTINEZ-TELLEZ M A. Pectic and galacturonic acid oligosaccharides on the postharvest performance of citrus fruits[J]. HortScience,2017,52(2):264-270.
[44] ZHANG T,CHE F B,ZHANG H,PAN Y,XU M Q,BAN Q Y,HAN Y,RAO J P. Effect of nitric oxide treatment on chilling injury,antioxidant enzymes and expression of the CmCBF1 and CmCBF3 genes in cold-stored Hami melon (Cucumis melo L.)fruit[J].Postharvest Biology and Technology,2017,127:88-98.