西瓜是中国重要的经济作物之一,但连年种植易导致西瓜枯萎病危害加剧,发病率显著升高,严重时超过50%[1]。西瓜枯萎病由尖孢镰孢菌西瓜专化型(Fusarium oxysporum f. sp. niveum,Fon)侵染引起,是典型的土传病害[2]。西瓜整个生育期都能发病,其中伸蔓期到结瓜期发病最严重。发病时,西瓜植株萎蔫,茎基部变褐,严重时整株枯死[3]。目前化学药剂防治效果不佳,因此开发具有抗菌活性的生防菌株对西瓜枯萎病的防治具有重要意义。
拮抗菌对西瓜枯萎病的抗病研究近年来有不少报道。枯草芽孢杆菌IBFCBF-4 盆栽条件下西瓜枯萎病的发病率下降51.1%[4];枯草芽孢杆菌YZUS149 可产嗜铁素、纤维素酶和蛋白酶,盆栽试验对西瓜枯萎病的防治效果达75.87%[5];枯草芽孢杆菌HBKYB-5 对西瓜枯萎病菌的抑菌率达56.82%,同时显著提高幼苗株高、茎粗、地上部与地下部鲜(干)质量、叶绿素含量及根系活力[6]。此外,芽孢杆菌XY-13 和荧光假单胞菌P4 组合能够提高西瓜枯萎病抗性,并促进西瓜幼苗生长,提高土壤有效性养分[7]。贝莱斯芽孢杆菌WB 株系能够诱导西瓜对枯萎病的系统抗性[8]。解淀粉芽孢杆菌DHA6 通过激发抗氧化酶活性从而产生对西瓜枯萎病的抗性,并且对西瓜幼苗具有明显的促生作用[9]。尽管铜绿假单胞菌作为生防菌已有不少研究报道[10-18],但其针对西瓜枯萎病的拮抗作用尚未见相关研究。
笔者从西瓜连作大棚根际土壤中筛选对西瓜枯萎病菌有优异拮抗性能的菌株,分析其抑菌作用,明确其对西瓜枯萎病菌的防病作用及对西瓜的生长促生效果,通过分子生物学鉴定其种类,并在此基础上分析其生物学特性、探究其可能的抗菌作用,以期为西瓜枯萎病的生物防治提供理论依据和技术基础。
1 材料和方法
1.1 材料
土样采集:从连作超过10 a(年)的西瓜塑料大棚中采集西瓜枯萎病发病植株的根际土壤。
供试西瓜品种:早佳8424。
病原菌:尖孢镰孢菌西瓜专化型(Fusarium oxysporum f.sp.niveum)生理小种Fon-1。
1.2 方法
1.2.1 病原菌的活化、根际土壤拮抗菌株分离及纯化 病原菌活化:取-80 ℃保存的Fon-1,置于马铃薯葡萄糖琼脂平板培养基(Potato Dextrose Agar,PDA)上,28 ℃培养。
菌株分离:土样过筛,用梯度稀释涂布法分别稀释至1×10-1、1×10-2、1×10-3、1×10-4、1×10-5、1×10-6、1×10-7,分别取100 μL 的1×10-3、1×10-4、1×10-5 的土壤稀释液均匀涂布于含有50 μg·mL-1重铬酸钾的高氏一号培养基平板、含(50 μg·mL-1)利福平的PDA培养基平板;将100 μL 1×10-5、1×10-6、1×10-7的土壤稀释液均匀涂布于NA 培养基上,28 ℃培养箱中倒置培养,随时观察挑出备用。
菌株的纯化:采用划线分离法纯化菌株,挑取固体平板培养基上不同颜色、形态的单菌落划线接种于NA培养基、高氏一号培养基、PDA培养基上重新培养,28 ℃培养至长出单菌落[19]。
1.2.2 拮抗菌株的筛选 拮抗菌株筛选:采用平皿对峙法,以Fon-1为靶标菌,将Fon-1菌饼(D=5 mm)接种在PDA平板中心,纯化后培养的菌液接种于靶标菌中心上下左右2.5 cm 处,以接种菌株Fon-1 菌饼为对照,每个处理3次重复。倒置培养在28 ℃培养箱中,待对照菌株生长至满皿时,挑选对Fon-1有显著抑菌效果菌株。
菌丝生长抑制率/%=(对照菌落半径-处理菌落半径)/(对照菌落半径-2.5 mm)×100[20]。
1.2.3 菌株K5 对西瓜枯萎病菌菌丝抑制作用及抑菌谱测定 菌株K5 对西瓜枯萎病菌菌丝皿内抑制效果:将Fon-1 置于PDA 平皿中心,在距靶标菌2.5 cm 处按照“十”字形接种拮抗菌,以单独接种Fon-1 为空白对照。在28 ℃培养箱中倒置培养,然后置于超深景显微镜下观察,记录菌丝特征。
抑菌谱测定:选取瓜类作物上常见的病原菌,按照上述方法进行K5的抑菌谱测定,每种病原菌5次重复,置于28 ℃培养箱中倒置培养,待对照长满培养皿后计算抑菌带宽。供试病原菌为瓜类腐皮镰孢菌(Fusarium. solani)、多主棒孢病菌(Corynespora.cassiicola)、轮枝镰孢菌(Fusarium verticillioides)、尖孢镰孢菌甜瓜专化型(Fusarium oxysporum f. sp.melonis,Fom)、甜瓜疫霉(Phytophthora melonis)、菜豆壳球孢(Macrophomina phaseolina)及瓜类炭疽病菌(Colletotrichum orbiculare)。
1.2.4 菌株K5对西瓜幼苗的温室防病、促生效果 培育西瓜幼苗,待长到两叶一心时,选择长势一致的西瓜幼苗采用蘸根法处理。每个处理30棵西瓜苗,3次重复。设置4个处理分别为(1)清水对照;(2)菌株K5悬浮液(OD600=1.0);(3)Fon-1培养液对照(浓度为1.0×107 CFU·mL-1);(4)菌株K5悬浮液(OD600=1.0)+Fon-1培养液对照(浓度为1.0×107 CFU·mL-1)。
接种处理后第7 天开始记录发病情况,当只接种Fon-1 培养液的植株发病率>50%时开始调查各个处理植株的发病情况、生物量,计算病情指数、发病率和相对防效等。病害分级参照文献[19]相关标准,共6 个等级,分别为:0 级,西瓜植株无任何发病症状;1级,西瓜植株整体生长良好,子叶边缘黄化、皱缩,茎基部轻微变黄;2级,西瓜植株子叶萎蔫,茎基部变黄褐,茎部良好,能直立生长;3级,西瓜植株子叶明显萎蔫,茎中度变褐萎蔫;4 级,西瓜植株严重萎蔫,子叶、茎明显萎蔫,茎部出现明显变褐症状;5 级,西瓜植株整株萎蔫、枯死或出苗晚,出苗后病死或长出菌丝。
病情指数=∑[(各发病等级×各个级别发病株数)/(植株总数×最高病级数)]×100。
防治效果/%=(对照病情指数-处理病情指数)/对照病情指数×100。
1.2.5 菌株K5 在不同培养基上的形态特征及生物学特性 参照东秀珠等[20]的方法对菌株K5 进行生物学特性鉴定,主要指标有:固氮能力、产蛋白酶能力、产纤维素酶能力、产氢氰酸(HCN)能力、产嗜铁素能力、分解有机磷能力、分解无机磷能力及产IAA能力。
1.2.6 菌株K5 分子生物学检测 使用天根生化科技(北京)有限公司生产的细菌基因组DNA 提取试剂盒提取菌株K5的基因组DNA,选用16S rDNA基因通用引物(27F:5'-AGAGTTTGATCMTGGCTCAG-3'/1492R:5'- GGTTACCTTGTTACGACTT-3')和rpob基因(rpob-F:5'-TGGCCGAGAACCAGTTCCGC-3'/rpob-R:5'-CGGCTTCGTCCAGCTTGTTC-3')进行PCR 扩增。PCR 反应体系:DNA 模板2.0 μL,2×Taq PCR Master Mix(诺唯赞P222-02)12.5 μL,10 μmol·L-1正反向引物各1.0 μL,加ddH2O至25 μL。PCR 反应条件:95 ℃3 min;95 ℃30 s;56 ℃30 s;72 ℃30 s(35个循环);72 ℃5 min。1%琼脂糖电泳检测,送生工生物工程(上海)股份有限公司测序。将测序结果与NCBI中GenBank数据库进行Blast比对分析,用MEGA 11 软件的N-J 法构建16S rDNA 与rpob基因序列的系统发育树。
1.2.7 菌株K5 抗生素合成基因分析、鉴定(1)引物设计。从菌株K5基因组中扩增抗生素2,4-DAPG合成基因、PCA 相关的phzCD 基因、吩嗪-1-甲酰胺(PCN)相关基因、硝吡咯菌素PRN相关基因及氢氰酸HCN 相关基因,参照已发表的相关引物序列[21](表1),并在生工生物工程(上海)股份有限公司合成。(2)抗生素合成基因的扩增与检测。以菌株K5基因组为模板,利用表1引物扩增相关基因。PCR扩增体系(25.0 μL)为:2×Taq PCR Master Mix 12.5 μL,10 μmol·L-1正反向引物各1.0 μL,DNA模板2.0 μL,补ddH2O 至25 μL。PCR 反应条件:95 ℃预变性3 min;95 ℃变性30 s;58 ℃退火30 s;72 ℃延伸40 s(95 ℃变性、58 ℃退火、72 ℃延伸共35 个循环);72 ℃延伸8 min[22]。随后用1%琼脂糖水平电泳检测,送公司测序。
表1 菌株pseudomonas aeruginasa K5 相关抗生素基因检测引物
Table 1 Primers for antibiotic gene detection related to pseudomonas aeruginasa K5

基因Gene DAPG片段大小Size/bp 745 PCA 1100 PCN 2000 PRN 786 HCN引物Primer PhlF PhlR PcaF PcaR PcnF PcnR PrnF PrnR HcnF HcnR序列(5´-3´)Sequence(5´-3´)GAGGACGTCGAAGACCACCA ACCGCAGCATCGTGTATGAG TGCCAAGCCTCGCTCCAAC CGCGTTGTTCCTCGTTCAT CGCACGGATCCTTTCAGAATGTTC GCCACGCCAAGCTTCACGCTCA CCACAAGCCCGGCCAGGAGC GAGAAGAGCGGGTCGATGAAGCC ACTGCCAGGGGCGGATGTGC ACGATGTGCTCGGCGTAC 587
1.2.8 数据处理 用Excel 和Graphpad prism 进行数据处理,进行t-test检测分析差异显著性。
2 结果与分析
2.1 土壤样品拮抗菌株的分离、筛选
利用梯度稀释法从连作10 多年的西瓜土壤中分离筛选菌株,通过平皿对峙获得部分对西瓜枯萎病菌抑制效果好的菌株(图1),笔者选取菌株K5深入研究。
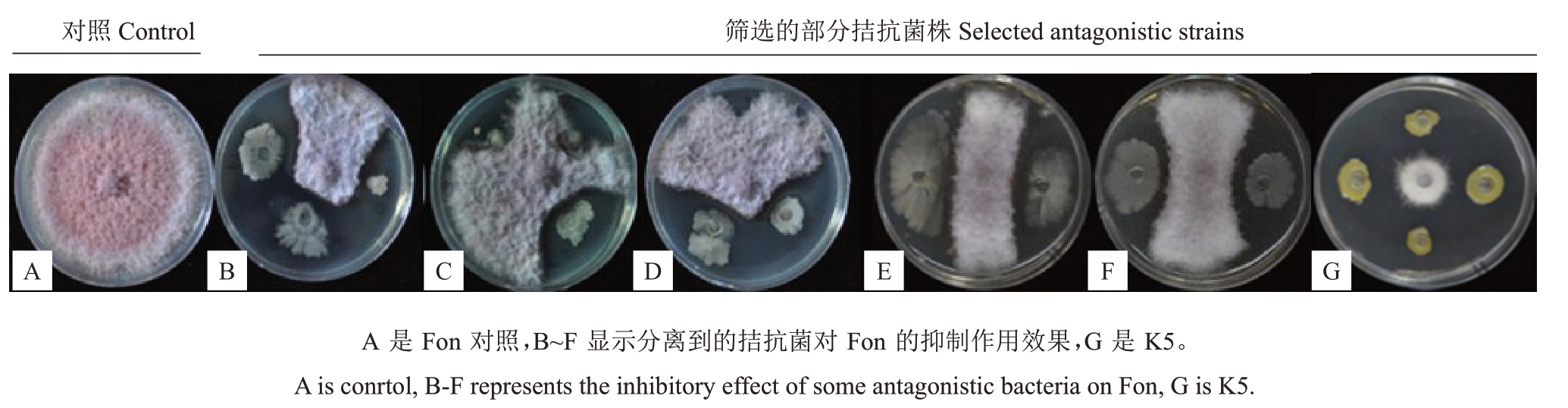
图1 部分分离菌株对西瓜枯萎菌的抑制作用
Fig.1 Inhibitory effects of selected strains on Fon
2.2 菌株K5的抑菌作用
2.2.1 菌株K5 对西瓜枯萎病菌的抑制作用 菌株K5对西瓜枯萎病菌的抑制作用明显(图2)。当Fon-1对照组平均半径为27.33 mm时(图2-A),K5对西瓜枯萎病菌的抑制平均半径仅约8.63 mm(图2-B),皿内抑制率达75.31%。
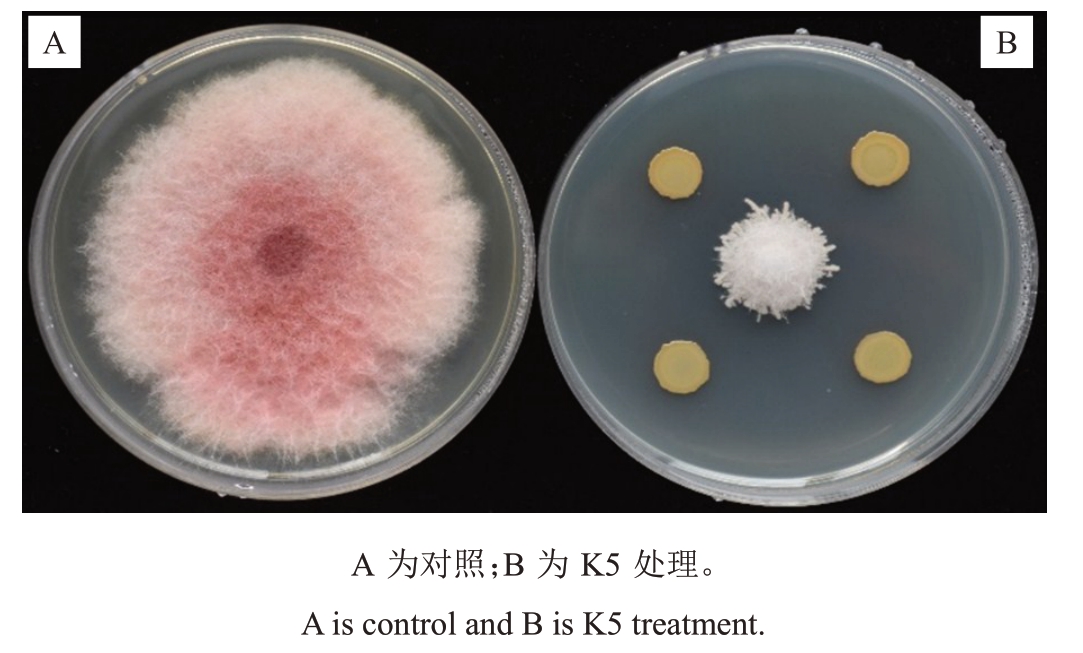
图2 菌株K5 对西瓜枯萎病菌抑制作用
Fig.2 Inhibitory effect of strain K5 on Fusarium wilt of watermelon
2.2.2 菌株K5 对西瓜枯萎病菌菌丝的影响 通过超景深三维立体显微镜观察菌丝形态,发现经K5拮抗处理的菌丝出现菌丝扭曲变形、某些部位菌丝会断裂或集结成团(图3-A),局部可见菌丝出现膨大、缢缩、变粗等畸形形态(图3-B)。对照组菌丝光滑、平直、整齐、有序、发散状生长、粗细均匀(图3-C~D)。对照菌丝直径平均值约3.57 μm,拮抗处理后菌丝直径平均值约5.49 μm。分析菌丝直径的差异发现K5 处理后的菌丝直径与对照组菌丝在p<0.000 1水平上差异显著(图3-E)。
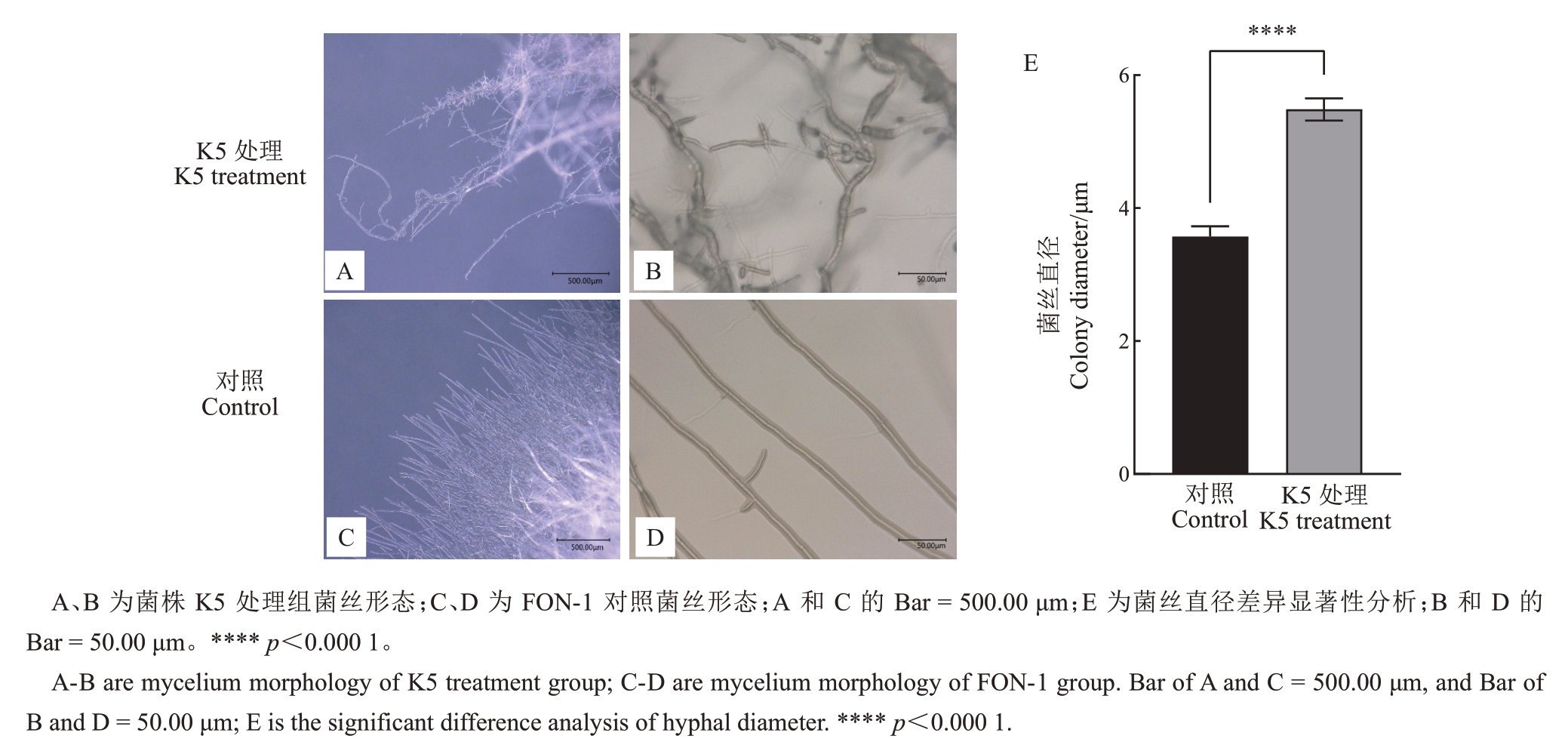
图3 K5 处理后西瓜枯萎病菌菌丝形态
Fig.3 Morphology of Fusarium wilt by K5 treatment in watermelon
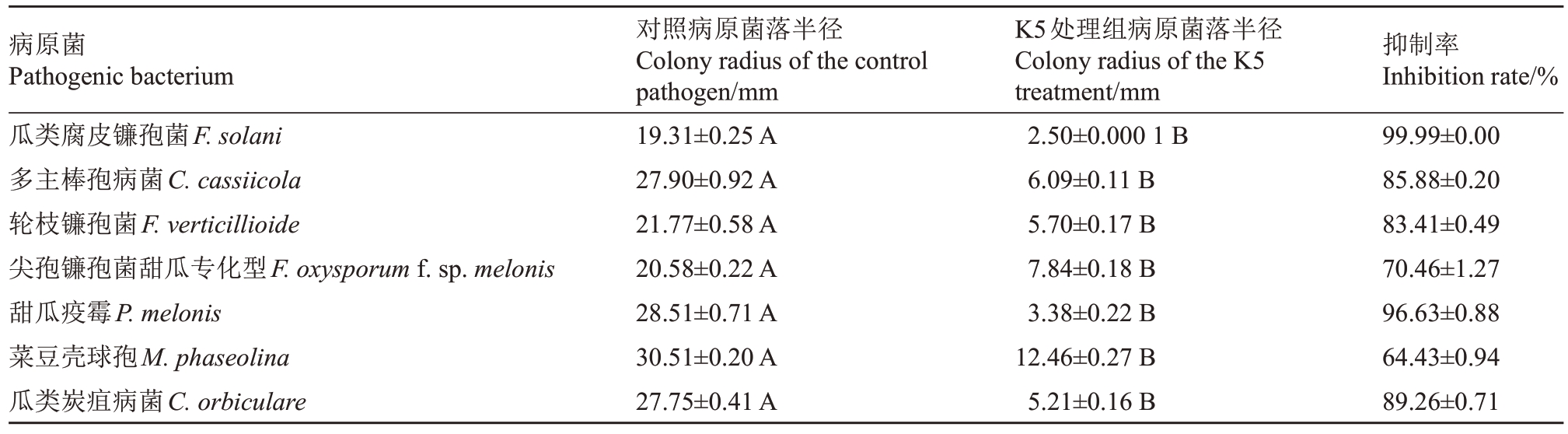
2.2.3 菌株K5抑菌谱 菌株K5对多种瓜类病原菌有明显的抑制作用(图4)。菌株K5 对瓜类腐皮镰孢菌(F. solani)皿内抑制率为99.99%、对多主棒孢病菌(C.cassiicola)皿内抑制率为85.88%、对轮枝镰孢菌(F.verticillioide)皿内抑制率为83.41%、对尖孢镰孢菌甜瓜专化型皿内抑制率为70.46%、对甜瓜疫霉(P.melonis)的皿内抑制率为96.63%、对菜豆壳球孢(M.phaseolina)皿内抑制率为64.43%、对瓜类炭疽病菌(C.orbiculare)皿内抑制率为89.26%(表2)。
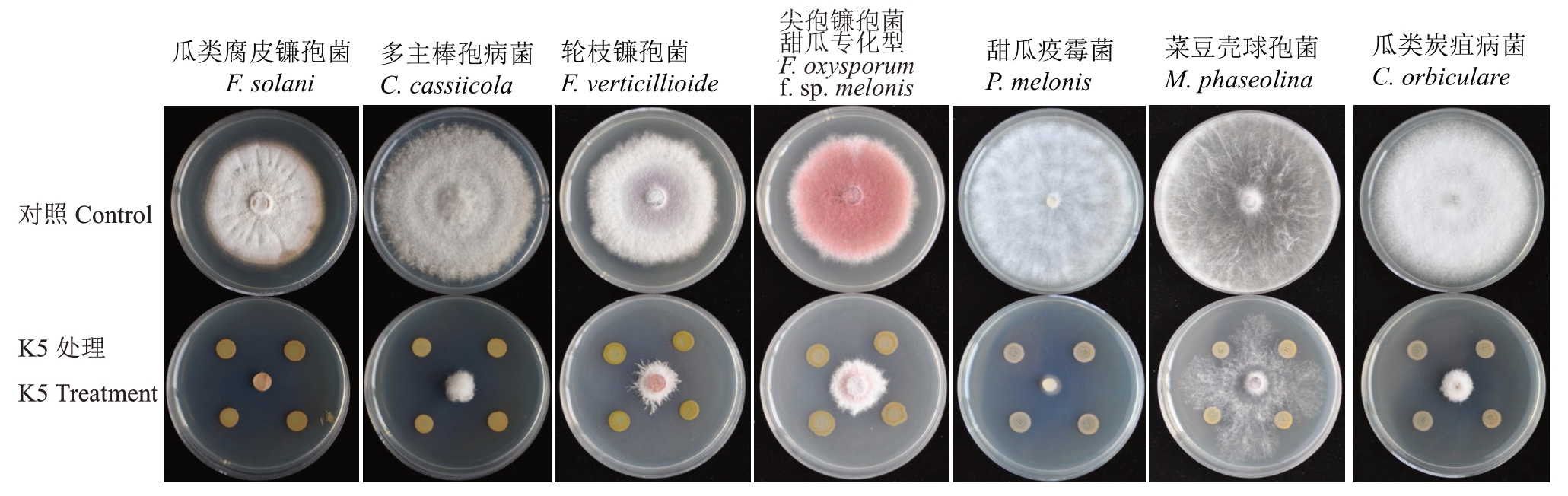
图4 K5 对多种瓜类病原菌的抑制作用
Fig.4 Inhibitory effects of K5 on a variety of pathogens
表2 菌株K5 对瓜类病原菌皿内的抑制率
Table 2 K5 in inhibition rate of pathogens in dish
注:不同大写字母表示在p<0.01 水平上差异极显著。
Note:Different capital letters indicates extremely significant differences at p<0.01.
病原菌Pathogenic bacterium瓜类腐皮镰孢菌F.solani多主棒孢病菌C.cassiicola轮枝镰孢菌F.verticillioide尖孢镰孢菌甜瓜专化型F.oxysporum f.sp.melonis甜瓜疫霉P.melonis菜豆壳球孢M.phaseolina瓜类炭疽病菌C.orbiculare对照病原菌落半径Colony radius of the control pathogen/mm 19.31±0.25 A 27.90±0.92 A 21.77±0.58 A 20.58±0.22 A 28.51±0.71 A 30.51±0.20 A 27.75±0.41 A K5处理组病原菌落半径Colony radius of the K5 treatment/mm 2.50±0.000 1 B 6.09±0.11 B 5.70±0.17 B 7.84±0.18 B 3.38±0.22 B 12.46±0.27 B 5.21±0.16 B抑制率Inhibition rate/%99.99±0.00 85.88±0.20 83.41±0.49 70.46±1.27 96.63±0.88 64.43±0.94 89.26±0.71
2.3 菌株K5对西瓜幼苗的防病与促生效果
2.3.1 菌株K5 对西瓜幼苗的防病效果 以枯萎病感病品种早佳8424 为试验品种,测定了菌株K5 对西瓜枯萎病的防病效果(图5)。Fon 处理的植株病情指数为38,而菌株K5+Fon 处理的西瓜幼苗的病情指数仅为8,防治效果达78.95%。

图5 温室盆栽试验菌株K5 对西瓜幼苗的防病效果
Fig.5 Disease control effect of strain K5 on watermelon seedlings in greenhouse pot experiment
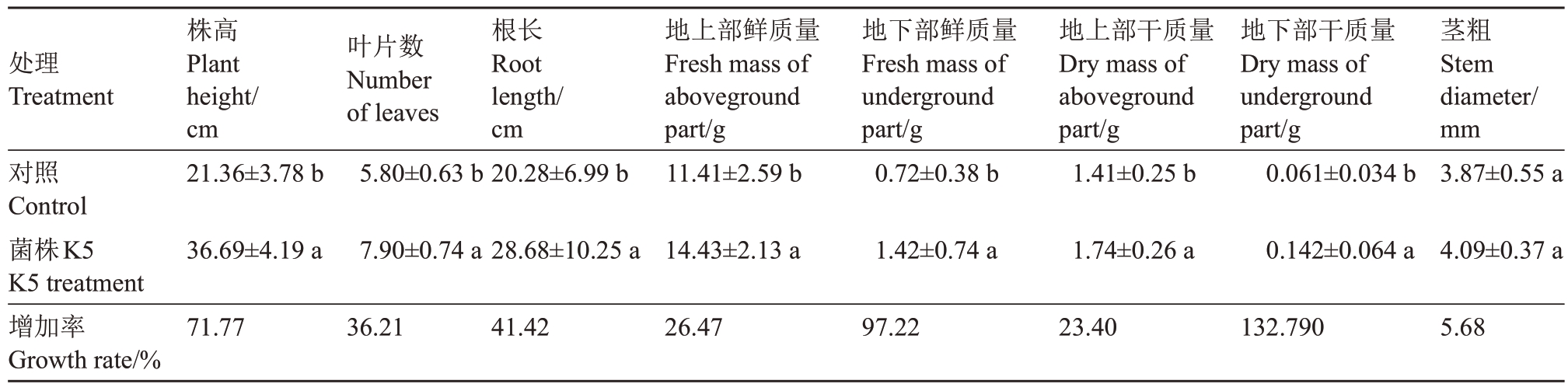
2.3.2 菌株K5 对西瓜植株的促生效果 菌株K5对西瓜幼苗的促生试验的结果显示K5 处理植株的高度明显高于对照植株(图6)。菌株K5 处理的西瓜幼苗的根长、地上部鲜质量、地下部鲜质量与对照相比在p<0.05水平上差异显著,地上部干质量和地下部干质量与对照相比在p<0.01 水平上差异显著;差异最为显著的是株高、叶片数,在p<0.0001水平上差异显著;而茎粗的比较发现K5处理和对照间差异不显著(表3)。株高、茎粗、叶片数、根长、地上部鲜质量、地下部鲜质量、地上部干质量、地下部干质量各项指标与对照相比分别增加71.77%、5.68%、36.21%、41.42%、26.47%、97.22%、23.40%、132.78%,表明菌株K5对西瓜幼苗促生作用明显。

图6 菌株K5 对西瓜植株的促生作用
Fig.6 Growth promotion effect of strain K5 on watermelon seedlings
表3 菌株K5 促生试验的西瓜生长指标
Table 3 Physiological indexes of watermelon in growth promotion test by strain K5
注:不同小写字母表示在p<0.05 水平上差异显著。
Note:Different small letters indicates significant differences at p<0.05.
处理Treatment 图6对照Control菌株K5 K5 treatment增加率Growth rate/%株高Plant height/cm 21.36±3.78 b叶片数Number of leaves 5.80±0.63 b根长Root length/cm 20.28±6.99 b地上部鲜质量Fresh mass of aboveground part/g 11.41±2.59 b地下部鲜质量Fresh mass of underground part/g 0.72±0.38 b地上部干质量Dry mass of aboveground part/g 1.41±0.25 b地下部干质量Dry mass of underground part/g 0.061±0.034 b茎粗Stem diameter/mm 3.87±0.55 a 36.69±4.19 a 7.90±0.74 a 28.68±10.25 a 14.43±2.13 a 1.42±0.74 a 1.74±0.26 a 0.142±0.064 a 4.09±0.37 a 71.7736.2141.4226.4797.2223.40132.7905.68
2.4 菌株K5分子生物学检测
将16S rDNA和rpob基因的测序结果与GenBank中已登录的核苷酸序列进行同源性比较,菌株K5 16S rDNA与铜绿假单胞菌(P.aeruginosa)(HQ537785.1、AB680318.1、AF094713.1、LC069033.1)的同源相似度均为100% ;rpob 基因与(P. aeruginosa,CP092846.1)的同源相似度为100%。利用MEGA 11软件构建菌株K5的16S rDNA(图7-A)和rpob基因(图7-B)的系统发育树分析表明,菌株K5与P.aeruginosa 聚为一个分支(图7),所以K5 被确定为Pseudomonas aeruginosa。

图7 基于16S rDNA 和rpob 基因序列构建K5 系统发育树
Fig.7 Phylogenetic trees of strain K5 based on 16S rDNA and rpob gene sequences

图8 菌株K5 的生物学特性Fig.8 Biological characteristics of strain K5
A.β-1-3 葡聚糖酶检测培养基;B.嗜铁素检测培养基;C.HCN 验证培养基;D.纤维素酶检测培养基;E. 解无机磷鉴定培养基;F.几丁质酶鉴定培养基;G.解有机磷鉴定培养基;H.固氮鉴定培养基。
A.β-1-3 glucanase assay medium;B.Ferriophilic test medium;C.HCN validation medium;D.Cellulase detection medium;E.Inorganic phosphorus solution identification medium;F.Chitinase identification medium;G.Organophosphorus hydrolysis identification medium;H.Nitrogen fixation identification medium.
2.5 菌株K5的生物学特征
菌株K5 在嗜铁素试验、固氮试验、解无机磷试验、几丁质利用试验、纤维素酶试验、β-1-3葡聚糖酶试验、HCN 试验中呈现阳性(图8)。该菌株可产生嗜铁素,有固氮、解无机磷的作用,具有纤维素酶、几丁质酶和β-1-3 葡聚糖酶的活性,不产生生长素、不具备解钾和解有机磷的能力(表4)。
表4 菌株K5 生物学特性检测结果
Table 4 Detection results of biological characteristics of
strain K5

注:“+”阳性,“-”阴性。
Note:“+”positive,“-”negative.
指标Indicators嗜铁素Siderophore生长素Auxin固氮Nitrogen fixation解无机磷Solubilization of inorganic phosphorus解有机磷Solubilization of organic phosphorus解钾Solubilization of potassium纤维素酶Cellulase几丁质酶Chitinase β-1-3葡聚糖酶β-1,3-glucanase氢氰酸Hydrogen cyanide结果Resuit+-++--++++
2.6 菌株K5抗菌物质合成相关基因的扩增
以菌株K5 的基因组为模板,可扩增出氢氰酸HCN(587 bp)、吩嗪-1-甲酰胺(PCN)(2000 bp)和硝吡咯菌素基因PRN(786 bp),但未扩增出吩嗪-1-羧酸(1100 bp)和2,4-二乙酰基间苯三酚(2,4-DAPG)(745 bp)相关基因(图9)。将扩增出的片段送样测序、比对测序结果与原始设计引物的模板基因一致性均在98%以上,表明扩增的基因片段为目的基因片段,说明该引物可以作为检测铜绿假单胞菌K5中4 种抗生素相关基因的特异引物。该结果说明K5菌株可产生氢氰酸、吩嗪-1-甲酰胺和硝吡咯菌素。
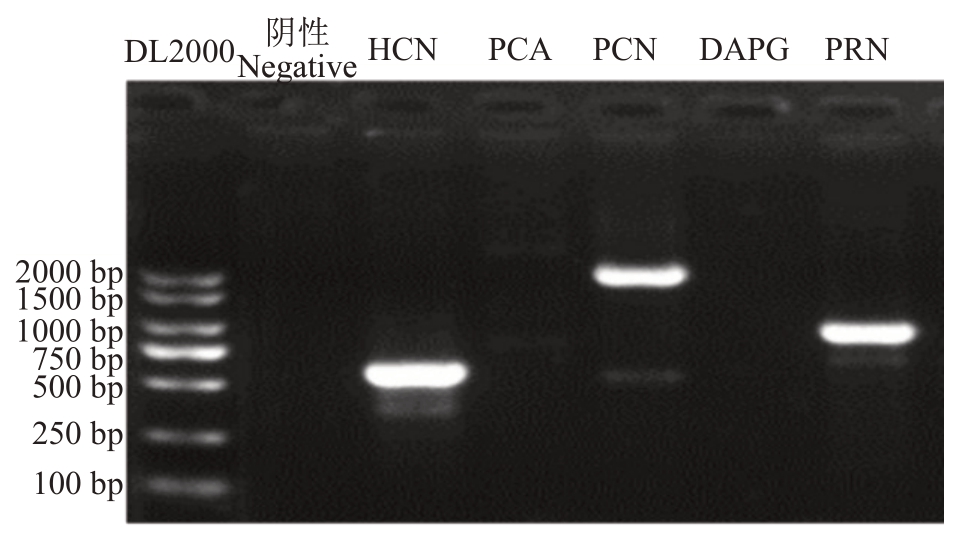
图9 菌株K5 基因PCR 产物1.0%琼脂糖凝胶电泳图
Fig.9 PCR detection of genes for biosynthesis of HCN,PCN and PRN in Pseudomonas aeruginosa strain K5
3 讨 论
西瓜一般在主产区连续多年栽培,所以普遍存在连作障碍现象[23]。连作后土壤中有益微生物种群数量减少,导致作物病害加重[24]。研究表明,土壤中有益微生物种群丰富且稳定是保障植物正常生长的重要条件[25]。自然界中生防微生物资源丰富且分布广泛,许多功能多样的有益微生物既可以抑制病原菌的生长和繁殖[26],还能产生多种次级代谢产物促进植物的生长。生防微生物及代谢产物防病、促生长、对环境友好且可以减弱病原菌抗性[27]。本研究从西瓜连作土壤里筛选到一株对西瓜枯萎病菌抑制作用明显的菌株(K5),基于16S rDNA 和rpob 基因序列系统进化分析发现该菌是铜绿假单胞菌菌株。
假单胞菌属的许多菌株不仅促生作用明显,且具有较好的防病效果[28]。菌株K5 与其他假单胞菌一样,也具有固氮、解无机磷的作用[29],其固氮能力可提高植物对氮源的吸收利用能力,促进植物生长[30]。菌株K5 明显的促生作用可能与产生这些物质相关。此外,K5 的抗病作用也很好,从其基因组中扩增出氢氰酸、吩嗪-1-甲酰胺和硝吡咯菌素三类抗菌物质基因,且从生物学特性发现该菌可产生氢氰酸物质。此外,假单胞菌主要产生酚嗪-1-羧酸、硝吡咯菌素、藤黄绿脓菌素和2,4-二乙酰基间苯三酚等[29],K5 和其他的假单胞菌相同,可能存在吩嗪-1-甲酰胺和硝吡咯菌素等抗菌物质的合成途径。假单胞菌产生嗜铁素、纤维素酶和蛋白酶等物质抑制病原菌的生长繁殖[31],K5 亦可产生嗜铁素,具有纤维素酶、几丁质酶和β-1-3葡聚糖酶的活性;蛋白酶、纤维素酶、嗜铁素和HCN可单独或复合抑制病原菌的扩展[32],诱导植物激活免疫应答反应[33]。推测这些酶或许可破坏菌丝的结构,使菌丝不能更好地侵染,从而起到防治病害的作用。这种基于酶解作用的抗真菌机制,在分子水平上揭示了K5菌株通过干扰病原菌形态建成过程实现生物防治。
生防菌成为潜在菌肥资源的重要前提是具有较好的拮抗效果。铜绿假单胞菌M18 可抑制甜瓜蔓枯病菌生长[34],且该菌浸泡黄瓜种子以及灌根试验中,使黄瓜枯萎病的病害发生率降低70%~80%[35]。铜绿假单胞菌Bc1-20促进甜瓜生长,且对甜瓜幼苗枯萎病的相对防治效果为52.34%[11]。相较之下,K5对西瓜幼苗枯萎病的盆栽防治效果可达78.95%。此外,菌株K5 对西瓜幼苗的促生效果显著,其处理使株高、茎粗、叶片数、根长、地上部鲜(干)质量及地下部鲜(干)质量等各指标显著升高,尤其在地下部生物量积累方面表现突出。结合K5 对多种瓜类病原菌的广谱抑菌活性,其展现出开发为复合生物菌剂的潜力。后续需进一步验证其田间防效,并深入解析其对枯萎病菌的分子防控机制,以推动西瓜枯萎病的精准防控策略构建。
4 结 论
本研究筛选出1株对西瓜枯萎病菌具有显著拮抗作用的铜绿假单胞菌菌株(K5)。该菌株可导致病原菌菌丝畸形膨大、扭曲,具有明显的促生和防病作用,且具有多种生物学特性,是一株极具开发潜力的生防菌剂候选菌株,为构建基于拮抗微生物的植物病害生物防治技术体系提供了理论依据。
[1] 陈燕萍,刘欣,肖荣凤,朱育菁,刘波.西瓜枯萎病田间调查及其病原菌鉴定[J].福建农业科技,2020,51(8):32-37.CHEN Yanping,LIU Xin,XIAO Rongfeng,ZHU Yujing,LIU Bo. Field investigation and pathogen identification of watermelon Fusarium wilt[J]. Fujian Agricultural Science and Technology,2020,51(8):32-37.
[2] LV H F,LU J Y,HUANG Y,WANG M X,YAN C S,BIE Z L.Priming watermelon resistance by activating physiological response and defense gene expression to alleviate Fusarium wilt in wheat-watermelon intercropping[J]. Horticulturae,2023,9(1):27.
[3] 甄银伟. 西瓜枯萎病的发病特征、发病原因及综合防治措施[J].乡村科技,2021,12(22):64-66.ZHEN Yinwei. Characteristics,causes,and integrated control measures of watermelon fusarium wilt[J]. Rural Science and Technology,2021,12(22):64-66.
[4] ZHU J X,TAN T M,SHEN A R,YANG X B,YU Y T,GAO C S,LI Z M,CHENG Y,CHEN J,GUO L T,SUN X P,YAN Z,LI J L,ZENG L B.Biocontrol potential of Bacillus subtilis IBFCBF-4 against Fusarium wilt of watermelon[J].Journal of Plant Pathology,2020,102(2):433-441.
[5] 孙正祥,龙欣钰,孟祥佳,曹帅,毛国庆,周燚.枯草芽孢杆菌YZU-S149 的分离鉴定及对西瓜枯萎病的生防作用[J].长江大学学报(自然科学版),2021,18(4):114-120.SUN Zhengxiang,LONG Xinyu,MENG Xiangjia,CAO Shuai,MAO Guoqing,ZHOU Yi. Isolation and identification of Bacillus subtilis YZU-S149 and its biocontrol effect on watermelon Fusarium wilt[J]. Journal of Yangtze University (Natural Science Edition),2021,18(4):114-120.
[6] 崔梦娇,杨洋,李敬蕊,吴晓蕾,宫彬彬,高洪波,吕桂云.生防菌复合基质对西瓜幼苗的促生作用及枯萎病的防治效果[J].河北农业大学学报,2022,45(6):88-93.CUI Mengjiao,YANG Yang,LI Jingrui,WU Xiaolei,GONG Binbin,GAO Hongbo,LÜ Guiyun. Effects of compound substrate with biocontrol bacteria on watermelon seedling growth and Fusarium wilt control[J].Journal of Hebei Agricultural University,2022,45(6):88-93.
[7] YANG D Y,ZHANG X Q,LI Z X,CHU R,SHAH S,WANG X Z,ZHANG X Y.Antagonistic effect of Bacillus and Pseudomonas combinations against Fusarium oxysporum and their effect on disease resistance and growth promotion in watermelon[J].Journal of Applied Microbiology,2024,135(5):lxae074.
[8] CHEN Z N,WANG Z G,XU W H. Bacillus velezensis WB induces systemic resistance in watermelon against Fusarium wilt[J].Pest Management Science,2024,80(3):1423-1434.
[9] AL-MUTAR D M K,NOMAN M,ALZAWAR N S A,AZIZULLAH,LI D Y,SONG F M.Cyclic lipopeptides of Bacillus amyloliquefaciens DHA6 are the determinants to suppress watermelon Fusarium wilt by direct antifungal activity and host defense modulation[J].Journal of Fungi,2023,9(6):687.
[10] 许煜泉,祝新德,王灿华,张雁,郑有丽.具有促进生长和抗病原真菌的根际假单胞菌株M18[C]//中国科学技术协会,浙江省人民政府. 面向21 世纪的科技进步与社会经济发展(下册).上海:上海交通大学生命科学技术学院,1999:50.XU Yuquan,ZHU Xinde,WANG Canhua,ZHANG Yan,ZHENG Youli. Rhizospheric Pseudomonas Strain M18 with Growth-Promoting and Antifungal Activities Against Pathogenic Fungi[C]//China Association for Science and Technology,Zhejiang Provincial People’s Government. Science and Technology Progress and Social Economic Development Towards the 21st Century (Volume Ⅱ). Shanghai:Shanghai Jiao Tong University College of Life Science and Technology,1999:50.
[11] 郝晓娟,刘波,谢关林,肖荣凤,陈璐.铜绿假单胞菌FJAT-346对番茄枯萎病的生防作用[J].山西农业大学学报(自然科学版),2011,31(1):39-43.HAO Xiaojuan,LIU Bo,XIE Guanlin,XIAO Rongfeng,CHEN Lu. Biocontrol effect against tomato Fusarium wilt of Pseudomonas aeruginosa strain FJAT-346[J].Journal of Shanxi Agricultural University(Natural Science Edition),2011,31(1):39-43.
[12] 张晓宇. 黄金梨采后病害生防菌的分离筛选及抗菌蛋白研究[D].太谷:山西农业大学,2014.ZHANG Xiaoyu. Study on isolating,screening and actibiotic protein of biological controlling bacteria against gold pear for postharvest disease[D]. Taigu:Shanxi Agricultural University,2014.
[13] 舒芳玲,李凤芳,黎起秦,袁高庆,林纬.番茄立枯病生防菌株B11-64 的鉴定及其生防特性[J].湖南农业科学,2022(11):55-59.SHU Fangling,LI Fengfang,LI Qiqin,YUAN Gaoqing,LIN Wei. Identification of strain B11-64 and its biocontrol characteristics against tomato Rhizoctonia rot[J]. Hunan Agricultural Sciences,2022(11):55-59.
[14] 魏靖宇,韩雨桐,翟文旭,卫勇,李宝通,刘慧芹.黄瓜土传病害拮抗细菌的筛选、鉴定及生防特性研究[J].中国生物防治学报,2022,38(6):1582-1591.WEI Jingyu,HAN Yutong,ZHAI Wenxu,WEI Yong,LI Baotong,LIU Huiqin. Screening,identification and biocontrol characteristics of antagonistic bacteria against cucumber soil-borne diseases[J]. Chinese Journal of Biological Control,2022,38(6):1582-1591.
[15] 郝芳敏,董文杰,臧全宇,马二磊,丁伟红,王毓洪.一株甜瓜枯萎病拮抗菌的筛选、鉴定及生防效果[J]. 中国瓜菜,2023,36(12):26-32.HAO Fangmin,DONG Wenjie,ZANG Quanyu,MA Erlei,DING Weihong,WANG Yuhong. Screening,identification and biocontrol effect of antagonistic bacteria against melon Fusarium wilt[J].China Cucurbits and Vegetables,2023,36(12):26-32.
[16] 杨德伟,施春兰,解紫薇,秦小萍,秦得强,高熹,顾小飞,谢永辉,吴国星.铜绿假单胞菌HZ15 的生物活性[J/OL].微生物学通报,2025:1-23.(2024-08-30).https://doi.org/10.13344/j.microbiol.china.240612.YANG Dewei,SHI Chunlan,XIE Ziwei,QIN Xiaoping,QIN Deqiang,GAO Xi,GU Xiaofei,XIE Yonghui,WU Guoxing.Bioactivities of Pseudomonas aeruginosa HZ15[J/OL].Microbiology China,2025:1-23.(2024-08-30).https://doi.org/10.13344/j.microbiol.china.240612.
[17] 程亮亮,叶磊,王文凯,唐建林,檀根甲. 小麦纹枯病拮抗菌HB-10 的筛选及其发酵条件优化[J]. 中国生物防治学报,2024,40(2):435-447.CHENG Liangliang,YE Lei,WANG Wenkai,TANG Jianlin,TAN Genjia. Screening of antagonistic bacterium HB- 10 against wheat sheath blight and optimization of fermentation conditions[J]. Chinese Journal of Biological Control,2024,40(2):435-447.
[18] 李慧,郑肖兰,侯会霞,吴伟怀,谭施北,罗磊,吴昊,易克贤.铜绿假单胞菌PaHNHK01 的鉴定及其对剑麻烟草疫霉的生防效果研究[J].热带作物学报,2024,45(10):2171-2182.LI Hui,ZHENG Xiaolan,HOU Huixia,WU Weihuai,TAN Shibei,LUO Lei,WU Hao,YI Kexian. Identification and biocontrol of Pseudomonas aeruginosa Pa HNHK01 against sisal Zebra disease[J].Chinese Journal of Tropical Crops,2024,45(10):2171-2182.
[19] 牛红杰.黄瓜枯萎病生防放线菌的分离筛选及其发酵工艺研究[D].北京:中国农业科学院,2019.NIU Hongjie. Isolation,screening,and fermentation of antagonistic actinomycetes to suppress cucumber Fusarium wilt[D].Beijing:Chinese Academy of Agricultural Sciences,2019.
[20] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.DONG Xiuzhu,CAI Miaoying. Manual of Systematic Identification of Common Bacteria[M].Beijing:Science Press,2001.
[21] 王超男. 拮抗细菌的筛选鉴定及其环脂肽合成相关基因检测[D].北京:北京农学院,2016.WANG Chaonan. Screening and identification of antagonistic bacteria and detecting the genes related to cyclie lipopeptides biosynthesis[D]. Beijing:Beijing University of Agriculture,2016.
[22] 徐伟慧,王恒煦,赵井明,王志刚,王可昕.西瓜枯萎病拮抗菌筛选及其拮抗性能研究[J].农业生物技术学报,2019,27(12):2238-2247.XU Weihui,WANG Hengxu,ZHAO Jingming,WANG Zhigang,WANG Kexin. Screening of antagonistic bacteria against Fusarium wilt of watermelon (Citrullus lanatus) and its antagonistic properties[J]. Journal of Agricultural Biotechnology,2019,27(12):2238-2247.
[23] 张曼,郝科星,张焕,侯东颖,侯富恩,张涛.设施西瓜连作障碍治理措施对比[J].山西农业科学,2022,50(9):1353-1358.ZHANG Man,HAO Kexing,ZHANG Huan,HOU Dongying,HOU Fuen,ZHANG Tao.Comparison of management measures of continuous cropping obstacle of facility watermelons[J].Journal of Shanxi Agricultural Sciences,2022,50(9):1353-1358.
[24] 朱绍坤,赵文东,孙凌俊,高圣华,马丽,赵海亮.连作障碍及缓解措施研究进展[J].北方果树,2018(4):1-3.ZHU Shaokun,ZHAO Wendong,SUN Lingjun,GAO Shenghua,MA Li,ZHAO Hailiang. Advances in alleviating the replant problem[J].Northern Fruits,2018(4):1-3.
[25] ZHANG H,HUA Z W,LIANG W Z,NIU Q H,WANG X.The prevention of bio-organic fertilizer fermented from cow manure compost by Bacillus sp. XG-1 on watermelon continuous cropping barrier[J]. International Journal of Environmental Research and Public Health,2020,17(16):5714.
[26] 张绍丽,黄磊,王友平,张禄祺,常培培,李华,韩梅梅,张自坤.西瓜枯萎病生防菌研究进展[J].长江蔬菜,2022(16):27-31.ZHANG Shaoli,HUANG Lei,WANG Youping,ZHANG Luqi,CHANG Peipei,LI Hua,HAN Meimei,ZHANG Zikun. Research progresses on biocontrol bacteria of watermelon Fusarium wilt[J].Journal of Changjiang Vegetables,2022(16):27-31.
[27] 任迁琪.西瓜枯萎病拮抗菌分离纯化鉴定及生物防治[D].南京:南京信息工程大学,2016.REN Qianqi. Isolation purification and identification of antagonistic microbes and biological control against fusarium wilt of watermelon[D].Nanjing:Nanjing University of Information Science&Technology,2016.
[28] 李芮.解淀粉芽孢杆菌41B-1、铜绿假单胞菌841P-3 对棉花根围土壤微生物群落结构的影响[D]. 南京:南京农业大学,2013.LI Rui. Effect of Bacillus amyloliquefaciens 41B-1 and Pseudomonas aeruginosa 841P-3 on soil microbial community in cotton rhizosphere[D]. Nanjing:Nanjing Agricultural University,2013.
[29] KHAN M S,GAO J L,ZHANG M F,XUE J,ZHANG X H.Pseudomonas aeruginosa Ld-08 isolated from Lilium davidii exhibits antifungal and growth- promoting properties[J]. PLoS One,2022,17(6):e0269640.
[30] 赵烨.西瓜根际促生菌株的筛选及抗病促生效果的研究[D].合肥:安徽农业大学,2013.ZHAO Ye. Isolation and characterization of watermelon-associated PGPRs and their potential for growth promotion and disease suppression[D].Hefei:Anhui Agricultural University,2013.
[31] 高芸.生防芽孢杆菌及假单胞菌拮抗植物微生物病害研究进展[J].北方园艺,2021(2):131-136.GAO Yun. Research progress in biocontrol of plant microbial diseases by Bacillus and Pseudomonas[J]. Northern Horticulture,2021(2):131-136.
[32] 魏雪.根际铜绿假单胞菌M18 中GacA 对次级代谢、初级代谢、分泌系统及运动性的全局性调控[D]. 上海:上海交通大学,2013.WEI Xue.Global regulation of GacA on secondary metabolism,primary metabolism,secretion systems and motility in rhizospheric Pseudomonas aeruginosa M18[D]. Shanghai:Shanghai Jiao Tong University,2013.
[33] 左静,廖晓兰.应用假单胞菌防治植物真菌性病害研究进展[J].现代农业科技,2011(22):164-165.ZUO Jing,LIAO Xiaolan.Study progress on plant fungal diseases prevention by Pseudomonas spp.[J].Modern Agricultural Science and Technology,2011(22):164-165.
[34] 许煜泉,唐玮宁,郑有丽,钟仲贤,徐悌惟. 筛选假单胞菌株M18 防治大棚黄瓜枯萎病害[J].上海交通大学学报,1999,33(2):210-213.XU Yuquan,TANG Weining,ZHENG Youli,ZHONG Zhongxian,XU Tiwei.Screening of Pseudomonas M18 and its biological control of cucumber wilt disease under commercial greenhouse[J].Journal of Shanghai Jiao Tong University,1999,33(2):210-213.
[35] WU D Q,LI Y Q,XU Y Q. Comparative analysis of temperature- dependent transcriptome of Pseudomonas aeruginosa strains from rhizosphere and human habitats[J].Applied Microbiology and Biotechnology,2012,96(4):1007-1019.