杧果(Mangifera indica L.)是漆树科杧果属果树,以果肉鲜美、风味独特而享有“热带果王”的美誉。目前,中国是杧果的主产国之一,产量位居世界第三[1-2]。中国常见的栽培品种有贵妃、台农一号、金煌芒、澳芒等[3],台农一号因优良的品质、高产性和较强的适应性在中国得到了广泛的推广和种植[4],并且该品种因果形均匀,且色、香、味俱佳成为杧果内销量最佳的品种。杧果是典型的呼吸跃变型果实,采收后要经历后熟才能达到商品性状,科学的催熟方式对提高杧果品质和延长货架期至关重要。乙烯利(ETH)催熟是采后处理中最常见的方法,例如1.2 g·L-1外源ETH处理显著促进杧果成熟[5],0.2 g·L-1外源ETH促进香蕉成熟的效果最好[6]。外源ETH通过诱导内源乙烯生成从而达到快速启动成熟过程的效果,经历后熟之后果实变黄、变软,商品价值迅速降低,采后易腐烂变质已成为制约杧果产业发展及采后贮藏保鲜的重要因素[7]。
果实质地作为衡量果实品质的核心指标之一,其变化特征直接影响消费者的食用体验与市场接受度。采后果实质地变化包括软化、木质化和自溶等,其中软化是大多数肉质果实常见的质地变化。随着果实成熟进程的推进,多种细胞壁水解酶活性显著增强,使得细胞壁结构和聚合物分子质量发生显著改变:纤维素分子链发生断裂导致链长缩短,半纤维素聚合度明显降低,而最突出的结构变化体现在细胞壁中层中的原果胶在水解酶的作用下逐步解聚为可溶性果胶及果胶酸,致使相邻细胞间黏附作用减弱,最终导致细胞分离和组织软化,这一系列过程受到一系列细胞壁水解酶的协同调控,例如:果胶甲酯酶(pectin methylesterase,PME)、果胶裂解酶(pectate lyase,PL)、多聚半乳糖醛酸酶(polygalacturonase,PG)、β-半乳糖苷酶(β-galactosidase,β-Gal)、纤维素酶(cellulase,CX)[8-11]。Wolf 等[12]和张清凤[13]研究表明,PME可以使果胶的主要成分聚半乳糖醛酸聚糖(HG)去甲基酯化,进而使PL 和PG 发挥作用,同时还可以激活CX 酶活性,共同促进了细胞壁的降解。Cai等[14]的研究表明抑制草莓果实中PME酶活性可以延缓果实的软化。王倩等[15]研究结果表明番茄在贮藏第9天PG酶活性达到最高,是番茄果实软化的关键酶。随着可视化技术的发展,Huang等[16]采用了共焦拉曼显微镜(CRM)、傅里叶变换红外显微镜(FTIRM)和受激拉曼散射显微术(SRS)3种方法对呼吸跃变型果实水蜜桃的细胞壁成分变化情况进行可视化观测,为细胞壁对果实软化的影响提供了更直观的认识。
目前,国内采后保鲜从1-MCP处理、温度调节、辐射处理、涂膜保鲜等多方面开展了研究,近年来对于植物激素的研究也逐渐得到广泛关注,大量研究结果表明外源激素处理具有调节采后果实品质的作用。茉莉酸甲酯(methyl Jasmonate,MeJA)已被证明是一种广泛存在于植物中的内生激素,能在植物种子萌发、开花及果实成熟等多种发育过程中发挥作用,例如:金欢淳等[17]研究表明,100 mg·L-1 MeJA能够显著改善葡萄果穗着色情况,高伟等[18]研究表明,10 mmol·L-1 MeJA 处理麝香葡萄果实可以使葡萄酒中香气物质含量大幅度提高,唐伟杰等[19]研究表明,10 μmol·L-1 MeJA 处理金冠苹果的保鲜效果更佳,而1500 μmol·L-1 MeJA 处理则加速果实的成熟与衰老。Han等[20]研究结果表明,MeJA处理与草莓色素代谢、糖代谢、果实软化和激素代谢相关基因的表达上调以及JA、花青素和糖含量的增加有关。Min等[21]研究结果表明,MeJA处理通过诱导与脂氧合酶途径和乙烯生物合成相关酶的活性来保持番茄采后的品质。
MeJA 作为植物生长调节剂具有无毒无害、广谱等优点,已经在苹果[22]、李[23]、石榴[24]、猕猴桃[25]、蓝莓[26]等多种园艺作物上开展了茉莉酸甲酯的应用研究,但MeJA对杧果的作用机制尚不明确,所以笔者在本试验中通过测定MeJA处理后色泽、硬度、酶活性、质构等生理生化指标和基因表达水平的变化,探究MeJA 对采后杧果果实成熟软化的影响,为解决乙烯处理后快速腐烂的问题提供参考,为MeJA 在采后杧果贮藏中的应用提供理论支持。
1 材料和方法
1.1 供试材料和采后处理
供试杧果品种为台农一号,2024 年3 月9 日采摘于海南省三亚市崖州区保平村杧果种植园,成熟度大约为八成熟(花后120 d),在实验室筛选去除病果、伤果,剪去果柄后用0.1%的氯消净清洗并浸泡20 min以去除残留的果胶和病菌,晾干后随机分为5组。处理组为0.5、1、2 mmol·L-1浓度的茉莉酸甲酯分别浸泡5 min并晾干后的杧果,之后密封于塑料桶中20 h取出。清水对照组用清水浸泡5 min,其余操作均一致。ETH组用0.5 g·L-1乙烯利溶液浸泡5 min,其余操作均一致。将处理后的杧果装入保鲜袋贮藏在20 ℃恒温箱中,自处理日起3 d取样1次,液氮处理后存放在-80 ℃冰箱用于后续的指标测定。
1.2 试验方法
试验一共设置5 个处理,每组设置20 个杧果用来观察表型,每组每隔3 d取样10个杧果充分混匀,用于测定指标和后续转录组送测(果肉果皮分别取样),每组测定乙烯释放率9个,测定色泽6个,共计530个杧果左右。
色度值使用经校正的色差计(日本)进行测定。测试时,沿着杧果横向的最大周长位置,对其正面和反面分别进行测量,并记录下a*、b*值。
采用英国制造的TA-XT2i质构分析仪对杧果的硬度、咀嚼性、回复性、脆度以及黏聚性等关键质构特性进行评估。每组随机选取3 个杧果作为样品,测定前轻轻削去杧果正面与反面中央区域约0.1 cm厚的表皮(每次削去的厚度保持一致),将处理好的杧果稳固地安置在质构分析仪的测试平台上,使用2 mm直径的探针进行测定(深入果肉0.5 cm),整个过程需手动扶持杧果以确保稳定,记录仪器显示此过程测定的质构数据。
可溶性固形物含量使用ATAGO PAL-1(日本)测定,每组随机称取2 g 处理好的果肉放置于纱布内,通过用力挤压的方式提取出其中的汁液,每组设置3次重复。
乙烯释放率使用Thermo Scientific 公司的Trace1300 型气相色谱系统测定。每组随机挑选3个杧果放置在2 L 的烧杯内,杯口用保鲜膜密封,25 ℃下静置2 h 以充分释放乙烯气体,使用注射器抽取1 mL 的杯内气体立即注入气相色谱仪中进行检测,每组3个重复。
PG、CX 活性及叶绿素含量参照曹建康等[27]的方法测定,PME、PL、原果胶含量和可溶性果胶含量使用试剂盒(苏州格锐思生物科技有限公司)进行测定,称取杧果果肉质量均与试剂盒要求一致。
1.3 细胞壁代谢途径中关键基因表达分析
采用CTAB法提取杧果果肉总RNA和1%琼脂糖凝胶电泳检测RNA 质量,随后用Monad 公司MonScript™RTIII All-in-One Mix with dsDNase试剂盒进行反转录,合成cDNA。使用吐露港公司的22204 2×Q3 SYBR qPCR Master Mix(Universal)试剂盒进行PCR 反应。引物序列见表1。采用2-△△Ct方法计算细胞壁代谢途径中关键基因的相对表达量,每个基因设置3次重复。
表1 实时荧光定量RT-PCR 引物
Table 1 Primer for quantitative real-time PCR

基因名称Gene name LOC123195233(MiPME1)LOC123194324(MiPME2)LOC123216510(MiPL1)LOC123215676(MiPL2)LOC123197587(MiPG1)LOC123211929(MiPG2)LOC123207825(MiPG3)LOC123211928(MiPG4)LOC123196885(MiPG5)MiActin引物序列(5'-3')Primer sequence(5'-3')F-ATTCTGCGTCTGGTCCTTTG R-TGGCGTCGGTGATAGTAGTG F-TCGCTGTAAGTGGAAGAGGA R-CGTTTGGTAAGAGGTCAGAATC F-CAATGGCGGTTTCTCCTA R-TGGGTTTCCAGTTTCACA F-ACTGGCAATCCAATAGACG R-CCACCAATAGCATCCTTTC F-TAACGGCACCAGCAGACA R-ATTTGGGCTCCATTCACG F-AACTGGTAGCAAGAGTGTAG R-GTAGTCCCTTTGAAGATAGA F-CAGGGCAGAAGACATTAC R-CCAACGGTCACATTAGAT F-AACTGGTAGCAAGAGTGTAG R-GTAGTCCCTTTGAAGATAGA F-TATTATTGCCCTGACCACA R-ATCAAATCTCACGGCTTCT F-TGTAAAACGACGGCCAGT R-CAGGAAACAGCTATGACC
1.4 数据分析与处理
使用Excel 软件进行数据分析和差异显著性分析,采用独立样本t检验进行显著性分析,差异显著性(p<0.05)用不同小写字母表示。使用Origin 软件进行相关性分析,使用GraphPad软件制图。
2 结果与分析
2.1 不同浓度MeJA处理对杧果外观品质的影响
如图1 所示,CK 在贮藏期第18 天有明显的转黄,不同浓度外源MeJA 处理的台农一号杧果相较于CK 都不同程度地加快由绿色向黄色转变,0.5 mmol·L-1 MeJA组提前3 d转黄,1和2 mmol·L-1 MeJA 组提前6 d 转黄。相较于ETH 组,3 组MeJA处理均慢于ETH组的转变速度,但12 d后ETH组杧果表面出现明显病斑。

图1 不同浓度MeJA 处理和ETH 处理后杧果外观品质的变化
Fig.1 Changes in the appearance quality of mangoes after treatment with MeJA and ETH
2.2 不同浓度MeJA处理对杧果贮藏品质的影响
由图2-A可知,ETH处理后杧果色度a*在第3~6天迅速上升,第6~9天显著高于MeJA和CK组,1和2 mmol·L-1MeJA组在6 d后显著上升并且变化趋势一致,在12 d与ETH组没有显著差异,0.5 mmol·L-1 MeJA 组在12 d 后逐渐上升,在18 d 后与ETH 组没有显著差异。由图2-B 可知,ETH 组的色度b*值在6~18 d 显著高于CK,1 和2 mmol·L-1 MeJA 组在9~18 d 显著高于CK,显著上升期比ETH 慢3 d,比CK组快9 d。由图2-C 可知,不同浓度MeJA 处理可以促进果实硬度的下降,ETH 组在6 d 后硬度迅速下降,1 和2 mmol·L-1MeJA 组在9 d 后逐渐下降,其中2 mmol·L-1MeJA 组在12 d 后与ETH 组不存在显著差异,1 mmol·L-1MeJA组在9~21 d内均与ETH组存在显著差异,在贮藏后期硬度高于ETH组。由图2-D 可知,不同浓度MeJA 处理后叶绿素含量均加速下降,其中2 mmol·L-1 MeJA 组在6 d 后与CK 组存在显著差异,1 mmol·L-1MeJA组在9 d后与CK组存在显著差异,并且两组在12 d后与ETH组不存在显著差异。如图2-E所示,不同浓度MeJA组和ETH组均使得乙烯释放高峰提前出现并且提升了峰值,试验结果说明茉莉酸甲酯可能是通过促进乙烯释放来促进果实成熟。如图2-F所示,不同浓度MeJA组和ETH组均可以提升可溶性固形物含量,0.5 mmol·L-1与CK组在贮藏期内不存在显著差异。
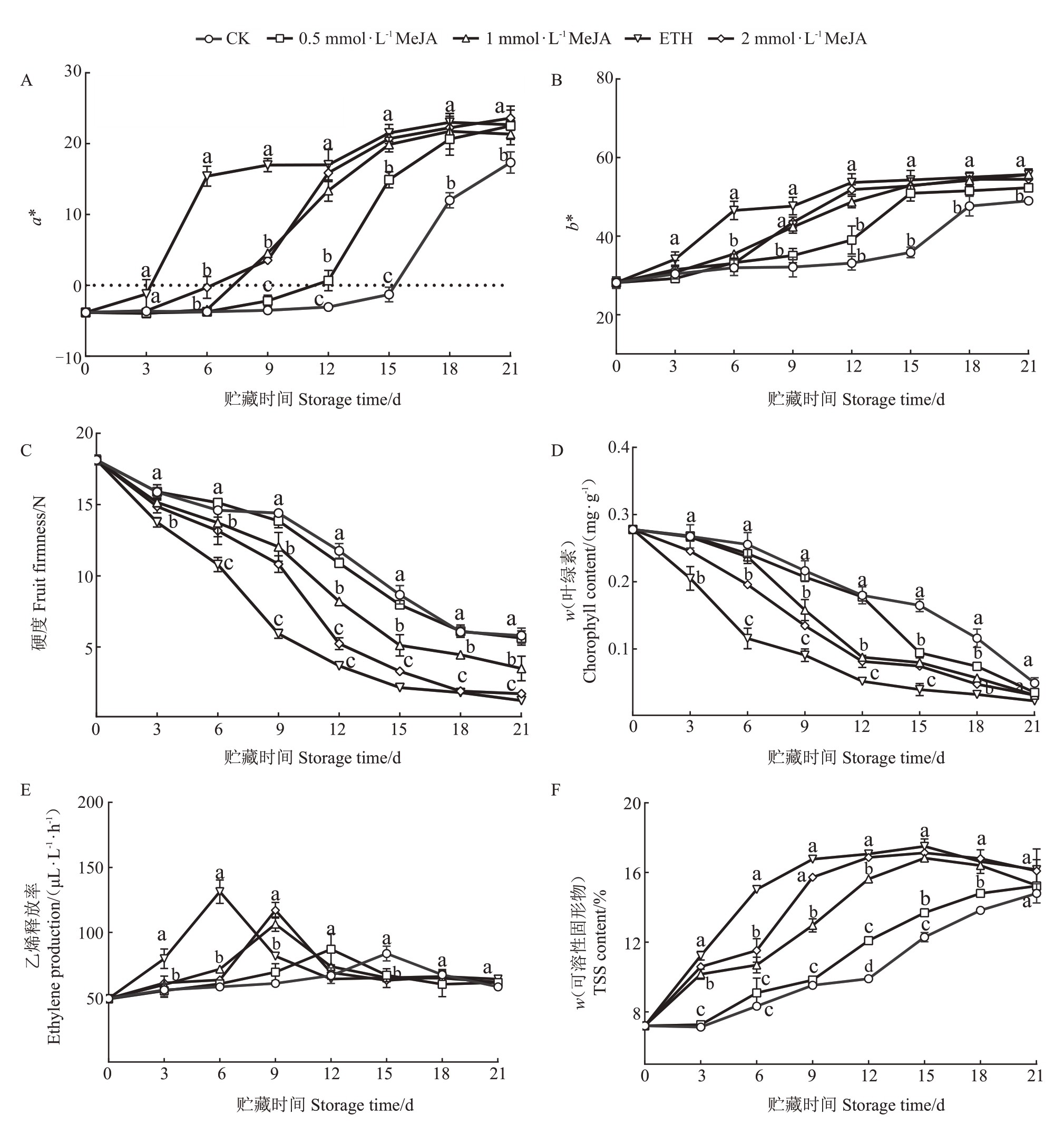
图2 不同浓度MeJA 处理和乙烯处理对杧果贮藏品质的影响
Fig.2 Effects of MeJA concentration and ethylene treatment on mango storage quality parameters
由上述不同浓度MeJA处理对杧果贮藏品质的影响可知,1 mmol·L-1 MeJA 和ETH 处理均可以有效促进杧果果实叶绿素降解实现颜色的由绿转黄。1 mmol·L-1 MeJA 叶绿素含量迅速下降期比ETH 晚6 d,但软化速度慢于ETH 组,并且在整个贮藏期硬度均高于ETH组,可以综合提高采后果实的外观品质和贮藏能力。所以选取1 mmol·L-1MeJA 处理进行后续研究,旨在探究MeJA 处理对果实软化的影响,探究果实软化的分子机制,为杧果采后品质维持和MeJA在采后杧果贮藏中的应用提供理论支持。
2.3 MeJA处理对杧果质地特性的影响
咀嚼性代表咀嚼采后杧果所用的力,综合反映样品对咀嚼的持续抵抗能力,如图3-A所示,杧果果实成熟过程中咀嚼性逐渐降低,MeJA 处理后咀嚼性在0~12 d内与CK组存在显著差异。黏聚性代表了杧果果肉抵抗受损保持自身完整性的能力,如图3-B 所示,MeJA 处理后黏聚性均低于CK 组并且在贮藏后期存在显著差异。脆度是杧果在压缩过程中发生破裂的现象,如图3-C 所示,MeJA 处理可以促进脆度的下降,并且在9 d 后显著低于CK 组。回复性代表了采后杧果果肉受到压缩、咀嚼后回弹的能力,如图3-D 所示,MeJA 可以促进回复性下降。综上所述,1 mmol·L-1 MeJA 处理可以促进杧果果实质构发生变化,提升了杧果的质构品质,这说明,1 mmol·L-1MeJA处理可以促进采后杧果果实的软化。
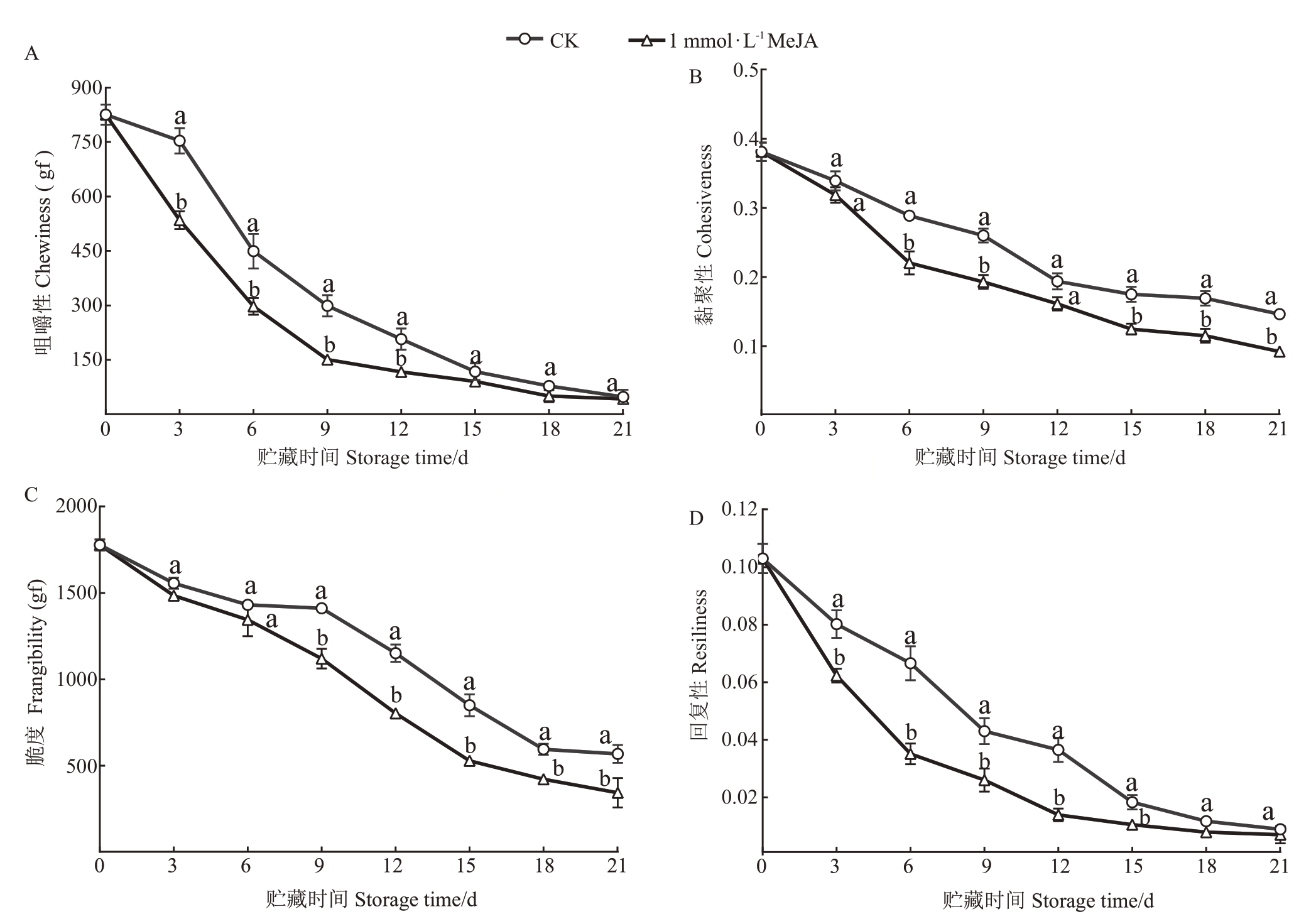
图3 MeJA 处理对杧果质地特性的影响
Fig.3 Effects of MeJA treatment on mango texture profile analysis(TPA)parameters
2.4 MeJA处理对细胞壁代谢物质的影响
细胞壁是植物细胞的第一层屏障,果实的软化主要与细胞壁的降解有关,其中的原果胶降解为可溶性果胶,细胞间粘连力下降导致细胞壁结构松散,直至果肉组织全部分解浆化,造成果实硬度的逐渐下降[28-30]。如图4 所示,MeJA 处理后原果胶含量逐渐下降,在第6~18 天内均显著低于对照组,可溶性果胶含量在21 d 内逐渐上升,并且在贮藏中期显著高于CK 组,这说明1 mmol·L-1 MeJA 处理可以显著促进原果胶转化为可溶性果胶,促进果实软化。
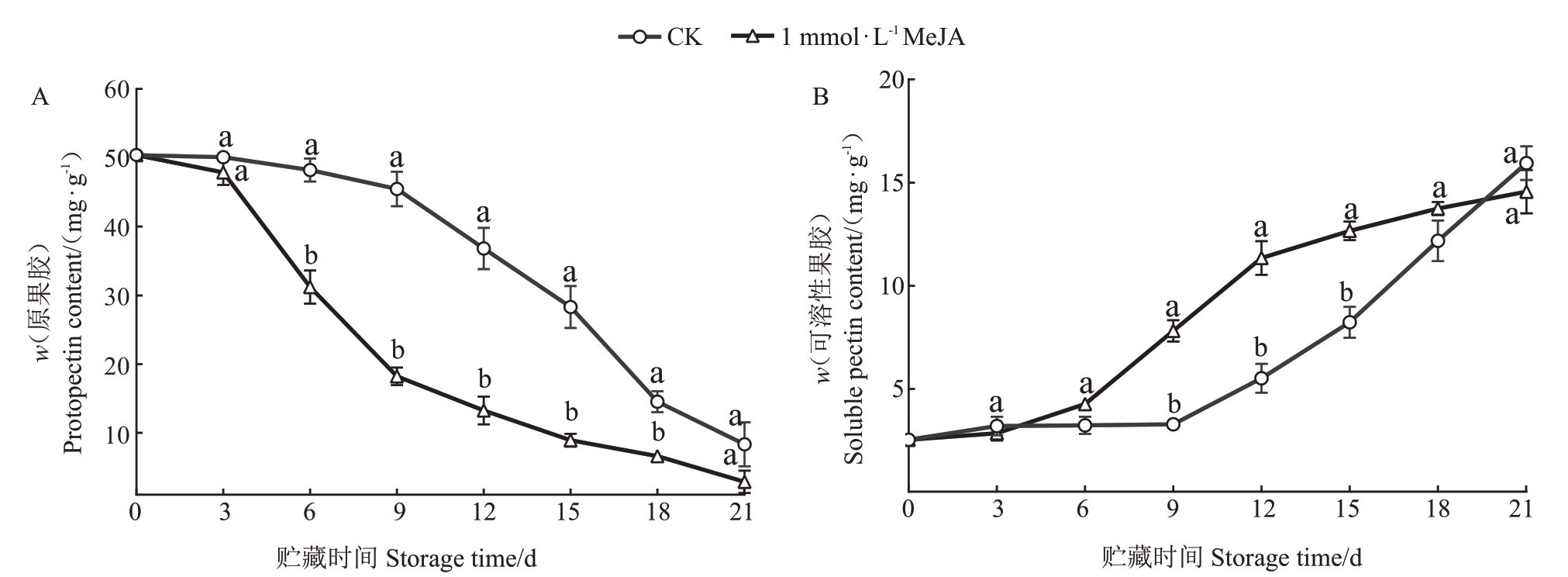
图4 MeJA 处理对细胞壁代谢物质含量的影响
Fig.4 Effects of MeJA treatment on cell wall metabolite contents
2.5 MeJA处理对忙果细胞壁降解酶活性的影响
果实软化主要依靠果胶酶来催化,目前已经发现的果胶酶类主要有PME、PG、PL 等[31-32],此外,细胞壁结构也会受到CX的作用[33]。由图5-A可知,在贮藏期间,杧果果实PME酶活性整体呈现先上升后下降的趋势,MeJA处理后PME酶活性在第9~12天显著高于CK 组,达到最高酶活性的时间比CK 组短6 d。由图5-B 可知,MeJA 处理可以在贮藏前期提高PL酶活性,但在贮藏后期显著低于CK组。由图5-C 可知,PG 酶活性在21 d 内呈现先上升后下降的趋势,MeJA 组PG 酶活性在第12 天达到最高(86.9 ng·g-1·h-1),在贮藏前期MeJA组和CK组存在显著差异。由图5-D 可知,MeJA 可以促进CX 酶活性提高,在第9~15天显著高于CK组,但整体酶活性保持在较低水平。这说明,MeJA 处理可以促进果胶酶活性的提高,进而使杧果发生软化。
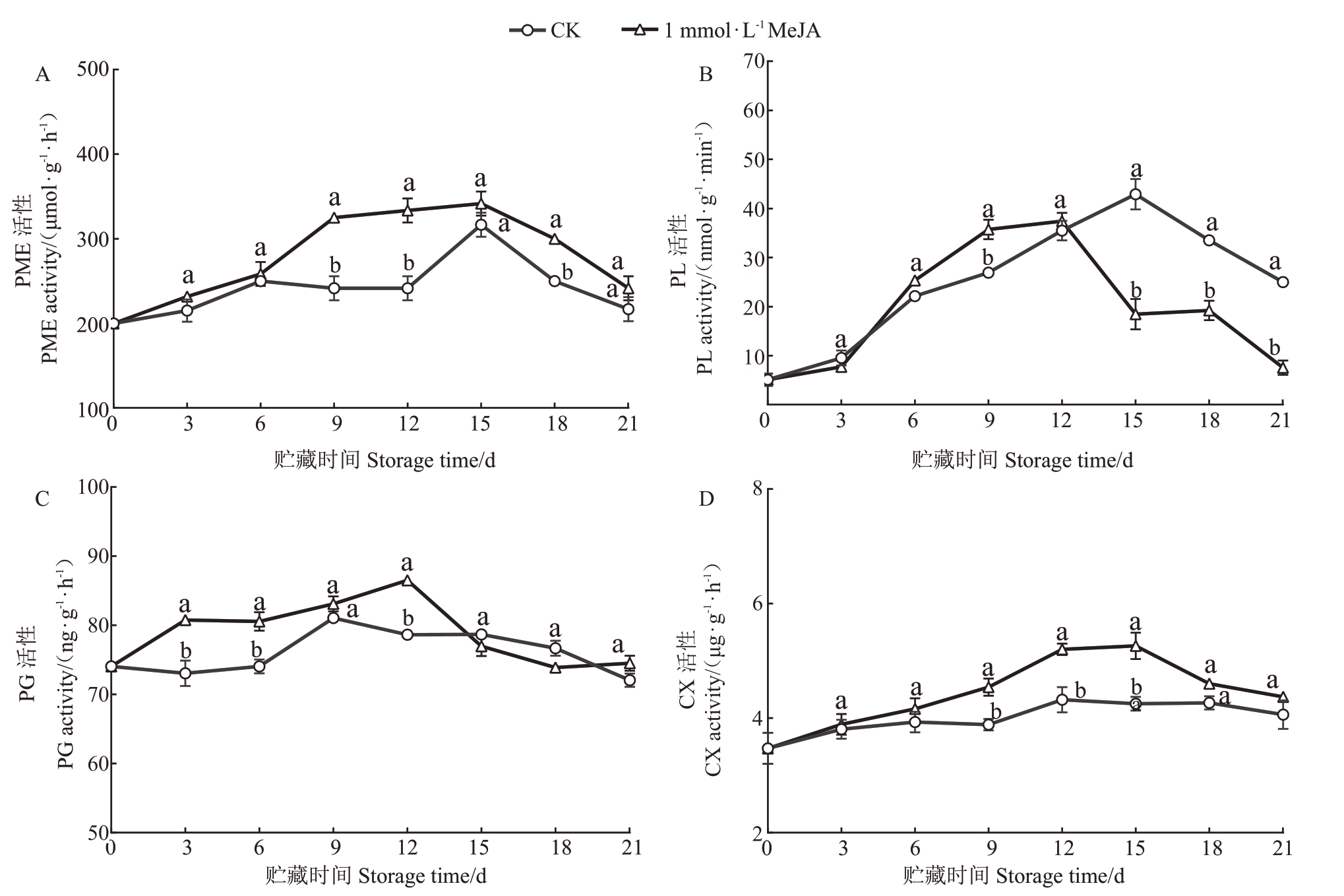
图5 MeJA 处理对采后杧果细胞壁降解酶活性的影响
Fig.5 Effects of MeJA treatment on postharvest mango cell wall-degrading enzyme activities
2.6 杧果软化基因筛选及实时荧光定量分析
MiPME,MiPL和MiPG都是杧果细胞壁降解通路上的相关基因,根据笔者课题组对1 mmol·L-1 MeJA 处理的台农一号杧果转录组数据进行统计分析,筛选出转录组中差异表达的注释为MiPME基因17个,MiPL基因6个,MiPG基因18个,根据其fpkm值绘制热图(图6),选取其中fpkm 值较高且相对表达量升高的9个基因进行qRT-PCR验证。结果如图7 所示,MeJA 处理后MiPME 相对表达量在贮藏期内呈现上升的趋势,MiPME1/2相对表达量在6~12 d显著高于CK 组,MiPME2 相对表达量在6 d 后维持在较高水平,CK组MiPME1在第18~21天显著高于MeJA组。MeJA处理后MiPL相对表达量在贮藏期内呈现先上升后下降的趋势,MiPL 表达量在第6~12天均为CK组的3倍以上,在12 d后CK组MiPL1表达量才大幅度上升,但MiPL2表达量在3~21 d内均较低。MeJA处理后MiPG3相对表达量在贮藏期内呈现先上升后下降的趋势,第12 天表达量为CK组的3 倍,MiPG1、MiPG2、MiPG4、MiPG5 贮藏期内呈现上升的趋势,MiPG1相对表达量在第6、18天显著高于CK组,MiPG2、MiPG4在第6~12天内显著高于CK组,并且均在第12天后表达量较高,MiPG5在第3~18 天表达量较低,在第21 天表达量在两组中均显著提升。综上所述,MeJA 促进果实软化可能与这些酶基因的差异表达有关。
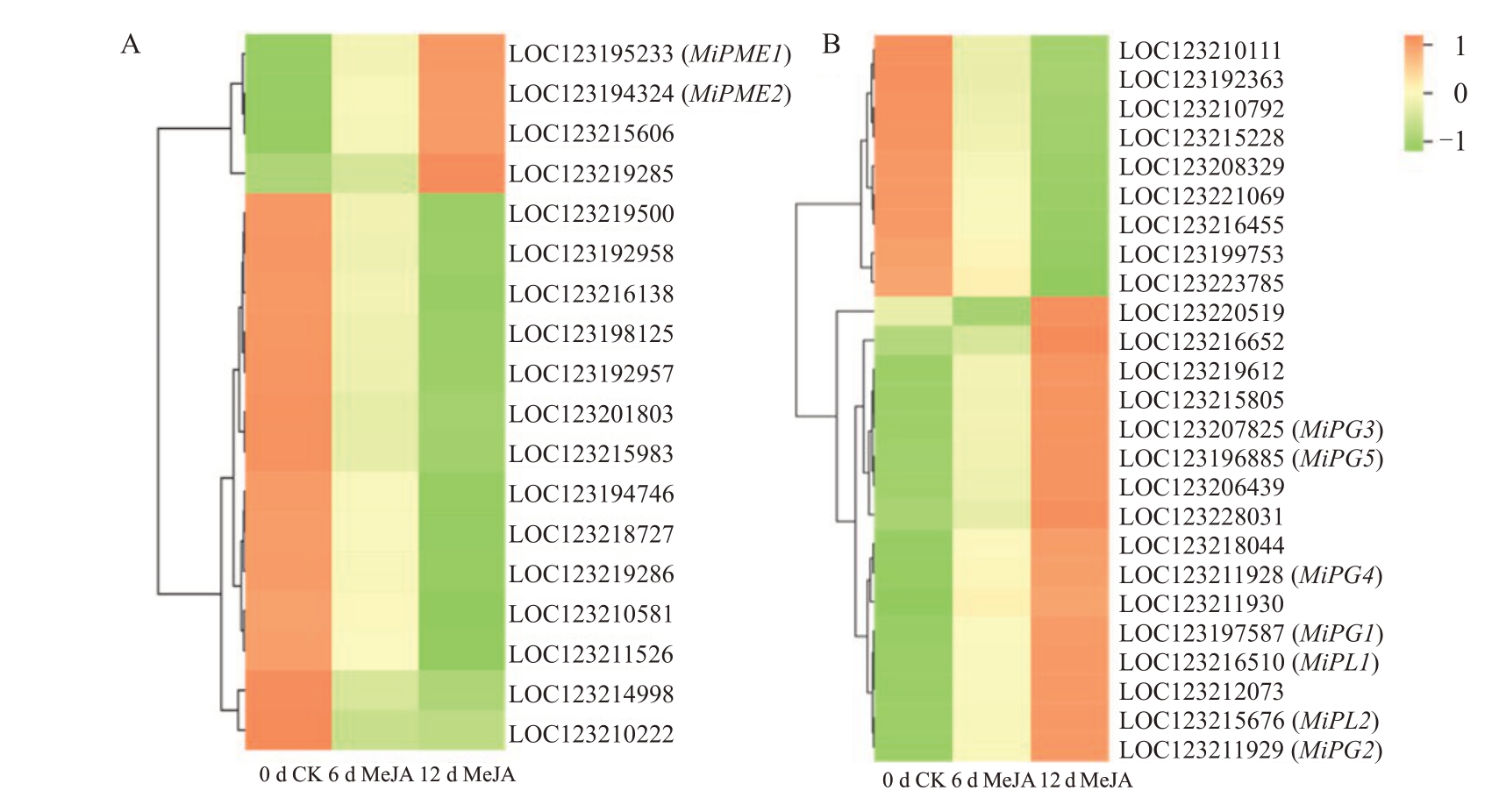
图6 热图分析MeJA 处理后差异表达的MiPME(A)、MiPL 和MiPG(B)
Fig.6 Heatmap analysis of differentially expressed MiPME(A),MiPL and MiPG(B)following MeJA treatment

图7 MeJA 处理后细胞壁降解关键基因相对表达量的变化
Fig.7 Changes of relative expression of key genes for cell wall degradation after MeJA treatment
2.7 MeJA介导的杧果果实软化各指标的相关性分析
对外源MeJA 处理后的台农一号果实的硬度、质构、酶活性、基因表达量等指标进行相关性分析,结果如图8 所示,果实的硬度与原果胶含量、咀嚼性、脆度、黏聚性、回复性呈显著正相关(r>0.9),原果胶含量与咀嚼性、硬度、脆度、黏聚性、回复性也存在显著正相关(r>0.9),硬度与可溶性果胶含量、MiPME2、MiPL1、MiPG1、MiPG4基因表达量呈显著负相关(r<-0.7),硬度与PME活性、PL活性呈负相关。PME 活性与MiPME1、MiPME2 基因表达量呈正相关。PL 活性与MiPL2 基因表达量相关性高于MiPL1 基因。PG 活性与MiPG3 基因表达量呈正相关,与MiPG1、MiPG5 基因表达量呈负相关。可溶性果胶含量与MiPG1、MiPG2、MiPG4、MiPME2 基因表达量呈显著正相关(r>0.7)。由上述可知,Me-JA 处理后细胞壁降解酶基因的差异表达导致了PME、PL、PG 活性的变化,使得杧果果实原果胶转化为可溶性果胶,最终使得杧果硬度降低。
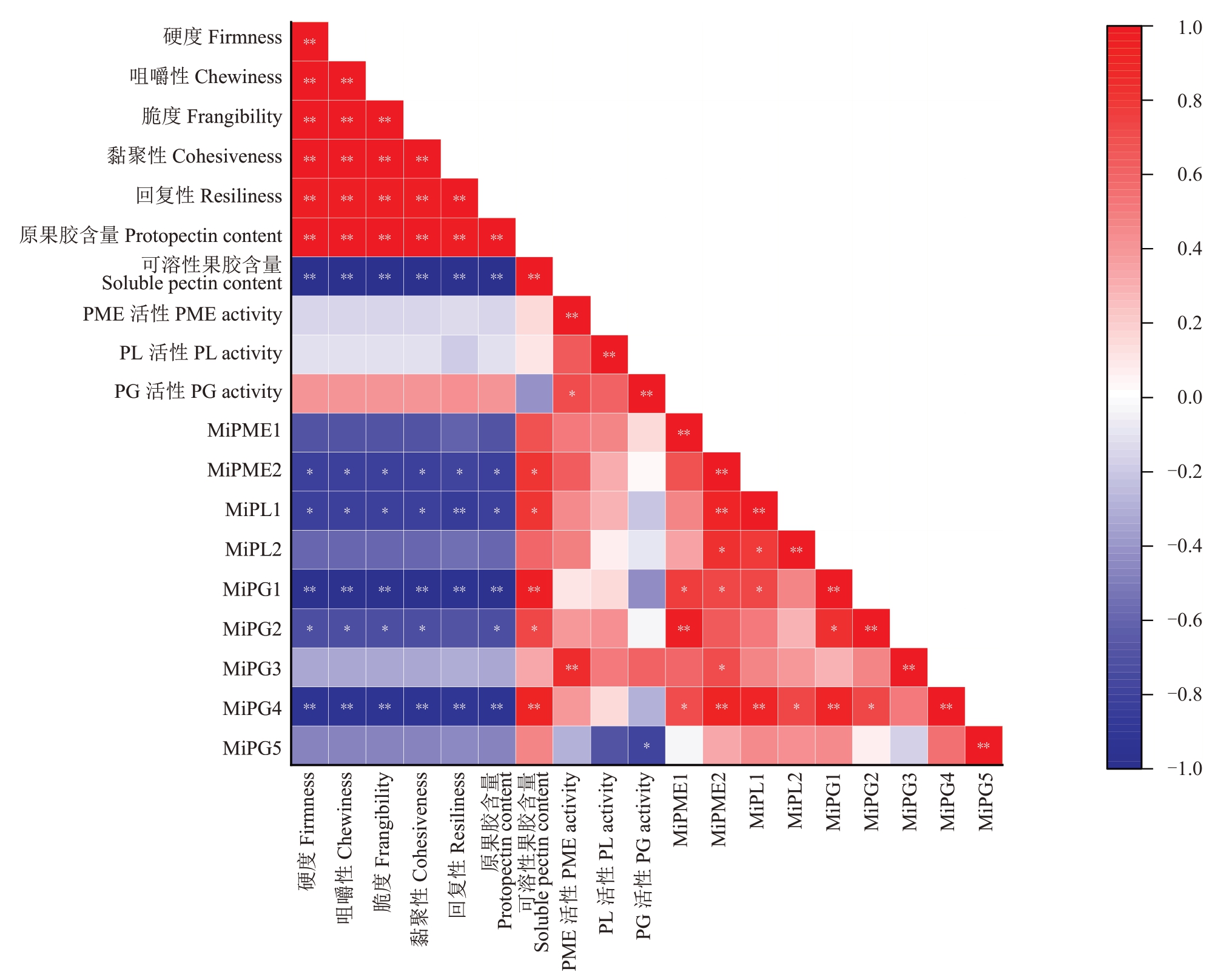
图8 MeJA 介导的杧果果实软化各指标的相关性分析
Fig.8 Correlation analysis of MeJA-mediated mango fruit softening
3 讨 论
杧果的质地决定了果实的口感,也直接影响采后的贮藏时间和经济价值。目前,除了硬度可以直观地反映果实软化程度外,质构相关指标也可以反映贮藏期间果实质地的变化。赵亚等[34]通过分析不同红毛丹品系的TPA 参数,发现硬度、弹性与咀嚼性、粘附性、胶黏性等质地参数之间相互呈正相关,红毛丹的TSS含量分别与其果实的凝聚性、胶黏性、弹性、咀嚼性、硬度和最大粘附性指标呈正相关,与本研究结果一致。
细胞壁具有维持细胞形态的作用,其组成成分主要包括纤维素、半纤维素、果胶、木质素等[35]。果实的软化主要与细胞壁的降解有关,这个过程中细胞壁水解酶将细胞壁分解导致细胞间粘附性和细胞内部膨压下降,进而降低了果实硬度。在杧果软化方面:刘帅民[36]研究表明褪黑素处理能显著抑制贵妃杧果PG、PME、CX 活性,还抑制了水溶性果胶升高,从而维持较低的果胶溶解度。Njie[7]研究结果表明褪黑素(melatonin,MT)处理增加了杧果果皮细胞壁果胶的含量,抑制了PG、PME、CX 和β-Glu 的活性,通过显著下调MiPG14、MiPME、MiCel 和Miβ-Glu 的转录表达来抑制杧果软化。徐萍等[37]研究结果表明0.5 mmol·L-1 MT 处理可以提高采后贵妃杧果的可溶性固形物含量,提高细胞降解酶(PG、β-Gal、CX)的活性,从而促进采后杧果果实的细胞壁降解和果实软化。这个结论也在本研究中得到验证:外源MeJA 处理可以通过影响细胞壁酶(PME、PL、PG、CX)的活性和基因的相对表达量的途径来降低原果胶含量和提升可溶性果胶含量,从而使得杧果果实硬度下降。类似的,细胞壁降解酶活性和果胶含量的高低也会影响其他水果的软化进程:Sanchez等[38]发现PME酶活性的先显著下降再显著上升与番木瓜的软化过程有关。王倩等[15]研究结果表明番茄中PG酶活性在果实成熟软化过程中有显著提高。上述结果表明果实的软化与细胞壁降解酶(PME、PG、PL)活性的提高及其编码基因高表达有关。
李秋利等[39]研究表明不同浓度MeJA 处理在果实生长过程中均增加了果实的可溶性固形物含量,与本研究结果一致。唐双双等[40]研究结果表明八成熟的草莓果实经1 mol·L-1MeJA熏蒸24 h可以促进品质指标在贮藏后期接近全熟草莓。杨光凯等[41]研究表明MeJA 促进果实着色,有效降低苹果果实叶绿素的含量,以上结果表明MeJA 具有改善果实品质的作用,与本研究结果一致。但也有研究结果表明,MeJA 具有浓度效应,50 μmol·L-1可以抑制蓝莓CX、PG、PME 和β-Gal 酶活性和抑制其编码基因的转录,抑制水溶性果胶的增加从而维持果实硬度。唐伟杰等[19]研究结果表明10 μmol·L-1 MeJA 可以延缓果实衰老,而1500 μmol·L-1 MeJA 处理则有相反效果,可以加速果实的成熟与衰老。综上所述,Me-JA的作用会受到物种、品种、浓度、生长阶段等多种因素的影响,在实际应用中需要根据具体需求选择合适的浓度来达到最佳效果。在本研究中,0.5、1、2 mmol·L-1 MeJA 处理可以促进杧果果实成熟,0.5 mmol·L-1浓度效果不显著,2 mmol·L-1 MeJA 效果最好,相较于乙烯,1 mmol·L-1 MeJA 在成熟过程中硬度下降较慢,针对这一现象笔者在本研究中对MeJA 的转录组数据进行分析筛选和qRT-PCR 验证,进一步确定MeJA对软化的作用和分子机制,为充分发挥MeJA的作用提供依据。
目前,茉莉酸甲酯(MeJA)对果实成熟的调控机制尚不明确,已有研究结果表明MeJA 可能通过促进内源乙烯的合成来促进果实成熟,例如:Tao 等[42]研究结果表明,外源MeJA处理后,与乙烯生物合成相关的基因表达上调,以及参与乙烯信号转导的大多数基因的转录水平也显著上调,可以导致内源乙烯产量增加,从而促进采后番茄的成熟,这与本研究结果MeJA处理后乙烯释放量提高和峰值提前出现相吻合,但无法对一些研究论文中低浓度MeJA 抑制成熟的结果进行解释,所以MeJA 促进果实成熟的分子机制还需要进一步研究和探索。
4 结 论
与CK 组相比,1 和2 mmol·L-1浓度的MeJA 处理均促进了叶绿素的降解,促进果实转色,促进硬度的下降,提高乙烯释放率和可溶性固形物含量,0.5 mmol·L-1处理效果不显著。ETH组和2 mmol·L-1 MeJA 均显著促进了果实的快速成熟,1 mmol·L-1 MeJA处理在促进杧果果实色泽转变的同时硬度下降速度慢于ETH 组。此外,与CK 组相比,1 mmol·L-1 MeJA 可以促进原果胶含量的下降和可溶性果胶含量的提升,提高多聚半乳糖醛酸酶(PG)、果胶甲酯酶(PME)、果胶裂解酶(PL)、纤维素酶(CX)活性,及其编码基因MiPME1/2、MiPL1/2、MiPG1-5的表达水平。综上所述,茉莉酸甲酯处理可以通过调控细胞壁代谢通路中关键酶基因的表达水平来影响相关酶活性,从而促进杧果果实的成熟和软化。
[1] 陈业渊,党志国,林电,胡美姣,黄建峰,朱敏,张贺,韩冬银,高爱平,高兆银,黄媛媛.中国杧果科学研究70 年[J].热带作物学报,2020,41(10):2034-2044.CHEN Yeyuan,DANG Zhiguo,LIN Dian,HU Meijiao,HUANG Jianfeng,ZHU Min,ZHANG He,HAN Dongyin,GAO Aiping,GAO Zhaoyin,HUANG Yuanyuan. Mango scientific research in China in the past 70 years[J].Chinese Journal of Tropical Crops,2020,41(10):2034-2044.
[2] CARELLA A,GIANGUZZI G,SCALISI A,FARINA V,INGLESE P,BIANCO R L. Fruit growth stage transitions in two mango cultivars grown in a Mediterranean environment[J].Plants,2021,10(7):1332.
[3] 刘德兵,刘国银,魏军亚.海南杧果产业发展及分析[J].中国热带农业,2022(2):11-18.LIU Debing,LIU Guoyin,WEI Junya. Development and analysis of mango industry in Hainan Province[J].China Tropical Agriculture,2022(2):11-18.
[4] 胡隆孝,曹琳彩,王凯,赵雷.采后催熟对‘台农一号’芒果理化品质及营养特性的影响[J]. 食品工业科技,2023,44(2):369-375.HU Longxiao,CAO Lincai,WANG Kai,ZHAO Lei. Effects of postharvest ripening on the physicochemical and nutraceutical properties of mango(Mangifera indica L.cv.Tainung No. 1)[J].Science and Technology of Food Industry,2023,44(2):369-375.
[5] 马冀恒,李雯,陈明敏,曾教科.不同处理对采后芒果质构的影响[J].保鲜与加工,2021,21(12):10-15.MA Jiheng,LI Wen,CHEN Mingmin,ZENG Jiaoke. Effects of different treatments on texture of postharvest mango fruits[J].Storage and Process,2021,21(12):10-15.
[6] 梁淑君,李大祥.不同浓度乙烯利对香蕉催熟的作用[C]//广东省教师继续教育学会教师发展论坛学术研讨会论文集(十一).广州,2023:566-570.LIANG Shujun,LI Daxiang. Effect of different concentrations of ethephon on ripening of bananas[C]//Proceedings of the Symposium on Teacher Development Forum of Guangdong Teachers' Continuing Education Society (XI). Guangzhou,2023:566-570.
[7] NJIE A.采后褪黑素处理对低温贮藏芒果果实软化的影响[D].贵阳:贵州大学,2023.NJIE A. Effect of postharvest melatonin treatment on softening of mango fruit stored at low temperature[D]. Guiyang:Guizhou University,2023.
[8] LARRIGAUDIERE C,PINTO E,VENDRELL M. Differential effects of ethephon and seniphos on color development of‘Starking Delicious’apple[J]. Journal of the American Society for Horticultural Science,1996,121(4):746-750.
[9] DAWSON D M,WATKINS C B,MELTON L D. Intermittent warming affects cell wall composition of‘Fantasia’nectarines during ripening and storage[J]. Journal of the American Society for Horticultural Science,1995,120(6):1057-1062.
[10] 胡留申,纪仁芬,李培环,顾志新,施瑞炳,熊帅.硬肉桃果实成熟前后呼吸和淀粉酶活性变化及其与硬度的关系[J].江苏农业科学,2013,41(2):152-153.HU Liushen,JI Renfen,LI Peihuan,GU Zhixin,SHI Ruibing,XIONG Shuai. Changes of respiration and amylase activity in hard-fleshed peach fruit before and after ripening and their relationship with hardness[J]. Jiangsu Agricultural Sciences,2013,41(2):152-153.
[11] 李雯,邵远志,庄军平,陈维信.蔗糖磷酸合成酶与香蕉果实成熟、衰老的关系[J].园艺学报,2006,33(5):1087-1089.LI Wen,SHAO Yuanzhi,ZHUANG Junping,CHEN Weixin.Relationships between the sucrose phosphate synthase and ripening,senescence of banana fruits[J]. Acta Horticulturae Sinica,2006,33(5):1087-1089.
[12] WOLF S,RAUSCH T,GREINER S.The N-terminal pro region mediates retention of unprocessed type-I PME in the Golgi apparatus[J].The Plant Journal,2009,58(3):361-375.
[13] 张清凤.果胶甲基酯酶在油菜素内酯调节拟南芥生长发育中的作用[D].兰州:兰州大学,2017.ZHANG Qingfeng. Roles of pectin methylesterase in brassinosteroid regulations of growth and development in Arabidopsis[D].Lanzhou:Lanzhou University,2017.
[14] CAI J F,MO X L,WE C J,GAO Z,CHEN X,CHENG X. Fv-MYB79 activates the transcription of FvPME38 to positively regulate the softening of strawberry fruit[J]. International Journal of Molecular Sciences,2022,23(1):101.
[15] 王倩,郏艳红,孙海波,吉立柱.不同耐贮性粉果番茄贮藏期间果实软化相关酶活性的研究[J].保鲜与加工,2020,20(1):72-77.WANG Qian,JIA Yanhong,SUN Haibo,JI Lizhu. Research on the activities of enzymes involved in fruits softening of pink tomato with different storage property during storage[J]. Storage and Process,2020,20(1):72-77.
[16] HUANG W N,NIE Y T,ZHU N,YANG Y F,ZHU C Q,JI M B,WU D,CHEN K S. Hybrid label-free molecular microscopies for simultaneous visualization of changes in cell wall polysaccharides of peach at single- and multiple-cell levels during postharvest storage[J].Cells,2020,9(3):761.
[17] 金欢淳,张培安,张涛,金联宇,董天宇,胡丹,房经贵.不同浓度茉莉酸甲酯对妮娜皇后果实着色与品质形成的影响[J].浙江农业科学,2023,64(9):2165-2172.JIN Huanchun,ZHANG Pei’an,ZHANG Tao,JIN Lianyu,DONG Tianyu,HU Dan,FANG Jinggui. Effects of different concentrations of methyl jasmonate on fruit coloration and quality formation of Queen Nina[J]. Journal of Zhejiang Agricultural Sciences,2023,64(9):2165-2172.
[18] 高伟,崔芳铭,刘敏.茉莉酸甲酯对‘小白玫瑰’和‘玫瑰香’葡萄酒香气的影响[J].中国农业大学学报,2024,29(7):79-88.GAO Wei,CUI Fangming,LIU Min. Effects of methyl jasmonate on the aroma of‘Muscat Blanc’and‘Muscat Hamburg’wines[J]. Journal of China Agricultural University,2024,29(7):79-88.
[19] 唐伟杰,张潆支,张良,吕静祎,孙明宇,葛永红,陈敬鑫.不同浓度茉莉酸甲酯处理对“金冠”苹果保鲜效果的影响[J].包装与食品机械,2024,42(1):12-18.TANG Weijie,ZHANG Yingzhi,ZHANG Liang,LÜ Jingyi,SUN Mingyu,GE Yonghong,CHEN Jingxin. Effects of different concentrations of methyl jasmonate treatment on preservation of‘Jinguan’apple fruit[J].Packaging and Food Machinery,2024,42(1):12-18.
[20] HAN Y L,CHEN C,YAN Z M,LI J,WANG Y H. The methyl jasmonate accelerates the strawberry fruits ripening process[J].Scientia Horticulturae,2019,249:250-256.
[21] MIN D D,LI Z L,AI W,LI J Z,ZHOU J X,ZHANG X H,MU D,LI F J,LI X A,GUO Y Y.The co-regulation of ethylene biosynthesis and ascorbate-glutathione cycle by methy jasmonate contributes to aroma formation of tomato fruit during postharvest ripening[J]. Journal of Agricultural and Food Chemistry,2020,68(39):10822-10832.
[22] 张梦媛.MeJA 对采后苹果果实品质和乙烯生物合成及其信号转导途径关键基因表达的影响[D].锦州:渤海大学,2019.ZHANG Mengyuan. Effects of MeJA on quality and expression of key genes involved in ethylene biosynthesis and signal transduction pathway during postharvest ripening of apple fruit[D].Jinzhou:Bohai University,2019.
[23] MARTÍNEZ-ESPLÁ A,ZAPATA P J,CASTILLO S,GUILLÉN F,MARTÍNEZ-ROMERO D,VALERO D,SERRANO M. Preharvest application of methyl jasmonate (MeJA) in two plum cultivars. 1. Improvement of fruit growth and quality attributes at harvest[J].Postharvest Biology and Technology,2014,98:98-105.
[24] 安娜,赵志永,贾晓昱,杨克箐.1-甲基环丙烯结合茉莉酸甲酯雾化熏蒸对石榴采后品质的影响[J].食品安全质量检测学报,2023,14(15):287-296.AN Na,ZHAO Zhiyong,JIA Xiaoyu,YANG Keqing.Effects of 1-methylcyclopropene combined with methyl jasmonate aerosol fumigation on postharvest quality of pomegranate fruit[J]. Journal of Food Safety&Quality,2023,14(15):287-296.
[25] 肖刘华,康乃慧,李树成,郑致远,罗绕绕,陈金印,陈明,向妙莲.茉莉酸甲酯对猕猴桃果实抗葡萄座腔菌过程中能量代谢和膜脂代谢的影响[J].中国农业科学,2024,57(7):1377-1393.XIAO Liuhua,KANG Naihui,LI Shucheng,ZHENG Zhiyuan,LUO Raorao,CHEN Jinyin,CHEN Ming,XIANG Miaolian.Effect of methyl jasmonate on energy metabolism and membrane lipid metabolism during resistance to Botryosphaeria dothidea in kiwifruit[J]. Scientia Agricultura Sinica,2024,57(7):1377-1393.
[26] 罗冬兰,瞿光凡,孙雁征,芈婷婷,张雨,曹森,巴良杰.茉莉酸甲酯处理对蓝莓贮藏品质的影响[J].中国南方果树,2022,51(4):161-166.LUO Donglan,QU Guangfan,SUN Yanzheng,MI Tingting,ZHANG Yu,CAO Sen,BA Liangjie. Effect of methyl jasmonate on storage quality of blueberry[J]. South China Fruits,2022,51(4):161-166.
[27] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007.CAO Jiankang,JIANG Weibo,ZHAO Yumei. Experimental guidance of postharvest physiology and biochemistry of fruits and vegetables[M].Beijing:China Light Industry Press,2007.
[28] CHEN H J,CAO S F,FANG X J,MU H L,YANG H L,WANG X,XU Q Q,GAO H Y.Changes in fruit firmness,cell wall composition and cell wall degrading enzymes in postharvest blueberries during storage[J].Scientia Horticulturae,2015,188:44-48.
[29] WANG D D,YEATS T H,ULUISIK S,ROSE J K C,SEYMOUR G B. Fruit softening:Revisiting the role of pectin[J].Trends in Plant Science,2018,23(4):302-310.
[30] 张鹏龙,陈复生,杨宏顺,李里特,宫保文,王留留.果实成熟软化过程中细胞壁降解研究进展[J].食品科技,2010,35(11):62-66.ZHANG Penglong,CHEN Fusheng,YANG Hongshun,LI Lite,GONG Baowen,WANG Liuliu. Research advances on cell wall disassembly in fruit ripening and softening[J].Food Science and Technology,2010,35(11):62-66.
[31] BRUMMELL D A,CIN V D,CRISOSTO C H,LABAVITCH J M. Cell wall metabolism during maturation,ripening and senescence of peach fruit[J]. Journal of Experimental Botany,2004,55(405):2029-2039.
[32] 佟兆国,王飞,高志红,周军,徐秋红,章镇.果胶降解相关酶与果实成熟软化[J].果树学报,2011,28(2):305-312.TONG Zhaoguo,WANG Fei,GAO Zhihong,ZHOU Jun,XU Qiuhong,ZHANG Zhen. Advances in research on the relationship between pectolytic enzymes and fruit softening[J]. Journal of Fruit Science,2011,28(2):305-312.
[33] WEI Y Y,ZHOU D D,WANG Z J,TU S C,SHAO X F,PENG J,PAN L Q,TU K. Hot air treatment reduces postharvest decay and delays softening of cherry tomato by regulating gene expression and activities of cell wall-degrading enzymes[J]. Journal of the Science of Food and Agriculture,2018,98(6):2105-2112.
[34] 赵亚,郭利军,胡福初,冯学杰,罗志文,陈哲,王祥和,邓会栋,范鸿雁.海南不同红毛丹品系资源果实质构特性的比较分析[J].分子植物育种,2019,17(8):2646-2654.ZHAO Ya,GUO Lijun,HU Fuchu,FENG Xuejie,LUO Zhiwen,CHEN Zhe,WANG Xianghe,DENG Huidong,FAN Hongyan.Comparison of texture parameters among different rambutan(Nephelium lappaceum L.) germplasm resources of Hainan[J].Molecular Plant Breeding,2019,17(8):2646-2654.
[35] PANIAGUA C,POSÉ S,MORRIS V J,KIRBY A R,QUESADA M A,MERCADO J A. Fruit softening and pectin disassembly:An overview of nanostructural pectin modifications assessed by atomic force microscopy[J].Annals of Botany,2014,114(6):1375-1383.
[36] 刘帅民.褪黑素处理对采后芒果成熟和衰老的影响[D].海口:海南大学,2020.LIU Shuaimin. Effects of melatonin treatment on ripening and senescence of postharvest mango[D]. Haikou:Hainan University,2020.
[37] 徐萍,黄婷,刘士琦,胡美姣,高兆银,刘家粮,张正科.褪黑素对冷藏后芒果果实冷害和后熟的影响及生理机制[J].食品科学,2024,45(8):218-227.XU Ping,HUANG Ting,LIU Shiqi,HU Meijiao,GAO Zhaoyin,LIU Jialiang,ZHANG Zhengke. Effect of melatonin on chilling injury and ripening of postharvest mango fruits during shelf life after refrigeration and underlying physiological mechanism[J].Food Science,2024,45(8):218-227.
[38] SANCHEZ N,GUTIÉRREZ-LÓPEZ G F,CÁEZ-RAMÍREZ G.Correlation among PME activity,viscoelastic,and structural parameters for Carica papaya edible tissue along ripening[J].Journal of Food Science,2020,85(6):1805-1814.
[39] 李秋利,高登涛,魏志峰,王志强,刘军伟,杨文佳.茉莉酸类物质对‘映霜红’桃果实品质的影响[J].中国南方果树,2018,47(3):107-112.LI Qiuli,GAO Dengtao,WEI Zhifeng,WANG Zhiqiang,LIU Junwei,YANG Wenjia. Effects of jasmonates on fruit quality of‘Yingshuanghong’peach[J]. South China Fruits,2018,47(3):107-112.
[40] 唐双双,郑永华,汪开拓,王晓梅,金鹏.茉莉酸甲酯处理对不同成熟度草莓果实采后腐烂和品质的影响[J]. 食品科学,2008,29(6):448-452.TANG Shuangshuang,ZHENG Yonghua,WANG Kaituo,WANG Xiaomei,JIN Peng. Effect of methy jamonate on decay and quality of postharvest strawberry fruit at different maturity stages[J].Food Science,2008,29(6):448-452.
[41] 杨光凯,武媛丽,高燕,张小军,郝燕燕.外源茉莉酸甲酯对苹果果实品质的影响[J].果树资源学报,2021,2(5):15-22.YANG Guangkai,WU Yuanli,GAO Yan,ZHANG Xiaojun,HAO Yanyan. Effects of exogenous methyl jasmonate on the quality of apple[J].Journal of Fruit Resources,2021,2(5):15-22.
[42] TAO X Y,WU Q,LI J Y,WANG D,NASSARAWA S S,YING T J. Ethylene biosynthesis and signal transduction are enhanced during accelerated ripening of postharvest tomato treated with exogenous methyl jasmonate[J]. Scientia Horticulturae,2021,281:109965.