杧果(Mangifera indica L.)是漆树科杧果属的常绿果树,在世界热带亚热带地区广泛种植,多异花授粉且主要依赖蝇类等昆虫进行授粉,其果实肉质鲜嫩、味道香甜且多汁、含有大量维生素和多种微量元素,深受消费者青睐,素有‘热带果王’之美誉[1-2]。中国是世界第二大杧果生产国,种植区域涵盖海南、广东、广西、云南、四川、福建和贵州等省份[3]。2023年,中国大陆杧果栽培面积达4.094万hm2、产量约511.9万t(农业农村部南亚办统计数据)。然而,我国杧果主栽品种大多从国外和台湾地区引进,品种同质化严重,导致部分地区过度集中上市,且缺乏具有地域特色的优质品种资源,制约了杧果产业的持续发展[3]。因此,选育具有自主知识产权的杧果优良新品种,对中国杧果产业高质量发展尤为重要。
杂交育种是杧果新品种选育的重要手段,与其他育种方法相比,杂交育种具有育种目标明确、可以快速聚合多个优良性状等优势[4-5]。杂交育种根据授粉方式可分为人工授粉杂交与自然授粉杂交。由于杧果花极小,人工授粉操作难度大,且母本必须为单胚品种,因此真正通过人工授粉杂交途径获得的新品种较少[6-7]。目前大多数杧果栽培品种均是通过自然杂交或实生选育得到的[8]。但完全的自然授粉杂交不可控因素较多,父本鉴定难度大,而将多个亲本罩网进行控制授粉,在早期对已知母本品种的控制授粉幼苗进行基因分型以鉴定最优父本是最好的选择[7]。父本鉴定的传统方法是形态学标记,鉴定简单直观、经济方便,但表型检测具有滞后性,所需时间长,易受植株生长状态及环境条件的影响,对于遗传变异水平低的杂交后代难以区分,且界定标准难以统一[9-10]。分子标记是以子代个体间DNA差异为基础的新一代技术,不受环境和生长状态的限制,可快速准确地匹配子代的候选亲本[11]。SSR(simple sequence repeats)标记具有多态性丰富、重复性好、位点多及共显性等优点,被广泛应用于杧果品种鉴定[12]、遗传图谱构建[8]、遗传多样性分析[13]、亲缘关系分析[14]及杂交种真实性鉴定[15]。传统的聚丙烯酰胺凝胶电泳SSR 分子标记技术,存在工作量大、分辨率低、费时费力等缺点,不适合大批量样品的检测,而荧光SSR标记技术具有效率高、准确度高、自动化程度高等优点,已成功应用于多种作物父本鉴定及亲缘关系分析[15]。党志国等[16]选择13个主要杧果品种混合种植进行自然授粉,获得1001 个F1后代,并使用SSR 标记成功进行杂交种鉴定。然而,该研究中授粉环境相对开放,杂交鉴定和亲和性评估可能受到外部花粉的影响。因此笔者在本研究中采用将多个品种置于同一罩网内进行控制授粉,并基于荧光SSR 标记对杧果控制授粉实生后代进行父本鉴定,以期为杧果杂交育种和分子标记辅助育种提供参考。
1 材料和方法
1.1 材料
材料种植于中国热带农业科学院南亚热带作物研究所杧果种质资源圃内,选择12个品种(Irwin、台农1 号、热农1 号、Kensington Pride、Zillate、Palmer、Dashehari、Zill、粤西1号、东镇红杧、桂杧1号、Tommy Atkins)进行混合嫁接,所有品种均置于同一罩网内,通过饲养苍蝇进行控制授粉,有效阻隔外界花粉的干扰。2024 年6—8 月,从10 个母本品种中成功收获136个果实,经播种后获得113株实生后代群体,编号H1~H113。
1.2 基因组DNA提取
采用改良CTAB法提取113株实生后代及12个候选亲本基因组DNA,用1%琼脂糖凝胶和Nano Drop One(Thermo Scientific)检测DNA的质量和浓度,统一调整DNA 浓度(ρ)为30 ng·μL-1,-20 ℃冰箱保存备用。
1.3 SSR引物与PCR扩增
笔者课题组前期以Alphonso 参考基因组成功开发杧果SSR标记,从开发的引物中选择10对峰图易读、重复性好、多态性高的SSR引物用于本次研究(表1)。试验所用SSR 引物合成与5′端不同荧光标记修饰均由上海生工生物工程有限公司完成。
表1 SSR 引物基本信息
Table 1 Detailed information of SSR primers
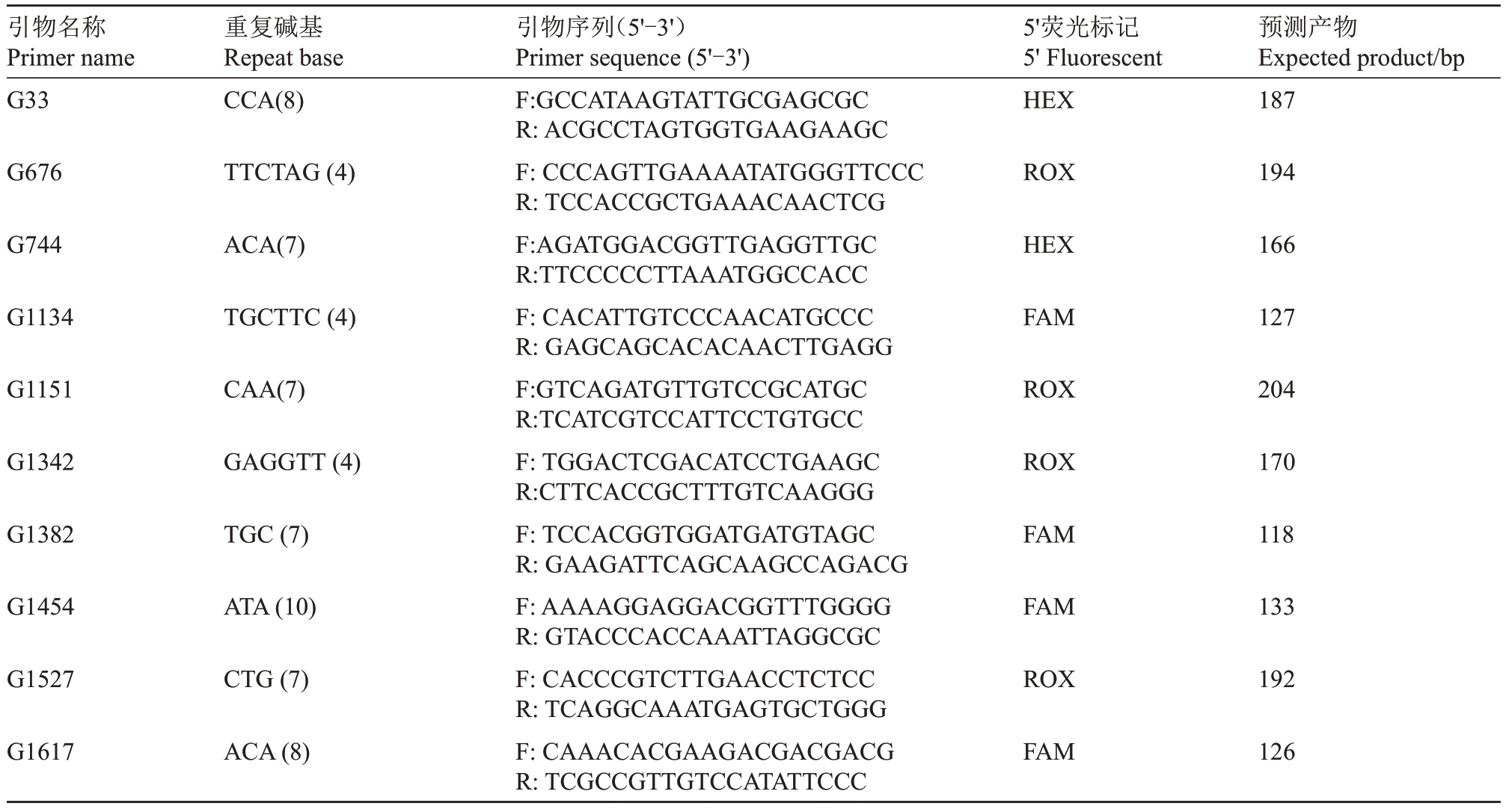
引物名称Primer name G33重复碱基Repeat base CCA(8)5'荧光标记5'Fluorescent HEX预测产物Expected product/bp 187 G676 TTCTAG(4)ROX 194 G744 ACA(7)HEX 166 G1134 TGCTTC(4)FAM 127 G1151 CAA(7)ROX 204 G1342 GAGGTT(4)ROX 170 G1382 TGC(7)FAM 118 G1454 ATA(10)FAM 133 G1527 CTG(7)ROX 192 G1617 ACA(8)引物序列(5'-3')Primer sequence(5'-3')F:GCCATAAGTATTGCGAGCGC R:ACGCCTAGTGGTGAAGAAGC F:CCCAGTTGAAAATATGGGTTCCC R:TCCACCGCTGAAACAACTCG F:AGATGGACGGTTGAGGTTGC R:TTCCCCCTTAAATGGCCACC F:CACATTGTCCCAACATGCCC R:GAGCAGCACACAACTTGAGG F:GTCAGATGTTGTCCGCATGC R:TCATCGTCCATTCCTGTGCC F:TGGACTCGACATCCTGAAGC R:CTTCACCGCTTTGTCAAGGG F:TCCACGGTGGATGATGTAGC R:GAAGATTCAGCAAGCCAGACG F:AAAAGGAGGACGGTTTGGGG R:GTACCCACCAAATTAGGCGC F:CACCCGTCTTGAACCTCTCC R:TCAGGCAAATGAGTGCTGGG F:CAAACACGAAGACGACGACG R:TCGCCGTTGTCCATATTCCC FAM 126
PCR 扩增反应体系为20 μL,包含2 μL DNA模板(30 ng·μL-1),0.5 μL 上游引物(10 μmol·L-1),0.5 μL 下游引物(10 μmol·L-1),10 μL 2×EasyTaq PCR SuperMix和7 μL超纯水。
PCR反应程序:94 ℃预变性5 min;94 ℃(30 s)/58 ℃(30 s)/72 ℃(30 s),35个循环,72 ℃延伸8 min;4 ℃保存待用。
PCR 产物毛细管电泳检测:PCR 扩增产物经过纯化后在ABI3730 基因测序仪上进行毛细管电泳,利用Genemapper Ⅴ4.0 软件进行片段大小读数;使用Peak Scanner Ⅴ1.0 软件(Applied Biosystems,USA)对获得的数据进行分析,以确定PCR 产物的准确片段大小。
1.4 数据处理
利用GenAlEx Ⅴ6.5软件计算遗传多样性参数,包括等位基因数(Na)、有效等位基因数(Ne)、香农信息指数(I)、观察杂合度(Ho)和期望杂合度(He)。利用Cervus Ⅴ3.07软件计算多态性信息含量(PIC)、非亲排除概率(NEP),并计算累计排除概率(CEP),仅当CEP达到或超过99%时,可用于亲子鉴定分析[17]。利用Powermaker Ⅴ3.25 计算Nei’s 遗传距离,并生成UPGMA聚类树;利用R Ⅴ4.3.2语言包ggtree进行UPGMA聚类树的美化。
1.5 父本鉴定
利用Cervus Ⅴ3.07计算亲本及控制授粉实生后代等位基因频率;在Simulation 程序中选择并运行Paternity 子程序,按要求输入亲本及控制授粉实生后代等位基因频率分析文件,参数设置为:亲子模拟10 000 次,候选父本12.0,候选父本的采样比0.096,匹配位点比0.99,基因型错误率0.01,检测自花授粉;在Parentage Analysis 程序中选择运行Paternity子程序,按要求逐步输入子代及候选父本基因型文件、等位基因频率分析结果和模拟分析结果,以进行最优父本匹配。
2 结果与分析
2.1 SSR位点的多态性及非亲排除概率检测
10对SSR引物在125份杧果资源中(113株杧果实生后代及12 个候选父本)检测到54 个等位基因(Na),平均每个标记检测到5.4个等位基因;有效等位基因数(Ne)变化范围为2.127~3.627,平均为2.825,其中G676、G1382、G33 和G1151 具有较高的有效等位基因数,表明这些位点有较强的检测效率;香农指数(I)变化范围为0.926~1.428,平均为1.185;观测杂合度(Ho)和期望杂合度(He)均值分别为0.689 和0.632;多态性信息含量(PIC)变化范围为0.452~0.677,平均为0.575,其中7 对引物PIC 大于0.5,为高多态性引物(表2)。以上结果表明,杧果控制授粉系有丰富的遗传多样性。图1展示了部分后代在荧光引物G1454中的毛细管电泳图。
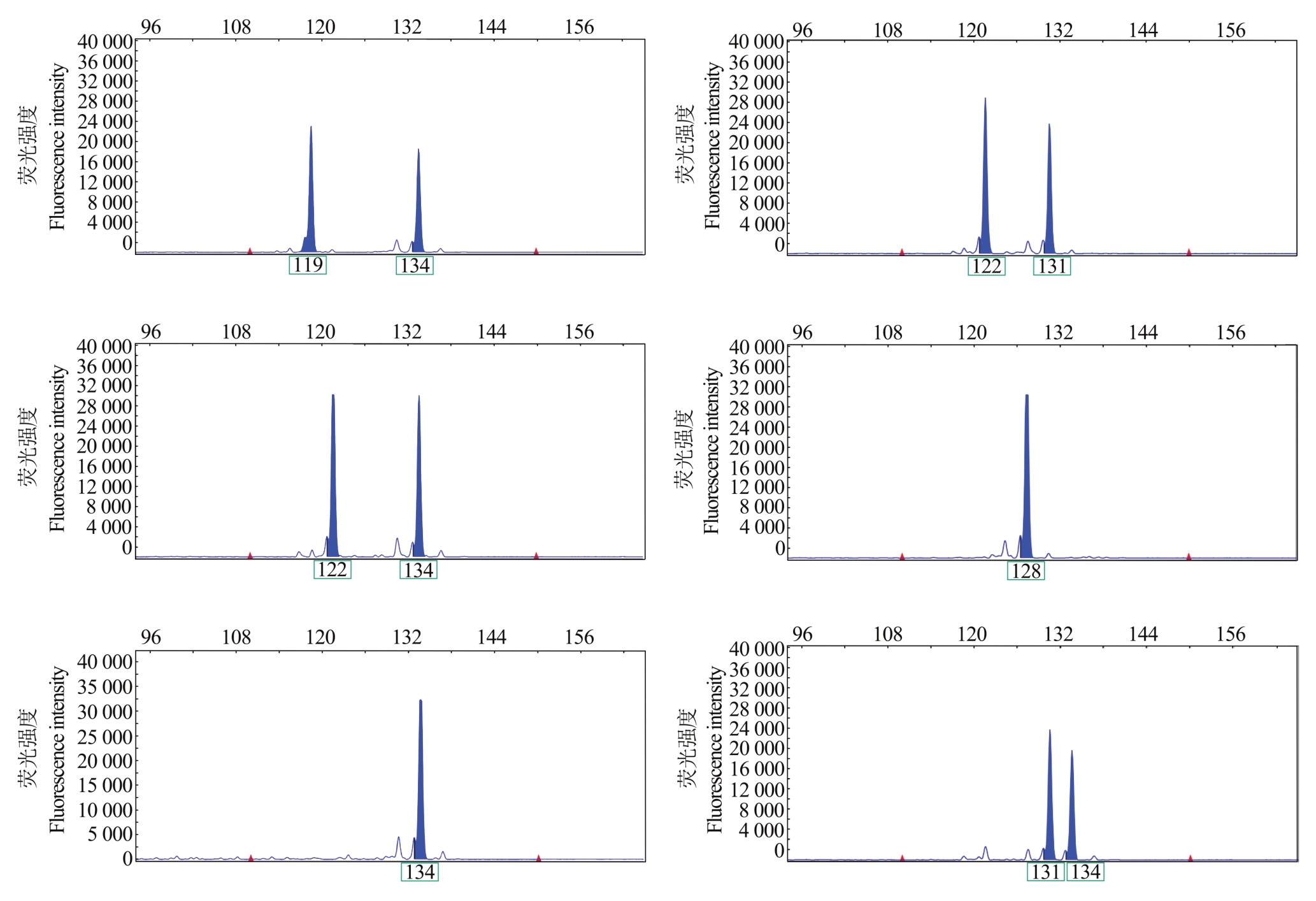
图1 荧光引物G1454 在部分后代中的基因型
Fig.1 The genotypes of fluorescent primer G1454 in partial progeny
表2 10 对SSR 引物在杧果控制授粉后代的遗传多样性
Table 2 Genetic diversity in progeny of controlled pollination in mango using 10 pairs of SSR primers
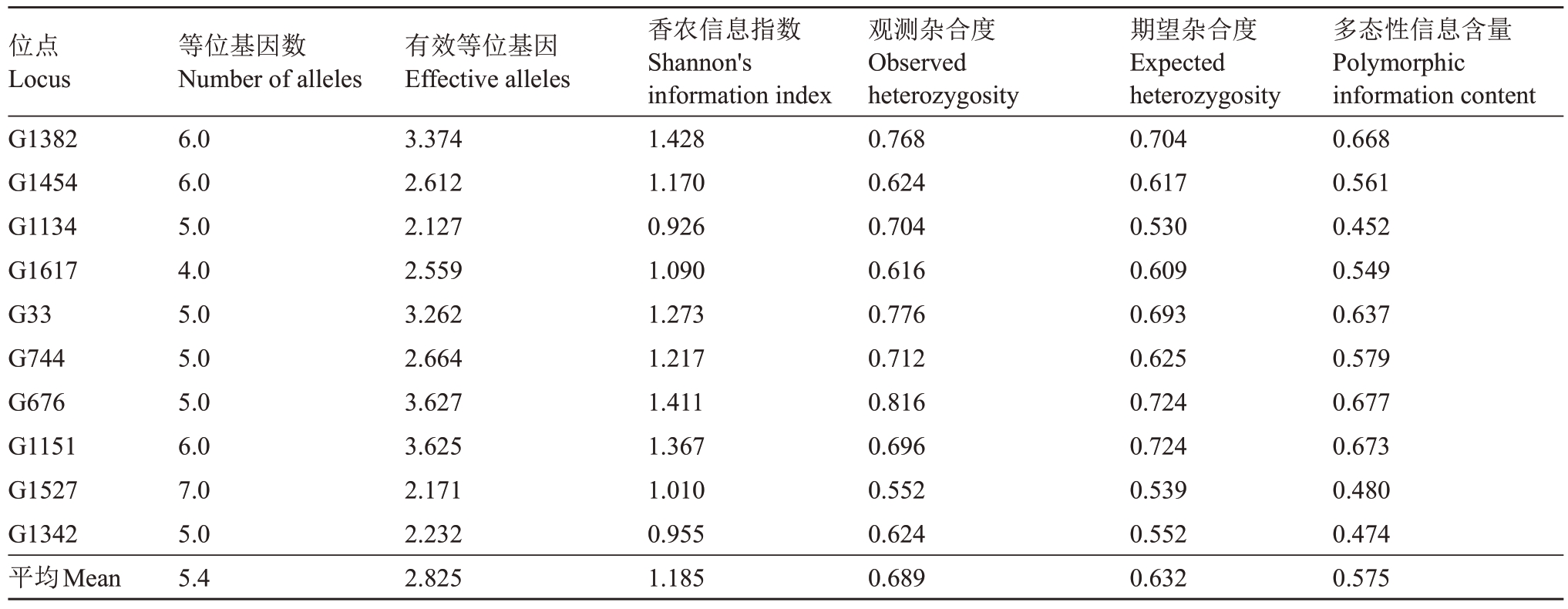
位点Locus G1382 G1454 G1134 G1617 G33 G744 G676 G1151 G1527 G1342平均Mean等位基因数Number of alleles 6.0 6.0 5.0 4.0 5.0 5.0 5.0 6.0 7.0 5.0 5.4有效等位基因Effective alleles 3.374 2.612 2.127 2.559 3.262 2.664 3.627 3.625 2.171 2.232 2.825香农信息指数Shannon's information index 1.428 1.170 0.926 1.090 1.273 1.217 1.411 1.367 1.010 0.955 1.185观测杂合度Observed heterozygosity 0.768 0.624 0.704 0.616 0.776 0.712 0.816 0.696 0.552 0.624 0.689期望杂合度Expected heterozygosity 0.704 0.617 0.530 0.609 0.693 0.625 0.724 0.724 0.539 0.552 0.632多态性信息含量Polymorphic information content 0.668 0.561 0.452 0.549 0.637 0.579 0.677 0.673 0.480 0.474 0.575
基于10对SSR引物计算亲权排除概率,结果显示,当母本与父本基因型未知时,单个位点的非亲排除概率(NE-1P)变化范围在0.689~0.856 之间;当母本或父本基因型已知时,单个位点的非亲排除概率(NE-2P)的变化范围在0.515~0.736 之间;当母本与父本基因型已知时,单个位点的非亲排除概率(NEPP)变化范围为0.319~0.597(表3)。根据引物的PIC 从高到低排序,逐步累计计算10 对SSR 引物的非亲排除概率,随着位点数量的增加,累计排除概率也相应提高(表3)。10对SSR引物的母本与父本基因型未知单亲累计排除概率CE-1P仅达到92.36%;在已知单个亲本或者已知双亲的情况下,10对SSR引物累计排除概率均在99%以上(表3)。
表3 杧果父本鉴定非亲排除概率和累计排除概率
Table 3 Exclusion probability and cumulative exclusion probability of paternity testing of mango
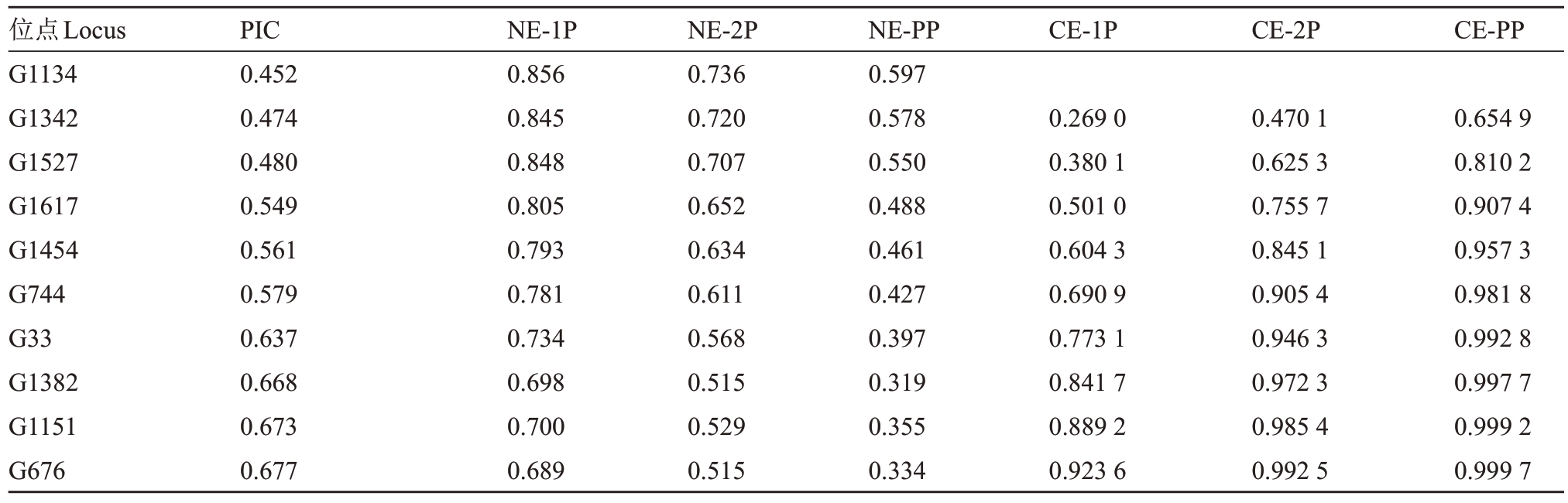
注:NE-1P.双亲基因型皆未知的非亲排除概率;NE-2P.已知一个亲本基因型的非亲排除概率;NE-PP.双亲基因型已知的非亲排除概率;CE-1P.双亲基因型皆未知的累计排除概率;CE-2P.已知一个亲本基因型的累计排除概率;CE-PP.双亲基因型已知的累计排除概率。
Note:NE-1P.Non-parental exclusion probability when both parental genotypes are unknown;NE-2P.Non-parental exclusion probability when one parental genotype is known;NE-PP.Non-parental exclusion probability when both parental genotypes are known;CE-1P.Cumulative exclusion probability when both parental genotypes are unknown;CE-2P.Cumulative exclusion probability when one parental genotype is known;CE-PP.Cumulative exclusion probability when both parental genotypes are known.
位点Locus G1134 G1342 G1527 G1617 G1454 G744 G33 G1382 G1151 G676 PIC 0.452 0.474 0.480 0.549 0.561 0.579 0.637 0.668 0.673 0.677 NE-1P 0.856 0.845 0.848 0.805 0.793 0.781 0.734 0.698 0.700 0.689 NE-2P 0.736 0.720 0.707 0.652 0.634 0.611 0.568 0.515 0.529 0.515 NE-PP 0.597 0.578 0.550 0.488 0.461 0.427 0.397 0.319 0.355 0.334 CE-1P CE-2P CE-PP 0.654 9 0.810 2 0.907 4 0.957 3 0.981 8 0.992 8 0.997 7 0.999 2 0.999 7 0.269 0 0.380 1 0.501 0 0.604 3 0.690 9 0.773 1 0.841 7 0.889 2 0.923 6 0.470 1 0.625 3 0.755 7 0.845 1 0.905 4 0.946 3 0.972 3 0.985 4 0.992 5
2.2 父本鉴定
利用Cervus Ⅴ3.07 对113 株杧果控制授粉系后代进行父本鉴定,结果显示,在80%和95%的置信度下,临界LOD 值分别为1.13 和4.36,表明当候选亲本的LOD 值超过1.13 时,鉴定可信度为80%;当LOD值超过4.36时,可信度提升至95%。在80%置信度下,113 株杧果后代中有95 株子代成功鉴定出最优父本,鉴定成功率为84.07%。其中,仅12 株子代存在1 个错配位点;在这95 株子代中,杂交后代80 株,占比84.21%,自交后代15 株,占比15.79%。在95%置信度下,有47 株子代成功鉴定到最优父本,鉴定成功率为41.59%。其中,5株子代存在1个错配位点;在这47 株子代中,杂交后代44 株,占比93.62%,自交后代3株,占比6.38%(表4)。
表4 杧果控制授粉实生后代置信度95%父本鉴定结果
Table 4 Paternal identification results with 95%confidence in progeny of controlled pollination in mango

编号Number H12 H17 H18 H19 H22 H23 H29 H30 H31 H32 H33 H44 H47 H48 H49 H50 H51 H52 H53 H55 H59 H60 H61 H63 H64 H65 H67 H68 H69 H70 H72 H75 H77 H80 H81 H83 H87 H89 H90 H91 H92 H95 H96 H101 H103 H105 H110子代名称Offspring name 5-Zill-3 6-台农1号-1 6-Tainong No.1-1 6-台农1号-2 6-Tainong No.1-2 6-台农1号-3 6-Tainong No.1-3 9-台农1号-1 9-Tainong No.1-1 10-Tommy Atkins-1 13-Zill-2 14-Zill-1 17-Zill-1 17-Zill-2 17-Zill-3 26-Zill-1 28-Zill-3 28-Zill-4 28-Zill-5 28-热农1号-1 28-Renong No.1-1 30-热农1号-1 30-Renong No.1-1 30-热农1号-2 30-Renong No.1-2 31-Irwin-1 31-台农1号-1 31-Tainong No.1-1 34-桂杧1号-2 34-Guimang No.1-2 34-桂杧1号-3 34-Guimang No.1-3 34-桂杧1号-4 34-Guimang No.1-4 34-桂杧1号-6 34-Guimang No.1-6 34-桂杧1号-7 34-Guimang No.1-7 34-桂杧1号-8 34-Guimang No.1-8 34-桂杧1号-10 34-Guimang No.1-10 34-桂杧1号-11 34-Guimang No.1-11 34-桂杧1号-12 34-Guimang No.1-12 34-桂杧1号-13 34-Guimang No.1-13 34-桂杧1号-15 34-Guimang No.1-15 35-桂杧1号-2 35-Guimang No.1-2 36-Zill-1 37-Zillate-1 37-Zillate-2 38-桂杧1号-2 38-Guimang No.1-2 38-桂杧1号-6 38-Guimang No.1-6 38-桂杧1号-8 38-Guimang No.1-8 38-Zill-1 38-Zill-2 38-Zill-3 40-桂杧1号-2 40-Guimang No.1-2 40-桂杧1号-3 40-Guimang No.1-3 41-桂杧1号-1 41-Guimang No.1-1 42-Irwin-1 Irwin-3台农1号-4 Tainong No.1-4母本Mother Zill台农1号Tainong No.1台农1号Tainong No.1台农1号Tainong No.1台农1号Tainong No.1 Tommy Atkins Zill Zill Zill Zill Zill Zill Zill Zill Zill热农1号Renong No.1热农1号Renong No.1热农1号Renong No.1 Irwin台农1号Tainong No.1桂杧1号Guimang No.1桂杧1号Guimang No.1桂杧1号Guimang No.1桂杧1号Guimang No.1桂杧1号Guimang No.1桂杧1号Guimang No.1桂杧1号Guimang No.1桂杧1号Guimang No.1桂杧1号Guimang No.1桂杧1号Guimang No.1桂杧1号Guimang No.1桂杧1号Guimang No.1 Zill Zillate Zillate桂杧1号Guimang No.1桂杧1号Guimang No.1桂杧1号Guimang No.1 Zill Zill Zill桂杧1号Guimang No.1桂杧1号Guimang No.1桂杧1号Guimang No.1 Irwin Irwin台农1号Tainong No.1最优父本Candidate father热农1号Renong No.1 Irwin热农1号Renong No.1 Palmer热农1号Renong No.1台农1号Tainong No.1热农1号Renong No.1台农1号Tainong No.1 Zill Zill Tommy Atkins Zill热农1号Renong No.1桂杧1号Guimang No.1热农1号Renong No.1 Tommy Atkins桂杧1号Guimang No.1桂杧1号Guimang No.1 Zill Irwin Zill台农1号Tainong No.1 Zill热农1号Renong No.1台农1号Tainong No.1 Zillate Zill热农1号Renong No.1 Zill Irwin Irwin热农1号Renong No.1 Zillate桂杧1号Guimang No.1热农1号Renong No.1热农1号Renong No.1热农1号Renong No.1热农1号Renong No.1桂杧1号Guimang No.1东镇红杧Dongzhenhong热农1号Renong No.1热农1号Renong No.1热农1号Renong No.1热农1号Renong No.1 Tommy Atkins热农1号Renong No.1热农1号Renong No.1 LOD值Trio LOD score 5.70 4.74 5.23 6.60 5.85 5.06 5.14 9.71 5.02 4.74 6.71 4.72 5.03 6.47 4.43 8.65 7.82 7.88 5.47 4.51 4.36 4.70 4.49 4.51 11.00 9.85 5.74 4.51 5.48 5.38 5.43 4.75 7.61 6.90 4.57 4.41 5.85 4.68 5.83 8.45 4.64 6.00 4.57 4.72 8.36 4.43 5.93自交或杂交Hybridize or selfing杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize自交Selfing自交Selfing杂交Hybridize自交Selfing杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize杂交Hybridize
2.3 亲本与杧果实生后代聚类分析
根据10对SSR引物在杂交后代中的扩增结果,对95 株鉴定出最优父本的后代及10 个亲本进行UPGMA聚类分析,并根据后代的母本分组,不同母本后代用不同颜色表示(图2)。结果显示,大多数后代与其父本或母本聚集在一起,呈现出明显的遗传亲缘关系。以Zill为母本的后代大多与母本的遗传距离较近,表现出偏母本的遗传趋势,这些后代通常与Zill聚集在一起,而不是与其父本聚在一起,如H3、H34、H35等与母本Zill聚集在一起;以桂杧1号为母本的后代也多数与母本聚在一起,显示出偏母本的遗传趋势,少数子代如H70则更接近父本,表现出偏父本的遗传趋势;以Dashehari为母本的后代全部与母本聚集,呈现出典型的偏母本遗传;以热农1号为母本的后代也大都表现出偏母本遗传趋势;此外,有些后代并未与母本聚集,且与父本的遗传距离也较远,表现出较为独立的遗传模式,如H10、H18和H22等(图2)。
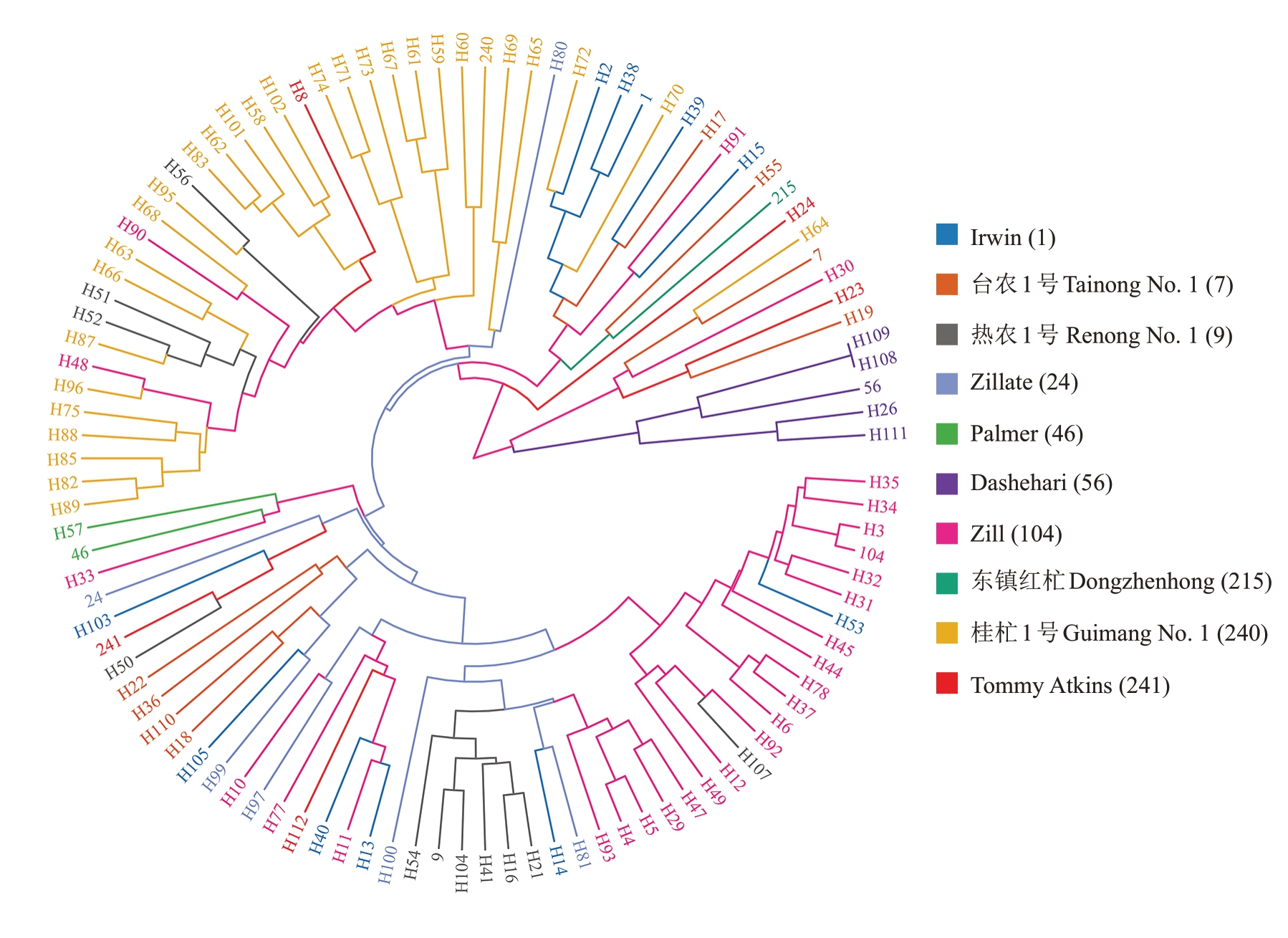
图2 杧果实生后代与亲本聚类分析
Fig.2 Cluster analysis of mango seedling progeny and parents
3 讨 论
在苗期对实生后代进行父本鉴定,可以通过早期筛选优良后代,减少资源浪费,加快育种进程,从而提高育种效率和精确性[15,18]。SSR分子标记技术已广泛应用于品种鉴定、遗传多样性分析以及动植物的亲权分析等领域[19-20]。在父本鉴定方面,王斯琪等[21]基于SSR 标记技术对枣树子代苗进行了父本鉴定,探讨了不同引物数量对父本鉴定结果的影响,并建立了一套完善的父本鉴定体系。邵文豪等[22]利用SSR标记技术分析了4个主要栽培品种子代的父本关系,结果显示主要父本为豆果和小苹果,并发现城固32具有一定的自交亲和性,为油橄榄品种的配置提供了重要参考。笔者在本研究中基于10对SSR标记,在113株控制授粉实生后代中成功鉴定出95株子代的最优父本,鉴定成功率为84.07%,且置信度均超过80%;其中杂交后代80株,占比84.21%,自交后代15株,占比15.79%。在置信度达到95%时,47 株子代成功鉴定出最优父本,鉴定成功率为41.59%;其中杂交后代44 株,占比93.62%,自交后代3 株,占比6.38%。研究结果表明,杧果具备杂交结实和自交结实能力,其中以杂交结实为主,且杂交后代的比例高达84.21%,显著高于李春牛等[23]在茉莉花中报道的80.49%。有研究表明,杧果具有隐蔽自交不亲和性,即可以自花授粉,但异花授粉是优先选择,这可能是造成杧果以杂交结实为主的原因之一[24]。
聚类分析可以系统性地揭示杂交后代群体内部的遗传多样性与结构,明确亲本与后代之间的遗传关系,已广泛应用于龙眼[25]、姜荷花[26]、番石榴[27]和枣[28]等作物。笔者在本研究中对95 株成功鉴定出最优父本的后代及10 个亲本进行了UPGMA 聚类分析,结果表明,大多数后代与其父本、母本聚集在一起,表现出明显的遗传倾向。以Zill 为母本的后代大多聚集在母本附近,表现出偏母本遗传,如H3、H34、H35 等与母本Zill 聚集在一起;同样,以桂杧1号为母本的后代大部分也与母本聚集,显示出偏母本遗传。已有研究表明,杧果人工杂交群体中部分个体存在偏父本遗传现象[15],表明遗传偏向可能因亲本组合特异性或遗传背景差异而有所变化。此外,H10、H18 和H22 等既未与母本也未与父本紧密聚集,可能与复杂的遗传背景或突变相关。这些结果直观地展现了后代的遗传分类及父母本的遗传贡献,对杂交群体的遗传多样性分析和优良品种的选育具有重要意义。然而,本研究中的实生后代群体规模相对较小,且由于部分品种存在花期不匹配和花粉活力低等问题导致两个品种未能成功作为有效亲本参与杂交。因此,有必要扩大控制授粉实生后代群体数量,为杧果杂交育种和新品种选育提供更坚实的研究基础。
4 结 论
笔者在本研究中利用SSR荧光引物结合毛细管电泳技术对杧果控制授粉实生后代进行了父本鉴定,95 株实生后代匹配到了最优父本,鉴定成功率为84.07%,置信度均在80%以上;对鉴定出最优父本的95株后代及10个亲本进行聚类分析,结果表明其后代表现为偏母本或偏父本遗传趋势,研究结果为杧果种质创新和新品种选育提供了参考依据。
[1] THARANATHAN R N,YASHODA H M,PRABHA T N. Mango (Mangifera indica L.),“The king of fruits”:An overview[J].Food Reviews International,2006,22(2):95-123.
[2] XU B,WU S J.Preservation of mango fruit quality using fucoidan coatings[J]. LWT-Food Science and Technology,2021,143:111150.
[3] 陈业渊,党志国,林电,胡美姣,黄建峰,朱敏,张贺,韩冬银,高爱平,高兆银,黄媛媛.中国杧果科学研究70 年[J].热带作物学报,2020,41(10):2034-2044.CHEN Yeyuan,DANG Zhiguo,LIN Dian,HU Meijiao,HUANG Jianfeng,ZHU Min,ZHANG He,HAN Dongyin,GAO Aiping,GAO Zhaoyin,HUANG Yuanyuan. Mango scientific research in China in the past 70 years[J]. Chinese Journal of Tropical Crops,2020,41(10):2034-2044.
[4] 罗睿雄,黄建峰,高爱平.我国芒果种质资源研究进展[J].中国热带农业,2013(1):10-13.LUO Ruixiong,HUANG Jianfeng,GAO Aiping.Research progress of mango germplasm resources in China[J]. China Tropical Agriculture,2013(1):10-13.
[5] 卿昊炜,黎明,易晨歆,张树伟,郭慧勤,彭宏祥,丁峰.荔枝、龙眼育种研究进展[J].中国南方果树,2024,53(3):1-6.QING Haowei,LI Ming,YI Chenxin,ZHANG Shuwei,GUO Huiqin,PENG Hongxiang,DING Feng.Research progress of litchi and longan breeding[J]. South China Fruits,2024,53(3):1-6.
[6] BALLY I S,LU P,JOHNSON P R. Mango breeding[M]. New York:Springer,2009:51-82.
[7] MICHAEL ⅤN,CRANE J,FREEMAN B,KUHN D,CHAMBERS A H.Mango seedling genotyping reveals potential self-incompatibility and pollinator behavior[J]. Scientia Horticulturae,2023,308:111599.
[8] KUHN D N,BALLY I S E,DILLON N L,INNES D,GROH A M,RAHAMAN J,OPHIR R,COHEN Y,SHERMAN A.Genetic map of mango:A tool for mango breeding[J]. Frontiers in Plant Science,2017,8:577.
[9] ZHANG J,YANG J J,LⅤY L,ZHANG X F,XIA C X,ZHAO H,WEN C L. Genetic diversity analysis and variety identification using SSR and SNP markers in melon[J].BMC Plant Biology,2023,23(1):39.
[10] 丁燕,木万福,杨龙,张鹏,管俊娇. 花菜类杂交种纯度鉴定SSR 核心引物筛选[J].中国种业,2021(11):79-84.DING Yan,MU Wanfu,YANG Long,ZHANG Peng,GUAN Junjiao. Screening of SSR core primers for purity identification of cauliflower hybrids[J].China Seed Industry,2021(11):79-84.
[11] 张咏琦,王超,许林林,吴娥娇,李天红,赵密珍,袁华招.野生二倍体草莓的SSR 分子标记开发及核心种质的构建[J].园艺学报,2023,50(11):2365-2375.ZHANG Yongqi,WANG Chao,XU Linlin,WU Ejiao,LI Tianhong,ZHAO Mizhen,YUAN Huazhao. Development of SSR molecular markers and construction of core collection of wild diploid strawberry[J]. Acta Horticulturae Sinica,2023,50(11):2365-2375.
[12] 唐玉娟,罗世杏,黄国弟,宋恩亮,李日旺,赵英,张宇,莫永龙,唐莹莹.基于SSR 荧光标记的杧果种质资源遗传多样性分析及分子身份证构建[J]. 热带作物学报,2023,44(11):2292-2304.TANG Yujuan,LUO Shixing,HUANG Guodi,SONG Enliang,LI Riwang,ZHAO Ying,ZHANG Yu,MO Yonglong,TANG Yingying. Genetic diversity analysis and molecular ID construction of mango germplasm based on SSR fluorescence markers[J].Chinese Journal of Tropical Crops,2023,44(11):2292-2304.
[13] DILLON N L,BALLY I S E,WRIGHT C L,HUCKS L,INNES D J,DIETZGEN R G.Genetic diversity of the Australian national mango genebank[J]. Scientia Horticulturae,2013,150:213-226.
[14] YAMANAKA S,HOSAKA F,MATSUMURA M,ONOUEMAKISHI Y,NASHIMA K,URASAKI N,OGATA T,SHODA M,YAMAMOTO T.Genetic diversity and relatedness of mango cultivars assessed by SSR markers[J]. Breeding Science,2019,69(2):332-344.
[15] LI X,ZHENG B,XU W T,MA X W,WANG S B,QIAN M J,WU H X. Identification of F1 hybrid progenies in mango based on fluorescent SSR markers[J].Horticulturae,2022,8(12):1122.
[16] 党志国,郑燕萍,朱敏,陈业渊,高爱平,黄建峰,罗睿雄,余东,雷新涛.利用SSR 技术鉴定杧果实生后代真假杂种及其遗传特性分析[J].果树学报,2024,41(12):2397-2407.DANG Zhiguo,ZHENG Yanping,ZHU Min,CHEN Yeyuan,GAO Aiping,HUANG Jianfeng,LUO Ruixiong,YU Dong,LEI Xintao. Identification of true hybrids of open-pollination seedling progenies in mango and genetic characterization of the progenies using SSR markers[J]. Journal of Fruit Science,2024,41(12):2397-2407.
[17] ⅤANKAN D M,FADDY M J.Estimations of the efficacy and reliability of paternity assignments from DNA microsatellite analysis of multiple-sire matings[J]. Animal Genetics,1999,30(5):355-361.
[18] JIA P P,LIU S H,LIN W Q,YU H L,ZHANG X M,XIAO X O,SUN W S,LU X H,WU Q S.Authenticity identification of F1 hybrid offspring and analysis of genetic diversity in pineapple[J].Agronomy,2024,14(7):1490.
[19] LI X X,QIAO L J,CHEN B R,ZHENG Y J,ZHI C C,ZHANG S Y,PAN Y P,CHENG Z H. SSR markers development and their application in genetic diversity evaluation of garlic (Allium sativum)germplasm[J].Plant Diversity,2022,44(5):481-491.
[20] 王敏,张新浩,崔冉,刘宇,杨莉,李海静,赵春江.利用微卫星标记鉴定德州驴亲子关系[J]. 中国畜牧兽医,2019,46(7):2003-2011.WANG Min,ZHANG Xinhao,CUI Ran,LIU Yu,YANG Li,LI Haijing,ZHAO Chunjiang. Parentage testing of Dezhou donkey with microsatellite marker[J].China Animal Husbandry&Ⅴeterinary Medicine,2019,46(7):2003-2011.
[21] 王斯琪,唐诗哲,孔德仓,贺润平,刘华波,麻丽颖,刘君,王哲,李颖岳,申连英,庞晓明.利用SSR 标记进行枣树子代苗父本鉴定[J].园艺学报,2012,39(11):2133-2141.WANG Siqi,TANG Shizhe,KONG Decang,HE Runping,LIU Huabo,MA Liying,LIU Jun,WANG Zhe,LI Yingyue,SHEN Lianying,PANG Xiaoming.Application of SSR markers for the identification of paternal parent for the seedlings of Chinese jujube[J].Acta Horticulturae Sinica,2012,39(11):2133-2141.
[22] 邵文豪,王兆山,张建国.基于SSR 标记的油橄榄主要栽培品种子代父本分析[J].林业科学研究,2020,33(3):22-30.SHAO Wenhao,WANG Zhaoshan,ZHANG Jianguo. Paternity analysis of main olive cultivars progenies based on SSR markers[J].Forest Research,2020,33(3):22-30.
[23] 李春牛,苏群,李先民,黄展文,孙明艳,卢家仕,王虹妍,卜朝阳.茉莉花全基因组SSR 标记开发及其亲缘关系鉴定[J].园艺学报,2024,51(10):2343-2357.LI Chunniu,SU Qun,LI Xianmin,HUANG Zhanwen,SUN Mingyan,LU Jiashi,WANG Hongyan,BU Zhaoyang. SSR molecular markers development and parentage relationship identification based on whole genomic sequences of Jasminum sambac[J].Acta Horticulturae Sinica,2024,51(10):2343-2357.
[24] PÉREZ Ⅴ,HERRERO M,HORMAZA J I. Self-fertility and preferential cross-fertilization in mango (Mangifera indica)[J].Scientia Horticulturae,2016,213:373-378.
[25] 黄爱萍,郑少泉.龙眼杂交后代果肉黄酮含量的遗传倾向研究与优株筛选[J].热带作物学报,2011,32(9):1595-1599.HUANG Aiping,ZHENG Shaoquan.Hereditary tendency of aril flavonoid in longan hybrid progenies and superior selection[J].Chinese Journal of Tropical Crops,2011,32(9):1595-1599.
[26] 江素华,吴雨欣,罗锦榕,叶悦娟,林金水,余惠文,陆銮眉.姜荷花杂交子代的SSR 鉴定及遗传多样性分析[J].热带作物学报,2024,45(5):928-935.JIANG Suhua,WU Yuxin,LUO Jinrong,YE Yuejuan,LIN Jinshui,YU Huiwen,LU Luanmei.Identification and genetic diversity analysis of hybrid offsprings of Curcuma alismatifolia revealed by SSR markers[J]. Chinese Journal of Tropical Crops,2024,45(5):928-935.
[27] 黄婉莉,张冬敏,符喜喜,陈心怡,张朝坤.番石榴杂交F1代基于SRAP 标记的鉴定及果实性状的遗传倾向分析[J].果树学报,2024,41(9):1731-1745.HUANG Wanli,ZHANG Dongmin,FU Xixi,CHEN Xinyi,ZHANG Chaokun.Identification by SRAP and genetic tendency analysis of fruit characteristics of hybrids in guava[J].Journal of Fruit Science,2024,41(9):1731-1745.
[28] 潘依玲,鲍荆凯,陈万年,吴翠云,王玖瑞,刘孟军,闫芬芬.枣JMS2×交城5 号F1代果实性状遗传分析与优系筛选[J].果树学报,2023,40(6):1085-1098.PAN Yiling,BAO Jingkai,CHEN Wannian,WU Cuiyun,WANG Jiurui,LIU Mengjun,YAN Fenfen. Genetic analysis of fruit traits and selection of superior lines in F1 generation of jujube JMS2 × Jiaocheng 5[J]. Journal of Fruit Science,2023,40(6):1085-1098.