核桃(Juglans regia L.)在全球范围内广泛种植,尤其在中国,核桃产业已成为推动地方经济发展、促进农民增收、优化产业结构的重要支柱。然而,核桃产业的持续健康发展,却面临着诸多挑战,其中,黑斑病的频繁暴发与蔓延,对核桃的产量和品质构成严重威胁。核桃黑斑病,由黄单胞菌属尤其是核桃专化型黄单胞杆菌(Xanthomonas arboricola pv. juglandis)引起的,是全球核桃产业的一大威胁。病菌通过风雨、昆虫传播,侵害叶片、嫩梢和果实,形成褐色或黑色病斑,严重时会导致组织坏死、病斑凹陷。核桃黑斑病的发病早晚及发病程度与温度、湿度有关。在足够的湿度条件下,细菌侵染叶片的温度范围为4~30 ℃,侵染幼果的为5~27 ℃。病菌的潜育期在不同部位也有差异,果实上为5~34 d,叶片上为8~18 d,但通常在大田环境下,这一过程15 d即可完成;从发病时间上看,核桃黑斑病从5月上旬至6月上旬开始发病,直至7 月下旬至8 月上旬,其间会反复侵染多次,核桃黑斑病的发病期一般为4—8月。黑斑病不仅破坏核桃外观品质,导致商业价值骤降,更严重的是造成产量锐减。因此,黑斑病已成为制约核桃产量稳定和品质提升的关键因素[1]。
核桃果实发生黑斑病会导致细胞内的活性氧逐步积累,对细胞膜系统造成伤害,严重时甚至会导致植物细胞死亡。可溶性糖(soluble sugar,SS)在植物体内扮演着重要的渗透调节剂角色,感病胁迫往往导致植物体内SS含量增加,以增强植物抗逆性。当植物被病原物及其代谢物侵染以后,一般都会抑制其体内正常蛋白质的合成;而可溶性蛋白(soluble protein,SP)含量的变化与其抗病性相关。脯氨酸(proline,Pro)在植物的对抗逆境的反应中,不仅可以作为渗透调节物质和能量来源,而且其含量也可以被用作评价植物抗病能力的标准。丙二醛(malondialdehyde,MDA)是植物膜脂过氧化产物,其含量能够较准确地反映植物受损伤的程度[2-4]。
苯丙烷代谢是植物次生代谢的核心,其产物包括酚类化合物、黄酮类和木质素等,既是植物结构成分,又具有强大的生物活性,对植物抗病、抗逆起着至关重要的作用。其中,苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)、肉桂酸-4-羟化酶(cinnamic acid 4-hydroxylase,C4H)和4-香豆酸辅酶A连接酶(4-coumarate-CoA ligase,4CL)是这一途径的关键调控酶。PAL 作为限速酶,催化苯丙氨酸转化为反式肉桂酸,启动整个苯丙烷代谢。C4H酶将反式肉桂酸转化为顺式肉桂酸,进一步进入多元酚合成路径。4CL酶则催化顺式肉桂酸与辅酶A结合生成肉桂酸-CoA,衍生出多种酚类和黄酮类化合物。在植物抗病防御中,苯丙烷代谢途径的激活常伴随着酚类物质的大量积累。这些物质可以直接抑制病原菌生长,或通过增强细胞壁硬度、形成物理屏障,防止病原菌入侵。此外,酚类物质还能作为信号分子,触发植物防御反应,诱导防御基因表达,增强系统性抗病性。已有研究揭示,不同核桃品种在应对黑斑病时,其苯丙烷代谢途径关键酶活性及酚类物质积累水平与抗病性能密切相关。如抗病品种在病原侵染后,PAL、C4H和4CL酶活性及次生代谢物木质素、类黄酮和总酚(total phenol,TP)含量显著高于感病品种,高效运转的苯丙烷代谢途径可能是抗病品种对抗黑斑病的重要机制[5-6]。
清香核桃(J.regia L.‘Qingxiang’)是目前在北方种植面积比较广泛的核桃品种,在中国核桃生产中具有比较好的发展前景,但是广大农户反映该品种在生产中较易感染核桃树黑斑病,发病率较高,对核桃树种植户造成了一定的损失。笔者在本试验中以清香核桃果实为研究对象,研究黑斑病病程中苯丙烷代谢途径中3种关键酶(PAL、C4H和4CL)的活性变化以及代谢途径中次生代谢物木质素、类黄酮和TP含量的变化,旨在揭示核桃果实在不同感病时期苯丙烷代谢的动态响应及其与抗病性的内在联系。通过深入了解这些关键酶在核桃防御黑斑病中的具体作用,为筛选抗黑斑病的核桃新种质提供一定的理论基础。
1 材料和方法
1.1 材料
材料品种为清香核桃,栽植于河南省济源市露地生产田,8年生植株。
1.2 方法
核桃坐果后30、60 和90 d 到生产田采集果实,共采集3 个时期。(1)对照材料(CK):无病核桃果实;(2)黑斑病感病材料(Xaj)(图1):感染黑斑病的核桃果实。两种材料分别采集30个核桃果实,放入泡沫箱低温冷藏带回实验室,放置到4 ℃冰箱中保存待用。
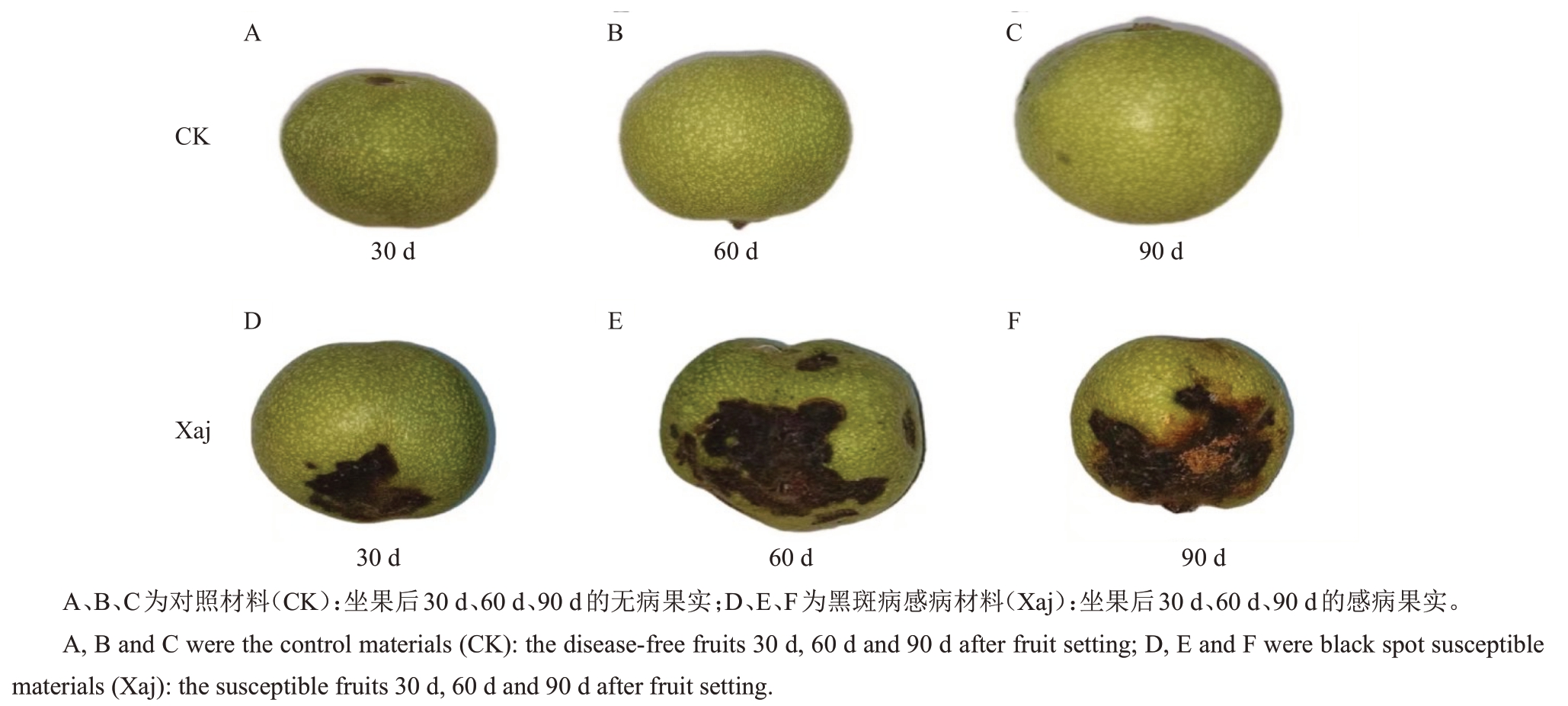
图1 黑斑病胁迫下不同发育时期的核桃果实
Fig.1 Walnut fruits at different developmental stages under black spot disease stress
1.2.1 黑斑病胁迫下核桃果实渗透调节物质和氧化物质含量的测定 SS、SP、Pro 和MDA 含量采用分光光度计法(722型分光光度计,上海仪电分析仪器有限公司)进行测定,测定试剂盒为BC0030、BC3180、BC0290 和BC0020(北京索莱宝科技有限公司)。具体操作步骤严格按照试剂盒说明书执行,3次重复。
1.2.2 黑斑病胁迫下核桃果实苯丙烷代谢途径关键酶活性的测定 苯丙烷代谢途径中PAL、C4H 和4CL 酶活性采用分光光度计法(721G 型分光光度计,上海仪电分析仪器有限公司)进行测定,测定试剂盒为BC0210、BC4080 和BC4220(北京索莱宝科技有限公司)。具体操作步骤严格按照试剂盒说明书执行,3次重复。
1.2.3 黑斑病胁迫下核桃果实苯丙烷代谢途径次生代谢物含量的测定 苯丙烷代谢途径次生代谢物中的木质素、类黄酮和TP含量均采用分光光度计法测定(木质素采用721G型分光光度计;类黄酮和TP采用722 型分光光度计,均为上海仪电分析仪器有限公司),由北京索莱宝科技有限公司提供试剂盒,试剂盒型号分别为BC4200、BC1330和BC1340。操作步骤严格按照试剂盒说明书执行,3次重复。
主要操作步骤:
(1)采集回来的核桃果实称取果仁0.1 g。
(2)将材料放在预冷的研钵中,加入1 mL 提取液,进行冰浴研磨。
(3)使用低温离心机进行离心,取上清液,置冰上待测。
(4)按照试剂盒说明书上的步骤和计算公式进行酶活测定以及计算(使用到紫外分光光度计、可见光分光光度计和水浴锅等)。
1.2.4 数据处理与分析 使用Excel 2019 处理数据,利用SPSS 20.0 分析数据,使用Origin 2022 软件绘图。
2 结果与分析
2.1 黑斑病胁迫下核桃果实发育不同时期渗透调节物质含量的变化
由图2-A 可以看出,30 d 时黑斑病感病胁迫条件下的SS 含量比CK 下降了24.36%,60 d 时黑斑病感病胁迫条件下比CK 上升30.48%,说明在感病条件下,病原菌的侵入可能会诱导植物体内小分子多糖的水解,造成SS含量增加,SS含量升高是一种感病的生理生化表现。核桃果实细胞中进行大量的物质积累,90 d时SS含量比CK显著降低(p<0.05)。
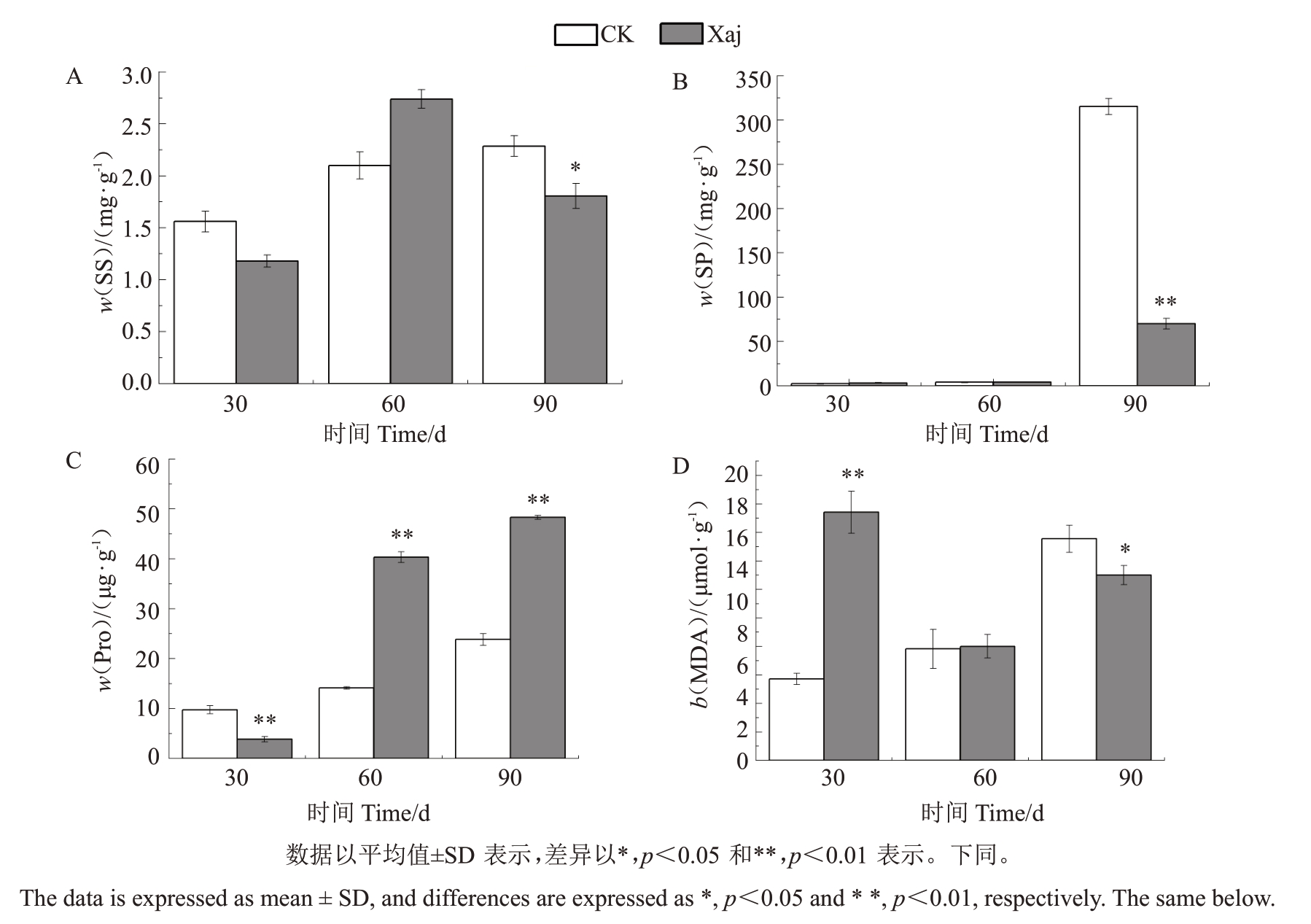
图2 黑斑病胁迫下核桃果实发育不同时期渗透调节物质含量的变化
Fig.2 Changes in the content of osmoregulatory substances during different stages of walnut fruit development under black spot disease stress
由图2-B可以看出,30 d时黑斑病感病胁迫条件下SP含量相比CK上升30.46%,60 d时SP含量上升仅2.23%,这可能是由于在感病条件下,病原菌的刺激激活植物体蛋白合成酶的活性,或者抑制了蛋白降解酶的活性,导致感病的组织细胞内SP 含量增加。而在90 d时SP含量极显著(p<0.01)下降了77.74%,可能是由于该时期黑斑病感病胁迫下,植株通过降解SP以参与抗病物质合成,进而增强抗病能力。
由图2-C 可以看出,30 d 时黑斑病感病胁迫条件下的Pro 含量比CK 极显著(p<0.01)降低了60.43%,由于Pro的含量较低,导致体内渗透平衡受影响,病原菌更容易入侵细胞。60 d 时黑斑病感病胁迫条件下的Pro 含量比CK 极显著(p<0.01)升高了185.15%,90 d时黑斑病感病胁迫条件下的Pro含量比CK极显著(p<0.01)升高102.60%,60 d和90 d时产生了大量的Pro。
由图2-D可以看出,MDA含量在30 d时黑斑病感病胁迫条件下比CK 极显著(p<0.01)升高200.98%,表明该时期细胞膜脂受损的程度较为严重,细胞膜的膜脂过氧化程度较强。MDA 含量在60 d时黑斑病感病胁迫条件下比CK仅升高2.34%,说明该时期细胞膜损伤程度减轻。MDA含量在90 d时黑斑病感病胁迫条件下比CK 降低16.33%,与同时期的CK 相比,黑斑病感病胁迫条件下显著降低(p<0.05)。
2.2 黑斑病胁迫下核桃果实发育不同时期苯丙烷代谢途径关键酶活性的变化
植物在应对生物胁迫的过程中,PAL 酶扮演着至关重要的角色。由图3-A可以看出,在30 d时,无论是Xaj还是CK,核桃果实的PAL酶活性都相对较低,变化不大。说明核桃此时处于刚感病的状态,体内的酶活性还处于比较稳定的状态,还未参与到抗病过程。感病1个月以后,Xaj中PAL酶活性极显著提升(p<0.01)。60 d 时,与同时期的CK 相比,Xaj的酶活性提升了34.1%。60 d与30 d相比,CK的酶活性提升了193%,而Xaj 的酶活性则提升了406.2%。核桃感病1 个月后PAL 酶活性提升明显,说明此时PAL 酶已经参与到核桃果实对黑斑病的调控过程中。植物体内PAL酶活性增强,有助于提高代谢途径内其他次生代谢物质的产量,以便于提高抗病性。到90 d时,CK与Xaj的PAL酶活性均下降明显,与CK 相比,Xaj 中的酶活性下降了19.3%。90 d与60 d相比,无论是Xaj还是CK,核桃体内PAL酶活性明显下降,CK 下降了57.1%,Xaj 下降了74.2%,说明核桃果实体内PAL 酶已经开始进入衰退期。从整体来看,当核桃遭受到病原微生物侵染后,核桃果实中PAL 酶活性的变化整体表现为先升高后降低的趋势,升高后会出现一个下降的现象。PAL 酶活性可能因反馈抑制或拮抗机制而下降,这是核桃果实为了保持代谢平衡和避免长期高成本防御的自我调节。
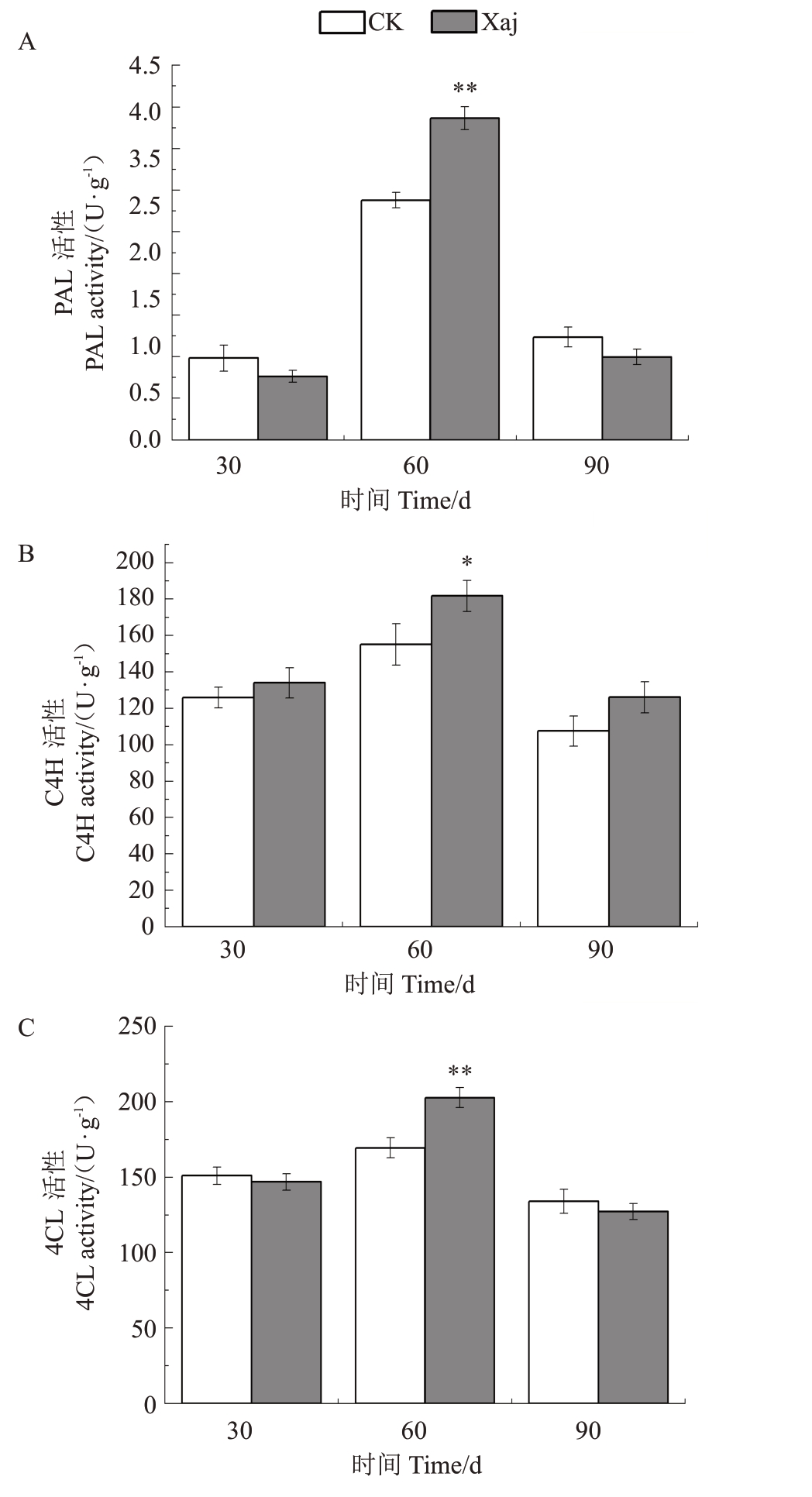
图3 黑斑病胁迫下核桃果实发育不同时期苯丙烷代谢途径关键酶活性的变化
Fig.3 Changes in key enzymes activity involved in phenylpropane metabolism pathway during different stages of walnut fruit development under black spot disease stress
C4H 酶活性的升高可以促进苯丙烷代谢酚酸类物质的合成,形成的香豆酸、阿魏酸和咖啡酸等酚酸可直接消灭病原物,从而对病原菌的生长繁殖产生抑制作用。由图3-B 可以看出,在30 d 时,Xaj 对比CK 无明显变化,说明核桃刚感病时体内的酶还处在正常代谢的状态,还未参与到核桃果实对黑斑病的调控过程中。随着病程的发展,到60 d 时,Xaj的酶活性显著提升(p<0.05),与同时期CK 相比提升了17.2%。60 d 与30 d 相比,CK 提升了23.2%,Xaj提升了35.6%。说明随着病程的发展,C4H酶已经开始参与到核桃果实对黑斑病的调控过程中。随着果实的发育与病程的发展,到90 d 时,Xaj 与CK的酶活性均有所下降,两者之间并无显著差异,但Xaj 的酶活性依旧高于CK,与CK 相比,Xaj 提升了17.3%,说明此时C4H 酶依旧在核桃的抗病进程中发挥着作用。整体来看,核桃感病后Xaj 的酶活性与CK 相比发生了较大程度的升高,说明当核桃受到病原微生物侵染以后,激活了苯丙烷代谢途径,C4H酶活性会提高以保证对病原微生物的抗性,从而增强核桃果实抗病性。
4CL酶在植物苯丙烷代谢网络中扮演着关键的节点角色,它对多种具有抗菌活性次生化合物的合成至关重要。在4CL酶的催化作用下,植物会形成多种代谢物。这些代谢物不仅能够直接抑制病原微生物的活动,还能够在植物免疫系统中发挥间接保护作用,抵御病原菌的侵袭。由图3-C可以看出,30 d时,Xaj 对比CK 的酶活性无显著变化,说明核桃刚感病时4CL酶还处于比较稳定的状态,并未参与到核桃果实抗病的代谢过程。感病1 个月后,到60 d时,两组酶活性均有提高,与同时期CK相比,Xaj的酶活性极显著提升(p<0.01),提升了19.7%。60 d与30 d相比,CK提升了12.2%,Xaj提升了38%。到90 d时,两组酶活性均有所下降,两者活性变化不显著。与同时期CK相比,Xaj下降了5%,说明核桃果实内4CL酶可能已经进入衰退期,酶的活性可能因反馈抑制等机制而下降。整体来看,两组的酶活性变化都呈现出了先升后降的趋势,但Xaj 酶活性的变化幅度明显大于CK,说明4CL 酶在核桃果实对黑斑病调控的进程中发挥了积极的作用。
2.3 黑斑病胁迫下核桃果实发育不同时期苯丙烷代谢途径次生代谢物的变化
木质素是植物细胞壁的主要成分之一,对增强细胞壁的机械强度和减少病原体入侵至关重要。在生物胁迫下,PAL、C4H和4CL酶活性的升高会促进木质素合成,加固细胞壁,从而阻止病原体扩散。由图4-A 可以看出,30 d 时,Xaj 对比CK 无显著变化。说明刚感病时核桃体内苯丙烷代谢途径中的次生代谢物还处于正常产生的状态,并未参与到抗病的过程中。感病1 个月以后到60 d 时,CK 与Xaj 的木质素含量均有提高,与同时期的CK 相比,Xaj 的含量极显著提升(p<0.01),提升了31.5%。60 d 与30 d相比,CK 提升了114.6%,Xaj 提升了198.1%。说明木质素的增加可以提高细胞壁的机械强度,形成物理屏障,在一定程度上可以阻止病原体的入侵和扩散。90 d 时,CK 的含量略微提升,与60 d 的CK 相比提升了2.5%;Xaj 的含量有所下降,与60 d 的Xaj相比下降了11.3%。但Xaj 的含量依旧高于CK,与同时期CK 相比,Xaj 的含量显著提升(p<0.05)了13.8%。说明木质素在核桃抵抗黑斑病的进程中发挥了作用。整体来看,当核桃遭受到病原微生物的侵染后,果实内木质素含量的变化整体呈现出先升高后降低的趋势。说明随着病害的进一步发展,核桃可能会启动其他的防御机制,如产生抗病蛋白、分泌抗菌物质等,此时木质素的合成和积累可能会达到一个平台期或有所下降。
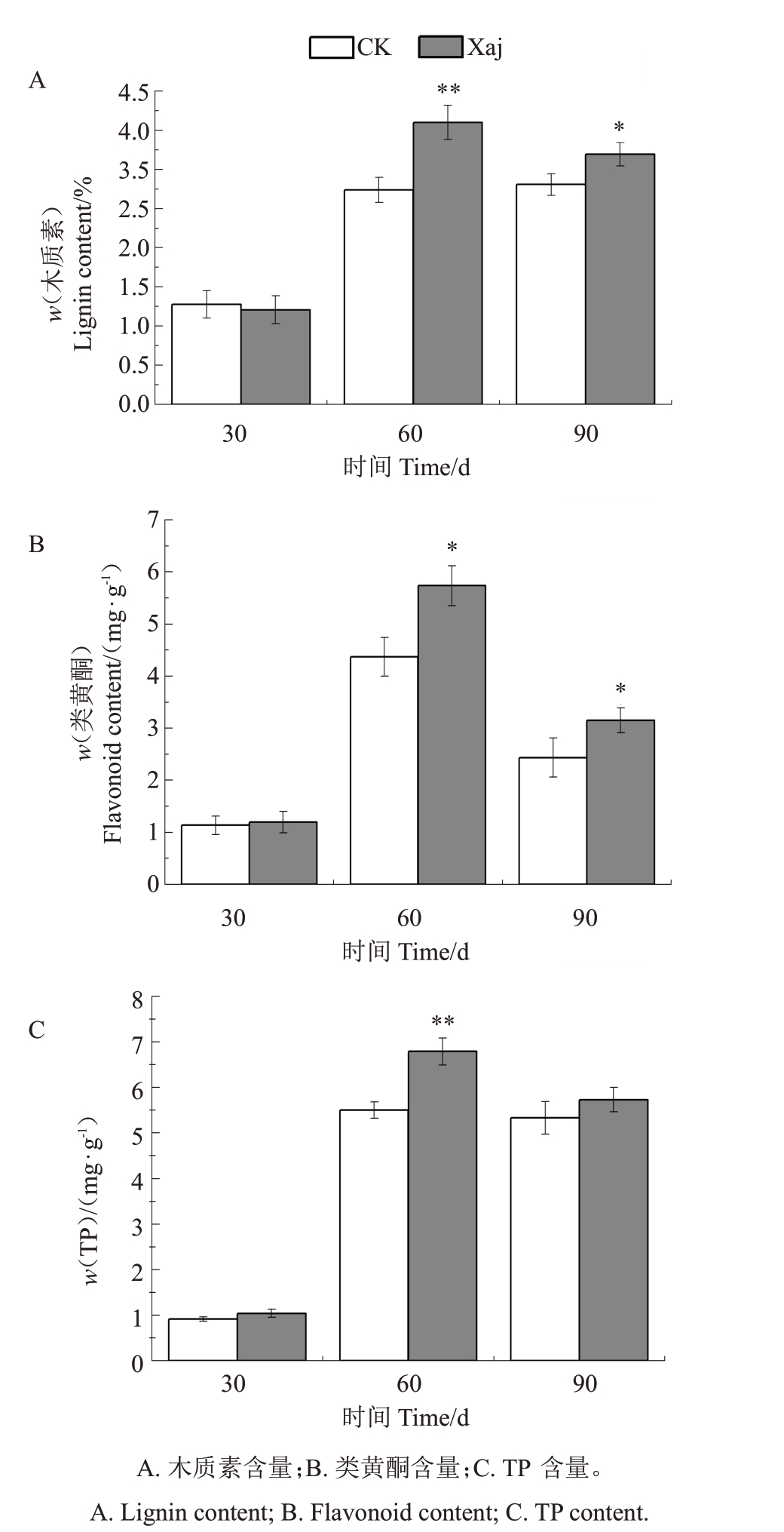
图4 黑斑病胁迫下核桃果实发育不同时期苯丙烷代谢途径次生代谢物含量的变化
Fig.4 Changes in secondary metabolites content of phenylpropane metabolism pathway during different stages of walnut fruit development under black spot disease stress
类黄酮是一类具有抗氧化和抗菌性质的次生代谢物,能够结合并中和有害的自由基,保护植物细胞免受氧化损伤。同时,某些类黄酮还能作为信号分子参与植物的防御反应,或直接抑制病原体生长。PAL、C4H 和4CL 酶活性增强可以促进类黄酮的合成,加强植物的防御体系。从图4-B可以看出,30 d时,Xaj对比CK无显著变化。说明刚感病时核桃果实内苯丙烷代谢途径中的次生代谢物还处于正常的代谢状态,未参与到核桃果实对黑斑病调控的过程中。到60 d 时,CK 与Xaj 的类黄酮含量均有提高,与同时期的CK相比,Xaj的含量显著提升(p<0.05)了31.3%。60 d与30 d相比,CK提升了285.2%,Xaj提升了379.5%。类黄酮含量在核桃感病后的变化趋势与木质素类似。说明核桃在感病后,类黄酮的含量会升高来清除有害物质和参与化学防御反应。到90 d 时,两组含量均有所下降,与60 d 相比,CK下降了44.3%,Xaj 下降了45.1%。但Xaj 含量依旧高于CK,与同时期CK 相比,Xaj 的含量显著提升(p<0.05)了29.3%,说明类黄酮含量依旧在核桃应对黑斑病的过程中发挥作用。整体来看,当核桃遭受到病原微生物的侵染后,类黄酮的变化整体呈现出先升高后降低的趋势。说明随着病害的进一步发展,核桃可能会调整自身的防御策略,类黄酮的合成和积累可能会受到其他因素的影响而发生变化。
TP包括了多种酚类化合物,它们在植物防御中扮演多重角色,包括抗氧化、抗微生物和吸引天敌等。在生物胁迫下,苯丙烷代谢途径关键酶活性的提高,加速了酚类物质的合成,增强了植物的抗性。从图4-C 可以看出,30 d 时,Xaj 对比CK 无显著变化。到60 d 时,CK 与Xaj 的类黄酮含量均有提高,与同时期的CK 相比,Xaj 极显著提升(p<0.01),提升了23.3%。60 d 与30 d 相比,CK 提升了501.5%,Xaj 提升了554.1%。说明核桃在感病后,为了抵抗病原菌的入侵,可能会启动一系列防御机制,包括增加TP 等次生代谢物质的合成。这些物质可以抑制病原菌的生长和繁殖,减轻病害对核桃果实造成的伤害。到90 d 时,两组含量均有所下降,与60 d 相比,CK 下降了3.2%,Xaj 下降了15.6%,但Xaj 依旧高于CK,与同时期CK 相比,Xaj 提升了7.5%,说明TP依旧在核桃抗病过程中发挥作用。整体来看,当核桃遭受到病原微生物的侵染后,TP含量的变化整体呈现出先升高后降低的趋势。TP 含量的下降可能是因为病原菌已经破坏了核桃果实细胞结构,导致TP 等物质的合成受到抑制或无法合成足够的量来抵抗病害。
3 讨 论
3.1 关于黑斑病胁迫下核桃果实发育不同时期渗透调节物质变化的研究
在黑斑病胁迫下,核桃果实可能会通过调整其内部的糖类、无机盐、氨基酸等渗透调节物质的含量来应对病害带来的压力。这些物质的变化可能旨在维持果实的正常生理功能,减轻病害对果实发育的不良影响。笔者在本研究中发现清香核桃患黑斑病60 d时SS含量升高,90 d时含量下降,这与李亚等[7]研究结果一致。糖类是动植物新陈代谢的基础,植物体内的糖不仅可以作为各种代谢反应的物质和能量来源,还可以为病原菌提供营养来源。SS是植物体内重要的渗透调节剂,感病胁迫往往导致植物中SS含量升高,从而提升植物抗逆性[8-9]。SP被认为是参与机体渗透调节的关键物质之一,其含量经常作为评估品种抗性的重要指标。植物细胞降解的可溶性蛋白是合成抗病物质的物质基础[7]。在本试验中30 d和60 d时,黑斑病感病胁迫条件下的SP含量相比CK上升,这是由于在感病条件下,病原菌的刺激可能会激活植物体蛋白合成酶的活性,或者抑制蛋白降解酶的活性,使得染病的组织细胞内SP含量增加,90 d 时SP 含量反而下降了77.74%,是由于该时期黑斑病感病胁迫条件下降解SP 以参与抗病物质的合成,从而增强了其抗病性。这与李亚等[7]的研究结果一致。Pro 作为渗透调节物质,是植物在生物胁迫下形成的一种重要的代谢适应性机制,它不仅可用于维持细胞内外渗透平衡,还可以提高植物抵抗逆境的能力。目前对植物渗透调节物质的研究主要集中在抗氧化活性和细胞保护功能等方面。此外在自由基清除方面也有重要作用[10-11]。在本研究中Pro含量变化呈现不断上升的趋势,这与李亚等[7]的研究结果一致。这种变化可能由于Pro的积累较少,破坏机体内的渗透平衡,使得病原菌更容易侵入。当植物体被病原菌侵染时,能够迅速产生Pro以减轻由于渗透失衡造成的酶蛋白变性,并通过调节组织细胞的渗透压来抵御外界环境的胁迫,发挥抗性作用。MDA 含量的增加可能导致细胞及细胞膜受损,其含量可以用来检测膜脂受损程度,从而反映细胞膜脂过氧化的程度[12]。在本试验中,相比于CK,30 d 时黑斑病感病胁迫条件下的MDA 含量呈升高趋势,这与赵秀娟等[3]的研究结果一致。
3.2 关于黑斑病胁迫下核桃果实发育不同时期苯丙烷代谢途径关键酶变化的研究
PAL 是苯丙烷代谢途径的第一个酶,催化L-苯丙氨酸转化为肉桂酸,这是整个途径的起始步骤。这一转化标志着从初级代谢向次级代谢的转变。肉桂酸随后进入不同的分支,生成多种重要的次生代谢物。在植物抗病过程中,PAL 酶活性的增强可以促进酚类化合物和植保素的合成,这些物质能够直接抑制病原体或参与植物的防御信号转导,增强植物的抗病性[12-14]。C4H 酶紧接着PAL 酶的作用,将肉桂酸转化为4-香豆酸,这是苯丙烷途径中的一个关键转化步骤。这个反应使产物向木质素、类黄酮等化合物的合成方向推进。在植物抵抗病原体侵袭时,C4H酶活性的增强有助于加速合成具有抗病作用的酚类物质和木质素沉积,形成物理屏障,限制病原菌的扩散[15]。4CL酶负责将4-香豆酸等酚酸转化为相应的辅酶A酯(如4-香豆酰-CoA),这是进一步合成木质素、类黄酮等化合物的前体。作为苯丙烷途径中转向下游分支的最后一个酶,4CL 酶对调节下游产物的合成至关重要。在植物的抗病机制中,4CL 酶通过促进这些次生代谢物的合成,不仅直接参与到化学防御中,还可能通过调节细胞壁的加固,增强植物的物理防御能力[16]。笔者在本研究中发现清香核桃在感染黑斑病后这些酶活性的变化均呈现先升高后降低的趋势,这些酶在前期推动了苯丙烷代谢途径,激发了清香核桃对黑斑病胁迫的自身保护机制,是清香核桃适应环境能力的体现,与尚军等[13]的研究结果一致。
3.3 关于黑斑病胁迫下核桃果实发育不同时期苯丙烷代谢途径次生代谢物变化的研究
木质素、类黄酮和TP含量的升高说明了当核桃遭受病原体侵染时,为了抵抗病原体,其体内的苯丙烷代谢途径会提高次生代谢物的产量来提高自身的抗病能力。木质素、类黄酮和TP是苯丙烷代谢途径中重要的次生代谢物,它们在植物感病后的变化趋势通常与植物的抗性密切相关[17-18]。木质素是一种复杂的酚类聚合物,主要存在于植物细胞壁中,具有增强细胞壁强度、抵抗病原体入侵的功能。当植物受到病原体感染时,木质素的合成和积累通常会增加。这是因为木质素的增加可以提高细胞壁的机械强度,形成物理屏障,阻止病原体的进一步入侵和扩散。此外,木质素还参与植物对病原体的化学防御反应,例如通过氧化反应产生有毒物质来杀死或抑制病原体的生长。类黄酮是一类广泛存在于植物中的多酚类化合物,具有多种生物活性,包括抗氧化、抗炎和抗菌等。在植物感病后,类黄酮的合成和积累也会发生变化。一方面,类黄酮的抗氧化作用可以帮助植物清除因病原体感染而产生的有害物质,减轻植物受到的损伤;另一方面,类黄酮还可以参与植物的化学防御反应,通过抑制病原体的生长和繁殖来减少病害的发生。TP 是一类广泛的酚类化合物的总称,包括了单酚和多酚等。在苯丙烷代谢途径中,TP 占据核心地位,因为其不仅作为结构成分参与植物细胞壁的加强,还具有多种生物学功能,如抗氧化、防御响应、吸引传粉者,以及调节植物生长发育等。TP 的合成与积累是植物响应环境变化如病原体攻击、物理伤害、紫外线照射的一种策略,体现了植物次生代谢在适应性和生存竞争中的重要作用。植物在感病后,其TP含量的变化趋势通常与植物对病害的抵抗能力有关。TP 是植物体内的一类重要次生代谢物质,它们具有抗氧化、抗菌、抗病毒等多种生物活性,对植物抵抗外界胁迫如病害、虫害等具有重要意义[19-20]。本研究结果与张昱等[18]的结果相似,研究发现清香核桃在感染黑斑病后木质素、类黄酮和TP含量升高,说明核桃在遭受病原体侵染时,苯丙烷代谢途径被激活,次代谢生物产量增加,以增强抗病能力。这些次生代谢物的变化体现了核桃对病原体胁迫的适应能力。
苯丙烷代谢途径是植物应对逆境的一种协同策略,确保了植物的生存与繁衍。因此,筛选和培育具有高PAL、C4H和4CL酶活性背景的品种,有望增强核桃对黑斑病的抵抗力。此外,了解这些关键酶以及次生代谢物在病程中的动态变化,有助于制定针对性的病害防治策略,如在病害易发期提前施加生物刺激剂或化学调控剂,以激活或维持这些关键酶的活性,提高植株的抗病能力。
4 结 论
在黑斑病胁迫下,清香核桃果实通过调整其内部的可溶性糖、可溶性蛋白、脯氨酸及丙二醛等渗透调节物质的含量来应对病害带来的压力,在苯丙烷代谢途径中,经过一系列酶促反应,产生包括木质素、类黄酮、TP等多种次生代谢物,苯丙烷代谢途径各种酶活性的上调不仅提高了木质素的含量,增强了植物的物理防御能力,同时,通过分支途径促进了类黄酮的合成,提供了化学防御和适应环境变化的能力。它们共同参与了清香核桃果实对黑斑病胁迫的响应和适应过程。
[1] 韩长志,祝友朋,王韵晴.核桃细菌性黑斑病的研究进展[J].林业科学研究,2021,34(4):184-190.HAN Changzhi,ZHU Youpeng,WANG Yunqing. Advances in research of walnut blight[J]. Forest Research,2021,34(4):184-190.
[2] WEISMANN D,HARTVIGSEN K,LAUER N,BENNETT K L,SCHOLL H P N,CHARBEL ISSA P,CANO M,BRANDSTÄTTER H,TSIMIKAS S,SKERKA C,SUPERTIFURGA G,HANDA J T,ZIPFEL P F,WITZTUM J L,BINDER C J. Complement factor H binds malondialdehyde epitopes and protects from oxidative stress[J]. Nature,2011,478(7367):76-81.
[3] 赵秀娟,张衍荣,胡开林.酶活性、丙二醛含量变化与豇豆抗枯萎病的关系[J].湖南农业大学学报(自然科学版),2009,35(3):245-248.ZHAO Xiujuan,ZHANG Yanrong,HU Kailin. MDA content and enzymatic changes during resistance of cowpea to Fusarium oxysporum f.sp.tracheiphilum[J].Journal of Hunan Agricultural University(Natural Sciences),2009,35(3):245-248.
[4] 王宏,马娜,蔺经,杨青松,李晓刚,常有宏.4 个早熟梨品种叶片对黑斑病的抗病性评价及与抗氧化酶的关系[J].江苏农业科学,2019,47(2):80-82.WANG Hong,MA Na,LIN Jing,YANG Qingsong,LI Xiaogang,CHANG Youhong. Evaluation of disease resistance of four early ripe pear varieties to black spot disease and its relationship with antioxidant enzymes[J]. Jiangsu Agricultural Sciences,2019,47(2):80-82.
[5] 谢凤,郝乐,王振杰,贾晋,邵玉涛.苯丙烷代谢途径分支对生物胁迫响应的研究进展[J].中国植保导刊,2023,43(2):23-30.XIE Feng,HAO Le,WANG Zhenjie,JIA Jin,SHAO Yutao.Advances in understanding how branches of the phenylpropanoid pathway respond to biotic stress[J]. China Plant Protection,2023,43(2):23-30.
[6] 张宽朝,金青,蔡永萍,林毅.苯丙氨酸解氨酶与其在重要次生代谢产物调控中的作用研究进展[J].中国农学通报,2008,24(12):59-62.ZHANG Kuanchao,JIN Qing,CAI Yongping,LIN Yi.Research progress of PAL and its control function of important secondav metabolltes[J]. Chinese Agricultural Science Bulletin,2008,24(12):59-62.
[7] 李亚,韩颖,杨斌,赵宁.黄单胞杆菌侵染后不同品种核桃抗病性相关生理指标的测定[J].福建农林大学学报(自然科学版),2020,49(4):453-458.LI Ya,HAN Ying,YANG Bin,ZHAO Ning. Assessing resistance against Xanthomonasar boricola in 4 walnuts cultivars using physiological indexes[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition),2020,49(4):453-458.
[8] HORSFALL M P. Soluble sugar content changes and their role in the resistance of potatoes against phytopathorain festans[J].Biokhimiya,1953,12:141-152.
[9] 陈建业.葡萄酒中酚酸及葡萄果实苯丙烷类代谢途径研究[D].北京:中国农业大学,2005.CHEN Jianye. Study on the phenolic acids in wines and phenylpropanoid metabolism in grape berries[D]. Beijing:China Agricultural University,2005.
[10] 张林,陈翔,吴宇,于敏,蔡洪梅,柳彬彬,倪芊芊,刘绿洲,许辉,房浩,李金才.脯氨酸在植物抗逆中的研究进展[J].江汉大学学报(自然科学版),2023,51(1):42-51.ZHANG Lin,CHEN Xiang,WU Yu,YU Min,CAI Hongmei,LIU Binbin,NI Qianqian,LIU Lüzhou,XU Hui,FANG Hao,LI Jincai. Research progress of proline in plant stress resistance[J].Journal of Jianghan University (Natural Science Edition),2023,51(1):42-51.
[11] 张茜.核桃抗细菌性黑斑病生理机制初步研究[D].杨凌:西北农林科技大学,2022.ZHANG Qian.Study on the physiological resistance mechanism of walnut(Juglans regia)to bacterial blight[D].Yangling:Northwest A&F University,2022.
[12] 蒋时姣.核桃黑斑病抗性评价及抗病机理研究[D].雅安:四川农业大学,2019.JIANG Shijiao. Sensitivity evaluation and disease resistance mechanism to walnut blight[D].Yaan:Sichuan Agricultural Uni-versity,2019.
[13] 尚军,吴旺泽,马永贵.植物苯丙烷代谢途径[J].中国生物化学与分子生物学报,2022,38(11):1467-1476.SHANG Jun,WU Wangze,MA Yonggui. Phenylpropanoid metabolism pathway in plants[J]. Chinese Journal of Biochemistry and Molecular Biology,2022,38(11):1467-1476.
[14] 柴秀伟,孔蕊,李宝军,朱亚同,毕阳,Dov Prusky.一氧化氮对苹果果实愈伤苯丙烷代谢的影响及生理机制分析[J].西北植物学报,2022,42(4):619-627.CHAI Xiuwei,KONG Rui,LI Baojun,ZHU Yatong,BI Yang,PRUSKY D. Effect of nitric oxide on phenylpropanoid metabolism in healing of apple fruit and analysis of its physiological mechanism[J].Acta Botanica Boreali-Occidentalia Sinica,2022,42(4):619-627.
[15] 陈浩,孙进华,王树军,李焕苓,王果,王家保.霜疫霉侵染对不同荔枝品种果皮苯丙烷类代谢的影响[J].热带作物学报,2021,42(6):1694-1699.CHEN Hao,SUN Jinhua,WANG Shujun,LI Huanling,WANG Guo,WANG Jiabao. Effects of phenylpropanoid metabolism in different litchi varieties during the infection of Phytophthora litchii[J]. Chinese Journal of Tropical Crops,2021,42(6):1694-1699.
[16] 陈惠明,黄学跃,刘敬业,李天福,冉邦定.烟草罹赤星病后苯丙烷类代谢途径有关酶及物质的动态研究[J].云南农业大学学报,1998,13(1):63-66.CHEN Huiming,HUANG Xueyue,LIU Jingye,LI Tianfu,RAN Bangding.Dynamies of related enzymes and substances of the phenylpropanes’metabolic pathway of tobacco infected by tobacco brown spat[J]. Journal of Yunnan Agricultural University(Natural Science),1998,13(1):63-66.
[17] QU G F,WU W N,BA L J,MA C,JI N,CAO S.Melatonin enhances the postharvest disease resistance of blueberries fruit by modulating the jasmonic acid signaling pathway and phenylpropanoid metabolites[J]. Frontiers in Chemistry,2022,10:957581.
[18] 张昱,石玲,张亚琳,马海娟,任新雅,张哲诚,朱璇.2,4-表油菜素内酯结合氯化钙处理对采后杏果实黑斑病及苯丙烷代谢的影响[J].核农学报,2022,36(12):2455-2461.ZHANG Yu,SHI Ling,ZHANG Yalin,MA Haijuan,REN Xinya,ZHANG Zhecheng,ZHU Xuan. Effect of 2,4-epibrassinolide combined with calcium chloride treatment on postharvest apricot fruit black spot disease and phenylpropanoid pathway[J].Journal of Nuclear Agricultural Sciences,2022,36(12):2455-2461.
[19] BAXTER H L,JR STEWART C N.Effects of altered lignin biosynthesis on phenylpropanoid metabolism and plant stress[J].Biofuels,2013,4(6):635-650.
[20] XU D D,DENG Y Z,XI P G,YU G,WANG Q,ZENG Q Q,JIANG Z D,GAO L W. Fulvic acid-induced disease resistance to Botrytis cinerea in table grapes may be mediated by regulating phenylpropanoid metabolism[J]. Food Chemistry,2019,286:226-233.