植物表皮蜡质是植物抵御外界环境胁迫的第一道屏障,在减缓水分散失、抑制病原菌侵害及延长水果贮藏期等方面发挥重要作用[1-4]。目前,大量研究表明通过外源试剂处理可以提高植物表皮蜡质含量,进而提高植物对外界不良环境的抵抗能力。例如,外源多巴胺处理显著提高了黄瓜叶片表皮蜡质含量,增强了叶片抗病性[5]。外源茉莉酸甲酯(Me-JA)处理增加了甜樱桃果实蜡质中长链烷烃化合物含量[6]。喷施氨基乙酰丙酸(ALA)和MeJA 增加了玉露香叶片蜡质含量[7]。水杨酸(SA)处理有效延缓了蓝莓果实总蜡含量的降低,显著影响了果实表皮蜡质组分占比[8]。2,4-表油菜素内酯(EBR)处理种子,可以提高甜高粱和青贮玉米叶片角质蜡在干旱条件下C28 和C30 醛的相对含量、甜高粱中C29 烷的相对含量以及青贮玉米C30 和C32 烷的相对含量[9]。褪黑素(melatonin,MT)作为内源性植物激素,在植物生长、抵抗生物和非生物胁迫等过程中发挥重要作用。MT对植物表皮蜡质合成的影响也已有广泛报道,例如,适当浓度的MT处理可以维持杧果果皮完整性,延缓果实衰老[10],降低枇杷果实日灼病果率及病害等级,缓解高温胁迫对果皮组织结构的伤害[11],增加番茄叶片表皮蜡质组分中烷烃和萜类含量,缓解叶片水分散失[12]以及维持蓝莓果实三萜类化合物含量,有效延缓果实蜡质含量的减少[13-14];空心李经MT 处理后,长链烷烃含量显著增加,维持了果实硬度,耐储性提高[15]。棕榈酸(palmitic acid,PA)作为蜡质合成前体之一,也是植物蜡质的主要组分之一,喷施PA对提高植物表皮蜡质含量具有重要作用。例如,PA 处理分别使玉露香、丰水和翠冠3个梨品种果实表皮蜡质含量显著提高了71.7%、65.3%和38.6%[16]。笔者在本研究中选用褪黑素、棕榈酸以及两种试剂的混合组合处理金煌和台农1号杧果叶片,通过GC-MS分析测定表皮蜡质含量和化学组分,探究外源试剂对杧果叶片表皮蜡质含量和组分的影响。改变杧果果皮蜡质组分,提高蜡质含量,有望成为改善杧果品质和提高杧果产量的重要手段,具有重要的科学意义和应用价值。
1 材料和方法
1.1 参试杧果材料
以海南省三亚市主栽杧果品种金煌和台农1号为试验材料。选取实验基地内按照常规田间管理栽种的1 年生大小一致健康杧果幼苗,杧果苗嫁接所用砧木一致,为鹰嘴芒。待到抽梢结束,在杧果浅绿幼叶转变为深绿新叶期间进行后续外源试剂处理。
1.2 外源试剂的配制
依次配制外源试剂100 μmol·L-1 MT、150 μmol·L-1 PA 和200 μmol·L-1 PA。配制方法如下:利用1 mL无水乙醇分别溶解褪黑素和棕榈酸,加入20 μL OP-10 乳化剂助溶,混合均匀后,用超纯水补齐至1 L。取500 mL 100 μmol·L-1 MT外源试剂分别与500 mL的150 μmol·L-1 PA、500 mL的200 μmol·L-1 PA试剂等体积混合,配制100 μmol·L-1 MT+150 μmol·L-1 PA 和100 μmol·L-1 MT+200 μmol·L-1 PA 混合溶液。对照组(CK):1 mL 无水乙醇,加入20 μL OP-10 乳化剂,用超纯水补齐至1 L。
1.3 外源试剂的处理
分别取50 mL 的对照组、100 μmol·L-1 MT、150 μmol·L-1 PA、200 μmol·L-1 PA、100 μmol·L-1 MT+150 μmol·L-1 PA 和100 μmol·L-1 MT+200 μmol·L-1 PA 溶液,均匀喷施在杧果叶片的上表皮和下表皮,每2 d 喷施1 次,共进行3 次喷施。每品种每处理3次重复,每重复3 株杧果幼苗。在外源试剂处理后第7天,在每株参试杧果植株相同部位取3枚叶片待测,每个处理共27枚杧果叶片用于后续蜡质含量和组分分析。
1.4 表皮蜡质的提取
利用氯仿提取杧果叶片表皮蜡质,使用叶面积仪测量叶片表面积。每个杧果品种每个处理组共27 枚待测叶片,平均分为3 组,用清水清洗干净,放置阴凉处晾干。每组共9 枚叶片分别测定叶面积后,在通风橱中用80 mL氯仿充分浸泡1 min。将浸泡后滤液转移至棕色样品瓶中,再加入2 μL内标正二十四烷溶液(10 mg·mL-1),通过氮吹仪吹干溶液获得蜡质粗提物。
1.5 表皮蜡质衍生化反应
取1 mg蜡质粗提物,加入200 μL吡啶和200 μL N,O-双(三甲基硅烷基)三氟乙酰胺(BSTFA),放入70 ℃烘箱内静置1 h,通过氮吹仪再次吹干溶液,加入1 mL色谱级氯仿重新溶解。使用1 mL无菌注射器将溶液通过0.45 μm有机过滤膜过滤至2 mL棕色进样瓶中等待上机测样。
1.6 表皮蜡质组分分析
蜡质化学组分含量借助三重四级杆气质联用仪(Trace1310/TSQ 9000,Thermo Scientific)和TG-5MS 毛细管色谱柱(30 m×0.25 mm I.D.,0.25 μm film,Thermo Scientific)进行分析。以1.2 mL·min-1氦气作为载气。仪器参数如下:进样口和传输线温度均设为280 ℃;离子源温度和四级杆温度分别为250 ℃和150 ℃;电子能量(EI)为70 eV;扫描范围为50~650 m/z。样品注入GC-MS后,50 ℃运行2 min,接着,以40 ℃·min-1的速度升温至200 ℃运行2 min。最后,以3 ℃·min-1升温至320 ℃,保持30 min。
1.7 数据分析
GraphPad prism 9 和Origin 2021 软件用于制作柱状图,Origin 2021 软件进行主成分分析,SPSS V23.0 软件用于差异显著性分析,标注的小写字母表示p<0.05 的显著差异。每个处理3 个生物学重复,数据以平均值±SD表示。
2 结果与分析
2.1 外源试剂对杧果叶片表皮蜡质主成分的调控
GC-MS检测结果表明金煌和台农1号杧果叶片表皮蜡质主要由脂肪族化合物、萜类和其他未分类化合物组成,不同外源试剂处理后的不同杧果品种叶片表皮蜡质含量和组分存在差异(表1)。对不同处理后的两种杧果主成分进行分析(PCA),结果显示处理组和对照组金煌杧果叶片表皮蜡质组分的PC1和PC2分别为34.8%和28.6%,可以解释63.4%的变异;而台农1号PC1和PC2分别为44.1%和24.8%,可以解释68.9%的变异(图1)。不同外源试剂处理对杧果叶片表皮蜡质组分和含量发挥的调控作用存在差异,其中100 μmol·L-1 MT 对杧果叶片蜡质主成分影响最小,其他处理组杧果叶片蜡质主成分发生显著变化。
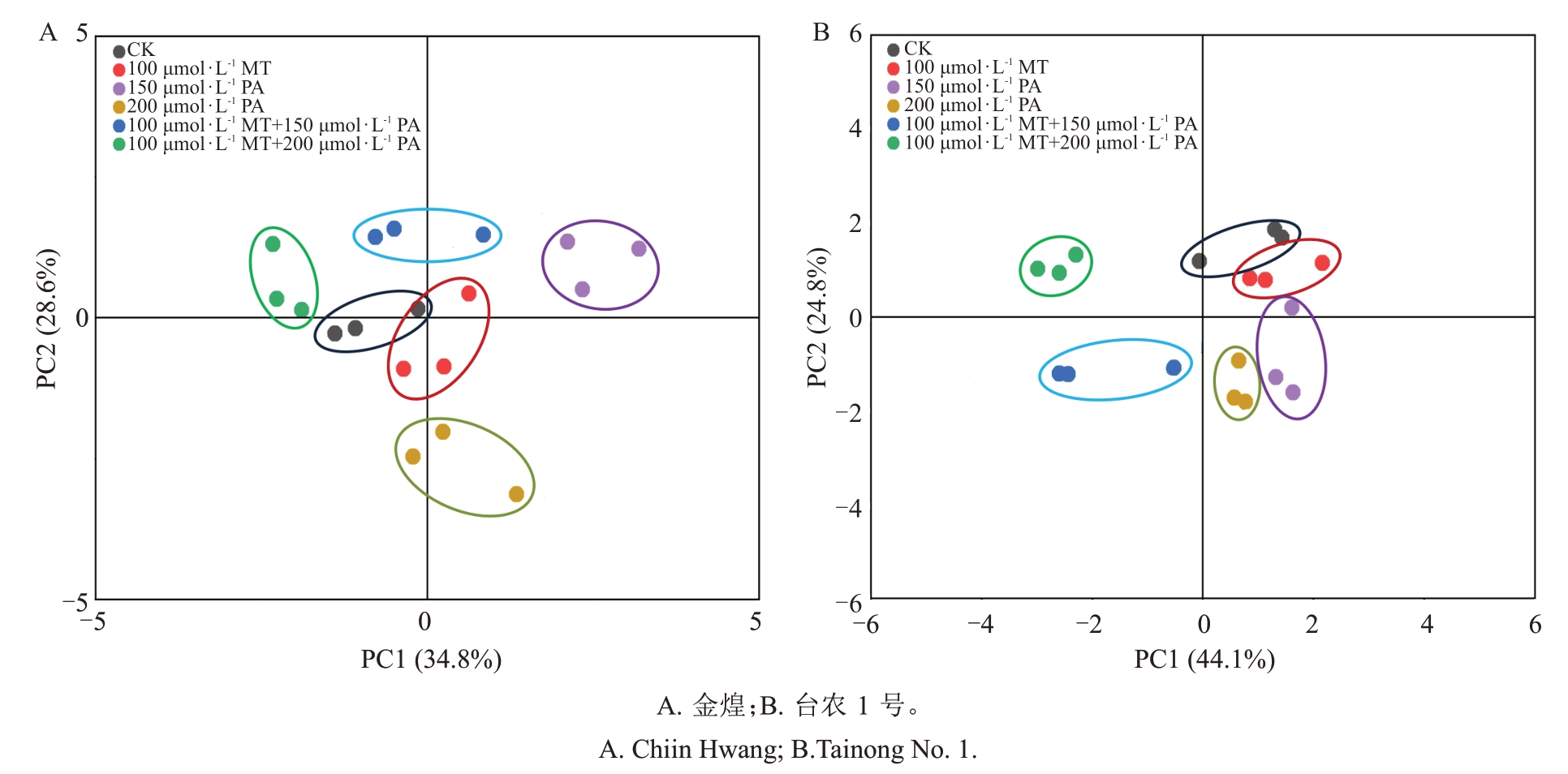
图1 不同处理后杧果叶片表皮蜡质组分主成分分析
Fig.1 Principal component analysis of wax components on mango leaf after different treatments
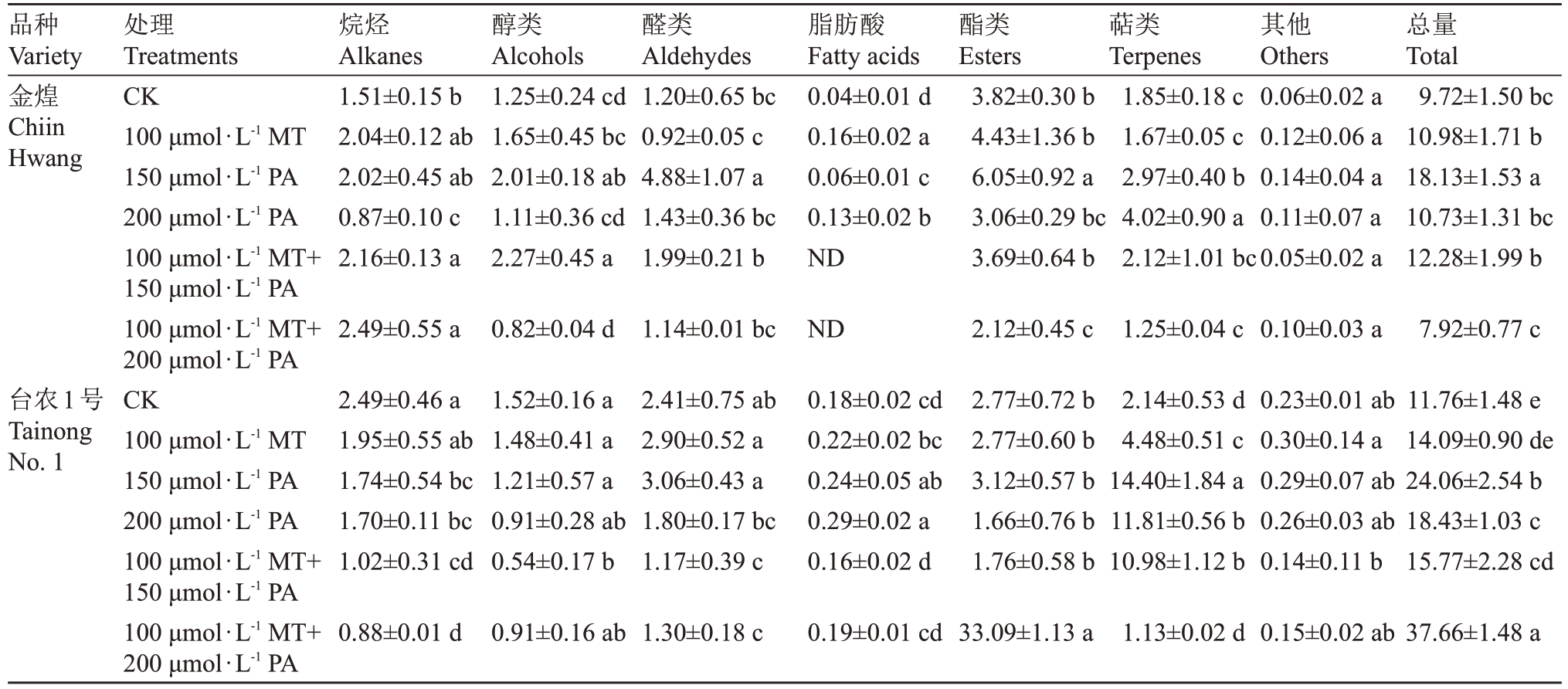
表1 不同处理下杧果叶片表皮蜡质组分含量
Table 1 The content of wax components on mango leaf under different treatments(μg·cm-2)
注:ND.未检测到。下同。
Note:ND.Undetected.The same below.
品种Variety金煌Chiin Hwang烷烃Alkanes 1.51±0.15 b 2.04±0.12 ab 2.02±0.45 ab 0.87±0.10 c 2.16±0.13 a 2.49±0.55 a醇类Alcohols 1.25±0.24 cd 1.65±0.45 bc 2.01±0.18 ab 1.11±0.36 cd 2.27±0.45 a 0.82±0.04 d醛类Aldehydes 1.20±0.65 bc 0.92±0.05 c 4.88±1.07 a 1.43±0.36 bc 1.99±0.21 b 1.14±0.01 bc脂肪酸Fatty acids 0.04±0.01 d 0.16±0.02 a 0.06±0.01 c 0.13±0.02 b ND ND酯类Esters 3.82±0.30 b 4.43±1.36 b 6.05±0.92 a 3.06±0.29 bc 3.69±0.64 b 2.12±0.45 c萜类Terpenes 1.85±0.18 c 1.67±0.05 c 2.97±0.40 b 4.02±0.90 a 2.12±1.01 bc 1.25±0.04 c其他Others 0.06±0.02 a 0.12±0.06 a 0.14±0.04 a 0.11±0.07 a 0.05±0.02 a 0.10±0.03 a总量Total 9.72±1.50 bc 10.98±1.71 b 18.13±1.53 a 10.73±1.31 bc 12.28±1.99 b 7.92±0.77 c台农1号Tainong No.1处理Treatments CK 100 μmol·L-1 MT 150 μmol·L-1 PA 200 μmol·L-1 PA 100 μmol·L-1 MT+150 μmol·L-1 PA 100 μmol·L-1 MT+200 μmol·L-1 PA CK 100 μmol·L-1 MT 150 μmol·L-1 PA 200 μmol·L-1 PA 100 μmol·L-1 MT+150 μmol·L-1 PA 100 μmol·L-1 MT+200 μmol·L-1 PA 2.49±0.46 a 1.95±0.55 ab 1.74±0.54 bc 1.70±0.11 bc 1.02±0.31 cd 1.52±0.16 a 1.48±0.41 a 1.21±0.57 a 0.91±0.28 ab 0.54±0.17 b 2.41±0.75 ab 2.90±0.52 a 3.06±0.43 a 1.80±0.17 bc 1.17±0.39 c 0.18±0.02 cd 0.22±0.02 bc 0.24±0.05 ab 0.29±0.02 a 0.16±0.02 d 2.77±0.72 b 2.77±0.60 b 3.12±0.57 b 1.66±0.76 b 1.76±0.58 b 2.14±0.53 d 4.48±0.51 c 14.40±1.84 a 11.81±0.56 b 10.98±1.12 b 0.23±0.01 ab 0.30±0.14 a 0.29±0.07 ab 0.26±0.03 ab 0.14±0.11 b 11.76±1.48 e 14.09±0.90 de 24.06±2.54 b 18.43±1.03 c 15.77±2.28 cd 0.88±0.01 d 0.91±0.16 ab 1.30±0.18 c 0.19±0.01 cd 33.09±1.13 a 1.13±0.02 d 0.15±0.02 ab 37.66±1.48 a
2.2 外源试剂对杧果叶片表皮蜡质含量的影响
不同外源试剂处理对不同品种杧果叶片表皮蜡质含量的影响存在差异(表1)。对照组金煌和台农1 号杧果叶片表皮蜡质总量分别为9.72 μg·cm-2和11.76 μg·cm-2。除100 μmol·L-1 MT+200 μmol·L-1 PA混合试剂处理后的金煌杧果叶片表皮蜡质含量略有降低外,其他处理后的杧果叶片蜡质含量均有提高。其中150 μmol·L-1 PA对金煌和台农1号两个杧果品种叶片蜡质含量提高均有显著效果,分别提高了1.87和2.05 倍。200 μmol·L-1 PA、100 μmol·L-1 MT+150 μmol·L-1 PA 和100 μmol·L-1 MT+200 μmol·L-1 PA试剂处理均可显著提高台农1号叶片表皮蜡质含量,较对照组分别提高了1.57、1.34和3.2倍,而处理后的金煌叶片表皮蜡质含量与对照组无显著差异。
2.3 外源试剂对杧果叶片表皮蜡质组分的影响
喷施不同外源试剂对不同品种杧果叶片表皮蜡质组分含量影响不同(表1 和图2)。与对照相比,100 μmol·L-1 MT 处理的金煌杧果叶片蜡质组分中的脂肪酸化合物显著增加了4.00 倍,其在总蜡质占比从0.39%提升至1.41%;150 μmol·L-1 PA 处理醇类、醛类、脂肪酸、酯类、萜类蜡质化合物含量均显著提高,其中醛类化合物增幅最显著,是对照组的4.07 倍,其在总蜡质占比从12.31%提升至26.94%;200 μmol·L-1 PA 处理蜡质组分中的烷烃、脂肪酸、萜类含量均有显著提高,其中最显著的是脂肪酸含量,提升倍数为3.25,其在总蜡质占比从0.39%提升至1.21%;100 μmol·L-1 MT+150 μmol·L-1 PA 和100 μmol·L-1 MT+200 μmol·L-1 PA处理金煌杧果叶片表皮蜡质均未检测到脂肪酸化合物。100 μmol·L-1 MT、150 μmol·L-1 PA、200 μmol·L-1 PA和100 μmol·L-1 MT+150 μmol·L-1 PA 处理显著增加了台农1 号杧果叶片表皮蜡质中萜类化合物含量,分别是对照组的2.09、6.73、5.52 和5.13 倍,而经100 μmol·L- 1 MT+200 μmol·L-1 PA 处理后该品种杧果叶片表皮蜡质酯类化合物增加了11.95 倍,其总蜡质占比从23.59%提升至87.88%,是其总蜡提升的主要原因。
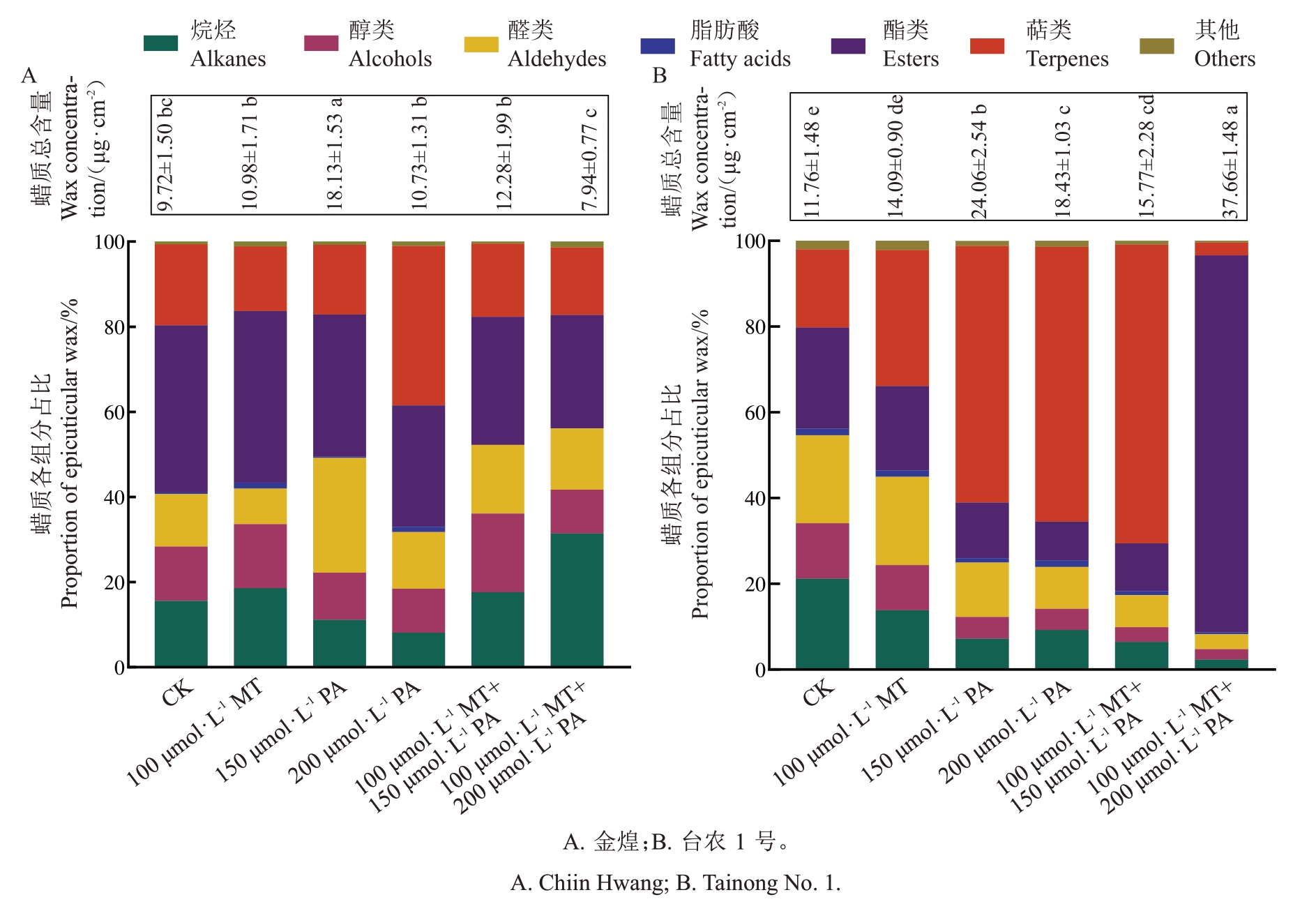
图2 不同处理对杧果叶片表皮蜡质组分占比的影响
Fig.2 Effect of different treatments on the proportion of wax components on mango leaf
2.4 外源试剂对杧果叶片表皮蜡质脂肪族化合物碳链分布的影响
外源试剂对不同杧果叶片表皮蜡质脂肪族化合物碳链分布的影响存在差异(图3)。杧果叶片蜡质中烷烃碳链长度分布范围为C16~C34,其中C25 和C26烷烃是金煌和台农1号叶片蜡质中的主要烷烃化合物(图3-A,E)。150 μmol·L-1 PA处理后的金煌杧果叶片蜡质中C16~C25 烷烃均减少,而C26 烷烃和C34烷烃含量均有增加(图3-A)。外源试剂处理后台农1 号杧果叶片蜡质中C26 和C29 烷烃减少,100 μmol·L-1 MT 处理后台农1 号杧果叶片蜡质中C18 烷烃显著增加(图3-E)。杧果叶片蜡质中脂肪酸碳链长度分布范围主要是C16和C18(图3-B,F),100 μmol·L-1 MT处理后金煌杧果叶片蜡质中C16和C18 脂肪酸显著增加(图3-B)。150 μmol·L-1 PA 和200 μmol·L-1 PA处理后金煌和台农1号杧果叶片蜡质中C16脂肪酸均显著增加(图3-B,F)。杧果叶片蜡质中醛类碳链长度分布范围主要为C24~C32(图3-C,G),150 μmol·L-1 PA处理后金煌杧果叶片蜡质中C28、C29、C32醛显著增加(图3-C),100 μmol·L-1 MT和150 μmol·L-1 PA 处理台农1 号杧果叶片蜡质中C29 和C32 醛显著增加(图3-G)。杧果叶片蜡质中醇类碳链长度分布范围主要为C16~C27(图3-D,H),外源试剂对杧果叶片蜡质醇类化合物的碳链分布影响较小,100 μmol·L-1 MT 处理后金煌杧果C27 醇显著减少(图3-D)。100 μmol·L-1 MT 和150 μmol·L-1 PA处理台农1号杧果叶片蜡质中C16醇均显著减少(图3-H)。
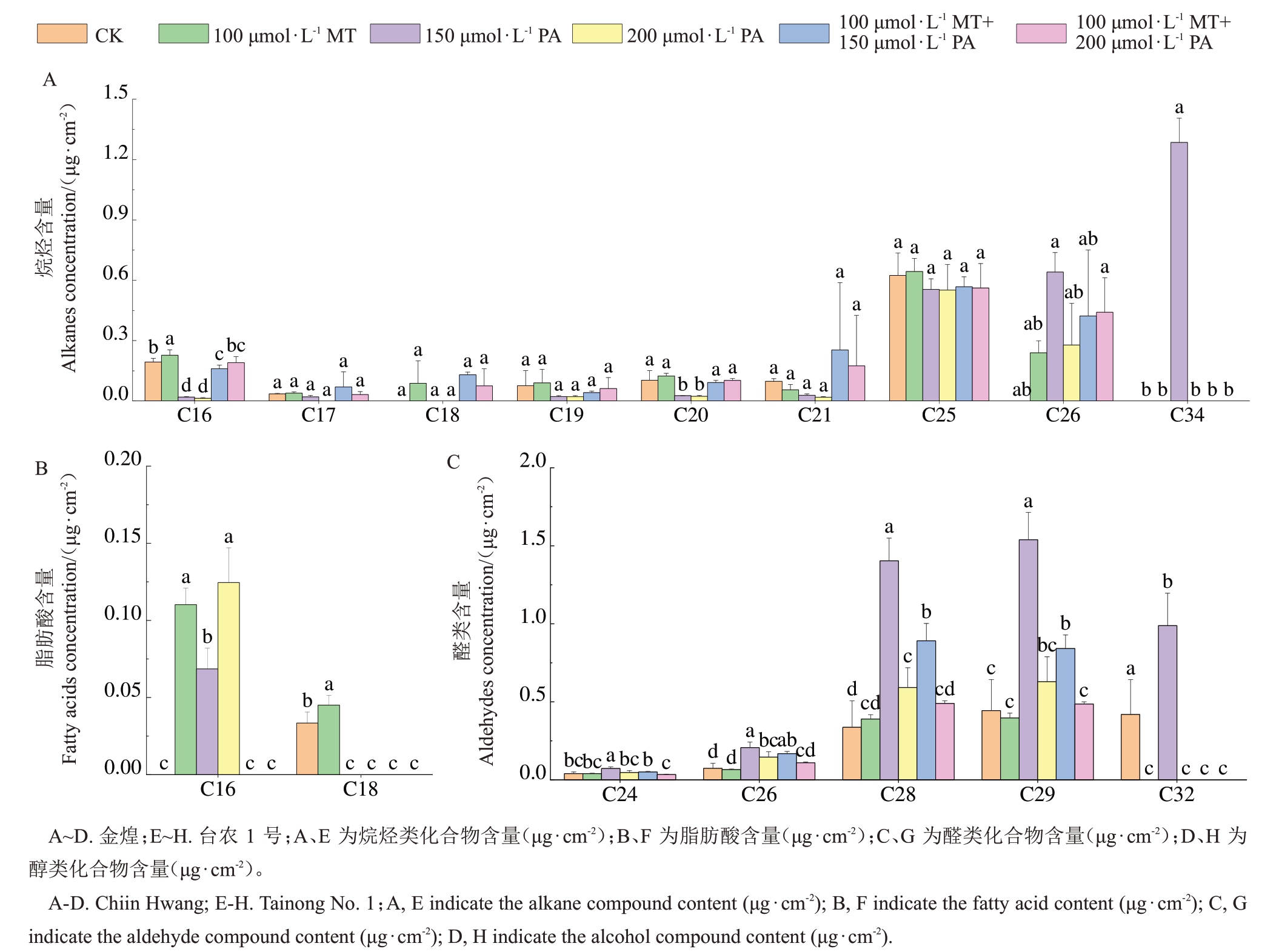
图3 外源试剂处理对杧果叶片表皮蜡质脂肪族化合物碳链分布的影响
Fig.3 Changes in the carbon chain distribution of aliphatic wax compounds in mango leaf epidermis under the influence of exogenous reagents
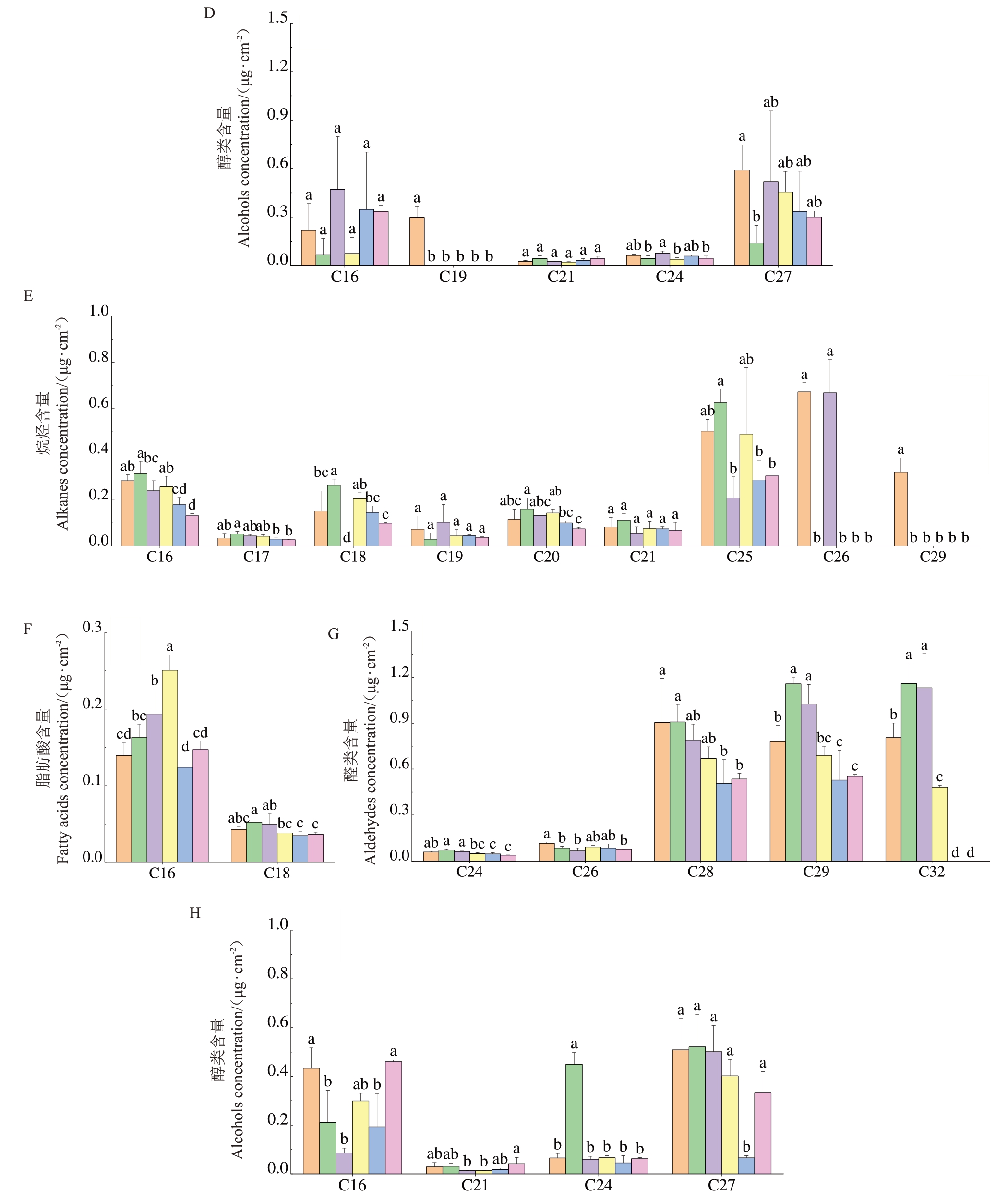
图3 (续) Fig.3 (Continued)
2.5 外源试剂对杧果叶片表皮蜡质萜类化合物成分的影响
不同外源试剂对杧果叶片表皮蜡质萜类成分均有影响(表2),其中在对照组中金煌杧果叶片表皮蜡质中未检测到β-香树脂醇,而200 μmol·L-1 PA、100 μmol·L-1 MT+150 μmol·L-1 PA 和100 μmol·L-1 MT+200 μmol·L-1 PA处理组中β-香树脂醇含量分别为0.98 μg·cm2,0.42 μg·cm2,0.38 μg·cm2。在对照组中台农1号杧果叶片表皮蜡质中未检测到α-香树脂醇,但在所有处理组均有发现,其含量为0.76~1.53 μg·cm2。木栓酮在金煌杧果叶片表皮蜡质中的含量为0.36 μg·cm2,150 μmol·L-1 PA和200 μmol·L-1 PA 处理可有效增加其含量至0.52 μg · cm2 和0.62 μg·cm2,其他处理未检测到该化合物。
表2 不同处理后主要萜类化合物含量
Table 2 Content of terpenoids after different treatments(μg·cm-2)
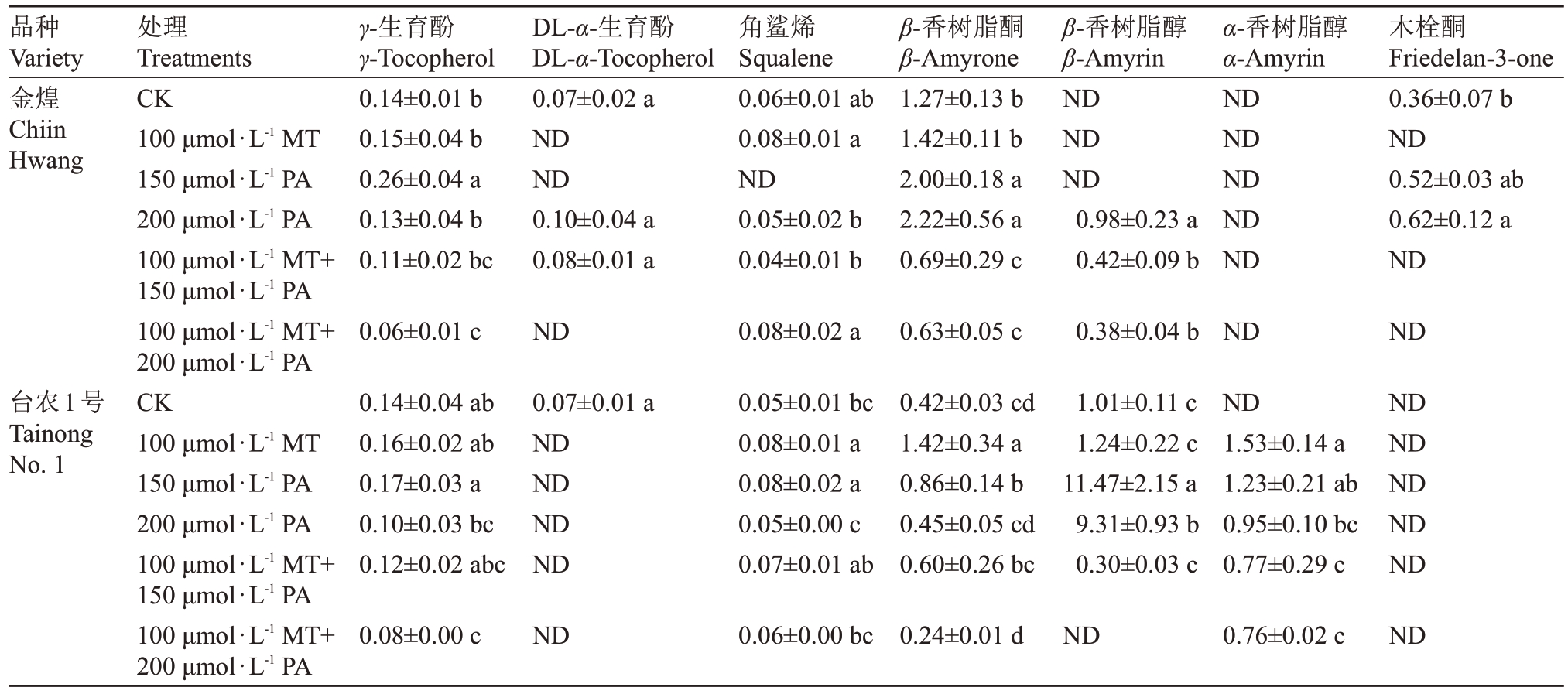
品种Variety金煌Chiin Hwang γ-生育酚γ-Tocopherol 0.14±0.01 b 0.15±0.04 b 0.26±0.04 a 0.13±0.04 b 0.11±0.02 bc DL-α-生育酚DL-α-Tocopherol 0.07±0.02 a ND ND 0.10±0.04 a 0.08±0.01 a处理Treatments CK 100 μmol·L-1 MT 150 μmol·L-1 PA 200 μmol·L-1 PA 100 μmol·L-1 MT+150 μmol·L-1 PA 100 μmol·L-1 MT+200 μmol·L-1 PA CK 100 μmol·L-1 MT 150 μmol·L-1 PA 200 μmol·L-1 PA 100 μmol·L-1 MT+150 μmol·L-1 PA 100 μmol·L-1 MT+200 μmol·L-1 PA角鲨烯Squalene 0.06±0.01 ab 0.08±0.01 a ND 0.05±0.02 b 0.04±0.01 b β-香树脂酮β-Amyrone 1.27±0.13 b 1.42±0.11 b 2.00±0.18 a 2.22±0.56 a 0.69±0.29 c β-香树脂醇β-Amyrin ND ND ND 0.98±0.23 a 0.42±0.09 b α-香树脂醇α-Amyrin ND ND ND ND ND木栓酮Friedelan-3-one 0.36±0.07 b ND 0.52±0.03 ab 0.62±0.12 a ND 0.06±0.01 c ND 0.08±0.02 a 0.63±0.05 c 0.38±0.04 b ND ND台农1号Tainong No.1 0.14±0.04 ab 0.16±0.02 ab 0.17±0.03 a 0.10±0.03 bc 0.12±0.02 abc 0.07±0.01 a ND ND ND ND 0.05±0.01 bc 0.08±0.01 a 0.08±0.02 a 0.05±0.00 c 0.07±0.01 ab 0.42±0.03 cd 1.42±0.34 a 0.86±0.14 b 0.45±0.05 cd 0.60±0.26 bc 1.01±0.11 c 1.24±0.22 c 11.47±2.15 a 9.31±0.93 b 0.30±0.03 c ND 1.53±0.14 a 1.23±0.21 ab 0.95±0.10 bc 0.77±0.29 c ND ND ND ND ND 0.08±0.00 c ND 0.06±0.00 bc 0.24±0.01 d ND 0.76±0.02 c ND
3 讨 论
不同植物叶片表皮蜡质组分差异较大,例如:酯类是杧果和甘蔗叶片表皮蜡质含量最高的组分[17],烷烃是玉米、克氏针茅、稗草叶片表皮蜡质主要成分,醛类和醇类化合物分别是水稻和大麦叶片表皮蜡质主要的化合物。而节节麦、草地早熟禾、糙隐子草叶片表皮蜡质以初级醇为主,羊草叶片表皮蜡质中次级醇相对含量最高。糜子叶片表皮蜡质组成成分以烷烃和初级醇等化合物为主[18]。在本研究中,杧果叶片表皮蜡质中烷烃和醇类的碳链分布呈奇数和偶数交替排列,醛类化合物以偶数碳链为主,与先前研究结果一致[16]。萜类化合物具有维持植物机械性能、抵抗病原菌侵害等作用[19-20],是植物叶片表皮蜡质的重要组成成分。大量果树叶片表皮蜡质检测到萜类化合物,包括杧果、草莓[21]、苹果[22]和火龙果[23]等。γ-生育酚、DL-α-生育酚、角鲨烯、β-香树脂酮、β-香树脂醇、α-香树脂醇和木栓酮是杧果叶片中检测到的主要萜类化合物。其中β-香树脂酮、β-香树脂醇、α-香树脂醇也是杧果[24]、越橘[25]和蓝莓[26]果实蜡质主要的萜类化合物。生育酚和角鲨烯可以抵御病原菌入侵,具有抗氧化能力,延长果实贮藏期[27-28]。γ-生育酚在两个杧果品种所有样品叶片中均可以检测到,DL-α-生育酚可在两种杧果对照组叶片中可检测到,但含量较低。杧果叶片蜡质中角鲨烯含量较低,并且在150 μmol·L-1 PA处理的金煌叶片中未检测到。此外,在杧果叶片表皮蜡质中还检测到了酯类和少量其他未分类的物质。杧果叶片表皮蜡质以C16和C24酯类为主。未分类化合物主要是C14 和C23 酚类化合物,在所有处理组中两个杧果品种叶片蜡质中无明显变化。本研究结果表明150 μmol·L-1 PA处理可提高金煌杧果叶片表皮蜡质中C28、C29和C32醛类化合物的含量。
蜡质的合成主要分为3 个步骤:首先,质体中C16 和C18 脂肪酸的从头合成;其次,C16 和C18 脂肪酸在内质网中进一步延伸合成链长为C20~C34的超长链脂肪酸;最后,超长链脂肪酸被修饰为不同蜡质组分。脂肪酸主要通过两个途径合成角质层蜡质:一是烷类合成途径,合成醛类、烷类、仲醇类以及酮类;二是伯醇合成途径,合成伯醇类和酯类,大量基因参与了该调控过程[29]。MT 可以缓解环境中的非生物胁迫对植物造成的伤害,吕夏晨等[30]发现,适量浓度的MT 在干旱胁迫下,可通过上调大麦蜡质合成相关基因MYB94、CER6、CER10 和TA6-SFT 的表达提高蜡质含量,进而缓解干旱胁迫对大麦造成的伤害,笔者在本研究中发现MT可以提高杧果蜡质含量,与先前研究一致。PA对植物的生长调节与其喷施的浓度有关,罗晓蔓等[31]研究发现,PA对马尾松幼苗苗高、地径、生物量和部分氧化酶活性等具有低促高抑效应。本研究结果显示,150 μmol·L-1 PA处理对杧果叶片蜡质含量的提高效果均较200 μmol·L-1浓度的效果好,并且高浓度的PA处理减少了烷烃含量,笔者推断PA对杧果蜡质的提高存在一个最适浓度,浓度过高反而会抑制杧果表皮蜡质的合成。相比100 μmol·L-1 MT+150 μmol·L-1 PA处理,100 μmol·L-1 MT+200 μmol·L-1 PA处理对台农1号杧果叶片表皮蜡质含量提升效果最明显,是对照组的3.2倍,其中烷烃减少了64.66%,而酯类化合物含量增加了11.93 倍。有研究表明MT 处理可以上调超长链脂肪酸合成通路核心基因KCS 家族成员表达[16],笔者推测MT 可能调节了蜡质合成前体的增加,而高浓度的PA抑制了烷类合成途径,从而使MT调控积累的蜡质合成前体通过伯醇合成途径产生大量的酯类化合物。而100 μmol·L-1 MT+200 μmol·L-1 PA对金煌杧果没有显著作用,可能是因为不同杧果品种对外源试剂浓度的敏感度存在差异。其具体的调控机制有待后续研究验证。
浅绿幼叶转变为深绿新叶是杧果叶片发育的关键时期,该阶段通常需要10~15 d,笔者在本研究中处理试验设置在该阶段完成,每2 d喷施1次,共计3次,且最后一次喷施距离采样时间7 d。由于笔者在本研究中重点研究外源试剂处理对杧果叶片表皮蜡质的影响,选择的植株也是种植在温室的杧果苗,旨在为未来通过蜡质研究提高杧果抗性、改善栽培条件提供理论研究。因此,设置的处理条件与实际生产中的外源试剂喷施间隔期存在差异,后期需要进行相关的田间试验,结合试剂经济性进一步优化试验方案,改良喷施过程,应对生产实际。蜡质是植物长期应对外界不良环境、生物胁迫和非生物胁迫等形成的保护屏障,在抵抗植物非气孔性失水、抗旱和防止病原菌侵染等方面都具有重要的生态功能[32]。本研究结果表明通过喷施外源试剂可以改变杧果叶片蜡质含量和组分,进而尝试提高杧果抵御生物和非生物胁迫的能力。本研究结果为后续研究外源试剂对杧果叶片表皮蜡质的合成调节作用提供了参考。
4 结 论
不同外源试剂处理可改变杧果叶片蜡质脂肪族化合物的碳链分布和萜类化合物含量,从而影响总含量的变化。100 μmol·L-1 MT+200 μmol·L-1 PA组合试剂对台农1号杧果叶片表皮蜡质含量的提升效果最显著,150 μmol·L-1 PA 对金煌和台农1 号两个杧果品种叶片表皮蜡质含量的提升效果均较好。
[1] CHU W J,GAO H Y,CHEN H J,FANG X J,ZHENG Y H.Effects of cuticular wax on the postharvest quality of blueberry fruit[J].Food Chemistry,2018,239:68-74.
[2] WANG P,WANG J J,ZHANG H Y,WANG C,ZHAO L,HUANG T,QING K. Chemical composition,crystal morphology,and key gene expression of the cuticular waxes of Goji(Lycium barbarum L.) berries[J]. Journal of Agricultural and Food Chemistry,2021,69(28):7874-7883.
[3] LIAKOPOULOS G,STAVRIANAKOU S,KARABOURNIOTIS G. Trichome layers versus dehaired lamina of Olea europaea leaves:Differences in flavonoid distribution,UV-absorbing capacity,and wax yield[J]. Environmental and Experimental Botany,2006,55(3):294-304.
[4] ZHANG Y L,YOU C X,LI Y Y,HAO Y J.Advances in biosynthesis,regulation,and function of apple cuticular wax[J]. Frontiers in Plant Science,2020,11:1165.
[5] 冀泽宇.外源多巴胺对黄瓜霜霉病的缓解效应及其机理研究[D].杨凌:西北农林科技大学,2022.JI Zeyu. Alleviation effect and mechanism of exogenous dopamine on cucumber downy mildew[D].Yangling:Northwest A&F University,2022.
[6] BALBONTÍN C,GUTIÉRREZ C,SCHREIBER L,ZEISLERDIEHL V V,MARÍN J C,URRUTIA V,HIRZEL J,FIGUEROA C R.Alkane biosynthesis is promoted in methyl jasmonate-treated sweet cherry (Prunus avium) fruit cuticles[J]. Journal of the Science of Food and Agriculture,2024,104(1):530-535.
[7] 吴潇,陈杨杨,石新杰,齐开杰,曹鹏,殷豪,张绍铃.喷施外源激素对‘玉露香’梨叶片表皮蜡质组分、结构及渗透性的影响[J].南京农业大学学报,2018,41(4):647-654.WU Xiao,CHEN Yangyang,SHI Xinjie,QI Kaijie,CAO Peng,YIN Hao,ZHANG Shaoling.Effects of spraying exogenous hormones on cuticular wax composition,structure and permeability of the leaves in‘Yuluxiang’pear[J].Journal of Nanjing Agricultural University,2018,41(4):647-654.
[8] JIANG B,LIU R L,FANG X J,TONG C,CHEN H J,GAO H Y. Effects of salicylic acid treatment on fruit quality and wax composition of blueberry (Vaccinium virgatum Ait) [J]. Food Chemistry,2022,368:130757.
[9] 栗扬.2,4-表油菜素内酯引发种子对甜高粱和青贮玉米抗旱生理及叶角质层的影响[D].重庆:西南大学,2021.LI Yang.Effects of 2,4-epbrassinolide priming on drought-resistant physiology and leaf cuticle of sweet sorghum and silage maize[D].Chongqing:Southwest University,2021.
[10] DONG J X,KEBBEH M,YAN R,HUAN C,JIANG T J,ZHENG X L. Melatonin treatment delays ripening in mangoes associated with maintaining the membrane integrity of fruit exocarp during postharvest[J]. Plant Physiology and Biochemistry,2021,169:22-28.
[11] 高雨薇,邓朝军,许奇志,李浩伟,项于倩,马翠兰,蒋际谋.外源褪黑素对新白8 号枇杷果实日灼和果皮解剖结构的影响[J].果树学报,2024,41(7):1387-1400.GAO Yuwei,DENG Chaojun,XU Qizhi,LI Haowei,XIANG Yuqian,MA Cuilan,JIANG Jimou.Effects of exogenous melatonin on the sunburn and peel anatomical structure of Xinbai 8 loquat fruit[J].Journal of Fruit Science,2024,41(7):1387-1400.
[12] 丁飞.褪黑素缓解番茄低温与水分胁迫机理研究[D].杨凌:西北农林科技大学,2017.DING Fei. Mechanisms of melatonin alleviating low temperature stress and water stress in tomato plants[D].Yangling:Northwest A&F University,2017.
[13] LI J,CAO Y R,BIAN S C,HONG S B,XU K,ZANG Y X,ZHENG W W.Melatonin improves the storage quality of rabbiteye blueberry (Vaccinium ashei) by affecting cuticular wax profile[J].Food Chemistry:X,2024,21:101106.
[14] LIU R L,SHANG F Z,NIU B,WU W J,HAN Y C,CHEN H J,GAO H Y. Melatonin treatment delays the softening of blueberry fruit by modulating cuticular wax metabolism and reducing cell wall degradation[J]. Food Research International,2023,173:113357.
[15] LIN X,HUANG S A,HUBER D J,ZHANG Q,WAN X,PENG J S,LUO D C,DONG X Q,ZHU S L. Melatonin treatment affects wax composition and maintains storage quality in‘Kongxin’plum(Prunus salicina L.cv)during postharvest[J].Foods,2022,11(24):3972.
[16] WU X,CHEN Y Y,SHI X J,QI K J,CAO P,LIU X Y,YIN H,ZHANG S L.Effects of palmitic acid(16∶0),hexacosanoic acid(26∶0),ethephon and methyl jasmonate on the cuticular wax composition,structure and expression of key gene in the fruits of three pear cultivars[J].Functional Plant Biology,2020,47(2):156-169.
[17] 马莉.甘蔗蜡质的代谢物组成、抗虫性及相关调控基因研究[D].南宁:广西大学,2023.MA Li. Metabolite composition,insect resistance and related regulatory genes in sugarcane waxes[D].Nanning:Guangxi University,2023.
[18] 武瑞鑫,刘贵波.禾本科植物表皮蜡质形成及其与环境因素的关系[J].草学,2021(4):9-18.WU Ruixin,LIU Guibo.Research progress on the epidermal wax of Gramineae plants and its responses to environment stress[J].Journal of Grassland and Forage Science,2021(4):9-18.
[19] MOGGIA C,GRAELL J,LARA I,SCHMEDA-HIRSCHMANN G,THOMAS-VALDÉS S,LOBOS G A. Fruit characteristics and cuticle triterpenes as related to postharvest quality of highbush blueberries[J].Scientia Horticulturae,2016,211:449-457.
[20] 张丽萍,刘瑞玲,韩延超,陈杭君,吴伟杰,房祥军,郜海燕.蓝莓表皮蜡质组分对果实采后抗病性的影响[J].中国食品学报,2021,21(12):205-213.ZHANG Liping,LIU Ruiling,HAN Yanchao,CHEN Hangjun,WU Weijie,FANG Xiangjun,GAO Haiyan. Effects of cuticular wax on disease resistance of postharvest blueberry[J].Journal of Chinese Institute of Food Science and Technology,2021,21(12):205-213.
[21] JIANG Y Y,PENG Y T,HOU G Y,YANG M,HE C X,SHE M S,LI X,LI M Y,CHEN Q,ZHANG Y,LIN Y X,ZHANG Y T,WANG Y,HE W,WANG X R,TANG H R,LUO Y.A high epicuticular wax strawberry mutant reveals enhanced resistance to Tetranychus urticae Koch and Botrytis cinerea[J].Scientia Horticulturae,2024,324:112636.
[22] CAO F G,LI Z X,JIANG L J,LIU C,QIAN Q,YANG F,MA F W,GUAN Q M. Genome-wide association study (GWAS) of leaf wax components of apple[J].Stress Biology,2021,1(1):13.
[23] HUANG H,JIANG Y M. Chemical composition of the cuticle membrane of pitaya fruits (Hylocereus polyrhizus)[J]. Agriculture,2019,9(12):250.
[24] WU J B,YOU Y Q,WU X,LIU F,LI G P,YIN H,GU C,QI K J,WEI Q,WANG S B,YAO Q S,ZHAN R L,ZHANG S L.The dynamic changes of mango(Mangifera indica L.)epicuticular wax during fruit development and effect of epicuticular wax on Colletotrichum gloeosporioides invasion[J]. Frontiers in Plant Science,2023,14:1264660.
[25] TRIVEDI P,NGUYEN N,KLAVINS L,KVIESIS J,HEINONEN E,REMES J,JOKIPII-LUKKARI S,KLAVINS M,KARPPINEN K,JAAKOLA L,HÄGGMAN H. Analysis of composition,morphology,and biosynthesis of cuticular wax in wild type bilberry (Vaccinium myrtillus L.) and its glossy mutant[J].Food Chemistry,2021,354:129517.
[26] CHU W J,GAO H Y,CAO S F,FANG X J,CHEN H J,XIAO S Y. Composition and morphology of cuticular wax in blueberry(Vaccinium spp.)fruits[J].Food Chemistry,2017,219:436-442.
[27] WANG J Q,HAO H H,LIU R S,MA Q L,XU J,CHEN F,CHENG Y J,DENG X X. Comparative analysis of surface wax in mature fruits between Satsuma mandarin (Citrus unshiu) and‘Newhall’navel orange (Citrus sinensis) from the perspective of crystal morphology,chemical composition and key gene expression[J].Food Chemistry,2014,153:177-185.
[28] WU X,YIN H,CHEN Y Y,LI L,WANG Y Z,HAO P P,CAO P,QI K J,ZHANG S L.Chemical composition,crystal morphology and key gene expression of cuticular waxes of Asian pears at harvest and after storage[J].Postharvest Biology and Technology,2017,132:71-80.
[29] 李娜.枣果实蜡质合成关键基因挖掘与验证[D].太谷:山西农业大学,2021.LI Na.Mining and verification of key genes for wax synthesis in jujube fruit[D].Taigu:Shanxi Agricultural University,2021.
[30] 吕夏晨,徐玲,张蓝天,张唯一,韩泾锦,童涛,张晓勤,薛大伟.褪黑素对干旱胁迫下大麦生理及蜡质基因表达的影响[J].植物生理学报,2020,56(5):1073-1080.LÜ Xiachen,XU Ling,ZHANG Lantian,ZHANG Weiyi,HAN Jingjin,TONG Tao,ZHANG Xiaoqin,XUE Dawei. Effects of exogenous melatonin on physiology and waxy genes expression in barley under drought stress[J]. Plant Physiology Journal,2020,56(5):1073-1080.
[31] 罗晓蔓,李敏,丁贵杰.三种有机酸对马尾松种子萌发及幼苗的化感作用[J].种子,2024,43(11):10-16.LUO Xiaoman,LI Min,DING Guijie. Allelopathic effects of three organic acids on seed germination and seeding growth of Pinus massoniana[J].Seed,2024,43(11):10-16.
[32] LEWANDOWSKA M,KEYL A,FEUSSNER I.Wax biosynthesis in response to danger:Its regulation upon abiotic and biotic stress[J].The New Phytologist,2020,227(3):698-713.