柑橘是世界第一大果树,以柚为代表的宽皮柑橘、橙和柠檬等均属于真正柑橘[1]。马家柚[Citrus maxima(L.)Osbeck‘Majiayou’]是江西省上饶市广丰区地方特色农产品,因具有果肉细嫩多汁、脆爽可口、药食兼用等特点而逐渐受到大众追捧,享有“江西省酸柚类第一名”的美誉[2],又由于其果肉色泽淡红似胭脂,汁胞饱满脆嫩,因此随着市场反馈和效益的稳步提升,马家柚种植规模和范围持续扩大,2023年仅广丰区种植面积可达1.33 万hm2,综合产值30亿元[3]。柚类多为实生繁殖,受环境气候影响易产生大量遗传变异,形成新种质。目前生产中存在两大类型的马家柚品系,即果皮光滑平整、低酸型的细皮马家柚和果皮粗糙坑洼、高酸型的粗皮马家柚[4]。粗皮马家柚因其果实特点通常不用于商品果栽植。由于生长初期细皮和粗皮马家柚品系在形态学上相似度极高,加之早期马家柚苗木市场管理混乱,大量粗皮品系和地方柚类资源与细皮马家柚苗木混卖现象频发,对果农造成了巨大的经济损失[2],作为“无商品属性”的粗皮品系也因此在马家柚产业中长期处于边缘地位。笔者通过实地调查并结合粗皮和细皮马家柚品系已有的研究进展,发现细皮和粗皮品系马家柚树姿均较为开张,树势中等,自然生长树高为5.11~5.39 m[4];两者每年均抽梢3 次,梢长和粗度均差异不显著;叶片形态均为卵圆形,翼叶宽大,粗皮品系成熟叶片叶脉相较于细皮品系更为突出,叶缘向叶背面翻转程度更高,粗皮品系部分嫩梢呈紫红色,细皮马家柚则为淡绿色;两者均为单生或总状花序,花蕾大,完全开放时花药低于柱头,粗皮品系花后7~10 d 部分花子房积累花青素,呈深紫色,细皮品系子房为深绿色,辨别花后子房色泽可作为早期分辨品系间差异的方法之一[5]。粗皮和细皮品系果实完熟均需210 d左右,细皮品系果实近卵圆形,油胞凹陷,果面光滑,套袋果实成熟时外皮金黄色,粗皮品系成熟果实为倒卵圆形,外果皮油胞突出,果面粗糙,金黄色和紫红色相间[6];粗皮品系可滴定酸含量为1.2%~1.4%,细皮品系可滴定酸含量为0.4%~0.8%[5,7]。对粗皮和细皮品系马家柚进行重测序比对,发现两者基因组差异较大,排除了两者是因无性芽变繁殖产生的变异。此外,已开发了用于区分和鉴定粗皮和细皮品系马家柚的InDel分子标记,可实现种苗早期筛选,有助于马家柚产业健康发展[8-9]。
马家柚品种选育工作进展较为缓慢,除粗皮和细皮品系外,目前还有报道称发现不稳定的无核类型,但无核表型还有待进一步观察确定[7-8]。事实上,笔者经过长期产区实践观察发现,马家柚具备一定的单性结实能力,8~10 a(年)树龄的成年马家柚树单株可挂果25~30个。单一马家柚细皮品系栽植园区果实完全无籽,而混栽粗皮品系或留有地方土柚周边的细皮品系有籽,同一园区距离较远的细皮品系却无籽[7]。此外,早期马家柚苗木市场中地方柚和粗皮品系泛滥是造成品系不纯的主要因素,往往果农种植至成年结果期后,苗木品系不纯的现象才开始显露,然而出于经济成本考量,差异品系苗木则是更多地被保留,上述情况共同促成了生产中马家柚有籽无籽性状不稳定的表象。此外,对于单一品系种植园而言,无籽马家柚个体品质稳定性差,不同年份间果实风味差异明显,较低的自然坐果率以及果皮过厚始终制约着马家柚产业规模和效益的进一步提升。大量研究表明,杂交授粉可使马家柚整体风味更为浓郁,降低皮厚的同时有助于果实可食率和产量的提升[7,10-14],粗皮品系也在长期生产实践中被农户习惯性地用于与细皮品系进行混栽,使果实产生一定数量的种籽。
柚类普遍具有自交不亲和性状(self-incompatibility,SI),该性状是植物用于抑制自交衰退、促进异交提升物种多样性和环境适应性的有效机制[15]。梁梅[16]通过细胞学、遗传学等试验首次鉴定并克隆了控制柑橘自交不亲和性状的雌雄蕊决定因子,证实了柑橘是由S-RNase 介导的配子体型SI。韦壮敏等[17]在已鉴定出的9个S-RNase基础上进一步利用63份柚类资源为材料,鉴定出全新的12个S-RNase基因,对63份柚类的鉴定覆盖度可达93.7%。配子体型SI具体表现为当父本花粉授到相同S单倍型的母本花柱时,花粉管无法正常萌发或伸长至子房完成双受精,这一过程是由于花柱特异表达的单一位点复等位基因能够特异性地抑制相同S 基因型花粉管生长[18]。具体而言,相同S基因型的SI亲本柚品种相互授粉表现为不亲和,杂交后果实无籽;不同的S基因型表现为授粉亲和,果实有籽。当亲本间仅有单个S 基因时,相互授粉表现为半亲和,即一部分花粉管停止生长,另一部分可正常生长延伸至花柱底部完成受精作用[16]。生产中在配置杂交组合时提前对亲本S基因型进行鉴定,筛选与待改良品种S基因型不同的优良父本可指导杂交授粉工作的顺利实施。此外,多年的杂交授粉试验结果表明,在花粉群体效应作用下,利用完全亲和性的父本进行人工授粉时会产生150~200粒种籽,大量的种籽会造成消费者食用便捷性下降,不利于商品果销售[10,19]。因此,筛选与待改良品种的半亲和性父本结合人工稀释授粉或授粉树配置下的花粉传粉过程中的自然稀释,理论上可在显著降低杂交果实种籽数的同时实现对风味品质的提升[20]。
笔者通过粗皮品系S基因型鉴定和花粉原位萌发等试验,旨在厘清马家柚主要品系间授粉亲和性特征,解析生产中马家柚果实有籽无籽现象不稳定现象,排除种质重复性开发造成的人力及经济损失。同时,通过比较分析粗皮品系作授粉父本(授粉树)时不同配置模式和距离情况下待改良细皮马家柚品质的差异,为马家柚品质改良、生产少籽风味浓郁的高品质商品果以及马家柚标准化建园下的授粉树配置模式提供可行性技术方案。
1 材料和方法
1.1 材料
不同授粉树配置模式和距离下细皮马家柚果实品质对比试验分别开展于江西省抚州市黎川县天意农庄(中心辐射式)和田圣浣生态农场(行列式),粗皮和细皮品系相互人工授粉试验在天意农庄完成。行列式种植园株行距为3 m×4 m,坡地种植,授粉树(粗皮品系)位于最高处的起始行,单行种植18~20株细皮马家柚成年树,坡度22°~25°,树高2.5~2.8 m,自然开心形,中下部挂果;中心辐射式种植园株行距为3.0 m×3.5 m,平地种植,树高4.5~5.0 m,自然圆头形,上中层挂果。园区树体均无明显病虫害,树势基本一致。样品收集后统一运送至华中农业大学园艺林学学院实验室进行常规品质测定,部分果肉组织用液氮冷冻,并置于-80 ℃冰箱保存,待后续可溶性糖和有机酸含量测定。粗皮和细皮品系S基因型鉴定所用叶片材料均采集于天意农庄。
1.2 方法
1.2.1 S 基因型鉴定 参考韦壮敏等[17]的S 基因鉴定方法,采用改良后的CTAB 法提取叶片DNA,采用NanoDrop 1000 超微量分光光度计检测DNA 的质量及浓度,鉴于韦壮敏等[17]报道的21对(S1~S21)引物对64 份柚资源鉴定覆盖率可达93.7%,将21 对S基因引物序列发送至武汉天一辉远生物科技有限公司合成。PCR 反应体系为25 μL,各组分分别为2×PCR Mix 15 μL,正、反向引物各2 μL(10 μmol·L-1),DNA 2 μL(50 ng·μL-1),超纯水4 μL。PCR 反应程序为94 ℃预变性5 min,94 ℃变性30 s,退火(详细温度参考韦壮敏等[17]的报道)30 s,72 ℃延伸50 s,35次循环;72 ℃终延伸5 min;12 ℃保存。粗皮品系退火温度由57 ℃依次梯度上升至61 ℃,对最终候选的明亮条带进行重复,确保试验结果的准确性,取10 μL扩增产物进行1%琼脂糖凝胶电泳,采用凝胶成像系统进行检测,明亮清晰条带即确定含有该引物对应的S基因。
1.2.2 人工杂交授粉及花粉原位萌发试验 粗皮品系盛花期较细皮品系提前3~5 d,提前采集一部分粗皮和细皮品系成熟花药置于28 ℃烘箱至完全散粉,装入离心管中进行标注并干燥避光保存。选择粗皮和细皮品系待授粉树体中下部外围的健壮结果枝,疏除枝上已经开放、未成熟的花朵以及畸形花。用镊子小心将花瓣及花药剥离,只留下柱头,再用小号毛笔蘸取离心管内的干燥花粉点在各自柱头上,分别配置细皮和粗皮品系自交和杂交授粉组合,完成授粉后立即套袋并于授粉枝末端挂牌写明授粉组合配置情况及总花数。套袋5 d 后选择晴朗天气对授粉组合花柱进行收集,如遇阴雨气候则延长至7~10 d进行采集。将收集的不同授粉组合花柱立即分别放入FAA固定液内避光保存。
利用苯胺蓝染色方法观察花粉管状态[16],FAA固定液浸泡24 h后取出花柱,使用95%乙醇溶液洗涤花柱2~3次,70%乙醇溶液继续洗涤2~3次,然后清水洗涤,加入4 mol·L-1NaOH溶液,密封,置于65 ℃水浴锅中水浴60 min,待花柱颜色由黄白色转为橙红色且透明时,取出花柱,倒掉离心管中的NaOH溶液,灌入清水浸泡,每30 min 换1 次清水,换水步骤重复3~4次,至花柱颜色转为黄色。花柱清洗完毕后,往离心管中加入1 mol·L-1K3PO3配制而成的苯胺蓝染色液浸泡染色20 min左右,染色过程注意避光。甘油压片,在UV滤片下观察花粉管的生长状况。
1.2.3 花粉活力检测和花粉体外萌发试验 使用I2-KI 染色法检测花粉活力。取适量花粉于离心管中,将离心管用锡箔纸包裹避光,再向管中在开裂前收集完整的花药,在28 ℃下干燥24 h 以释放花粉。向成熟花粉加入200 μL 的染液,轻轻振荡混匀,在黑暗条件下染色3~5 min。滴2~3滴于载玻片上,并在显微镜下观察。
参考梁梅[16]的方法计算花粉体外萌发率,花粉粒培养在液体萌发培养基的表面上,培养基成分包括:0.02% MgSO4,0.01% KNO3,0.03% Ca(NO3)2,0.01% H3BO3,20% PEG-4000 以及20%蔗糖,pH=6.0。室温培养8 h,镜检观察花粉萌发情况并统计萌发率,将花粉管长度超过花粉直径作为萌发标准。
1.2.4 有籽果率调查及果实品质测定 对两种授粉树配置模式的自然传粉状态下细皮品系有籽率进行调查,行列式园区纵向共13行,每行采集10个果;辐射式以授粉树(粗皮品系)为中心,外围每圈分别取9~12 个果,分别统计两种配置模式下各行有籽果率。用于果实品质测定的果实采集方案如下:行列式园区分别选取第1、9、13行两端及中间处共9株树(圈中数字编号为对应样本树),行列式对照组(CK1)为相同树上的无籽果实;辐射式园区选取授粉树为中心不同距离的第1、2、3行各方位共12株树(圈中数字编号为对应样本树),每单株中下部的不同方位随机选取3个大小均一的果实,每行共采集9个果实,辐射式对照组(CK2)为相同树上的无籽果实,参考徐宸宇[7]和Zhang[21]的方法测定可溶性糖和可滴定酸含量及常规品质。
1.3 数据统计与分析
采用Excel 2016软件对试验数据进行统计与作图,采用SPSS 26软件进行差异显著性分析。
2 结果与分析
2.1 粗皮品系马家柚S基因型鉴定
根据韦壮敏等[17]的研究结果,马家柚(主栽细皮品系)S基因型为S10S16,为验证该方法的可靠性,笔者分别采集了主栽细皮及粗皮品系马家柚叶片进行S基因型鉴定与验证。与前人报道一致,细皮马家柚扩增结果为S10S16,粗皮马家柚品系S基因型为S10S12,与细皮品系具有一个相同S 基因(图1)。根据S 基因型预测两者相互授粉,结果可能表现为半亲和性。

图1 S-RNase 基因特异扩增
Fig.1 Specific amplification of S-RNase gene
2.2 粗皮和细皮品系马家柚花粉活力测定
为进一步验证粗皮和细皮马家柚品系间授粉亲和性,首先通过花粉活力和体外萌发试验验证两者花粉育性。结果显示,细皮和粗皮马家柚品系花粉活性分别为98.17%和97.04%,细皮和粗皮品系的花粉体外萌发率分别为45.96%和42.67%,差异不显著,满足后续相互授粉的条件(图2,表1)。
表1 细皮和粗皮马家柚品系花粉活力和花粉离体萌发率统计
Table 1 Pollen staining activity and in vitro germination rate of Xipi and Cupi strains of Majiayou
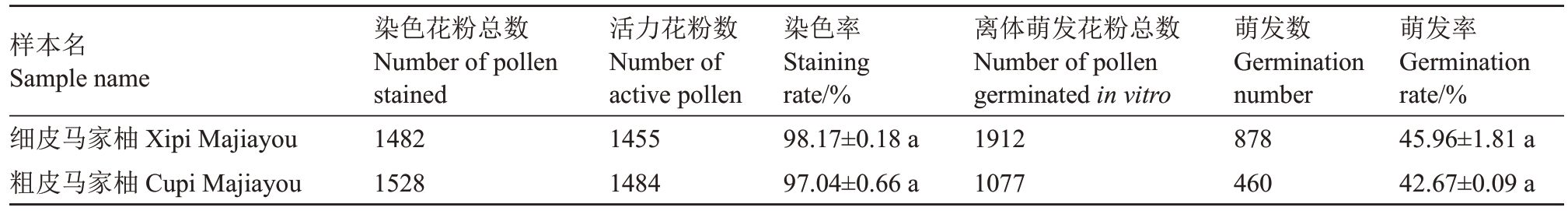
注:同列数据后不同小写字母表示在0.05 水平差异显著。
Note:Different small letters in the same column indicate significant difference at 0.05 level.
样本名Sample name细皮马家柚Xipi Majiayou粗皮马家柚Cupi Majiayou萌发率Germination rate/%45.96±1.81 a 42.67±0.09 a染色花粉总数Number of pollen stained 1482 1528活力花粉数Number of active pollen 1455 1484染色率Staining rate/%98.17±0.18 a 97.04±0.66 a离体萌发花粉总数Number of pollen germinated in vitro 1912 1077萌发数Germination number 878 460

图2 细皮(A、B)和粗皮(C、D)品系马家柚花粉I2-KI 染色花粉及离体萌发
Fig.2 I2-KI stained pollen and in vitro germination of Xipi(A,B)and Cupi(C,D)strains of Majiayou
2.3 粗皮和细皮品系马家柚授粉亲和性鉴定
粗皮和细皮品系自交和相互授粉后的花柱用于苯胺蓝染色观察花粉管生长状态。染色结果显示,细皮和粗皮品系自交授粉后花粉管均表现为停留在花柱顶部和上部(图3 左上和右下)便停止伸长,即自交时完全不亲和;然而粗皮和细皮品系相互授粉后花粉管则表现一部分正常生长至花柱中下部,一部分则于花柱顶部停止生长(图3 右上和左下),即粗皮和细皮品系相互授粉呈半亲和性。
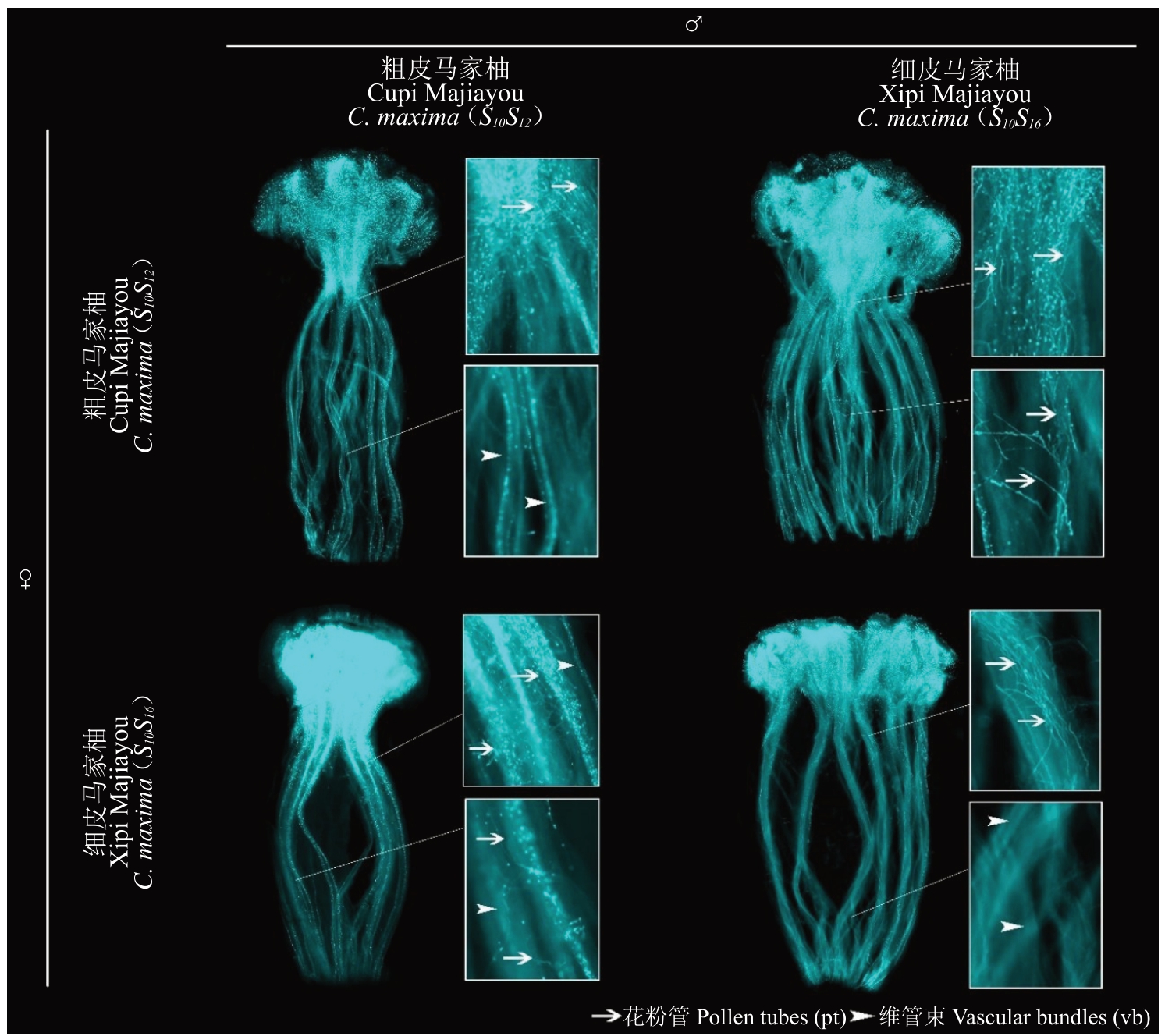
图3 细皮和粗皮品系马家柚自交和相互授粉花柱苯胺蓝染色
Fig.3 Self and cross-pollination styles of Cupi and Xipi strains of Majiayou dyed with aniline blue
2.4 两种授粉树配置模式下主栽马家柚有籽果率及品质分析
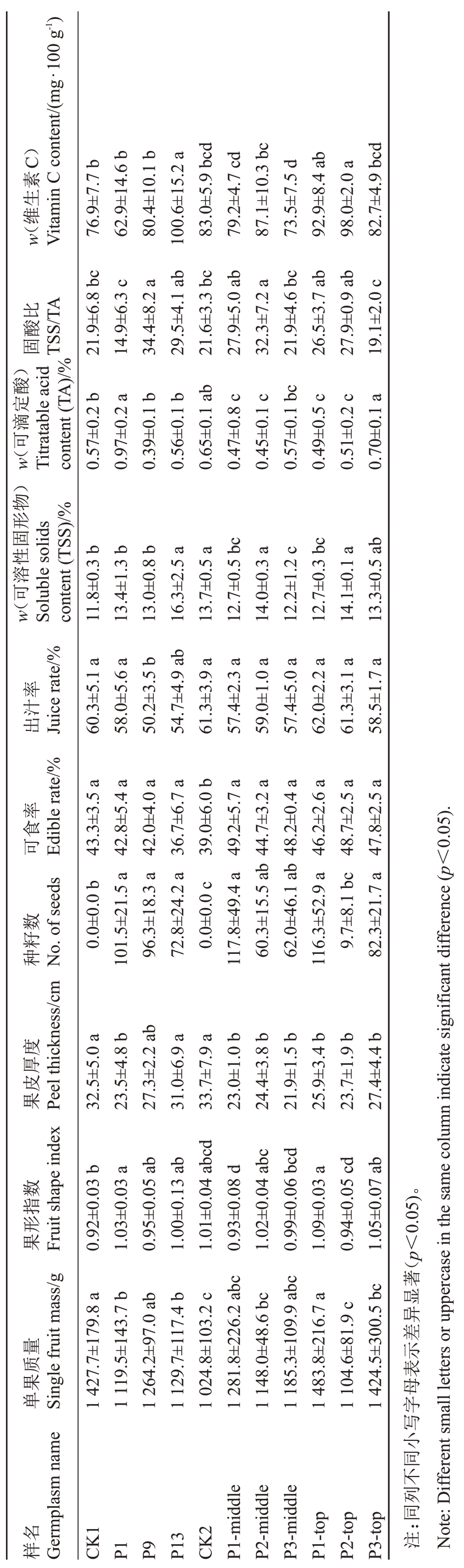
为探究半亲和性授粉父本配置下不同距离的自然传粉马家柚有籽率及果实品质,两种授粉树配置模式园区示意图如图4-A~B所示。分别对不同配置模式下的马家柚有籽果率进行调查,结果显示,行列式授粉树模式下,P1~P8 各行有籽果率均高于80.0%,P9~P13 各行果实有籽率降低,介于66.7%~73.3%。中心辐射式授粉树模式下,P1~P2 行有籽果率高于87.5%,P3行有籽果率降低为59.7%(图4-D~E)。进一步对不同授粉树配置模式下的细皮马家柚果实品质进行比较分析,结果显示,随着自然传粉距离的增加,行列式模式下的主栽马家柚果皮厚度呈现出先降后增的趋势(图4-C),其中P1和P9行果皮厚度分别为23.5 和27.3 mm,相较于CK1 的32.5 mm 分别降低了27.7%和16.0%,P13行果皮厚度和CK1无显著差异。此外,种籽数表现为随自然传粉距离增加不断降低。果实内在风味品质方面,P13 行马家柚果实可溶性固形物含量为16.3%,显著高于CK1 4.5个百分点;P1行果实可滴定酸含量相较于CK1显著提高0.4 个百分点,P9 行可滴定酸含量为各行间最低,为0.39%;固酸比(TSS/TA)以P1行最低,为14.9,相较于CK1 降低了32.0%,P9 和P13 行相较于CK1分别增加了57.1%和34.7%。维生素C 含量呈现出随自然传粉距离的增加而不断升高的趋势(表2)。综合果实内在及外观品质,P9行果实品质最优,即行列式坡地栽植模式下每间隔36~40 m配置授粉树。
表2 两种授粉树配置模式下不同自然授粉距离的马家柚果实品质分析
Table 2 Analysis of fruit quality of Majiayou planted at different distances under two pollination tree configuration modes
?
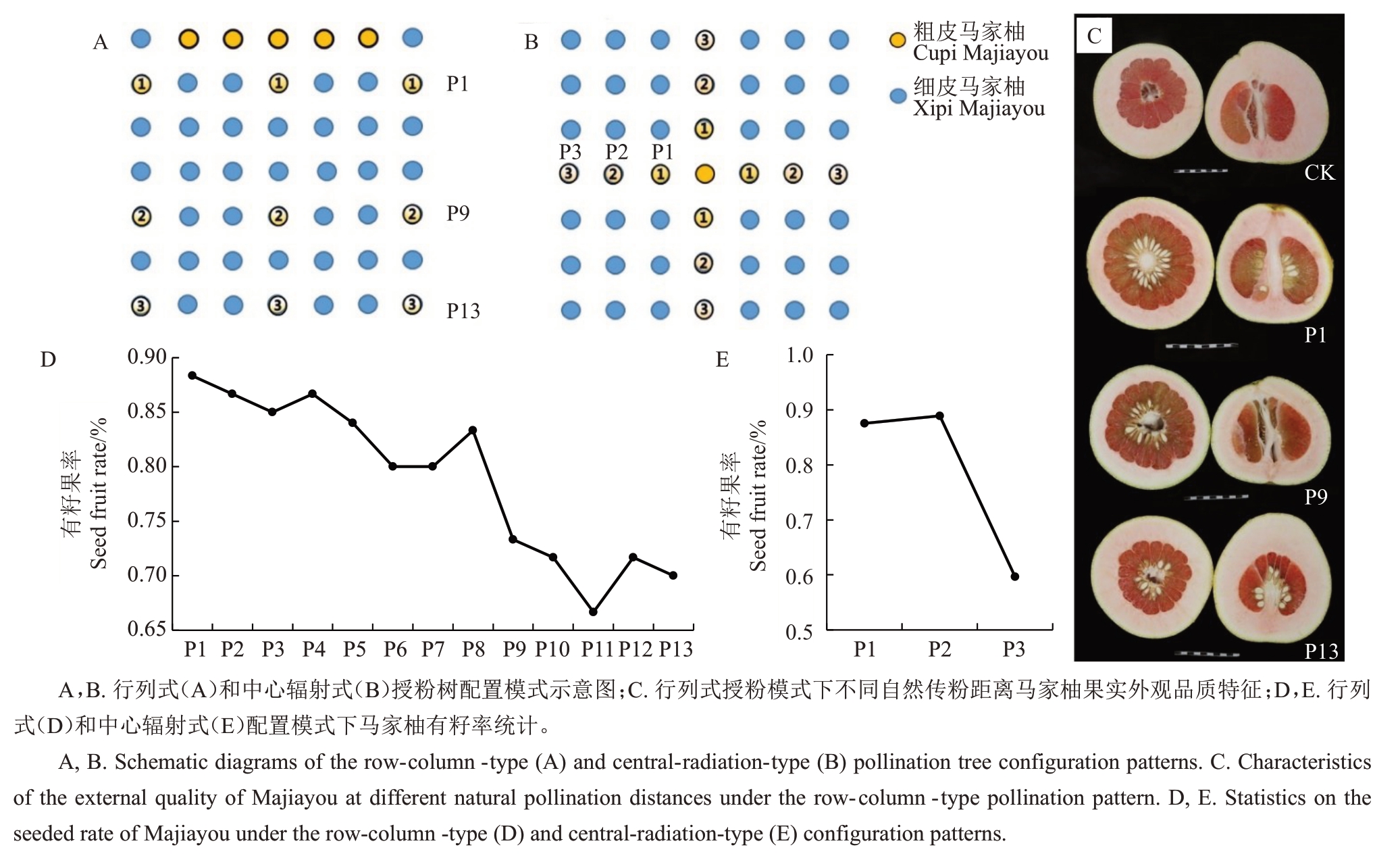
图4 不同授粉树配置模式图及不同距离自然传粉的主栽马家柚有籽果率
Fig.4 Diagram of different pollination tree configuration modes and natural pollination at different distances for the main planting Majiayou with seeded fruit rate
在中心辐射式授粉树配置模式下,分别对不同距离及不同结果部位有籽和无籽细皮马家柚果实品质指标进行比较。结果显示,处理组果皮厚度均显著低于CK2 的33.7 mm,果皮厚度平均降低18.7%~35.0%。此外,有籽果可食率相较于CK2 均有显著提升。在内在风味品质方面,P1 和P2 行上中部有籽果相较于CK2均显著降低了可滴定酸含量,P3行各部位与CK2 无显著差异。各结果部位马家柚固酸比随传粉距离的增加表现出明显的先增后降趋势,P1 和P2 行上部有籽果固酸比相较于CK2 分别增加了29.2%和49.5%;中部果实则分别增加了21.0%和27.4%,P3 行各部位有籽果与CK2 无显著差异(表2)。中心辐射式栽植模式下以P2 行果实综合品质最优,即12~20 株细皮主栽品系于中心处适宜配置1株粗皮品系。
2.5 行列式授粉树配置模式下不同距离主栽马家柚风味品质分析
行列式授粉树配置模式下随传粉距离的增加其果实外观品质表现出一定趋势,同时标准化建园中多以行列式排布,进一步对可溶性糖及有机酸含量进行测定分析,结果如图5 所示。P13 行主栽马家柚可溶性总糖及蔗糖、葡萄糖含量相较于CK1分别显著升高36.6%、24.6%、47.5%,果糖含量相较于CK1 升高了25.1%;P1 行可溶性糖各组分含量相较于CK1均有一定降低。在有机酸含量方面,P9行总酸和柠檬酸含量相较于CK1分别显著降低了20.5%和33.3%;P1 行总酸和柠檬酸含量较CK1 显著升高。综合而言,主流行列式授粉树配置模式下以P9行马家柚果实糖酸风味品质最优。
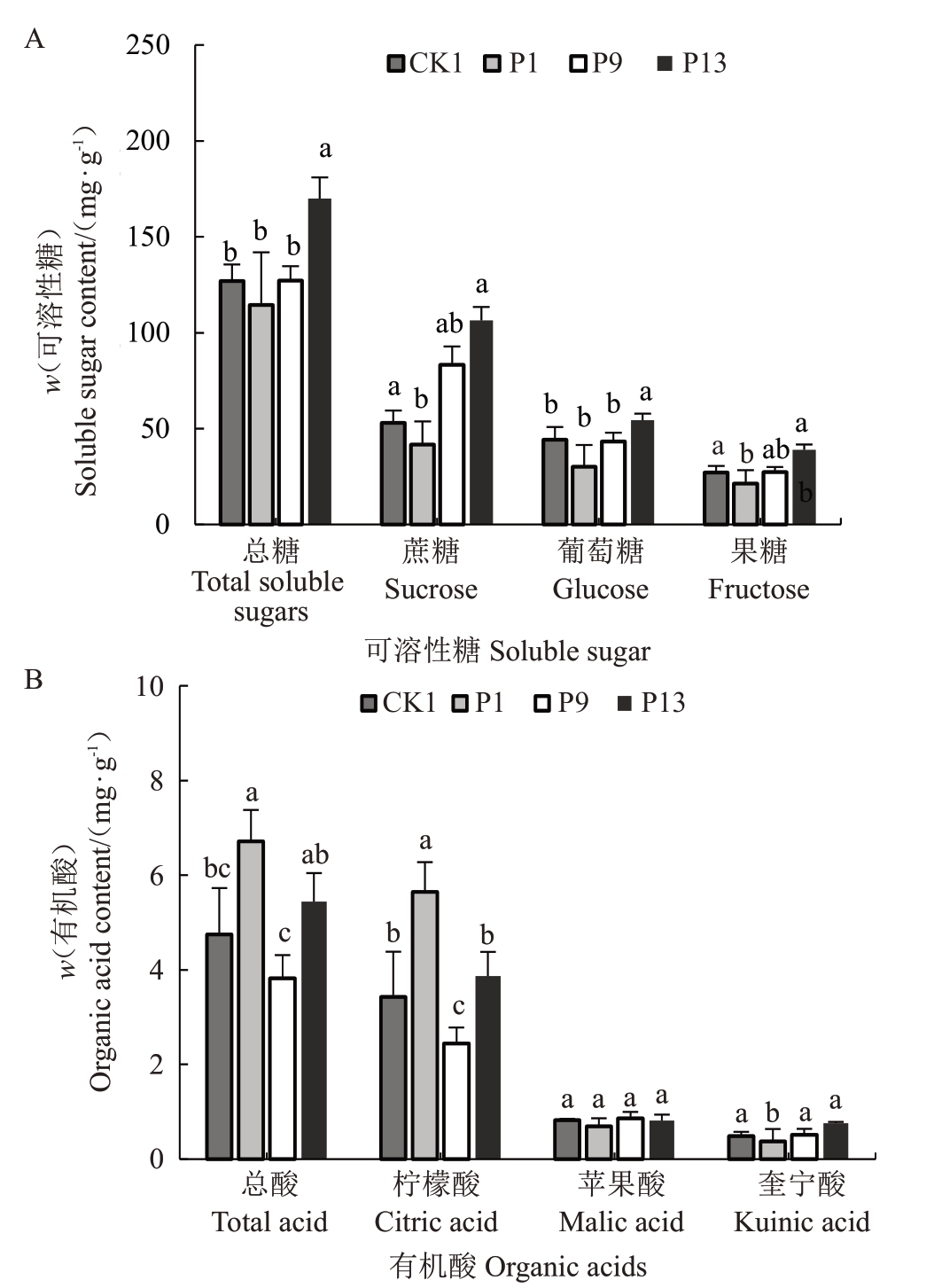
图5 行列式授粉树配置模式下不同自然传粉距离的细皮马家柚可溶性糖(A)和有机酸(B)含量
Fig.5 The content of soluble sugars(A)and organic acids(B)in the main cultivated Xipi Majiayou with different natural pollination distances in a determinant pattern
3 讨 论
马家柚是原产于中国江西省广丰县大南镇的地方特色柚类品种,自20 世纪80 年代初至今已有近45 a(年)的品种发展历史,作为地方支柱型产业,马家柚在地区脱贫致富道路上发挥着关键性作用[2]。马家柚属于典型的内陆性柚,不同于海洋性柚类的地理隔离,内陆各地域间自然与人为因素以及柚的单胚特性共同促进了柚的遗传多样性[22]。曹立新[23]系统性地调查了广丰县及其周边地区46 份柚资源并对马家柚起源和亲缘关系进行分析,发现马家柚已产生部分变异。目前地方及研究人员普遍认为马家柚主要分为主栽品种和粗皮、无核马家柚两个变异品系,其中粗皮马家柚在树势、嫩梢、叶片和果实特征等方面与主栽品种差异明显。Lu 等[5]研究表明,CgAN1、CgRuby1 和CgPH4 分别在粗皮马家柚不同组织中的差异表达促进了花青素和酸度的高积累。此外,粗皮和细皮马家柚全基因组SNP信息为两者遗传关系提供了更为直接的证据,结果表明粗皮和细皮马家柚每条染色体上均存在一个以上的非相似区域,即粗皮和细皮马家柚并非其中一方的芽变。值得一提的是,无核品系与主栽马家柚植物学特征高度一致,在果实内在品质、矿质元素、抗氧化物质及活性氧和内源激素等方面两者也基本保持一致[4]。柚类除普遍具有自交不亲和特性外,还具有不同程度的单性结实能力[16],因此,柚类无核品系的真实性往往需要通过严谨的自交和异交试验进行验证。事实上,笔者通过多年产区实践发现,单一主栽细皮品系栽植的成年果园马家柚逐年间均为无籽,而同一园区土柚或粗皮马家柚周边的细皮品系果实有籽性状不稳定。此外,粗皮马家柚均表现为有籽。以上现象促使笔者进一步验证马家柚无核品系的真实性,避免品种重复性开发带来的资金和人力损失。笔者利用韦壮敏等[17]设计的21对S-RNase基因引物,特异性地扩增鉴定粗皮马家柚S基因型,同时扩增已知S 基因型的主栽马家柚验证引物可行性。结果显示粗皮马家柚S 基因型为S10S12,与主栽马家柚(S10S16)为半亲和。花粉原位萌发试验结果进一步验证了基于两者S基因型下相互自交和异交的预测表型,即当园区同时存在粗皮和细皮马家柚时,两者相互传粉会导致果实有籽,而单一纯系的主栽马家柚(细皮)种植园则果实无籽。早期因马家柚产业发展迅猛导致苗木混卖而造成的种植园品系不纯进一步支持了本研究结论的可靠性。然而,粗皮马家柚并非毫无商品性价值,马家柚作为酸柚类型品种,高糖高酸赋予马家柚果实特有风味,粗皮马家柚往往因管理不当加剧了高酸口感,走访注意到目前已有少部分果园针对粗皮马家柚进行的肥水统一管理以生产出风味更为浓郁的马家柚,从而满足不同喜好的消费者需求。
果实发育完整性尤其受到授粉受精后激素水平的影响,生长素和赤霉素被认为是果实受精后启动发育的关键[24-27]。单性结实产生无籽果实,是园艺作物中高度偏好的农艺性状[28-29],单性结实能力强弱直接影响果实产量及内在品质,利用外源激素诱导单性结实果实生产已在多种园艺作物中得到了很好的应用[30-31]。柚类果实个体较大,仅依赖单性结实形成完整果实要求品种自身更为充足的激素供给,同时受限于柚果实特殊构造,即果肉(汁胞)的增大慢于外果皮的膨大和增厚以及油胞层与白皮层的隔离作用,直接阻碍了发育过程中外源激素的有效补充。沙田柚单性结实能力弱,较低的坐果率和未授粉果实中心柱中空时产生的内裂流胶要求完全的授粉受精;马家柚等酸柚类型品种无籽果易出现部分汁囊不发育或发育不均的现象,此外,无籽马家柚个体差异大、产量低、果皮厚(可食率低)、风味寡淡(低糖、降酸慢)等品质问题尤为突出[11,13]。多年多点多组合的马家柚授粉试验结果表明,通过配置合适的授粉父本可显著改善包括马家柚单果质量、果皮厚度、可食率和风味,是马家柚提质增产的有效技术措施[7,11],本研究结果同样表明,两种半亲和性授粉树配置模式下不同范围内的自然传粉主栽马家柚果实品质得到了显著改善,为马家柚标准化建园提供了数据支撑。授粉果实产生大量种籽以及食用便捷性的下降与无籽化育种目标存在冲突,因此进一步降低因授粉产生的种籽数,生产少籽或瘪籽果实是目前授粉技术推广的难点。花粉密度直接影响授粉后的种籽形态数量和果实外观品质,高花粉密度在体内和体外两种环境下均促进了花粉管内赤霉素(GA3和GA4)含量的增加,而两种生长活性GA的浓度与果实大小、中果皮细胞数量和花粉管生长速率呈正相关[20]。本研究同样获得了类似结论,随着粗皮授粉树与主栽马家柚传粉距离的增加,果实种籽数量不断下降,而果皮厚度则不断增加并逐渐接近无籽果实水平。这实际上是配子体间相互竞争的结果:当柱头上的亲和性花粉数量远远超过全部胚珠受精所需数量时,交配结果则表现为非随机事件,即含有更高水平刺激生长类物质(如赤霉素等)的高活力花粉往往作为旺盛的配子体并最终在竞争中优先进入子房完成受精[20],进而影响果实性状和发育水平。因此,研究不同花粉密度对果实综合品质的影响,找到种籽数量和品质的“平衡点”,对指导生产中授粉品种选择及合理配置授粉树和主栽树之间的数量关系具有实际指导意义。
筛选利用优良性状的父本品种花粉与待改良品种授粉后生产出影响熟期、果形、风味和色泽等的杂交当代果实或种子是花粉直感的具体应用,花粉直感效应对提高籽粒抗性、产量和果实品质潜力巨大,在作物育种和品种改良中具有重大意义[32]。近年来研究人员发现,一方面父本花粉与母本受精后形成种子,发育中的种子向维管系统输送激素信号与周围组织建立连接,协调果实内部的早期分裂膨大和成熟转变[33-35];另一方面,通过韧皮部/胞间连丝特异性地由种子转移至果肉组织中的mRNA 已被证实[36]。笔者筛选鉴定半亲和性的粗皮品系对主栽马家柚进行品质改良已得到有效验证,未来将进一步鉴定柚果实异源授粉中影响果实发育完整性和风味品质的移动mRNA,并加以改造生产出品质优异的高品质柚果实。
4 结 论
通过S 基因型鉴定和花柱苯胺蓝染色实验证实了马家柚粗皮和细皮品系间授粉的半亲和特性,解析了生产中马家柚果实有籽无籽的不稳定现象。同时,通过比较分析不同授粉树配置模式下不同自然传粉距离的主栽马家柚品质差异,为马家柚品质改良、生产少籽且风味浓郁的高品质商品果以及马家柚标准化建园下的授粉树配置方案提供数据支撑。
[1] 郭文武,叶俊丽,邓秀新.新中国果树科学研究70 年:柑橘[J].果树学报,2019,36(10):1264-1272.GUO Wenwu,YE Junli,DENG Xiuxin. Fruit scientific research in new China in the past 70 years:Citrus[J].Journal of Fruit Science,2019,36(10):1264-1272.
[2] 高华清,韩蒙蒙,胡子君.上饶市‘广丰马家柚’发展现状、问题及对策[J].现代园艺,2019(1):40-41.GAO Huaqing,HAN Mengmeng,HU Zijun. Development status,problems and countermeasures of‘Guangfeng Majiayou’in Shangrao city[J].Xiandai Horticulture,2019(1):40-41.
[3] 林国卫,曾芷仪,袁昕,刘佳凝,木也赛尔·吐鲁洪,吉莉莉.马家柚的研究进展[J].上饶师范学院学报,2024,44(3):67-75.LIN Guowei,ZENG Zhiyi,YUAN Xin,LIU Jianing,Muyesai·Turuhong,JI Lili. Research progress of Citrus maxima (L.) Osbeck‘Majiayou’[J]. Journal of Shangrao Normal University,2024,44(3):67-75.
[4] 杨莉,张涓涓,刘德春,刘山蓓,徐炳星,周施清,毛卫平,刘勇.马家柚及其变异品系植物学特性观察[J].中国果菜,2017,37(1):28-30.YANG Li,ZHANG Juanjuan,LIU Dechun,LIU Shanbei,XU Bingxing,ZHOU Shiqing,MAO Weiping,LIU Yong. Observation on botany characteristics of Majia pommole and its variety[J].China Fruit Vegetable,2017,37(1):28-30.
[5] LU Z H,HUANG Y,MAO S Y,WU F F,LIU Y,MAO X Q,ADHIKARI P B,XU Y T,WANG L,ZUO H,RAO M J,XU Q.The high-quality genome of pummelo provides insights into the tissue-specific regulation of citric acid and anthocyanin during domestication[J].Horticulture Research,2022,9:uhac175.
[6] JIANG Q H,YE J L,ZHU K J,WU F F,CHAI L J,XU Q,DENG X X.Transcriptome and co-expression network analyses provide insights into fruit shading that enhances carotenoid accumulation in pomelo(Citrus grandis)[J].Horticultural Plant Journal,2022,8(4):423-434.
[7] 徐宸宇.马家柚优系遗传鉴定及提高品质技术研究[D].武汉:华中农业大学,2021.XU Chenyu.Genetic identification of superiority and quality improvement technology research of Majia pomelo[D]. Wuhan:Huazhong Agricultural University,2021.
[8] 吴方方,徐强.图说广丰马家柚优质高效栽培技术[M].北京:中国农业出版社,2019.WU Fangfang,XU Qiang. Picture shows high-quality and efficient cultivation techniques for Guangfeng Majia pomelo[M].Beijing:China Agriculture Press,2019.
[9] 徐强,万鹏飞,王沦,罗鑫,路志浩,蒋小林,方秋莹,邓秀新.一组马家柚InDel 分子标记及其在柑橘品种种苗早期区分粗皮马家柚中的应用:CN108660246B[P].2021-01-22.XU Qiang,WAN Pengfei,WANG Lun,LUO Xin,LU Zhihao,JIANG Xiaolin,FANG Qiuying,DENG Xiuxin. Ma pomelo In-Del(insertion-deletion)molecular marker,and application of molecular marker in differentiating rough bark Ma pomelo at early stage of citrus seed seedling:CN108660246B[P].2021-01-22.
[10] 徐宸宇,曹立新,唐启正,吴巨勋,伊华林.马家柚遗传来源鉴定与适宜授粉品种筛选[J].华中农业大学学报(自然科学版),2022,41(2):124-135.XU Chenyu,CAO Lixin,TANG Qizheng,WU Juxun,YI Hualin. Identification of Majia pomelo germplasm and screening of varieties with suitable pollination[J]. Journal of Huazhong Agricultural University (Natural Science Edition),2022,41(2):124-135.
[11] 徐宸宇,唐启正,刘慧宇,吴巨勋,伊华林.基于主成分分析综合评价6 个杂交授粉组合的马家柚果实品质[J].果树学报,2024,41(2):282-293.XU Chenyu,TANG Qizheng,LIU Huiyu,WU Juxun,YI Hualin.Comprehensive evaluation on fruit quality of six hybrid pollination combinations of Majiayou based on the principal component analysis[J]. Journal of Fruit Science,2024,41(2):282-293.
[12] 靳瑞霞.马家柚不同授粉组合果实品质研究[D].武汉:华中农业大学,2013.JIN Ruixia. Study effect of different pollination combination on fruit quality of Majia pummelo[D]. Wuhan:Huazhong Agricultural University,2013.
[13] 毛桑隐,路志浩,张祥,叶俊丽,伊华林,柴利军,邓秀新,吴方方,徐强.花粉直感对马家柚果实品质的影响[J].果树学报,2023,40(11):2391-2402.MAO Sangyin,LU Zhihao,ZHANG Xiang,YE Junli,YI Hualin,CHAI Lijun,DENG Xiuxin,WU Fangfang,XU Qiang. Effect of xenia on fruit quality of Majiayou[J].Journal of Fruit Science,2023,40(11):2391-2402.
[14] 杨海健.柑橘有性杂交创造新种质及授粉对马家柚和HB 柚果实品质的影响研究[D].武汉:华中农业大学,2012.YANG Haijian. The study of creating citrus new germplasm by sexual hybridization and the hybridization influence on the fruit quality of Majiayou and HB pomelo[D].Wuhan:Huazhong Agricultural University,2012.
[15] ZHAO H,ZHANG Y,ZHANG H,SONG Y Z,ZHAO F,ZHANG Y E,ZHU S H,ZHANG H K,ZHOU Z D,GUO H,LI M M,LI J H,GAO Q,HAN Q Q,HUANG H Q,COPSEY L,LI Q,CHEN H,COEN E,ZHANG Y J,XUE Y B.Origin,loss,and regain of self-incompatibility in angiosperms[J]. The Plant Cell,2022,34(1):579-596.
[16] 梁梅.柑橘自交不亲和相关基因鉴定及其演化[D].武汉:华中农业大学,2019.LIANG Mei.Gene identification and evolution of self-incompatibility of citrus[D]. Wuhan:Huazhong Agricultural University,2019.
[17] 韦壮敏,魏斯佳,陈鹏,胡健兵,汤雨晴,叶俊丽,李先信,邓秀新,柴利军.63 份柚类资源S 基因型鉴定[J].园艺学报,2022,49(5):1111-1120.WEI Zhuangmin,WEI Sijia,CHEN Peng,HU Jianbing,TANG Yuqing,YE Junli,LI Xianxin,DENG Xiuxin,CHAI Lijun.Identification of S-genotypes of 63 pummelo germplasm resources[J].Acta Horticulturae Sinica,2022,49(5):1111-1120.
[18] LIANG M,CAO Z H,ZHU A D,LIU Y L,TAO M Q,YANG H Y,XU Q Jr,WANG S H,LIU J J,LI Y P,CHEN C W,XIE Z Z,DENG C L,YE J L,GUO W W,XU Q,XIA R,LARKIN R M,DENG X X,BOSCH M,FRANKLIN-TONG V E,CHAI L J.Evolution of self-compatibility by a mutant Sm-RNase in citrus[J].Nature Plants,2020,6(2):131-142.
[19] 洪俊彦,黄仁,黄春颖,王建华,徐一帆,李佩佩,胡渊渊,黄坚钦,李岩. 植物花粉直感的研究进展及展望[J]. 植物生理学报,2020,56(2):151-162.HONG Junyan,HUANG Ren,HUANG Chunying,WANG Jianhua,XU Yifan,LI Peipei,HU Yuanyuan,HUANG Jianqin,LI Yan. Research progress and prospects of xenia[J]. Plant Physiology Journal,2020,56(2):151-162.
[20] ZHANG C X,TATEISHI N,TANABE K. Pollen density on the stigma affects endogenous gibberellin metabolism,seed and fruit set,and fruit quality in Pyrus pyrifolia[J].Journal of Experimental Botany,2010,61(15):4291-4302.
[21] ZHANG L T. The sweetness of sugars[J]. Journal of South China University of Technology,2002,30(1):89-91.
[22] 刘勇.柚类资源分子系统学及其核心种质构建研究[D].武汉:华中农业大学,2005.LIU Yong. Molecular phylogenetic analysis and core collection construction using SSR and AFLP markers in pummelo[D].Wuhan:Huazhong Agricultural University,2005.
[23] 曹立新.江西省广丰县柚资源调查与马家柚起源分析[D].武汉:华中农业大学,2012.CAO Lixin. The investigation of pummelo germplasms and the origin analysis of Majiayou in Guangfeng Jiangxi province[D].Wuhan:Huazhong Agricultural University,2012.
[24] LIAO X,LI M S,LIU B,YAN M L,YU X M,ZI H L,LIU R Y,YAMAMURO C. Interlinked regulatory loops of ABA catabolism and biosynthesis coordinate fruit growth and ripening in woodland strawberry[J]. Proceedings of the National Academy of Sciences of the United States of America,2018,115(49):E11542-E11550.
[25] DE JONG M,WOLTERS-ARTS M,GARCÍA-MARTÍNEZ J L,MARIANI C,VRIEZEN W H. The Solanum lycopersicum auxin response factor 7 (SlARF7) mediates cross-talk between auxin and gibberellin signalling during tomato fruit set and development[J].Journal of Experimental Botany,2011,62(2):617-626..
[26] KANG C Y,DARWISH O,GERETZ A,SHAHAN R,ALKHAROUF N,LIU Z C. Genome-scale transcriptomic insights into early-stage fruit development in woodland strawberry Fragaria vesca[J].The Plant Cell,2013,25(6):1960-1978.
[27] CHENG Z H,SONG W Y,ZHANG X L. Genic male and female sterility in vegetable crops[J]. Horticulture Research,2023,10(1):uhac232.
[28] SHARIF R,SU L,CHEN X H,QI X H.Hormonal interactions underlying parthenocarpic fruit formation in horticultural crops[J].Horticulture Research,2022,9:uhab024.
[29] GALIMBA K D,BULLOCK D G,DARDICK C,LIU Z C,CALLAHAN A M. Gibberellic acid induced parthenocarpic‘Honeycrisp’apples (Malus domestica) exhibit reduced ovary width and lower acidity[J].Horticulture Research,2019,6:41.
[30] KLAP C,YESHAYAHOU E,BOLGER A M,ARAZI T,GUPTA S K,SHABTAI S,USADEL B,SALTS Y,BARG R.Tomato facultative parthenocarpy results from SlAGAMOUS-LIKE 6 loss of function[J]. Plant Biotechnology Journal,2017,15(5):634-647.
[31] LI J,WU Z,CUI L,ZHANG T L,GUO Q W,XU J,JIA L,LOU Q F,HUANG S W,LI Z G,CHEN J F. Transcriptome comparison of global distinctive features between pollination and parthenocarpic fruit set reveals transcriptional phytohormone cross-talk in cucumber (Cucumis sativus L.)[J]. Plant &Cell Physiology,2014,55(7):1325-1342.
[32] MCATEE P,KARIM S,SCHAFFER R,DAVID K.A dynamic interplay between phytohormones is required for fruit development,maturation,and ripening[J]. Frontiers in Plant Science,2013,4:79.
[33] MARTIN-ORTIGOSA S,PETERSON D J,VALENSTEIN J S,LIN V S Y,TREWYN B G,LYZNIK L A,WANG K. Mesoporous silica nanoparticle-mediated intracellular cre protein delivery for maize genome editing via loxP site excision[J]. Plant Physiology,2014,164(2):537-547.
[34] WANG Z P,ZHANG Z B,ZHENG D Y,ZHANG T T,LI X L,ZHANG C,YU R,WEI J H,WU Z Y.Efficient and genotype independent maize transformation using pollen transfected by DNA-coated magnetic nanoparticles[J]. Journal of Integrative Plant Biology,2022,64(6):1145-1156.
[35] PARK C W,CHOI J Y,SON Y J,KIM D H,LI H J,LIANG W Q,LEE C H,JUNG K H,KIM Y J. Magnetofected pollen gene delivery system could generate genetically modified Cucumis sativus[J].Horticulture Research,2024,11(8):uhae179.
[36] WANG T,ZHENG Y,XU C,DENG Y L,HAO X Y,CHU Z C,TIAN J,WANG Y,ZHANG X Z,HAN Z H,WU T. Movement of ACC oxidase 3 mRNA from seeds to flesh promotes fruit ripening in apple[J]. Molecular Plant,2024,17(8):1221-1235.