柑橘是世界第一大类水果,也是中国南方地区最重要的经济作物之一,近年来中国柑橘产业一直保持稳定增长态势,柑橘栽培面积和产量不断增加[1]。杂交育种是最有效的选育新品种方式之一,通过选择具有优良性状的亲本,利用基因重组技术实现亲本优良性状的重新组合,但杂交后代群体性状分离严重。利用分子标记辅助育种方法已成为当今鉴定柑橘亲缘关系的有效途径之一。
分子标记技术可通过分析DNA 片段差异对柑橘属植物的遗传多样性进行评估,从而揭示品种或物种间的遗传差异及亲缘关系。该技术在杂交后代亲本鉴定中具有广泛应用,例如利用限制性片段长度多态性(RFLP)分析可确定杂交后代的遗传特征和来源。简单重复序列标记(SSR)是由重复的2~6 bp DNA片段特定序列为核心的分子标记,也称为微卫星DNA(Microsatellite DNA)[2]。SSR 标记具有多态性高、易检测的优点,被广泛地应用于亲本来源鉴定和遗传研究[3]。王旭等[4]用17对SSR引物对68份柚类种质资源进行遗传背景研究,在遗传距离0.36 处将材料分成5 个类群,达到与结构分析结果基本一致的效果。周锐等[5]通过SSR 分子标记对无酸甜橙、红江橙、贡柑、年橘、新会柑、滑皮金柑的四倍体实生苗进行鉴定,发现所鉴定的四倍体均来自其二倍体品种珠心细胞自然加倍形成的双二倍体。Xu等[6]利用SSR和SNP标记构建了柑橘高密度连锁图谱,将便于QTL 定位和基因组研究。黄其椿等[7]采用3 个SSR 分子标记从广西、重庆、四川种植的16个主栽柑橘品种中筛选出沃柑和无核沃柑。
种子多胚性是一种柑橘类植物特有的生物学现象,并已被证明为单基因控制的显性性状。利用分子标记技术可在柑橘童期快速鉴定单多胚性,筛选单胚材料,避免多胚性对杂交育种的干扰,从而缩短育种周期[8]。因此,笔者在本研究中将利用SSR 分子标记技术对130 份清见×鄂柑一号杂交后代进行鉴定,结合毛细管荧光电泳技术高效收集数据,分析其亲缘关系及遗传多样性,为柑橘种质资源利用及遗传育种提供理论支持。
1 材料和方法
1.1 试验材料
试验材料来源于湖北省农业科学院果树茶叶研究所国家柑橘原种保存圃(北纬30 °17′ 41″,东经114°8′29″)。以清见橘橙(Citrus unshiu Marc.×C.sinesis Osbeck)为母本,以鄂柑一号椪柑(Citrus reticulata Blanc.‘Ponkan’)为父本,经常规杂交选育杂交F1代。2021年3月共采集130份子代样品。
1.2 样品DNA的提取及质量检测
以清见×鄂柑一号杂交后代的新叶为试材。利用改良CTAB 法[9]提取叶片DNA,DNA 质量利用1.0%琼脂糖凝胶电泳进行检测,并将各样品质量浓度稀释至200 ng·μL-1备用。
1.3 SSR标记引物的筛选及毛细管电泳
选取38对SSR引物(引物由武汉天一华煜基因科技有限公司合成),对两个亲本及130个杂交子代基因组DNA 进行PCR 扩增。PCR 反应体系为20 μL,10 μL×EsTaqMasterMix(Dye),浓度为10 μmol·L-1的正反向引物各0.5 μL,200 ng·μL-1DNA模板0.5 μL,ddH2O 8.5 μL。扩增反应程序为:94 ℃预变性2 min;94 ℃变性30 s,55~65 ℃退火30 s,72 ℃延伸30 s,共30 个循环;最后72 ℃延伸2 min。PCR 产物置于4 ℃冰箱保存。PCR产物由全自动毛细管电泳系统(QI Axcel Advanced,QIAGEN)电泳分离。引物序列为:CHR2-2F:AAAACTCACTTACATTCATACACAC,CHR2- 2R:GCACTTACCAAACCCCATCTC,CHR8-3F:TTTTAAGCTAACAAGCCCCC,CHR8-3R:ATGAATGGCCATGATTTTGC,CHR8-4F:ACAAGTACGGCAAGGTCGT,CHR8-4R:TTCAACGCCCAAAATTTGTT。
1.4 杂交后代单多胚鉴定的PCR 反应体系和反应程序
PCR反应体系和程序参照Wang等[10],并略作修改。PCR 反应体系总20 μL:10 μL 的2 × Es Taq Master Mix,ddH2O 8.2 μL,正反引物各0.4 μL(武汉天一华煜基因科技有限公司合成),DNA 模板1.0 μL。引物序列来源于王霞等[10]开发的引物mite_p1 和mite_p2。PCR 在PCR 仪(C1000)上进行。预变性95 ℃5 min;变性95 ℃30 s,退火52 ℃30 s,延伸72 ℃60 s,30个循环;终延伸72 ℃5 min,4 ℃保存。引物序列 :mite_p1- F:GTACCGAATTACCMCCCATAA,mite_p1-R:GTAGGATTTGGGTTATTGATG,mite_p2- F:TCTGGTTCATTGAGAATCCGCG,mite_p2-R:ATCATGTGGGTCATGGTAC。
1.5 数据统计
数据均利用NTSYSpc21、Microsoft Excel 2010软件进行处理。
2 结果与分析
2.1 多态性引物的筛选
利用聚丙烯酰胺凝胶电泳技术对清见×鄂柑一号杂交后代具有双亲特异性的引物进行初步筛选。如图1 所示,在38 对SSR 引物中共获得3 对引物能够在清见与鄂柑一号双亲中分别扩增出特异性条带,且F1代中能同时扩增出双亲特异性条带。该结果在毛细管电泳中得到了相同的结果,证明这3 对引物是可以用于鉴定清见×鄂柑一号杂交后代的SSR分子标记。CHR8-3、CHR8-4和CHR2-2能够扩增出双亲各自的特异性条带,并且在子代中具有较为明显的差异,结果比较稳定,所以利用这3对SSR特异性引物对清见×鄂柑一号的杂交F1代进行杂种鉴定。
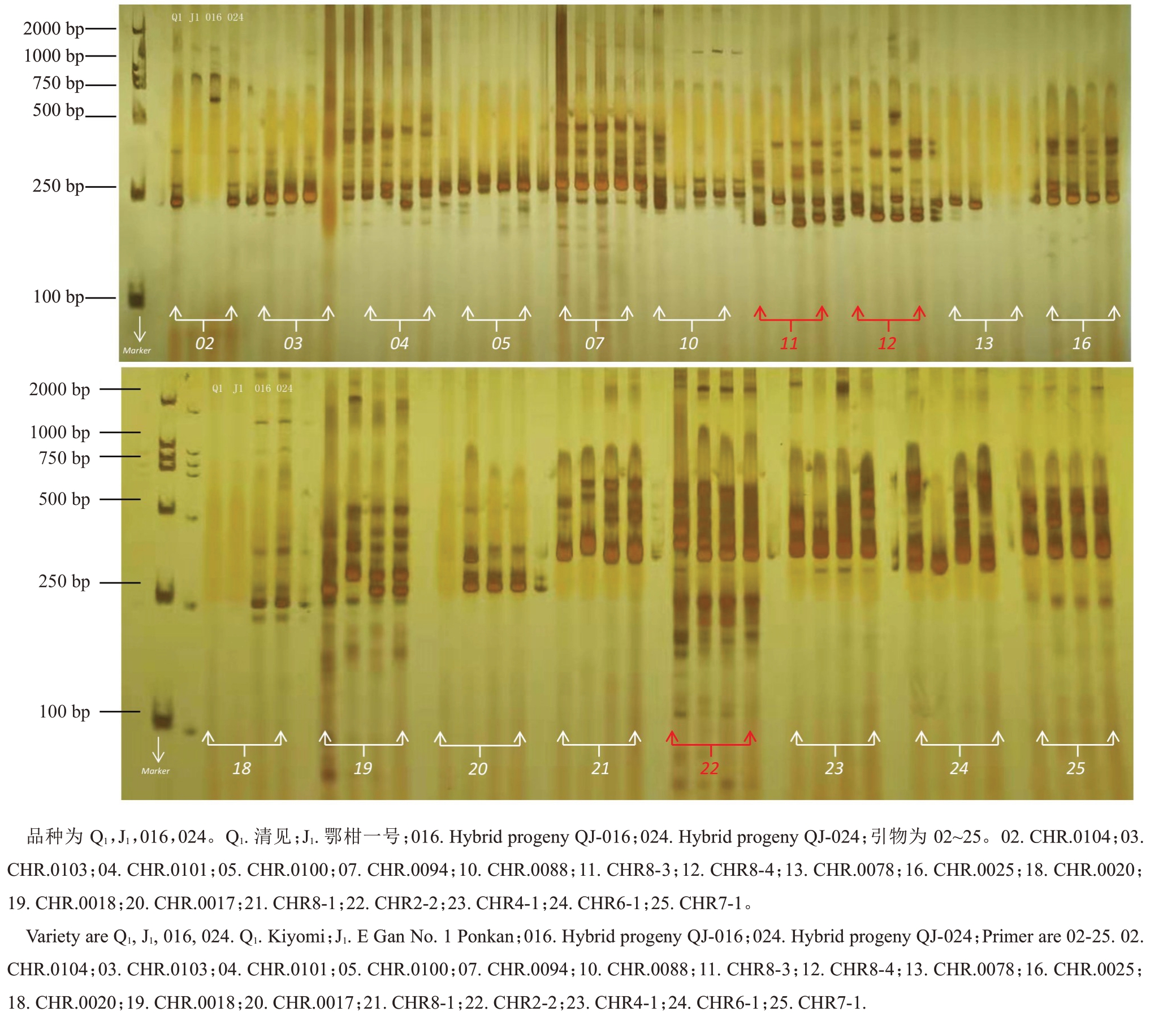
图1 特异性SSR 引物筛选
Fig.1 Screening of the specific SSR primers
2.2 SSR分子标记杂种鉴定
利用毛细管电泳系统对130个清见×鄂柑一号杂交F1鉴定。通过图2所示,引物CHR2-2能在130个杂交F1中扩增出双亲条带的子代有103个,杂种鉴定率为79.23%。如图3所示,引物CHR8-3在130个清见×鄂柑一号杂交F1中,有69个杂交后代能够扩增出双亲的特异性条带,杂种鉴定率为53.08%。如图4所示,引物CHR8-4对130个清见×鄂柑一号杂交后代的鉴定结果中,有68个杂交后代能够扩增出双亲的特异性条带,杂种鉴定率为52.31%。通过3对引物相互补充,综合杂种鉴定率达到了99.23%。
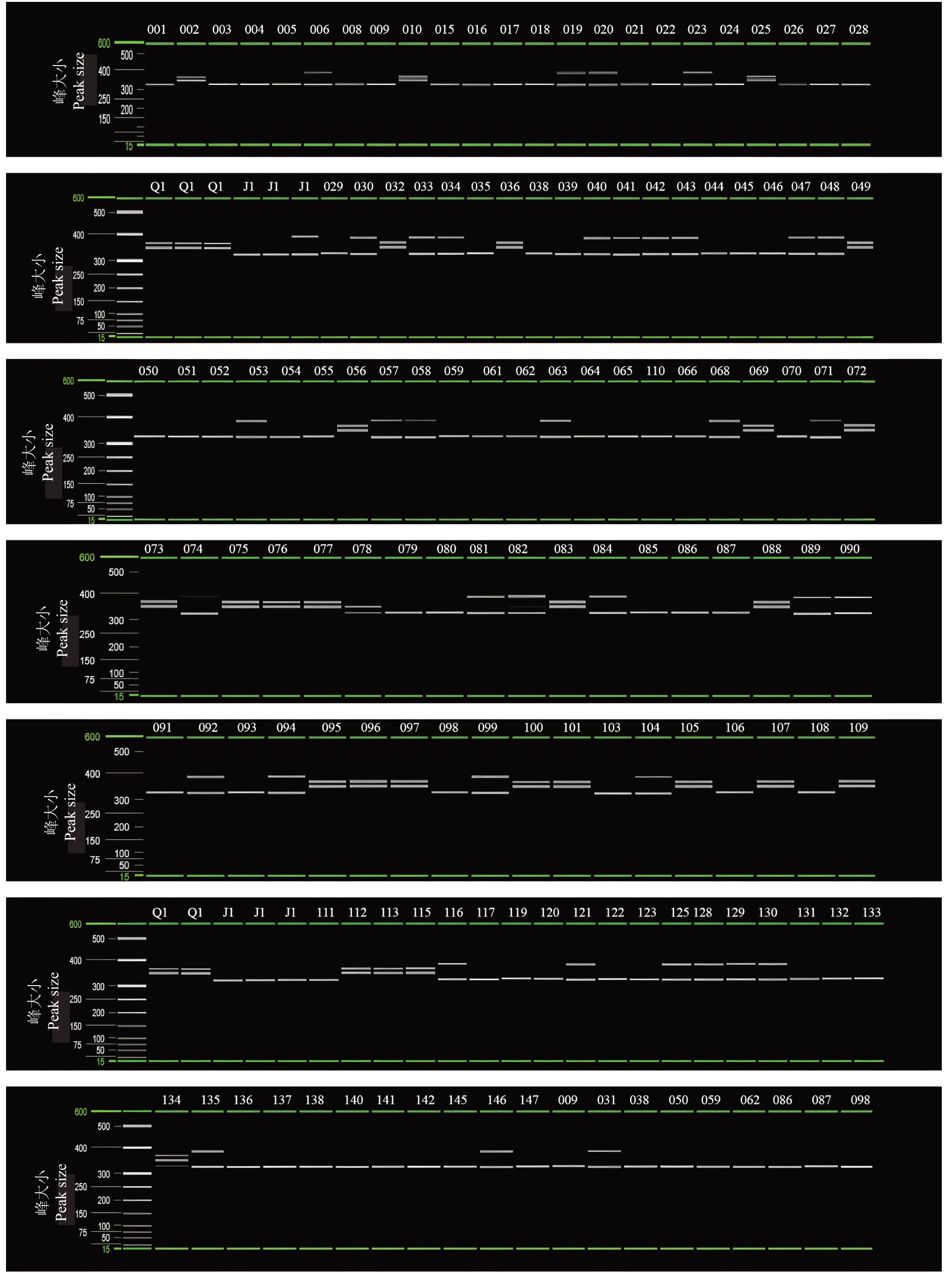
图2 CHR2-2 引物对清见×鄂柑一号杂种后代的扩增谱带
Fig.2 The amplification bands of CHR2-2 primer in offspring of Kiyomi×E Gan No.1 ponkan

图3 CHR8-3 引物对清见×鄂柑一号杂种后代的扩增谱带
Fig.3 The amplification bands of CHR8-3 primer in offspring of Kiyomi×E Gan No.1 ponkan
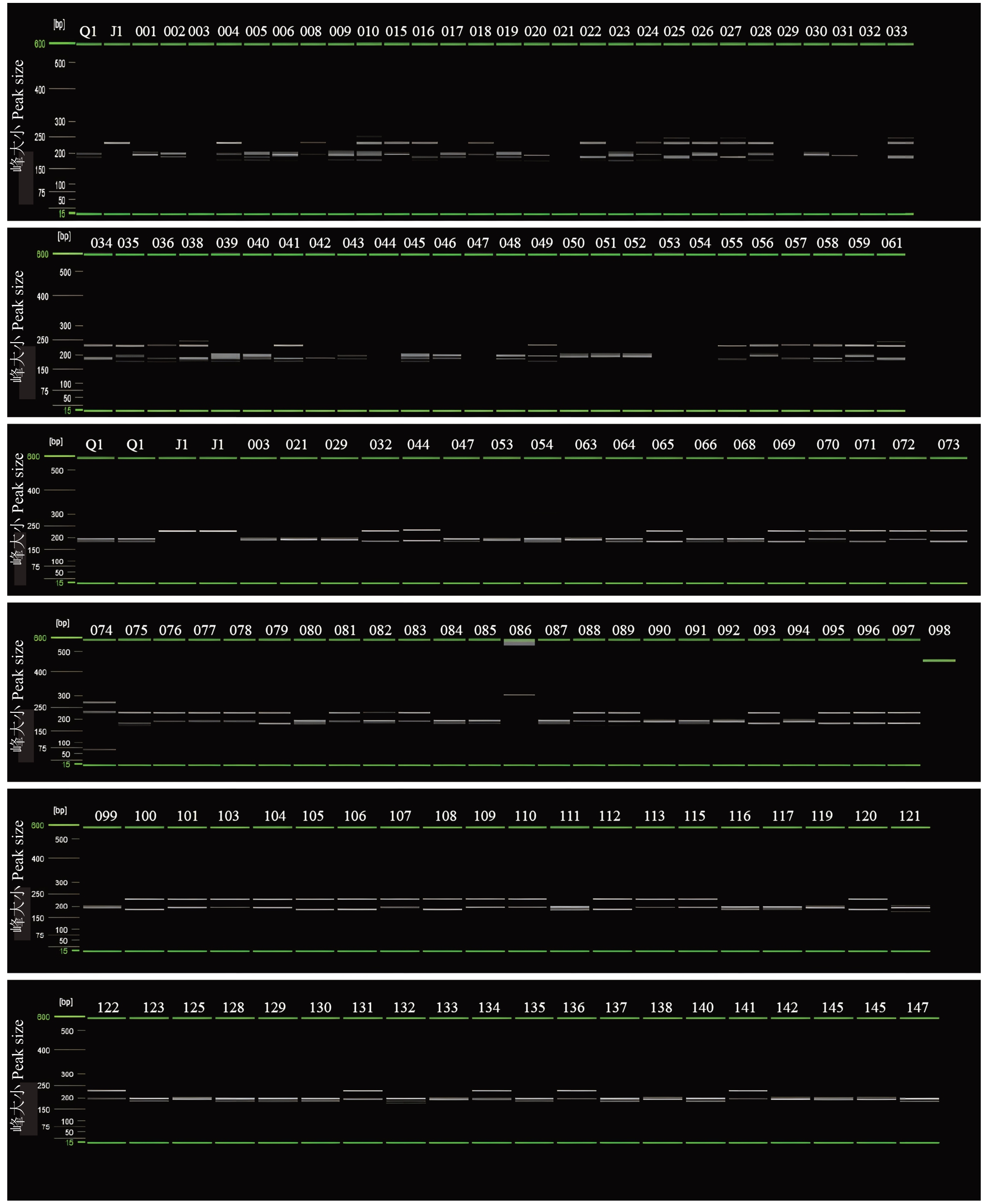
图4 CHR8-4 引物对清见×鄂柑一号杂种后代的扩增谱带
Fig.4 The amplification bands of CHR8-4 primer in offspring of Kiyomi×E Gan No.1 ponkan
2.3 聚类分析
通过筛选出的引物在子代中共扩增出163条谱带,利用NTSYSpc-2.10e软件,使用不加权成对群算术平均法将子代SSR 数据聚类分析,获得UPGMA树状图,如图5所示。清见、鄂柑一号以及大部分杂交后代部分分离,相似系数约为0.81,树状图簇基本符合当前的分类。所有杂交后代的遗传多样性都很高,不同后代的相似系数范围为0.805~0.990,相似系数比较大。树状图中最大的簇大约在0.881 的相似度分成两组。最大簇的较深部分被归类为亲缘关系倾向母本清见,共45 株,占比34.62%。另外一簇归类为亲缘关系倾向父本鄂柑一号,共32个子代聚为一类,占比为24.62%,而鄂柑一号与部分子代聚集在一起,相似系数为0.905,与母本清见相似系数为0.810,说明这32 个子代偏父系遗传。在遗传相似系数0.810处,将杂交后代和亲本分为两大类群,分别是母本清见与129 个子代聚为一类,占比99.23%,而QJ-082为一类,占比为0.73%。大多数子代与清见聚为一大类,相似系数小于0.900,杂交后代的遗传多样性较高。同时说明大多数杂交后代与母本清见的亲缘关系比父本鄂柑一号亲缘关系更近。
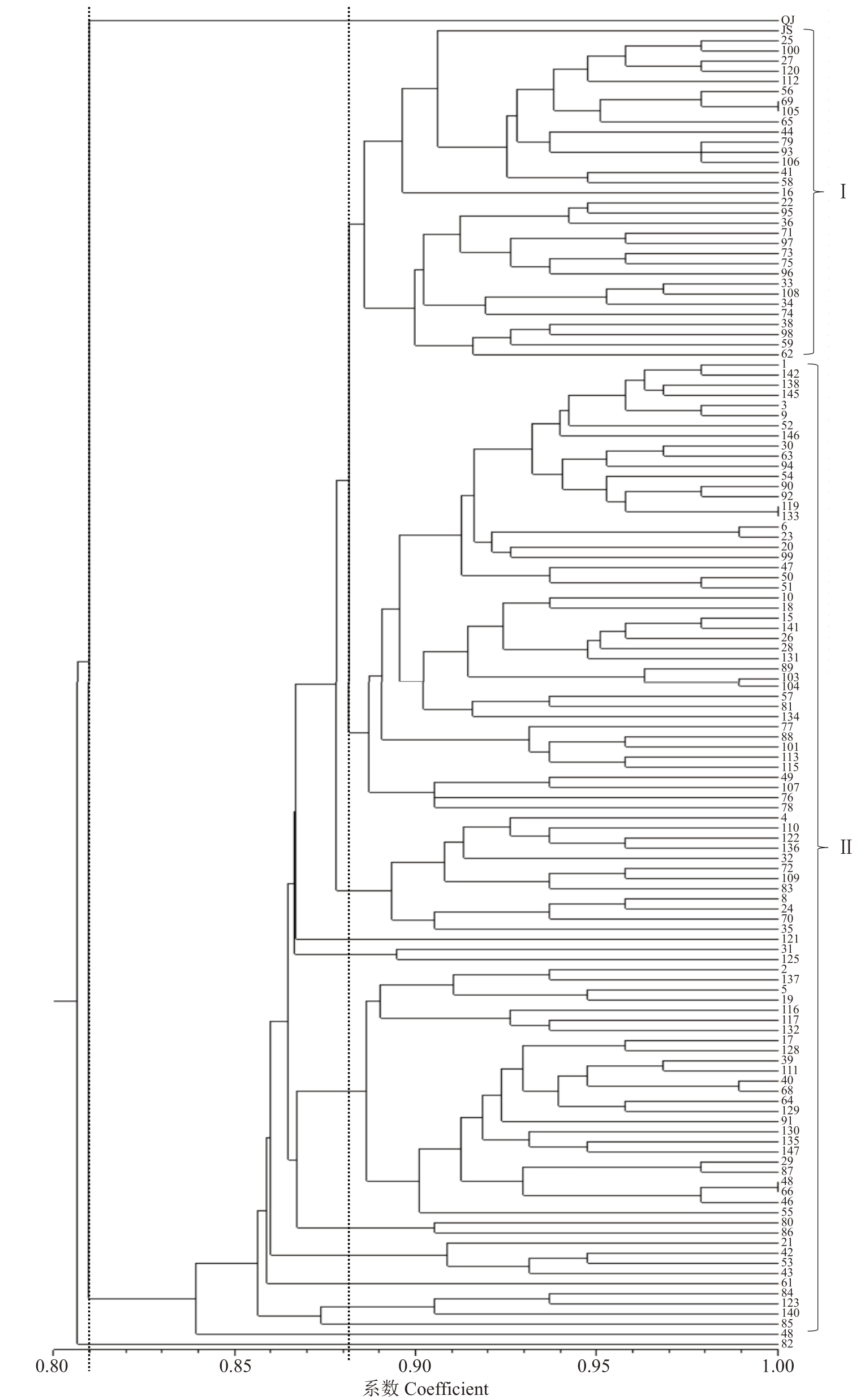
图5 清见×鄂柑一号杂交后代UPGMA 聚类分析
Fig.5 UPGMA phylogenetic tree of hybrid offspring of Kiyomi×E Gan No.1 ponkan
2.4 单多胚性状分子鉴定
利用能够鉴定柑橘单、多胚性状的MITE分子标记对清见×鄂柑一号杂交后代进行单多胚区分。如表1 所示,通过mite_p1 分子标记对130 株清见×鄂柑一号杂交后代进行单多胚鉴定分析,检测到仅有一条带(未扩增出MITE片段)的植株38株(没有扩增出MITE 条带的是单胚后代),占比29.23%;具有3 条带扩增出MITE 片段的植株92 株(扩增出MITE 条带的是多胚后代),占比70.77%,经过统计分析得出清见×鄂柑一号杂交后代中多胚性植株多于单胚性植株,基因分离比例为1∶2.42。同时,使用mite_p2 分子标记随机对12 份样品进行验证,发现mite_p2 分子标记扩增谱带与mite_p2 完全相同,两个分子标记均能有效鉴定杂交群体的单多胚性状(表2)。
表1 清见×鄂柑一号杂种后代的单多胚性状mite_p1 分子标记鉴定结果
Table 1 Results of polyembryony trait of the offspring of Kiyomi and E Gan No.1 ponkan using mite_p1 molecular marker
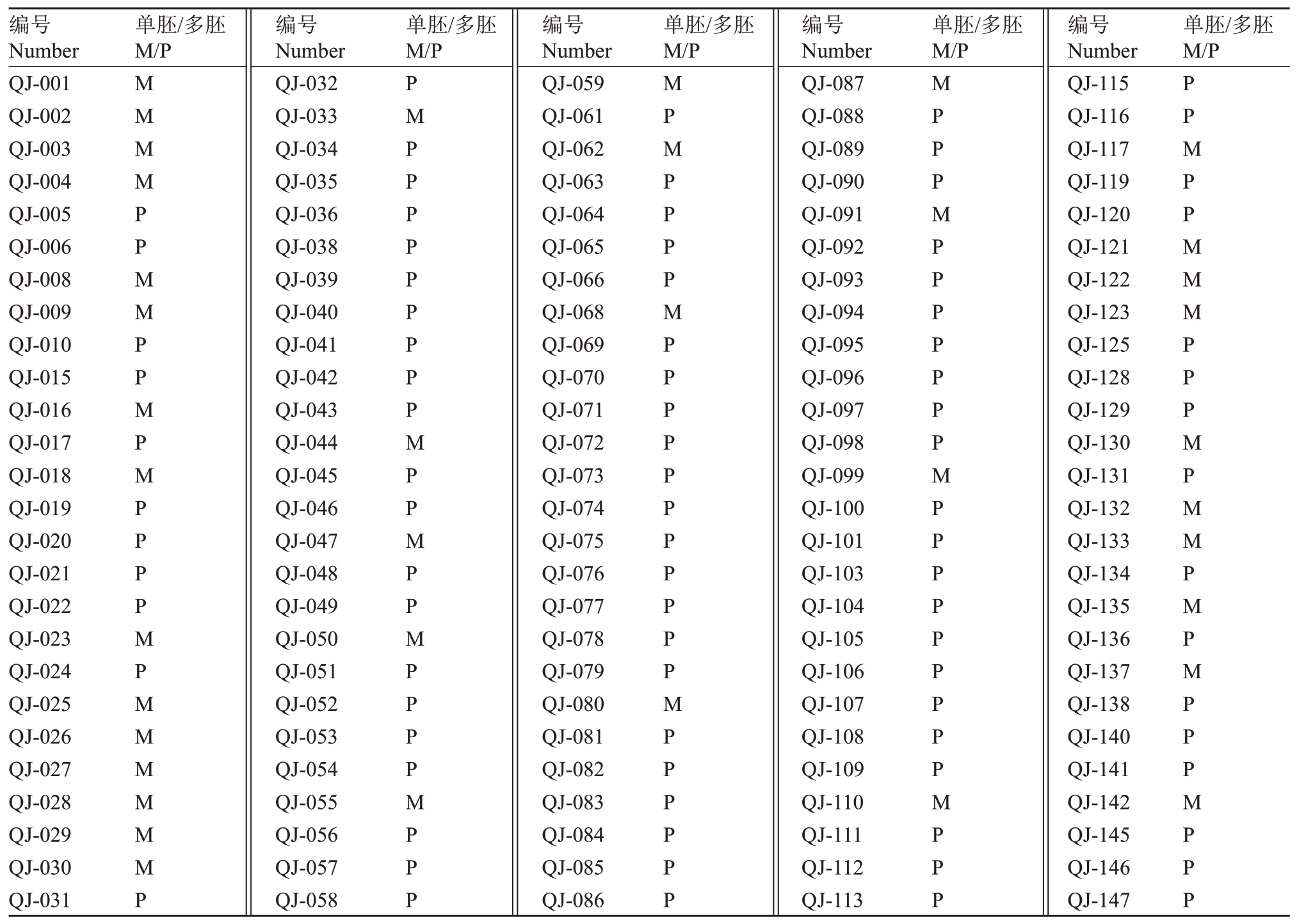
注:M.单胚性状;P.多胚性状。下同。
Note:M.Monoembryonic trait;P.Polyembryonic trait.The same below.
单胚/多胚M/P单胚/多胚M/P单胚/多胚M/P单胚/多胚M/P单胚/多胚M/P编号Number QJ-001 QJ-002 QJ-003 QJ-004 QJ-005 QJ-006 QJ-008 QJ-009 QJ-010 QJ-015 QJ-016 QJ-017 QJ-018 QJ-019 QJ-020 QJ-021 QJ-022 QJ-023 QJ-024 QJ-025 QJ-026 QJ-027 QJ-028 QJ-029 QJ-030 QJ-031 MMMMPPMMPPMPMPPPPMPMMMMMMP编号Number QJ-032 QJ-033 QJ-034 QJ-035 QJ-036 QJ-038 QJ-039 QJ-040 QJ-041 QJ-042 QJ-043 QJ-044 QJ-045 QJ-046 QJ-047 QJ-048 QJ-049 QJ-050 QJ-051 QJ-052 QJ-053 QJ-054 QJ-055 QJ-056 QJ-057 QJ-058 PMPPPPPPPPPMPPMPPMPPPPMPPP编号Number QJ-059 QJ-061 QJ-062 QJ-063 QJ-064 QJ-065 QJ-066 QJ-068 QJ-069 QJ-070 QJ-071 QJ-072 QJ-073 QJ-074 QJ-075 QJ-076 QJ-077 QJ-078 QJ-079 QJ-080 QJ-081 QJ-082 QJ-083 QJ-084 QJ-085 QJ-086 MPMPPPPMPPPPPPPPPPPMPPPPPP编号Number QJ-087 QJ-088 QJ-089 QJ-090 QJ-091 QJ-092 QJ-093 QJ-094 QJ-095 QJ-096 QJ-097 QJ-098 QJ-099 QJ-100 QJ-101 QJ-103 QJ-104 QJ-105 QJ-106 QJ-107 QJ-108 QJ-109 QJ-110 QJ-111 QJ-112 QJ-113 MPPPMPPPPPPPMPPPPPPPPPMPPP编号Number QJ-115 QJ-116 QJ-117 QJ-119 QJ-120 QJ-121 QJ-122 QJ-123 QJ-125 QJ-128 QJ-129 QJ-130 QJ-131 QJ-132 QJ-133 QJ-134 QJ-135 QJ-136 QJ-137 QJ-138 QJ-140 QJ-141 QJ-142 QJ-145 QJ-146 QJ-147 PPMPPMMMPPPMPMMPMPMPPPMPPP
表2 清见×鄂柑一号杂种后代的单多胚性状mite_p2 分子标记鉴定结果
Table 2 Results of polyembryony trait of the offspring of Kiyomi and E Gan No.1 ponkan using mite_p2 molecular marker
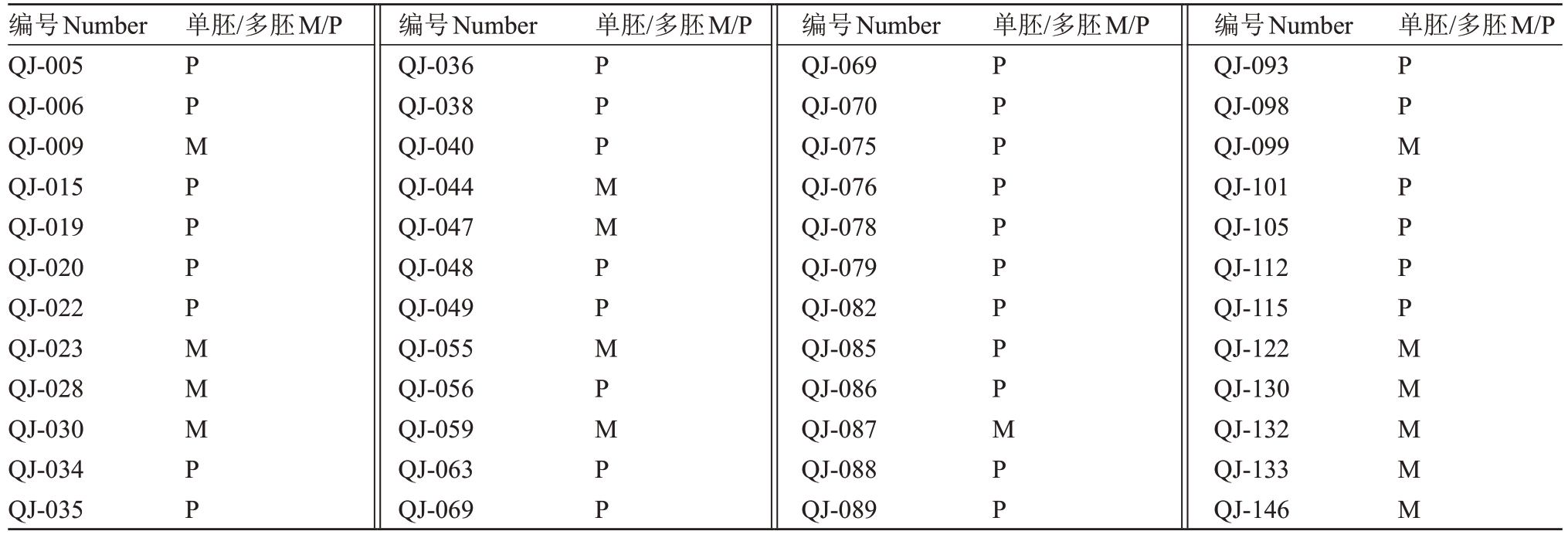
单胚/多胚M/P单胚/多胚M/P单胚/多胚M/P 单胚/多胚M/P编号Number QJ-005 QJ-006 QJ-009 QJ-015 QJ-019 QJ-020 QJ-022 QJ-023 QJ-028 QJ-030 QJ-034 QJ-035 PPMPPPPMMMPP编号Number QJ-036 QJ-038 QJ-040 QJ-044 QJ-047 QJ-048 QJ-049 QJ-055 QJ-056 QJ-059 QJ-063 QJ-069 PPPMMPPMPMPP编号Number QJ-069 QJ-070 QJ-075 QJ-076 QJ-078 QJ-079 QJ-082 QJ-085 QJ-086 QJ-087 QJ-088 QJ-089 PPPPPPPPPMPP编号Number QJ-093 QJ-098 QJ-099 QJ-101 QJ-105 QJ-112 QJ-115 QJ-122 QJ-130 QJ-132 QJ-133 QJ-146 PPMPPPPMMMMM
2.5 单多胚性状的验证
对已挂果的44株清见×鄂柑一号杂交后代进行单多胚性状的统计,结果见表3。统计发现符合单多胚性状鉴定结果的子代有38 个,占比84.09%,其中表现出单胚性状的有13个,表现出多胚性状的有31 个,分析得知清见×鄂柑一号杂交后代中多胚性植株多于单胚性植株,单胚性植株与多胚性植株的比例为1∶2.38,这与单胚和多胚基因分离比例1∶2.42相近,也与两对引物“mite_p1”和“mite_p2”单多胚鉴定结果一致,说明此两对引物能有效鉴别出该杂交后代中具有单胚性状和多胚性状的植株。
表3 清见×鄂柑一号杂种后代的单多胚性状统计
Table 3 Statistics of monoembryonic or polyembryonic traits of the offspring of Kiyomi and E Gan No.1 ponkan
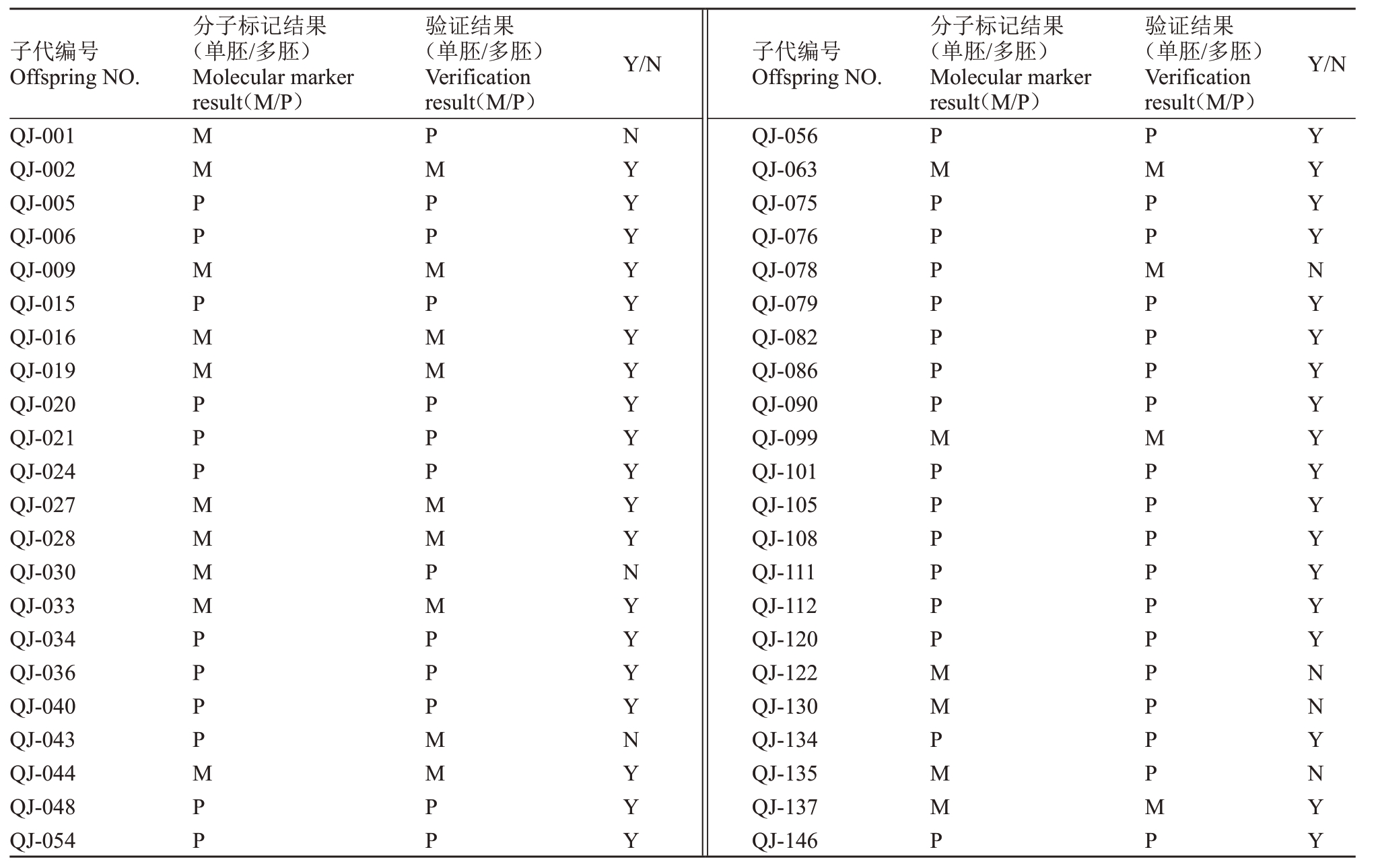
注:Y.符合结果;N.不符合结果。
Note:Y.Match the result;N.Not match the result.
子代编号Offspring NO.分子标记结果(单胚/多胚)Molecular marker result(M/P)验证结果(单胚/多胚)Verification result(M/P)Y/N 子代编号Offspring NO.分子标记结果(单胚/多胚)Molecular marker result(M/P)验证结果(单胚/多胚)Verification result(M/P)Y/N QJ-001 QJ-002 QJ-005 QJ-006 QJ-009 QJ-015 QJ-016 QJ-019 QJ-020 QJ-021 QJ-024 QJ-027 QJ-028 QJ-030 QJ-033 QJ-034 QJ-036 QJ-040 QJ-043 QJ-044 QJ-048 QJ-054 MMPPMPMMPPPMMMMPPPPMPP PMPPMPMMPPPMMPMPPPMMPP NYYYYYYYYYYYYNYYYYNYYY QJ-056 QJ-063 QJ-075 QJ-076 QJ-078 QJ-079 QJ-082 QJ-086 QJ-090 QJ-099 QJ-101 QJ-105 QJ-108 QJ-111 QJ-112 QJ-120 QJ-122 QJ-130 QJ-134 QJ-135 QJ-137 QJ-146 PMPPPPPPPMPPPPPPMMPMMP PMPPMPPPPMPPPPPPPPPPMP YYYYNYYYYYYYYYYYNNYNYY
3 讨 论
笔者在本研究中采用SSR技术对清见×鄂柑一号杂交后代进行杂种鉴定,筛选出3对稳定性高、重复性好的特异性引物CHR8-3、CHR8-4 和CHR2-2。使用这3对引物对群体进行鉴定,综合杂种鉴定率为99.23%。其中仅QJ-002未通过鉴定,可能由于基因座缺失或多态性,导致特异性引物无法成功扩增,这可能与基因组重组或变异有关[11]。聚类分析可直观反映种质间的遗传背景和相似性,常宏兵等[12]利用32 个SSR 标记从69 个玉米品种中扩增出97 个等位基因,发现玉米群体的遗传距离介于0.103~0.803之间,并通过聚类分析将69个品种划为5 个类群。苏国钊等[13]使用20 对SSR 引物构建了208个苦瓜品种的DNA指纹图谱库,并通过聚类分析将208 个苦瓜品种分为两类。在柑橘中,刘勇等[14]利用31 对SSR 标记研究了122 份柚(C.grandis Osbesk)类资源及近缘种遗传多样性,检测到335个等位基因变异,并用UPGMA 法将材料分成7 个组群,110 个柚类品种在相似系数0.712 处,可细分成18 个亚组。在本研究中,通过聚类分析可将130 个杂交后代分为两个类群,且多数杂交后代与母本清见的亲缘关系更近。杂交后代的遗传多样性较高,不同后代的相似系数范围为0.805~0.990,杂交后代间的遗传相似系数比较相近。该结果与前人以沙田柚为母本创制的两个杂交后代群体相符,其种内杂交后代群体(沙田柚×强德勒柚)遗传差异小,呈现父系遗传,而种外杂交后代群体(沙田柚×红江橙)则遗传变异大,呈现母系遗传[15]。
大多数柑橘品种具有多胚现象,导致常规育种难以得到真正的杂种后代,严重影响了柑橘杂交育种的进程。相反,由于多胚属于配子体无融合生殖,子代完全遗传母本的特性,对杂种性状的固定和砧木资源利用又具有重要价值[16]。前人研究认为柑橘多胚性状是显性基因控制的质量性状,基因型为A_;单胚性状是隐性基因控制,基因型aa[17]。Wang等[10]利用单胚HB 柚和多胚Fairchild 橘的杂交分离群体定位到单多胚决定基因CitRWP,并在该基因启动子区域鉴定到一段约300 bp的微型可逆重复转座元件(MITE),开发出单多胚鉴定的分子标记“mite_p1”和“mite_p2”。因此,使用分子标记手段在早期对杂交后代群体的单多胚性进行鉴定,对优异育种和砧木资源的挖掘与利用具有重要意义。然而该标记在柑橘杂交育种群体中的应用研究还较少,尤其是育种中最常见的以清见等单胚材料为母本所创制的杂交群体。
笔者在本研究中以单胚的清见为母本,以湖北省特色主栽抗寒多胚椪柑品种鄂柑一号为父本创制了杂交群体130 份,为湖北省优质晚熟抗寒柑橘新品种培育奠定了基础。理论上清见(aa)与金水柑(Aa)杂交后代单、多胚分离比应接近1∶1,然而实际检测后代群体中分离比为1∶2.42。夏强明等[8]对以华柚2 号为母本、沙田柚和鸡尾葡萄柚为父本杂交组合获得的实生苗1018和687株进行的早期胚性鉴定表明,沙田柚为父本的有性后代均为单胚性,而鸡尾葡萄柚为父本的后代,单胚性与多胚性比例为2.86∶1,并推测可能有部分多胚子代未能有效扩增出MITE 条带,导致出现单胚性子代较多。本研究结果显示多胚性子代多于单胚性子代,同时单、多胚验证结果也发现,单胚植株与多胚植物的比例为1∶2.38,与分子标记鉴定结果非常接近,可以排除PCR扩增对结果的不利影响。首先,Smith等[18]对多个单胚性状柑橘品种与多胚性状枳属的杂交后代研究认为单、多胚性状由多个基因位点控制。张斯淇[19]通过多胚性红橘与枳的杂交试验,发现子代的多胚性状实际比例与理论预期存在显著差异。通过对亲本的MITE 片段插入检测,发现枳中未检测到相关片段,而红橘中检测到该片段。据此推测,子代的多胚基因可能部分源自枳,且枳属中控制多胚性状的基因位点与柑橘属中已知的多胚基因位点相互独立。其次,前人从土豆中鉴定到344831个可能的有害突变,这些有害等位基因具有品种特异性,并且会在F2群体中产生严重的分离失衡[20]。因此,推测可能是有害变异或其他控制位点导致了清见和鄂柑一号杂交群体单多胚性状出现偏分离。本研究的结果将为柑橘种质资源高效利用及遗传育种提供理论支持和实践经验。
4 结 论
利用SSR 分子标记对清见×鄂柑一号杂交后代130 个杂交后代筛选出的特异性引物CHR2-2/CHR8-3/CHR8-4 可用于以清见为母本的其他杂交组合后代的亲缘关系鉴定,为柑橘优异农艺性状的遗传解析奠定了理论基础。利用“mite_p1”和“mite_p2”分子标记对杂交后代进行单多胚性鉴定,发现单胚和多胚分离比不是1∶1,而是1∶2.42,并通过形态学观察对分子标记结果进行了验证,推测可能是有害变异或其他控制位点导致了清见和鄂柑一号杂交群体单多胚性状出现偏分离。
[1] 邓秀新,王力荣,李绍华,张绍铃,张志宏,丛佩华,易干军,陈学森,陈厚彬,钟彩虹.果树育种40 年回顾与展望[J].果树学报,2019,36(4):514-520.DENG Xiuxin,WANG Lirong,LI Shaohua,ZHANG Shaoling,ZHANG Zhihong,CONG Peihua,YI Ganjun,CHEN Xuesen,CHEN Houbin,ZHONG Caihong. Retrospection and prospect of fruit breeding for last four decades in China[J]. Journal of Fruit Science,2019,36(4):514-520.
[2] 李映志. 宽皮柑橘(Citrus reticulate Blanco)的遗传多样性及系统发育研究[D].武汉:华中农业大学,2006.LI Yingzhi.Research on the genetic diversity and phylogenetic relationship of loose skin mandarins(Citrus reticulate Blanco)[D].Wuhan:Huazhong Agricultural University,2006.
[3] ZHEBENTYAYEVA T N,REIGHARD G L,GORINA V M,ABBOTT A G. Simple sequence repeat (SSR) analysis for assessment of genetic variability in apricot germplasm[J].Theoretical and Applied Genetics,2003,106(3):435-444.
[4] 王旭,彭洁,朱延松,杨胜男,张晓楠,余洪,江东,梁大成.基于SSR 分子标记的68 份柚类种质资源亲缘关系分析[J].安徽农业科学,2021,49(4):100-103.WANG Xu,PENG Jie,ZHU Yansong,YANG Shengnan,ZHANG Xiaonan,YU Hong,JIANG Dong,LIANG Dacheng.Analysis of genetic relationship of 68 pummelo germplasm resources based on SSR molecular marker[J].Journal of Anhui Agricultural Sciences,2021,49(4):100-103.
[5] 周锐,解凯东,王伟,彭珺,谢善鹏,胡益波,伍小萌,郭文武.依据多倍体形态特征快速高效发掘柑橘四倍体[J].园艺学报,2020,47(12):2451-2458.ZHOU Rui,XIE Kaidong,WANG Wei,PENG Jun,XIE Shanpeng,HU Yibo,WU Xiaomeng,GUO Wenwu.Efficient identification of tetraploid plants from seedling populations of apomictic citrus genotypes based on morphological characteristics[J].Acta Horticulturae Sinica,2020,47(12):2451-2458.
[6] XU Y Y,LIU S R,GAN Z M,ZENG R F,ZHANG J Z,HU C G. High-density genetic map construction and identification of QTLs controlling leaf abscission trait in Poncirus trifoliata[J].International Journal of Molecular Sciences,2021,22(11):5723.
[7] 黄其椿,卢东长城,陈东奎,江东,刘吉敏,谢健,施平丽,张兰,刘福平.沃柑SSR 分子标记筛选及其在品种鉴定上的应用[J].江苏农业科学,2020,48(1):75-79.HUANG Qichun,LU Dongchangcheng,CHEN Dongkui,JIANG Dong,LIU Jimin,XIE Jian,SHI Pingli,ZHANG Lan,LIU Fuping. Screening of Orah SSR markers and its application in cultivar identification[J].Jiangsu Agricultural Sciences,2020,48(1):75-79.
[8] 夏强明,彭珺,解凯东,伍小萌,徐强,郭文武.以雄性不育胞质杂种‘华柚2 号’为母本创制柚有性群体[J]. 果树学报,2019,36(8):961-967.XIA Qiangming,PENG Jun,XIE Kaidong,WU Xiaomeng,XU Qiang,GUO Wenwu. Production of sexual hybrids with male sterile somatic cybrid pummelo‘Huayou No. 2’as female parent[J].Journal of Fruit Science,2019,36(8):961-967.
[9] 石开明,邓志军,方响亮.贡水白柚基因组DNA 提取方法研究[J].北方园艺,2014(21):97-100.SHI Kaiming,DENG Zhijun,FANG Xiangliang. Study on extraction of genome DNA in Gongshui pomelo[J]. Northern Horticulture,2014(21):97-100.
[10] WANG X,XU Y T,ZHANG S Q,CAO L,HUANG Y,CHENG J F,WU G Z,TIAN S L,CHEN C L,LIU Y,YU H W,YANG X M,LAN H,WANG N,WANG L,XU J D,JIANG X L,XIE Z Z,TAN M L,LARKIN R M,CHEN L L,MA B G,RUAN Y J,DENG X X,XU Q. Genomic analyses of primitive,wild and cultivated citrus provide insights into asexual reproduction[J].Nature Genetics,2017,49(5):765-772.
[11] 韩健,夏文文,杨贵兵,罗旭钊,蒋松良,李先信,邓子牛,马先锋. 沙田柚×枳杂交群体创建与InDel 标记鉴定[J]. 果树学报,2023,40(2):223-229.HAN Jian,XIA Wenwen,YANG Guibing,LUO Xuzhao,JIANG Songliang,LI Xianxin,DENG Ziniu,MA Xianfeng. Establishment of Shatian pomelo×P.trifoliata hybrid population and In-Del marker identification[J]. Journal of Fruit Science,2023,40(2):223-229.
[12] 常宏兵,王晨,何美敬,曹熙敏,俞凤芳,曹晓良,宋炜,吕爱枝.基于SSR 标记对69 份玉米种质资源的遗传多样性分析[J/OL].作物杂志,2025:1-8. (2025-01-10). https://link.cnki.net/urlid/11.1808.s.20250110.1111.012.CHANG Hongbing,WANG Chen,HE Meijing,CAO Ximin,YU Fengfang,CAO Xiaoliang,SONG Wei,LÜ Aizhi. Genetic diversity analysis of 69 maize germplasm resources based on SSR markers[J/OL].Crops,2025:1-8.(2025-01-10).https://link.cnki.net/urlid/11.1808.s.20250110.1111.012.
[13] 苏国钊,李嫒嫒,刘中华,陈宇华,张秀杰,马莹雪,杨旭红,邓超,徐振江.苦瓜品种SSR 分子标记鉴定技术体系构建与应用[J].中国农业科学,2024,57(11):2227-2242.SU Guozhao,LIAiai,LIU Zhonghua,CHEN Yuhua,ZHANG Xiujie,MA Yingxue,YANG Xuhong,DENG Chao,XU Zhenjiang.Construction and application of SSR marker identification system for bitter gourd varieties[J]. Scientia Agricultura Sinica,2024,57(11):2227-2242.
[14] 刘勇,刘德春,吴波,孙中海.利用SSR 标记对中国柚类资源及近缘种遗传多样性研究[J]. 农业生物技术学报,2006,14(1):90-95.LIU Yong,LIU Dechun,WU Bo,SUN Zhonghai.Genetic diversity of pummelo and their relatives based on SSR markers[J].Journal of Agricultural Biotechnology,2006,14(1):90-95.
[15] 韩国辉,向素琼,汪卫星,魏旭,何波,李晓林,梁国鲁.沙田柚杂交后代群体的SSR 鉴定与遗传多样性分析[J].中国农业科学,2010,43(22):4678-4686.HAN Guohui,XIANG Suqiong,WANG Weixing,WEI Xu,HE Bo,LI Xiaolin,LIANG Guolu. Identification and genetic diversity of hybrid progenies from Shatian pummelo by SSR[J]. Scientia Agricultura Sinica,2010,43(22):4678-4686.
[16] CONNER J A,MOOKKAN M,HUO H Q,CHAE K,OZIASAKINS P.A parthenogenesis gene of apomict origin elicits embryo formation from unfertilized eggs in a sexual plant[J]. Proceedings of the National Academy of Sciences of the United States of America,2015,112(36):11205-11210.
[17] NAKANO M,SHIMIZU T,FUJII H,SHIMADA T,ENDO T,NESUMI H,KUNIGA T,OMURA M. Marker enrichment and construction of haplotype-specific BAC contigs for the polyembryony genomic region in Citrus[J]. Breeding Science,2008,58(4):375-383.
[18] SMITH M W,WEBB M,GULTZOW D L,NEWMAN T K,INNES D,DILLON N,OWEN-TURNER J,XU Q.Application of a MITE citrus apomixis marker in the Australian rootstock breeding program[J].Acta Horticulturae,2019(1230):1-6.
[19] 张斯淇.柑橘无融合生殖的遗传分析和相关基因挖掘[D].武汉:华中农业大学,2017.ZHANG Siqi. Genetic analysis of citrus apomixis and its related genes discovery[D]. Wuhan:Huazhong Agricultural University,2017.
[20] ZHANG C Z,WANG P,TANG D,YANG Z M,LU F,QI J J,TAWARI N R,SHANG Y,LI C H,HUANG S W. The genetic basis of inbreeding depression in potato[J]. Nature Genetics,2019,51(3):374-378.