蓝莓属于杜鹃花科(Ericaceae)越橘属(Vaccinium spp.)[1]。在中国蓝莓广泛栽培,但在一些南方产区,因气候潮湿等因素导致灰霉病连续多年暴发,进而严重影响了蓝莓果实的产量、品质及产业的经济效益。绿宝石(Emerald)是易感易发灰霉病的品种之一[2],受害严重时甚至会绝产。已有学者对灿烂(Britewell)[3]、莱格西(Legacy)[4]等品种的蓝莓灰霉病开展研究,但对绿宝石的相关研究仍然极少。
灰霉病为真菌性病害,主要致病菌为葡萄孢属真菌(Botrytis),最常见的为灰葡萄孢真菌。灰葡萄孢侵染范围广,可危害470 多种植物包括重要经济作物如蓝莓、番茄、葡萄、草莓、黄瓜等[5]。草莓、葡萄、蓝莓等浆果类作物的发病特性相似,患病部位变褐、软腐、产生水渍状斑点[6]。环境温度为18~23 ℃,相对湿度持续在90%以上最有利于灰葡萄孢生存。在蓝莓生长季,低温高湿天气易导致花序和嫩芽感染灰霉病,花序紧密的蓝莓品种如绿宝石蓝莓更易感染[7]。灰葡萄孢往往从花朵部位开始感染,然后传播到发育中果实的子房和花梗,在果实成熟时处于休眠状态,收获前或采摘后导致果实腐烂[8]。灰葡萄孢菌会分泌降解细胞壁的酶类、草酸、毒素等致病因子,同时使植物在发病过程中产生活性氧(reactive oxygen species,ROS),ROS 可加速侵染部位的细胞死亡[9]。
当前,防治灰霉病的方法有物理防治、化学防治、微生物防治及诱导植物抗性防治[10]。因价格低、效果快,化学防治为灰霉病的主要防治方式[11]。但是,长期使用化学药物后,灰霉病易产生严重抗药性。有研究人员发现,在收集的249 株灰葡萄孢杆菌分离株中,66%对啶酰菌胺耐药,66%对吡唑醚菌酯耐药,29%对苯己胺耐药,20%对环丙脲胺中度耐药[12]。大量用药也易导致蓝莓农残超标,影响果实品质和效益。欧盟对多菌灵、甲胺磷、甲氰菊酯等35项蓝莓用药的最大残留限量(MRLs)的要求高于中国[13]],因此化学防治不仅易限制中国蓝莓出口创汇,还带来食品安全隐患。因此,建立蓝莓灰霉病的绿色防控方法至关重要。
茉莉酸甲酯、水杨酸、壳寡糖、枯草芽孢杆菌作为植物生理活性物质均可诱导植物抗病性。茉莉酸甲酯为天然植物产物,可介导多种发育过程和针对生物和非生物胁迫的防御反应,已被确立为植物信号传导分子[14]。水杨酸可作为内源信号使系统产生获得性抗性(Systemic Acquired Resistance,SAR),使植株积累病程相关蛋白,从而产生SAR,并影响细胞内抗氧化相关酶的活性,从而增强植物抗氧化系统活性,降低脂质的氧化水平,促进细胞代谢[15]。壳寡糖为天然植物生长刺激剂,可控制疾病,延长果实贮藏期,通过抑制细胞壁降解相关酶及其编码基因的表达延迟果实软化,保留不同次生代谢物如酚、类黄酮,增强防御酶的活性,从而抑制病原体感染并降低疾病发病率[16]。对田间生长的草莓施用三次茉莉酸甲酯可以激活植株的防御机制,上调发病机制相关蛋白编码基因的表达,延缓采后灰霉病的感染进程[17];采收前用2 mmol·L-1 SA 处理蓝莓Stella Blue,果实的多酚含量和抗氧化能力提高了100%[18],从而减少病害发生;对生长期间的杏果实喷施0.05%的壳寡糖溶液,果实黑斑病发病率减少了16.37%[19]。枯草芽孢杆菌为低毒生物制剂,已广泛推广,但存在作用对象单一的缺点[20],需进行具体田间试验进行效果验证。枯草芽孢杆菌Y2 菌株可诱导梨果实的抗病反应,增加黄酮类化合物含量,增强抗氧化相关酶活性[21]。贝莱斯芽孢杆菌(Bacillus velezensis)防治番茄灰霉病的效果优良,可显著提高叶片脯氨酸和可溶性蛋白的含量[22]。
目前,在番茄[23]、蓝莓[24]、草莓[25]等果实采后常辅以壳聚糖涂膜或施用1-甲基环丙烯(1-MCP)达到保鲜、抗病、延长货架期的目的,但壳聚糖涂膜的保鲜效果较弱且需与天然精油复配使用[26],而1-MCP 化学性质不稳定、半衰期短[27],这两种生长调节物质均存在使用方法复杂、成本较高的缺点。有研究表明在果实采收前对植株施用生长调节物质可提高果实品质,例如在收获前,施用MeJA 可提高樱桃抗氧化能力和酚类含量,延长水果保质期,提高水果质量并增加硬度[28]。采前对草莓进行水杨酸处理,可使其红色更深、硬度更高,糖、抗坏血酸和酚类物质的含量增加[29]。采前对番茄植株叶面喷施0.5 g·L-1和0.16 g·L-1的壳寡糖溶液,可提高成熟果实番茄红素、维生素C、果糖和葡萄糖的含量[30]。SA用于延缓采后蓝莓果实软化、腐烂[31];不同浓度的壳聚糖与精油复配涂膜也用于探究蓝莓的采后保鲜及对其可滴定酸、丙二醛等相关生理指标的影响[24],但更易被吸收的壳聚糖分解产物壳寡糖对蓝莓的影响研究极少;采后用MeJA浸泡蓝莓提高贮藏硬度[32],保持品质性状,或采前叶面喷施提高蓝莓植株抗氧化能力,减缓环境胁迫[33]。
SA、MeJA、壳寡糖、枯草芽孢杆菌在蓝莓花果发育过程中应用甚少,作用效果尚不明确。笔者在本研究中通过在蓝莓花期和果实转色期前,施用茉莉酸甲酯、壳寡糖、水杨酸三种天然植物生理活性物质与低毒生物制剂枯草芽孢杆菌,旨在制定蓝莓花期和幼果期灰霉病的绿色防护措施,保证蓝莓食品安全,提升果实的产量和品质,为科学防治蓝莓灰霉病提供依据。
1 材料和方法
1.1 材料
以安徽省郎溪县白茅岭农场的蓝莓绿宝石为试材进行田间试验,从蓝莓灰霉病发病果实中分离获得灰葡萄孢(Botrytis cinerea)。
1.2 试验方法
1.2.1 灰葡萄孢防治制剂筛选 含药平板制作参考李树成等[34]的方法,将相应试剂按比例加入温度约为40 ℃的马铃薯葡萄糖琼脂(PDA)培养基中,分别制成0.5、1、2、3、4 mmol·L-1的水杨酸平板(简称0.5SA、1SA、2SA、3SA、4SA),0.01、0.05、0.1 mmol·L-1的茉莉酸甲酯平板(简称0.01M、0.05M、0.1M),62.5、2000 mg·L-1 的枯草芽孢杆菌平板(简称62.5BS、2000BS),0.6、1.5、5、10 g·L-1的壳寡糖平板(简称0.6C、1.5C、5C、10C)。将灰葡萄孢在PDA 培养基上进行培养,打取7 mm 菌饼放置在带药平板中央,以不带药平板作为对照,3 次重复,25 ℃恒温培养,每日用十字交叉法测量菌的生长直径,直至对照组长满平板为止。
1.2.2 生理活性制剂田间施用方法 田间蓝莓定植3 a(年),起垄栽培,南北行向,株行距1 m×2 m,设置SA 处理浓度为0.1、0.5、1 mmol·L-1(简称0.1SA、0.5SA、1SA);MeJA 处理浓度为0.01、0.1、0.5 mmol·L-1(简称0.01M、0.1M、0.5M);壳寡糖处理质量浓度为1.5、5 g·L-1(简称1.5C、5C);枯草芽孢杆菌处理质量浓度为2 g·L-1(简称BS);设置喷清水为对照,共10个处理组,每处理组为一垄(30株),3次重复,每重复为10 株,分别在花期(2024 年3 月22日、2024年4月1日)、幼果期(2024年4月20日)、膨大期(2024年5月10日)施用,用电动喷雾器对整株均匀喷施,至整株植株湿润并向下滴水为止。随机选取不同树体中部外围果实进行取样(2024 年4 月20日采集幼果期果实、2024年5月10日采集膨大期果实、2024年5月20日采集转色期与成熟期果实)。
1.2.3 田间调查方式 花期灰霉发病率调查:每处理间隔一定距离随机选取5 株植株,在花期统计整株花量、因灰霉侵染产生的萎蔫花序数及发霉花朵数,计算发病比率。
果实发育特性调查:在幼果期、膨大期、转色期、成熟期每处理每重复随机摘取等量果实,混匀,随机选取20 颗蓝莓果实,使用游标卡尺测量横径与纵径,使用千分之一天平测量质量,使用GY-4 水果硬度计(北京金科利达电子科技有限公司)测量硬度。
树体新梢量与产量调查:果实成熟后,各处理每重复随机选取1株蓝莓,共3株,统计整株果实个数,结合平均成熟果实单果质量估算果实产量;新梢停长后,各处理每重复随机选取1株植株,共3株,统计整株新梢量。
采后发病情况统计:各处理组随机选择90颗成熟蓝莓果实,于第3天计算腐烂率;各处理组随机选择100 颗成熟蓝莓果实,从各组中随机选择10 颗统计初始单果质量,第9 天各组随机选择10 颗统计单果质量,计算质量损失率,均设置3次重复。
1.2.4 生理指标测定 DPPH自由基清除率测定方法:取0.5 g 样品,95%乙醇提取,取2 mL 上清液加2 mL DPPH溶液(0.1 mmol·L-1),暗反应30 min测吸光度[35]。丙二醛(MDA)含量测定方法:取0.5 g 样品,加入5 mL 5%三氯乙酸(TCA)溶液,取2 mL 上清液,加入0.67%硫代巴比妥酸(TBA)溶液2 mL,100 ℃水浴30 min,测定吸光度[36]。SOD 酶活性测定使用氮蓝四唑光还原法[37]。花青素含量用pH 示差法测定[38]。原花青素用正丁醇盐酸法测定,以原花青素为标准品[35]。总酚和总黄酮含量分别使用福林酚比色法[39]与亚硝酸钠-硝酸铝法[40]测定,均以芦丁标准品定量。果糖和蔗糖含量测定使用间苯二酚比色法[41],葡萄糖含量测定使用南京建成生物工程研究所葡萄糖(GLU)测试盒,可溶性总糖含量测定使用蒽酮硫酸法[41]。可滴定酸含量测定使用NaOH中和滴定法[42]。
1.3 数据处理
使用Origin 2022进行图表绘制与主成分分析和相关性分析,使用IBM SPSS Statistics 26 进行数据统计分析,试验均设置3次重复,平均值误差均使用标准误差,采用Duncan分析法进行差异显著性分析。
2 结果与分析
2.1 灰葡萄孢生长抑制活性物质筛选
水杨酸(第2、3、4 天)和壳寡糖(第1、2、3 天)都对灰葡萄孢菌丝生长有显著抑制作用(图1-A、C、E、F),且浓度越高,抑制作用越强,第4天时,0.5、1、2、3、4 mmol·L-1的SA处理灰葡萄孢直径较CK分别显著下降了16.04%、19.41%、36.83%、48.91%、66.93%;第3 天时,0.6、1.5、5、10 g·L-1的壳寡糖处理灰葡萄孢直径较CK 分别显著下降了12.16%、31.61%、55.04%、85.01%。第2、3、4天,茉莉酸甲酯对灰葡萄孢菌丝生长抑制效果从大到小依次为0.01 mmol·L-1、0.1 mmol·L-1、0.05 mmol·L-1(图1-B、G)。在生长第3、4 天0.01M 处理组灰葡萄孢菌丝直径显著低于对照组,而在生长第4天0.1M处理组灰葡萄孢菌丝直径显著低于对照组。62.5BS、2000BS均对灰葡萄孢菌丝生长具有100%的抑制作用,它们可以迅速利用PDA培养基中的营养和生长空间(图1-D、H)。

图1 不同浓度活性物质对灰葡萄孢生长的影响
Fig.1 Effect of different concentrations of active substances on the growth of Botrytis cinerea
2.2 绿宝石蓝莓田间灰霉病防治效果分析
灰霉病菌主要侵染部位为枯萎花瓣,初期携带残留萎蔫花瓣的花萼变紫、萎蔫下垂,遇雨极易腐烂,天晴后皱缩发黑,随侵染加剧着生灰褐色粗糙状霉层。由于绿宝石具有花序落花不整齐的特性,因此发病花序极易侵染健康花序。
如图2所示,与对照相比,不同处理均显著降低萎蔫花序的灰霉病比率,1SA效果最好,其次按效果从高到低依次为1.5C、0.1SA、5C、0.5SA、0.5M、0.01M、BS和0.1M。除0.5SA,其余处理均显著降低发霉花朵的灰霉病比率,0.5M 处理的效果最好,其次效果从高到低为0.1SA、5C、0.01M、BS、1.5C、0.1M、1SA。以上结果表明,0.1SA、5C、0.5M、0.01M、BS 田间处理防治萎蔫花序和发霉花朵灰霉病发病的效果较优。
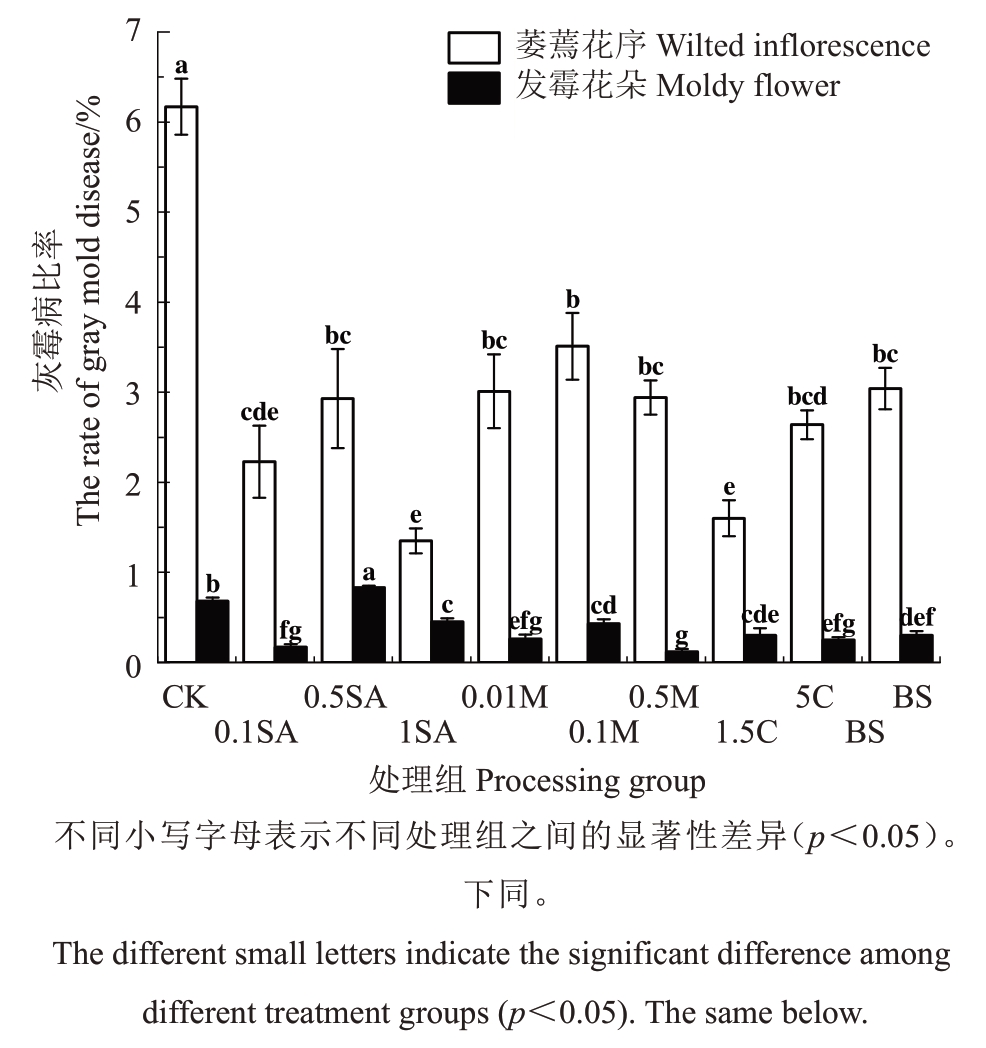
图2 不同处理下萎蔫花序和发霉花朵的发病比率
Fig.2 Incidence rate of wilted inflorescence and moldy flower under different treatments
2.3 施用生理活性物质对蓝莓果实生长的影响
如图3 所示,在幼果期,1.5C 与0.5M 处理的果实横径与质量均显著高于对照;三种SA 处理与BS处理的果实纵径显著低于对照;除0.1M 与BS 处理外,其余处理的果实硬度均显著高于对照。在果实膨大期,1.5C、BS、0.5SA 处理果实的横径与质量显著高于对照;1SA、0.1SA、0.01M 处理果实的纵径显著低于对照;除1SA、0.5M、0.01M、5C 处理外,其余处理的果实硬度均显著高于对照。在转色期,0.1SA 处理果实的横径和质量显著高于对照,5C 处理果实的横径和质量均显著低于对照;1SA、0.5M、1.5C、5C 处理果实的硬度显著高于对照;各处理果实的纵径无显著差异。在成熟期,除5C 处理外,各处理果实质量显著大于对照;除0.01M 和1.5C 处理外,其余处理能提高果实硬度,但未达显著水平,可能与果实体积增大有关。综上可得,1.5C处理可显著增加幼果和膨大期果实的横径、质量、硬度;0.1SA 处理可降低幼果和膨大期果实的纵径与质量,但会增加硬度,显著增大转色期果实的横径和质量,维持硬度和纵径与对照组水平一致;0.5M 与1.5C 处理可显著提高转色期果实的硬度,维持横纵径、质量基本不变。各处理对成熟期果实大小的影响主要表现在横径,除5C 处理外,其他处理均显著提高果实的横径。
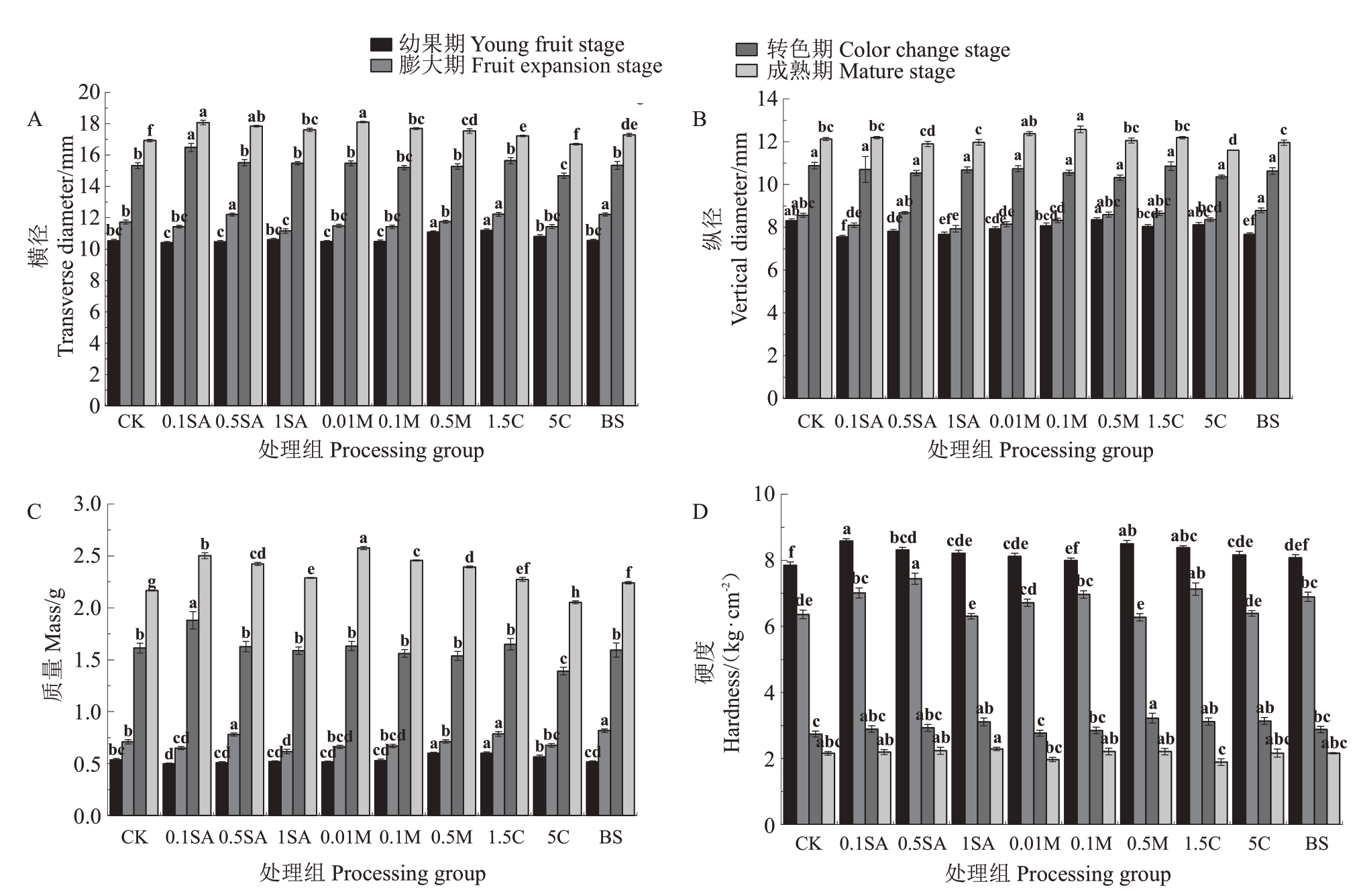
图3 幼果期、膨大期、转色期、成熟期果实的横纵径、硬度、质量平均值
Fig.3 Average value of hardness,weight,transverse and vertical diameters of fruits in young fruit stage,fruit expansion stage,color change stage and mature stage
2.4 喷施药物对蓝莓植株树体和果实采后品质的影响
如图4所示,5C、BS、0.5M、0.01M处理组新梢量显著高于对照,1SA 处理组新梢量显著低于对照;0.1SA、1.5C、1SA 处理组果实产量显著高于对照,BS处理组果实产量显著低于对照;采后第3天时各处理组腐烂率均显著低于对照;采后第9天时1.5C、0.1SA、0.5M 处理组果实质量损失比率显著低于对照。综上,1.5C、0.1SA、0.5M 处理能较好的维持蓝莓果实的采后品质。
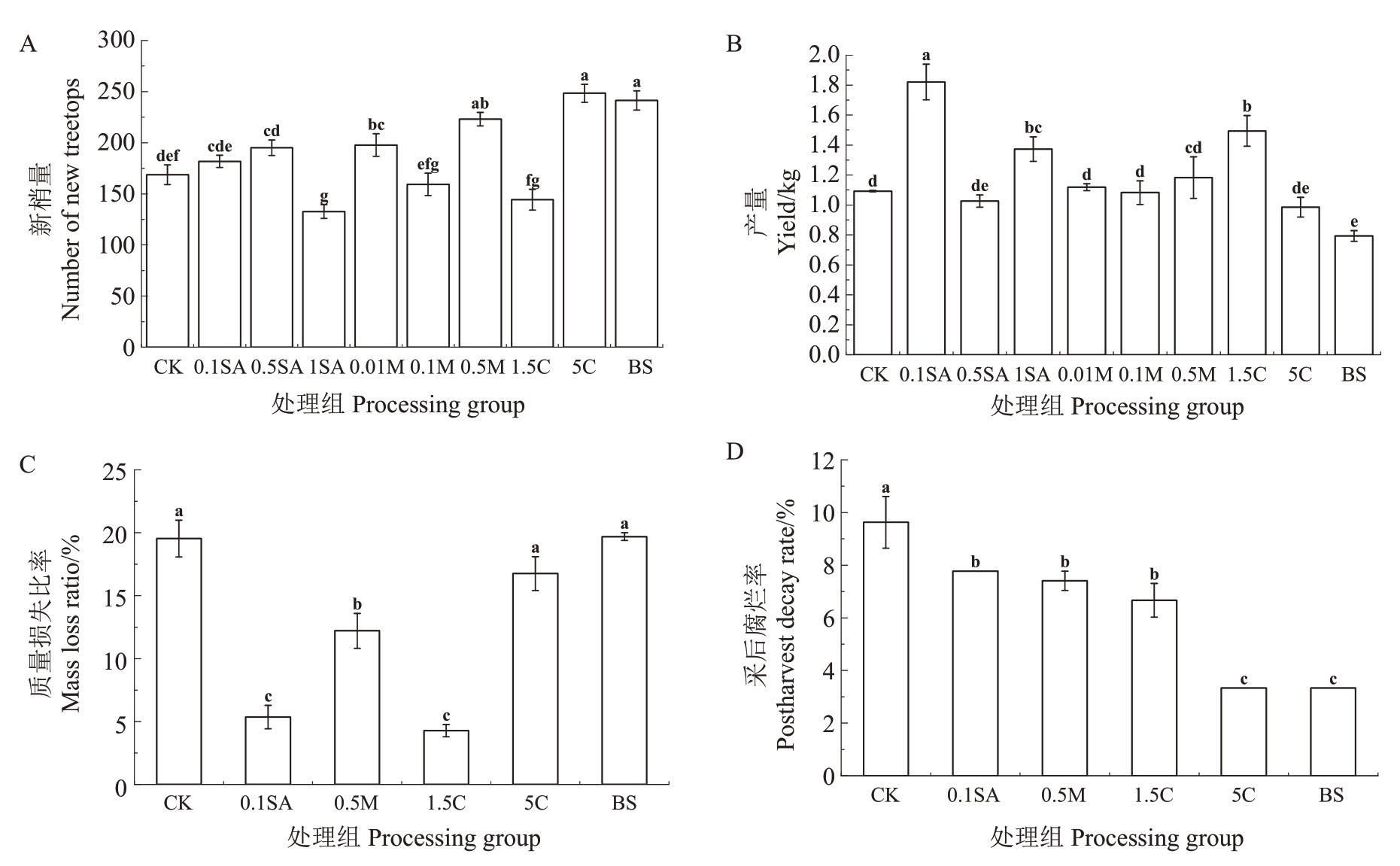
图4 不同处理组对树体及采后成熟果实贮藏品质的影响状况
Fig.4 Effects of different treatment groups on the storage quality of postharvest mature fruit and tree
2.5 施用活性物质对蓝莓果实品质的影响
2.5.1 施用活性物质对抗氧化活性的影响 丙二醛含量反映果实细胞膜透性和衰老程度。如图5-A所示,在幼果期,0.1SA、1.5C 处理果实丙二醛含量显著高于对照;在膨大期,1.5C 处理果实丙二醛含量显著低于对照,0.1SA 处理果实丙二醛含量显著高于对照;在转色期,0.1SA处理果实丙二醛含量显著低于对照;在前三个时期,0.5M 处理果实丙二醛含量与对照无显著差异;在成熟期,各处理果实丙二醛含量均显著低于对照,其中0.5M 处理效果最佳,有利于增强果实耐储性。

图5 在幼果期、膨大期、转色期、成熟期0.1SA、0.5M、1.5C 处理对果实抗氧化活性与糖酸含量的影响
Fig.5 Effects of 0.1SA,0.5M,1.5C on antioxidant activity and sugar and acid content in young fruit stage,fruit expansion stage,color change stage and mature stage
DPPH 自由基清除率反映果实的抗氧化能力。如图5-B所示,DPPH自由基清除率从幼果到膨大期缓慢上升,到转色期开始缓慢下降,到成熟期迅速下降。1.5C 与0.5M 处理在幼果期DPPH 自由基清除率显著低于对照,但1.5C在转色期显著提升;0.1SA处理使其在幼果期显著下降,膨大期无显著变化,在转色期显著下降;在成熟期,各处理均可显著提升成熟果实抗氧化能力,其中0.5M处理效果最佳。
如图5-C,0.1SA 处理在成熟期果实SOD 活性显著低于对照,在其余三个时期与对照无显著差异。0.5M和1.5C处理在四个时期均使果实SOD活性显著低于对照。推测原因是:SOD活性降低使细胞迅速积累超氧阴离子,作为激活细胞抗性的信号,所以将其维持在较低水平。
2.5.2 施用活性物质对糖酸含量的影响 随果实成熟,总糖含量持续上升(图5-D),0.5M处理组在幼果期果实总糖含量显著高于对照;1.5C处理组在膨大期果实总糖含量显著高于对照;在转色期和成熟期,各处理果实总糖含量均高于对照。果糖含量从幼果期到膨大期基本不变,到转色期开始迅速上升,并随成熟持续上升(图5-E)。成熟期各组果糖含量均高于对照。蔗糖含量从幼果期到成熟期呈持续上升趋势(图5-F),膨大期0.5M 处理果实蔗糖含量显著高于对照。膨大期0.5M 处理果实葡萄糖含量迅速下降,到转色期迅速上升,与蔗糖含量变化趋势相反,说明两者在此时间段发生相互转化。成熟期,各处理组果实蔗糖、葡萄糖、总糖含量均显著高于对照。
可滴定酸含量从幼果期到膨大期迅速上升,到转色期迅速下降,随果实成熟持续下降(图5-G)。除成熟期1.5C 处理果实可滴定酸含量显著高于对照外,在四个时期,其余各处理均无显著差异。
综上,三种处理均可提升成熟蓝莓甜度,1.5C处理可大幅增加各时期果实的葡萄糖含量(图5-H),适度提升成熟期蓝莓的酸度,改善其风味品质。
2.5.3 施用活性物质对酚类和黄酮类物质含量的影响 蓝莓果实的原花青素和总酚含量从幼果期到膨大期逐渐上升,随转色和成熟逐渐下降(图6-A、B)。0.1SA处理下果实原花青素含量在膨大与转色期与对照无显著差异,在幼果期与成熟期显著高于对照;0.5M处理下果实原花青素含量除膨大期与对照无显著差异外,幼果期、转色期、成熟期均显著低于对照;1.5C处理下果实原花青素含量在幼果与转色期与对照无显著差异,在膨大期显著低于对照,成熟期显著高于对照。果实的总酚含量在成熟期各组均高于对照。果实的花青素含量在成熟期除0.1SA处理与对照无显著差异外,0.5M和1.5C处理均显著低于对照(图6-C)。
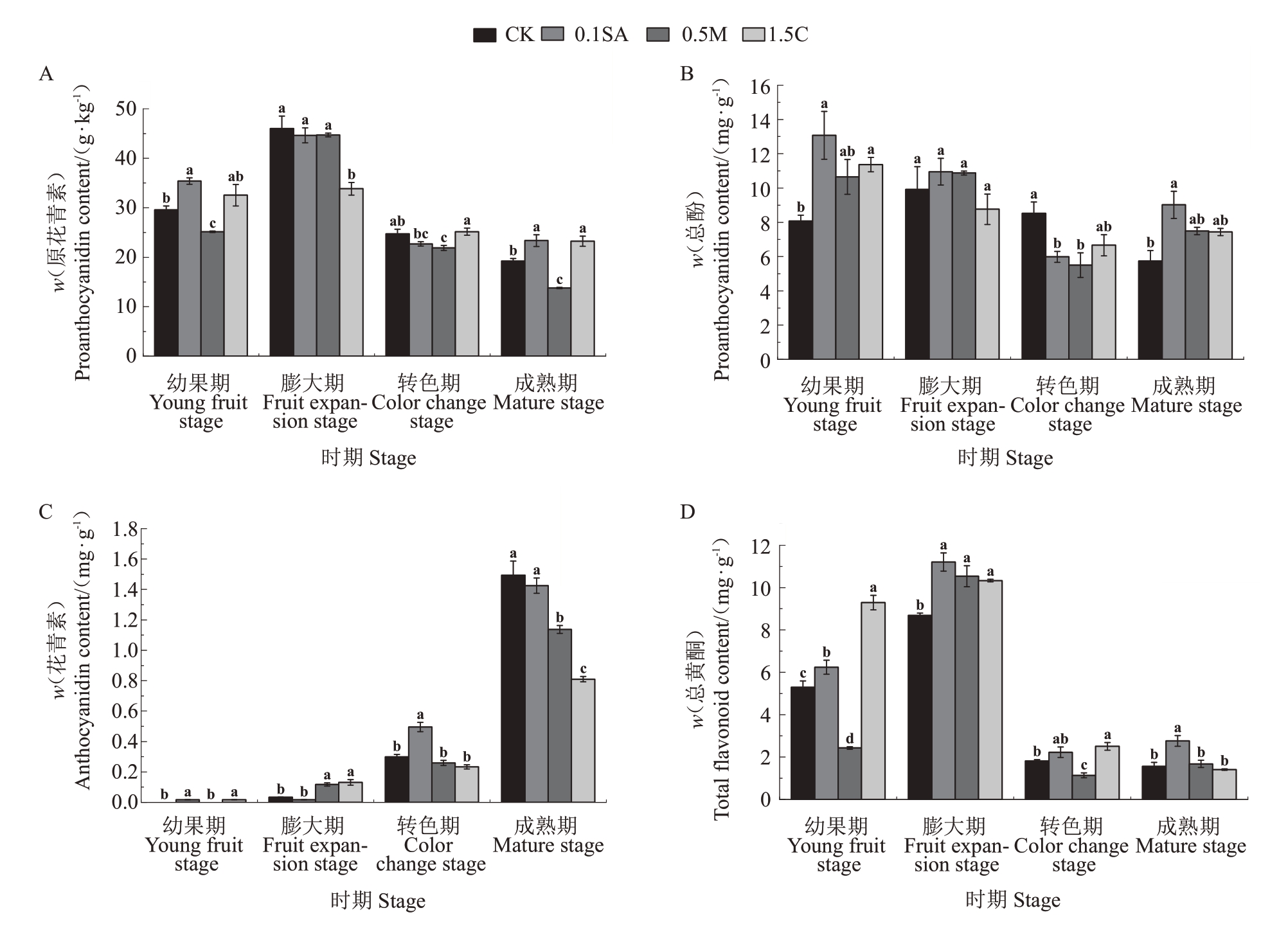
图6 幼果期、膨大期、转色期、成熟期0.1SA、0.5M、1.5C 处理对果实酚类和黄酮类物质含量的影响
Fig.6 Effect of 0.1 SA,0.5M,1.5C on the content of phenols and flavonoids in young fruit stage,fruit expansion stage,color change stage and mature stage
总黄酮含量从幼果期到膨大期逐渐上升,到转色期迅速下降,至成熟期基本不变(图6-D)。0.1SA处理下果实总黄酮含量除在转色期高于对照但无显著差异外,其余三个时期均显著高于对照;0.5M 处理下果实总黄酮含量在幼果期显著低于对照,在膨大期显著高于对照,在转色期显著低于对照,在成熟期与对照无显著差异。
综上,0.1SA处理综合表现最优,可显著增加成熟期果实的原花青素、总酚、总黄酮含量,并维持花青素含量较对照无显著差异,说明该处理可以有效提升果实抗氧化能力与抵抗逆境的能力,提高其营养价值。
2.5.4 施用活性物质对成熟蓝莓内外品质影响的综合评价 为精确评价各处理对成熟果实内外品质的影响(表1),对16 个指标进行主成分分析,提取出3个主成分因子,累计方差贡献率达100%,说明3 个主成分因子可解释成熟果实内外品质全部信息。第一主成分主要由总糖、蔗糖、果糖含量及DPPH自由基清除率决定,反映果实甜度和抗氧化能力;第二主成分主要由成熟果实硬度、横径、质量、总黄酮及花青素含量决定,反映果实大小和营养品质;第三主成分主要由原花青素含量和纵径决定,同样反映果实大小与营养品质。
表1 主成分载荷矩阵
Table 1 Principal component load matrix
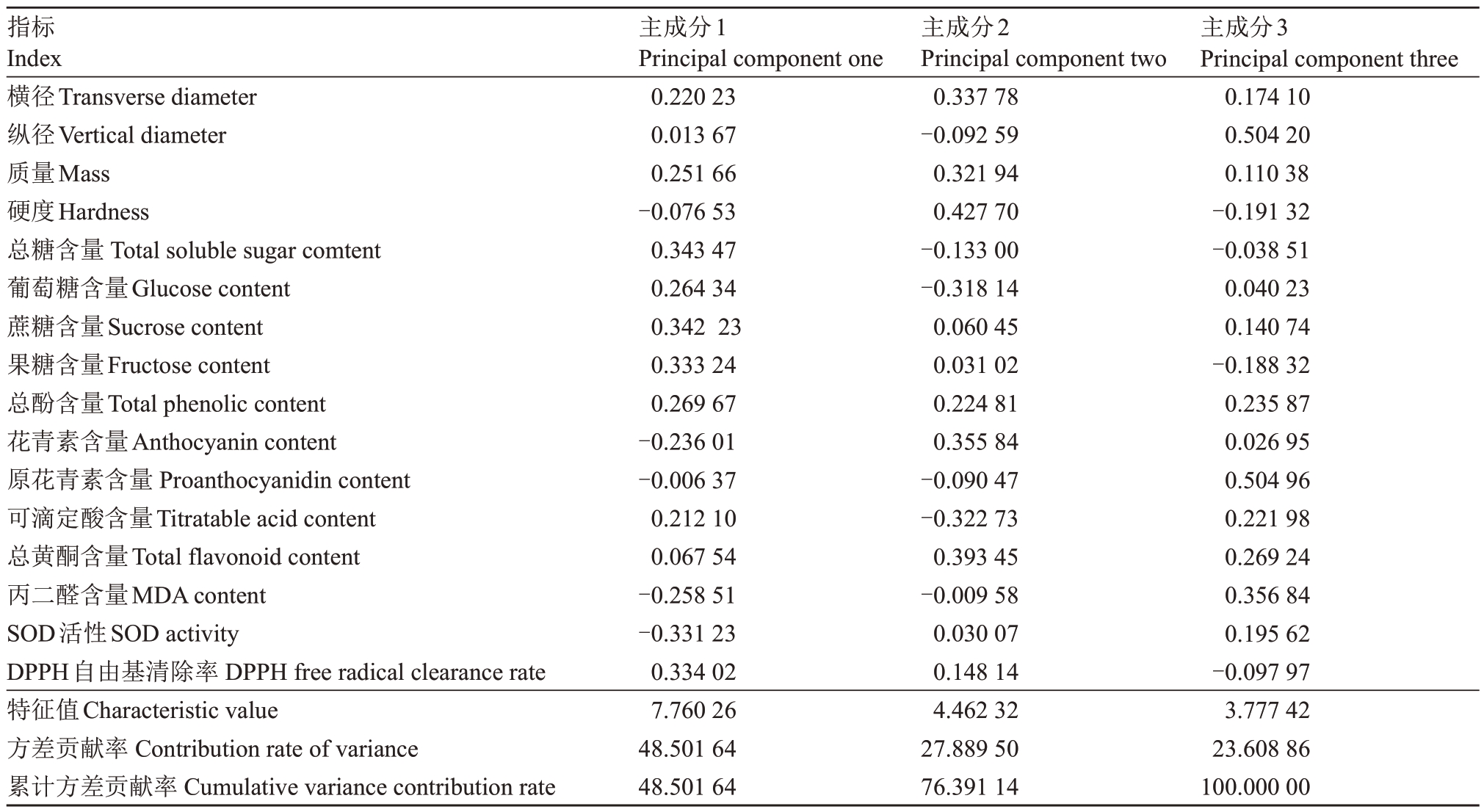
指标Index横径Transverse diameter纵径Vertical diameter质量Mass硬度Hardness总糖含量Total soluble sugar comtent葡萄糖含量Glucose content蔗糖含量Sucrose content果糖含量Fructose content总酚含量Total phenolic content花青素含量Anthocyanin content原花青素含量Proanthocyanidin content可滴定酸含量Titratable acid content总黄酮含量Total flavonoid content丙二醛含量MDA content SOD活性SOD activity DPPH自由基清除率DPPH free radical clearance rate特征值Characteristic value方差贡献率Contribution rate of variance累计方差贡献率Cumulative variance contribution rate主成分1 Principal component one 0.220 23 0.013 67 0.251 66-0.076 53 0.343 47 0.264 34 0.342 23 0.333 24 0.269 67-0.236 01-0.006 37 0.212 10 0.067 54-0.258 51-0.331 23 0.334 02 7.760 26 48.501 64 48.501 64主成分2 Principal component two 0.337 78-0.092 59 0.321 94 0.427 70-0.133 00-0.318 14 0.060 45 0.031 02 0.224 81 0.355 84-0.090 47-0.322 73 0.393 45-0.009 58 0.030 07 0.148 14 4.462 32 27.889 50 76.391 14主成分3 Principal component three 0.174 10 0.504 20 0.110 38-0.191 32-0.038 51 0.040 23 0.140 74-0.188 32 0.235 87 0.026 95 0.504 96 0.221 98 0.269 24 0.356 84 0.195 62-0.097 97 3.777 42 23.608 86 100.000 00
利用筛选出的11 个关键指标的隶属函数加权平均值对成熟果实品质进行综合评价(表2),效果由高到低依次为0.1SA、1.5C、0.5M。由单因素隶属度得出,0.5M 对DPPH 自由基清除效果最好,可提高果实的抗氧化能力;0.1SA对原花青素、总黄酮含量提升效果最优,可提高果实营养品质。
表2 不同处理对果实品质影响的综合评价
Table 2 Comprehensive evaluation of the effects of different treatments on fruit quality
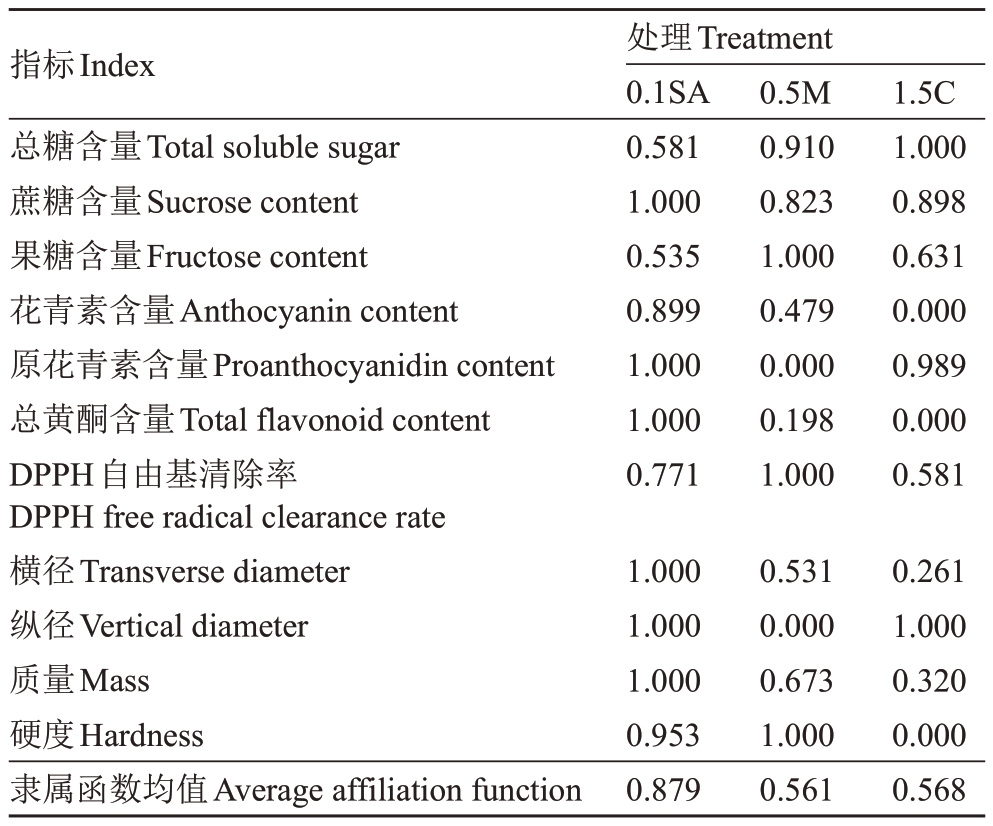
指标Index总糖含量Total soluble sugar蔗糖含量Sucrose content果糖含量Fructose content花青素含量Anthocyanin content原花青素含量Proanthocyanidin content总黄酮含量Total flavonoid content DPPH自由基清除率DPPH free radical clearance rate横径Transverse diameter纵径Vertical diameter质量Mass硬度Hardness隶属函数均值Average affiliation function处理Treatment 0.1SA 0.581 1.000 0.535 0.899 1.000 1.000 0.771 0.5M 0.910 0.823 1.000 0.479 0.000 0.198 1.000 1.5C 1.000 0.898 0.631 0.000 0.989 0.000 0.581 1.000 1.000 1.000 0.953 0.879 0.531 0.000 0.673 1.000 0.561 0.261 1.000 0.320 0.000 0.568
2.5.5 活性物质处理对成熟蓝莓内外品质影响的相关性分析 如图7 所示,在CK 组,原花青素与DPPH 自由基清除率呈显著正相关,总糖与蔗糖含量呈显著正相关,成熟果实质量与SOD活性呈极显著正相关;在0.1SA 组,DPPH 自由基清除率与丙二醛含量、SOD活性、成熟果实质量均呈显著正相关,与成熟果实硬度呈显著负相关;在0.5M 组,DPPH自由基清除率与总糖、原花青素、总黄酮含量呈负相关,与花青素含量呈正相关,总糖与原花青素含量呈正相关,原花青素、葡萄糖、成熟果实横径与总酚含量均呈显著正相关,成熟果实质量与总黄酮含量呈显著负相关;在1.5C组,DPPH自由基清除率与原花青素含量呈正相关,总糖与总酚含量、花青素含量、成熟果实横径呈负相关,与总黄酮含量、成熟果实质量呈正相关,花青素含量与成熟质量呈负相关,葡萄糖含量与成熟硬度呈显著正相关。综上果实抗氧化能力主要受原花青素含量影响,0.1SA 通过影响SOD 活性,而0.5M 和1.5C 通过影响糖含量及黄酮类物质含量调控果实抗氧化能力及外观品质,3 个处理均可通过黄酮类物质含量调控果实甜度。
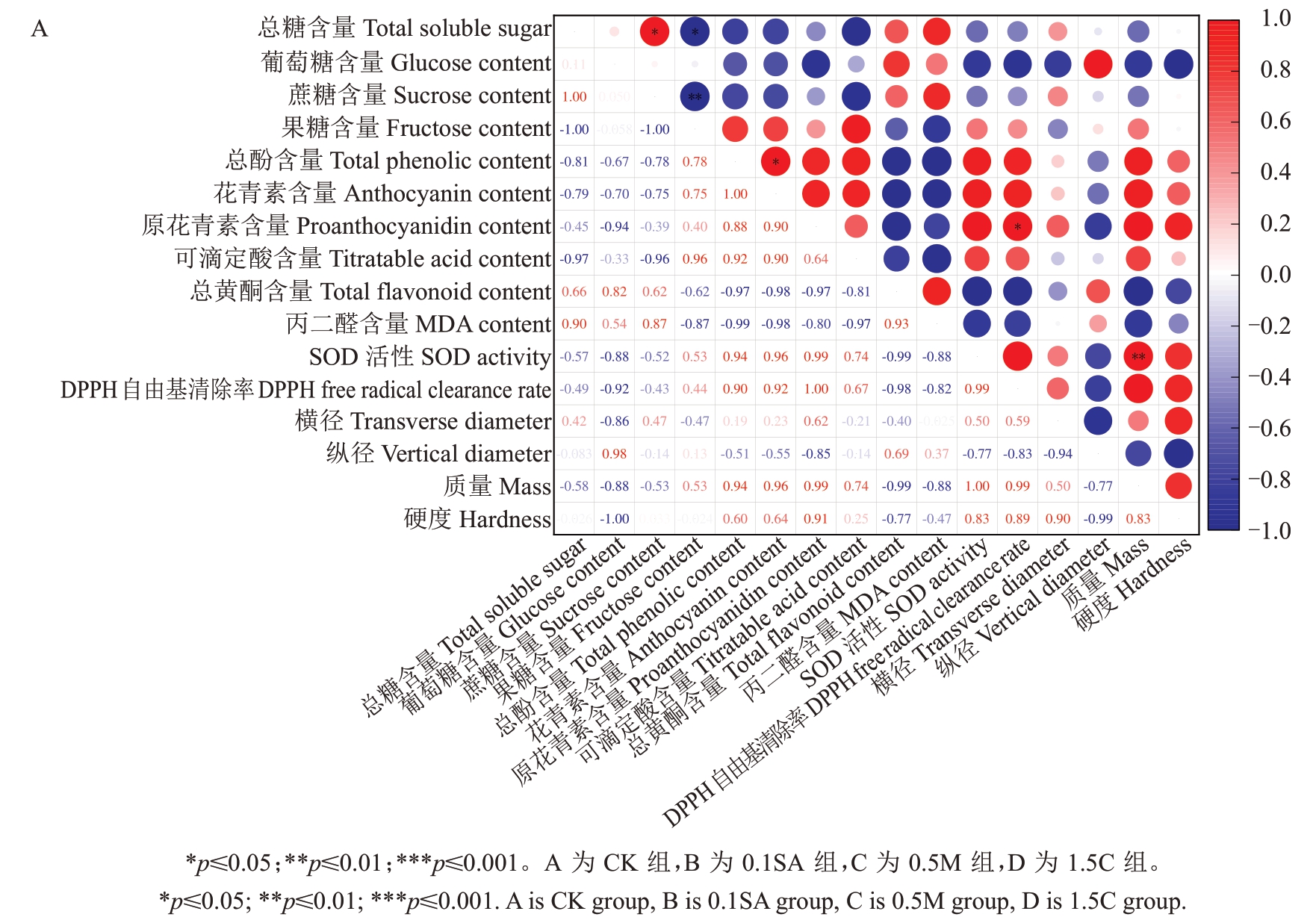
图7 不同处理下成熟果实内外品质指标相关性分析热图
Fig.7 Correlation between internal and external quality indexes of mature fruits under different treatments

图7 (续) Fig.7 (Continued)
3 讨 论
3.1 四种活性物质对田间蓝莓灰霉病的抑制效果
本研究中单一抑制萎蔫花序和发霉花朵灰霉病效果最好的处理组分别为1SA和0.5M,对两者抑制效果均好的为0.1SA,其次依次为5C、0.5M、0.01M、BS。0.1SA、0.5M、1.5C 大幅提高成熟果实DPPH 自由基清除率,从而降低果实丙二醛含量,延缓果实衰老。以往灰霉病发病率调查较为笼统,常以发病株数或随机枝条发病花量作为衡量指标[43],缺乏根据特定品种发病特征进行整株详细调查的研究。不同于平板对峙试验中呈现出的水杨酸、壳寡糖浓度越高,抑菌效果越好的特性,田间状况较为复杂,且制剂会在杀菌的同时影响植株自身的抗性。水杨酸可作抗性诱导剂,如使用1.5 μmol·L-1的水杨酸每周两次喷洒草莓叶片延缓了灰葡萄孢在果实上的表达和发育,并提高了果实对病原体的防御效果、增加了果实产量[44]。因此制剂的施用浓度要根据使用环境灵活调整。本研究中成熟期果实0.1SA、0.5M、1.5C处理组SOD活性显著下降,这可能是由于通过迅速积累超氧阴离子,作为转导信号,来激活细胞抗性反应。SA能诱导ROS爆发、调控抗氧化酶活性,增强植物抗性反应,SA还可以抑制活性氧降解酶类的活性,从而使细胞内部积累一定量的活性氧,达到增强植物抗性的目的[45]。壳聚糖和水杨酸联合涂膜处理可有效抑制砂糖橘绿霉病病斑直径和发病率升高,增强其抗性[46]。MeJA 可提高发病机制相关蛋白含量和总酚含量,增强番茄果实对灰葡萄孢菌的抗性[47]。使用12.5 g·L-1的壳寡糖溶液处理葡萄活体叶片,可降低49.5%的白粉病发病率[48]。枯草芽孢杆菌可产生多种抗真菌化合物,包括挥发物、脂肽、生物表面活性剂、几丁质酶、壳聚糖酶和其他真菌壁降解酶[49],同时可迅速利用植株表面的养分来增殖,从而为植株形成一层保护膜。在秋海棠上接种灰葡萄孢前24 h,与接种同时或接种后24 h 喷洒枯草芽孢杆菌均可抑制其在秋海棠叶盘上的定植[50]。
本研究发现5C、BS、0.5M、0.01M可以显著增加蓝莓植株的新梢量,可能原因是糖类、真菌制剂可以直接为树体提供营养物质,而茉莉酸甲酯通过刺激糖类代谢,为树体提供营养。应用MeJA 可以诱导淀粉酶(Amylase)活性并增加β-Amylase 的表达水平,这有助于通过淀粉降解进行糖的生物合成[51]。0.1SA、1.5C、1SA可以显著提升蓝莓的果实产量,在活性物质处理下,保证树体生殖生长与营养生长的平衡也是需要笔者考虑的问题。
本研究发现0.1SA、1.5C、0.5M有助于蓝莓植株抵抗灰霉病,还可增加或维持果实产量和新梢量,对树体无负面影响,综合表现出色。这说明,水杨酸、壳寡糖、茉莉酸甲酯的抑病效果超越了枯草芽孢杆菌,且无毒,可作为商业抑菌剂,具有广泛的应用前景。
3.2 不同活性物质处理对不同时期果实内外品质的影响
除5C外,其他处理均可显著增加成熟期蓝莓果实的质量和横径,维持纵径和硬度,提高蓝莓外观品质。在0.1SA、0.5M、1.5C处理中,0.1SA在提高成熟果实质量和横径方面均最佳,并可小幅提升硬度。水杨酸可调节植物生长,它通过调控细胞内光合效率、抗氧化反应、矿物质吸收、激素平衡等促进细胞伸长、分裂,进而影响果实发育[52]。本研究显示,0.1SA 主要在成熟期显著提高果实总糖含量,且对原花青素、总黄酮、总酚含量提升效果优于其他处理。笔者推测,SA通过促进叶片光合作用及果实对蔗糖和葡萄糖等糖类的获取来增加单果质量,这可能也与蔗糖合酶促进蔗糖的合成有关。100 mg·L-1水杨酸可以通过调节糖积累来增加椰枣果实的产量[53]。酚类物质的增加可以延缓细胞衰老,维持果实硬度,延缓猕猴桃的软化[54]。本研究发现0.5M处理下蓝莓的成熟期果实DPPH 自由基清除能力最强,MDA 的累积量最低。此外0.5M 处理还可促进转色期果实中蔗糖向葡萄糖的转化。相关性分析显示,0.5M处理下果实抗氧化能力主要受原花青素等黄酮类含量影响,原花青素与DPPH 自由基清除率为负相关关系,可能原因是酚类是合成类黄酮的前体[55],拥有较强的抗氧化能力,可对自由基产生抑制作用[56]。酚类物质累积会导致原花青素等黄酮类物质合成减少,增强果实抗氧化能力。1.5C 处理对成熟期果实总糖、可滴定酸、各时期果实的葡萄糖含量提升的效果为最佳,因此壳寡糖可用于改善蓝莓果实风味,而不仅是增加甜味。相关性分析显示,成熟果实质量与总糖含量呈正相关。壳寡糖可以作为外源激发子,刺激果实自身积累糖等初级代谢产物,成熟期果实主动积累蔗糖与葡萄糖有利于维持细胞稳定的膜结构和蛋白质结构,确保在横径增加时能够维持硬度。转色期可再喷施一次壳寡糖来提升成熟期硬度。使用1.5%壳寡糖处理柑橘果实,其果皮葡萄糖含量显著提高,从而为果实抗病反应供应能量与底物,并刺激三羧酸循环有机酸的积累[57]。
综合评价表明三种处理效果从高到低为0.1SA、1.5C、0.5M,它们对成熟期果实内外品质提升同样表现出色。从经济成本方面考虑,水杨酸与壳寡糖价格低廉,茉莉酸甲酯则较为昂贵,在实际田间施用时,可根据预算及目的灵活调整搭配使用。例如期望效果为抑制灰霉病同时提升果实大小仅需施用价格低廉的水杨酸即可;若希望有效提升果实甜度,调节风味,则壳寡糖为优良选择。本研究通过将施用三种生理活性物质后对蓝莓果实品质产生的影响进行对比,明确其在农业应用上各自的优势及可能原因,旨在为农业生产提供简明的指导。
4 结 论
0.1 mmol·L-1 SA、1.5 g·L-1壳寡糖、0.5 mmol·L-1 MeJA在抑制花期灰霉病、促进果实发育与提升品质方面表现优良。0.1 mmol·L-1 SA对抑制萎蔫花序和发霉花朵综合效果较优,且其提升成熟期果实横径及原花青素、总黄酮、总酚含量的效果优于其他处理;1.5 g·L-1壳寡糖对成熟期果实的总糖、可滴定酸、各时期果实的葡萄糖含量提升的效果最佳;0.5 mmol·L-1 MeJA对成熟期果实DPPH自由基清除能力最强。本研究可为蓝莓田间绿色有机种植提供实践指导。
[1] YANG W J,GUO Y X,LIU M,CHEN X F,XIAO X Y,WANG S N,GONG P,MA Y M,CHEN F X. Structure and function of blueberry anthocyanins:A review of recent advances[J]. Journal of Functional Foods,2022,88:104864.
[2] 陈亚军,董克锋.设施蓝莓灰霉病发生调查及绿色防控[J].果农之友,2023(2):72-74.CHEN Yajun,DONG Kefeng. Investigation and green prevention and control of blueberry botrytis in facilities[J].Fruit Growers’Friend,2023(2):72-74.
[3] 孔珊珊,王芳,朱绍志,李文清,李贤忠,邓佳.羧甲基壳聚糖处理对采后蓝莓抗灰霉病的影响[J].北方园艺,2020(2):15-22.KONG Shanshan,WANG Fang,ZHU Shaozhi,LI Wenqing,LI Xianzhong,DENG Jia. Effect of carboxymethyl chitosan treatment on postharvest blueberry resistance to gray mold[J].Northern Horticulture,2020(2):15-22.
[4] 颜倩,侯瑞,李思,罗其鑫,李金子月.1 株蓝莓灰霉病病原菌的分离鉴定及杀菌剂室内毒力测定[J].江苏农业科学,2024,52(3):153-159.YAN Qian,HOU Rui,LI Si,LUO Qixin,LI Jinziyue. Isolation and Identification of a cinelia botrytis pathogen of blueberry and determination of fungicide virulence in the laboratory[J]. Jiangsu Agricultural Sciences,2024,52(3):153-159.
[5] 王帆帆,毛婷,唐涛,段媛媛,郭晓亮,游景茂.湖北贝母灰霉病病原菌鉴定及防治药剂筛选[J]. 北方园艺,2023(17):102-109.WANG Fanfan,MAO Ting,TANG Tao,DUAN Yuanyuan,GUO Xiaoliang,YOU Jingmao. Identification and screening fungicide of the pathogen of gray mold on Fritillaria hupehensis Hsiao[J].Northern Horticulture,2023(17):102-109.
[6] 张苗苗,张雨晨,杨怡中,范盈盈,何伟忠,王成,黄伟,刘峰娟. 拮抗菌防治葡萄采后病害研究进展[J]. 食品工业科技,2024,45(9):410-418.ZHANG Miaomiao,ZHANG Yuchen,YANG Yizhong,FAN Yingying,HE Weizhong,WANG Cheng,HUANG Wei,LIU Fengjuan. Research progress on antagonistic antimicrobial prevention and control of grape postharvest diseases[J]. Science and Technology of Food Industry,2024,45(9):410-418.
[7] 戴启东,李广旭,杨华,张广仁,周朝辉.6 种杀菌剂对蓝莓采后灰葡萄孢菌的室内毒力测定[J].辽宁农业科学,2019(4):19-22.DAI Qidong,LI Guangxu,YANG Hua,ZHANG Guangren,ZHOU Chaohui.Toxicity assay of the six fungicides on Botrytis cinerea from post-harvest blueberry fruits[J]. Liaoning Agricultural Sciences,2019(4):19-22.
[8] NEUGEBAUER K A,MATTUPALLI C,HU M J,OLIVER J E,VANDERWEIDE J,LU Y Z,SULLIVAN K,STOCKWELL V O,OUDEMANS P,MILES T D. Managing fruit rot diseases of Vaccinium corymbosum[J].Frontiers in Plant Science,2024,15:1428769.
[9] HOU J,FENG H Q,CHANG H W,LIU Y,LI G H,YANG S,SUN C H,ZHANG M Z,YUAN Y,SUN J,ZHU-SALZMAN K,ZHANG H,QIN Q M. The H3K4 demethylase Jar1 orchestrates ROS production and expression of pathogenesis-related genes to facilitate Botrytis cinerea virulence[J]. New Phytologist,2020,225(2):930-947.
[10] 王方方,付清泉,史学伟,王斌.灰霉病致病机理及其防治措施研究进展[J].中国果菜,2024,44(1):47-53.WANG Fangfang,FU Qingquan,SHI Xuewei,WANG Bin. Research progress on the pathogenesis and control measures of grey mould[J].China Fruit&Vegetable,2024,44(1):47-53.
[11] 李博雅,鲁姸璇,谢家贝,施李鸣,张克诚,葛蓓孛,冉隆贤.武夷菌素防治葡萄灰霉病的作用及机理[J].中国生物防治学报,2023,39(3):676-683.LI Boya,LU Yanxuan,XIE Jiabei,SHI Liming,ZHANG Kecheng,GE Beibei,RAN Longxian. Suppression and mechanism of Wuyiencin on grape gray mold[J].Chinese Journal of Biological Control,2023,39(3):676-683.
[12] SAITO S,MICHAILIDES T J,XIAO C L. Fungicide resistance profiling in Botrytis cinerea populations from blueberry in California and Washington and their impact on control of gray mold[J].Plant Disease,2016,100(10):2087-2093.
[13] 雷玲,郑蔚然,徐明飞,于国光,王强.国内外蓝莓农药最大残留限量比对分析[J].浙江农业科学,2023,64(2):435-440.LEI Ling,ZHENG Weiran,XU Mingfei,YU Guoguang,WANG Qiang.Comparative analysis of maximum residue limits of pesticides in blueberry in home and abroad[J]. Journal of Zhejiang Agricultural Sciences,2023,64(2):435-440.
[14] 金欢淳,张培安,张涛,金联宇,董天宇,胡丹,房经贵.不同浓度茉莉酸甲酯对妮娜皇后果实着色与品质形成的影响[J].浙江农业科学,2023,64(9):2165-2172.JIN Huanchun,ZHANG Pei’an,ZHANG Tao,JIN Lianyu,DONG Tianyu,HU Dan,FANG Jinggui.Effect of different concentrations of methyl jasmonate on the coloring and quality formation of Queen Nina fruit[J]. Journal of Zhejiang Agricultural Sciences,2023,64(9):2165-2172.
[15] HU Y L,ZHI L L,LI P,HANCOCK J T,HU X Y. The role of salicylic acid signal in plant growth,development and abiotic stress[J]. Phyton-International Journal of Experimental Botany,2022,91(12),2591-2605.
[16] BOSE S K,HOWLADER P,WANG W X,YIN H.Oligosaccharide is a promising natural preservative for improving postharvest preservation of fruit:A review[J]. Food Chemistry,2021,341:128178.
[17] VALENZUELA-RIFFO F,ZÚÑIGA P E,MORALES-QUINTANA L,LOLAS M,CÁCERES M,FIGUEROA C R. Priming of defense systems and upregulation of MYC2 and JAZ1 genes after Botrytis cinerea inoculation in methyl jasmonate- treated strawberry fruits[J].Plants,2020,9(4):447.
[18] RETAMAL-SALGADO J,ADAOS G,CEDEÑO-GARCÍA G,OSPINO-OLIVELLAS C,VERGARA-RETAMALES R,LOPÉZ M D,OLIVARES R,HIRZEL J,OLIVARES-SOTO H,BETANCUR M.Preharvest applications of oxalic acid and salicylic acid increase fruit firmness and polyphenolic content in blueberry(Vaccinium corymbosum L.)[J].Horticulturae,2023,9(6):639.
[19] 赵亚婷,刘豆豆,朱璇,侯媛媛.采前壳寡糖处理对杏果实黑斑病的抗性诱导[J].西北植物学报,2015,35(7):1409-1414.ZHAO Yating,LIU Doudou,ZHU Xuan,HOU Yuanyuan.Resistance induction of preharvest chitosan oligosaccharide treatment to black spot in apricots fruits[J]. Acta Botanica Boreali-Occidentalia Sinica,2015,35(7):1409-1414.
[20] 李怡洁,杨佐忠.枯草芽孢杆菌主要作用机制与应用研究进展[J].四川林业科技,2019,40(4):126-130.LI Yijie,YANG Zuozhong.Advances in researches on main action mechanism and application of Bacillus subtilis[J].Journal of Sichuan Forestry Science and Technology,2019,40(4):126-130.
[21] WANG X J,XIE S Y,MU X Y,GUAN B,HU Y Z,NI Y Q.Investigating the resistance responses to Alternaria brassicicola in‘Korla’fragrant pear fruit induced by a biocontrol strain Bacillus subtilis Y2[J]. Postharvest Biology and Technology,2023,199:112293.
[22] 张琦,刘应敏,杨东燕,朱晓琴,裴冬丽,张庆琛.贝莱斯芽孢杆菌SM2 对番茄灰霉病的生防效果[J].中国瓜菜,2024,37(2):66-73.ZHANG Qi,LIU Yingmin,YANG Dongyan,ZHU Xiaoqin,PEI Dongli,ZHANG Qingchen. Biological control effects of Bacillus velezensis SM2 against Botrytis cinerea causing tomato gray mold[J].China Cucurbits and Vegetables,2024,37(2):66-73.
[23] 李杰,张寒冰,课净璇,刘磊,张帅雅.花椒黄酮提取液-壳聚糖复合保鲜涂膜剂制备及其对圣女果保鲜效果评价[J].中国食品添加剂,2024,35(10):11-19.LI Jie,ZHANG Hanbing,KE Jingxuan,LIU Lei,ZHANG Shuaiya. Preparation of Zanthoxylum bungeanum flavonoids extracting solution-chitosan composite fresh-keeping coating and evaluation of its preservation effect on cherry tomatoes[J]. China Food Additives,2024,35(10):11-19.
[24] 任鹏飞,曲梦锐,王东营.壳聚糖-黄精精油复合涂膜对蓝莓果实的保鲜功效[J].北方园艺,2024(24):69-74.REN Pengfei,QU Mengrui,WANG Dongying. Preservation effect of chitosan-Polygonatum essential oil compound coating on blueberry fruit[J].Northern Horticulture,2024(24):69-74.
[25] 罗自生,姜柔王,李贞彪,肖韵,龚晓惠,侯东园,黄静,陈彦培,林星宇,徐艳群.1-MCP 缓释水凝胶对采后草莓果实品质和抗病性的影响[J].食品工业科技,2024,45(2):316-323.LUO Zisheng,JIANG Rouwang,LI Zhenbiao,XIAO Yun,GONG Xiaohui,HOU Dongyuan,HUANG Jing,CHEN Yanpei,LIN Xingyu,XU Yanqun.A hydrogel with sustained release of 1-MCP affects the fruit quality and disease resistance of postharvest strawberry[J]. Science and Technology of Food Industry,2024,45(2):316-323.
[26] 曹梦园,乔成奎,韩丽君,谢汉忠,陈如霞,李晓光.壳聚糖对果蔬的抗菌保鲜效果及其应用研究进展[J].食品安全质量检测学报,2024,15(9):93-102.CAO Mengyuan,QIAO Chengkui,HAN Lijun,XIE Hanzhong,CHEN Ruxia,LI Xiaoguang.Research progress on the preservation and antibacterial effect of chitosan on fruits and vegetables and its application[J]. Journal of Food Safety & Quality,2024,15(9):93-102.
[27] SONG J S,YOO S K,KIM D S.The effect of 1-(3-phenyl-propyl) cyclopropene versus 1-MCP on the quality and storage life of tomato (Solanum lycopersicum) fruit[J]. Postharvest Biology and Technology,2018,145:20-26.
[28] WANG S Y,SHI X C,LIU F Q,LABORDA P.Effects of exogenous methyl jasmonate on quality and preservation of postharvest fruits:A review[J].Food Chemistry,2021,353:129482.
[29] GAČNIK S,VEBERIČ R,HUDINA M,KORON D,MIKULIČPETKOVŠEK M. Salicylate treatment affects fruit quality and also alters the composition of metabolites in strawberries[J].Horticulturae,2021,7(10):400.
[30] ZHENG J R,CHEN H,WANG T L,MUSTAFA G,LIU L H,WANG Q M,SHAO Z Y. Quality improvement of tomato fruits by preharvest application of chitosan oligosaccharide[J]. Horticulturae,2023,9(3):300.
[31] 黄一峰,王斯瑶,阮鹏展,赵重阳,李一峰.外源水杨酸处理对采后蓝莓果实软化的调控作用[J].保鲜与加工,2024,24(7):22-27.HUANG Yifeng,WANG Siyao,RUAN Pengzhan,ZHAO Chongyang,LI Yifeng. Regulation effect of exogenous salicylic acid treatment on the softening of postharvest blueberry fruit[J].Storage and Process,2024,24(7):22-27.
[32] YıLMAZ M. Enhancing cold storage quality of blueberry (Vaccinium corymbosum‘Bluecrop’) with methyl jasmonate treatments[J].Applied Fruit Science,2024,66(1):81-88.
[33] CÁCERES C,CAZOR- CURILEF C,DELGADO- SANTIBAÑEZ P,MACHADO M,DELGADO M,RIBERA-FONSECA A,INOSTROZA- BLANCHETEAU C,BRAVO L A,GONZÁLEZ-VILLAGRA J,NUNES-NESI A,REYES-DÍAZ M. Foliar methyl jasmonate application activates antioxidant mechanisms to counteract water deficits and aluminum stress in Vaccinium corymbosum L.[J].Horticulturae,2024,10(11):1172.
[34] 李树成,王印宝,赵显阳,吴帆,肖刘华,陈明,陈金印,向妙莲.翠冠梨果实采后病原菌分离鉴定及室内毒力测定[J].中国南方果树,2021,50(6):116-120.LI Shucheng,WANG Yinbao,ZHAO Xianyang,WU Fan,XIAO Liuhua,CHEN Ming,CHEN Jinyin,XIANG Miaolian.Isolation and identification of postharvest pathogens in Cuiguan pear fruit and determination of virulence in laboratory[J]. South China Fruits,2021,50(6):116-120.
[35] YANG J F,SHI W J,LI B B,BAI Y C,HOU Z X.Preharvest and postharvest UV radiation affected flavonoid metabolism and antioxidant capacity differently in developing blueberries (Vaccinium corymbosum L.)[J].Food Chemistry,2019,301:125248.
[36] DHINDSA R S,PLUMB-DHINDSA P,THORPE T A. Leaf senescence:Correlated with increased levels of membrane permeability and lipid peroxidation,and decreased levels of superoxide dismutase and catalase[J]. Journal of Experimental Botany,1981,32(1):93-101.
[37] JIANG T J,JAHANGIR M M,JIANG Z H,LU X Y,YING T J.Influence of UV-C treatment on antioxidant capacity,antioxidant enzyme activity and texture of postharvest shiitake (Lentinus edodes) mushrooms during storage[J]. Postharvest Biology and Technology,2010,56(3):209-215.
[38] KAZAZIC M,MEHIC E,DJAPO-LAVIC M. Phenolic content and bioactivity of two sour cherry cultivars and their products[J].Bulletin of the Chemists and Technologists of Bosnia and Herzegovina,2022(58):1-6.
[39] PRADA-MUÑOZ J,COY-BARRERA E. Targeted anthocyanin profiling of fruits from three southern highbush blueberry cultivars propagated in Colombia[J].Molecules,2024,29(3):691.
[40] EL-HAWARY S S,ELWEKEEL A,ABO EL-ELA S O,ABDELMOHSEN U R,OWIS A I.Metabolic profiling and biological activity of two Livistona species:L. chinensis and L. australis[J].RSC Advances,2023,13(22):14855-14862.
[41] 张志良,瞿伟菁,李小方.植物生理学实验指导[M].4 版.北京:高等教育出版社,2009:106-108.ZHANG Zhiliang,QU Weijing,LI Xiaofang. Plant physiology experimental guidance[M]. 4th ed. Beijing:Higher Education Press,2009:106-108.
[42] 杨菁华,高举,李文芳,刘骥,霍嘉兴,任振硕,李龙,陈佰鸿,毛娟,马宗桓.苹果PDHB-1 基因家族的鉴定与表达分析[J].生物工程学报,2023,39(12):4965-4981.YANG Jinghua,GAO Ju,LI Wenfang,LIU Ji,HUO Jiaxing,REN Zhenshuo,LI Long,CHEN Baihong,MAO Juan,MA Zonghuan. Identification and expression analysis of apple PDHB-1 gene family[J].Chinese Journal of Biotechnology,2023,39(12):4965-4981.
[43] 刘太昭,梁平,李威.黔东南州蓝莓灰霉病发生情况及绿色防控技术[J].农技服务,2023,40(6):98-100.LIU Taizhao,LIANG Ping,LI Wei. Occurrence of blueberry gray mold in Qiandongnan Miao and Dong Autonomous Prefecture and green prevention and control technology[J].Agricultural Technology Service,2023,40(6):98-100.
[44] ORTEGA MARTÍNEZ L D,OCAMPO MENDOZA J,OLVERA SALINAS J,ZARATE RIVAS F,ROJAS REYES F,SALAZAR MAGALLÓN J,PÉREZ ARMENDÁRIZ B. Inducers of resistance to Botrytis cinerea in postharvest strawberry fruits[J].Revista Bio Ciencias,2017,4(5):1-12.
[45] 张智慧,聂燕芳,何磊,李云锋,王振中.外源水杨酸诱导水稻相关防御酶活性及内源水杨酸含量的变化[J].华中农业大学学报,2010,29(5):541-545.ZHANG Zhihui,NIE Yanfang,HE Lei,LI Yunfeng,WANG Zhenzhong. Changes of resistance-related defense enzymes activities and endogenous salicylic acid in rice induced by exogenous salicylic acid[J].Journal of Huazhong Agricultural University,2010,29(5):541-545.
[46] 付瑞敏,夏铁骑,杨雪,刘春雷,王丁,陈五岭.壳聚糖复合水杨酸对砂糖橘采后绿霉病的生物防治效果研究[J].食品科技,2022,47(4):54-62.FU Ruimin,XIA Tieqi,YANG Xue,LIU Chunlei,WANG Ding,CHEN Wuling. Biological control effect of chitosan combined with salicylic acid on postharvest green mold in Citrus reticulate Blanco[J].Food Science and Technology,2022,47(4):54-62.
[47] YU W Q,ZHAO R R,SHENG J P,SHEN L.SlERF2 is associated with methyl jasmonate-mediated defense response against Botrytis cinerea in tomato fruit[J]. Journal of Agricultural and Food Chemistry,2018,66(38):9923-9932.
[48] TAIBI O,FEDELE G,ROSSI V. Pre-infection efficacy of resistance inducers against grapevine powdery mildew[J]. Plant Pathology,2024,73(5):1238-1246.
[49] KILANI- FEKI O,BEN KHEDHER S,DAMMAK M,KAMOUN A,JABNOUN-KHIAREDDINE H,DAAMI-REMADI M,TOUNSI S. Improvement of antifungal metabolites production by Bacillus subtilis V26 for biocontrol of tomato postharvest disease[J].Biological Control,2016,95:73-82.
[50] PIERMANN L,FUJINAWA M F,DE CARVALHO PONTES N,GALVÃO J A H,BETTIOL W. Inhibition of mycelial growth,conidial germination,and Botrytis cinerea Pers.:Fr colonization in begonia with biocompatible products[J].Scientia Agricola,2023,80:e20210062.
[51] LI J Z,MIN D D,LI Z L,FU X D,ZHAO X M,WANG J H,ZHANG X H,LI F J,LI X A,GUO Y Y. Regulation of sugar metabolism by methyl jasmonate to improve the postharvest quality of tomato fruit[J]. Journal of Plant Growth Regulation,2022,41(4):1615-1626.
[52] KAYA C,UGURLAR F,ASHRAF M,AHMAD P. Salicylic acid interacts with other plant growth regulators and signal molecules in response to stressful environments in plants[J]. Plant Physiology and Biochemistry,2023,196:431-443.
[53] TALAAT N B,NESIEM M R A,GADALLA E G,ALI S F.Gibberellic acid and salicylic acid dual application improves date palm fruit growth by regulating the nutrient acquisition,amino acid profile,and phytohormone performance[J]. Journal of Soil Science and Plant Nutrition,2023,23(4):6216-6231.
[54] WANG X,LIANG D,XIE Y,LÜ X L,WANG J,XIA H. Melatonin application increases accumulation of phenol substances in kiwifruit during storage[J]. Emirates Journal of Food and Agriculture,2019:361.
[55] ZUITER A S. Proanthocyanidin:Chemistry and biology:From phenolic compounds to proanthocyanidins[M]//Reference Module in Chemistry,Molecular Sciences and Chemical Engineering.Amsterdam:Elsevier,2014.
[56] 邹雪梅,卜庆状,张馨予,詹德江,陈芳,王建忠.蓝莓果实品质分析与评价研究进展[J].辽宁农业科学,2023(5):66-71.ZOU Xuemei,BU Qingzhuang,ZHANG Xinyu,ZHAN Dejiang,CHEN Fang,WANG Jianzhong. Research progress on quality analysis and evaluation of blueberry fruit[J]. Liaoning Agricultural Sciences,2023(5):66-71.
[57] WANG S P,ZHOU Y H,LUO W,DENG L L,YAO S X,ZENG K F.Primary metabolites analysis of induced citrus fruit disease resistance upon treatment with oligochitosan,salicylic acid and Pichia membranaefaciens[J].Biological Control,2020,148:104289.