葡萄绿枝嫁接是在葡萄新梢处于半木质化时进行嫁接的方法,是目前葡萄苗木生产中常用的繁殖方式之一[1]。抗性砧木嫁接苗可以增强葡萄植株适应环境的能力,提高葡萄栽培的经济效益[2]。嫁接愈合是嫁接苗生产的关键环节。在组织学水平上,愈合过程需要经历4个阶段:(1)在切口处发生组织粘连;(2)在切面上形成愈伤组织;(3)愈伤组织细胞快速分裂并分化;(4)维管组织重建[3]。Melnyk 等[4]研究认为,愈合过程中韧皮部连接和木质部连接是暂时分离的,拟南芥在嫁接后1 d发生组织粘连,韧皮部重连发生在嫁接后3~4 d,木质部重连发生在嫁接后6~7 d,完成愈合过程需要8~10 d。Duan等[5]研究发现,温室番茄嫁接苗在嫁接后2 d 发生组织粘连,但在连接处仍有间隙,嫁接后3 d细胞不断分裂填补间隙,嫁接后4~5 d 维管束不断分化并重新连接,嫁接后7 d 木质部和韧皮部基本完成重连。Xu等[6]研究发现,同源嫁接西瓜幼苗的韧皮部和木质部重连不能及时分离,在嫁接后12~13 d 完成维管组织的重连。Cookson 等[7]通过对葡萄越冬枝条进行机械嫁接,分析嫁接后3 d和28 d的砧木和嫁接接口的转录组,发现随着时间的推移,与细胞壁合成、韧皮部和木质部发育相关的基因上调表达。
植物内源激素在嫁接愈合过程中起着至关重要的作用。生长素(auxin,IAA)是影响嫁接的关键激素,对细胞分裂和维管组织的生长发育具有调控作用。生长素介导的信号转导途径需要生长素受体ABP1(auxin-binding protein 1)和TIR1(transport inhibitor response protein 1)、生长素早期响应基因Aux/IAA(auxin/indole-3-acetic acid)、GH3(gretchen hagen 3)和SAUR(small auxin-up RNA)、生长素响应因子ARF(auxin response factor)等共同协作[8-9]。有研究发现,应用少量生长素可促进韧皮部分化,而大量生长素则可以诱导韧皮部和木质部形成[10]。植物体内具有活性的细胞分裂素(cytokinin,CTK)以异戊烯基腺嘌呤(isopentenyladenine,IP)、反式玉米素(trans-zeatin,tZ)、二氢玉米素(dihydrozeatin,DZ)形式存在。Kawaguchi 等[11]分别研究接穗和砧木切口部位植物激素的变化,结果表明IP型细胞分裂素的浓度最高,且远高于DZ 型。对温室番茄嫁接苗的研究发现IP 可能与维管束重构有关[5]。脱落酸(abscisic acid,ABA)不仅在响应生物和非生物胁迫中发挥重要作用,还在植物发育过程中发挥作用[12]。脱落酸信号转导的核心成分由脱落酸受体PYR/PYL(pyrabactin resistance/PYR1-like)、蛋白磷酸酶PP2C(protein phosphatase 2C)、蔗糖非酵解型蛋白激酶SnRK2(sucrose non-fermenting 1-related protein kinase 2)以及脱落酸响应元件结合因子ABF(ABA responsive element binding factor)组成[13]。Ikeuchi等[14]对拟南芥愈伤组织的形成进行植物激素定量分析,发现脱落酸会抑制愈伤组织细胞的增殖。茉莉酸(jasmonic acid,JA)及其衍生物茉莉酸-异亮氨酸(jasmonic acid-isoleucine,JA-Ile)、茉莉酸甲酯(methyl jasmonate,MeJA)与抗性相关,在逆境(包括创伤)应答过程中激活,也参与植物生长发育调节[15]。茉莉酸类激素主要参与切割后的创伤应激响应[16]。茉莉酸缺乏突变体aos、茉莉酸不敏感突变体coil 以及外源茉莉酸处理的拟南芥中,维管组织细胞的增殖方式相似,表明在愈合过程中茉莉酸不是细胞增殖过程所必需的[17]。
目前葡萄绿枝嫁接愈合过程所涉及的激素相关调控机制的研究较少,理解其调控机制是科学选择接穗和砧木的基础。笔者在本研究中以天工丽人/贝达、天工墨玉/贝达和阳光玫瑰/贝达砧穗组合的嫁接接口为材料,分别在嫁接后1、4、7、10和13 d采集样品并进行激素含量的测定,同时对天工丽人/贝达的嫁接接口进行转录组测序,旨在揭示葡萄绿枝嫁接愈合过程中植物激素及相关基因的变化,为葡萄绿枝嫁接愈合的生物学机制研究奠定基础,同时为揭示葡萄嫁接愈合的分子机制提供参考。
1 材料和方法
1.1 植物材料
2023 年6 月26 日在北京大兴喜山葡萄合作社(39°38′46″S,116°41′43″E)进行葡萄绿枝嫁接。苗圃为露天苗圃,南北行向,平垄种植,垄长15 m,相邻两垄之间的距离60 cm。以当年贝达(Vitis riparia×V.labrusca)硬枝扦插苗为砧木,以天工丽人(V.labrusca×V.vinifera)、天工墨玉(V.labrusca×V.vinifera)和阳光玫瑰(V.labrusca×V.vinifera)为接穗进行绿枝嫁接。嫁接方法为劈接,嫁接操作由熟练技术工人完成。嫁接完成后当天漫灌至土壤完全湿润,嫁接后5~7 d(days after grafting,DAG)补水并施肥,10 DAG开始正常育苗管理。
分别在嫁接后1、4、7、10和13 d采集样品,每个时间点随机选取5个样品作为1次重复,每个砧穗组合3次重复。从嫁接后1 d(6月27日)开始观察接穗芽的形态学变化。用修枝剪采集嫁接接口(长2.5~3.0 cm)(图1),液氮速冻后转移至-80 ℃冰箱保存,用于激素测定及RNA提取。

图1 嫁接接口
Fig.1 The photo of a graft union
1.2 不同砧穗组合嫁接接口激素含量测定
嫁接接口激素含量的测定参照Yao等[18]的方法并略作修改,将样品用球磨仪研磨成粉,每个重复准确称量0.5 g 植物粉末,装入5 mL 离心管,加入2.5 mL 冰冷的50%乙腈水溶液和10 μL 0.1 μg·mL-1内标。冰浴避光超声15 min,4 ℃、10 000 r·min-1离心5 min,收集上清液至10 mL 离心管,残渣重复提取1次,合并上清液。
将收集到的上清液(约5 mL)经Fotector Plus高通量全自动固相萃取仪(Fotector-08HT,睿科集团股份有限公司,厦门,中国)富集到HLB固相萃取小柱(0.05 mL·mg-1,天津博纳艾杰尔科技公司)中,用3 mL洗脱液(含有2.5%甲醇和0.5%甲酸的二氯甲烷)手动洗脱。收集的洗脱液用氮气吹干,用200 μL甲醇复溶,混匀,然后用0.22 μm 有机尼龙过滤膜过滤,用高效液相色谱-三重四级杆串联质谱仪(1290-6470,Agilent,USA)测定激素含量。
参考Yao等[18]植物激素的质谱参数进行定性分析,采用外标法进行定量分析。计算植物激素含量C1=CV/M 。其中C 为代入标线测得的检测质量浓度(ng·mL-1);V 为上机检测样品的体积(mL);M 为样品取样质量(g)。
1.3 天工丽人/贝达嫁接接口RNA 提取和转录组测序
按照植物总RNA 提取试剂盒(DP441,天根生化科技有限公司,北京,中国)说明书提取天工丽人/贝达嫁接接口总RNA,并送至百迈客生物科技有限公司(北京)进行转录组测序。使用NanoDrop 2000分光光度计(Thermo Scientific,美国)和Agient2100/LabChip GX(PerkinElmer,美国)检测RNA 纯度、浓度以及完整性。样品检测合格后,构建cDNA 文库并进行质量检测,合格后使用Illumina NovaSeq6000测序平台进行PE150模式测序。对测序得到的原始数据(Raw Data)进行过滤,将获得的高质量序列(Clean Data)与参考基因组(PN40024.v4.57)进行序列比对。利用StringTie进行组装,重构转录组用于后续分析。采用每千个碱基的转录每百万映射读取的片段(fragments per kilobase of transcript per million fragments mapped,FPKM)作为衡量基因表达水平的指标。
1.4 差异表达基因的筛选和分析
不同样本中表达水平存在显著差异的基因称为差异表达基因(differentially expressed gene,DEG)。使用DESeq2 软件进行差异分析,以FPKM>1、|log2Fold Change|≥1、FDR<0.01 为标准,对嫁接后1、4、7、10和13 d这5个时期的样品进行两两比较,筛选差异表达基因。利用百迈克云平台BMKCloud(https://www.biocloud.net)对筛选得到的差异表达基因进行基因功能注释和功能富集。重点关注参与植物激素合成和代谢、植物激素信号转导途径上的差异表达基因。
1.5 共表达网络构建与分析
使用TBtools WGCNA shiny 插件,对天工丽人/贝达嫁接后1、4、7、10 和13 d 的转录组数据进行基因共表达网络分析(weighted gene co-expression network analysis,WGCNA)。过滤掉90%以上FPKM<10 的基因,过滤后的基因根据表达量进行层次聚类,未发现离群样本。以无尺度拓扑拟合指数R2≥0.83,最优软阈值power=28,构建更符合无尺度拓扑结构的网络。采用动态剪切树法构建基因聚类树,最小模块数为30,相似模块合并参数为0.25。绘制基因共表达模块与天工丽人/贝达植物激素含量的相关性热图。以皮尔逊相关系数(|r|≥0.8)和显著性p 值(p<0.05)的大小为筛选条件,寻找关键基因模块,并进一步筛选葡萄绿枝嫁接愈合过程中与内源激素相关的关键基因。
1.6 qRT-PCR验证
对8 个关键基因进行实时荧光定量(qRTPCR)。使用HiScript ⅡQ Select RT SuperMix for qPCR(+gDNA wiper)试剂盒(R233,南京诺唯赞生物科技股份有限公司,中国)将RNA 反转录为cDNA,具体步骤参照说明书。利用NCBI官网的Primer-BLAST 工具(https://www.ncbi.nlm.nih.gov/tools/primer-blast/index.cgi?LINK_LOC=BlastHome)设计特异性引物,以VviUBQ为内参基因,引物具体信息见表1。使用ChamQ Universal SYBR qPCR Master Mix试剂盒(Q711,南京诺唯赞生物科技股份有限公司,中国)在CFX384 Touch 实时荧光定量PCR 仪(Bio-Rad,美国)上进行qRT-PCR,反应体系和程序参照试剂盒说明书。设置3 次生物学与3 次技术重复,根据2-ΔΔCt方法计算基因相对表达量。
表1 qRT-PCR 引物序列
Table 1 qRT-PCR primer sequences

基因名称Gene name GH3 LOX AOS OPCL1 ABF TCH4 AHA TIR1 VviUBQ正向引物(5'-3')Forward primers(5'-3')TTCTGAATTCCTCACCAGCTCT CAGAGGTTGACCCCAAGACG AAGCGAACTCGCAGCAAAAG CATAGCAAAACAGGTGGCTCC TTGAGCTAGAGTCGCTGGTG CCCCAGCGGATTATCTTCTCT CAGTCTGAATTGGTTGAGCCC CATGGCTATGGCTTACCCGA GTGGTATTATTGAGCCATCCTT反向引物(3'-5')Reverse primers(3'-5')CCTTTGTCCAACCCAGGCA TCTGAACAAGAACCGCACCA GGCCTAGAGTGAGGATGGGA CCAAATCCATGACGCCCAAG CAGGTTCTCCATCAACTGCTTAT GTAGGAGGCAGTGAAGGGTG CTCTCATTAGCAGCCTCCGT TCCAGCTCTCTCAGATTCCTGC AACCTCCAATCCAGTCATCTAC
1.7 数据处理与分析
Excel 2003 软件用于数据整理,SPSS 26.0 软件用于方差分析和邓肯检验(p<0.05),Origin 2018、R 4.4.1和Cytoscape 3.8.0软件用于数据分析并作图。
2 结果与分析
2.1 不同砧穗组合接穗芽物候期观测
图2为天工墨玉/贝达绿枝嫁接愈合过程中接穗芽的形态变化,根据接穗芽的形态变化,大致可以分为静止期、芽膨大期、萌芽期、叶片显现期和展叶期5 个时期。静止期芽的形态没有明显变化,然后是芽膨大期和萌芽期,之后是叶片显现期和展叶期,叶片完全展开意味着嫁接成活。
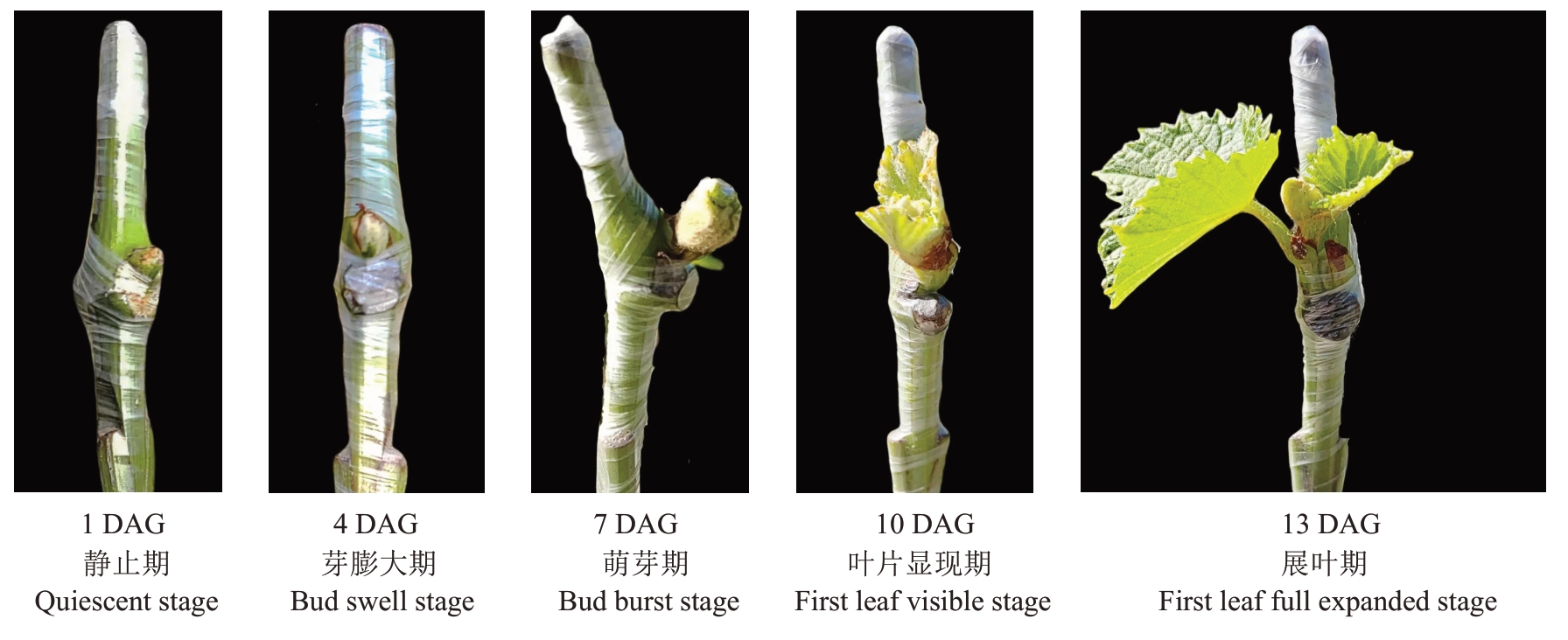
图2 天工墨玉/贝达接穗芽的形态变化
Fig.2 Morphological changes of scion bud in the graft combination of Tiangong Moyu/Beta
不同砧穗组合接穗芽物候期变化见表2。天工墨玉/贝达最先萌芽,在4 DAG 观察到芽膨大,而天工丽人/贝达和阳光玫瑰/贝达萌芽相对较晚,在7 DAG 观察到芽膨大。3 个砧穗组合在13 DAG 均至少有一枚叶的叶身完全展开。通常认为接穗芽的第一枚真叶完全展开,说明嫁接操作成功,接穗与砧木之间已经愈合,接穗开始从砧木吸收养分和水分。在13 DAG 统计不同砧穗组合的嫁接成活率,天工丽人/贝达为94.00%、天工墨玉/贝达为94.81%、阳光玫瑰/贝达为96.84%。
表2 不同砧穗组合接穗芽的发育日期
Table 2 Development dates of scion bud in the different rootstock-scion combinations

注:“-”表示介于两个采样时间点之间的某个时间。
Note:“-”represents a specific time between two sampling time points.
物候期Phenological period芽膨大期Bud swell stage萌芽期Bud burst stage叶片显现期First leaf visible stage展叶期First leaf full expanded stage阳光玫瑰/贝达Shine Muscat/Beta 7 DAG-10 DAG 13 DAG天工丽人/贝达Tiangong Liren/Beta 7 DAG-10 DAG 13 DAG天工墨玉/贝达Tiangong Moyu/Beta 4 DAG 7 DAG 10 DAG 13 DAG
2.2 不同砧穗组合嫁接接口内源激素含量的动态变化
比较天工丽人/贝达、天工墨玉/贝达和阳光玫瑰/贝达砧穗组合嫁接接口在嫁接后不同时间的激素含量变化。由图3-A~C 可知,IAA 含量在嫁接愈合过程中整体呈上升趋势。天工墨玉/贝达IAA 含量在10 DAG 达到最高值,而天工丽人/贝达和阳光玫瑰/贝达IAA含量在13 DAG达到最高值。天工丽人/贝达IAA含量在嫁接后第2周呈上升趋势,且13 DAG的IAA 含量显著高于7 DAG。与天工丽人/贝达不同,天工墨玉/贝达和阳光玫瑰/贝达的IAA 含量在嫁接后第1 周显著上升。图3-D~F 显示,不同砧穗组合嫁接接口的IP 含量随嫁接后时间的增加总体呈下降趋势。天工丽人/贝达IP 含量在嫁接后第1周下降13.26%,在嫁接后第2 周变化幅度极小。天工墨玉/贝达和阳光玫瑰/贝达IP含量在7~10 DAG下降幅度最大,分别下降了18.19%、25.23%。图3-G~I显示,ABA含量在愈合前期保持较高水平,愈合后期呈下降趋势。天工丽人/贝达ABA含量在1~4 DAG无明显变化,在4~7 DAG 显著下降,下降约37.55%。天工墨玉/贝达和阳光玫瑰/贝达ABA含量在嫁接后第1周无明显变化,嫁接后第2周下降幅度分别为25.32%、32.30%。
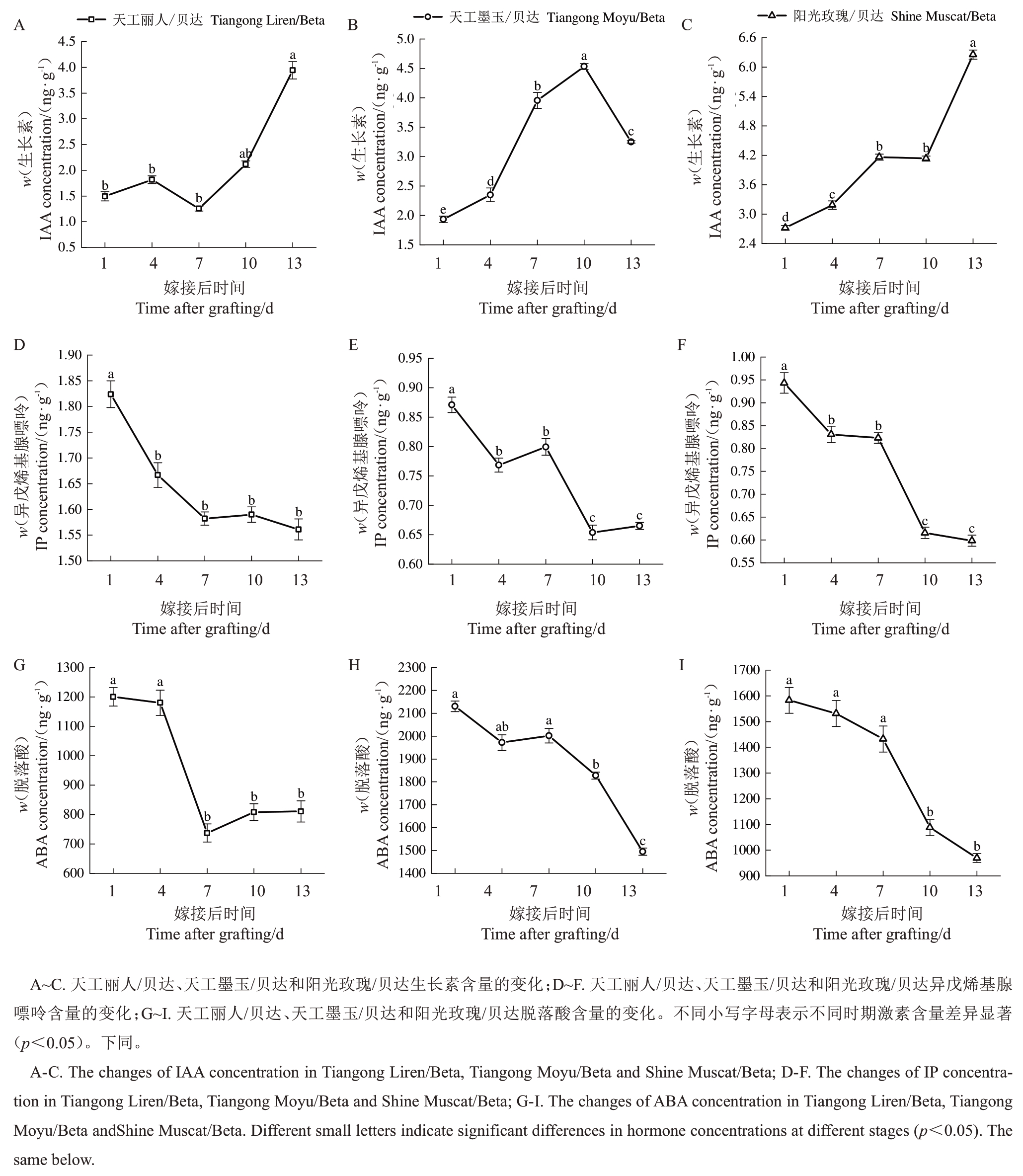
图3 嫁接后不同时间嫁接联合体生长素、脱落酸、异戊烯基腺嘌呤含量的变化
Fig.3 The changes of IAA,ABA,IP concentrations in the graft unions at different DAG
当植物受到生物或非生物胁迫时,会引起JAs含量增高。JA 及其衍生物JA-lle、MeJA 在1 DAG含量最高(图4),在愈合过程中整体呈下降趋势。图4-A~C表明,不同砧穗组合嫁接接口的JA含量在嫁接后第1 周显著下降,嫁接后第2 周基本不变。JA-lle是植物中JA的主要活性形式,由图4-D可知,天工丽人/贝达JA-Ile含量在1~4 DAG无明显变化,之后显著下降,在10 DAG 最低,之后显著上升。MeJA是JA的衍生物,由图4-G可知,天工丽人/贝达MeJA 含量无明显变化。在葡萄绿枝嫁接愈合过程中,天工墨玉/贝达和阳光玫瑰/贝达JA-lle、Me-JA含量变化趋势相似,在嫁接后第1周显著下降,嫁接后第2周变化幅度较小,呈先上升后下降的趋势(图4-E~F、H~I)。
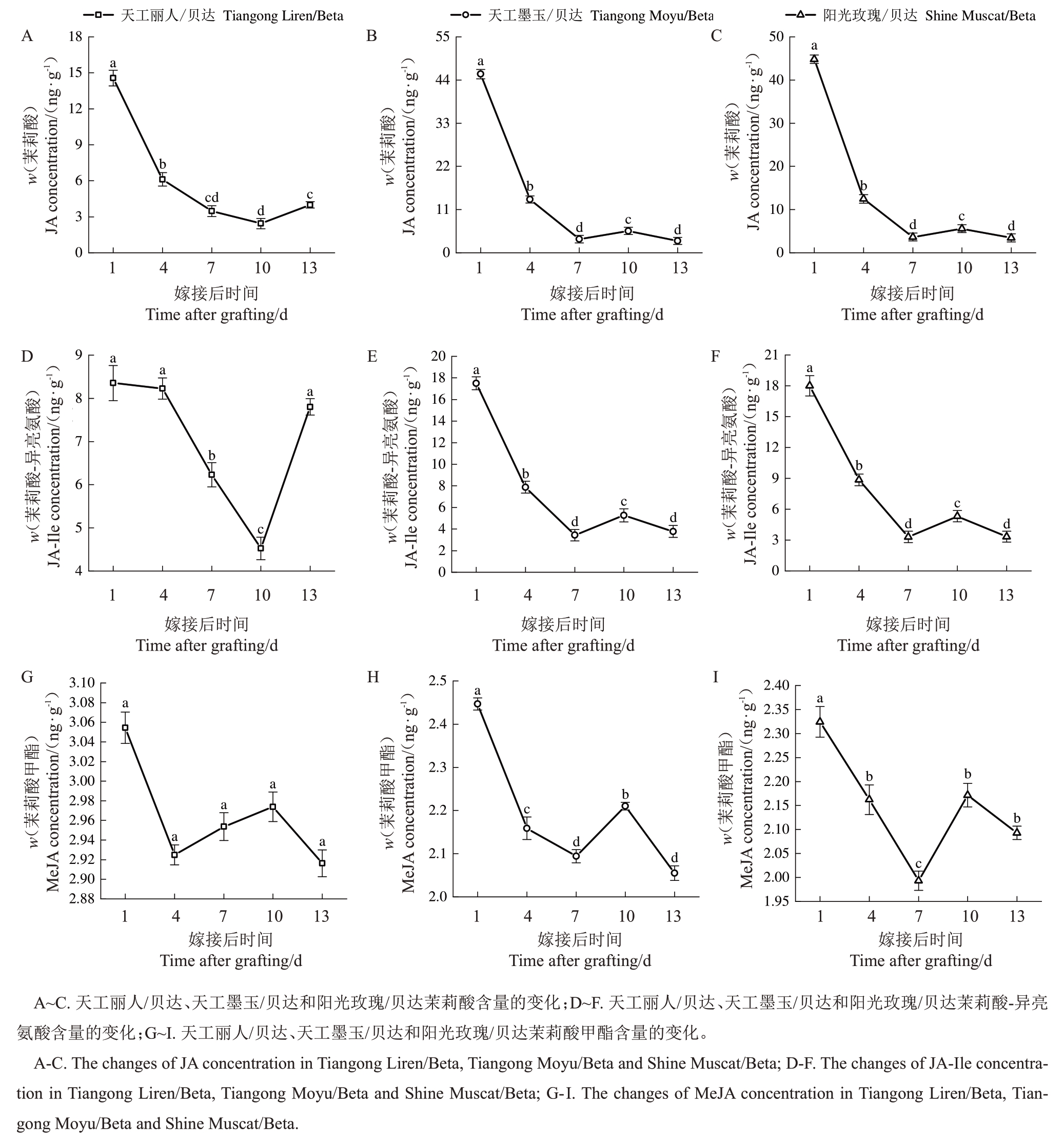
图4 嫁接后不同时间嫁接联合体茉莉酸、茉莉酸-异亮氨酸、茉莉酸甲酯含量的变化
Fig.4 The changes of JA,JA-Ile,MeJA concentrations in the graft unions at different DAG
2.3 转录组测序数据质量分析
对嫁接后1、4、7、10 和13 d 天工丽人/贝达的嫁接接口进行转录组测序,基于嫁接后不同天数命名样品(表3)。各样品Clean reads数在19.51~21.20 Mb,Q20 均在98%以上,Q30 不小于94.86%。各样品的Reads 与参考基因组的比对效率在90.33%~92.04%。转录组测序数据比对上参考基因组唯一位置的比例在87.28%~89.50%。说明转录组数据利用效率高、不存在污染,可用于后续数据分析。
表3 样品测序数据统计结果
Table 3 Statistical results of sample sequencing data
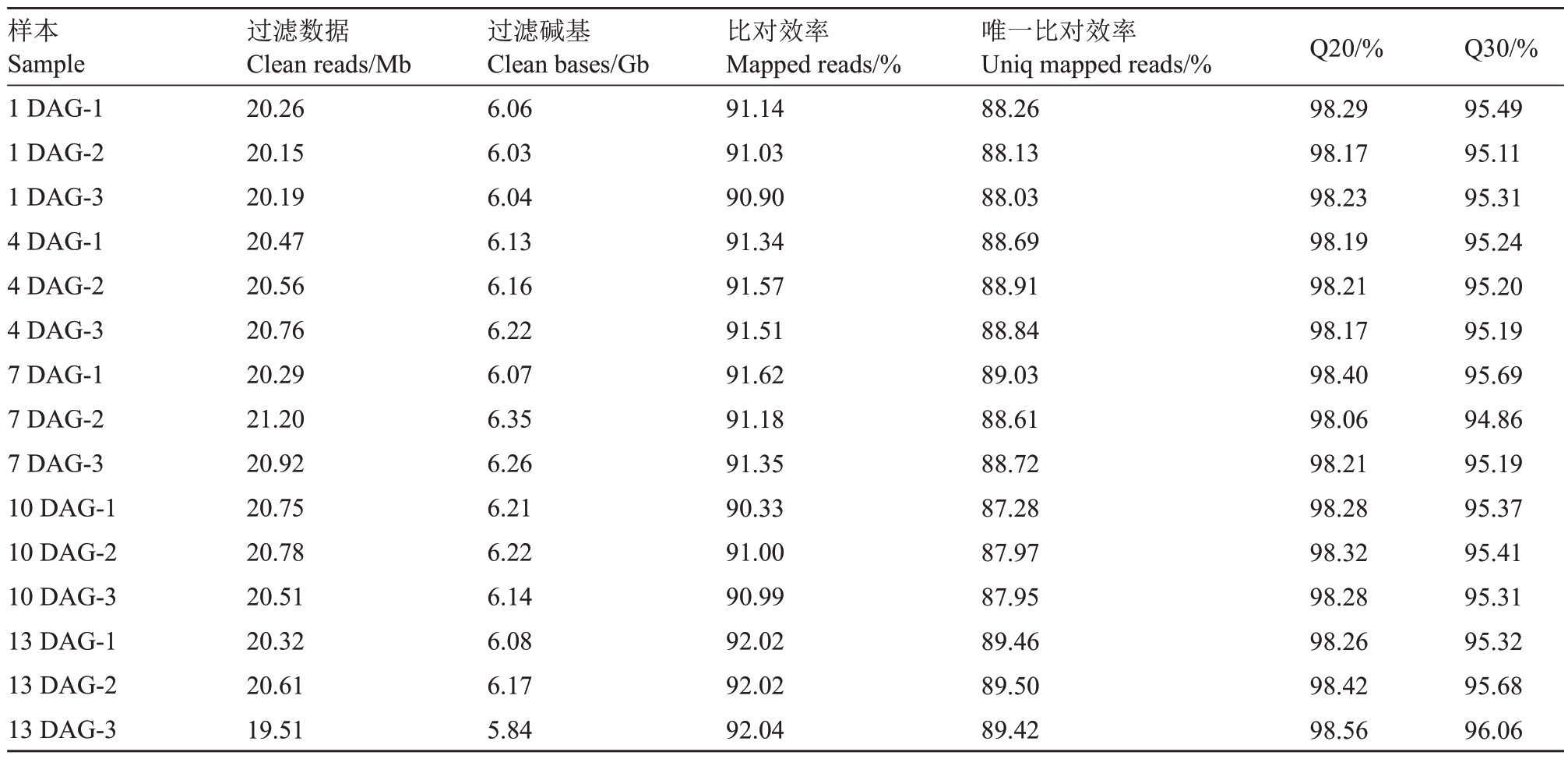
样本Sample 1 DAG-1 1 DAG-2 1 DAG-3 4 DAG-1 4 DAG-2 4 DAG-3 7 DAG-1 7 DAG-2 7 DAG-3 10 DAG-1 10 DAG-2 10 DAG-3 13 DAG-1 13 DAG-2 13 DAG-3过滤数据Clean reads/Mb 20.26 20.15 20.19 20.47 20.56 20.76 20.29 21.20 20.92 20.75 20.78 20.51 20.32 20.61 19.51过滤碱基Clean bases/Gb 6.06 6.03 6.04 6.13 6.16 6.22 6.07 6.35 6.26 6.21 6.22 6.14 6.08 6.17 5.84比对效率Mapped reads/%91.14 91.03 90.90 91.34 91.57 91.51 91.62 91.18 91.35 90.33 91.00 90.99 92.02 92.02 92.04唯一比对效率Uniq mapped reads/%88.26 88.13 88.03 88.69 88.91 88.84 89.03 88.61 88.72 87.28 87.97 87.95 89.46 89.50 89.42 Q20/%98.29 98.17 98.23 98.19 98.21 98.17 98.40 98.06 98.21 98.28 98.32 98.28 98.26 98.42 98.56 Q30/%95.49 95.11 95.31 95.24 95.20 95.19 95.69 94.86 95.19 95.37 95.41 95.31 95.32 95.68 96.06
为了检验样品选择的可靠性,计算样品转录组数据的皮尔逊相关系数(图5)。各个时期的3 个生物学重复之间的相关性均大于0.99,呈显著正相关,表明重复样品间相似度高,重复性好,可以进行下一步分析。

图5 样品相关性分析
Fig.5 Correlation analysis of samples
2.4 差异表达基因筛选
对天工丽人/贝达不同时期嫁接接口的转录本表达水平进行差异显著性分析,得到10个比较组的差异表达基因结果(图6),筛选到6319 个差异表达基因。首先是1 DAG vs 13 DAG差异表达基因数量最多,有3846个,其中1724个基因显著上调,2122个基因显著下调;其次是1 DAG vs 10 DAG,有3301个,其中1439 个基因显著上调,1862 个基因显著下调;第三是1 DAG vs 7 DAG,有2968 个,其中1399个基因显著上调,1569 个基因显著下调;表明7 DAG、10 DAG、13 DAG 与1 DAG 相比,嫁接接口中的基因转录调控发生较大的变化。10 DAG vs 13 DAG 比较组差异表达基因数量最少,有861个,其中317 个基因显著上调,544 个基因显著下调。表明10 DAG 与13 DAG 基因表达模式差异较小。4 DAG vs 10 DAG比较组有2417个差异表达基因,其中866 个基因显著上调,1551 个基因显著下调;4 DAG vs 13 DAG 比较组有2303 个差异表达基因,其中697 个基因显著上调,1606 个基因显著下调;1 DAG vs 4 DAG 比较组有1633 个差异表达基因,其中963个基因显著上调,670个基因显著下调;7 DAG vs 10 DAG 比较组有1303 个差异表达基因,其中714 个基因显著上调,589 个基因显著下调;4 DAG vs 7 DAG 比较组有1254 个差异表达基因,其中270 个基因显著上调,984 个基因显著下调;7 DAG vs 13 DAG 比较组有890 个差异表达基因,其中284个基因显著上调,606个基因显著下调。
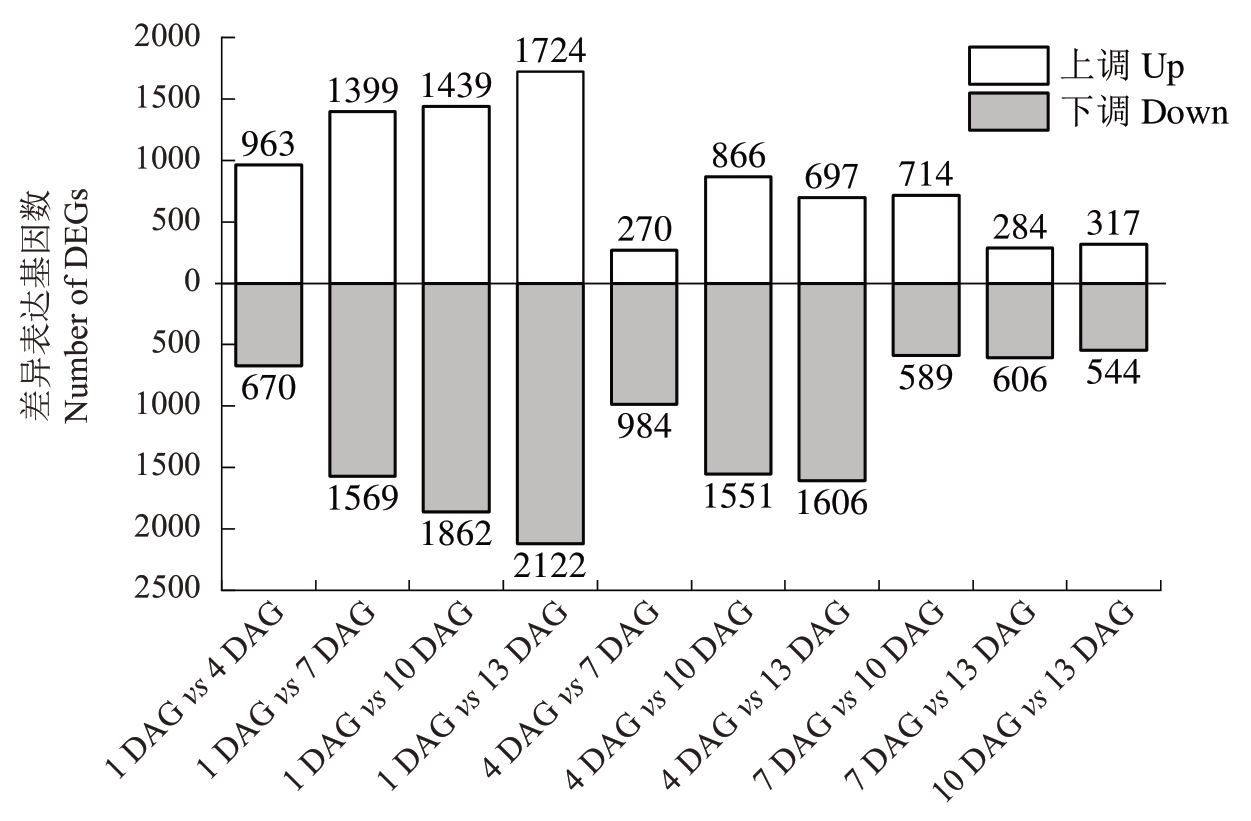
图6 不同比较组的差异表达基因数量
Fig.6 The number of differentially expressed genes in different comparisons
2.5 差异表达基因的聚类分析
为了了解嫁接后不同时期嫁接接口差异表达基因的表达模式,利用Mfuzz对10个比较组的差异表达基因进行时序表达分析(图7)。结果表明,6319个基因分成6 类,最多的一类(Cluster 5)包含了1416 个基因,在愈合过程中表达整体呈下降趋势,且在1~4 DAG 下降趋势明显。这些基因显著富集在核糖体的结构组成、细胞质翻译、核糖体、木葡聚糖:木葡聚糖葡萄糖基转移酶活性、木葡聚糖代谢过程等途径中。Cluster 4 包含1072 个基因,其表达整体呈上升趋势,在7~10 DAG 表达水平基本保持稳定。这些基因主要富集在叶绿体类囊体膜、叶绿体基质、叶绿体、叶绿体被膜、质体间质等途径中。Cluster 3 包含1063 个基因,其表达水平在嫁接后第1 周呈上升趋势,嫁接后第2 周呈先下降后上升趋势。在4~10 DAG表达水平较高。这些基因主要富集在叶绿体被膜、生长素激活的信号转导、叶绿体、果糖-1,6-二磷酸酶Ⅰ、韧皮部或木质部组织发生等途径中。Cluster 6包含980个基因,其表达大体呈下降趋势,在1~4 DAG 表达水平基本保持稳定,在4~10 DAG 下降趋势较为明显。这些基因主要富集在DNA 结合转录因子活性、转移酶活性,转移氨基酰基以外的酰基、质膜的锚固成分、谷胱甘肽结合、膜的锚固成分等途径中。Cluster 2包含973个基因,其在1~4 DAG的表达呈上升趋势,之后逐渐下降。这些基因主要富集在DNA 结合转录因子活性、核小体、质外体、植物型次生细胞壁的生物发生、木质素分解代谢过程等途径中。Cluster 1包含815个基因,其在嫁接后第1周表达水平基本保持稳定,在嫁接后第2周呈先上升后下降趋势。这些基因主要富集在未折叠蛋白反应、盐胁迫响应、热休克响应、伴侣辅因子依赖性蛋白质重折叠、过氧化氢响应等途径中。

图7 嫁接后不同天数嫁接接口差异表达基因聚类
Fig.7 Cluster analysis of differentially expressed genes in the graft unions at different DAG
2.6 参与植物激素合成和代谢的差异表达基因分析
如图8所示,在葡萄绿枝嫁接愈合过程中,共筛选到27个差异表达基因参与植物激素合成和代谢,其中分别有3个、2个、12个和10个差异表达基因参与生长素、细胞分裂素、脱落酸和茉莉酸的合成和代谢。

图8 参与植物激素合成和代谢的差异表达基因
Fig.8 Differentially expressed genes involved in plant hormones synthesis and metabolism
由图8-A可知,在色氨酸依赖的合成生长素的色胺途径中,色氨酸脱羧酶基因TDC(Vitvi07g00696)和醛脱氢酶基因ALDH(Vitvi04g01402)在7 DAG表达量最高。与色氨酸合成有关的芳香族氨基酸转氨酶基因ISS1(Vitvi09g00444)表达量在1~10 DAG 呈下降趋势,之后呈上升趋势。
由图8-B 可知,细胞分裂素生物合成限速酶基因IPT(Vitvi07g00154)在嫁接后第1周高表达,之后呈下降趋势。使细胞分裂素失活的细胞分裂素脱氢酶基因CKX(Vitvi04g00161)表达量在1~4 DAG、7~10 DAG显著下降,分别下降了66%、60%。
高等植物主要以间接途径,即类胡萝卜素途径为主合成脱落酸。八氢番茄红素合成酶(PSY)是类胡萝卜素生物合成第一步的限速酶,其可催化牻牛儿牻牛儿基焦磷酸(GGPP)转化为八氢番茄红素。由图8-C 可知,2 个PSY(Vitvi04g02011 和Vitvi12g00084)在嫁接后第2周高表达。八氢番茄红素经过一系列反应生成反式番茄红素。反式番茄红素在番茄红素β-环化酶(LCYB)、β-胡萝卜素羟化酶(BCH)、玉米黄质环氧化酶(ZEP)、新黄质合成酶(NSY)等的催化下生成新黄质。新黄质在9-顺式-环氧类胡萝卜素双加氧酶(NCED)的催化下生成黄质醛,NCED 所催化的新黄质裂解反应为脱落酸合成途径中的限速反应。NCED(Vitvi19g01356)在1~4 DAG 高表达,在4~10 DAG 呈下降趋势,与脱落酸含量变化趋势相似。黄质醛经黄氧素脱氢酶(ABA2)、脱落醛氧化酶(AAO)两步氧化生成脱落酸。脱落酸主要通过氧化降解和结合失活两条途径丧失生物活性。3 个脱落酸8′-羟化酶基因A8H(Vitvi02g01269、Vitvi03g00508 和Vitvi18g00792)表达量在1~4 DAG 呈下降趋势。脱落酸β-葡萄糖基转移酶基因AOG(Vitvi03g00533)表达量在1~10 DAG呈下降趋势,之后显著上升。
茉莉酸的生物合成从α-亚麻酸开始,经脂氧合酶(LOX)转化为13(S)-氢过氧化亚麻酸(13(S)-HPOT),13(S)-HPOT经丙二烯氧化物合酶(AOS)以及丙二烯氧化物环化酶(AOC)的作用生成12-氧代植物二烯酸(12-OPDA),之后经过12-氧代植二烯酸还原酶(OPR)和一系列β-氧化反应生成茉莉酸。由图8-D 可知,2 个LOX(Vitvi01g01562 和Vitvi06g00158)、AOS(Vitvi18g00886)、AOC(Vitvi14g01246)、2 个OPR(Vitvi18g03162 和Vitvi18g04622)、OPCL1(Vitvi18g00124)共7 个基因的表达量均在1~4 DAG显著下降。其中,除LOX(Vitvi01g01562)和AOC(Vitvi14g01246)之外的5 个基因的表达量在1~10 DAG 大致呈下降趋势,与茉莉酸含量变化趋势一致。
2.7 参与植物激素信号转导的差异表达基因分析
如图9所示,在葡萄绿枝嫁接愈合过程中,筛选到49 个差异表达基因参与植物激素信号转导途径(vvi04075)。这些差异表达基因分布在8 类植物激素中,分别为生长素、细胞分裂素、脱落酸、茉莉酸、油菜素内酯(brassinosteroid,BR)、赤霉素(gibberellin,GA)、乙烯(ethylene,ET)、水杨酸(salicylic acid,SA),其中以生长素、脱落酸和油菜素内酯等激素包含的差异表达基因较多,分别为17 个、8 个和8 个,表明这3类激素在葡萄绿枝嫁接愈合过程中起到重要的调控作用。
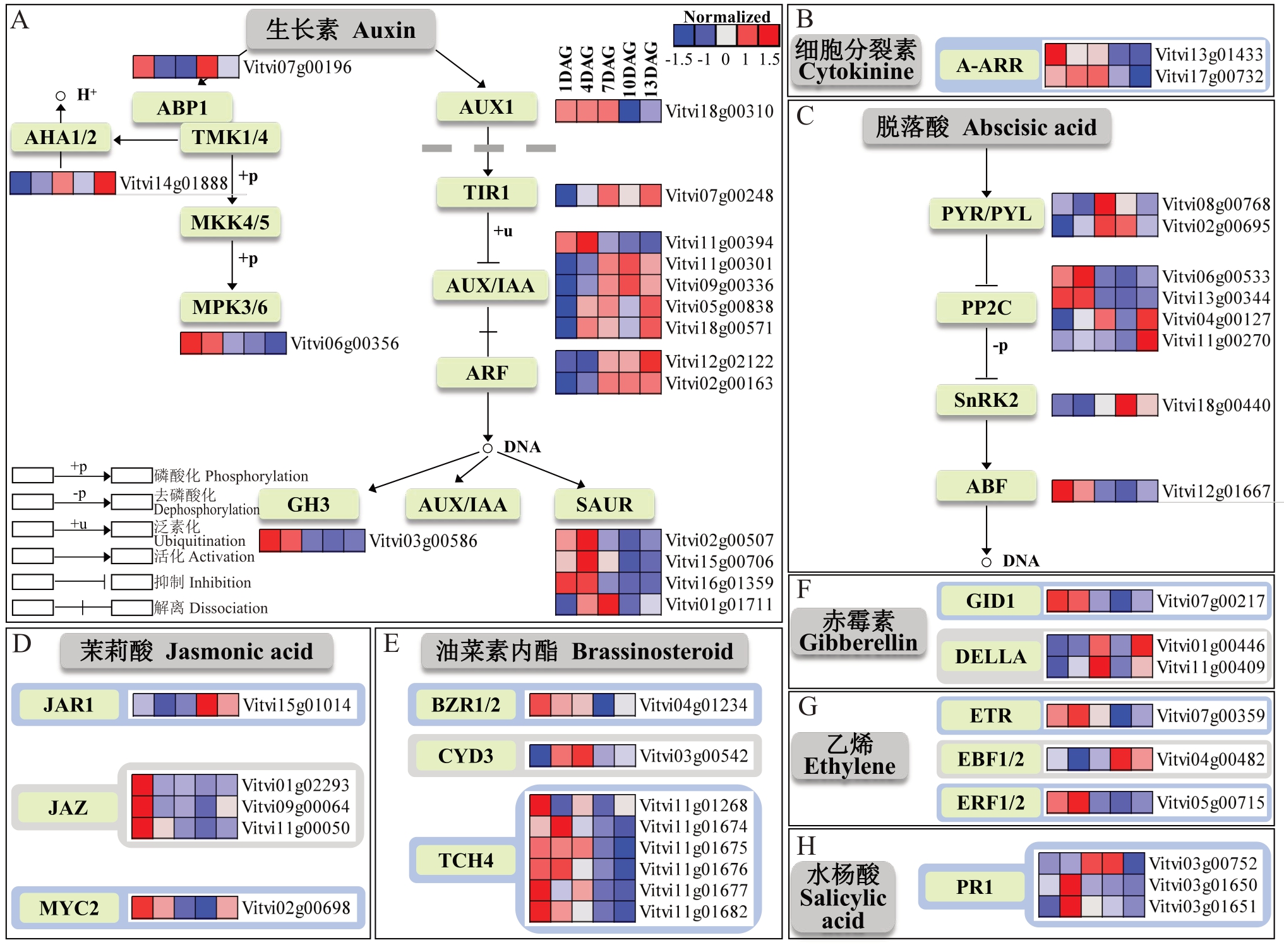
图9 “植物激素信号转导”途径中的差异表达基因
Fig.9 Differentially expressed genes in the“Plant hormone signal transduction”pathway
生长素介导的信号转导途径差异表达基因最多,分布在经典的TIR1-Aux/IAA-ARFs 信号转导途径以及ABP1-TMKs 共同介导的非经典信号转导途径中。由图9-A 可知,有14个差异表达基因参与经典生长素信号转导,包括1 个生长素内向转运载体AUX1(auxin influx carrier)、1 个TIR1、5 个Aux/IAA、2 个ARF、1 个GH3 和4 个SAUR。AUX1(Vitvi18g00310)在嫁接后第1 周高表达,在10 DAG 表达量最低。TIR1(Vitvi07g00248)的表达量在嫁接后第1周呈上升趋势。2个ARF在1~4 DAG表达量较低,之后呈上升趋势。Aux/IAA、GH3 和SAUR 是生长素诱导的早期基因。5 个Aux/IAA 表达量在1~4 DAG 呈上升趋势,其中Aux/IAA(Vitvi11g00394)在4 DAG 表达量最高,之后显著下降,4 DAG 的表达量是7 DAG 的2.2 倍。GH3(Vitvi03g00586)在1~4 DAG 高表达,之后显著下降,4 DAG 的表达量是7 DAG 的5.3 倍。4 个SAUR 表达量在1~4 DAG 均呈上升趋势。有3个差异表达基因参与非经典生长素信号转导,包括1个生长素胞外受体ABP1、1个细胞膜质子泵ATP 酶基因AHA(plasma membrane H+-transporting ATPase)、1 个丝裂原活化蛋白激酶基因MPK3(mitogen-activated protein kinase)。ABP1(Vitvi07g00196)表达量在7~10 DAG 显著上升。AHA(Vitvi14g01888)表达量在嫁接后第1 周呈上升趋势。MPK3(Vitvi06g00356)在1~4 DAG 高表达,之后显著下降,4 DAG 的表达量是7 DAG 的2倍。
参与细胞分裂素信号转导的2个细胞分裂素响应调节因子A-ARR(two-component response regulator)在嫁接后第1周高表达(图9-B)。
有8 个差异表达基因参与脱落酸信号转导,包括2 个PYR/PYL、4 个PP2C、1 个SnRK2 和1 个ABF。如图9-C所示,2个PYR/PYL表达量在嫁接后第1周呈上升趋势,之后呈下降趋势。3个负调控因子 PP2C(Vitvi06g00533、Vitvi13g00344 和 Vitvi11g00270)与正调控因子SnRK2 表达量变化趋势相反。SnRK2在1~4 DAG表达量呈下降趋势,4~10 DAG呈上升趋势,10~13 DAG呈下降趋势。转录因子ABF(Vitvi12g01667)与SnRK2 在1~4 DAG 表达量变化趋势一致,之后呈相反变化趋势。
有5 个差异表达基因参与茉莉酸信号转导,包括1个茉莉酸氨基酸合成酶基因JAR1(jasmonic acid-amino acid synthetase)、3 个转录抑制因子JAZ(jasmonate ZIM domain-containing protein)和1 个bHLH 类转录因子MYC2(myelocytomatosis protein 2)。由图9-D可知,JAR1表达量在1~4 DAG呈下降趋势,在4~10 DAG呈上升趋势。3个JAZ表达量在1~4 DAG 显著下降。MYC2 在1~4 DAG 高表达,在1~10 DAG呈下降趋势。
有8 个差异表达基因参与油菜素内酯信号转导,包括1 个转录因子BZR1/2(brassinosteroid resistant 1/2)、1 个编码细胞周期蛋白的基因CYCD3(cyclin D3-plant)和6 个木葡聚糖内糖基转移酶基因TCH4(xyloglucan endotransglucosylase protein)。由图9-E 可以看出,CYCD3(Vitvi03g00542)表达量在嫁接后第1 周呈上升趋势,7 DAG 的表达量是1 DAG 的2.9 倍。除Vitvi11g01268 之外的5个TCH4 在1~4 DAG 高表达,在10~13 DAG 显著下降。
有3 个差异表达基因参与赤霉素信号转导,包括1 个赤霉素受体基因GID1(gibberellin insensitive dwarf 1)和2 个负调控因子DELLA(DELLA protein)。由图9-F 可知,GID1(Vitvi07g00217)在1~4 DAG 高表达,在1~10 DAG 呈下降趋势。2 个DELLA 表达量在嫁接后第1 周呈上升趋势,嫁接后第2周呈先下降后上升趋势。
有3个差异表达基因参与乙烯信号转导,包括1个乙烯受体基因ETR(ethylene receptor)、1个编码Fbox蛋白的基因EBF(EIN3-binding F-box protein)和1 个乙烯响应转录因子ERF(ethylene-responsive transcription factor)。由图9-G 可知,ETR(Vitvi07g00359)和ERF(Vitvi05g00715)在1~4 DAG 高表达,在4~10 DAG 呈下降趋势。而EBF(Vitvi04g00482)表达量变化趋势相反。
参与水杨酸信号转导的3个差异表达基因均为病程相关蛋白基因PR1(pathogenesis-related protein 1)。由图9-H 可知,Vitvi03g00752 表达量在1~10 DAG呈上升趋势,之后显著下降。Vitvi03g01650和Vitvi03g01651表达量在1~4 DAG显著上升,之后呈下降趋势。
2.8 加权基因共表达网络构建与分析
2.8.1 基因共表达模块构建 为分析转录组数据中的基因表达特征,寻找葡萄绿枝嫁接愈合过程中与内源激素相关的基因模块和共表达基因。将转录组数据中的36 966个基因过滤掉90%以上FPKM<10的基因,获得7949 个高表达基因进行WGCNA 分析。过滤后的基因根据表达量进行层次聚类(图10-A),未发现离群样本。以无尺度拓扑拟合指数R2≥0.83,最优软阈值power=28,构建更符合无尺度拓扑结构的网络。采用动态剪切树法共获得13 个共表达模块(图10-B),各模块中所包含的基因数量差异明显,其中松石绿(Turquoise)模块中的基因数量最多,有2400 个,棕褐色(Tan)模块中的基因数量最少,仅有41个(图10-C)。

图10 嫁接接口不同时期基因共表达模块
Fig.10 Modules of gene co-expression at different stages in the graft unions
2.8.2 模块与代谢物的关联分析 将13 个基因共表达模块分别与天工丽人/贝达嫁接接口的IAA、IP、ABA、JA、JA-Ile、MeJA 含量进行相关性分析。以皮尔逊相关系数(|r|≥0.8)和显著性p值(p<0.01)的大小为筛选条件。由图11 可知,松石绿模块与JA、IP含量变化呈显著正相关(r=0.94,p=1.6×10-7;r=0.85,p=6.1×10-5),黄绿色(Greenyellow)模块与IAA 含量变化呈显著正相关(r=0.85,p=6×10-5)。棕色(Brown)模块与ABA、IP 含量变化呈显著负相关(r=-0.82,p=1.7×10-4;r=-0.8,p=3.8×10-4)。红色(Red)模块与JA-Ile含量变化呈显著负相关(r=-0.81,p=2.6×10-4)。
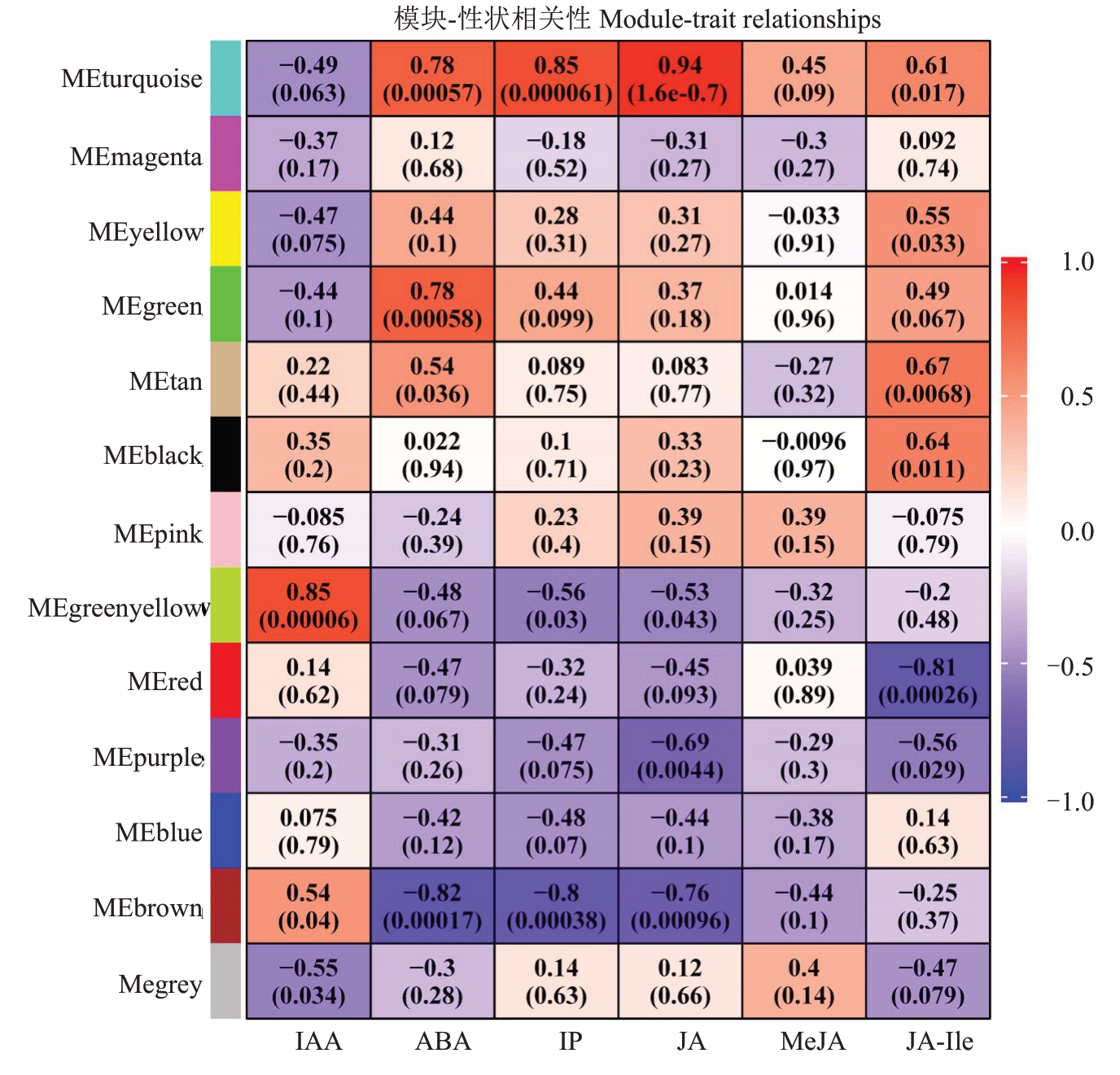
图11 基因模块与植物激素含量相关性热图
Fig.11 Heat map of correlation between gene modules and plant hormone concentrations
2.8.3 葡萄绿枝嫁接愈合过程中与内源激素相关的关键基因 与植物激素含量变化高度相关的松石绿模块和棕色模块为关键模块。2个模块分别包含前文(2.6,2.7)所述26个、10个DEGs,根据基因显著性(gene significance,GS)>|0.75|、模块关系(module membership,MM)>0.89、模块连通性(eigengene connectivity,kME)>0.89过滤。松石绿模块中筛选到6 个DEGs,分别为IAA 早期响应基因GH3(Vit-vi03g00586),JA 合成路径上的 LOX(Vitvi06g00158)、AOS(Vitvi18g00886)、OPCL1(Vitvi18g00124),ABA转录因子ABF(Vitvi12g01667)以及与初生细胞壁有关的木葡聚糖内糖基转移酶基因TCH4(Vitvi11g01682)。棕色模块中筛选到2个IAA信号转导通路上的DEGs,分别为细胞膜质子泵ATP酶基因AHA(Vitvi14g01888)和IAA 受体基因TIR1(Vitvi07g00248)。利用Cytoscape 3.8.0 软件对松石绿模块筛选到的6个DEGs进行可视化。由图12可以看出,与JA 合成有关的3 个DEGs 相关性较显著。IAA 早期响应基因GH3(Vitvi03g00586)与ABA 转录因子ABF(Vitvi12g01667)相关性也较显著,说明ABA和IAA信号转导存在相互作用共同调控葡萄绿枝嫁接愈合过程。
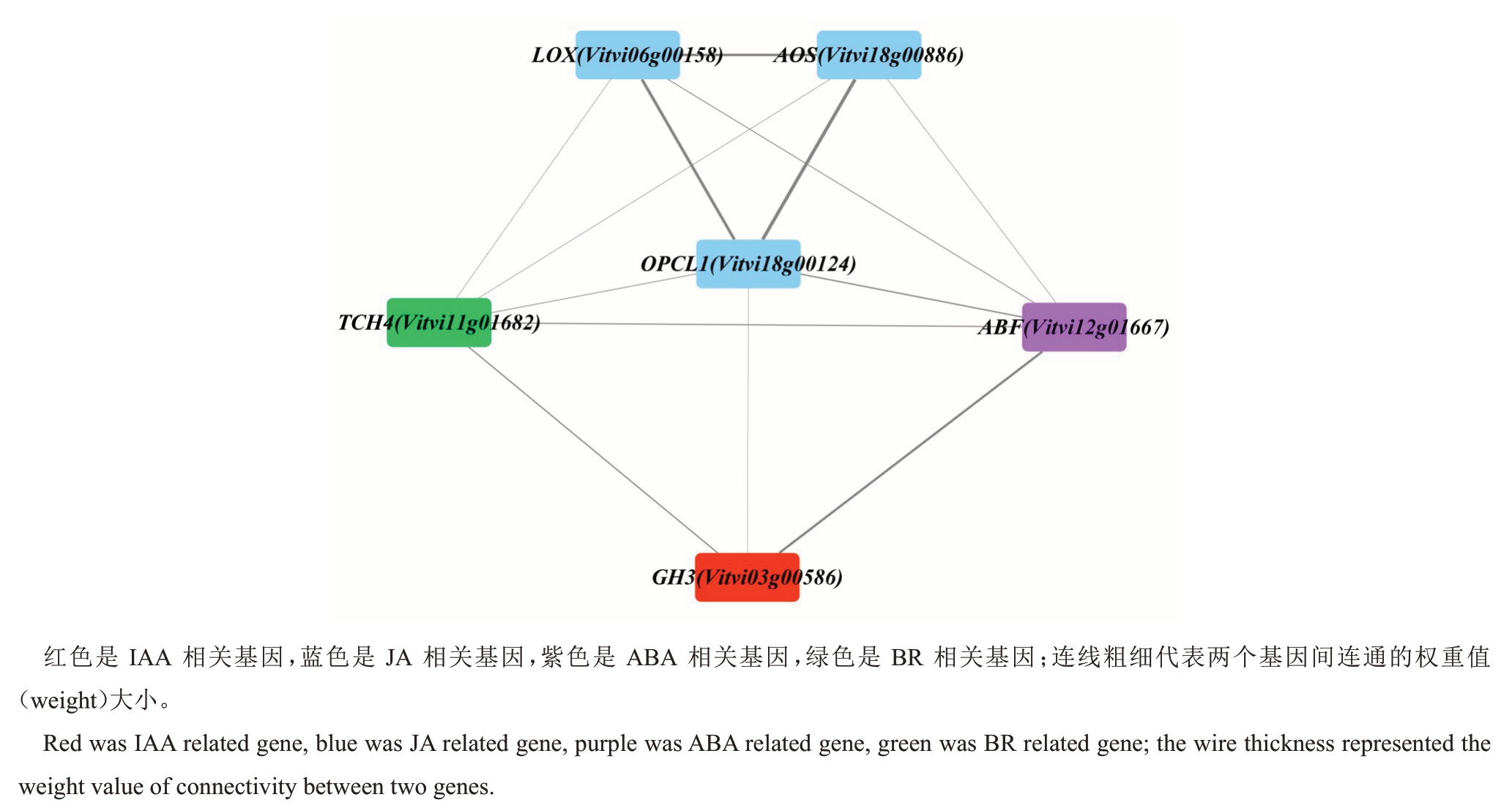
图12 松石绿模块内与植物激素相关的核心基因的基因网络
Fig.12 Gene network of core genes associated with plant hormones within turquoise module
2.8.4 qRT-PCR验证 对筛选到的葡萄绿枝嫁接愈合过程中与内源激素相关的8个关键基因进行qRTPCR验证(图13)。结果显示8个基因的相对表达量变化趋势与转录组测序结果基本一致,说明转录组数据可靠,用此数据得出的分析结果可信。
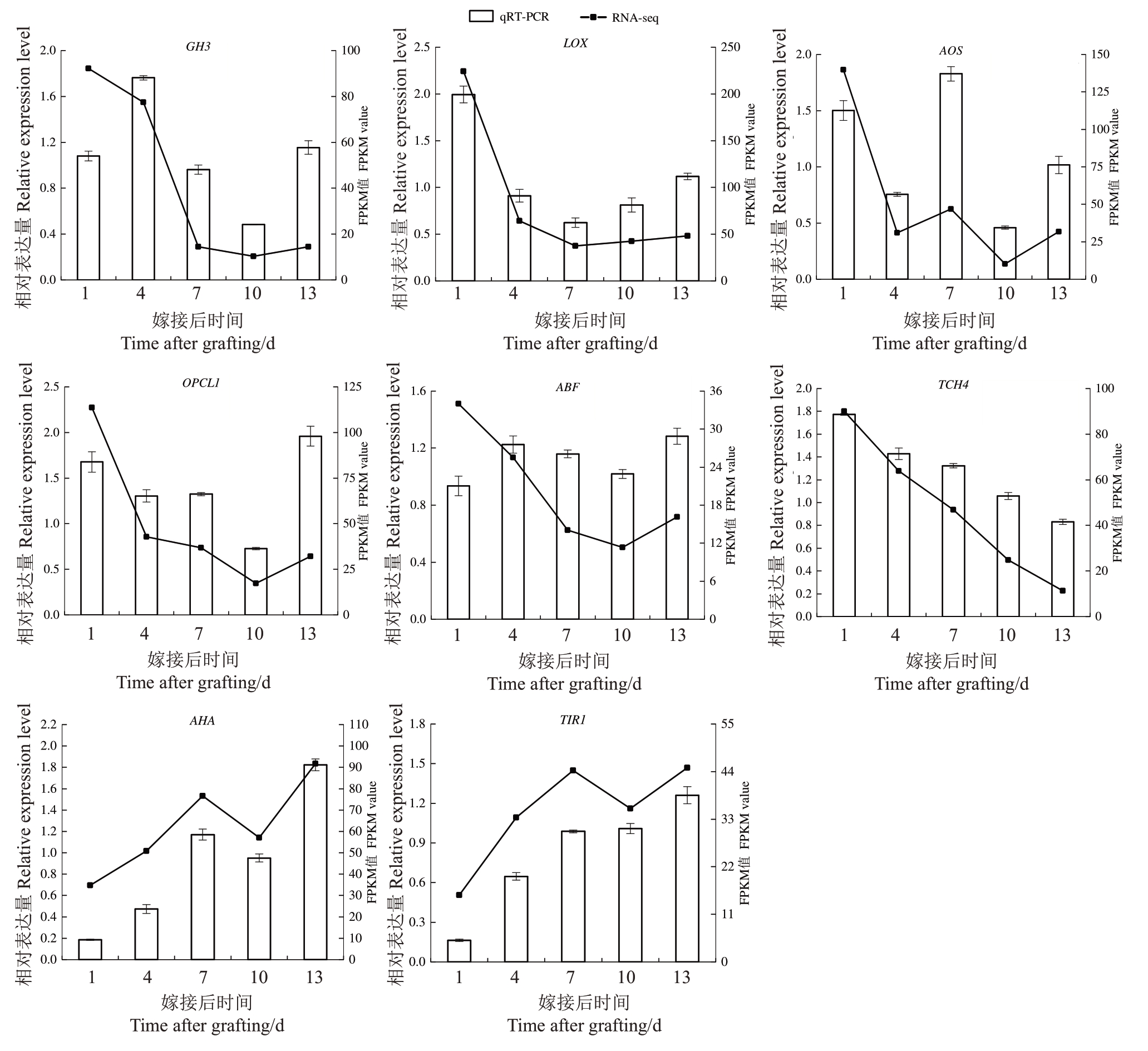
图13 葡萄绿枝嫁接愈合过程中8 个关键基因的实时荧光定量验证
Fig.13 qRT-PCR validation of 8 key genes in the healing process of grapevine greenwood grafting
3 讨 论
葡萄绿枝嫁接愈合过程与拟南芥相似,接穗与砧木伤口处密切结合发生组织粘连,结合处周围韧皮部、木质部薄壁细胞等发生脱分化形成愈伤组织。愈伤组织细胞不断分裂迅速填充砧穗间隙,部分愈伤组织细胞分化为维管组织,实现砧穗之间的连通[19]。观察接穗芽外观形态可知,不同砧穗组合接穗芽萌芽时间不同,可能是因为接穗与砧木的亲和性不同,从而导致愈合进程不同,但不同砧穗组合在13 DAG接穗芽均至少有1枚叶片完全展开,表明不同砧穗组合在嫁接后13 d内完成绿枝嫁接愈合过程,砧穗之间连通,能正常进行水分和养分运输。
笔者在本研究中对天工丽人/贝达的嫁接接口进行转录组测序,结果表明,愈合过程中的基因表达存在显著差异。与1 DAG 相比,7、10 和13 DAG 均存在大量下调基因,而4 DAG 下调基因较少,这可能是愈合前期接穗和砧木切割面上的细胞膨胀,在嫁接接口处形成薄膜,响应初生细胞壁松弛、次生细胞壁形成的基因活跃[4],导致1~4 DAG 之后的表达基因出现大量下调。通过时序表达分析将差异表达基因分成6 类,最多的一类基因显著富集在木葡聚糖:木葡聚糖葡萄糖基转移酶活性、木葡聚糖代谢过程等途径中,并且在愈合过程中表达整体呈下降的趋势,也进一步说明葡萄绿枝嫁接愈合前期与细胞壁的动态变化密切相关。此外,包含基因较多的Cluster 3 主要富集在叶绿体被膜、生长素激活的信号转导、叶绿体、果糖-1,6-二磷酸酶Ⅰ、韧皮部或木质部组织发生等途径,表明生长素信号转导途径在愈合过程中起重要的调控作用。
植物细胞壁在伤口反应、细胞黏附、识别和分化中具有重要作用[20]。木葡聚糖是双子叶植物初生细胞壁中重要的半纤维素[21]。木葡聚糖内糖基转移酶(TCH4)功能体现在催化木葡聚糖分子转移、细胞壁松弛时重新排列聚合物、使细胞扩增修饰初生细胞壁或使细胞壁部分降解等方面[22-23]。有研究表明,BR可诱导TCH4活性增强,在植物细胞壁松弛过程中发挥重要作用[24]。本研究结果表明参与BR 信号转导的除Vitvi11g01268 之外的5 个TCH4 在1~4 DAG 高表达,在10~13 DAG 显著下降,表明愈合前期TCH4可能通过改变细胞壁的结构和性质来调节细胞的形态和功能。
不同砧穗组合IAA 含量变化趋势相似,在愈合过程中呈上升趋势。在细胞核内,IAA 主要依赖于经典的TIR1-Aux/IAA-ARFs 信号转导途径实现生长素信号的传递,调节植物细胞对生长素的慢速响应[25]。在本研究中,GH3(Vitvi03g00586)在1~4 DAG高表达,之后显著下降。GH3能催化IAA腺苷化或与氨基酸形成复合物,在IAA失活中起核心作用[26]。天工丽人/贝达嫁接接口的IAA 含量在愈合前期较低,愈合后期呈上升趋势。Kawaguchi等[11]研究未嫁接接穗和未嫁接砧木切口部位植物激素的变化,发现在切割后24、72、120 和168 h,接穗部位IAA-Asp 浓度呈上升趋势而IAA 浓度呈下降趋势,因此推测IAA 在愈合前期浓度较低与GH3 通路有关。生长素胞外受体ABP1 在植物界广泛存在,与TMKs跨膜受体激酶形成生长素共受体来感受并快速传递胞外生长素信号[27]。有研究发现,ABP1在维管组织创伤后再生过程中显著上调表达,且过表达ABP1 可促进再生。同时,ABP1 和TMKs 是茎在伤口周围再生维管系统中所必需的[28]。在本研究中,ABP1(Vitvi07g00196)在7 DAG vs 10 DAG 显著上调,说明在7~10 DAG 细胞可能进行维管组织相关的活动。激活的TMKs通过磷酸化方式调控AHA、MKK4/5-MPK3/6 等一系列下游底物活性[29]。有研究表明,IAA 可以在数秒内诱导TMK1 结合AHA,激活质子泵的活性,导致大量质子被泵出细胞外,从而引起细胞壁酸性化和细胞的伸长[30]。IAA还能通过TMK1/4-MKK4/5-MPK3/6信号途径,来调控细胞分裂模式[31]。在本研究中,AHA(Vitvi14g01888)表达量在嫁接后第1 周呈上升趋势,MPK3(Vitvi06g00356)在1~4 DAG 高表达。说明IAA 在1~4 DAG促进细胞不断分裂和增殖,在1~7 DAG促进细胞伸长。
CTK 通常通过与IAA 信号通路的互作而发挥作用[32]。有研究发现,一些CTK信号突变体可以诱导木质部分化,外源CTK处理也会抑制木质部的形成[33]。IP 含量在愈合过程中总体呈下降趋势,与IAA水平趋势相反。说明葡萄绿枝嫁接愈合过程中IP 与IAA 信号通路存在拮抗作用,IP 可能负调控木质部的形成。
ABA含量在愈合前期保持较高水平,愈合后期呈下降趋势。在本研究中,ABA 合成关键酶基因NCED(Vitvi19g01356)和ABA 转录因子ABF(Vitvi12g01667)均在1~4 DAG 高表达,在4~10 DAG 呈下降趋势,与天工丽人/贝达ABA 含量变化趋势相似。ABA 既可以在木质部运输[34],也可以在韧皮部运输。ABA 早期水平较高可能是受损组织脱水引起干旱胁迫,导致ABA 合成增加,并通过维管组织运输到嫁接接口处[11]。ABA含量在愈合后期呈下降趋势可能与维管束的重连有关。
JAs含量在愈合过程中整体呈下降趋势。JA合成路径上的LOX(Vitvi06g00158)、AOS(Vitvi18g00886)和OPCL1(Vitvi18g00124)的表达量与天工丽人/贝达JA含量变化趋势一致。JA与IAA信号转导相互作用,IAA 抑制JA 生物合成[35]。有研究发现,JAs 能抑制CTK 响应,允许更多木质部形成[15]。Jang 等[36]研究发现,JAs 与IAA、CTK 相互作用通过抑制生长素极性转运载体PIN7.4 的表达来调控木质部的形成。JAs在维管形成中的作用及其与IAA、CTK的相互作用有待进一步研究。
4 结 论
葡萄绿枝嫁接愈合过程中植物激素的含量变化具有阶段特异性。IP、ABA 和JAs 含量在愈合前期较高,IAA 含量在愈合后期保持较高水平。转录组数据筛选出27 个DEGs 参与植物激素合成和代谢,49个DEGs参与植物激素信号转导。IAA在嫁接愈合过程中起关键作用,IP、ABA、JAs 通过与IAA 信号转导相互作用,共同调控葡萄绿枝嫁接愈合过程。IP与IAA信号通路存在拮抗作用,IP可能负调控木质部的形成。JA 与IAA 信号转导存在相互作用,IAA抑制JA生物合成。本研究结果为葡萄绿枝嫁接愈合分子机制研究奠定了基础。
致谢:感谢北京大兴喜山葡萄合作社提供试验材料,感谢卢浩成、姚雪辰、田萌勃、史宁、李明玉在仪器分析和论文写作过程中给予的指导!
[1] 史祥宾,王海波,黄永,魏华,王小龙,王志强,王宝亮,刘英君.葡萄叶柄去除绿枝嫁接苗木标准化繁育技术[J].果树实用技术与信息,2023(12):23-24.SHI Xiangbin,WANG Haibo,HUANG Yong,WEI Hua,WANG Xiaolong,WANG Zhiqiang,WANG Baoliang,LIU Yingjun. Standard breeding technique of grape leaf removal greenwood grafting seedlings[J].Applied Technology and Information for Fruit Tree,2023(12):23-24.
[2] 王海波,史祥宾,黄永,魏华,王小龙,王志强,王宝亮,刘英君.葡萄嫁接苗木标准化繁育技术[J].果树实用技术与信息,2023(12):21-23.WANG Haibo,SHI Xiangbin,HUANG Yong,WEI Hua,WANG Xiaolong,WANG Zhiqiang,WANG Baoliang,LIU Yingjun. Standard breeding technique of grape grafted seedlings[J]. Applied Technology and Information for Fruit Tree,2023(12):21-23.
[3] 杜浩,陈瑶,吴庆贤,刘思彤,靳乐妮,尹增芳.砧/穗间交流的物质及其嫁接愈合效应[J]. 中国细胞生物学学报,2024,46(2):327-335.DU Hao,CHEN Yao,WU Qingxian,LIU Sitong,JIN Leni,YIN Zengfang. The exchange substance of rootstock and scion and its grafting healing effect[J]. Chinese Journal of Cell Biology,2024,46(2):327-335.
[4] MELNYK C W,SCHUSTER C,LEYSER O,MEYEROWITZ E M.A developmental framework for graft formation and vascular reconnection in Arabidopsis thaliana[J]. Current Biology,2015,25(10):1306-1318.
[5] DUAN Y D,ZHANG F,MENG X M,SHANG Q M. Spatiotemporal dynamics of phytohormones in the tomato graft healing process[J]. Horticultural Plant Journal,2024,10(6):1362-1370.
[6] XU J N,WEI X Y,XIONG M,ZHANG T,LIU C J,BIE Z L,HUANG Y. A method for simultaneously monitoring phloem and xylem reconnections in grafted watermelon seedlings[J].Scientia Horticulturae,2022,299:111058.
[7] COOKSON S J,MORENO M J C,HEVIN C,MENDOME L Z N,DELROT S,TROSSAT-MAGNIN C,OLLAT N.Graft union formation in grapevine induces transcriptional changes related to cell wall modification,wounding,hormone signalling,and secondary metabolism[J]. Journal of Experimental Botany,2013,64(10):2997-3008.
[8] DHARMASIRI N,DHARMASIRI S,ESTELLE M. The F-box protein TIR1 is an auxin receptor[J]. Nature,2005,435(7041):441-445.
[9] ROBERT S,KLEINE-VEHN J,BARBEZ E,SAUER M,PACIOREK T,BASTER P,VANNESTE S,ZHANG J,SIMON S,ČOVANOVÁ M,HAYASHI K,DHONUKSHE P,YANG Z B,BEDNAREK S Y,JONES A M,LUSCHNIG C,ANIENTO F,ZAŽÍMALOVÁ E,FRIML J. ABP1 mediates auxin inhibition of clathrin-dependent endocytosis in Arabidopsis[J]. Cell,2010,143(1):111-121.
[10] RASOOL A,MANSOOR S,BHAT K M,HASSAN G I,BABA T R,ALYEMENI M N,ALSAHLI A A,EL-SEREHY H A,PARAY B A,AHMAD P. Mechanisms underlying graft union formation and rootstock scion interaction in horticultural plants[J].Frontiers in Plant Science,2020,11:590847.
[11] KAWAGUCHI K,NOTAGUCHI M,OKAYASU K,YU S W,KOJIMA M,TAKEBAYASHI Y,SAKAKIBARA H,OTAGAKI S,MATSUMOTO S,SHIRATAKE K. Plant hormone profiling of scion and rootstock incision sites and intra-and inter-family graft junctions in Nicotiana benthamiana[J].Plant Signaling&Behavior,2024,19(1):2331358.
[12] VISHWAKARMA K,UPADHYAY N,KUMAR N,YADAV G,SINGH J,MISHRA R K,KUMAR V,VERMA R,UPADHYAY R G,PANDEY M,SHARMA S.Abscisic acid signaling and abiotic stress tolerance in plants:A review on current knowledge and future prospects[J].Frontiers in Plant Science,2017,8:161.
[13] CHEN K,LI G J,BRESSAN R A,SONG C P,ZHU J K,ZHAO Y.Abscisic acid dynamics,signaling,and functions in plants[J].Journal of Integrative Plant Biology,2020,62(1):25-54.
[14] IKEUCHI M,IWASE A,RYMEN B,LAMBOLEZ A,KOJIMA M,TAKEBAYASHI Y,HEYMAN J,WATANABE S,SEO M,DE VEYLDER L,SAKAKIBARA H,SUGIMOTO K. Wounding triggers callus formation via dynamic hormonal and transcriptional changes[J]. Plant Physiology,2017,175(3):1158-1174.
[15] NANDA A K,MELNYK C W. The role of plant hormones during grafting[J].Journal of Plant Research,2018,131(1):49-58.
[16] 谢露露,崔青青,董春娟,尚庆茂.植物嫁接愈合分子机制研究进展[J].植物学报,2020,55(5):634-643.XIE Lulu,CUI Qingqing,DONG Chunjuan,SHANG Qingmao.Recent advances in molecular mechanisms of plant graft healing process[J].Chinese Bulletin of Botany,2020,55(5):634-643.
[17] MATSUOKA K,YANAGI R,YUMOTO E,YOKOTA T,YAMANE H,SATOH S,ASAHINA M.RAP2.6L and jasmonic acid-responsive genes are expressed upon Arabidopsis hypocotyl grafting but are not needed for cell proliferation related to healing[J].Plant Molecular Biology,2018,96(6):531-542.
[18] YAO X C,XIA N Y,MENG X,DUAN C Q,PAN Q H.A onestep polyphenol removal approach for detection of multiple phytohormones from grape berry[J].Horticulturae,2022,8(6):548.
[19] 王凤婷,赵福顺,乔凯彬,徐珣,刘金亮.蔬菜嫁接砧穗互作分子机制研究进展[J].生物技术通报,2024,40(10):149-159.WANG Fengting,ZHAO Fushun,QIAO Kaibin,XU Xun,LIU Jinliang. Progress on the molecular mechanism of scion-rootstock interactions in vegetable grafting[J]. Biotechnology Bulletin,2024,40(10):149-159.
[20] SALA K,KARCZ J,RYPIEŃ A,KURCZYŃSKA E U.Unmethyl-esterified homogalacturonan and extensins seal Arabidopsis graft union[J].BMC Plant Biology,2019,19(1):151.
[21] 肖银燕,袁伟娜,刘静,孟建,盛奇明,谭烨欢,徐春香.木葡聚糖及其在植物抗逆过程中的功能研究进展[J]. 植物学报,2020,55(6):777-787.XIAO Yinyan,YUAN Weina,LIU Jing,MENG Jian,SHENG Qiming,TAN Yehuan,XU Chunxiang. Xyloglucan and the advances in its roles in plant tolerance to stresses[J]. Chinese Bulletin of Botany,2020,55(6):777-787.
[22] XU W,PURUGGANAN M M,POLISENSKY D H,ANTOSIEWICZ D M,FRY S C,BRAAM J.Arabidopsis TCH4,regulated by hormones and the environment,encodes a xyloglucan endotransglycosylase[J].The Plant Cell,1995,7(10):1555-1567.
[23] 杨帅,高尚珠,卢晗,詹亚光,曾凡锁.植物细胞壁形成及在非生物胁迫中的作用[J].植物生理学报,2023,59(7):1251-1264.YANG Shuai,GAO Shangzhu,LU Han,ZHAN Yaguang,ZENG Fansuo. Plant cell wall development and its function in abiotic stress[J].Plant Physiology Journal,2023,59(7):1251-1264.
[24] 陈晨,陈虹,倪铭,张子晗,喻方圆.油菜素内酯调控植物生长发育的研究进展[J].林业科学,2022,58(7):144-155.CHEN Chen,CHEN Hong,NI Ming,ZHANG Zihan,YU Fangyuan. Research progress of brassinolide in regulating plant growth and development[J]. Scientia Silvae Sinicae,2022,58(7):144-155.
[25] YU Z P,ZHANG F,FRIML J,DING Z J.Auxin signaling:Research advances over the past 30 years[J]. Journal of Integrative Plant Biology,2022,64(2):371-392.
[26] SUGAWARA S,MASHIGUCHI K,TANAKA K,HISHIYAMA S,SAKAI T,HANADA K,KINOSHITA-TSUJIMURA K,YU H,DAI X H,TAKEBAYASHI Y,TAKEDA-KAMIYA N,KAKIMOTO T,KAWAIDE H,NATSUME M,ESTELLE M,ZHAO Y D,HAYASHI K I,KAMIYA Y,KASAHARA H. Distinct characteristics of indole-3-acetic acid and phenylacetic acid,two common auxins in plants[J].Plant&Cell Physiology,2015,56(8):1641-1654.
[27] ZHOU Y W,WANG C Y,YU Y Q,DING Z J,XU T D. Rapid auxin signaling:An ancient and conserved response in plants[J].The Innovation Life,2024,2(2):100061.
[28] FRIML J,GALLEI M,GELOVÁ Z,JOHNSON A,MAZUR E,MONZER A,RODRIGUEZ L,ROOSJEN M,VERSTRAETEN I,ŽIVANOVIĆ B D,ZOU M X,FIEDLER L,GIANNINI C,GRONES P,HRTYAN M,KAUFMANN W A,KUHN A,NARASIMHAN M,RANDUCH M,RÝDZA N,TAKAHASHI K,TAN S T,TEPLOVA A,KINOSHITA T,WEIJERS D,RAKUSOVÁ H.ABP1-TMK auxin perception for global phosphorylation and auxin canalization[J]. Nature,2022,609(7927):575-581.
[29] YU Y Q,TANG W X,LIN W W,LI W,ZHOU X,LI Y,CHEN R,ZHENG R,QIN G C,CAO W H,PÉREZ-HENRÍQUEZ P,HUANG R F,MA J,QIU Q Q,XU Z W,ZOU A L,LIN J C,JIANG L W,XU T D,YANG Z B.ABLs and TMKs are co-receptors for extracellular auxin[J].Cell,2023,186(25):5457-5471.
[30] LIN W W,ZHOU X,TANG W X,TAKAHASHI K,PAN X,DAI J W,REN H,ZHU X Y,PAN S Q,ZHENG H Y,GRAY W M,XU T D,KINOSHITA T,YANG Z B. TMK-based cell-surface auxin signalling activates cell-wall acidification[J]. Nature,2021,599(7884):278-282.
[31] 马军,徐通达.植物非经典生长素信号转导通路解析[J].生物技术通报,2020,36(7):15-22.MA Jun,XU Tongda. Non-canonical auxin signaling pathway in plants[J].Biotechnology Bulletin,2020,36(7):15-22.
[32] SCHALLER G E,BISHOPP A,KIEBER J J. The Yin-Yang of hormones:Cytokinin and auxin interactions in plant development[J].The Plant Cell,2015,27(1):44-63.
[33] MÄHÖNEN A P,HIGUCHI M,TÖRMÄKANGAS K,MIYAWAKI K,PISCHKE M S,SUSSMAN M R,HELARIUTTA Y,KAKIMOTO T. Cytokinins regulate a bidirectional phosphorelay network in Arabidopsis[J]. Current Biology,2006,16(11):1116-1122.
[34] YANG Q,DENG X J,LIU T,QIAN J Y,ZHANG P H,ZHU E G,WANG J Q,ZHU X X,KUDOYAROVA G,ZHAO J Z,ZHANG K W. Abscisic acid root-to-shoot translocation by transporter AtABCG25 mediates stomatal movements in Arabidopsis[J].Plant Physiology,2024,195(1):671-684.
[35] PITAKSARINGKARN W,ISHIGURO S,ASAHINA M,SATOH S. ARF6 and ARF8 contribute to tissue reunion in incised Arabidopsis inflorescence stems[J]. Plant Biotechnology,2014,31(1):49-53.
[36] JANG G,YOON Y,CHOI Y D.Jasmonic acid modulates xylem development by controlling expression of PIN-FORMED 7[J].Plant Signaling&Behavior,2019,14(9):1-4.