中国柑橘产业发展迅速,近年来保持世界第一大柑橘生产国和销售国的地位[1]。椪柑(Citrus reticulata Blanco.)作为主要的宽皮柑橘品种,是消费者喜爱的鲜食品种之一。其中,华柑4 号是靖安椪柑的无核芽变新品种[2],与其母本靖安椪柑相比果实品质明显改善。然而华柑4号存在开花量大但坐果率低、果实发育缓慢等问题,在市场上因果实偏小而得不到消费者青睐,其大果比率低直接影响农业生产者的收益,导致果农生产积极性受挫,不利于新品种的推广与产业布局。因此,探明华柑4 号果实发育迟缓的成因,有助于尽早形成良种良法体系。
果实是被子植物的特征性器官,柑橘果实属于柑果,为芸香科植物特有。果皮由子房壁发育而来[3],分为外果皮(油胞层)、中果皮(白皮层)、内果皮(果肉),其中内果皮膜质分为若干室,向内生出汁囊,是食用的主要部分[4]。柑橘果实生长呈S 型曲线,整个过程分为3个阶段[5],分别为细胞分裂期、果实膨大期和果实成熟期。在细胞分裂期细胞大量分裂,为果皮生长奠定基础;果实膨大期主要是果肉发育,决定最终果实大小;在果实成熟期果实质量略微增加,主要是内含物的改变。一般幼果细胞分裂期发生在开花后的一段时期,子房形成后细胞开始膨大,这个过程持续整个果实生长周期[6]。果实作为柑橘最重要的部位,它的大小通过细胞分裂和细胞膨大共同调控。在黄瓜中,过表达CsARF10使果实细胞膨大和伸长受到抑制,导致果实畸形[7]。袁静贤[8]以幼果期西瓜为材料,发现9个ARF基因与果实膨大呈正相关,6 个ARF 基因与果实细胞分裂呈正相关。此外,研究发现MdARF106 在苹果果实细胞分裂和膨大阶段高表达[9]。
植物内源激素可以调节果实发育过程,以响应环境和内源信号。在黄瓜生长关键期,果实较长的黄瓜品种生长素含量快速达到峰值[10],研究证实Cs-FUL1A 能够通过抑制生长素转运来影响细胞分裂和细胞扩张过程,从而调节黄瓜果实长度[11]。在番茄中,SlPRE2与AtPRE1,都是通过赤霉素调节反应来调控细胞伸长的蛋白,同时发现赤霉素途径的转录因子SlGRAS2参与了细胞扩张的调节[12]。在猕猴桃果皮中,细胞分裂素生物合成基因IPT 和CYP735A表达下调导致扩张蛋白下调,影响果实大小[13]。前人通过转录组分析两种大小差异显著的葫芦,发现3 个与细胞分裂素相关的基因(CKX1、CKX2、CKX3)表现出显著的差异[14]。笔者在本研究中利用田间数据统计分析、激素含量测定及转录组分析等方法探究影响HG4果实大小的关键因子,为其果实发育的调控机制提供线索,为优质大果的栽培技术改良提供重要的理论支撑。
1 材料和方法
1.1 试验材料
供试材料为华中农业大学国家柑橘育种中心资源圃的无核椪柑华柑4 号和有核椪柑华柑2 号。2021 年采集开花前15 d 和7 d(days before flowering,DBF)的花苞,开花后5、25、45 d(days after flowering,DAF)的幼果,用液氮速冻后放于-80 ℃超低温冰箱保存,用于提取植物内源激素。2021年采集5、15、25、35、45 DAF 的幼果用FAA 固定液固定,用于石蜡切片制备;采集80、110、140、170、200、230 DAF的果实测定果实大小。
1.2 果实大小测定及分级标准
使用数显游标卡尺(精确到0.01 mm)测量果实纵横径,纵径为果实纵向对称轴面的长度,横径为果实赤道面的长度,果形指数为果实纵径与横径的比值,每个果实3 次重复。分级标准按农业部发布的NY/T 589—2002 标准执行,对HG4 果实横径分为3个区间:<65 mm、65~70 mm、>70 mm。
1.3 石蜡切片制备
石蜡切片制作参考王蓉[15]的方法并作适当修改,使用番红固绿染液对切片进行染色。切片置入番红染液中染色1~2 h,自来水洗去多余染料,在50%、70%、80%梯度乙醇中各3~8 s 进行脱色,于固绿染液中染色30~60 s,无水乙醇三缸脱水,用干净的二甲苯透明5 min,加两滴中性树胶封片。
1.4 植物内源激素提取和测定
参考Pan 等[16]的方法提取植物内源激素,色谱条件:色谱柱为Agilent SB-C18(50 mm×2.1 mm,1.8 μm),流动相A泵溶液为0.04%乙酸水溶液,B泵溶液为乙腈,柱温40 ℃,进样量10 μL。质谱条件:使用电喷雾离子源,样品质谱信号采集分别采用正、负离子(ESI+、ESI-)扫描模式,质谱参数见表1。
表1 不同植物内源激素质谱参数
Table 1 Mass spectrometry parameters of different plant endogenous hormones
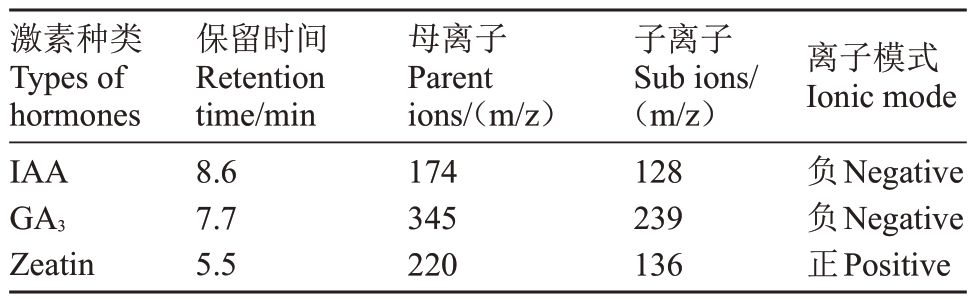
激素种类Types of hormones IAA GA3 Zeatin保留时间Retention time/min 8.6 7.7 5.5母离子Parent ions/(m/z)174 345 220子离子Sub ions/(m/z)128 239 136离子模式Ionic mode负Negative负Negative正Positive
1.5 转录组数据分析
采集25 和45 DAF 的HG4 与HG2 幼果,每个样品3 次生物学重复,送往诺禾致源公司对样品进行RNA提取及转录组测序。
测序原始数据经过质控和过滤后,使用HISAT2将数据比对到克里曼丁橘(Citrus clementina)参考基因组(http://citrus.hzau.edu.cn/),使用StringTie 软件对转录本进行组装并用TPM 定量[17]。使用R 包DESeq2 对样本之间的差异基因进行分析,采用pvalue<0.05,log2FoldChange>1 为阈值筛选差异表达基因[18],采用TBtools 软件进行差异表达基因GO和KEGG富集分析[19]。
1.6 数据分析
采用Microsoft Excel(Microsoft Office,2010)软件对数据进行整理,差异显著性使用SPSS 25 软件进行分析,图形绘制使用GraphPad Prism 8 软件,原始图片处理使用Adobe Photoshop CC 2019软件。
2 结果与分析
2.1 HG4与HG2果实生长发育动态
为初步了解HG4 和HG2 的果实发育动态(图1),在5~45 DAF 观察幼果赤道面发现5 DAF 时HG4 白皮层的细胞层数大于HG2,但在15~45 DAF时HG4 白皮层的细胞层数始终小于HG2。同时观察HG4 和HG2 细胞分裂期的白皮层细胞形态,5~45 DAF 二者的白皮层细胞密度持续减小;15~45 DAF HG4 白皮层细胞密度始终大于HG2;35 DAF时,HG4 白皮层细胞密度(1682 个·mm-2)显著大于HG2(1468个·mm-2)(图1-B)。此外,如图2所示,从80 DAF 开始,每隔30 d 测量果实横纵径,发现HG4的果实横纵径始终显著小于HG2。80 DAF 测量HG4 的横纵径分别为26.41、24.97 mm,HG2 横纵径分别为31.30、30.50 mm。230 DAF果实成熟时HG4的横纵径分别为55.35、45.41 mm,HG2 的横纵径分别为67.79、55.74 mm。HG4 和HG2 的果形指数分别从0.945、0.975变为0.822、0.823。

图1 HG4 和HG2 白皮层细胞学观察
Fig.1 Cytological observation in the white pericarp of HG4 and HG2
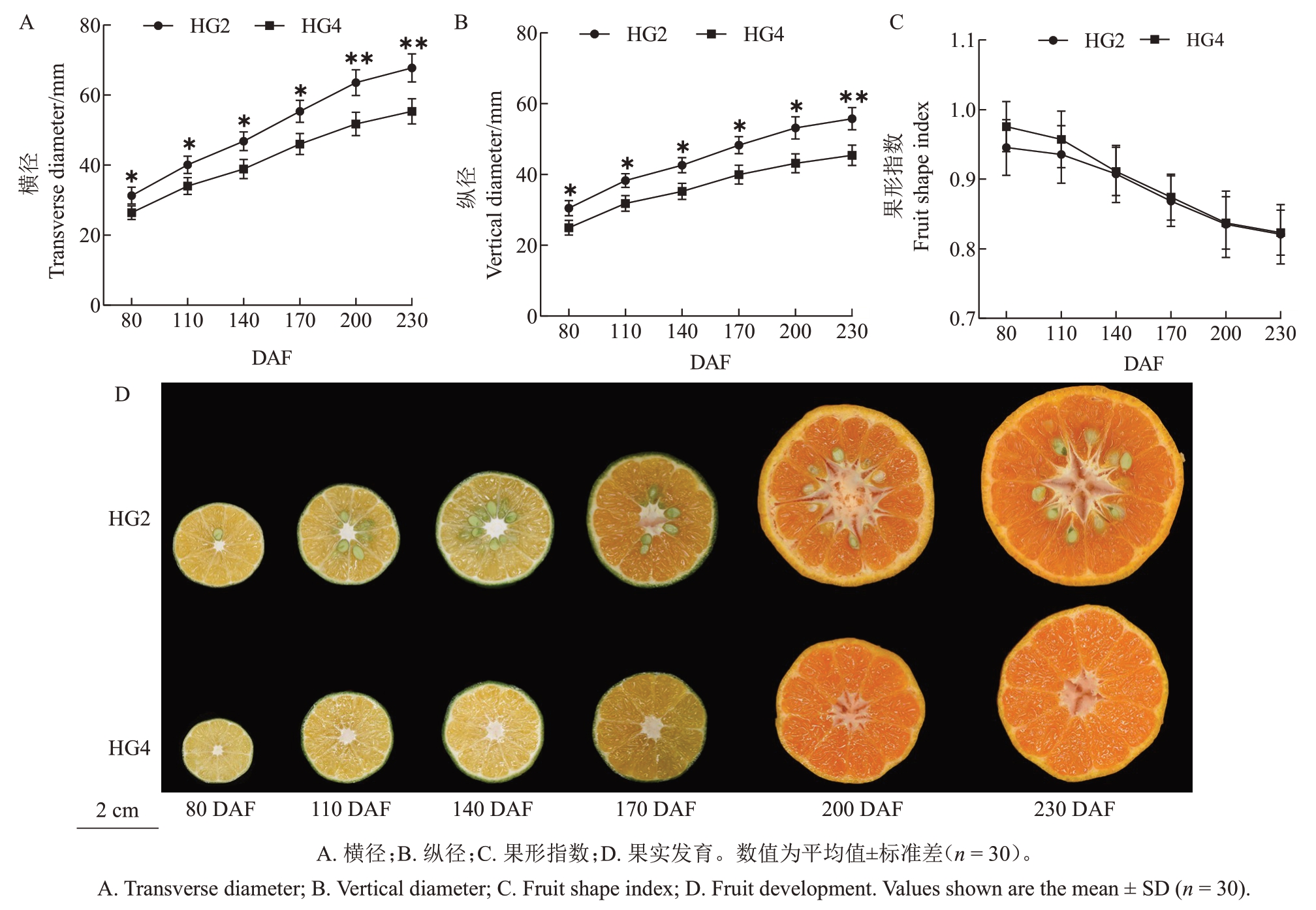
图2 HG4 和HG2 果实发育动态
Fig.2 Dynamics of HG4 and HG2 fruit development
2.2 HG4与HG2植物内源激素含量分析
为探究植物内源激素含量对HG4 果实发育的影响,测定HG4和HG2在15 DBF至45 DAF的幼果植物内源激素含量(图3)。结果显示,HG2 与HG4在15 DBF至45 DAF的幼果内源激素IAA、GA3和Zeatin含量整体呈先上升后下降趋势。其中,在45 DAF时HG2 生长素含量(w)为290.21 ng∙g-1 显著高于HG4 的117.08 ng∙g-1。在25 DAF 时HG2 的GA3含量达到峰值(2.27 ng∙g-1),而HG4 的GA3含量仅为0.90 ng∙g-1,两者差异显著。在25 DAF 和45 DAF,HG2的GA3和Zeatin激素含量均高于HG4。
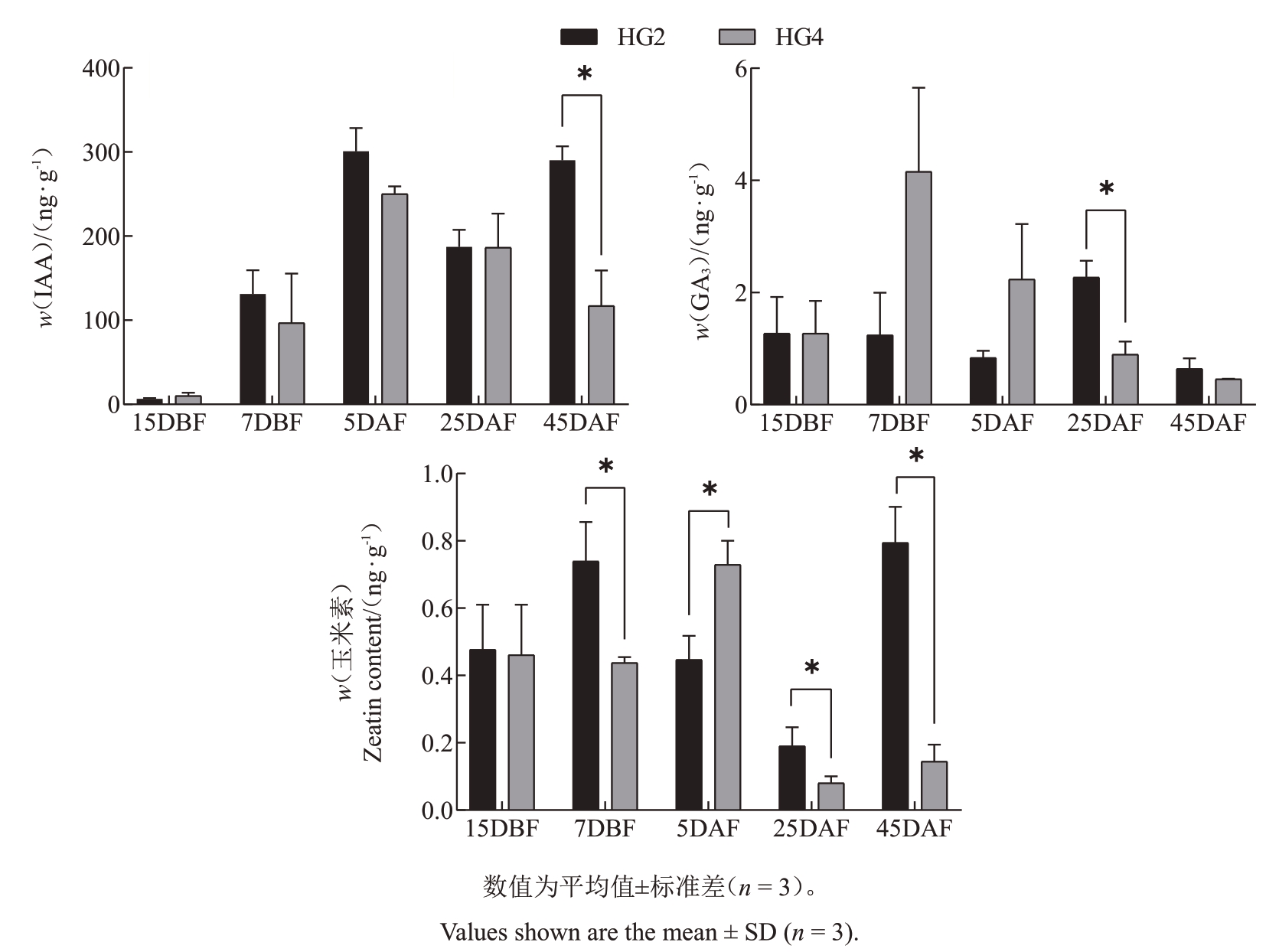
图3 HG4 和HG2 不同时期的植物激素含量
Fig.3 Phytohormone content at different stages of HG4 and HG2
2.3 转录组分析鉴定HG4与HG2细胞分裂期差异表达基因
通过测定HG4和HG2幼果植物内源激素含量发现,HG4的幼果内源激素含量在25 DAF和45 DAF均低于HG2。因此,为进一步探究HG4果实大小发育的影响因子,对25 DAF和45 DAF两个时期的HG4和HG2幼果进行转录组测序,并对其进行功能分析。
2.3.1 差异表达基因鉴定 对25 DAF和45 DAF的HG4 和HG2 幼果的转录组数据进行主成分分析和样品相关性分析,结果表明样品的重复性较好(图4)。HG4和HG2在25 DAF的转录组比较共鉴定到829个差异表达基因,其中434个上调表达,395个下调表达;45 DAF的转录组比较共鉴定到480个差异表达基因,其中318个上调表达,162个下调表达(表2)。两组材料25 DAF和45 DAF转录组均差异表达的基因共173个(图5-A)。为了鉴定参与果实大小发育的调控因子,在该173 个差异基因中,预测了其中具有编码转录因子能力的差异基因。通过对比拟南芥(Arabidopsis)同源基因,鉴定到了3个ERF转录因子(Ciclev10005820m、Ciclev10005863m、Ciclev10021265m),2 个 MADS 转录因子(Ciclev10016394m、Ciclev10032489m),1 个GRF转录因子Ciclev10025855m 和1 个ADAP 转录因子Ciclev10025985m(图5-B)。这7个候选转录因子可能参与HG4果实大小的调控。
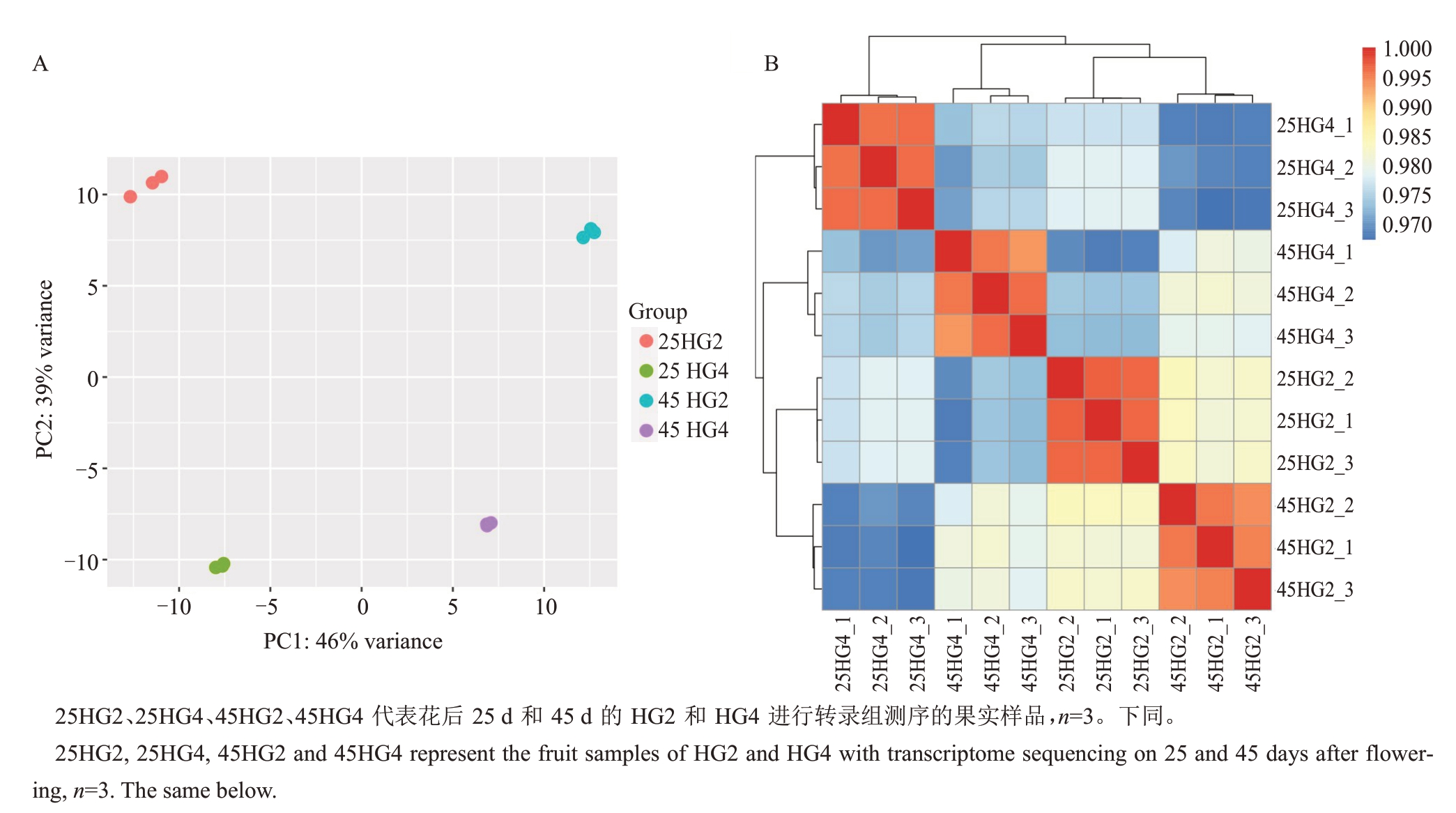
图4 HG4 和HG2 样品重复性(A)与相关性分析(B)
Fig.4 Analysis of sample repeatability(A)and correlation(B)in HG4 and HG2
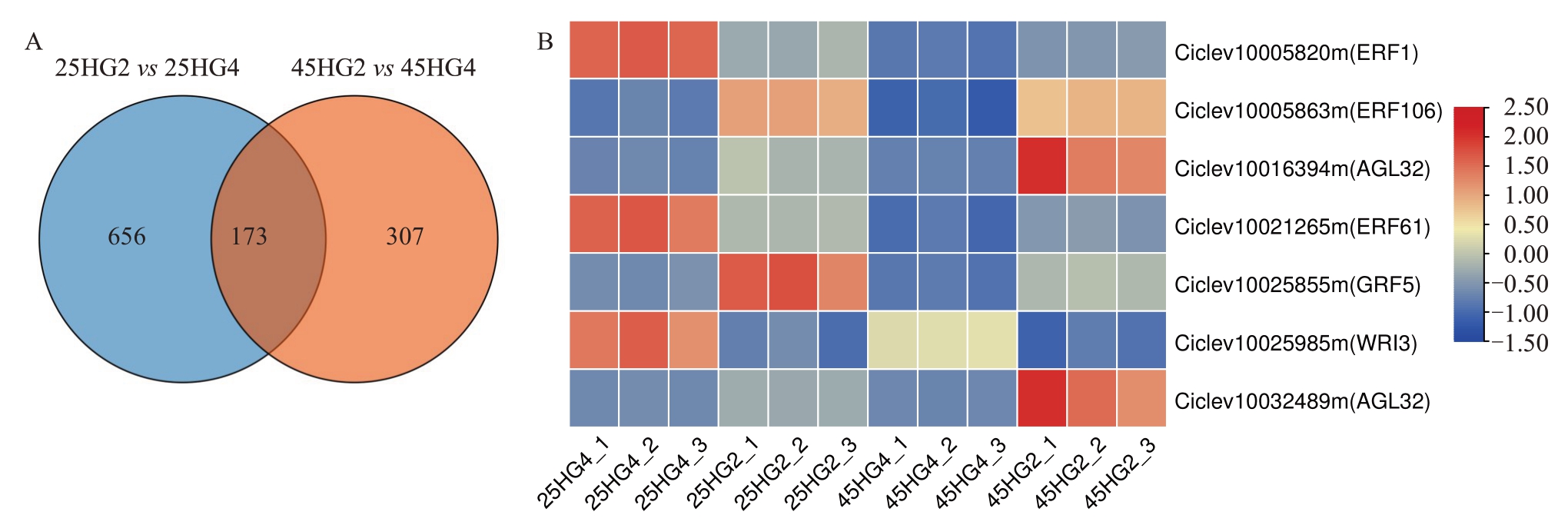
图5 HG4 和HG2 不同发育时期差异表达基因筛选(A)及鉴定(B)
Fig.5 Screen(A)and identification(B)of DEGs in HG4 and HG2 at different developmental stages
表2 HG4 和HG2 不同发育时期差异表达基因数
Table 2 Number of DEGs in HG4 and HG2 at different developmental stages

花后时间Time after anthesis/d 25 45差异表达基因数Number of DEGs 829 480上调表达基因数Number of up-regulated genes 434 318下调表达基因数Number of down-regulated genes 395 162
2.3.2 差异表达基因GO 注释和KEGG 通路富集分析 为了进一步了解HG4和HG2幼果不同发育时期差异基因的生物学功能,对25 DAF和45 DAF幼果转录组均差异表达的173个差异表达基因进行GO注释分析,鉴定到的差异表达基因主要参与细胞葡聚糖代谢、细胞发育、碳水化合物代谢、生殖系统发育等多种生物学过程,这些差异表达基因主要集中在细胞壁、细胞外周、外部封装结构等部位上发挥作用,分子功能主要包括单加氧酶活性、氧化还原酶活性等(图6-A)。进一步将25 DAF和45 DAF差异表达的173个基因进行KEGG 通路富集分析,结果表明差异表达基因富集到植物激素信号转导、细胞色素P450、类脂物代谢、苯丙素生物合成、氨基酸代谢等多个代谢路径上(图6-B)。

图6 HG4 和HG2 不同发育时期差异表达基因GO(A)、KEGG(B)分析
Fig.6 GO(A)and KEGG(B)analysis of DEGs in HG4 and HG2 at different stages of development
2.3.3 HG4 与HG2 内源激素代谢通路相关基因表达分析 通过转录组数据分析植物内源激素合成通路上5个基因的差异表达来探究植物内源激素对果实膨大的影响,如图7所示,包括生长素合成通路上YUC 的同源基因(CmYUC10、CmYUC11),赤霉素合成通路上GA20ox 的同源基因(CmGA20ox1、CmGA20ox5),细胞分裂素合成通路上的基因(CmIPT2)。发现HG4 生长素、赤霉素和细胞分裂素合成通路上的基因表达水平整体相较于HG2 偏低,这与细胞分裂期植物内源激素含量测定的结果相符。在25 DAF 和45 DAF 时,HG4 和HG2 的CmGA20ox5 的表达模式与GA20ox1 的相对表达水平一致,并且HG4赤霉素合成通路上的基因表达水平显著低于HG2,这表明赤霉素含量对HG4果实膨大的影响可能更大。
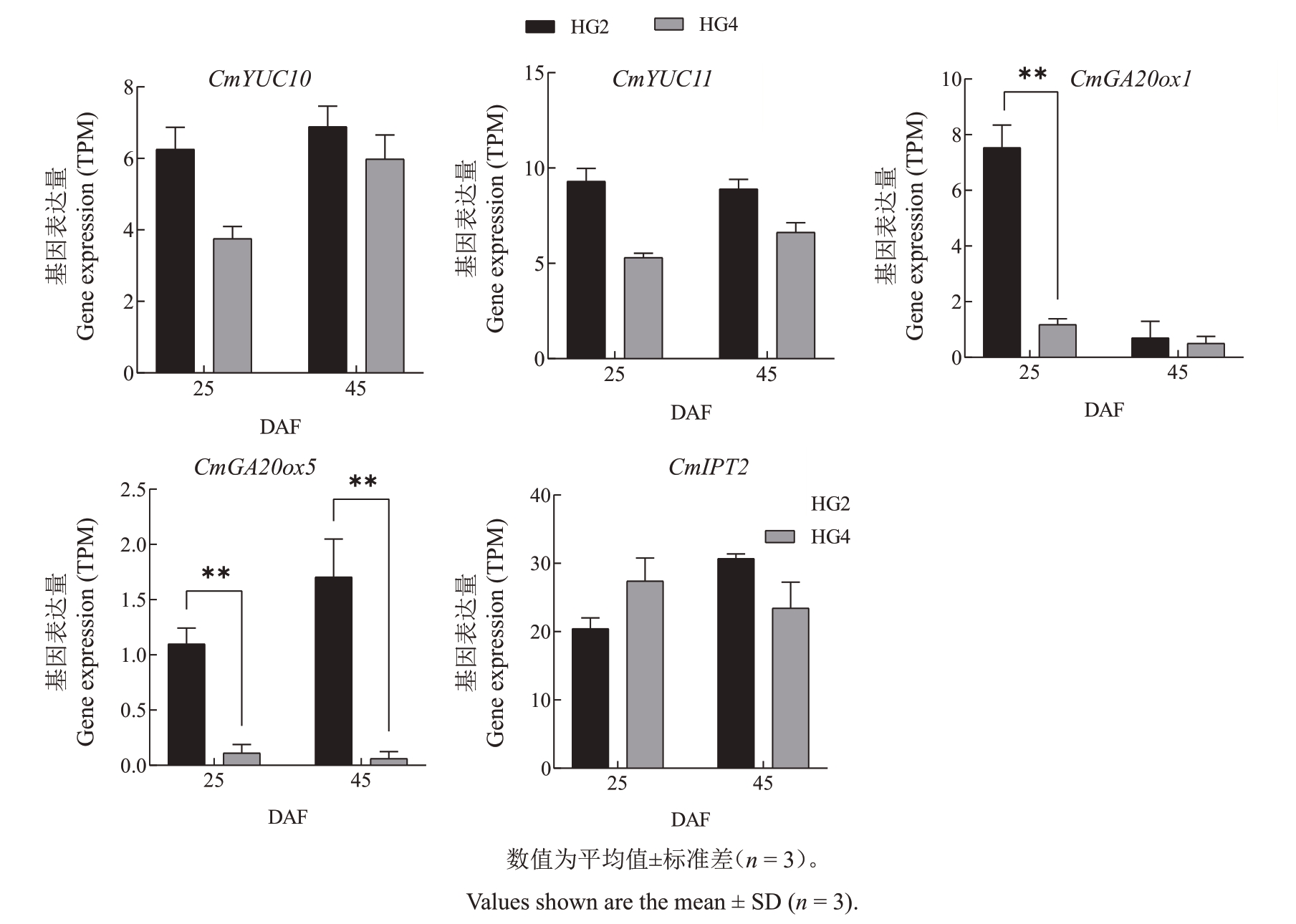
图7 HG4 和HG2 内源激素代谢通路相关基因差异表达
Fig.7 Expression of genes related to endogenous hormone metabolic pathways of HG4 and HG2
2.4 HG4结果母枝粗度与果实横径的关系
果实成熟期测量果实横径及对应的结果母枝粗度(图8),果实横径<65 mm、65~70 mm、>70 mm对应的结果母枝平均粗度分别为1.98、2.39、2.94 mm;果实横径<65 mm的结果母枝粗度最小值为1.56 mm,最大值为2.1 mm,果实横径为65~70 mm 的结果母枝粗度最小值为2.1 mm,最大值为2.52 mm,果实横径>70 mm的结果母枝粗度最小值为2.22 mm,最大值为3.49 mm。由此得出结论,结果母枝粗度与果实横径呈正相关。
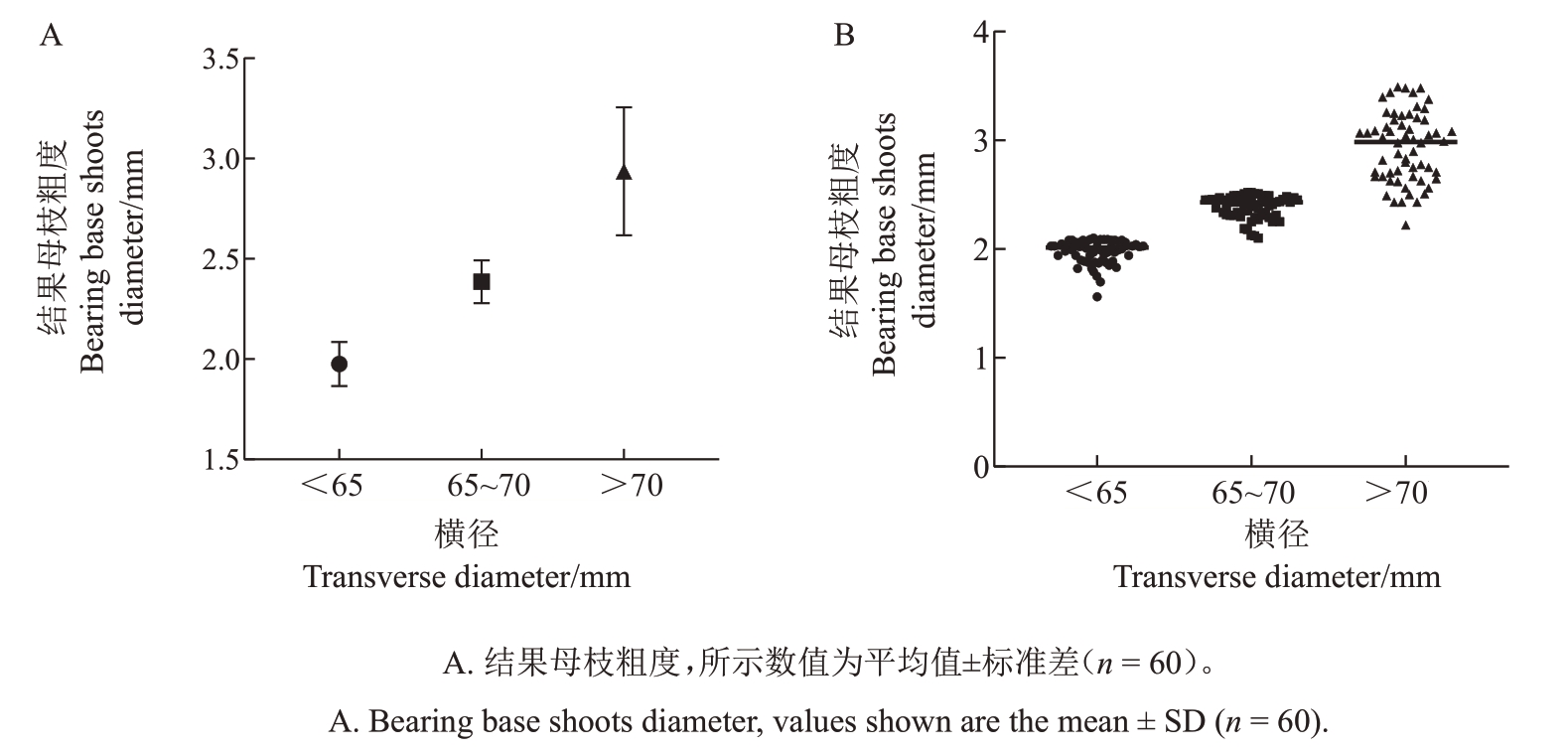
图8 HG4 结果母枝粗度对应的果实横径
Fig.8 Bearing base shoots diameter corresponds to transverse diameter of HG4
2.5 HG4结果高度与果实横径的关系
果实成熟期测量不同高度坐果部位的果实横径,同样将横径分为3个区间<65 mm、65~70 mm、>70 mm。如图9 所示,上部果实横径占比分别为20%、40%、40%,中部果实分别为48%、42%、10%,下部果实分别为58%、38%、4%;上、中、下部果实的平均横径分别为69.15、64.53、64.35 mm,上部基本不存在横径<60 mm 的果实。生长在上部的果实中,横径>70 mm的大果占比高达40%,小果比例只有20%,而生长在下部的果实中,横径>70 mm的大果仅有4%,小果占比高达58%。
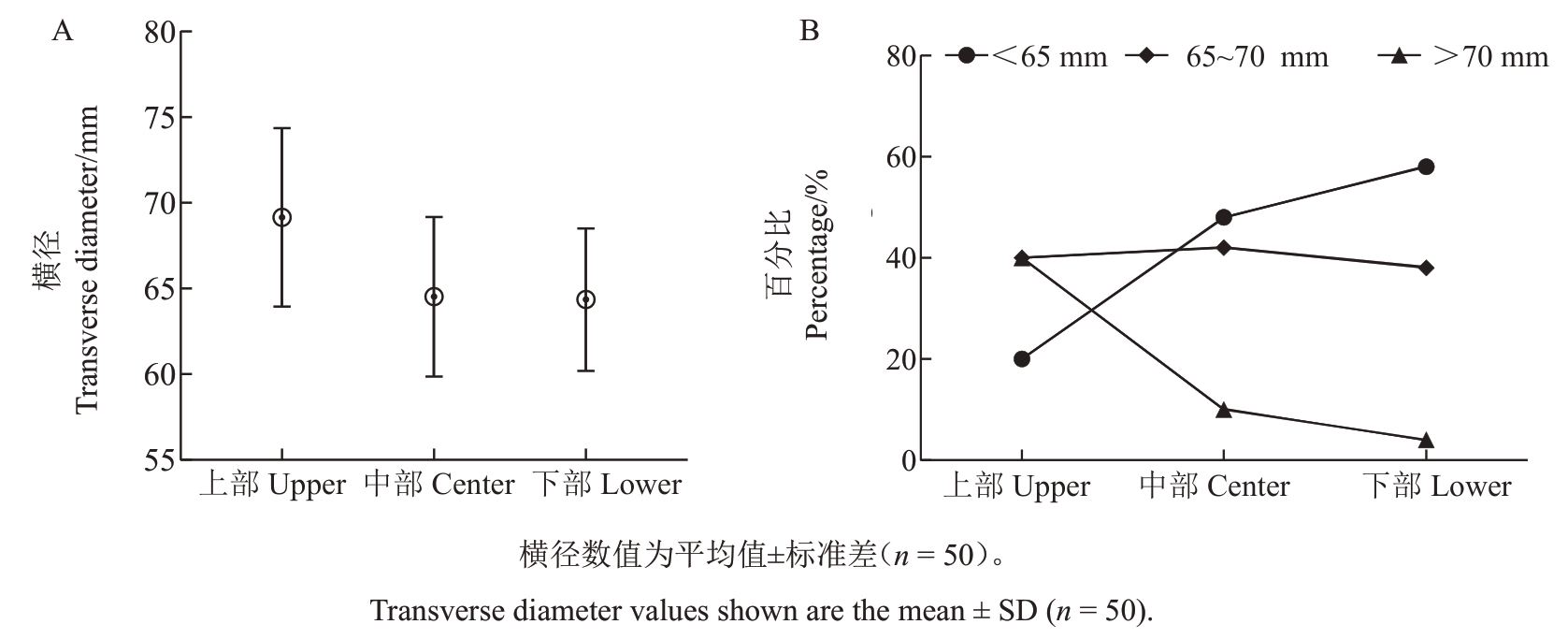
图9 HG4 不同高度坐果位置对应的果实横径(A)及分级占比(B)
Fig.9 Corresponding transverse diameter(A)and classification percentage(B)for different height of HG4 fruit set
3 讨 论
柑橘以果实为主要的收获器官,果实大小关联产量形成,是重要农艺性状之一[20]。果实膨大由细胞数量的增加和细胞形态的增大决定,这两者体现的是细胞分裂和细胞膨大能力[21]。在枇杷中,通过EjBZR1 基因间接影响细胞膨大从而调控果实大小[22]。黄瓜中CsHEC1可能通过介导细胞数量来促进黄瓜瓜把伸长[23]。前人以西瓜97103为研究对象,发现果实发育中期以细胞膨大为主,细胞面积与数目快速增长,单果质量生长速率在13 DAF 最高[8]。笔者在本研究中发现在15~45 DAF 幼果期HG4 和HG2的白皮层细胞层数持续增加且HG4白皮层的细胞层数始终小于HG2;15~45 DAF 幼果期HG4 和HG2的白皮层细胞密度持续减小且HG4白皮层细胞密度始终大于HG2。此后,80 DAF时HG4的横纵径分别比HG2小15.62%和18.13%,230 DAF果实成熟时HG4 的横纵径分别比HG2 小18.35%和18.53%,二者的大小差异更为明显。因此,HG4细胞膨大能力较弱,可能是导致HG4果实偏小的直接原因。
果实大小是由多基因控制的数量性状,如fw2.2、fw3.2、FAS 和WUS 等[24],其中fw2.2 是番茄上第一个被克隆与果实大小相关的基因,其贡献率达30%,通过控制心皮细胞的数量来调节植物器官中的细胞数量,从而影响番茄果实大小。笔者在本研究中通过对25 DAF 和45 DAF 的HG4 和HG2 幼果转录组进行分析,在两个材料两个时期均差异表达的基因共173个。转录调控是生物生长发育最核心的调控方式之一,转录因子通过结合目标基因启动子调控基因的转录,最终影响生物的性状[25-26]。在差异基因中鉴定到了7个候选转录因子可能参与HG4果实大小的调控,为今后的机制研究和栽培措施改进提供了方向。同时,为了进一步了解HG4和HG2幼果不同发育时期的差异基因的生物学功能,173个差异表达基因富集到植物激素信号转导、细胞色素P450、类脂物代谢、苯丙素生物合成、氨基酸代谢等多个代谢路径上。植物内源激素作为一种重要的调节物质,在植物开花、结实、子房发育、成熟、衰老、脱落等生理过程中发挥着重要作用[27]。本研究结果表明HG4 与HG2 的幼果内源激素IAA、GA3和Zeatin含量整体呈先上升后下降趋势,花后25 d和45 d HG2幼果内源激素始终高于HG4。同时,通过转录组分析发现HG4 内源激素合成通路上的CmYUC10、CmYUC11、CmGA20ox1、CmGA20ox5、CmIPT2 基因表达水平整体相较于HG2 更低,这与前期测定内源激素含量的结果一致。其中,HG4赤霉素合成通路上GA20ox的同源基因CmGA20ox1和CmGA20ox5基因表达水平极显著低于HG2。因此,细胞分裂期低含量的赤霉素可能是影响HG4 幼果发育的主要因素。前人研究发现,在低温条件下CmGA20ox1 和CmLFY 可能参与低温诱导菊花的开花提前[28],然而在拟南芥[29]和南瓜[30]中过量表达CmGA20ox1,则导致开花晚、叶片偏小、植株矮化。
结果母枝粗度对果实大小和品质影响较大。将猕猴桃结果母枝粗度范围划分为5 个等级,粗度在10~12 mm 时果实纵横径和单果质量最大,粗度在8~10 mm 时果实内在品质最佳[31]。苏受婷等[32]将南丰蜜橘的结果母枝划分为4 个等级,粗度在2.5~3.0 mm 的果实品质最差,等权情况下粗度2.5 mm以下的果实品质最佳,因纵横径和单果质量的权重高,加权情况下粗度3.5 mm以上的果实最优。HG4结果母枝粗度在1.56~3.49 mm,粗度≤2.00 mm的果实偏小,粗度在2.00~3.00 mm 的果实适中,粗度≥3.00 mm 的果实偏大,结果母枝粗度与果实横径成正比例关系,这与前人结果一致[32]。同时,笔者在本研究中通过田间调查统计分析发现,位于HG4树下部的果实偏小,其中横径<65 mm 果实占58%,横径>70 mm的大果仅有4%;而位于树上部的果实整体偏大,横径>65 mm的果实占比为80%,其中横径>70 mm 的大果为40%。因此,树上部果实横径偏大(69.15 mm),下部果实横径偏小(64.35 mm)。这可能与不同冠层的温度、光合产物供给差异有关。
4 结 论
通过田间数据统计分析、激素含量测定及转录组分析等手段发现HG4果实发育早期激素代谢通路基因低表达影响其内源激素含量变化,可能是果实较小的内在原因,同时发现HG4结果母枝粗度和结果高度也是影响其果实大小的重要因素。笔者在本研究中分析了生长素、赤霉素和细胞分裂素的含量及其合成通路上相关基因的差异表达对HG4果实发育的影响,但激素之间存在着复杂的相互串扰作用,信号通路复杂,未来可结合转录组和代谢组等多组学的手段进一步探究柑橘果实发育机制。
[1] 邓秀新.柑橘产业发展趋势与桂林柑橘品种结构调整[J].南方园艺,2020,31(6):1-4.DENG Xiuxin.The development trend of citrus industry and the adjustment of citrus variety structure in Guilin[J].Southern Horticulture,2020,31(6):1-4.
[2] 吴巨勋,张雅菁,伊华林,谢宗周,邓秀新.无核柑橘新品种华柑4 号的选育[J].果树学报,2022,39(3):495-498.WU Juxun,ZHANG Yajing,YI Hualin,XIE Zongzhou,DENG Xiuxin. Breeding report of a new seedless ponkan cultivar Huagan No.4[J].Journal of Fruit Science,2022,39(3):495-498.
[3] STANDER O P J. Fruit split and fruit size studies on citrus[D].Stellenbosch:Stellenbosch University,2013.
[4] SADKA A,SHLIZERMAN L,KAMARA I,BLUMWALD E.Primary metabolism in citrus fruit as affected by its unique structure[J].Frontiers in Plant Science,2019,10:1167.
[5] 丁常笑.Zn(NO3)2与NAA 影响‘红江橙’果皮解剖结构及陷痕果发生的研究[D].广州:华南农业大学,2016.DING Changxiao.Effect of Zn(NO3)2 and NAA on peel anatomical structure and mechanism of creasing in‘Hongjiangcheng’orange[D]. Guangzhou:South China Agricultural University,2016.
[6] MU Q,HUANG Z J,CHAKRABARTI M,ILLA-BERENGUER E,LIU X X,WANG Y P,RAMOS A,VAN DER KNAAP E. Fruit weight is controlled by cell size regulator encoding a novel protein that is expressed in maturing tomato fruits[J].PLoS Genetics,2017,13(8):e1006930.
[7] 郭勤卫.黄瓜果实发育相关的基因克隆与表达及蛋白组学分析[D].南京:南京农业大学,2013.GUO Qinwei. Cloning and expression of genes and proteomic analysis in cucumber fruit development[D]. Nanjing:Nanjing Agricultural University,2013.
[8] 袁静贤.生长素相关转录因子家族基因在西瓜果实膨大过程中的调控作用分析[D].武汉:华中农业大学,2015.YUAN Jingxian. Regulation analysis of auxin-related transcription factor family genes on watermelon fruit expansion[D]. Wuhan:Huazhong Agricultural University,2015.
[9] DEVOGHALAERE F,DOUCEN T,GUITTON B,KEELING J,PAYNE W,LING T J,ROSS J J,HALLETT I C,GUNASEELAN K,DAYATILAKE G A,DIAK R,BREEN K C,TUSTIN D S,COSTES E,CHAGNÉ D,SCHAFFER R J,DAVID K M.A genomics approach to understanding the role of auxin in apple(Malus × domestica) fruit size control[J]. BMC Plant Biology,2012,12(1):7.
[10] LIU X X,PAN Y P,LIU C,DING Y Y,WANG X,CHENG Z H,MENG H W. Cucumber fruit size and shape variations explored from the aspects of morphology,histology,and endogenous hormones[J].Plants,2020,9(6):772.
[11] ZHAO J Y,JIANG L,CHE G,PAN Y P,LI Y Q,HOU Y,ZHAO W S,ZHONG Y T,DING L,YAN S S,SUN C Z,LIU R Y,YAN L Y,WU T,LI X X,WENG Y Q,ZHANG X L.A functional allele of CsFUL1 regulates fruit length through repressing CsSUP and inhibiting auxin transport in cucumber[J]. The Plant Cell,2019,31(6):1289-1307.
[12] 姬雅静,李金焱,张沛宇,马力群,朱鸿亮.番茄果实形状的调控机制研究进展[J].园艺学报,2023,50(9):2015-2030.JI Yajing,LI Jinyan,ZHANG Peiyu,MA Liqun,ZHU Hongliang.Research progress on the regulatory mechanism of shape formation in tomato fruit[J]. Acta Horticulturae Sinica,2023,50(9):2015-2030.
[13] NARDOZZA S,COONEY J,BOLDINGH H L,HEWITT K G,TROWER T,JONES D,THRIMAWITHANA A H,ALLAN A C,RICHARDSON A C.Phytohormone and transcriptomic analysis reveals endogenous cytokinins affect kiwifruit growth under restricted carbon supply[J].Metabolites,2020,10(1):23.
[14] ZHANG H Y,TAN J,ZHANG M,HUANG S P,CHEN X.Comparative transcriptomic analysis of two bottle gourd accessions differing in fruit size[J].Genes,2020,11(4):359.
[15] 王蓉.柑橘胞质杂种‘华柚2 号’雄性不育的生理特征及CsmiR399a.1 调控雄性不育的作用机理[D]. 武汉:华中农业大学,2021.WANG Rong. Physiologcal characterization of male sterility in somatic cybrid G1 + HBP and regulatery mechanism of CsmiR399a.1 in citrus male sterility[D]. Wuhan:Huazhong Agricultural University,2021.
[16] PAN X Q,WELTI R,WANG X M.Quantitative analysis of major plant hormones in crude plant extracts by high-performance liquid chromatography-mass spectrometry[J]. Nature Protocols,2010,5(6):986-992.
[17] PERTEA M,KIM D,PERTEA G M,LEEK J T,SALZBERG S L.Transcript-level expression analysis of RNA-seq experiments with HISAT,StringTie and Ballgown[J]. Nature Protocols,2016,11(9):1650-1667.
[18] LOVE M I,HUBER W,ANDERS S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2[J].Genome Biology,2014,15(12):550.
[19] CHEN C J,CHEN H,ZHANG Y,THOMAS H R,FRANK M H,HE Y H,XIA R. TBtools:An integrative toolkit developed for interactive analyses of big biological data[J]. Molecular Plant,2020,13(8):1194-1202.
[20] 彭澳林,郑蓉,舒波,罗纯.园艺植物果实大小调控机制研究进展[J/OL]. 分子植物育种,2025:1-20. (2025-01-07). https://link.cnki.net/urlid/46.1068.S.20250107.1530.006.PENG Aolin,ZHENG Rong,SHU Bo,LUO Chun. Research progress on molecular regulation of fruit size in horticultural plants[J/OL].China Industrial Economics,2025:1-20.(2025-01-07).https://link.cnki.net/urlid/46.1068.S.20250107.1530.006.
[21] GAN L J,SONG M Y,WANG X C,YANG N,LI H,LIU X X,LI Y. Cytokinins is involved in regulation of tomato pericarp thickness and fruit size[J]. Horticulture Research,2022,9:uhab041.
[22] SU W B,SHAO Z K,WANG M,GAN X Q,YANG X H,LIN S Q.EjBZR1 represses fruit enlargement by binding to the EjCYP90 promoter in loquat[J].Horticulture Research,2021,8(1):152.
[23] WANG Z Y,ZHOU Z Y,WANG L M,YAN S S,CHENG Z H,LIU X F,HAN L J,CHEN G X,WANG S Y,SONG W Y,CHEN J C,LIU L,SONG X F,YAN L Y,ZHAO J Y,ZHANG X L.The CsHEC1-CsOVATE module contributes to fruit neck length variation via modulating auxin biosynthesis in cucumber[J].Proceedings of the National Academy of Sciences of the United States of America,2022,119(39):e2209717119.
[24] FRARY A,NESBITT T C,GRANDILLO S,KNAAP E,CONG B,LIU J,MELLER J,ELBER R,ALPERT K B,TANKSLEY S D.fw2.2:A quantitative trait locus key to the evolution of tomato fruit size[J].Science,2000,289(5476):85-88.
[25] 唐征,陈思雀,徐谦,钟伟杰,刘庆,朱世杨.AP2/ERF 在青花菜苗期响应黑腐病的功能研究[J]. 园艺学报,2024,51(11):2523-2539.TANG Zheng,CHEN Sique,XU Qian,ZHONG Weijie,LIU Qing,ZHU Shiyang. Functional study of AP2/ERF in response to black rot at broccoli seedling stage[J].Acta Horticulturae Sinica,2024,51(11):2523-2539.
[26] 刘逸婷,王汝鑫,张海梦,井朋伟,史巧芳,赵晓春,余义和.葡萄VlCKX5 基因的表达特性及转录调控分析[J/OL]. 果树学报,2024:1-21. (2024-11-19). https://doi.org/10.13925/j.cnki.gsxb.20240493.LIU Yiting,WANG Ruxin,ZHANG Haimeng,JING Pengwei,SHI Qiaofang,ZHAO Xiaochun,YU Yihe. Expression characteristics and transcriptional regulation analysis of VlCKX5 gene in grape[J/OL]. Journal of Fruit Science,2024:1-21. (2024-11-19).https://doi.org/10.13925/j.cnki.gsxb.20240493.
[27] HOU Y M,LI H X,ZHAI L L,XIE X,LI X Y,BIAN S M.Identification and functional characterization of the Aux/IAA gene VcIAA27 in blueberry[J]. Plant Signaling & Behavior,2020,15(1):1700327.
[28] LYU J,AIWAILI P,GU Z Y,XU Y J,ZHANG Y H,WANG Z L,HUANG H F,ZENG R H,MA C,GAO J P,ZHAO X,HONG B. Chrysanthemum MAF2 regulates flowering by repressing gibberellin biosynthesis in response to low temperature[J].The Plant Journal,2022,112(5):1159-1175.
[29] RADI A,LANGE T,NIKI T,KOSHIOKA M,LANGE M J P.Ectopic expression of pumpkin gibberellin oxidases alters gibberellin biosynthesis and development of transgenic Arabidopsis plants[J].Plant Physiology,2006,140(2):528-536.
[30] CURTIS I S,WARD D A,THOMAS S G,PHILLIPS A L,DAVEY M R,POWER J B,LOWE K C,CROKER S J,LEWIS M J,MAGNESS S L,HEDDEN P.Induction of dwarfism in transgenic Solanum dulcamara by over-expression of a gibberellin 20-oxidase cDNA from pumpkin[J]. The Plant Journal,2000,23(3):329-338.
[31] 易淑瑶,刘青,贾东峰,李亦淇,黄春辉,钟敏,廖光联,徐小彪.不同结果母枝粗度对‘东红’猕猴桃果实品质的影响[J].中国南方果树,2020,49(4):122-126.YI Shuyao,LIU Qing,JIA Dongfeng,LI Yiqi,HUANG Chunhui,ZHONG Min,LIAO Guanglian,XU Xiaobiao. Influence of bearing base shoots with a diameter on fruit quality of‘Donghong’kiwifruit[J].South China Fruits,2020,49(4):122-126.
[32] 苏受婷,魏清江,宁少君,廖晓娜,马张正,辜青青.结果母枝粗度对南丰蜜橘果实品质的影响[J].江西农业大学学报,2018,40(5):932-940.SU Shouting,WEI Qingjiang,NING Shaojun,LIAO Xiaona,MA Zhangzheng,GU Qingqing.Effects of bearing base shoot diameter on fruit quality of Nanfeng tangerine[J]. Acta Agriculturae Universitatis Jiangxiensis,2018,40(5):932-940.