作为植物细胞骨架的重要组成部分,微管(microtubule)对植物组织形态建成、生长发育、胞内物质运输、信号转导等方面均有至关重要的作用[1-2]。微管是高度动态变化的25 nm 管状结构,主要由α-微管蛋白(α-tubulin,TUA)和β-微管蛋白(β-tubulin,TUB)异源二聚体组成。自1987年微管蛋白被鉴定后,已发现α-微管蛋白和β-微管蛋白通常由多个家族基因编码:拟南芥有6个AtTUAs和9个AtTUBs[3];水稻有4 个OsTUAs 和8 个OsTUBs[4-6];杨树有8 个PtrTUAs和20个PtrTUBs[7],龙眼已鉴定到6个DlTUAs和9 个DlTUBs[8]。植物不同组织在不同的发育阶段,可以选择性地表达一个或多个微管蛋白家族成员,进而聚合形成不同稳定性和排列的微管阵列,调控植物组织生长发育和抗逆性[1,9-11]。如棉花Gh-TUB6 和GhTUB1 分别在纤维细胞起始和伸长时期高度表达;而在纤维发育后期,GhTUB7特异性高表达[12-14]。此外,异常表达微管蛋白基因,常常引起微管的结构和排列变化,最终影响植物的生长发育和抗逆性[9-10]。例如,大豆α-微管蛋白的点突变体it1导致大豆株高降低,株型紧凑[15];拟南芥α-微管蛋白tua6突变体引起下胚轴表皮细胞内微管呈斜向甚至纵向排列,抑制下胚轴细胞的纵向伸长,促进细胞横向扩张,最终导致产生更短更粗的下胚轴[16];玉米αtubulin4 基因点突变体ZmDos1 微管排列的方向发生改变,从而引起原生木质部导管次生壁沉积方向变成螺旋形,最终影响其耐旱性[17]。
苹果(Malus domestica Borhk.)是中国最重要的落叶果树之一,其种植面积和产量均居全国首位。苹果矮化密植具有早花、易于管理等优点,苹果栽培模式正由传统的乔化稀植向矮化密植发展。在生产上主要利用矮化砧木或者矮生品种来实现矮化密植,苹果矮化或矮生的机制研究多集中在激素调控领域,普遍认为激素调控树体节间的细胞分裂和细胞伸长,从而调控矮化或矮生[18-20]。而从植物细胞生长发育来看,微管的排列决定了细胞的伸长和分裂,也是调控植物矮化的中心,而且大部分激素都通过调节微管的排列来促进或抑制细胞的伸长[1,21-22],但微管调控苹果矮化或矮生的相关研究鲜有报道。因此,笔者在本研究中鉴定了苹果β-微管蛋白家族基因,对其进行系统进化树、基因结构分析等生物信息学分析,并通过RT-qPCR 明确其在苹果不同组织及不同砧木中的表达模式,为进一步探究苹果β-微管蛋白家族基因的功能奠定基础。
1 材料和方法
1.1 植物材料
选取种植于河南农业大学毛庄苹果试验基地的矮化砧木T337、Pamajul、JM7,乔化砧木楸子(M.prunifolia)、西府海棠(M. micromalus)、平邑甜茶(M. hupehensis)和柱形苹果润太一号为试验材料,在同一时期选取1年生枝条的木质部、韧皮部、成熟叶片、幼嫩叶片和茎尖等组织部位,将采集好的样品用锡箔纸包裹,液氮速冻后运送至实验室,存放于-80 ℃的超低温冰箱中,以备后续使用。
1.2 试验方法
1.2.1 苹果MdTUBs家族基因的鉴定与分析 利用Pfam数据库(http://pfam-legacy.xfam.org)获得TUBs家族基因保守结构域Pfam 登录号:PF00091/PF03953,通过隐马尔可夫模型(hidden markov model,HMM)在苹果基因组数据库(https://www.rosaceae.org)中搜索所有含有该结构域且E-value<1e-7的基因序列;同时以拟南芥中9个AtTUBs基因的序列为模板鉴定苹果MdTUBs 基因,在苹果基因组数据库网站中进行比对筛选并命名。利用MEGA11 软件将苹果与其他植物的TUBs 基因家族成员氨基酸序列进行序列比对,使用TBtools 软件构建邻接系统发育树,boortstrap复制为1000,最后使用iTOL(https://itol.embl.de)在线工具进行美化。利用MEMEsuite(https://meme-suite.org/meme/tools/meme)在线工具对苹果MdTUBs 家族成员的保守基序(motif)进行分析,保守基序个数设为10个。根据下载的苹果MdTUBs的CDS序列与DNA全长序列,使用TBtools软件绘制基因结构图。
1.2.2 苹果MdTUBs家族的染色体定位及共线性分析 根据苹果基因组注释文件,利用TBtools获取染色体位置信息并绘制染色体位置分布图,对Md-TUBs 家族在进化过程中可能发生的基因复制事件,利用TBtools 软件One StepMCScanX-Super Fast等程序分析苹果MdTUBs 物种内共线性关系,并使用TBtools 软件的Advanced Circos 程序对结果进行可视化分析。
1.2.3 苹果MdTUBs 家族蛋白三维结构预测 将苹果MdTUBs 家族成员蛋白序列依次上传到蛋白质三维结构在线预测网站(Swiss-Model https://swissmodel.expasy.org),即可得到各成员的蛋白质三维预测结构。
1.2.4 苹果MdTUBs基因家族成员顺式作用元件分析 使用TBtools 软件从苹果全基因组序列中提取MdTUBs基因家族每个成员基因序列上游2000 bp区域的序列作为启动子序列,将其上传至在线预测网站PlantCare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测MdTUBs 基因家族启动子区域顺式作用元件,并使用TBtools 软件的Simple BioSequence Viewer 程序对预测的结果进行可视化作图。
1.2.5 植物RNA的提取和cDNA合成 将不同苹果砧木和润太一号苹果的各个组织的样品在液氮预冷的研钵中快速研磨成粉末状,分别取50~100 mg分装到2 mL 离心管内,用于提取总RNA。总RNA 按照华越洋RNA提取试剂盒(北京华越洋生物科技有限公司)试验操作说明提取,检测所提取的总RNA 浓度,采用1.2%的琼脂糖凝胶电泳对获得的总RNA样品检测后,按照HiScript ⅡQ RT SuperMix for qPCR(+gDNA wiper0)逆转录试剂盒(南京诺唯赞生物科技股份有限公司)说明书上的步骤进行逆转录获得cDNA,用于实时荧光定量PCR(RT-qPCR)分析。
1.2.6 RT-qPCR 分析 根据获得的13 个苹果β-tubulin的碱基序列,通过Primer Premier 5设计特异性的定量引物(表1),引物均由生工生物公司合成。RT-qPCR的反应体系(10 μL):5 μL SYBR Green PCRMaster mix,各0.5 μL 的正、反向引物,1 μL cDNA,3 μL ddH2O,利用荧光定量仪(北京酷搏科技有限公司)进行苹果β-tubulin各家族基因的表达量分析,以苹果Actin 为内参基因,采用2-△△CT法进行苹果β-tubulin各基因家族的定量分析[23]。
表1 定量引物的设计
Table 1 Design of quantitative PCR primers

基因名称Gene name MdTUB1 MdTUB2 MdTUB3 MdTUB4 MdTUB5 MdTUB6 MdTUB7 MdTUB8 MdTUB9 MdTUB10 MdTUB11 MdTUB12 MdTUB13引物序列-F(5'-3')Primer sequences-F(5'-3')CCTCACTCTCCAAAACCCTTCG TCAAATCCAACCGTTACGACC GGAGAGGGATCGAGGGACAA TAGCAGTTCAGTGGTCCGAA TGTACCCGTCCAAGTGGAGA ATATCCGCCCTCTTACTCCCT ACACCGACTTCGGATACACTC AACCCTAAAAGCGCAGCAGA GGTGCTTGATGAATCGTGCC AGCGCAGTGGTGTTTTAGGA TCTTACGCATCTTCCCCGTTT AGGAGGAAGAGCTGGAGGATT GCTGGAGAACTGAGGATTGGA引物序列-R(5'-3')Primer sequences-R(5'-3')CACTGGCCTCCCTGGATGTG AGGGTTAGGGTTTGGGGTCT ATCAATGCCAGAAAGCAAGCG AAACCCACCATCAAACAAAATGCAC CCAAGGCTCACAACTGAAGC CGATCTGGTTGCCGCATTG ACTTGGAGCCGATCTGGTTG CCAGAACTTGGAGCCGATCT ATACAAGGACCCCTCCCACA AGAAGTCTCGAAAAGATGGCTCA GTGTTACCGGTGTACTGCCC AACCCAAATCCCACGAATGGA TCCCTAAGAATGGGAAGGCT
1.2.7 数据分析与作图试验数据使用Microsoft Office Excel 进行统计,差异显著性分析使用SPSS软件进行单因素方差分析,使用Graphpad Prism 8.0软件绘制柱形图。
2 结果与分析
2.1 苹果MdTUBs基因家族成员鉴定与分析
利用隐马尔可夫模型(HMM)在苹果基因组数据库中搜索MdTUBs基因,并以拟南芥AtTUBs基因家族的氨基酸序列为参考,最终从苹果GDDH13 v1.1 基因组中鉴定到13 个MdTUBs 基因家族成员。根据其与拟南芥微管蛋白AtTUBs 的相似性,对苹果中的MdTUBs进行命名(表2)。通过分析发现,13个苹果β-微管蛋白的编码区碱基长度均在1332~1350 bp 之间,氨基酸长度在444~450 aa 之间;最长的MdTUBs 成员是MdTUB7、MdTUB8、MdTUB10和MdTUB11,分子质量介于49.92~50.46 ku。
表2 苹果MdTUBs 基因家族成员基本信息
Table 2 Basic information of apple β-tubulin gene family members
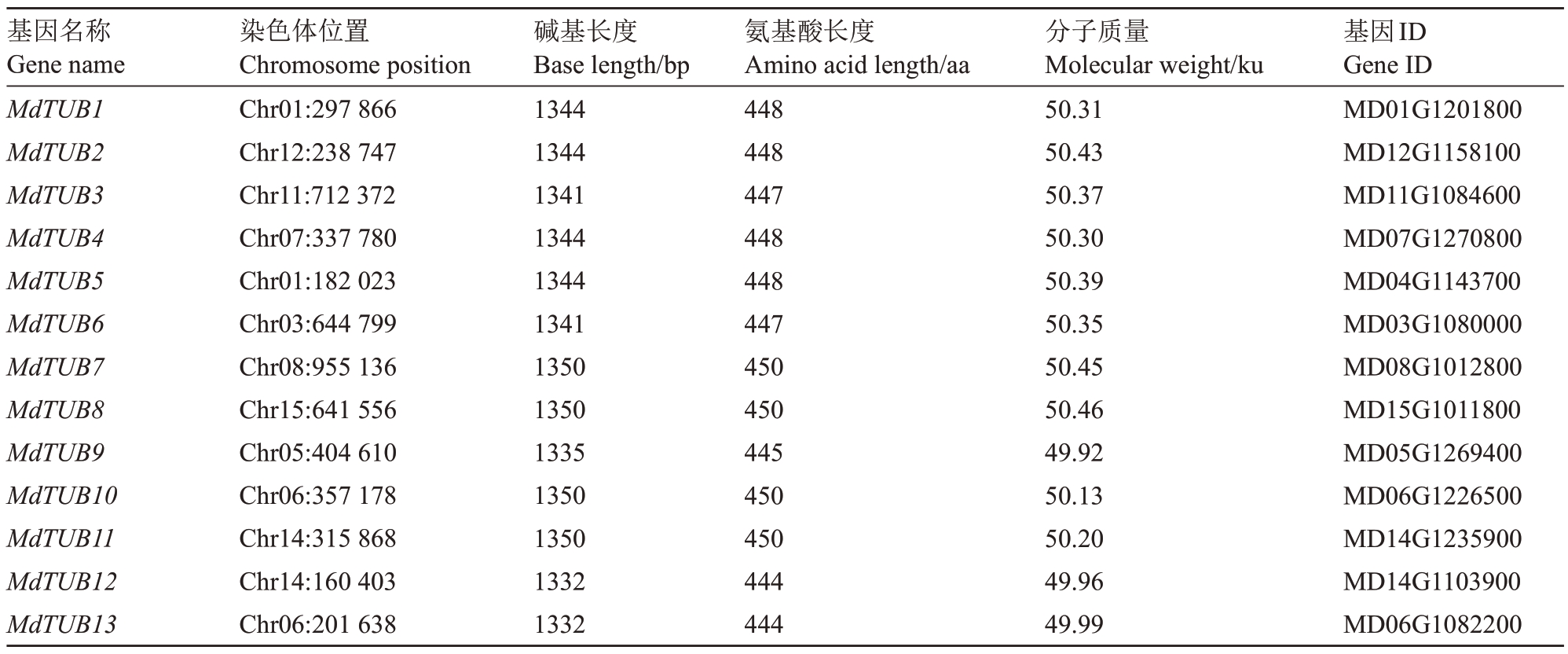
基因名称Gene name MdTUB1 MdTUB2 MdTUB3 MdTUB4 MdTUB5 MdTUB6 MdTUB7 MdTUB8 MdTUB9 MdTUB10 MdTUB11 MdTUB12 MdTUB13染色体位置Chromosome position Chr01:297 866 Chr12:238 747 Chr11:712 372 Chr07:337 780 Chr01:182 023 Chr03:644 799 Chr08:955 136 Chr15:641 556 Chr05:404 610 Chr06:357 178 Chr14:315 868 Chr14:160 403 Chr06:201 638碱基长度Base length/bp 1344 1344 1341 1344 1344 1341 1350 1350 1335 1350 1350 1332 1332氨基酸长度Amino acid length/aa 448 448 447 448 448 447 450 450 445 450 450 444 444分子质量Molecular weight/ku 50.31 50.43 50.37 50.30 50.39 50.35 50.45 50.46 49.92 50.13 50.20 49.96 49.99基因ID Gene ID MD01G1201800 MD12G1158100 MD11G1084600 MD07G1270800 MD04G1143700 MD03G1080000 MD08G1012800 MD15G1011800 MD05G1269400 MD06G1226500 MD14G1235900 MD14G1103900 MD06G1082200
2.2 苹果MdTUBs 家族成员染色体分布定位及共线性分析
为了将MdTUBs家族基因在苹果染色体上的位置可视化,利用生物信息学分析工具TBtools绘制了MdTUBs 家族成员在苹果的11 条染色体上的分布图(图1)。分析结果显示,13 个MdTUBs 基因家族成员不均匀地分布在11 个苹果染色体上,在6 号和14 号染色体上分布2 个,其余染色体上均分布1个。为探究苹果MdTUBs 基因家族的进化机制,对定位在染色体上的13 个MdTUBs 基因家族成员进行共线性分析(图2),通过MCscan 分析,鉴定了苹果MdTUBs 基因家族的串联重复和片段重复基因对,在同一染色体上距离小于200 kb 的紧密相关基因被定义为串联重复,其余的则被定义为片段重复[24]。苹果种内共线性分析发现,苹果MdTUBs 基因家族没有串联重复事件序列,但存在18个片段重复基因对,结果表明了片段重复在苹果MdTUBs 基因家族进化中起主导作用。
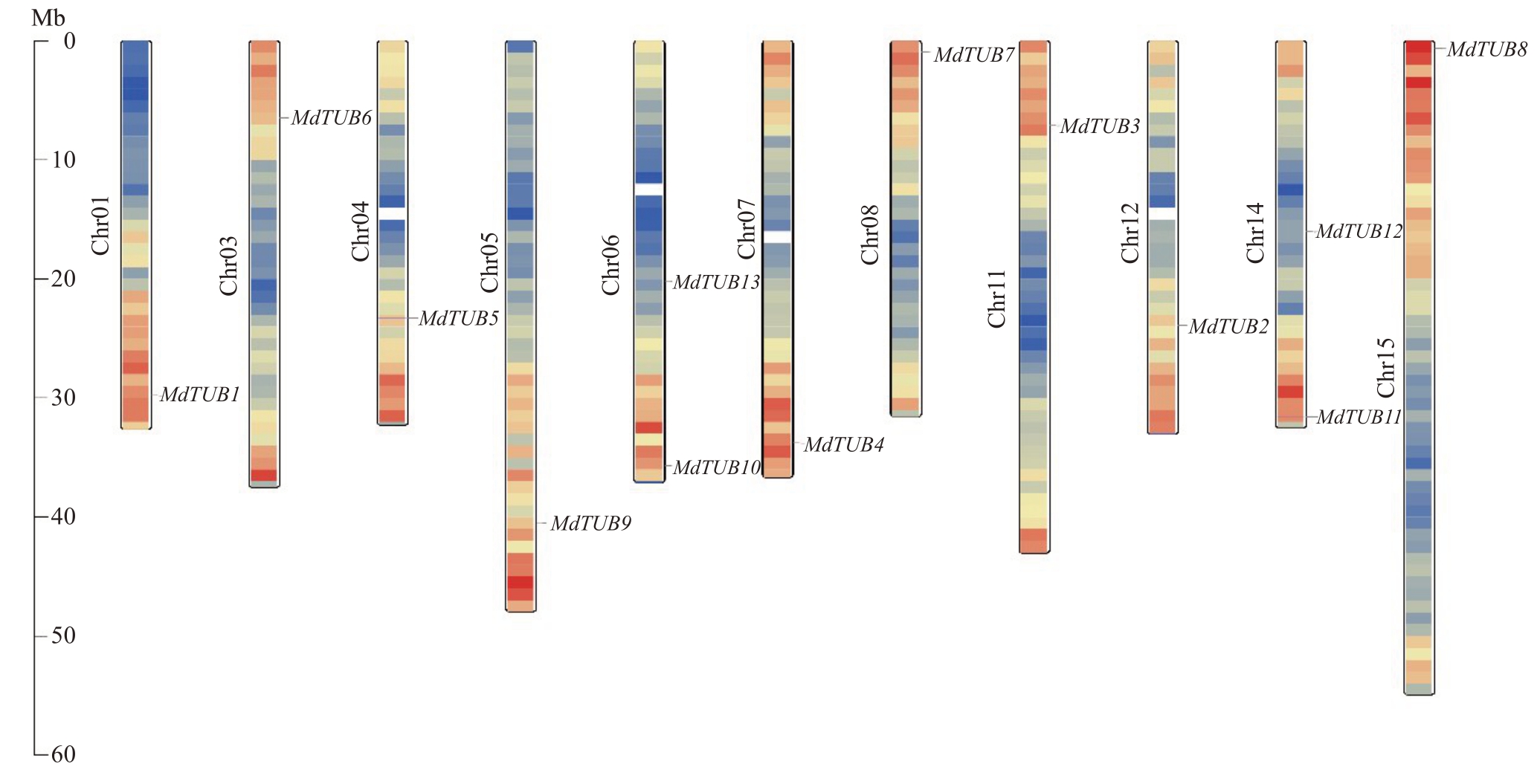
图1 苹果MdTUBs 家族基因在染色体上的分布
Fig.1 Chromosomal distribution of apple β-tubulin family genes
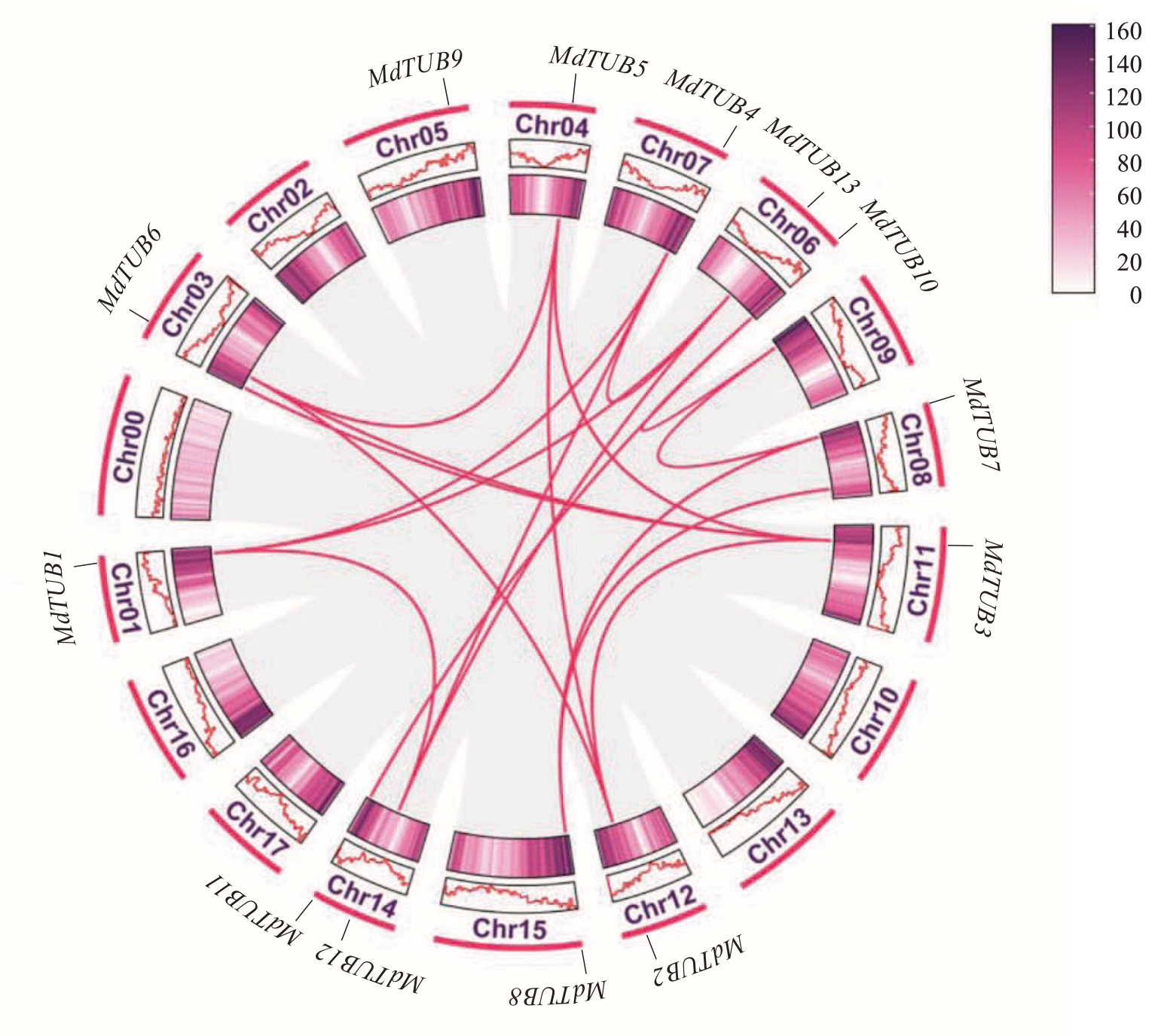
图2 苹果MdTUBs 基因家族成员间共线性分析
Fig.2 Collinearity analysis of β-tubulin gene family members in apple
2.3 苹果MdTUBs基因家族的进化树分析
使用MEGA11对来自苹果、拟南芥、牛筋草、陆地棉、苜蓿、水稻、狗尾草、马铃薯、小麦、玉米、百日菊等的TUBs家族成员构建系统进化树(图3),结果显示苹果MdTUBs 基因家族成员可以分为5 大类,除了MdTUB9之外,其余家族成员都是以成对的形式出现在系统进化树中。第一类包括6 个成员,分别为MdTUB1~6,其中MdTUB1 与MdTUB4、Md-TUB2 与MdTUB5、MdTUB3 与MdTUB6 有较近的亲缘关系且以成对的形式出现。第二类包括Md-TUB10 和MdTUB11,与苜蓿MtTUB2 归为一类。第三类只有1 个成员MdTUB9,与拟南芥AtTUB4、AtTUB9 归为一类。第四类包括2 个成员MdTUB7和MdTUB8,也是以成对的形式出现,与陆地棉Gh-TUB6 归为一类。第五类包含2 个成员,即Md-TUB12 和MdTUB13,与苜蓿MtTUB6、陆地棉Gh-TUB7和GhTUB10归为一类。
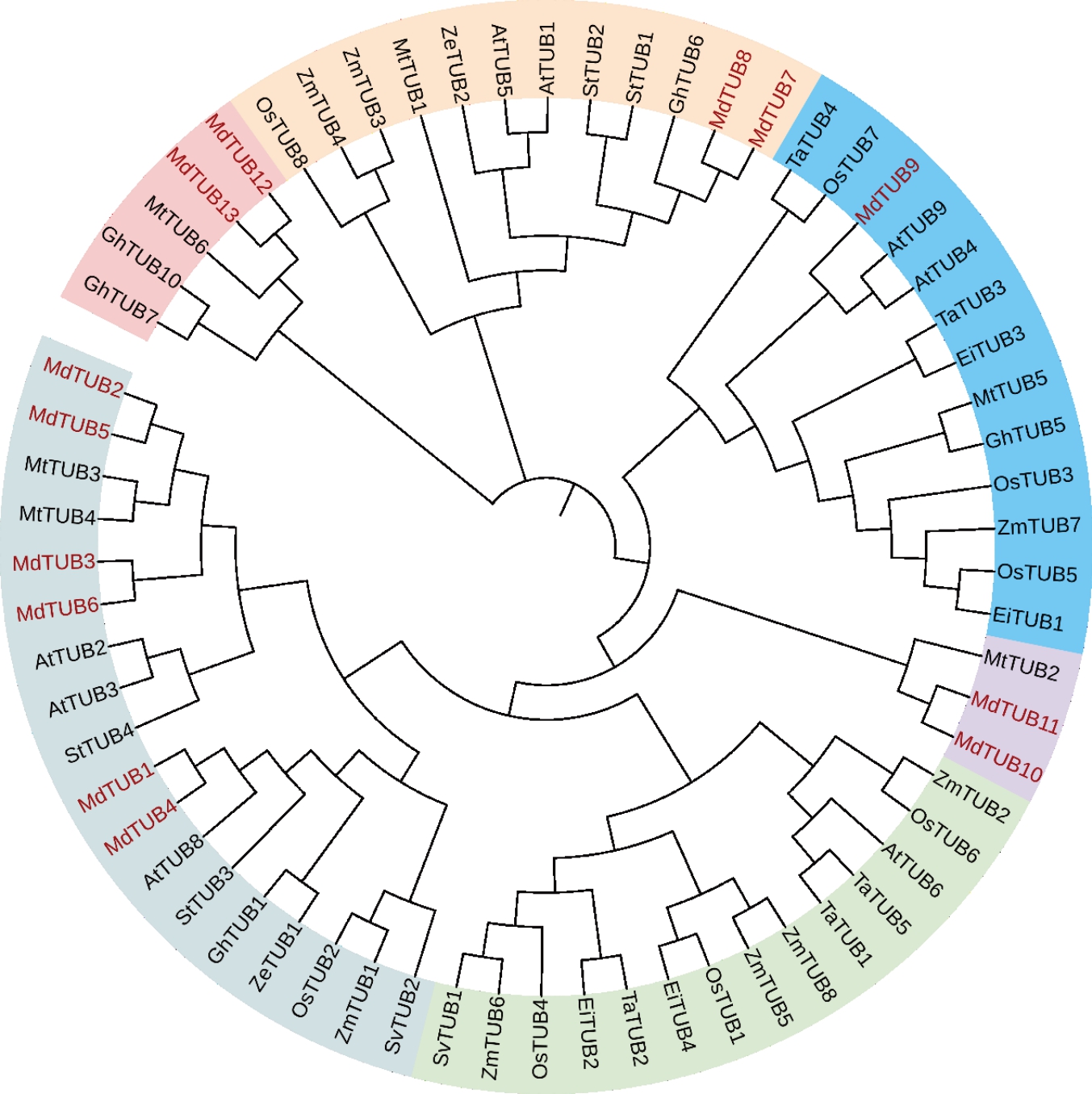
图3 苹果MdTUBs 家族成员的进化树分析
Fig.3 Phylogenetic tree analysis of apple β-tubulin family members
2.4 苹果MdTUBs基因家族的序列比对
对苹果MdTUBs家族成员的氨基酸进行了多序列比对分析(图4),发现13 个MdTUBs 蛋白氨基酸序列的一致度达到94.77%,表明了苹果MdTUBs成员之间具有高度保守性。此外,13 个苹果MdTUBs成员的N 端氨基酸序列高度保守,只有C 末端氨基酸序列表现出较大的差异。

图4 苹果MdTUBs 家族蛋白多序列比对
Fig.4 Multiple sequence alignment of apple β-tubulin family proteins
2.5 苹果MdTUBs 微管蛋白家族基因的结构和保守基序分析
根据基因组注释信息,利用TBtools软件对苹果MdTUBs 基因家族的基因结构进行可视化分析(图5),结果表明苹果MdTUBs 家族成员的基因结构高度相似。为了明确苹果MdTUBs家族基因的蛋白保守结构域,将苹果MdTUBs 家族成员蛋白序列上传至在线工具MEME-suite,获得基因结构注释文件,配合使用金冠苹果基因组数据库gff3 文件,利用TBtools 软件作图分析(图5),结果显示苹果13 个MdTUBs 蛋白质序列中均含有10 个保守基序(motif 1~10),表明这些MdTUBs 蛋白序列具有极其相似的保守结构域分布模式,可能具有相似的生物学功能。
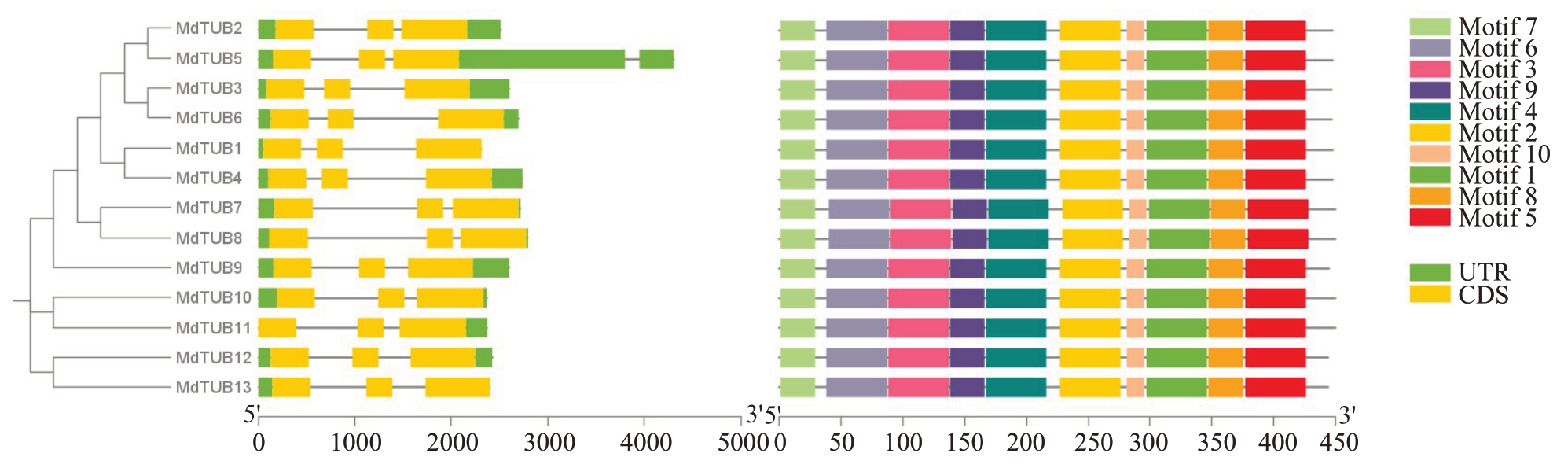
图5 苹果MdTUBs 基因结构和保守Motif 分析
Fig.5 Gene structure and motif analysis of apple β-tubulin
2.6 苹果MdTUBs微管家族蛋白三维结构预测
将MdTUBs 微管蛋白家族各成员蛋白序列上传至Swiss-Model 在线工具,预测各成员的蛋白三维结构模型(图6),苹果MdTUBs 微管蛋白家族的蛋白结构预测的GMQE 值均大于0.85,证明预测结构较为可信。根据预测结果可以发现,苹果Md-TUBs 微管蛋白家族的蛋白结构基本一致,所有的苹果MdTUBs家族蛋白的C端尾部均有一段不同数量的谷氨酸或甘氨酸残基构成的CTT结构,可能与蛋白翻译后修饰密切相关[25]。
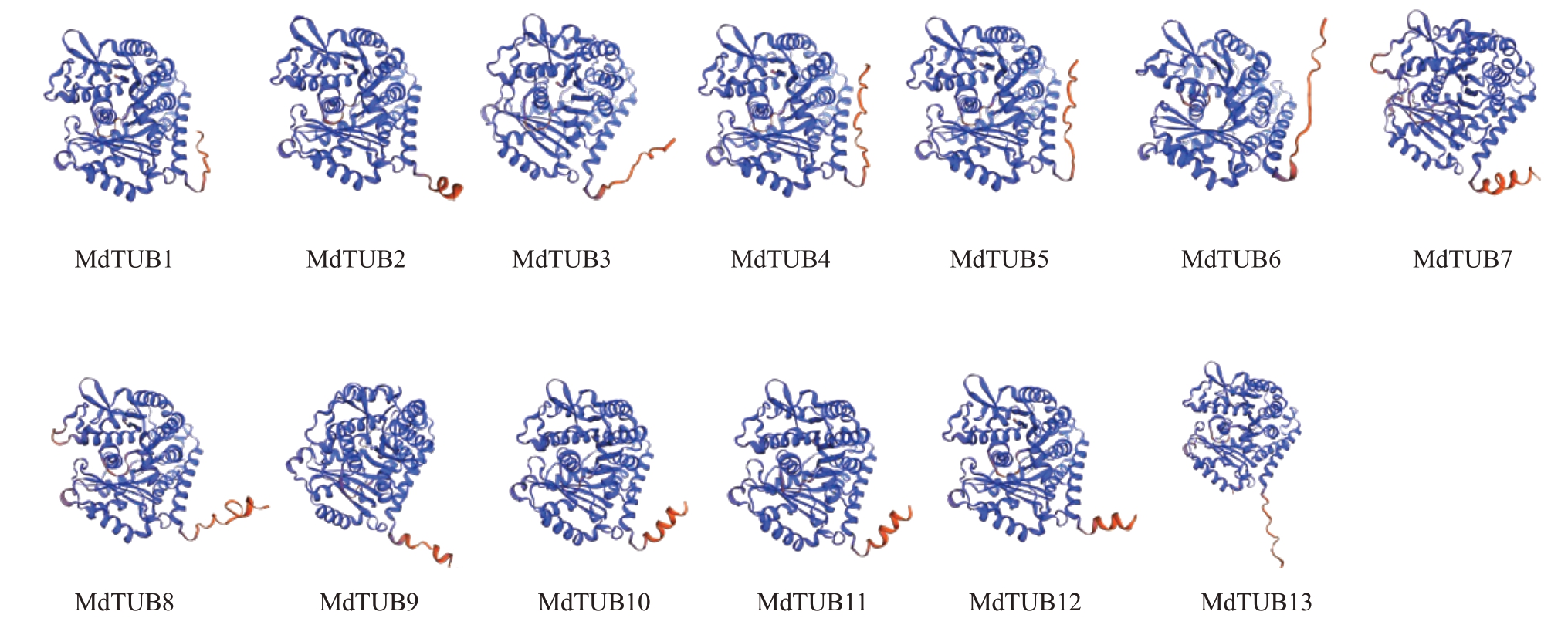
图6 苹果MdTUBS 家族蛋白三维结构预测
Fig.6 Three-dimensional structure prediction of apple β-tubulin family proteins
2.7 苹果MdTUBs 家族基因启动子顺式作用元件分析
顺式作用元件在一定程度上可以反映基因的转录调控作用,为了进一步明确苹果MdTUBs 家族成员的调控模式及潜在功能,利用Plant CARE预测了苹果13个MdTUBs 基因2000 bp启动子的顺式作用元件,并使用TBtools 软件进行可视化分析。苹果MdTUBs家族成员启动子区域的顺式作用元件如图7所示,每个MdTUBs家族成员都含有至少4种顺式作用元件,依据其功能可以将这些顺式作用元件分为四大类,分别是与生长和发育调节相关的响应元件、激素响应元件、植物代谢响应元件和胁迫响应元件[26],表明了苹果MdTUBs 家族成员可能在植物激素调控、生长发育、植物代谢和应对环境胁迫方面发挥作用。
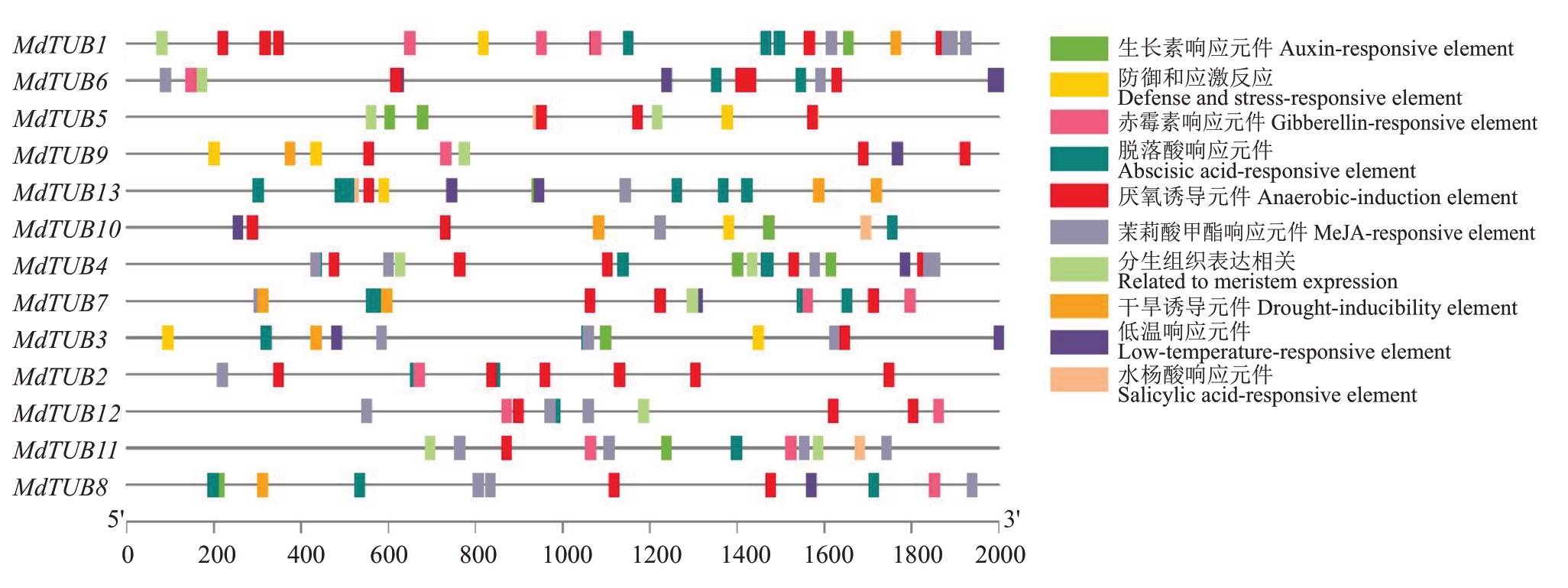
图7 苹果MdTUBs 家族基因启动子区域顺式作用元件分布情况
Fig.7 Cis-acting elements distribution in the promoter regions of β-tubulin family genes in apple
2.8 苹果MdTUBs 家族基因在柱形苹果润太一号组织中的表达分析
以柱形苹果润太一号1年生枝条的成熟叶片、韧皮部、木质部、嫩叶和茎尖5个组织为材料,利用RTqPCR,分析了苹果MdTUBs家族基因在不同组织中的表达水平。如图8 所示,MdTUB2、MdTUB6、Md-TUB9、MdTUB10 和MdTUB11 在韧皮部组织中都有较高的表达量,在嫩叶和茎尖中表达量较少;Md-TUB3和MdTUB5在嫩叶组织中表达量最高,其次是成熟叶和茎尖;MdTUB1、MdTUB4和MdTUB12在木质部、嫩叶和茎尖的表达量高于成熟叶和韧皮部;MdTUB8除了在成熟叶中的相对表达量较低之外,在其他组织中均有一定的表达量;MdTUB7在嫩叶和茎尖中的表达量较高而在成熟叶中表达量较低;Md-TUB13 在茎尖中的表达量远高于其他组织,而在成熟叶中几乎不表达。
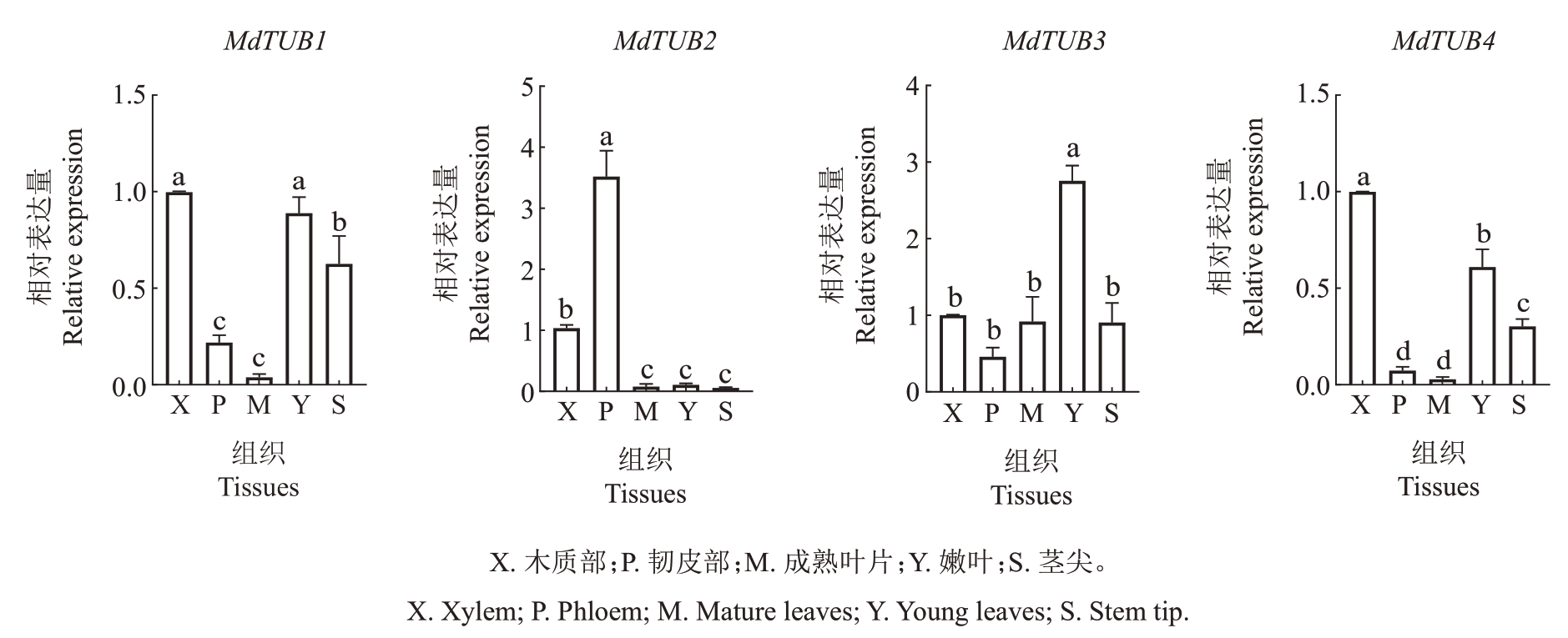
图8 苹果MdTUBs 家族基因在苹果润太一号不同组织中的表达量
Fig.8 The relative expression of β-tubulin family genes in different tissues of Runtai No.1
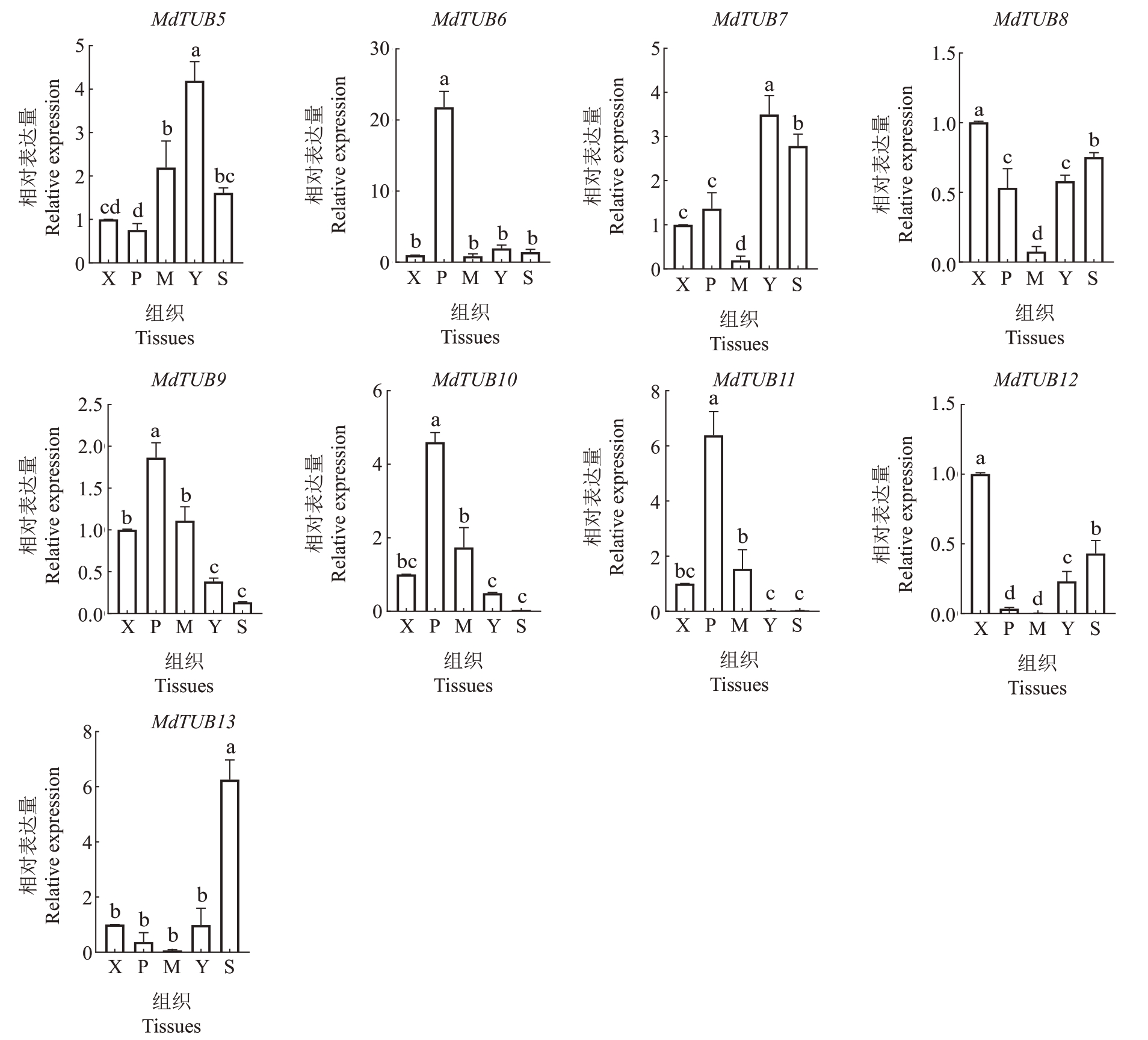
图8 (续) Fig.8 (Continued)
2.9 苹果MdTUBs 家族基因在矮化砧木与乔化砧木茎尖的差异表达分析
以矮化砧木T337、Pamajul、JM7 和乔化砧木楸子(M.prunifolia)、西府海棠(M.micromalus)、平邑甜茶(M.hupehensis)的茎尖为材料,通过实时定量RT-qPCR,明确其在苹果不同砧木中的表达模式。如图9 所示,MdTUB4 在矮化砧木中的表达量显著低于乔化砧木,而MdTUB12 在矮化砧木中的表达量显著高于乔化砧木,其他苹果MdTUBs 家族成员在矮化和乔化砧木中的表达未见明显规律。结果表明了MdTUB4 和MdTUB12 可能参与调控苹果矮生。
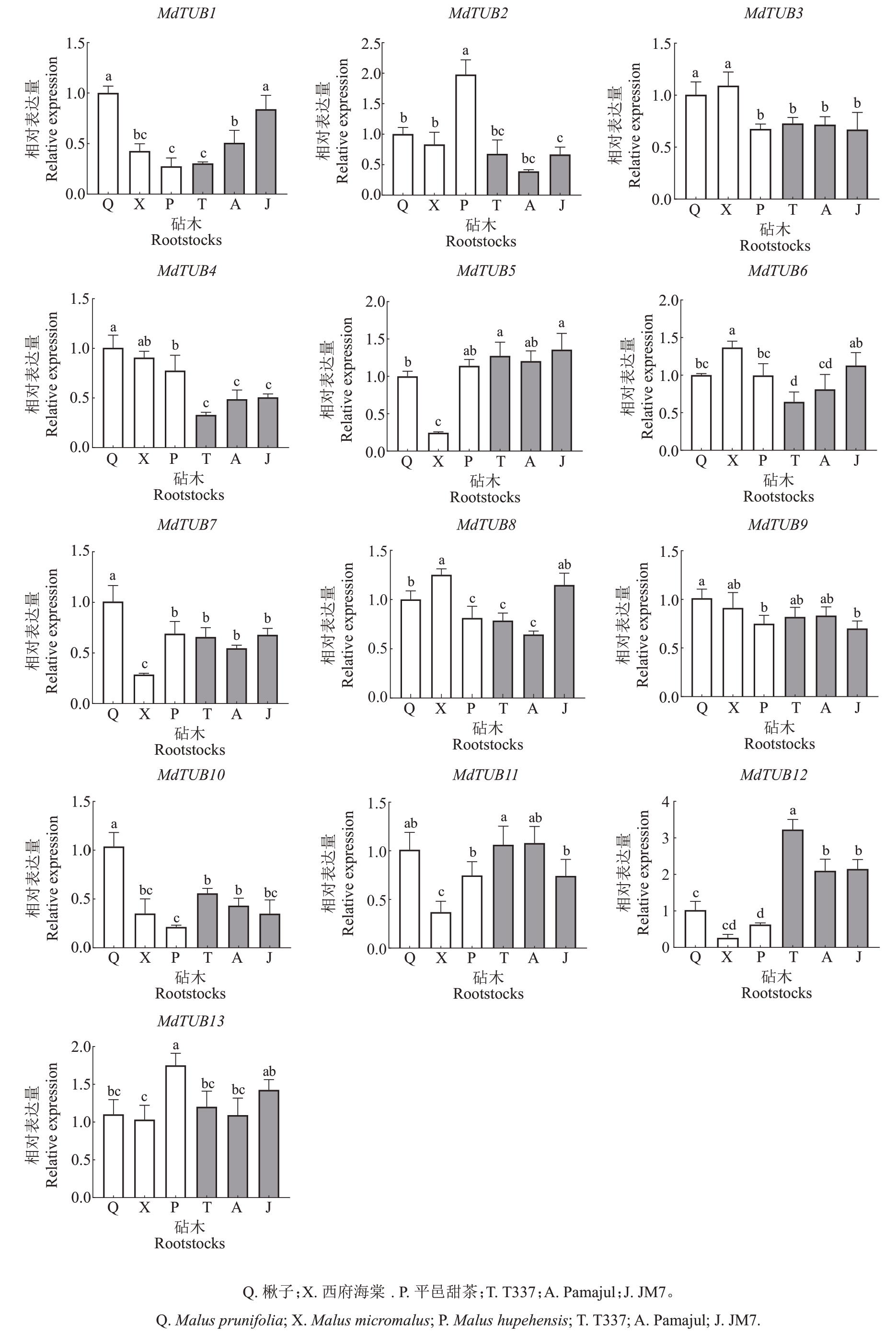
图9 苹果MdTUBs 家族基因在矮化砧木与乔化砧木茎尖中的表达量
Fig.9 The relative expression of β-tubulin family genes in shoot tips of dwarf rootstocks and arborescent rootstocks
3 讨 论
自1963年发现植物微管后,大量的研究揭示了微管在调控植物生长发育中的作用。随着荧光蛋白和转基因技术的应用,使微管在植物细胞内可视化,发现微管是动态变化的管状结构,其快速变化和动态排列对植物细胞有丝分裂、细胞伸长和物质运输都有着重要调控作用,进而调控植物的生长发育、果实的生长发育、木材形成和抗逆性等[22,27-29]。植物如何调控微管的动态变化和排列进而调控组织器官形态建成一直是研究的热点。普遍认为微管蛋白家族基因的选择性表达对微管的动态变化和排列至关重要。因此,鉴定微管蛋白家族基因成员和分析其表达模式,可以为全面了解微管蛋白的功能提供基础。随着越来越多的物种全基因组组装成功,已陆续在拟南芥、毛竹、龙眼、杨树、水稻等多种植物中鉴定到了微管蛋白家族基因[30],而且发现微管蛋白通常以多基因家族的形式出现,在特定的细胞类群和组织器官中,植物可以选择性地表达某个或多个微管蛋白家族基因,进而组装成不同动态性的微管阵列,从而调控特定细胞和组织的生长发育[31-35]。然而相关的研究在苹果中未有报道。笔者在本研究中基于苹果GDDH13 v1.1 基因组数据库[36],鉴定到了13个MdTUBs家族成员,它们分别定位于11条染色体上。对其种内共线性分析发现,苹果MdTUBs 家族没有串联重复事件序列,只存在18个片段重复基因对,表明苹果MdTUBs 家族扩增主要为片段重复事件。已有研究报道微管蛋白家族成员在真核生物中具有较高的保守性[37-38],在本研究中,通过多序列比对发现苹果的13 个MdTUBs 家族成员的相似度达到94.77%,通过基因结构分析发现MdTUBs家族成员都包含共有的保守基序,三维结构预测发现苹果MdTUBs 家族蛋白具有较一致的结构,表明了苹果MdTUBs家族成员之间具有高度保守性。系统进化树分析发现,苹果MdTUBs 家族成员聚为五大类,除了MdTUB9之外,其余成员均以成对的形式出现在进化树中。在植物的生长和发育过程中,需要整合不同组织或环境信号来调控基因的表达,在这一过程中,转录起始是至关重要的一环,顺式作用元件作为转录因子特异结合的位点,它们在调控基因表达中的作用不可忽视。苹果MdTUBs家族基因启动子含有多个激素响应元件和胁迫响应元件,表明苹果MdTUBs 基因家族可能在植物激素调控和应对环境胁迫方面发挥作用。
已有研究发现在植物发育的特定阶段或特定的细胞类型中会选择性地表达微管蛋白家族基因,参与到不同组织不同的生长发育阶段。例如,水稻在开花前OsTUBA1 和OsTUBA2 大量积累,而在开花过程中OsTUBA3 大量表达[4-5];在玉米的根系中,ZmTUB1 和ZmTUB2 主要表达在根的皮层中[39-40],AtTUA1 和AtTUB9 在拟南芥的花粉中高度表达[41];在毛竹中,PhTUA4 在花序中表达量相对较高,而PhTUA1、PhTUB1 和PhTUB11 分别在根、笋和鞭中的表达量高于叶和花序中[30,42]。笔者在本研究中发现苹果MdTUBs家族基因在不同组织中的表达模式有一定差异:苹果MdTUB2、MdTUB6、MdTUB9、Md-TUB10 和MdTUB11 在韧皮部组织中表达量最高,MdTUB1、MdTUB4、MdTUB8 和MdTUB12 在木质部中表达量最高,而MdTUB3、MdTUB5 和MdTUB7 在嫩叶中表达量最高,MdTUB13在茎尖组织中表达量远高于其他组织,这表明它们可能参与调控苹果不同组织的生长发育。
在梨矮生型品种Nein Vert 中鉴定到一个PpTUB 基因PCP044487.1 可能与矮生相关,其在矮生型梨品种茎尖中的表达量低于乔化梨品种[43]。笔者在本研究中也得到了相似的结果,在苹果乔化砧木中,MdTUB4的表达量显著高于矮化砧木,而Md-TUB12呈现出了相反的趋势。这表明苹果MdTUB4和MdTUB12 蛋白可能参与调控苹果矮生。随着苹果遗传转化体系和基因编辑的建立和完善[44-45],后续可通过遗传转化试验获得MdTUB4 和MdTUB12 的转基因苹果,评价其株高、茎粗等生长指标,进一步验证其调控苹果矮生的功能。
4 结 论
在苹果基因组中共鉴定到了13 个MdTUBs 家族基因,其蛋白结构高度保守,分为5个亚族。共线性分析结果表明,苹果MdTUBs家族13个成员只存在片段重复事件。苹果MdTUBs家族基因在不同组织和不同砧木中表现出了不同的表达模式,表明其可能参与调控苹果矮生等多种生长发育进程。本研究为后续开展苹果微管蛋白相关研究及应用奠定了理论基础。
[1] NICK P. Microtubules and the tax payer[J]. Protoplasma,2012,249(Suppl.2):S81-S94.
[2] GUDIMCHUK N B,MCINTOSH J R. Regulation of microtubule dynamics,mechanics and function through the growing tip[J]. Nature Reviews Molecular Cell Biology,2021,22(12):777-795.
[3] KOPCZAK S D,HAAS N A,HUSSEY P J,SILFLOW C D,SNUSTAD D P. The small genome of Arabidopsis contains at least six expressed alpha-tubulin genes[J].The Plant Cell,1992,4(5):539-547.
[4] JEON J S,LEE S,JUNG K H,JUN S H,KIM C,AN G.Tissuepreferential expression of a rice α-tubulin gene,OsTubA1,mediated by the first intron[J]. Plant Physiology,2000,123(3):1005-1014.
[5] XU C S,CHEN B T,HUANG S J,DENG Z Y,WANG T. A point mutation in the rice alpha-tubulin gene OsTUBA3 causes grain notching[J].New Phytologist,2023,240(3):1052-1065.
[6] YOSHIKAWA M,YANG G X,KAWAGUCHI K,KOMATSU S. Expression analyses of β-tubulin isotype genes in rice[J].Plant and Cell Physiology,2003,44(11):1202-1207.
[7] OAKLEY R V,WANG Y S,RAMAKRISHNA W,HARDING S A,TSAI C J. Differential expansion and expression of α- and β-tubulin gene families in Populus[J]. Plant Physiology,2007,145(3):961-973.
[8] SERRATO-DIAZ L M,RIVERA-VARGAS L I,GOENAGA R,FRENCH-MONAR R D. First report of Lasiodiplodia theobromae causing inflorescence blight and fruit rot of longan (Dimocarpus longan L.)in Puerto Rico[J].Plant Disease,2014,98(2):279.
[9] BLUME R Y,RABOKON A M,PYDIURA M,YEMETS A I,PIRKO Y V,BLUME Y B. Genome-wide identification and evolution of the tubulin gene family in Camelina sativa[J].BMC Genomics,2024,25(1):599.
[10] DIAO L,LIU M Y,LIU Y L,ZHANG X,BAO L.Microtubules composed of α4A undergo curved growth mainly mediated by its core structure[J].Journal of Molecular Cell Biology,2023,15(1):mjad004.
[11] 潘婷,杨慕童,刘阳轩,孙秀强,涂升斌,SMALLE J,汪松虎.26S 蛋白酶体调控微管蛋白的降解[J].四川大学学报(自然科学版),2019,56(2):351-356.PAN Ting,YANG Mutong,LIU Yangxuan,SUN Xiuqiang,TU Shengbin,SMALLE J,WANG Songhu. 26S proteasome regulates the degradation of microtubule[J]. Journal of Sichuan University(Natural Science Edition),2019,56(2):351-356.
[12] 党媛玥,马建江,杨书贤,宋吉坤,贾冰,冯盼,陈全家,于霁雯. 棉花β-tubulin 基因家族的鉴定及其在纤维发育中的表达[J].中国农业科学,2023,56(23):4585-4601.DANG Yuanyue,MA Jianjiang,YANG Shuxian,SONG Jikun,JIA Bing,FENG Pan,CHEN Quanjia,YU Jiwen.Genome-wide identification and expression analysis of β-tubulin family in cotton fiber development[J]. Scientia Agricultura Sinica,2023,56(23):4585-4601.
[13] CHEN B J,ZHAO J J,FU G Y,PEI X X,PAN Z E,LI H G,AHMED H,HE S P,DU X M. Identification and expression analysis of Tubulin gene family in upland cotton[J]. Journal of Cotton Research,2021,4(1):20.
[14] LI Y L,SUN J,LI C H,ZHU Y Q,XIA G X. Specific expression of a β-tubulin gene(GhTub1)in developing cotton fibers[J].Science in China Series C:Life Sciences,2003,46(3):235-242.
[15] SU B H,GUO Y,LI Z F,GAO H W,WEI Z Y,QIU L J. Ideal type 1 is caused by a point mutation in the α-tubulin gene that affects microtubule arrangement in soybean[J].The Crop Journal,2023,11(3):713-722.
[16] MATSUMOTO S,KUMASAKI S,SOGA K,WAKABAYASHI K,HASHIMOTO T,HOSON T. Gravity-induced modifications to development in hypocotyls of Arabidopsis tubulin mutants[J].Plant Physiology,2010,152(2):918-926.
[17] HUANG S Q,GUO S Y,DAI L F,MI L Y,LI W R,XING J J,HU Z B,WU W Q,DUAN Z K,LI B Z,SUN T,WANG B J,ZHANG Y,XIAO T Q,XUE Y L,TANG N,LI H,ZHANG C Q,SONG C P. Tubulin participates in establishing protoxylem vessel reinforcement patterns and hydraulic conductivity in maize[J].Plant Physiology,2024,196(2):931-947.
[18] 冯轶,许雪峰,张新忠,吴婷,王忆,韩振海.苹果矮化砧木致矮机理的研究进展[J].园艺学报,2018,45(9):1633-1641.FENG Yi,XU Xuefeng,ZHANG Xinzhong,WU Ting,WANG Yi,HAN Zhenhai. Progress of dwarfing mechanism of apple rootstock[J].Acta Horticulturae Sinica,2018,45(9):1633-1641.
[19] LI J R,CAI H C,PENG H X,DENG Y L,ZHOU S J,TIAN J,ZHANG J,HU Y J,QIN X X,YAO Y C,ZHENG Y,WANG S.The chromosome-level genome assembly of the dwarfing apple interstock Malus hybrid‘SH6’[J]. Scientific Data,2024,11(1):552.
[20] ZHAO H Y,WAN S Y,HUANG Y N,LI X Q,JIAO T T,ZHANG Z J,MA B Q,ZHU L C,MA F W,LI M J. The transcription factor MdBPC2 alters apple growth and promotes dwarfing by regulating auxin biosynthesis[J]. The Plant Cell,2024,36(3):585-604.
[21] 周德宝. 植物激素与细胞骨架的排向[J]. 植物生理学通讯,2005,41(2):224-228.ZHOU Debao. Plant hormones and layout of cytoskeleton[J].Plant Physiology Communications,2005,41(2):224-228.
[22] COEN E,COSGROVE D J.The mechanics of plant morphogenesis[J].Science,2023,379(6631):eade8055.
[23] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-Delta Delta C(T))method[J].Methods,2001,25(4):402-408.
[24] CANNON S B,MITRA A,BAUMGARTEN A,YOUNG N D,MAY G.The roles of segmental and tandem gene duplication in the evolution of large gene families in Arabidopsis thaliana[J].BMC Plant Biology,2004,4:10.
[25] HAMMOND J W,CAI D W,VERHEY K J. Tubulin modifications and their cellular functions[J]. Current Opinion in Cell Biology,2008,20(1):71-76.
[26] 胡亚威,彭淼,阳灿,李荣华,刘鑫,陈岳文,杨长耀,杨金磊,卢嘉伟,卢晓鹏,杨俊枫.柑橘热应激转录因子的全基因组鉴定及其在柑橘日灼果皮中的表达特性[J]. 果树学报,2024,41(12):2408-2424.HU Yawei,PENG Miao,YANG Can,LI Ronghua,LIU Xin,CHEN Yuewen,YANG Changyao,YANG Jinlei,LU Jiawei,LU Xiaopeng,YANG Junfeng.Genome-wide identification of citrus heat stress transcription factors and their expression characteristics in citrus sunburned peel[J]. Journal of Fruit Science,2024,41(12):2408-2424.
[27] STEHBENS S,WITTMANN T. Targeting and transport:How microtubules control focal adhesion dynamics[J].The Journal of Cell Biology,2012,198(4):481-489.
[28] BRESSAN C,SAGHATELYAN A. Intrinsic mechanisms regulating neuronal migration in the postnatal brain[J]. Frontiers in Cellular Neuroscience,2021,14:620379.
[29] BAO M J,DÖRIG R E,VAZQUEZ-PIANZOLA P M,BEUCHLE D,SUTER B. Differential modification of the C-terminal tails of different α-tubulins and their importance for microtubule function in vivo[J].eLife,2023,12:e87125.
[30] 朱成磊,李彩丽,李晓佩,史晶晶,高志民.毛竹微管蛋白的分子特征及PeTUA3 的功能[J].林业科学,2020,56(7):44-54.ZHU Chenglei,LI Caili,LI Xiaopei,SHI Jingjing,GAO Zhimin.Molecular characteristics of tubulins and preliminary function analysis of peTUA3 in Phyllostachys edulis[J]. Scientia Silvae Sinicae,2020,56(7):44-54.
[31] BREVIARIO D,GIANÌ S,MORELLO L. Multiple tubulins:Evolutionary aspects and biological implications[J]. The Plant Journal,2013,75(2):202-218.
[32] HSIAO A S,HUANG J Y. Microtubule regulation in plants:From morphological development to stress adaptation[J]. Biomolecules,2023,13(4):627.
[33] LLOYD C,CHAN J. Microtubules and the shape of plants to come[J]. Nature Reviews Molecular Cell Biology,2004,5(1):13-22.
[34] CYR R J.Microtubules in plant morphogenesis:Role of the cortical array[J]. Annual Review of Cell Biology,1994,10:153-180.
[35] JANKE C,MAGIERA M M. The tubulin code and its role in controlling microtubule properties and functions[J]. Nature Reviews Molecular Cell Biology,2020,21(6):307-326.
[36] DACCORD N,CELTON J M,LINSMITH G,BECKER C,CHOISNE N,SCHIJLEN E,VAN DE GEEST H,BIANCO L,MICHELETTI D,VELASCO R,DI PIERRO E A,GOUZY J,JASPER G REES D,GUÉRIF P,MURANTY H,DUREL C E,LAURENS F,LESPINASSE Y,GAILLARD S,AUBOURG S,QUESNEVILLE H,WEIGEL D,VAN DE WEG E,TROGGIO M,BUCHER E.High-quality de novo assembly of the apple genome and methylome dynamics of early fruit development[J].Nature Genetics,2017,49(7):1099-1106.
[37] SU H,HAO T T,YU M J,ZHOU W Y,WU L,SHENG Y L,YI Z Z.Complex evolutionary patterns within the tubulin gene family of ciliates,unicellular eukaryotes with diverse microtubular structures[J].BMC Biology,2024,22(1):170.
[38] BINAROVÁ P,TUSZYNSKI J. Tubulin:Structure,functions and roles in disease[J].Cells,2019,8(10):1294.
[39] VILLEMUR R,JOYCE C M,HAAS N A,GODDARD R H,KOPCZAK S D,HUSSEY P J,SNUSTAD D P,SILFLOW C D. α-tubulin gene family of maize (Zea mays L.):Evidence for two ancient alpha-tubulin genes in plants[J]. Journal of Molecular Biology,1992,227(1):81-96.
[40] VILLEMUR R,HAAS N A,JOYCE C M,SNUSTAD D P,SILFLOW C D. Characterization of four new β-tubulin genes and their expression during male flower development in maize(Zea mays L.)[J]. Plant Molecular Biology,1994,24(2):295-315.
[41] YEMETS A,SHADRINA R,BLUME R,PLOKHOVSKA S,BLUME Y. Autophagy formation,microtubule disorientation,and alteration of ATG8 and tubulin gene expression under simulated microgravity in Arabidopsis thaliana[J]. NPJ Microgravity,2024,10(1):31.
[42] HOU D,CHENG Z C,XIE L H,LI X Y,LI J,MU S H,GAO J.The R2R3MYB gene family in Phyllostachys edulis:Genomewide analysis and identification of stress or development-related R2R3MYBs[J].Frontiers in Plant Science,2018,9:738.
[43] 侯董亮,王彩虹,田义轲,肖玉雄,张蓓.梨β–微管蛋白基因及其在矮生型与普通型梨茎尖中的表达差异[J].园艺学报,2016,43(2):320-328.HOU Dongliang,WANG Caihong,TIAN Yike,XIAO Yuxiong,ZHANG Bei. A group of β-tubulin genes and their expression difference in stem tips between the dwarf and standard type pears[J].Acta Horticulturae Sinica,2016,43(2):320-328.
[44] LI H X,SUN H C,DONG H Q,WANG S Y,FAN X Q,LI Y,CHENG L L,ZHANG Z H,WANG Y,ZHANG X Z,XU X F,HAN Z H,LI W. Genome editing of apple squamosa promoter bindng protein-like 6 enhances adventitious shoot regeneration[J].Plant Physiology,2023,191(2):840-843.
[45] DAI H Y,LI W R,HAN G F,YANG Y,MA Y,LI H,ZHANG Z H.Development of a seedling clone with high regeneration capacity and susceptibility to Agrobacterium in apple[J]. Scientia Horticulturae,2013,164:202-208.