中国沙棘(Hippophae rhamnoides subsp. sinensis Rousi),是胡颓子科沙棘属的一种落叶性灌木或小乔木,适应能力强,广泛生长于中国华北、西北、西南等地[1]。中国沙棘是一种具有重要经济和生态价值的植物,果实富含多种生物活性物质,如不饱和脂肪酸、维生素C 等,对人类健康具有颇多益处[2]。中国沙棘是一种重金属富集型的植物,能够吸收并累积土壤中的铅等重金属,这种特性使沙棘果实及其加工产品中重金属含量超出了安全标准,尤其是在浓缩果汁和其衍生产品中,这种超标情况更为显著[3]。因此,研究中国沙棘对铅胁迫的响应机制,对中国沙棘产业的可持续发展和人类健康具有重要意义。
随着工业高速发展,环境问题日益突出,尤其是土壤中的铅污染问题。铅在土壤中溶解度低,受多种因素影响,迁移能力弱,导致土壤污染加剧[4]。铅对植物生长有显著的负面影响,高浓度铅会抑制植物种子中的生长分子,影响生根和发芽,导致植物衰败或死亡[5]。铅污染还影响植物的光合作用、水分代谢和矿物质吸收[6]。铅污染通过食物链影响人体健康,过量摄入铅会影响儿童智力发育,损害阅读和协调能力[7],导致胃肠问题,如食欲不振和便秘。铅的摄入还可能引起肾组织变性和肾功能改变[8],增加肾衰竭风险。此外,铅对神经系统有直接毒性作用,可能引发铅性脑病[9]。
植物对铅的吸收主要有两个重要途径,第一,植物叶片的吸收和吸附;第二,植物根系吸收和转运。植物叶片具有吸收大气中重金属气溶胶的能力[10],由于铅在土壤中的流动性较差,且主要以非可交换态存在[11],因此,在大气铅浓度较高的地区,植物通过叶片的吸附和吸收作用积累铅的可能性,要远大于通过根系吸收后再向地上部分转移的可能性。铅从大气环境中向植物叶片内部的转移过程与叶片的表面形态和内部结构密切相关[12]。植物叶片表皮上的角质层小孔、气孔以及排水孔道是大气中铅颗粒进入叶片的关键途径,而在这些途径中,气孔的进入效率最高[13]。
植物根系对铅的吸收可能涉及主动和被动两种机制。大多数植物根系通过吸收在土壤中以溶解态的形式存在的铅[14],铅在植物中的迁移率相对较低,大部分被植物吸收的铅局限于根部,只有少量的铅被输送到芽中,这可能是由于内胚层中卡氏带的屏障作用,以及木质部果胶等会阻碍铅离子的运输[15]。铅一旦被植物根系表面吸附,就有可能通过质外体途径和共质体途径两种主要的细胞间运输途径,进入根的内部。质外体途径涉及细胞壁和细胞间隙,是一个非细胞质的路径。在质外体途径中,铅可能与细胞壁的多糖(如纤维素、半纤维素和果胶)相互作用,这些多糖中含有可以与铅离子形成络合物的官能团。质外体途径允许铅在细胞间隙中相对快速地移动,但最终可能需要跨越质膜进入共质体途径以进行长距离运输[16];共质体途径涉及细胞质和质膜连接的细胞间连丝。这是一个细胞内的路径,允许分子和离子在细胞之间直接移动。对于铅而言,共质体途径可能涉及特定的转运蛋白,这些蛋白可以帮助铅穿过质膜进入细胞质,然后通过共质体途径在细胞之间转移[17]。
植物在铅污染的情况下,会发生一系列的生理生化变化来响应铅胁迫,形成耐受机制。一般来说,植物对铅的耐受和解毒机制可通过外部屏障作用来排斥铅的吸收,以及通过内部生理调节来增强对铅的耐受性[5]。植物通过根系的细胞壁和角质层形成物理屏障,这些屏障能够限制铅离子的跨膜运输;当植物接触到重金属毒性区域时,能够通过抑制其根系的扩展,有效减少与有毒重金属的接触面积,进而减轻重金属造成的损害[18]。细胞壁是铅离子进入植物细胞的第一道防线,在植物对铅的耐性和解毒过程中发挥着关键作用。细胞壁中的组分(果胶、纤维素和木质素等),含有大量的负电基团,这些负电基团可通过吸附(通过静电作用吸附带正电的铅离子)、络合(与铅离子形成络合物)、沉淀(与铅离子反应生成不溶性的沉淀物)等方式与铅离子发生相互作用,能够有效抑制其进入植物细胞内,从而降低了铅对植物细胞的毒性[3]。除细胞壁外,质膜作为细胞的外层界限,也为细胞提供了一个物理屏障。质膜的脂质双分子层对大多数离子和大分子是不可渗透的,这有助于限制铅离子的进入。同样,质膜表面带有负电荷(磷酸基团),这些负电荷区域能够吸附带正电的铅离子,减少了铅离子通过膜的机会。植物细胞内的液泡含有多种有机酸、蛋白质和生物碱等成分,这些能够与铅离子形成络合物[19],而植物细胞内部的液泡可以通过液泡膜上的特定转运蛋白,如HMA(重金属ATP酶)家族蛋白,将铅离子泵入液泡中,从而降低其对细胞的毒性[20]。
酰基辅酶A结合蛋白(ACBPs)是一类在脂类代谢过程中起关键作用的蛋白质,这类蛋白含有一个高度保守的酰基辅酶A 结合域(ACB),其在不同物种间保持功能上的一致性。ACB 能够与碳链长度介于C12 至C26 之间的酰基辅酶A 分子结合,形成稳定的复合物,这种稳定性对确保脂肪酸代谢过程中生化反应的顺利进行至关重要[21]。植物ACBPs可以在不同的组织中表达,响应非生物和生物胁迫,并被分类到不同的亚细胞位置[22]。在植物中,根据ACBPs的结构和功能,可将其分为4个主要类别:分别是只含有一个ACB 域的小分子质量的ACBPs(Small ACBPs);含有N 端ACB 域和C 端ankyrin 结构域的大分子质量ACBPs(ANK-ACBPs);只含有一个ACB 域的大分子质量ACBPs(Large ACBPs);含有N 端ACB 域和C 端kelch 结构域的大分子质量ACBPs(Kelch ACBPs)[23]。
植物中的酰基辅酶A结合蛋白对维持细胞内脂质代谢的平衡至关重要,该蛋白能够参与调控植物的生长和发育过程,而且还能够响应多种生物和非生物胁迫,包括重金属、氧化应激、低温以及病原体的侵袭等,对植物的正常生长发育与逆境应答具有重要作用[24]。拟南芥ACBPs基因家族中的AtACBP1和AtACBP2能够结合卵磷脂(lecithin)和酰基辅酶脂类(Acyl-CoA),并参与长链饱和脂肪酸的合成[25];AtACBP1和AtACBP2被铅离子、镉离子、铜离子等重金属离子胁迫时,表达水平上升,并通过与亚油酰辅酶A(linoleoyl-CoA)和亚麻酰辅酶A(linolenoyl-CoA)结合,参与到细胞膜的修复过程[26];过表达AtACBP2可以增强拟南芥的抗旱能力[27]。此外,在水稻的研究中发现,在干旱和高盐条件下,OsACBP4的表达量迅速升高;在种子形成的过程中,OsACBP5的表达量显著升高,OsACBP6对伤害(如机械损伤或病理伤害)非常敏感[28],并且是目前已知唯一定位于过氧化物酶体的ACBP。过氧化物酶体是β-氧化的唯一场所,所以此发现意味着OsACBP6可能为脂类的降解运送了底物[29]。由此可见,ACBPs基因家族在帮助植物应对生物和非生物胁迫中具有重要作用。
中国沙棘是我国及世界的重要经济作物,目前关于中国沙棘ACBPs 基因家族的信息较为缺乏,因此开展中国沙棘ACBPs 基因家族的全基因组鉴定以及分析其在铅胁迫下的表达模式和功能具有重要意义。笔者基于中国沙棘的全基因组对中国沙棘ACBPs 基因家族进行鉴定,筛选出8 个ACBPs 基因家族成员,并对该基因家族进行生物信息学分析,以及对不同浓度铅胁迫下的基因表达量进行分析,为初步解析中国沙棘响应重金属铅胁迫的分子机制,以及通过基因工程手段培育重金属铅低积累性的新品种提供研究基础和分子靶标。
1 材料和方法
1.1 中国沙棘ACBPs基因家族的鉴定及基本信息
从Pfam 数据库下载ACBPs 基因结构域的隐马尔可夫文件(PF00887),从国家基因库核酸序列归档系统中获取中国沙棘的全基因组、蛋白序列和注释文件。利用Hmmer search 脚本,以e 值<0.001 为标准,对中国沙棘的全基因组蛋白序列进行搜索,筛选获得候选蛋白。随后将候选蛋白序列文件提交至SMART数据库和Pfam数据库,进行进一步的保守结构域比对确认,并根据结果对中国沙棘该家族的8个成员进行命名,分别为HrLACBPs1~HrLACBPs8。利用ExPASy 网站和WoLF PSORT 网站,分析中国沙棘ACBPs 家族蛋白的蛋白长度、相对分子质量、理论等电点,以及预测该家族成员的亚细胞定位。
1.2 中国沙棘ACBPs 基因家族的多序列比对和基因结构分析
利用MEGA 7.0 软件的ClustalW 功能,对下载的中国沙棘蛋白序列进行多序列比对,将对比的结果导入GeneDoc 软件分析保守结构域,并对结果进行美化。将鉴定出的8个中国沙棘ACBPs基因家族成员的序列,以及该家族成员基因进化树的nwk 文件,上传至基因结构展示服务器(GSDS)进行可视化分析,得到中国沙棘ACBPs 基因家族的基因结构和进化树的组合图。
1.3 中国沙棘ACBPs 基因家族系统发育及Motif分析
从JGI 数据库下载拟南芥、向日葵的ACBPs 蛋白序列文件,从Figshare 数据库中下载翅果油树(Elaeagnus mollis Diels)的全基因组、蛋白序列和注释文件,并通过ACBPs 基因结构域的隐马尔可夫文件(PF00887),筛选得出10 个翅果油树ACBPs 蛋白。将中国沙棘、拟南芥、翅果油树、向日葵4 种植物的ACBPs 基因家族成员的蛋白质序列放到同一个文件中,导入到MEGA 11.0 软件中进行ClustalW比对、参数默认,比对完成之后剪切差异太大的序列。利用MEFA 软件的Neighbor-Joining(邻接法)构建多物种系统发育树。将系统发育树的nwk文件提交Evolview网站进行可视化分析与美化处理。利用MEGA网站,设置搜索参数为10,对该家族的蛋白保守基序(motif)进行预测,并将预测结果文件与该家族成员基因进化树的nwk 文件上传到TBtools 软件,得到蛋白保守基序与系统发育树的组合图。
1.4 中国沙棘ACBPs 基因染色体定位、顺式作用元件分析
利用Perl 脚本从中国沙棘基因组的Gff 注释文件中提取ACBPs 基因家族染色体的位置信息,通过Mapchart 软件可视化,并在Adobe Illustrator 中进行美化处理。从中国沙棘ACBPs 基因家族中提取转录起始位点前2000 个碱基对的DNA 序列,作为启动子区域,利用PlantCare 网站,分析该家族启动子区域的顺式作用元件。
1.5 中国沙棘ACBPs基因共线性、蛋白质互作网络分析
使用TBtools 中的相关插件分析中国沙棘ACBPs 基因家族的染色体长度信息、基因关联信息以及基因在染色体上的位置,再利用Advanced Circos 插件进行绘图,得到中国沙棘ACBPs 基因家族物种内的共线性,并根据拟南芥和翅果油树的基因组文件和Gff 注释文件进行分析,得到中国沙棘与拟南芥、翅果油树ACBPs 基因家族物种间的共线性。通过String 数据库确定中国沙棘ACBPs 基因家族与拟南芥中相应基因之间的蛋白互作关系。获得互作关系后,利用Cytospace软件对蛋白互作网络进行可视化处理,得到蛋白互作网络。
1.6 中国沙棘ACBPs蛋白三维结构预测
采取同源建模(homology modeling)的方法对蛋白质的三维结构进行预测,相似的氨基酸序列对应着相似的蛋白质结构,利用在线工具SWISSMODEL,找到与目标序列同源的已知结构作为模板(目标序列与模板序列的一致度至少要达到30%),选定好蛋白质模型下载PDB 文件,然后提交至SAVES网站进行测评(提供5个软件的评估结果),其中有3 个显示通过即表示预测结果可信度较高。进行上述生物信息学分析的在线工具网址如表1所示。
表1 用于中国沙棘ACBPs 基因家族生物信息学分析的工具
Table 1 Tools used for bioinformatics analysis of the ACBPs gene family in H. rhamnoides subsp. sinensis Rousi

在线工具Online tools国家基因库核酸序列归档系统 CNSA JGI Pfam ExPASy WoLF PSORT GSDS Evolview MEGA PlantCare String SWISS-MODEL SAVES Figshare网址Website https://ftp.cngb.org/pub/CNSA/data2/CNP0001846/CNS0383685/CNA0022752/https://phytozome-next.jgi.doe.gov/https://www.ebi.ac.uk/interpro/http://web.expasy.org/protparam/https://wolfpsort.hgc.jp/http://gsds.gaolab.org/https://evolgenius.info//evolviewv2/#login https://meme-suite.org/meme/doc/overview.html https://bioinformatics.psb.ugent.be/webtools/plantcare/html/https://cn.string-db.org/https://swissmodeexpasy.org/https://saves.mbi.ucla.edu/https://figshare.com/
1.7 中国沙棘ACBPs基因家族转录组分析和qRTPCR验证
选取生长状况良好的中国沙棘幼苗,并对其进行不同浓度的硝酸铅胁迫:对照组(不含硝酸铅)、500、1000、2000、5000 mg·kg-1,胁迫4 周。使用DP452 型号的RNA 提取试剂盒(由天根公司提供)提取幼苗中的总RNA。将中国沙棘幼苗送至武汉迈特维尔生物科技有限公司,进行RNA-Seq 测序。根据测序结果,基于ACBPs 基因的FPKM 值(每千个碱基的转录每百万映射读取的fragments),使用TBtools 软件绘制表达量热图,以展示基因表达的变化。
使用天根KR118 试剂盒进行反转录得到cDNA。针对HrLACBPs 家族的8 个基因,通过上海生工生物工程股份有限公司合成特异性引物(表2)。选用微管蛋白(TUBULIN)作为内参基因,采用SYBR Green(FP215,天根)染料进行实时荧光定量PCR(qRT-PCR)分析,试验的反应体系为20 μL,每个样品进行3 次重复试验。使用2-ΔΔCt计算中国沙棘ACBPs 基因家族的相对表达量,并使用GraphPad prism软件对qRT-PCR结果进行可视化。
表2 中国沙棘ACBPs 基因家族qRT-PCR 引物
Table 2 qRT-PCR primers of the ACBPs gene family in H.rhamnoides subsp. sinensis Rousi

基因ID Gene ID Hiprha1gene12790 Hiprha1gene06859 Hiprha1gene20548 Hiprha1gene15641 Hiprha1gene17806 Hiprha1gene07485 Hiprha1gene10649 Hiprha1gene01688 Tubulin上游引物 Forward primers GCGGCACACGAGGCTGAATC GAAAGAGAGAGCCAAGTGGGATGC ATGGCCTGTACAAGCAAGCTACTG GTAGGGTTGTTTCCATGGCTCCAG TCAAGCAAGCTACTGTTGGTCCAG CTGTCCGTGGTCAACTAGCATCTG CTGCTCTCCTTCTCTACGCTTTGC AAGTGGCAAGCGTGGCAGAAG GGAGATGTTCCGCAGAGTTAG下游引物 Reversed primers ACTCTCCACACCTTCCCAGTCATC GCTTCTTCCTGCAACTGTCTCACC CAGCCTTCCAAGCATCCCACTTAG ACCCACTTGGCTTCTCAGATTTGC CCTTCCACGCATCCCACTTAACTC TTGGAGCTTGTGCCGCAGTTC GGCATTCCAGGCACTCGGTTC TTTCACAGAGGCACCAGCAATCC GTGAACTCCATCTCATCCATACC
2 结果与分析
2.1 中国沙棘ACBPs基因家族的鉴定及基本信息
通过生物信息学方法对中国沙棘ACBPs 基因家族进行鉴定,得到8个ACBPs基因家族成员,并对其编码的蛋白质的理化性质进行分析,结果见表3。蛋白质的长度范围为71 AA(HrLACBPs3)~677 AA(HrLACBPs7);蛋白质分子质量为7995.1 Da(Hr-LACBPs3)~74498.7 Da(HrLACBPs7);其理论等电点介于4.22(HrLACBPs4)~7.53(HrLACBPs5)之间,其中碱性氨基酸(pI>7)较少,只有一个(Hr-LACBPs5),剩余7个均为酸性氨基酸。根据亚细胞定位预测分析,中国沙棘ACBPs 基因家族蛋白质的分布也呈现多样性。HrLACBPs1 定位在内质网,HrLACBPs3 定位在细胞质,HrLACBPs4 定位在叶绿体,而其他蛋白质则定位于细胞核。
表3 中国沙棘ACBPs 蛋白的理化性质、亚细胞定位
Table 3 Physicochemical properties and subcellular localization of ACBPs proteins in H. rhamnoides subsp. sinensis Rousi
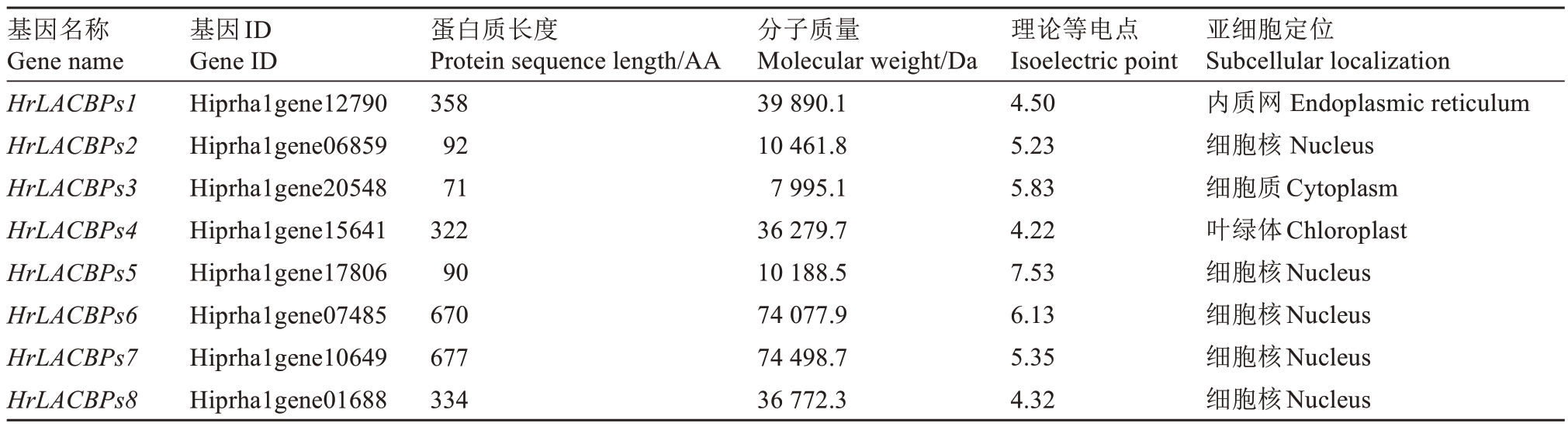
基因名称Gene name HrLACBPs1 HrLACBPs2 HrLACBPs3 HrLACBPs4 HrLACBPs5 HrLACBPs6 HrLACBPs7 HrLACBPs8基因ID Gene ID Hiprha1gene12790 Hiprha1gene06859 Hiprha1gene20548 Hiprha1gene15641 Hiprha1gene17806 Hiprha1gene07485 Hiprha1gene10649 Hiprha1gene01688蛋白质长度Protein sequence length/AA 358 92 71 322 90 670 677 334分子质量Molecular weight/Da 39 890.1 10 461.8 7 995.1 36 279.7 10 188.5 74 077.9 74 498.7 36 772.3理论等电点Isoelectric point 4.50 5.23 5.83 4.22 7.53 6.13 5.35 4.32亚细胞定位Subcellular localization内质网 Endoplasmic reticulum细胞核 Nucleus细胞质Cytoplasm叶绿体Chloroplast细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus
2.2 中国沙棘ACBPs 基因家族的多序列比对和系统发育
在先前的研究中,ACBPs 基因家族中的两个保守基序YKQA 和KWDAW 被认为是结合酰基辅酶A 酯的必要基序。多重序列比对分析表明(图1),8个ACBPs 的氨基酸序列中也发现了这两个保守基序。

图1 中国沙棘ACBPs 基因家族蛋白多序列比对Fig. 1 Multiple sequence alignment of ACBPs gene family proteins in H. rhamnoides subsp. sinensis Rousi
通过构建系统进化树对中国沙棘(8 个)、拟南芥(6 个)[28]、翅果油树(10 个)、向日葵(8 个)[30]的ACBPs 蛋白序列进行系统进化分析,结果表明,这些植物中的ACBPs 蛋白可根据系统发育树的分支情况分为四大类(Group1~Group4)(图2)。在各个类别中,ACBPs 蛋白的成员数量存在差异。Group1含有3 个中国沙棘ACBPs 成员,Group2 中含有1 个中国沙棘ACBPs成员,Group3和Group4中都含有2个中国沙棘ACBPs成员。同时,通过系统树可以发现翅果油树的evm.model.LG01.147 单独分为了一类,通过进一步的理化性质分析,发现该蛋白在翅果油树的10个ACBPs蛋白中等电点最低,为酸性蛋白质,猜测该蛋白可能进化出了新的功能,具体功能尚需进一步研究。
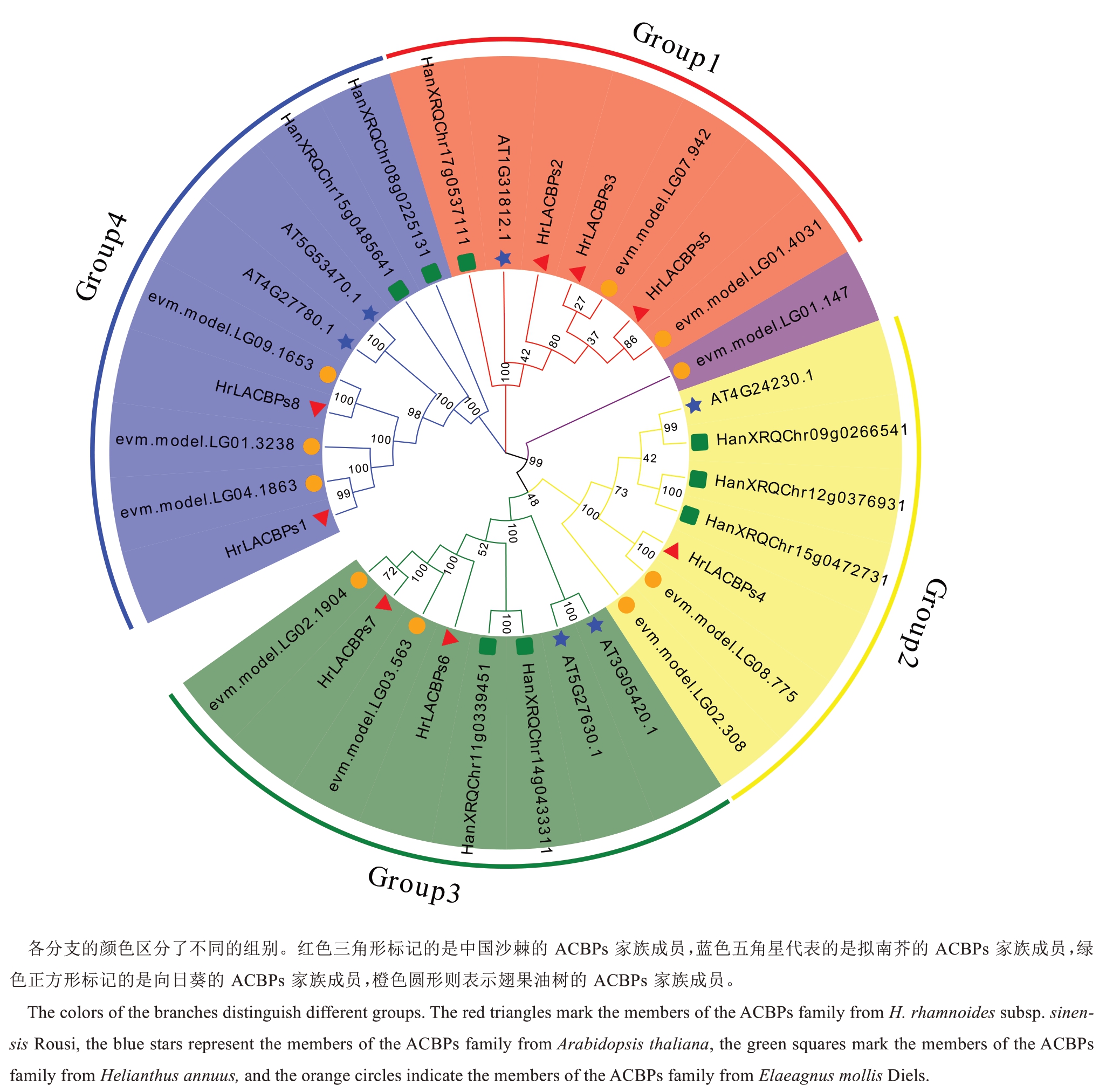
图2 中国沙棘、拟南芥、向日葵、翅果油树ACBPs 蛋白的系统进化分析
Fig. 2 Phylogenetic analysis of ACBPs proteins in H. rhamnoides subsp. sinensis Rousi, Arabidopsis thaliana, Helianthus annuus and Elaeagnus mollis Diels
2.3 中国沙棘ACBPs 基因家族基因结构及Motif分析
中国沙棘ACBPs 基因家族的基因结构分析表明(图3),中国沙棘8条ACBPs基因均含有外显子结构,其中Group3 中所含外显子数量最多,均为18 个外显子;Group2 的HrLACBPs4 含有外显子数量最少,仅有2 个;Group1 中成员的外显子数量为3~4个。由此可见,位于同一类别中的HrLACBPs 家族成员的外显子数量接近,呈现高度的序列相似性和保守性。
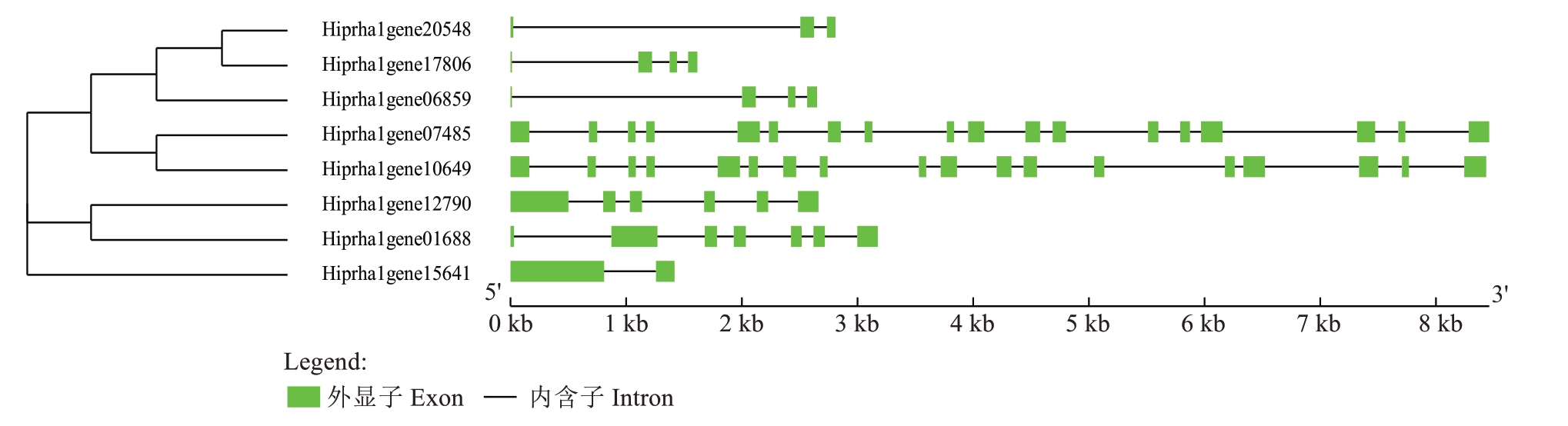
图3 中国沙棘ACBPs 基因家族基因结构分析
Fig. 3 Analysis of the gene structure of the ACBPs gene family in H. rhamnoides subsp. sinensis Rousi
为进一步了解中国沙棘ACBPs 基因家族的特征,对ACBPs 家族蛋白的Motif 序列进行分析。分析结果表明(图4),HrLACBPs家族编码蛋白的10个Motif 序列中,亲缘关系较近的成员之间的Motif 序列的位置分布更相似。所有的HrLACBPs成员都存在Motif1,表明Motif1 在ACBPs 基因家族中具有重要作用。此外,HrLACBPs6 和HrLACBPs7 缺失了Motif7 序列,而在HrLACBPs2 和HrLACBPs5 均含有两个Motif7 序列,这表明了HrLACBPs 家族基因在功能上也存在一定的差异。
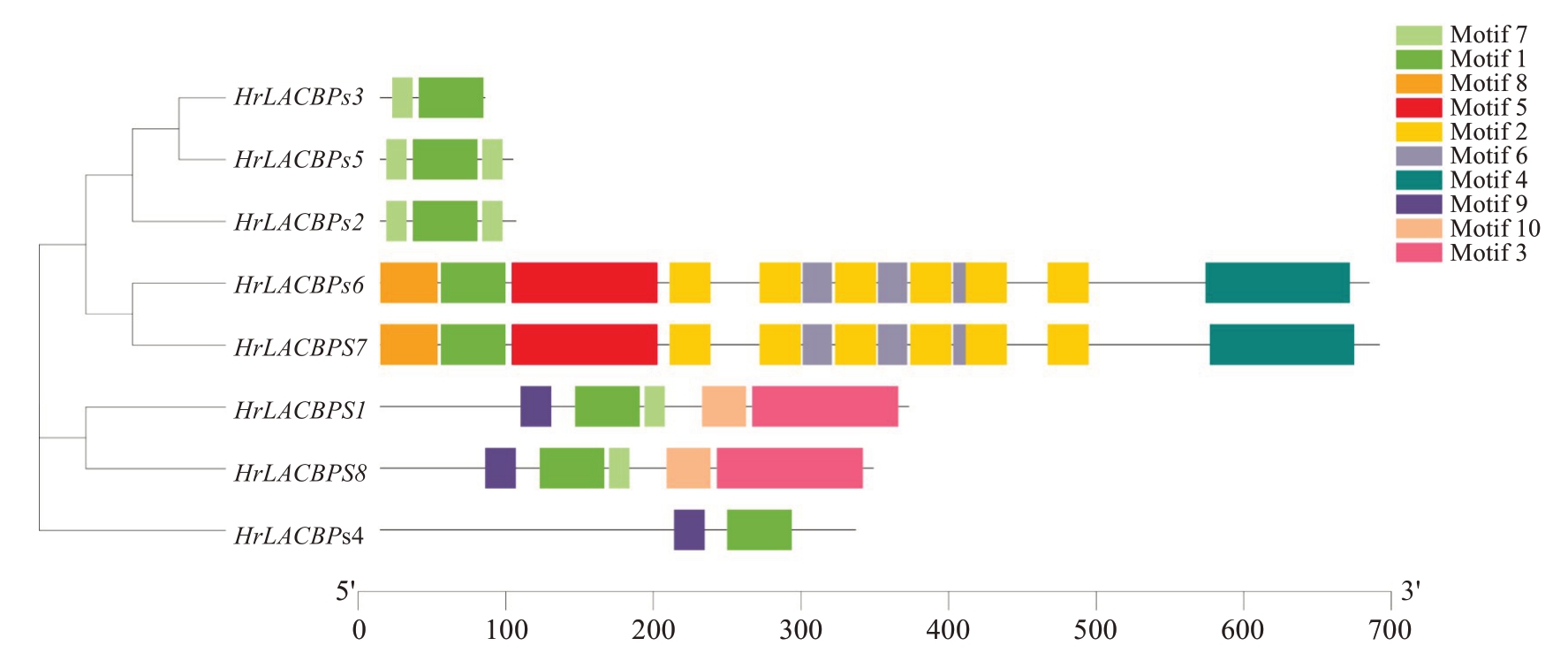
图4 中国沙棘ACBPs 基因家族motif 序列分布情况
Fig. 4 Distribution of motif sequences in the ACBPs gene family in H. rhamnoides subsp. sinensis Rousi
2.4 中国沙棘ACBPs 基因染色体定位和顺式作用元件分析
中国沙棘ACBPs 基因家族染色体定位结果表明(图5),中国沙棘8 个ACBPs基因分布于7 条不同的染色体上,其中HrLACBPs5 和HrLACBPs4 位于4号染色体上,剩余6个基因分别位于1号、2号、3号、5号、11号、12号染色体上。
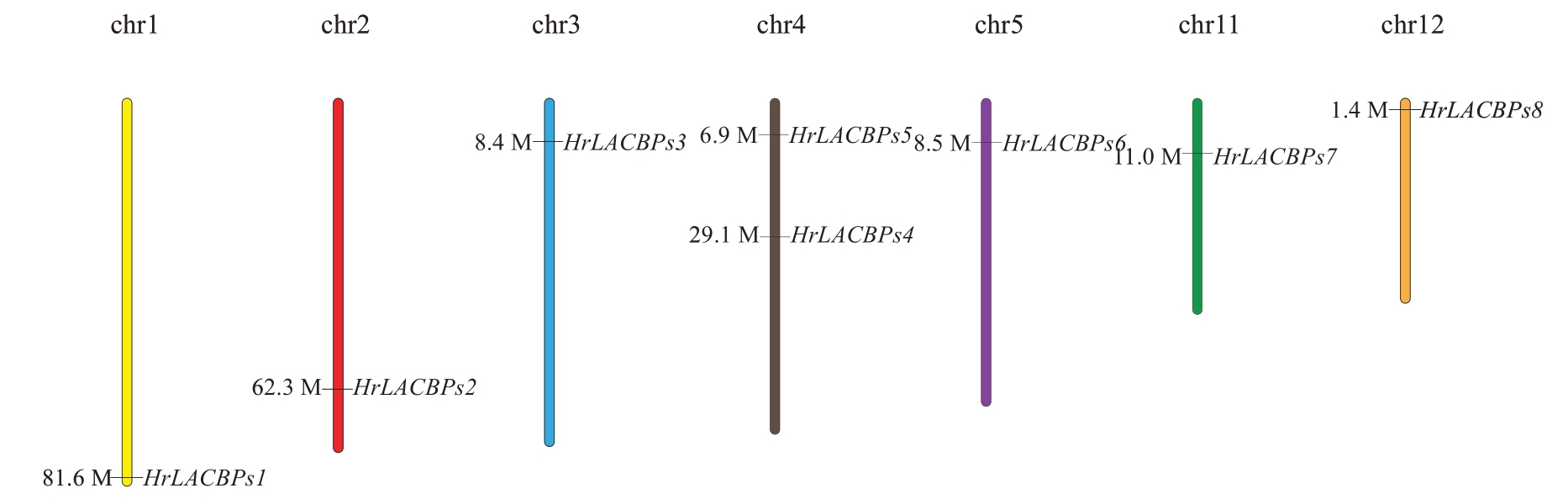
图5 中国沙棘ACBPs 基因家族染色体定位
Fig. 5 Chromosomal localization of the ACBPs gene family in H. rhamnoides subsp. sinensis Rousi
对中国沙棘ACBPs 基因家族顺式作用元件进行分析(图6),重点选取了激素调控、分生组织表达和胁迫应激相关的调控元件。其中激素调控相关的顺式作用元件主要包括4 种类型:促进植物响应脱落酸信号的ABRE 元件、与水杨酸信号转导相关的TCA-element 元件、参与生长素信号转导的TGA-element元件,以及与茉莉酸甲酯信号相关的TGACGmotif 元件;植物体内的基因表达调控也涉及到4 种特定的顺式作用元件:与低温胁迫反应相关的LTR元件、胁迫响应元件STRE、涉及防御机制和应激反应的TC-rich 元件,以及与伤害信号相关的WUNmotif元件;还有一类与分生组织特异性表达密切相关的顺式作用元件,即CAT-box元件。
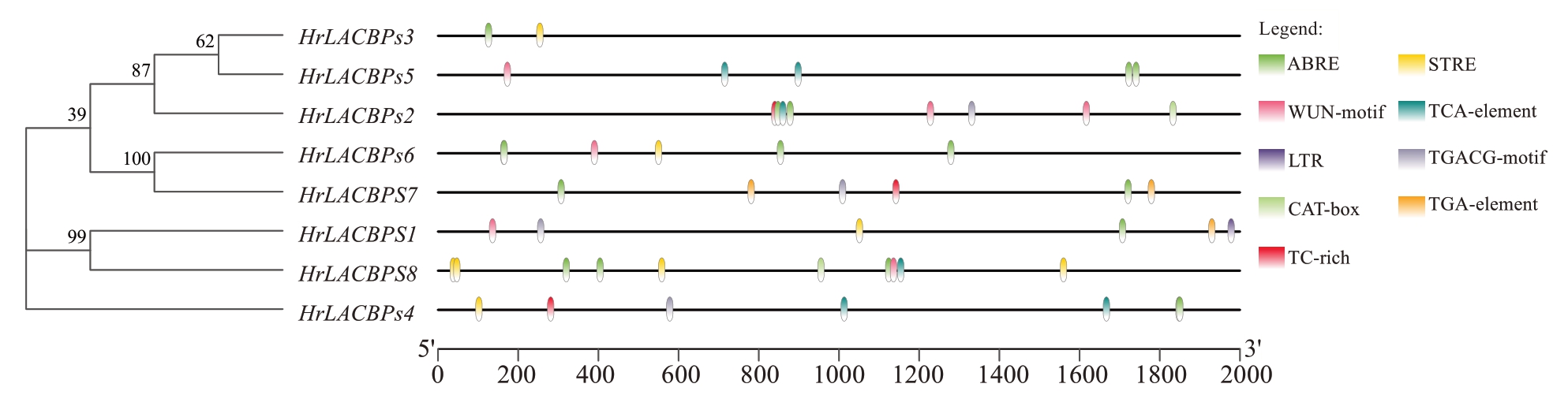
图6 中国沙棘ACBPs 基因家族顺式作用元件分析
Fig. 6 Analysis of cis-acting elements in the ACBPs gene family of H. rhamnoides subsp. sinensis Rousi
笔者所选取的9 种顺式作用元件在HrLACBPs基因家族成员的分布中呈现差异性。具体来说,Hr-LACBPs8 含有最多的响应元件,共计10 个;而Hr-LACBPs3最少,仅有2个。从响应元件的类型来看,HrLACBPs 家族成员普遍包含3 种或以上的元件。由此推测HrLACBPs家族成员可能具有多重生物学功能。在HrLACBPs1 中发现含有与低温胁迫反应相关的元件(LTR),这表明HrLACBPs1 与AtACBP6类似,也可能参与响应低温胁迫,提高植物对低温的耐受性[31]。
2.5 中国沙棘ACBPs 基因共线性、蛋白质互作网络分析
通过中国沙棘ACBPs 基因家族物种内共线性分析结果表明(图7),在chr1、chr2、chr3、chr4、chr5、chr11和chr12上各分布有一些具有共线性的ACBPs基因,分别是定位在chr1 和chr12 上的HrLACBPs1和HrLACBPs8;定位在chr5 和chr11 上的HrLACBPs6 和HrLACBPs7 以及定位于chr2、chr3 和chr4 上的HrLACBPs2、HrLACBPs3 和HrLACBPs5 三个基因互有共线性。HrLACBPs4与其他7个基因均没有共线性。中国沙棘ACBPs 基因家族共线性分析结果表明,chr2、chr3 和chr4 之间存在较密切的共线性关系。
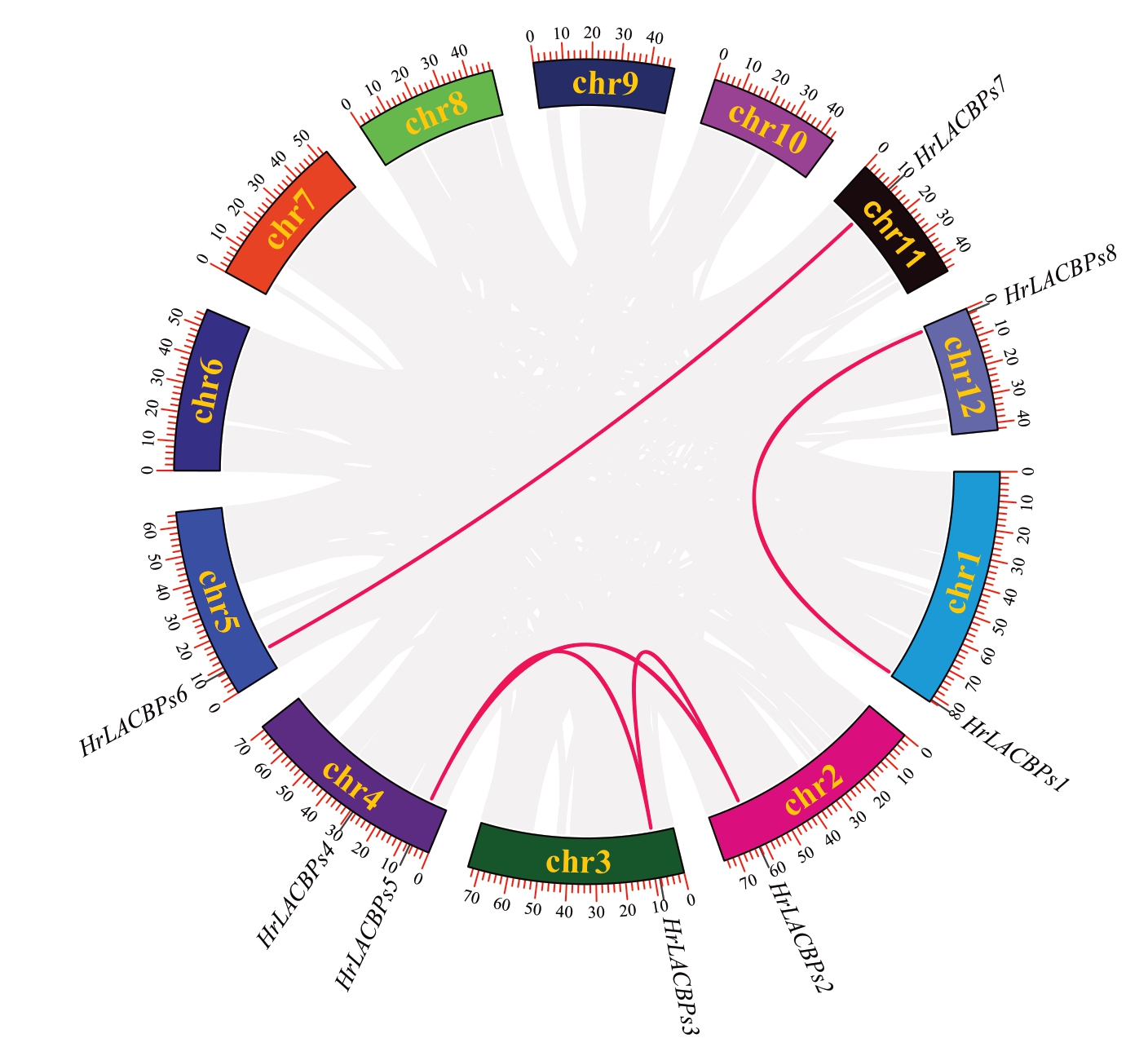
图7 中国沙棘ACBPs 基因家族物种内共线性分析
Fig. 7 Intraspecific collinearity analysis of the ACBPs gene family in H. rhamnoides subsp. sinensis Rousi
进一步构建中国沙棘ACBPs 基因家族和拟南芥、翅果油树的共线性分析(图8),结果表明,中国沙棘ACBPs 基因家族与拟南芥ACBPs 基因家族之间存在9 条共线性,而与中国沙棘同为胡颓子科的翅果油树ACBPs基因家族之间存在17条共线性,分析发现,中国沙棘与翅果油树ACBPs 同源基因的数量要显著多于中国沙棘与拟南芥ACBPs 同源基因的数量,反映了胡颓子科ACBPs 基因家族在进化过程中的保守性和相似性。
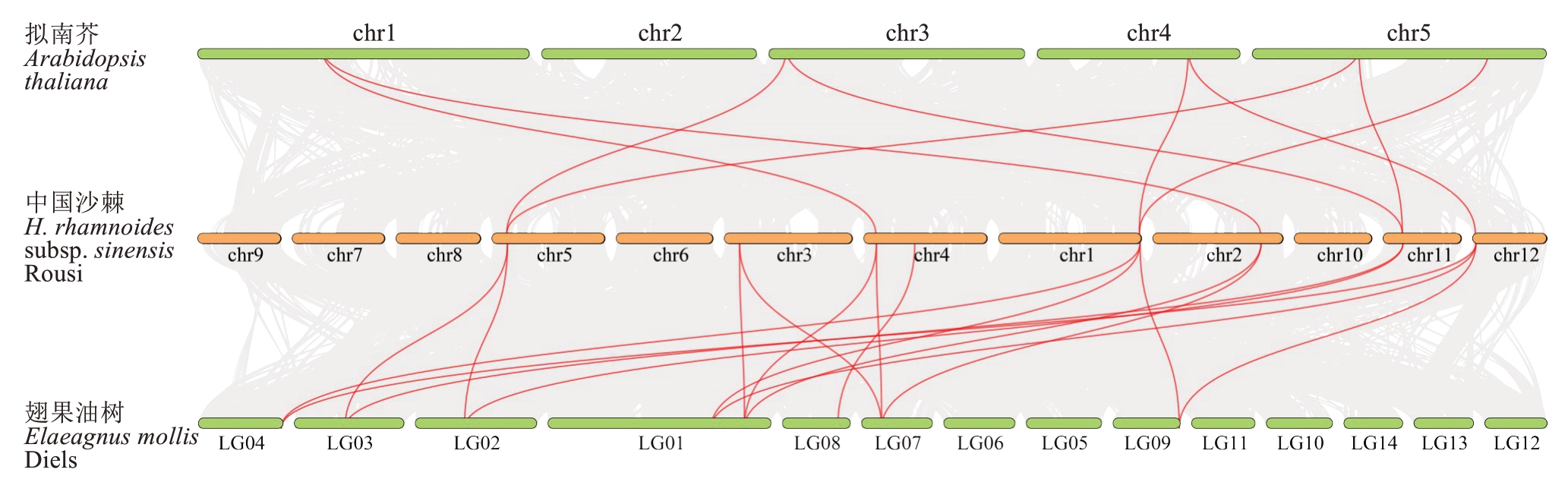
图8 中国沙棘ACBPs 基因家族与拟南芥、翅果油树ACBPs 基因家族物种间共线性分析
Fig. 8 Interspecific collinearity analysis of the H. rhamnoides subsp. sinensis Rousi ACBPs gene family and the Arabidopsis thaliana, Elaeagnus mollis Diels ACBPs gene family
基于拟南芥与中国沙棘蛋白的同源性,利用String 数据库,进行HrLACBPs 家族蛋白的互作分析。根据Cytoscape 中的degree 值筛选出核心蛋白,如图9 所示,圆圈内颜色的深浅代表不同互作强度,颜色深,代表与核心蛋白互作强度大,颜色浅,代表与核心蛋白互作强度小;圆圈之间的线条表示蛋白之间存在互作关系。根据结果可以看出,核心蛋白为拟南芥ACBPs 基因家族的ACBP6,而ACBP6 在冷胁迫下的应答中起重要作用,其过表达能够增强植物的耐冷性。在冷胁迫条件下,ACBP6 可能通过调控与冷胁迫相关的基因表达,参与脂类代谢中卵磷脂的转运,修复受损的细胞膜,从而提高植物对低温的耐受性[32],而中国沙棘ACBPs 基因家族中Hr-LACBPs1 也存在低温胁迫的顺式作用元件。这表明中国沙棘的HrLACBPs1 可能在低温胁迫响应中起重要作用,与拟南芥ACBPs基因家族的ACBP6在功能上可能存在一定的相似性或相互作用。
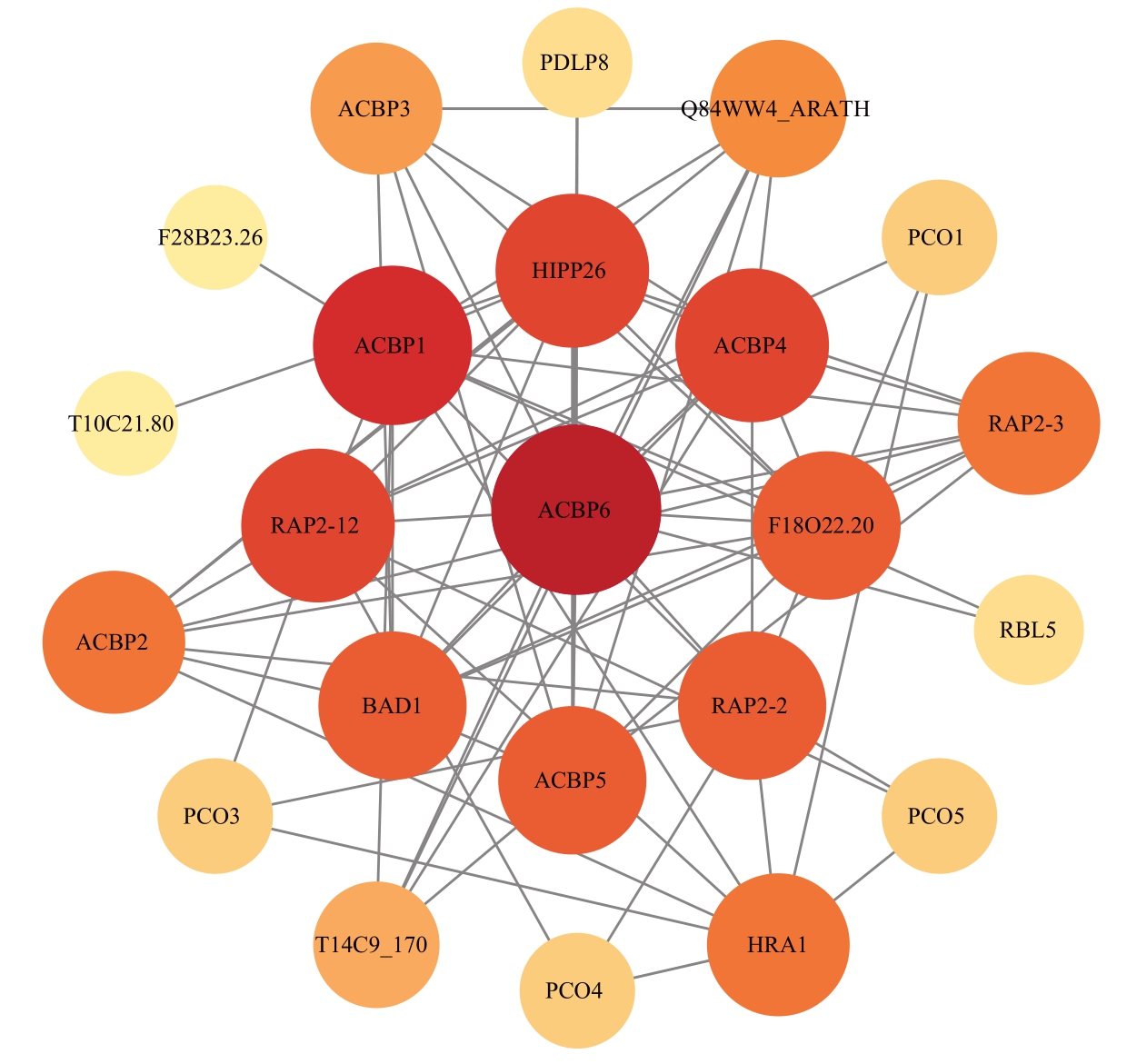
图9 中国沙棘ACBPs 蛋白基于拟南芥ACBPs 蛋白的蛋白质互作网络
Fig. 9 Protein-protein interaction network of H. rhamnoides subsp. sinensis Rousi ACBPs based on Arabidopsis ACBPs
2.6 中国沙棘ACBPs蛋白三维结构预测
基于同源建模原理,对中国沙棘ACBPs 基因家族进行了蛋白三维结构预测,结果表明(图10),Group3 中的蛋白结构最为复杂,且结构模型相似度较高;Group1 中的蛋白氨基酸序列较短且结构相对简单,主要由α 螺旋组成,同时伴有一些β 转角,这些蛋白的结构模型也展现出较高的相似性;Group2的HrLACBPs4,蛋白结构模型也较为简单,相较于Group1 中的蛋白模型,具有更多的α 螺旋;Group4中的蛋白模型相似度较低,HrLACBPs1存在一条长而弯曲的链状结构。这表明中国沙棘ACBPs 基因家族在进化过程中发生了一定程度的变异和分化,也暗示ACBPs基因在功能上具有一定的多样性。

图10 中国沙棘ACBPs 蛋白三维结构
Fig. 10 Three-dimensional structure of H. rhamnoides subsp. sinensis Rousi ACBPs protein
2.7 中国沙棘ACBPs 基因家族转录组分析和qRTPCR验证
选取生长状况良好的中国沙棘幼苗,并对其进行不同浓度的硝酸铅胁迫,胁迫4 周后,将中国沙棘幼苗送至武汉迈特维尔生物科技有限公司,进行RNA-Seq测序。中国沙棘ACBPs基因家族测序结果表明(图11),HrLACBPs 家族成员在铅胁迫条件下,表达量均发生了不同程度的变化。与对照相比,Hr-LACBPs1在低浓度铅胁迫(500~1000 mg·kg-1)时,表达量下降,但在高浓度铅胁迫(2000~5000 mg·kg-1)时,表达量上升;HrLACBPs2、HrLACBPs3、Hr-LACBPs5、HrLACBPs6以及HrLACBPs8在铅胁迫浓度为500~2000 mg·kg-1时,表达量下调,但在铅胁迫为5000 mg·kg-1下的表达量相对升高;HrLACBPs4随着铅胁迫浓度的升高,表达量呈先升高后下降的趋势。
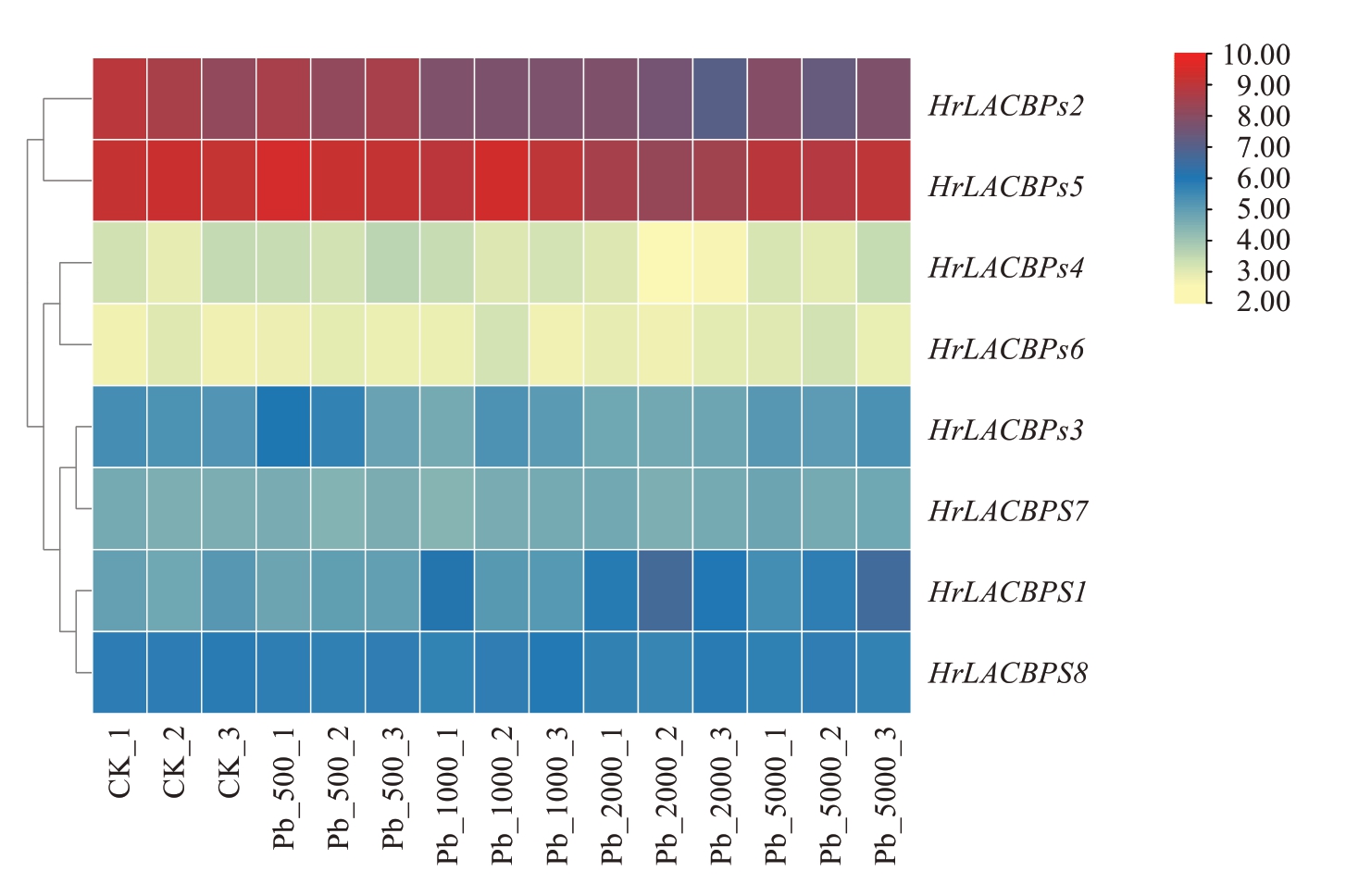
图11 中国沙棘ACBPs 基因家族在不同浓度铅胁迫下的表达分析
Fig. 11 Expression analysis of ACBPs gene family in H. rhamnoides subsp. sinensis Rousi under different concentrations of lead stress
qRT-PCR 的验证结果(图12)与转录组表达分析的结果基本一致。除了HrLACBPs1 外,其他基因在与同基因其他样本的对比中,在铅胁迫浓度为2000 mg·kg-1下的表达量均较低,甚至HrLACBPs2和HrLACBPs3 在Pb2000 浓度时几乎不表达;而Hr-LACBPs家族基因在铅胁迫浓度为5000 mg·kg-1时相对表达量均会升高。通过分析可以推测中国沙棘面临重金属铅胁迫时,HrLACBPs 基因家族的成员有不同的表现,都可以在一定程度上响应重金属铅离子胁迫。
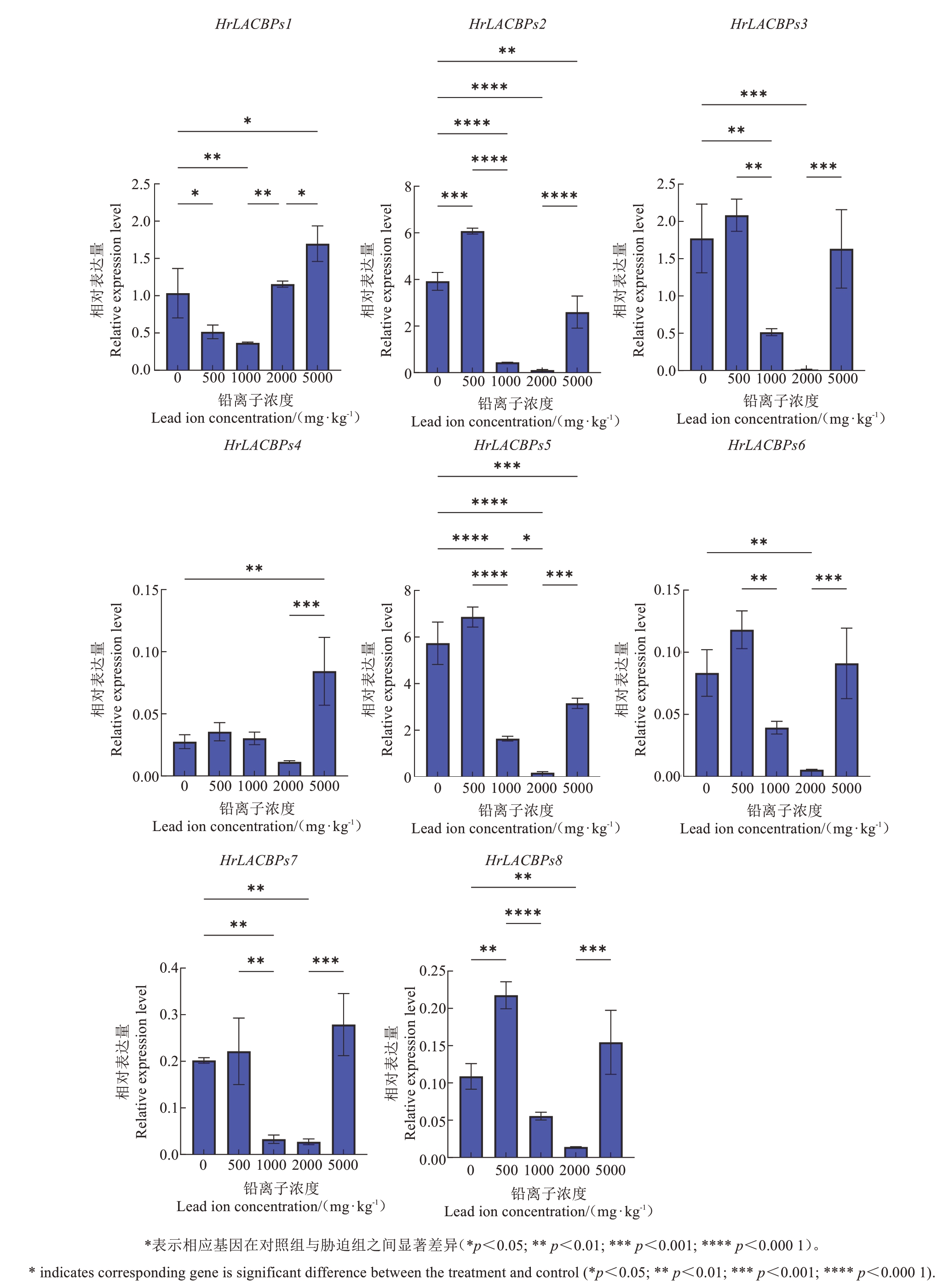
图12 不同铅浓度胁迫下HrLACBPs 家族基因的相对表达量
Fig. 12 Relative expression level of the HrLACBPs gene family under different lead concentration stress
3 讨 论
目前,在已知的植物ACBPs 基因家族的研究中发现,除了一些多倍体植物ACBPs 基因家族数量较多外,例如,陆地棉(24 个)、白菜(20 个)、欧洲油菜(45 个)等,二倍体植物ACBPs 基因家族数量较少,例如,毛果杨(7个)、拟南芥(6个)、水稻(6个)、高粱(5 个)、玉米(5 个)等[32]。笔者在本研究中对二倍体植物中国沙棘的ACBPs基因家族进行筛选得到8个基因,与其他二倍体植物ACBPs 基因家族的数量总体相近。
根据系统发育关系可将中国沙棘ACBPs 基因家族分为4 组。根据基因结构分析的结果,发现中国沙棘ACBPs 家族中Group3 的成员含有最多的外显子数量,这一特征可能增加了选择性剪接的发生概率,进而增加了ACBPs 基因家族功能的多样性[33]。顺式作用元件对许多生物过程和应激反应至关重要[34],在顺式作用元件的分析结果中发现,在大多数HrLACBPs 启动子区域中发现了参与对伤害信号、水杨酸和脱落酸信号响应的元件。
亚细胞定位预测结果表明,中国沙棘ACBPs 蛋白主要定位在细胞核中,在细胞质、叶绿体、内质网中也有分布。这表明HrLACBPs 家族成员可能参与调控基因表达、脂质的代谢和转运、中长链酰基辅酶A(acyl-CoA)的转运以及叶绿体生物膜的修复和维持等。此外,已有的研究表明,拟南芥ACBPs 家族成员蛋白多数定位于细胞质,在水稻中,ACBPs 家族成员可定位于细胞质与内质网以及定位于过氧化物酶体的OsACBP6[29]。
转录组表达分析与qRT-PCR 检测结果表明,与对照(0 mg·kg-1)相比,HrLACBPs 家族的大部分基因在铅浓度为500 mg·kg-1时表达量相对上升,在1000 与2000 mg·kg-1 时表达量大幅度下降,而在5000 mg·kg-1时表达量上升。这可能是由于低浓度的铅胁迫(500 mg·kg-1)对植物造成的氧化应激较小,植物可以通过增强基因的表达量,进而增强植物的抗氧化防御机制,从而增强对铅的耐受性[35];而随着铅胁迫浓度增加到1000~2000 mg·kg-1时,可能会超过植物对铅的耐受阈值,导致植物无法响应高浓度的铅胁迫,因此基因的表达量会大幅度降低[36];但在极高浓度的铅胁迫(5000 mg·kg-1)下,植物可能会启动另一种响应机制,包括重金属的隔离、储存或排出,以及修复受损细胞结构的基因上调[37],导致基因的表达量上升。此外,定位于内质网的HrLACBPs1在低浓度铅胁迫(500 mg·kg-1)时的表达量相较于对照有所下降,而在2000 与5000 mg·kg-1时表达量逐渐上升。这表明基因表达的变化可能还与他们在细胞内的位置有关。定位于细胞核的基因,可能主要参与调控应激反应的转录调控因子或信号转导分子,而定位于内质网的基因,可能与蛋白质的折叠、修饰和运输以及脂质合成、加工和运输有关。而HrLACBPs1 表达量的不同,可能是因为内质网在感知到较低浓度的铅胁迫时,会减少基因的表达以减少蛋白质的合成负荷,在更高浓度胁迫时,则可能提高表达量以应对蛋白质损伤的积累。上述解释是基于一般生物学原理和已有的科学研究提出的假设,如果要准确解释这些qRT-PCR 分析结果,还需要更详细的试验数据和更深入的分子机制研究。
4 结 论
中国沙棘基因组中鉴定到8 个HrLACBPs 基因,不均匀分布在7 条染色体上,这些基因分为4 个类别且大部分基因预测定位于细胞核中;同一类别家族成员基因结构与Motif 序列相似;Group1 的基因成员之间具有较高的共线性;相比于拟南芥ACBPs基因家族,中国沙棘ACBPs基因家族与翅果油树ACBPs 基因家族表现出更高的共线性;蛋白质三维结构预测结果表明,中国沙棘ACBPs 基因家族同一类别的成员三维结构相似;不同浓度重金属铅离子胁迫下的转录组分析表明,8个HrLACBPs基因在不同浓度的铅胁迫条件下存在表达差异,可能通过不同的分子机制响应重金属铅离子胁迫。
[1] 李嘉欣,李鸿燕,刘丽娥,张恬,周武. 沙棘NRAMP 基因家族鉴定及铅胁迫下表达分析[J]. 生物技术通报,2024,40(5):191-202.LI Jiaxin,LI Hongyan,LIU Li’e,ZHANG Tian,ZHOU Wu.Identification and expression analysis of the NRAMP family in seabuckthorn under lead stress[J]. Biotechnology Bulletin,2024,40(5):191-202.
[2] 段爱国,张建国. 青海西宁市沙棘产业发展研究[J]. 林业科技通讯,2019(3):3-7.DUAN Aiguo,ZHANG Jianguo. Studies on industrial development of seabuckthorn in Xining,Qinghai[J]. Forest Science and Technology,2019(3):3-7.
[3] 李嘉欣,马健芝,刘丽娥,张晶晶,杜明阳,李鸿燕,周武. 沙棘基因组中HMA 基因家族的鉴定和分析[J/OL]. 分子植物育种,2023:1-25.(2023-04-06). https://kns.cnki.net/kcms/detail/46.1068.S.20230404.1740.017.html.LI Jiaxin,MA Jianzhi,LIU Li’e,ZHANG Jingjing,DU Mingyang,LI Hongyan,ZHOU Wu. Identification and analysis of the HMA gene family in sea buckthorn genome[J/OL]. Molecular Plant Breeding,2023:1-25.(2023-04-06). https://kns.cnki.net/kcms/detail/46.1068.S.20230404.1740.017.html.
[4] 肖龙恒,唐续龙,卢光华,张颖,郭敏,张梅. 重毒性铅污染土壤清洁高效修复研究进展[J]. 工程科学学报,2022,44(2):289-304.XIAO Longheng,TANG Xulong,LU Guanghua,ZHANG Ying,GUO Min,ZHANG Mei. Research progress in cleaning and efficient remediation of heavy,toxic,lead-contaminated soil[J]. Chinese Journal of Engineering,2022,44(2):289-304.
[5] 段德超,于明革,施积炎. 植物对铅的吸收、转运、累积和解毒机制研究进展[J]. 应用生态学报,2014,25(1):287-296.DUAN Dechao,YU Mingge,SHI Jiyan. Research advances in uptake,translocation,accumulation and detoxification of Pb in plants[J]. Chinese Journal of Applied Ecology,2014,25(1):287-296.
[6] 方玲. 雌雄沙棘接种丛枝菌根真菌对重金属污染的生理生态响应及修复潜力研究[D]. 绵阳:绵阳师范学院,2023.FANG Ling. Physiological response and ecological restoration potential of dioecious Hippophae rhamnoides inoculated with arbuscular mycorrhizal fungi to heavy metal pollution[D]. Mianyang:Mianyang Teachers’ College,2023.
[7] 周芯. 酸洗废液中重金属铅和铜的去除研究[D]. 青岛:青岛理工大学,2018.ZHOU Xin. Removal of heavy metal lead and copper from pickling waste liquor[D]. Qingdao:Qingdao University of Technology,2018.
[8] 刘辽源. 牡蛎壳粉对土壤中铅赋存形态的影响及其钝化效果分析[J]. 农业科技通讯,2024(6):91-95.LIU Liaoyuan. Impact of oyster shell powder on the speciation and immobilization effect of lead in soil[J]. Bulletin of Agricultural Science and Technology,2024(6):91-95.
[9] 韦友欢,黄秋婵. 铅对人体健康的危害效应及其防治途径[J].微量元素与健康研究,2008,25(4):62-64.WEI Youhuan,HUANG Qiuchan. The toxicological effect of lead on the human health and its measures of preventing[J].Studies of Trace Elements and Health,2008,25(4):62-64.
[10] UZU G,SOBANSKA S,SARRET G,MUÑOZ M,DUMAT C.Foliar lead uptake by lettuce exposed to atmospheric fallouts[J].Environmental Science & Technology,2010,44(3):1036-1042.
[11] LI Z,SHUMAN L M. Mobility of Zn,Cd and Pb in soils as affected by poultry litter extract:I. leaching in soil columns[J].Environmental Pollution (Barking,Essex),1997,95(2):219-226.
[12] TOMAŠEVIĆ M,VUKMIROVIĆ Z,RAJŠIĆ S,TASIĆ M,STEVANOVIĆ B. Characterization of trace metal particles deposited on some deciduous tree leaves in an urban area[J]. Chemosphere,2005,61(6):753-760.
[13] SCHRECK E,FOUCAULT Y,SARRET G,SOBANSKA S,CÉCILLON L,CASTREC-ROUELLE M,UZU G,DUMAT C.Metal and metalloid foliar uptake by various plant species exposed to atmospheric industrial fallout:Mechanisms involved for lead[J]. Science of the Total Environment,2012,427:253-262.
[14] PUNAMIYA P,DATTA R,SARKAR D,BARBER S,PATEL M,DAS P. Symbiotic role of Glomus mosseae in phytoextraction of lead in vetiver grass [Chrysopogon zizanioides (L.)][J].Journal of Hazardous Materials,2010,177(1/2/3):465-474.
[15] KOSAKIVSKA I V,BABENKO L M,ROMANENKO K O,KOROTKA I Y,POTTERS G. Molecular mechanisms of plant adaptive responses to heavy metals stress[J]. Cell Biology International,2021,45(2):258-272.
[16] SEREGIN I V,SHPIGUN L K,IVANOV V B. Distribution and toxic effects of cadmium and lead on maize roots[J]. Russian Journal of Plant Physiology,2004,51(4):525-533.
[17] SAHI S V,BRYANT N L,SHARMA N C,SINGH S R. Characterization of a lead hyperaccumulator shrub,Sesbania drummondii[J]. Environmental Science & Technology,2002,36(21):4676-4680.
[18] 李嘉欣,李鸿燕,刘丽娥,周武. 植物在铅胁迫下的耐受机制[J/OL]. 分子植物育种,2023:1-11.(2023-03-03). https://kns.cnki.net/kcms/detail/46.1068.S.20230302.1034.008.html.LI Jiaxin,LI Hongyan,LIU Li’e,ZHOU Wu. Tolerance mechanisms of plants under lead stress[J/OL].Molecular Plant Breeding,2023:1-11.(2023-03-03). https://kns.cnki.net/kcms/detail/46.1068.S.20230302.1034.008.html.
[19] GUPTA D K,HUANG H G,CORPAS F J. Lead tolerance in plants:Strategies for phytoremediation[J]. Environmental Science and Pollution Research International,2013,20(4):2150-2161.
[20] 王晓桐,李昊阳,徐吉臣. 毛果杨HMA 基因家族的生物信息学分析[J]. 植物生理学报,2014,50(7):891-900.WANG Xiaotong,LI Haoyang,XU Jichen. Bioinformatics analysis of the Heavy Metal Transporting ATPase gene family in poplar genome[J]. Plant Physiology Journal,2014,50(7):891-900.
[21] 姜雪. 第四类ACBP 亚细胞定位及作用机制研究[D]. 哈尔滨:东北林业大学,2021.JIANG Xue. Subcellular localization and functional mechanism analyses of Class IV ACBP[D]. Harbin:Northeast Forestry University,2021.
[22] LUNG S C,CHYE M L. Arabidopsis acyl-CoA-binding proteins regulate the synthesis of lipid signals[J]. New Phytologist,2019,223(1):113-117.
[23] 徐利剑,梁晶,李泽宇,刘博洋,孟威. 植物酰基辅酶A 结合蛋白的研究进展[J]. 中国农学通报,2019,35(30):78-83.XU Lijian,LIANG Jing,LI Zeyu,LIU Boyang,MENG Wei.The progress of plant Acyl-CoA-binding proteins[J]. Chinese Agricultural Science Bulletin,2019,35(30):78-83.
[24] 姜雪,宋兴舜,孟威. 三类植物脂类转运蛋白家族研究进展[J].中国农学通报,2021,37(18):85-94.JIANG Xue,SONG Xingshun,MENG Wei. Research progress of three lipid transporter families in plants[J]. Chinese Agricultural Science Bulletin,2021,37(18):85-94.
[25] CHEN Q F,XIAO S,QI W Q,MISHRA G,MA J Y,WANG M F,CHYE M L. The Arabidopsis acbp1acbp2 double mutant lacking acyl-CoA-binding proteins ACBP1 and ACBP2 is embryo lethal[J]. New Phytologist,2010,186(4):843-855.
[26] GAO W,XIAO S,LI H Y,TSAO S W,CHYE M L. Arabidopsis thaliana acyl-CoA-binding protein ACBP2 interacts with heavy-metal-binding farnesylated protein AtFP6[J]. New Phytologist,2009,181(1):89-102.
[27] DU Z Y,CHEN M X,CHEN Q F,XIAO S,CHYE M L. Overexpression of Arabidopsis acyl-CoA-binding protein ACBP2 enhances drought tolerance[J]. Plant,Cell & Environment,2013,36(2):300-314.
[28] MENG W,SU Y C F,SAUNDERS R M K,CHYE M L. The rice acyl-CoA-binding protein gene family:Phylogeny,expression and functional analysis[J]. New Phytologist,2011,189(4):1170-1184.
[29] MENG W,HSIAO A S,GAO C J,JIANG L W,CHYE M L.Subcellular localization of rice acyl- CoA- binding proteins(ACBPs) indicates that OsACBP6:GFP is targeted to the peroxisomes[J]. New Phytologist,2014,203(2):469-482.
[30] RABOANATAHIRY N,WANG B S,YU L J,LI M T. Functional and structural diversity of acyl-CoA binding proteins in oil crops[J]. Frontiers in Genetics,2018,9:182.
[31] LIAO P,CHEN Q F,CHYE M L. Transgenic Arabidopsis flowers overexpressing acyl-CoA-binding protein ACBP6 are freezing tolerant[J]. Plant & Cell Physiology,2014,55(6):1055-1071.
[32] 王思竹,张洵,戴绍军,李莹. 植物ACBP 家族成员功能研究进展[J]. 草业科学,2019,36(10):2535-2548.WANG Sizhu,ZHANG Xun,DAI Shaojun,LI Ying. Advances in research regarding the function of the ACBP family in plants[J].Pratacultural Science,2019,36(10):2535-2548.
[33] 王雪莹,王瑞琪,张洋,刘聪,夏德安,魏志刚. 毛果杨CNGC家族全基因组鉴定及胁迫响应分析[J]. 植物研究,2022,42(4):613-625.WANG Xueying,WANG Ruiqi,ZHANG Yang,LIU Cong,XIA Dean,WEI Zhigang. Genome-wide identification and stress response analysis of cyclic nucleotide-gated channels (CNGC)gene family in Populus trichocarpa[J]. Bulletin of Botanical Research,2022,42(4):613-625.
[34] IBRAHEEM O,BOTHA C E J,BRADLEY G. In silico analysis of cis-acting regulatory elements in 5’ regulatory regions of sucrose transporter gene families in rice (Oryza sativa Japonica)and Arabidopsis thaliana[J]. Computational Biology and Chemistry,2010,34(5/6):268-283.
[35] 朱晨璐,武欣怡,喻君保,黄偲祺,曹树一,翟林,韩雪洁,侯晓龙. 基于转录组测序金丝草叶片响应铅胁迫的抗氧化酶相关基因[J]. 农业环境科学学报,2022,41(10):2158-2169.ZHU Chenlu,WU Xinyi,YU Junbao,HUANG Siqi,CAO Shuyi,ZHAI Lin,HAN Xuejie,HOU Xiaolong. Antioxidant enzyme- related genes of Pogonatherum crinitum leaves in response to lead stress based on RNA-Seq[J]. Journal of Agro-Environment Science,2022,41(10):2158-2169.
[36] MENG L D,YANG Y P,MA Z W,JIANG J W,ZHANG X M,CHEN Z R,CUI G W,YIN X J. Integrated physiological,transcriptomic and metabolomic analysis of the response of Trifolium pratense L. to Pb toxicity[J]. Journal of Hazardous Materials,2022,436:129128.
[37] ILYAS M Z,SA K J,ALI M W,LEE J K. Toxic effects of lead on plants:Integrating multi-omics with bioinformatics to develop Pb-tolerant crops[J]. Planta,2023,259(1):18.