盐胁迫是限制植物生长的重要环境因素之一,给农业带来了持续且严重的危害[1]。中国盐渍化土地主要分布于西北、华北、东北及沿海地区,其中西北地区盐渍土所占比例较大[2]。盐胁迫通常会导致植物生长受抑、生物量减少、叶绿素降解、光合和呼吸速率降低[3]。在盐胁迫条件下,植物叶片Na+的过量积累会抑制其他离子的转运和吸收,从而产生离子毒害[4]。盐胁迫也会诱导植物产生过量的活性氧(ROS),导致细胞膜脂过氧化,从而破坏植物的生长代谢活动[5]。植物对不同盐胁迫的响应受胁迫时间和植物生长状况等因素的影响。选育耐盐品种和通过转基因育种是利用盐渍土的重要途径之一,然而选种育种的周期长、难度大。
褪黑素(N-乙酰基-5-甲氧基色胺,MT)于1958年首次从动物中分离出来[6],并于1995 年首次在植物中被发现[7]。MT是一种多调节分子,存在于大多数动植物中[8]。在植物中,MT 与吲哚乙酸(IAA)相似,都作为一种生长调节剂,能够诱导植物芽和根的生长,刺激植物产生新的侧根和不定根[9]。MT可在低温[10]、干旱[11]、高盐[12]等非生物胁迫下促进植物生长发育,也可作为渗透调节物质维持离子稳态和生长调节。近年来,许多研究都关注MT 缓解植物盐胁迫的功能和调控作用。在燕麦中,与未进行MT处理的幼苗相比,MT 处理提高了抗氧化系统的活性,缓解了盐胁迫下的细胞失衡[13];在黄瓜中,与空白对照相比,MT处理后黄瓜根系活力增强、光合性能提升[14]。甜菜在遭受盐胁迫后,生物量显著下降、光系统Ⅱ(PSⅡ)光化学活性降低,ROS 快速产生;而施用MT后,甜菜细胞代谢增强、并激活抗氧化系统以消除ROS。MT处理的植物可通过调节多胺代谢[8]、修复损伤核酸等方式缓解盐胁迫造成的伤害,因而植物具有更强的耐盐性[15]。
石榴(Punica granatum L.)是石榴科石榴属落叶灌木,原产于伊朗地区[16]。目前,在中国河南、西安、新疆等地广泛种植,因其具有丰富的营养和药用价值,深受消费者的喜爱[17]。近年来的研究表明石榴可以降低血压和对抗糖尿病和癌症等严重疾病[18]。因公众对石榴益处的认识不断提高,其消费量也在不断增加。石榴具有较强的适应性,能够抵抗高温、干旱等逆境[19],对盐度也有一定的耐受性[20],然而目前土地盐渍化程度逐年加重,石榴幼苗仍遭受盐胁迫的伤害[21]。已有研究发现,盐胁迫下石榴生长减缓,根系和叶片发生离子外渗,严重时会导致植株死亡[22]。新疆是中国石榴的重要产区之一,然而目前石榴品种单一且多为硬籽。例如本地的叶城酸石榴,由于籽粒硬度大受众偏少。近年来,引进的突尼斯软籽石榴因具有籽粒柔软、果大多汁等优点逐渐演化成新疆地区的主流品种[23]。然而新疆耕地盐渍化日益严重,无论是引进的软籽石榴还是本地石榴均受到盐胁迫伤害[24]。这一不利因素严重限制了软籽石榴在新疆的生产。目前已有研究发现水杨酸可有效缓解盐胁迫对石榴幼苗的伤害[1]。但针对叶片喷施MT对盐胁迫条件下石榴光合参数和生理特性的影响尚未清楚。因此,本试验研究了叶片喷施MT对盐胁迫下石榴光合参数、荧光参数、叶绿素含量、抗氧化酶活性、渗透调节物质含量的影响,旨在为叶面喷施MT 缓解石榴幼苗遭受盐胁迫伤害提供理论基础。
1 材料和方法
1.1 材料及处理
试验材料为1年生石榴扦插幼苗,供试品种为引进的突尼斯软籽石榴(引自河南荥阳)和本地的叶城酸石榴。试验于石河子大学农学院试验站进行。石榴幼苗采用基质(蛭石∶珍珠岩∶草炭=1∶1∶1,V/V/V)栽培方法栽植于直径14 cm、高16 cm的美植袋中。
试验共设置6 个处理:对照,Hoagland 营养液+叶片喷施清水;T1,盐胁迫处理(Hoagland 营养液+200 mmol·L-1 NaCl);T2,盐胁迫(同T1)+外源喷施50 μmol·L-1 MT;T3,盐胁迫+外源喷施100 μmol·L-1 MT;T4,盐胁迫+外源喷施200 μmol·L-1 MT;T5,盐胁迫+400 μmol·L-1 MT。用Hoagland营养液和NaCl溶液进行浇灌,盆底放置托盘防止溶液外渗。采用随机区组设计,3 次重复。分别在处理后5、10 和15 d进行光合特性指标的测定和采样。
1.2 测定指标及方法
1.2.1 光合气体交换参数的测定 采用Li-6800 便携式光合仪(美国Li-COR公司)于胁迫后5、10、15 d上午10:00-12:00,选取石榴枝条上的功能叶(随机选取20 枚)进行净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、胞间CO2浓度(Ci)等参数的测定。
1.2.2 光合色素含量的测定 采用乙醇浸提法[25]测定光合色素含量,称取0.2 g新鲜叶片,剪碎,加入到装有10 mL 95%乙醇的试管中,避光浸泡48 h,在665、649、470 nm的波长下比色,并计算光合色素含量。
1.2.3 叶绿素荧光参数的测定 采用叶绿素荧光成像系统(MAX-Imaging-PAM)于胁迫后5、10、15 d上午10:00-12:00进行测定。测定前将石榴幼苗暗处理30 min,测定参数包括PSⅡ最大光化学效率(Fv/Fm)、光化学淬灭系数(qP)、非光化学淬灭系数(NPQ)、实际光化学效率(YⅡ)。
1.2.4 生理指标的测定 利用氮蓝四唑(NBT)光化学还原法测定超氧化物歧化酶(SOD)活性[22]、利用愈创木酚显色法测定过氧化氢酶(POD)活性[26]、利用过氧化氢氧化还原法测定过氧化氢酶(CAT)活性[26]、利用电导法测定相对电导率(REC)[27]、利用硫代巴比妥酸法测定丙二醛(MDA)含量[27]。
1.3 数据处理
采用Microsoft Excel 2021 和SPSS 26.0 软件统计及分析数据,采用LSD法进行各处理间数据的方差分析和显著性检验。采用主成分分析法(PCA)[28]进行生理指标间的相关性分析,采用秩和比综合评价法(RSR)[29]进行综合评价,并利用Origin 2024 软件制图。
2 结果与分析
2.1 外源MT对盐胁迫下石榴表型的影响
由图1 可知,正常状态下突尼斯和叶城酸石榴的叶片均呈现深绿色。盐处理(T1)后,突尼斯和叶城酸石榴叶片明显减小、失绿,叶缘甚至出现焦化。这表明盐胁迫下植物叶绿素降解,光合作用被抑制。当外源喷施低浓度MT 后,叶片的失绿现象逐渐缓解,如T3 和T4 处理的叶城酸和突尼斯石榴叶片均得到明显恢复。但当喷施高浓度MT处理(T5)后,胁迫伤害并没有继续缓解,叶城酸和突尼斯叶片均出现了明显的皱缩。从叶片表型结果可知,低浓度MT处理可促进盐胁迫下石榴叶片的生长以及抑制叶绿素降解。

图1 不同处理对2 个石榴品种叶片表型的影响
Fig.1 Effects of different treatments on leaf phenotypes of two pomegranate cultivars
2.2 外源MT对盐胁迫下石榴光合特性的影响
由图2 可知,与对照相比,盐胁迫(T1)处理后,2 个石榴品种的Pn、Tr、Gs均降低,且随着胁迫时间的延长Pn、Tr、Gs呈现出逐渐下降的趋势。Ci随着盐胁迫(T1)时间的增加而升高。在15 d 时,与盐胁迫相比,随着MT 浓度的增加,T2~T5 处理的突尼斯软籽和叶城酸Pn、Tr、Gs基本呈现出先升后降的趋势,而Ci呈现出先降后升的趋势。在同一胁迫处理时间下,突尼斯软籽和叶城酸分别在T4 和T3 处理时Pn、Tr、Gs出现最大值、Ci则出现最小值。在第15天时,与T1相比,突尼斯软籽T4处理和叶城酸T3处理的Pn、Tr、Gs 分别增加82.0%和73.8%、60.0%和51.7%、113.2%和60.7%,同时Ci分别减少23.7%和26.3%。从光合参数角度分析,低浓度MT(50、100、200 μmol·L-1)均能缓解盐胁迫对突尼斯软籽和叶城酸幼苗的伤害。

图2 不同处理下2 个石榴品种光合特性参数的变化
Fig.2 Changes in parameters of photosynthetic characteristics of two pomegranate cultivars by different treatments
2.3 外源MT 对盐胁迫下石榴光合色素含量的影响
由图3 可知,与对照相比,盐胁迫后,T1~T5 处理的光合色素含量均显著降低。T1 处理随着胁迫时间的延长,2 个石榴品种幼苗的叶绿素a(Chl a)、叶绿素b(Chl b)、叶绿素a+b(Chl a+b)含量均逐渐降低;随着MT 浓度的增加和胁迫时间的延长,T2~T5 处理Chl a、Chl b、Chl a+b 含量均逐渐降低,但在同一胁迫处理时间下T2~T5处理则随着MT浓度的增加而呈现出先增后减的趋势。值得关注的是,在5~15 d,与T4 处理相比,突尼斯软籽的T5 处理Chl a、Chl b、Chl a+b 含量出现了骤降,分别降低了23.8%-35.9%、19.8%-23.6%、16.1%-34.2%。在第5天时,突尼斯软籽在T4处理下,Chl a、Chl b、Chl a+b含量与T1处理相比分别增加40.6%、45.7%、23.1%,叶城酸在T3 处理下Chl a、Chl b、Chl a+b 含量与T1处理相比分别增加41.8%、46.3%、47.1%。由此可知,T4 和T3 处理分别对缓解突尼斯软籽和叶城酸石榴叶绿素降解的效果最佳。

图3 不同处理对2 个石榴品种光合色素含量的影响
Fig.3 Effect of different treatments on photosynthetic pigment content of two pomegranate cultivars
2.4 外源MT对盐胁迫下石榴荧光参数的影响
由图4、图5可知,光化学淬灭系数(qP)、非光化学淬灭系数(NPQ)、实际光化学效率(YⅡ)、最大光化学效率(Fv/Fm)4个荧光参数在盐胁迫下均有显著差异,说明盐胁迫严重影响了石榴的光合作用。随着盐胁迫时间的持续,各胁迫处理qP均呈现出逐渐降低的趋势。外源施用MT提高了盐胁迫下石榴叶片的qP 数值。在胁迫第15 天时,各处理qP 均为最小值,其中突尼斯软籽和叶城酸分别是T4 处理和T3处理的qP数值为最大。由图4-C~D可知,NPQ变化趋势与qP 相反,随着胁迫时间的延长,盐胁迫处理(T1)的NPQ数值呈现逐渐增大的趋势。当外源喷施MT后,与T1相比NPQ数值有不同程度降低。
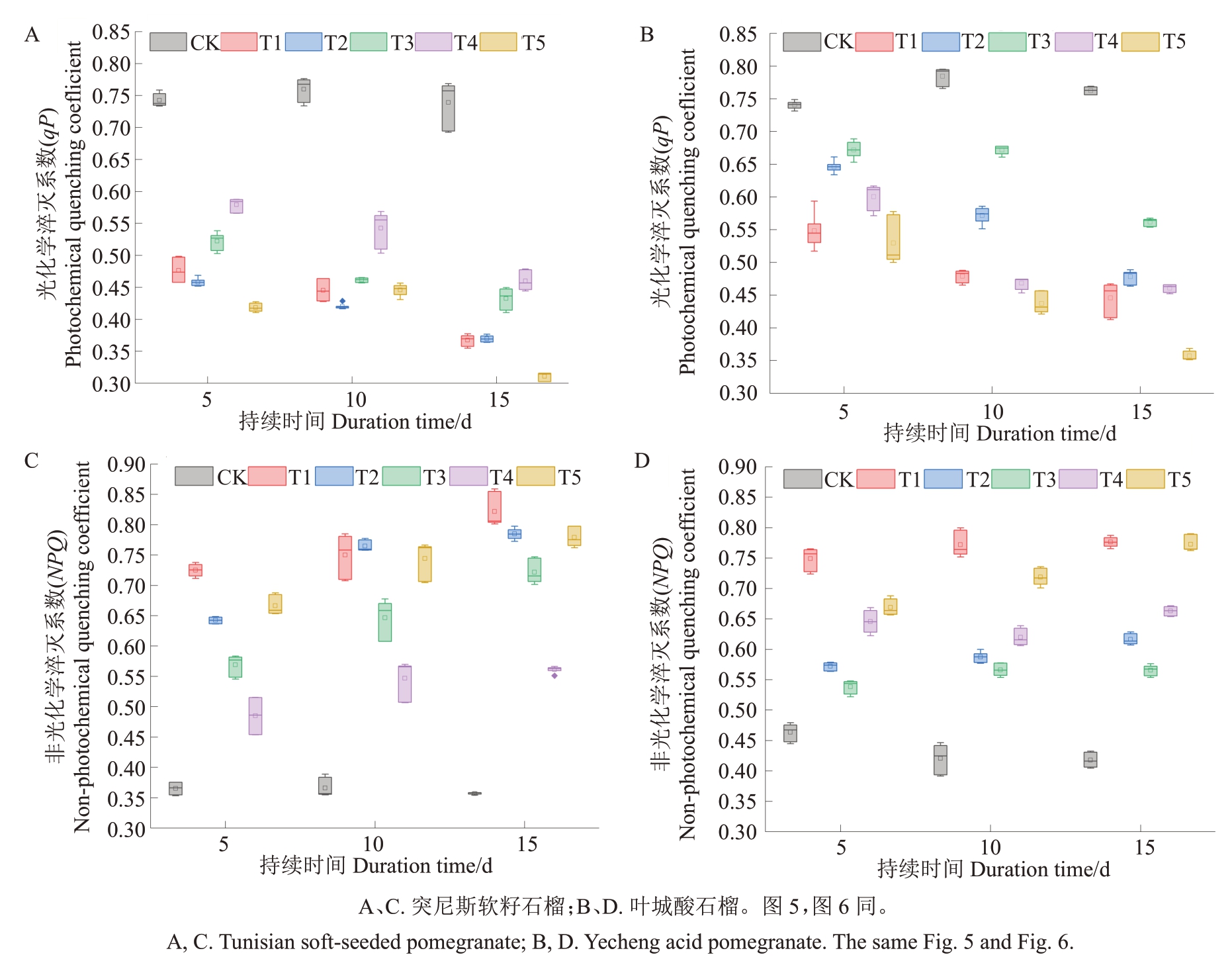
图4 不同处理对2 个石榴品种qP 和NPQ 参数的影响
Fig.4 Effects of different treatments on qP and NPQ parameters of two pomegranate cultivars
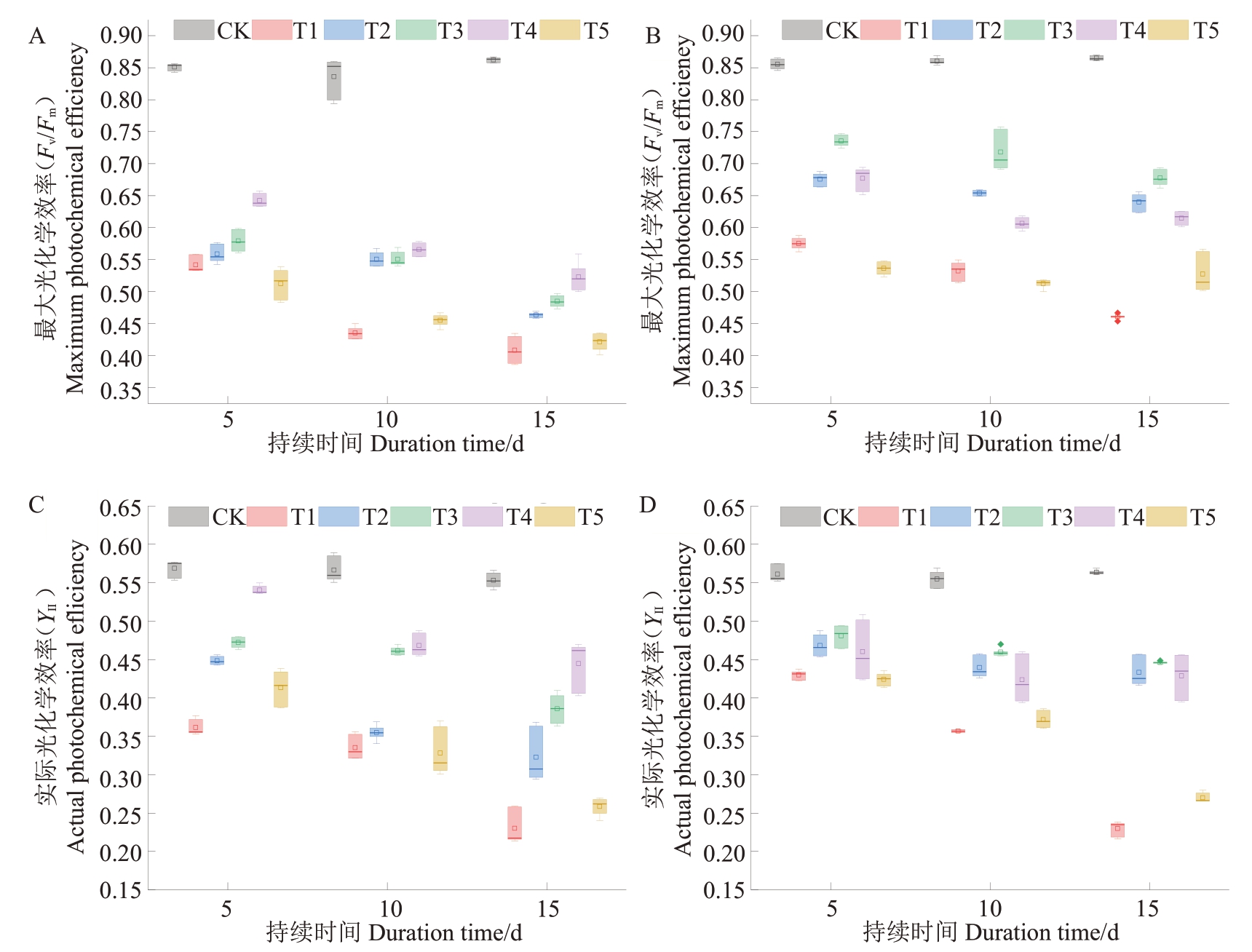
图5 不同处理对2 个石榴品种Fv/Fm和YⅡ的影响
Fig.5 Effects of different treatments on Fv/Fm and YⅡof two pomegranate cultivars
由图5可知,随着盐胁迫的持续Fv/Fm与YⅡ均呈现出逐渐降低的趋势。盐胁迫后,突尼斯软籽Fv/Fm值低于叶城酸的值,这可能与突尼斯软籽耐盐性较弱导致光合电子传递速率降低有关。此外,盐胁迫至第15 天时,突尼斯软籽和叶城酸的Fv/Fm值在T1 处理时均最低。外源施用MT后(T2~T4),各处理Fv/Fm值逐渐增大。然而当外源MT 浓度为400 μmol·L-1(T5)时,突尼斯软籽和叶城酸的Fv/Fm数值却降低,这可能是因为高浓度的MT也会对石榴幼苗的Fv/Fm产生抑制。外源喷施MT 后,随着盐胁迫时间的持续,各处理的YⅡ数值基本保持在0.2~0.5 之间。在胁迫5~15 d 时,突尼斯软籽T4 处理、叶城酸T3 处理的YⅡ数值最大。综上可知,外源MT 浓度为200 μmol·L-1和100 μmol·L-1时分别对缓解突尼斯软籽和叶城酸遭受盐胁迫伤害的效果最佳。
2.5 外源MT 对盐胁迫下石榴REC 和MDA 含量的影响
由图6-A~B可知,随着胁迫时间的延长,2个品种叶片相对电导率(REC)均逐渐升高、在第15天时达到峰值,较对照分别增高53.3%、51.3%。与对照相比,突尼斯软籽和叶城酸幼苗T1 处理的REC 值增幅最大。胁迫至第15天时,突尼斯软籽和叶城酸幼苗T1~T5处理的REC值呈现出先减后增的趋势,分别在T4 和T3 处理时出现最低值,分别为38.426%、39.648%。
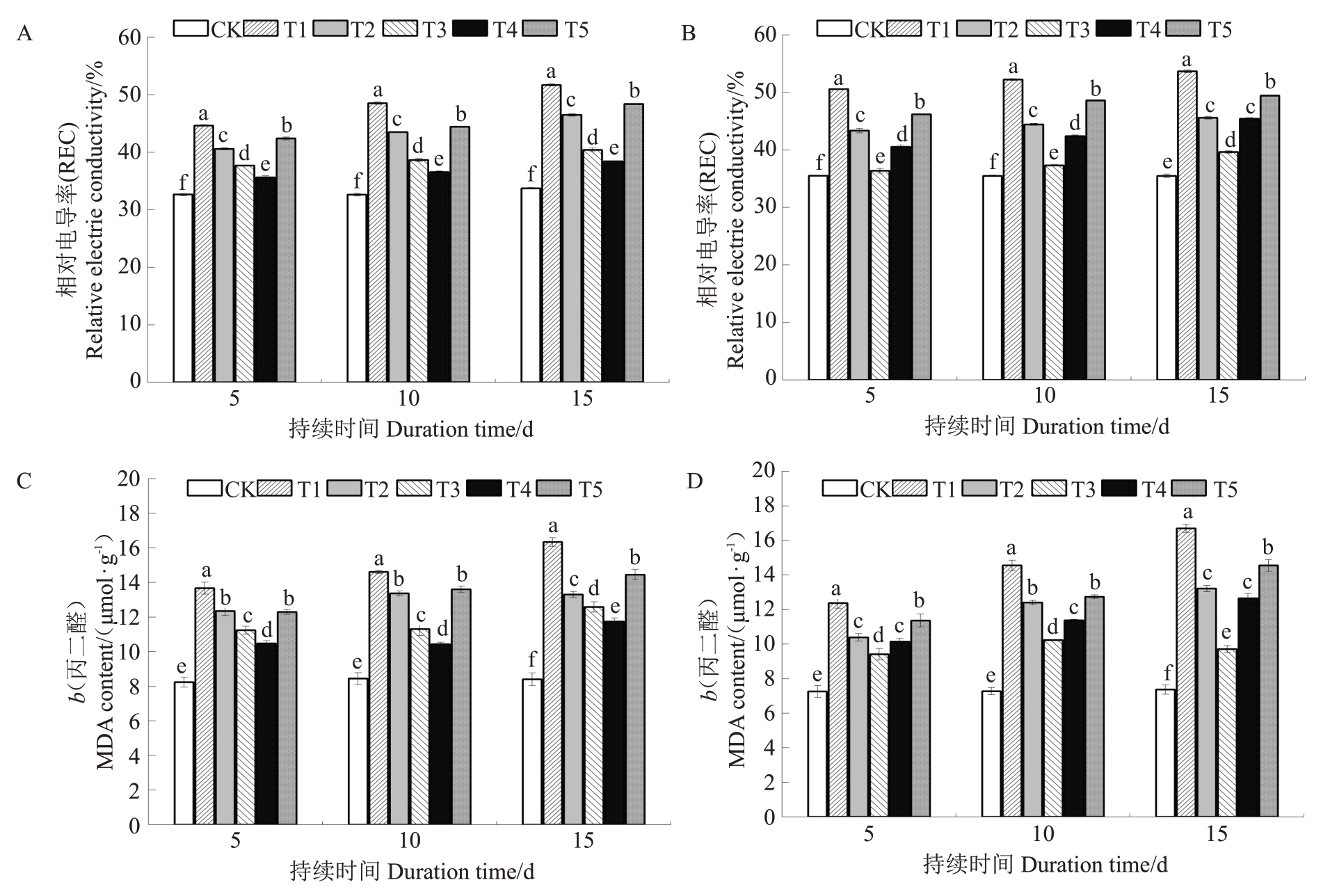
图6 不同处理对2 个石榴品种REC 和MDA 含量变化的影响
Fig.6 Effect of different treatments on changes in REC and MDA content of two pomegranate cultivars
对石榴幼苗进行盐胁迫处理后,与对照相比,各处理的丙二醛(MDA)含量均显著增加(图6-C~D)。胁迫至第15 天时,突尼斯软籽各处理的MDA 含量(b)分别为13.311 μmol·g(-1T2)、12.587 μmol·g(-1T3)、11.746 μmol·g-(1T4)、14.450 μmol·g-(1T5),均显著低于T1(16.341 μmol·g-1)、高于对照(8.409 μmol·g-1);T1~T5 处理中,T4 处理的MDA 含量最低,与T1 相比显著降低28.1%。胁迫至第15 天时,叶城酸各处理MDA含量均达到最大值(T3除外),与对照相比,分别增加126.5%(T1)、79.2%(T2)、31.6%(T3)、71.7%(T4)、97.4%(T5)。综上,MT 处理可降低REC 和MDA 含量,从而提高质膜的通透性同时抑制脂质过氧化作用,保持石榴幼苗细胞膜的完整性和功能表达,从而减轻盐胁迫的毒害,改善植物生长状况。
2.6 外源MT对盐胁迫下石榴抗氧化酶活性的影响
由图7-A、D 可知,T1 处理2 个品种的石榴幼苗SOD活性均逐渐降低,而T2~T5处理的突尼斯软籽和叶城酸SOD 活性随胁迫时间的延长基本呈现先升后降的趋势、且在第10天时达到峰值。胁迫至第15天时,叶城酸SOD活性在T1~T5处理中均为最低值,分别为224.099 U·g-1(T2)、234.450 U·g-1(T4)、202.223 U·g-1(T5),都显著高于T1(152.117 U·g-1)、且低于T3(284.099 U·g-1);T1 处理的2 个品种的石榴幼苗POD 活性逐渐降低,T2~T5 处理的2 个品种的石榴幼苗POD 活性均呈先升后降趋势,在第10天时达到峰值(图7-B、E)。胁迫至第15天,突尼斯软籽和叶城酸POD活性在各处理中均出现最低值;与T1 相比,突尼斯软籽POD 活性分别增高50.7%(T2)、65.0%(T3)、60.4%(T4)、28.67%(T5);与T1相比,叶城酸POD活性分别增高33.9%(T2)、41.7%(T3)、34.2%(T4)、22.0%(T5)。

图7 不同处理对2 个石榴品种抗氧化酶活性的影响
Fig.7 Effect of different treatments on antioxidant enzyme activities of two pomegranate cultivars
随着胁迫时间的持续,T1 处理的2 个品种的石榴幼苗在第5 天时,与对照相比,CAT 活性略有升高,但是在第10、15天时均降低(图7-C、F)。T2~T5处理突尼斯软籽和叶城酸的CAT 活性均随着胁迫时间的持续呈先升后降的趋势,在第10 天时出现峰值。胁迫至第15 天时,突尼斯软籽和叶城酸CAT 活性分别在T4 和T3 处理时出现峰值,分别为81.420 U·g-1·min-1、102.860 U·g-1·min-1;与T1 相比分别增高63.6%、118.0%。
2.7 外源MT对盐胁迫下石榴幼苗的综合分析
为筛选出外源MT对盐胁迫下石榴幼苗的代表性生理指标,本文对2个石榴品种的16个生理指标进行相关性分析和主成分分析。研究结果表明,2个石榴品种生理指标的相关性和代表性结果基本相似。由图8可知,2个石榴品种中,Pn、Tr与Chl a、Chl b、Chl a+b、Fv/Fm和Y Ⅱ呈正相关,与Ci、NPQ、REC 和MDA呈负相关。有趣的是Ci与Chl a、Chl b、Chl a+b、qP、Fv/Fm和YⅡ均呈显著负相关。主成分载荷系数是筛选外源MT对盐胁迫下石榴幼苗的代表性生理指标的重要分析指标,可以分析每个主成分中隐变量的重要性。2 个石榴品种的主成分分析结果显示(表1),除SOD、POD 和CAT 之外,其余指标因子载荷系数均在0.9以上。由此可知,Pn、Tr、Gs、Ci、Chl a、Chl b、Chl a+b、qP、NPQ、Fv/Fm、YⅡ、REC、MDA 均是外源MT影响盐胁迫下石榴幼苗生长的代表性生理指标。
表1 各生理指标因子载荷系数
Table 1 Load coefficient of each physiological index factor
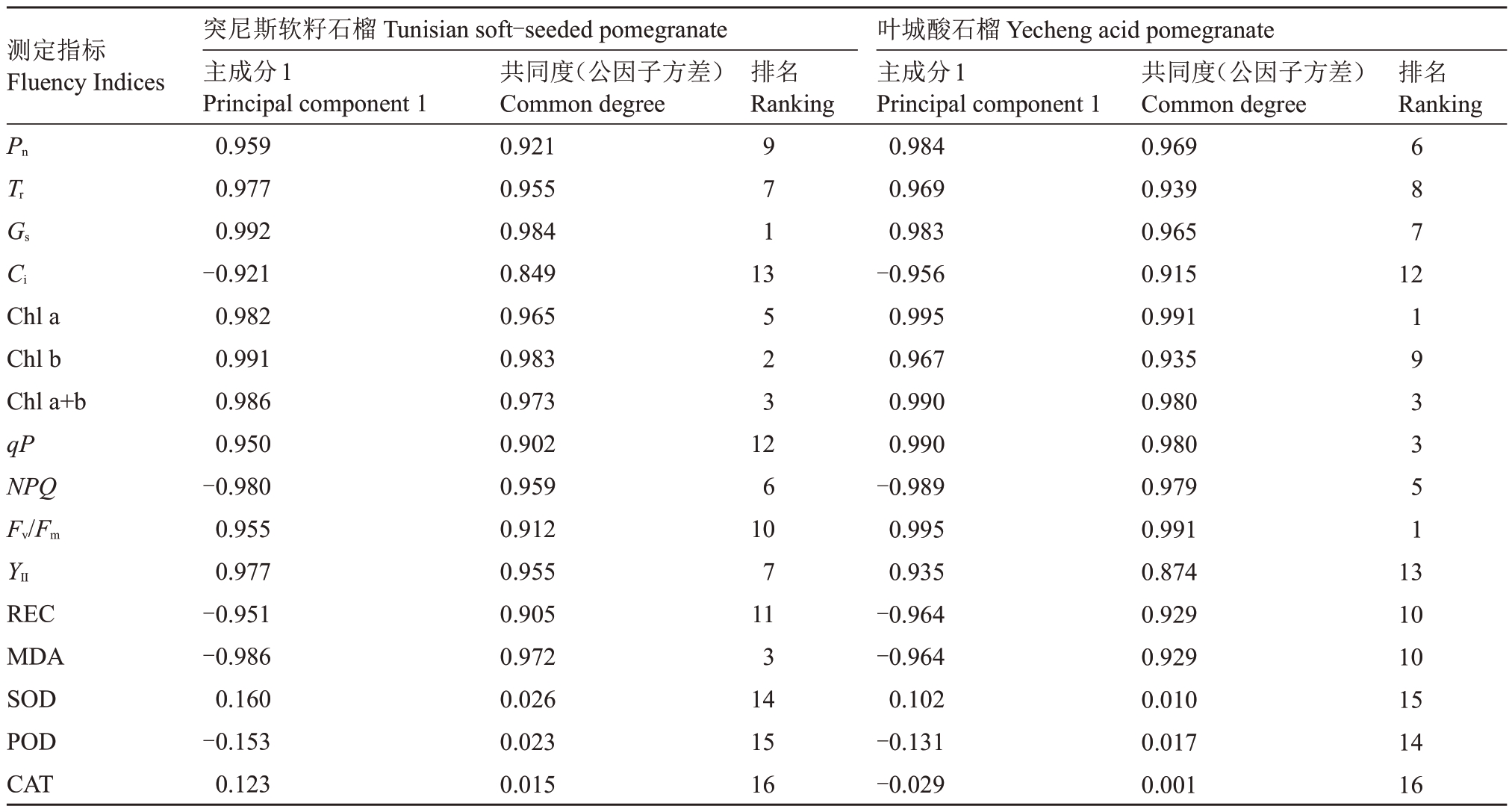
测定指标Fluency Indices突尼斯软籽石榴Tunisian soft-seeded pomegranate主成分1 Principal component 1 0.959 0.977 0.992-0.921 0.982 0.991 0.986 0.950-0.980 0.955 0.977-0.951-0.986 0.160-0.153 0.123共同度(公因子方差)Common degree 0.921 0.955 0.984 0.849 0.965 0.983 0.973 0.902 0.959 0.912 0.955 0.905 0.972 0.026 0.023 0.015排名Ranking排名Ranking Pn Tr Gs 9 7 1 6 8 7 Ci 13 12 Chl a Chl b Chl a+b qP NPQ Fv/Fm 5 2 3 1 9 3 3 5 1 YⅡREC MDA SOD POD CAT 12 6 10 7 11 3 14 15 16叶城酸石榴Yecheng acid pomegranate主成分1 Principal component 1 0.984 0.969 0.983-0.956 0.995 0.967 0.990 0.990-0.989 0.995 0.935-0.964-0.964 0.102-0.131-0.029共同度(公因子方差)Common degree 0.969 0.939 0.965 0.915 0.991 0.935 0.980 0.980 0.979 0.991 0.874 0.929 0.929 0.010 0.017 0.001 13 10 10 15 14 16
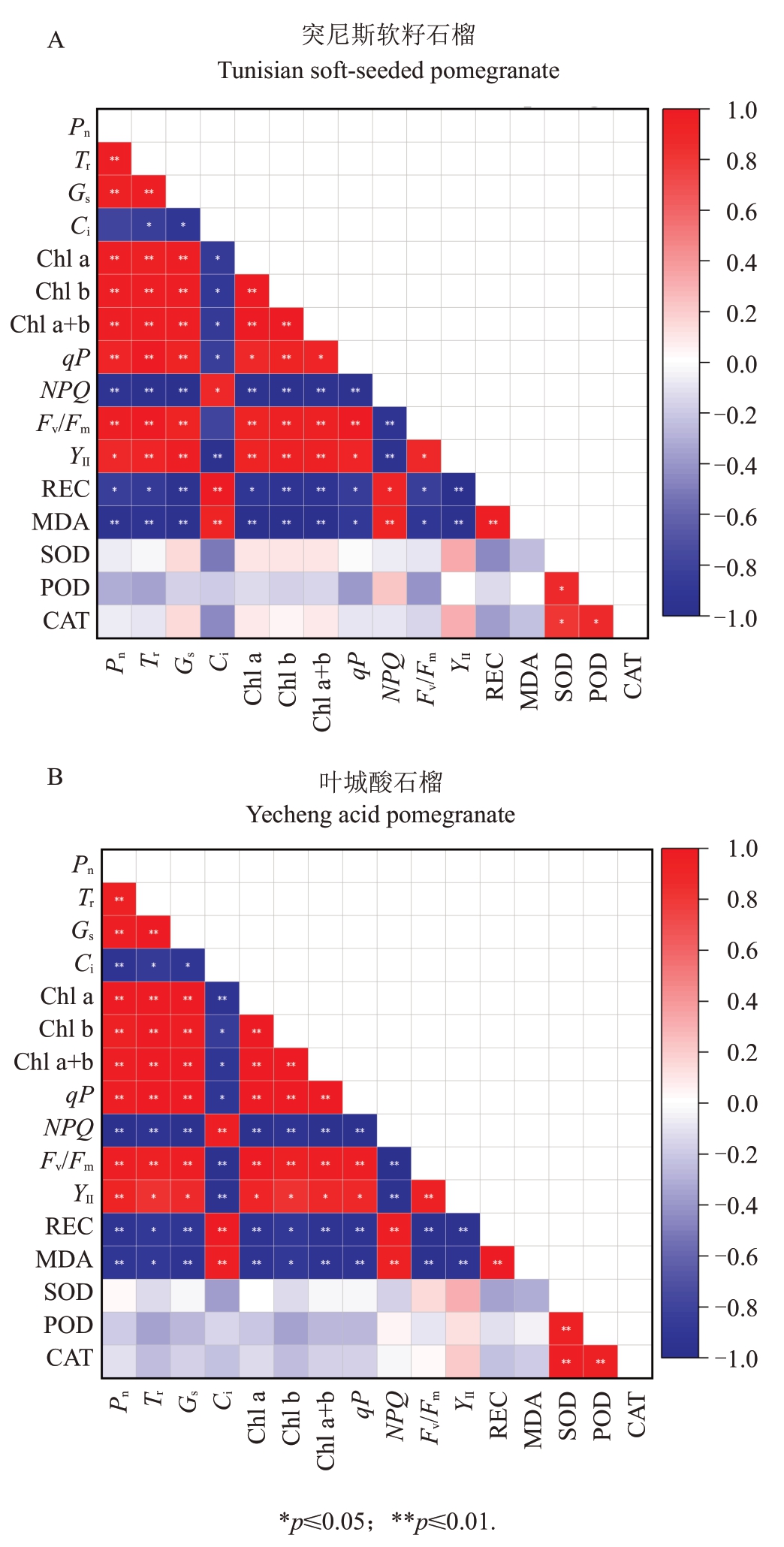
图8 外源MT 对盐胁迫下各生理指标的相关性
Fig.8 Correlation heat map of exogenous MT on physiological indexes under salt stress
为探究盐胁迫下缓解石榴幼苗的最佳MT 浓度,采用秩和比综合评价法分别对不同MT 处理下的缓解作用进行综合性评价(表2)。盐胁迫下,缓解两个石榴品种的最佳MT浓度不同。各处理对突尼斯软籽幼苗生长的缓解效果表现为:对照>T4>T3>T2>T5>T1,即外施200 μmol·L-1褪黑素缓解突尼斯软籽幼苗遭受盐害的效果最佳;各处理对叶城酸幼苗生长的缓解效果表现为:对照>T3>T2>T4>T5>T1,即外施100 μmol·L-1褪黑素缓解叶城酸遭受盐害的效果最佳。
表2 各处理秩和比综合评价表
Table 2 Comprehensive evaluation table of treatment rank sum ratio
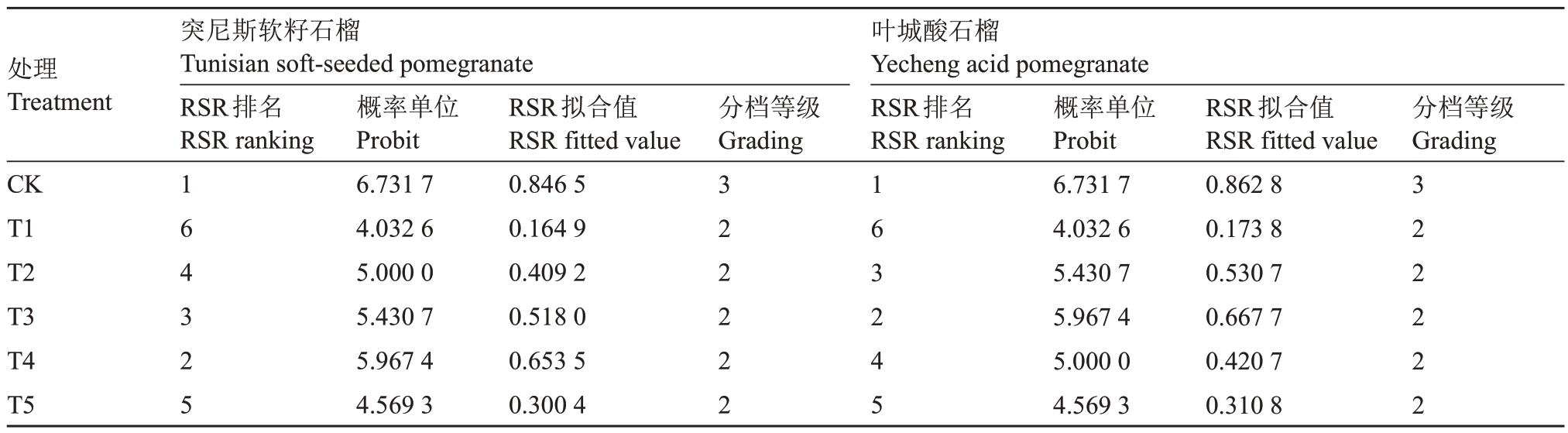
处理Treatment突尼斯软籽石榴Tunisian soft-seeded pomegranate RSR排名RSR ranking概率单位Probit 6.731 7 4.032 6 5.000 0 5.430 7 5.967 4 4.569 3 RSR拟合值RSR fitted value 0.846 5 0.164 9 0.409 2 0.518 0 0.653 5 0.300 4分档等级Grading叶城酸石榴Yecheng acid pomegranate RSR排名RSR ranking分档等级Grading CK T1 T2 T3 T4 T5 1 6 4 3 2 5 3 2 2 2 2 2 1 6 3 2 4 5概率单位Probit 6.731 7 4.032 6 5.430 7 5.967 4 5.000 0 4.569 3 RSR拟合值RSR fitted value 0.862 8 0.173 8 0.530 7 0.667 7 0.420 7 0.310 8 3 2 2 2 2 2
3 讨 论
表型特征是评估植物耐盐性最重要和最直观的指标。笔者的研究结果表明,高盐度(200 mmol·L-1 NaCl)对石榴生长产生负面影响,这些结果与前人的研究结果一致[30]。该研究发现增加盐浓度会抑制石榴枝条长度、叶面积、干鲜质量、开花或产量等方面的生长[30]。盐度限制根系生长,抑制水分和必需矿物质的吸收,减少养分的供应,最终导致生长减缓[19]。盐处理导致盐敏感石榴品种离子大量外渗,保水能力受损,导致气孔关闭,从而降低光合作用和蒸腾速率[20]。Pn降低会间接导致CO2同化减少[31],从而抑制盐敏石榴的生长和发育。因此,盐胁迫下有限的营养导致石榴植株偏小,叶片发黄,严重时还会出现叶片灼伤、坏死等情况[22]。Liu等[20]筛选出了Salavatski、Sirenevyi、Kandahar等10种耐盐石榴品种,他们认为石榴在一定程度上耐盐胁迫,这可能是由于在根中储存Na+并将K+和Ca2+运输到叶片的能力更高。
Pn、Gs、Tr、Ci 是反映植物光合能力的重要参数[31]。本试验中,盐胁迫造成突尼斯软籽和叶城酸石榴幼苗叶片Pn、Gs和Tr降低而Ci升高,这可能与盐胁迫导致石榴幼苗光合作用失调有关。研究表明,盐胁迫会使气孔部分关闭,导致植物叶肉细胞中CO2浓度降低,进而抑制光合作用[32]。本试验发现,施用适宜浓度的MT(100、200 μmol·L-1)后,与盐胁迫相比两个石榴品种的幼苗光合作用参数(Pn、Gs、Tr)均随着胁迫时间的持续而明显改善,其中叶城酸和突尼斯软籽石榴的光合参数分别在MT 浓度为200 μmol·L-1、100 μmol·L-1时最高。郭爱华在外源施用MT对盐碱胁迫下黄瓜幼苗光合特性研究中也得到相似结论[33]。蒋希瑶等[34]的研究认为MT 能提高番茄净光合速率从而缓解碱胁迫带来的非气孔限制,这可能与MT 能使植株保持较低的细胞CO2浓度和增高气孔导度有关。在盐胁迫下甜菜幼苗中也得到了类似的结论,在30~90 μmol·L-1MT浓度下甜菜的光合效率显著提高[35]。也有报道指出,MT作为一种植物生长调节剂,能有效增高干旱胁迫下北美红栎树叶片气孔导度,促进胞间CO2积累,从而提高幼树的净光合速率[36]。
植物在遭受盐胁迫时会发生一系列形态及生理的变化来维持自身的生命活动。叶绿素具有捕获、传递光能的作用,是植物进行光合作用必不可少的物质,主要有Chl a、Chl b以及Chl a+b[37]。在盐胁迫下,植物叶绿体中加速产生降解酶,导致叶绿素降解进而影响植物的光合作用[38]。研究表明,外源MT可能抑制盐胁迫造成的叶绿素降解酶活性的增强,从而提高植物叶片叶绿素含量[35]。本试验中,随着胁迫时间的持续,两个石榴幼苗叶片的叶绿素含量呈下降趋势。喷施外源MT 后,叶绿素含量有所增加,缓解了盐胁迫对光合色素的影响,保证了植物光合作用的正常进行,这与聂萌恩等[39]试验结果一致。
叶绿素荧光是光合作用的有效探针,可以检测几乎所有的光合作用变化[40]。本试验结果表明,盐胁迫提高了NPQ,显著降低了YⅡ、Fv/Fm、qP。在一定程度上施用外源MT减轻了这些影响。作为PSⅡ反应中心的光化学效率,YⅡ的降低意味着盐胁迫抑制光合作用[41]。Fv/Fm的降低是由于光合电子传递速率受到抑制[10]。qP的降低表明PSⅡ功能被破坏,不能有效传递光合电子[42]。NPQ是反映叶绿素吸收和转化的非光化学淬灭指数,是一种用于抵抗光损伤的有效散热元件[43]。在本试验中,盐胁迫导致NPQ增大,PSⅡ和光合速率降低。MT 在盐胁迫下提高了石榴幼苗的YⅡ、Fv/Fm、qP,降低了NPQ,表明MT可以有效提高PSⅡ光化学效率和叶片光合速率,这与对三叶橙的相关研究结果一致[40]。因此,MT可以提高植物在盐胁迫下的光合能力。
植物为应对不利条件引起的氧化应激反应,已经进化出一种有效的抗氧化防御系统,包括酶促抗氧化剂和非酶促抗氧化剂[44]。据报道,盐胁迫条件下,植物抗氧化酶的高活性是植物抵御ROS损伤所必需的,高抗氧化活性可代表植物高氧化胁迫耐受性。在ROS 分解过程中酶系统中的抗氧化酶已被赋予特定作用。在植物细胞中SOD 将O2-转换成H2O2再被CAT 和POD 分解。CAT 催化H2O2水解成H2O 和O2[45]。在氧化应激下,ROS 的产生会促进植物抗氧化酶活性的升高[46]。许多研究证实,MT在非生物胁迫下可增高抗氧化酶活性[47-49]。在本研究中,在盐胁迫下突尼斯软籽和叶城酸石榴的SOD、POD、CAT 活性与对照相比均显著下降。外源喷施MT后,与盐胁迫处理相比,两个石榴品种的抗氧化酶活性均显著增高,随着胁迫时间的延续整体都呈现先升后降的趋势。这与外源MT预处理对ROS清除体系有积极作用,从而提高陆地棉植株的耐盐性的结论一致[50]。同时他们指出外源MT 保护棉花植株免受盐胁迫,防止细胞水平氧化应激引起损伤的原因可能是:MT可作为ROS清除剂和光谱氧化剂,可调节抗氧化酶编码基因的表达从而提高植株抗氧化酶活性,以保护植物组织免受氧化损伤[50]。在玉米幼苗盐胁迫研究中,60 μmol·L-1 MT 浓度均能显著提高SOD、POD、CAT、抗坏血酸过氧化物酶的活性[51]。这些结果表明,MT的应用提高了抗氧化酶的活性,并减少盐胁迫对石榴幼苗中ROS 的积累。REC和MDA常作为鉴定植物耐盐性的重要生理指标,可一定程度上反映植物对逆境胁迫的抵抗能力[32]。REC可衡量植株细胞膜透性,MDA含量则可反映细胞膜质过氧化程度[52]。本试验发现,盐胁迫使突尼斯软籽和叶城酸石榴叶片的REC和MDA含量均显著增大。施用外源MT 后,两个指标的数值显著降低,整体呈现随着MT 浓度增加先降后升的趋势。笔者的研究结果与Jiang 等[53]在玉米中的试验结果一致。在盐胁迫下金盏菊[54]、香椿[55]以及辣椒[56]中,发现MT处理也能够降低MDA的浓度。因此,MT可降低膜中的脂质过氧化作用,保持幼苗细胞膜的完整性和功能表达,从而减轻盐胁迫的毒害,改善植物生长状态[56]。
本研究为研究褪黑素提高石榴耐盐性生理机制提供了一定的理论依据,然而探究外源MT 调控石榴幼苗耐盐性的分子机制仍有待进一步的研究。利用转录组学、代谢组学以及蛋白组学等多组学联合分析技术对外源施用MT 对盐胁迫下石榴生理变化、光合能力的影响等进行多角度解读,有助于进一步揭示相关机制,对培育耐盐石榴品种具有重要意义。
4 结 论
突尼斯软籽和叶城酸分别外施200、100 μmol·L-1 MT 后,显著提高了在盐胁迫下石榴叶片对光能的吸收和捕获能力,提高了光合电子传递速率,增强植物光合能力;同时减少电解质外渗,清除ROS积累,缓解了盐胁迫造成的细胞膜氧化损伤,从而增强植物的耐盐性。这为褪黑素在石榴栽培中的广泛应用提供了一定的理论依据。
[1] KHALIL H A,EL-ANSARY D O,AHMED Z F R. Mitigation of salinity stress on pomegranate (Punica granatum L. cv.Wonderful) plant using salicylic acid foliar spray[J]. Horticulturae,2022,8(5):375.
[2] 周杰,王志春,杨帆.盐碱土壤植物修复机制研究进展[J].生态学杂志,2024,43(5):1453-1462.ZHOU Jie,WANG Zhichun,YANG Fan. Research progress about phytoremediation mechanisms in saline- sodic soils[J].Chinese Journal of Ecology,2024,43(5):1453-1462.
[3] DICHALA O, THERIOS I, PAPADOPOULOS A,CHATZISTATHIS T,CHATZISAVVIDIS C,ANTONOPOULOU C. Effects of varying concentrations of different salts on mineral composition of leaves and roots of three pomegranate(Punica granatum L.) cultivars[J]. Scientia Horticulturae,2021,275:109718.
[4] 杨林林,韩敏琦,高嘉,杨胜敏.不同形态硒对盐胁迫下小麦苗期光合生理、抗氧化系统及离子稳态的影响[J].山东农业科学,2023,55(9):46-56.YANG Linlin,HAN Minqi,GAO Jia,YANG Shengmin. Effects of different selenium forms on photosynthetic physiology,antioxidant system and ion homeostasis of wheat seedlings under salt stress[J]. Shandong Agricultural Sciences,2023,55(9):46-56.
[5] 蒋文鑫,马国辉,赵黎明,黄安琪,冯乃杰,郑殿峰,邹武龙.S-诱抗素对不同盐胁迫下水稻生理特性及产量的影响[J].核农学报,2023,37(12):2485-2495.JIANG Wenxin,MA Guohui,ZHAO Liming,HUANG Anqi,FENG Naijie,ZHENG Dianfeng,ZOU Wulong. Effects of SABA on physiological characteristics and yield of rice under different salt stresses[J]. Journal of Nuclear Agricultural Sciences,2023,37(12):2485-2495.
[6] LERNER A B,CASE J D,TAKAHASHI Y,LEE T H,MORI W. Isolation of melatonin,the pineal gland factor that lightens melanocytes[J]. Journal of the American Chemical Society,1958,80(10):2587.
[7] HATTORI A,MIGITAKA H,IIGO M,ITOH M,YAMAMOTO K,OHTANI-KANEKO R,HARA M,SUZUKI T,REITER R J.Identification of melatonin in plants and its effects on plasma melatonin levels and binding to melatonin receptors in vertebrates[J]. Biochemistry and Molecular Biology International,1995,35(3):627-634.
[8] KE Q B,YE J,WANG B M,REN J H,YIN L N,DENG X P,WANG S W. Melatonin mitigates salt stress in wheat seedlings by modulating polyamine metabolism[J]. Frontiers in Plant Science,2018,9:914.
[9] ARNAO M B,HERNÁNDEZ-RUIZ J. Melatonin and its relationship to plant hormones[J].Annals of Botany,2018,121(2):195-207.
[10] 于郑娇,李书昆,褚鹏飞,房雨婷,王德颖,李亚楠,吴冰洁.外源褪黑素对低温胁迫下番茄幼苗光合荧光及生化特性的影响[J].山东农业科学,2023,55(8):48-55.YU Zhengjiao,LI Shukun,CHU Pengfei,FANG Yuting,WANG Deying,LI Yanan,WU Bingjie. Effects of exogenous melatonin on photosynthetic,fluorescence and biochemical characteristics of tomato seedlings under low temperature stress[J]. Shandong Agricultural Sciences,2023,55(8):48-55.
[11] 张玲,麻冬梅,刘晓霞,马巧利,侯汶君,李嘉文,苏立娜,杭嘉慧.根灌外源褪黑素对干旱胁迫下紫花苜蓿生理特性的影响研究[J].草地学报,2024,32(1):198-206.ZHANG Ling,MA Dongmei,LIU Xiaoxia,MA Qiaoli,HOU Wenjun,LI Jiawen,SU Lina,HANG Jiahui.The effects of exogenous melatonin on seedling physiological characteristics of alfalfa under drought stress[J].Acta Agrestia Sinica,2024,32(1):198-206.
[12] ZHANG Y,ZHOU X J,DONG Y T,ZHANG F,HE Q L,CHEN J H,ZHU S J,ZHAO T L. Seed priming with melatonin improves salt tolerance in cotton through regulating photosynthesis,scavenging reactive oxygen species and coordinating with phytohormone signal pathways[J]. Industrial Crops and Products,2021,169:113671.
[13] 李嘉文,麻冬梅,苏立娜,张玲,侯汶君,杭嘉慧.外源褪黑素对盐胁迫下燕麦幼苗生长及抗氧化系统的影响[J].草地学报,2023,31(2):396-403.LI Jiawen,MA Dongmei,SU Lina,ZHANG Ling,HOU Wenjun,HANG Jiahui. Effects of exogenous melatonin on oat seedling growth and antioxidant system under salt stress[J]. Acta Agrestia Sinica,2023,31(2):396-403.
[14] 李荣,焦志阳,银珊珊,周国彦,谢洋.喷施褪黑素对黄瓜幼苗耐盐效应研究[J].中国瓜菜,2023,36(1):53-58.LI Rong,JIAO Zhiyang,YIN Shanshan,ZHOU Guoyan,XIE Yang. Effects of melatonin spraying on salt tolerance of cucumber seedlings[J]. China Cucurbits and Vegetables,2023,36(1):53-58.
[15] 张琦,张文静,袁宪凯,李明,赵强,杜艳丽,杜吉到.褪黑素对盐胁迫下普通菜豆芽期核酸修复的调控机制[J].植物学报,2023,58(1):108-121.ZHANG Qi,ZHANG Wenjing,YUAN Xiankai,LI Ming,ZHAO Qiang,DU Yanli,DU Jidao. The regulatory mechanism of melatonin on nucleic acid repairing of common bean(Phaseolus vulgaris)at the sprout stage under salt stress[J].Chinese Bulletin of Botany,2023,58(1):108-121.
[16] CALZONE A,COTROZZI L,PELLEGRINI E,LORENZINI G,NALI C,MAATHUIS F. Can the transcriptional regulation of NHX1 SOS1 and HKT1 genes handle the response of two pomegranate cultivars to moderate salt stress? [J]. Scientia Horticulturae,2021,288:110309.
[17] 卓热木·塔西,木合塔尔·扎热,卢明艳,帕丽旦·阿布什,吴正保.自然干旱条件下2 个石榴品种生长和光合等生理特性的变化[J].干旱地区农业研究,2018,36(6):77-85.ZORAM Tax,MUHTAR Zari,LU Mingyan,PARIDAM Abux,WU Zhengbao.Changes in growth and photosynthetic and other physiological characteristics of two pomegranate cultivars under drought condition[J]. Agricultural Research in the Arid Areas,2018,36(6):77-85.
[18] 张晶,李论,张梅,胡晓龙,汪豪.石榴化学成分及药理活性研究进展[J].中国药科大学学报,2023,54(4):421-430.ZHANG Jing,LI Lun,ZHANG Mei,HU Xiaolong,WANG Hao. Research progress in chemical constituent and pharmacological activity of Punica granatum L.[J].Journal of China Pharmaceutical University,2023,54(4):421-430.
[19] 唐海霞,陶吉寒,冯立娟,王中堂,尹燕雷. 石榴耐盐碱研究进展[J].山东农业大学学报(自然科学版),2020,51(5):975-979.TANG Haixia,TAO Jihan,FENG Lijuan,WANG Zhongtang,YIN Yanlei. Research progress of salt and alkali tolerance of pomegranate[J]. Journal of Shandong Agricultural University(Natural Science Edition),2020,51(5):975-979.
[20] LIU C Y,ZHAO X Q,YAN J X,YUAN Z H,GU M M.Effects of salt stress on growth,photosynthesis,and mineral nutrients of 18 pomegranate (Punica granatum) cultivars[J]. Agronomy,2020,10(1):27.
[21] 杨文涛,王琦,郭二丹,徐皓.土壤盐渍化对植物影响的研究进展[J].农业与技术,2024,44(18):95-99.YANG Wentao,WANG Qi,GUO Erdan,XU Hao. Research progress on the effects of soil salinization on plants[J].Agriculture and Technology,2024,44(18):95-99.
[22] CALZONE A,COTROZZI L,PELLEGRINI E,GUIDI L,LORENZINI G,NALI C. Differential response strategies of pomegranate cultivars lead to similar tolerance to increasing salt concentrations[J].Scientia Horticulturae,2020,271:109441.
[23] 关思慧,柴亚倩,崔洪鑫,宋晋泰,朱光裕,刘慧英,郝庆,刁明.低温胁迫对2 个石榴品种幼苗光合参数和生理特性的影响[J].果树学报,2023,40(5):946-958.GUAN Sihui,CHAI Yaqian,CUI Hongxin,SONG Jintai,ZHU Guangyu,LIU Huiying,HAO Qing,DIAO Ming.Effects of low temperature stress on photosynthetic parameters and physiological characteristics for seedlings of two pomegranate varieties[J].Journal of Fruit Science,2023,40(5):946-958.
[24] 朱生堡,乌尔古丽·托尔逊,唐光木,张云舒,徐万里,马海刚.新疆盐碱地变化及其治理措施研究进展[J].山东农业科学,2023,55(3):158-165.ZHU Shengbao,Wuerguli Tuoerxun,TANG Guangmu,ZHANG Yunshu,XU Wanli,MA Haigang. Research progress on salinealkali land changes and its treatment measures in Xinjiang[J].Shandong Agricultural Sciences,2023,55(3):158-165.
[25] 严衍禄,刘心生.叶绿素测定方法的研究[J].北京农业大学学报,1982(2):53-67.YAN Yanlu,LIU Xinsheng. Studies on determination chlorophylls a and b[J].Journal of China Agricultural University,1982(2):53-67.
[26] 肖望. 植物生理学实验指导[M]. 广州:中山大学出版社,2020:45-46.XIAO Wang. Experimental guidance of plant physiology[M].Guangzhou:Sun Yat-sen University Press,2020:45-46.
[27] 王晶英,敖红,张杰,曲桂琴.植物生理生化实验技术与原理[M].哈尔滨:东北林业大学出版社,2003:78-79.WANG Jingying,AO Hong,ZHANG Jie,QU Guiqin. Experimental techniques and principles of plant physiology and biochemistry[M]. Harbin:Northeast Forestry University,2003:78-79.
[28] 柴亚倩,关思慧,崔洪鑫,万文亮,刁明.水氮耦合对软籽石榴幼苗抗氧化生理特性的影响[J].北方园艺,2023(11):29-37.CHAI Yaqian,GUAN Sihui,CUI Hongxin,WAN Wenliang,DIAO Ming. Effects of water and nitrogen coupling on antioxidant physiological characteristics of soft-seeded pomegranate seedlings[J].Northern Horticulture,2023(11):29-37.
[29] 王宁宁,罗雪梅,陈明媛,郭睿,刘建国.外源褪黑素对盐旱复合胁迫下油莎豆种子萌发和幼苗生长的影响[J/OL].中国农业科技导报,1- 11(2024- 08- 09). https://doi.org/10.13304/j.nykjdb.2023.0306.WANG Ningning,LUO Xuemei,CHEN Mingyuan,GUO Rui,LIU Jianguo. Effects of exogenous melatonin on seed germination and seedling growth of salt-drought soybean [J/OL]. Journal of Agricultural Science and Technology,1-11(2024-08-09).https://doi.org/10.13304/j.nykjdb.2023.0306.
[30] OKHOVATIAN-ARDAKANI A R,MEHRABANIAN M,DEHGHANI F,AKBARZADEH A.Salt tolerance evaluation and relative comparison in cuttings of different omegranate cultivar[J].Plant,Soil and Environment,2010,56(4):176-185.
[31] JIANG D,LU B,LIU L T,DUAN W J,CHEN L,LI J,ZHANG K,SUN H C,ZHANG Y J,DONG H Z,LI C D,BAI Z Y.Exogenous melatonin improves salt stress adaptation of cotton seedlings by regulating active oxygen metabolism[J].PeerJ,2020,8:e10486.
[32] 苏立娜,麻冬梅,李嘉文,张玲,侯汶君.外源褪黑素对盐胁迫下两种紫花苜蓿生理及光合特性的影响[J].草地学报,2023,31(3):726-732.SU Lina,MA Dongmei,LI Jiawen,ZHANG Ling,HOU Wenjun. Implications of exogenous melatonin on the physiological and photosynthetic characteristics of the seedlings of two alfalfa varieties[J].Acta Agrestia Sinica,2023,31(3):726-732.
[33] 吴鹏,吕剑,郁继华,刘娜,李金武,金莉,金宁,王舒亚.褪黑素对盐碱复合胁迫下黄瓜幼苗光合特性和渗透调节物质含量的影响[J].应用生态学报,2022,33(7):1901-1910.WU Peng,LÜ Jian,YU Jihua,LIU Na,LI Jinwu,JIN Li,JIN Ning,WANG Shuya. Effects of melatonin on photosynthetic properties and osmoregulatory substance contents of cucumber seedlings under salt-alkali stress[J]. Chinese Journal of Applied Ecology,2022,33(7):1901-1910.
[34] 蒋希瑶,牛宁,崔洪鑫,魏少伟,熊航,刘慧英,刁明.叶面喷施褪黑素对NaHCO3 胁迫下番茄幼苗光合特性的影响[J].干旱地区农业研究,2022,40(2):87-95.JIANG Xiyao,NIU Ning,CUI Hongxin,WEI Shaowei,XIONG Hang,LIU Huiying,DIAO Ming.Effects of leaf surface melatonin spray on photosynthetic properties of tomato seedlings under NaHCO3 stress[J].Agricultural Research in the Arid Areas,2022,40(2):87-95.
[35] LIU L,WANG Z Y,GAI Z J,WANG Y B,WANG B,ZHANG P F,LIU X Y,CHEN J T,ZHANG S Y,LIU D,ZOU C L,LI C F. Exogenous application of melatonin improves salt tolerance of sugar beet (Beta vulgaris L.) seedlings[J].Acta Physiologiae Plantarum,2022,44(6):57.
[36] 汪俊峰,余敏芬,李东宾,吴婷婷,郑炳松,闫道良.褪黑素对模拟干旱胁迫下北美红栎幼树幼树光合性能及抗氧化酶系统的影响[J].生态科学,2021,40(2):167-174.WANG Junfeng,YU Minfen,LI Dongbin,WU Tingting,ZHENG Bingsong,YAN Daoliang.Effects of melatonin on photosynthetic performance and antioxidant enzyme system of Quercus rubra seedlings under simulated drought stress[J].Ecological Science,2021,40(2):167-174.
[37] 方发之,桂慧颖,黎肇家,张晓凤.6 种红树幼苗对不同盐度的生理适应性[J].植物研究,2023,43(6):881-889.FANG Fazhi,GUI Huiying,LI Zhaojia,ZHANG Xiaofeng.Physiological adaptation of six mangrove seedlings to different salinity[J]. Bulletin of Botanical Research,2023,43(6):881-889.
[38] 陈海雁,黄荣,赵亮,杨杰,谢金晶,张振粉.Cp2-EPS 对盐胁迫下紫花苜蓿苗期形态及光合特性的影响[J]. 草地学报,2024,32(1):229-238.CHEN Haiyan,HUANG Rong,ZHAO Liang,YANG Jie,XIE Jinjing,ZHANG Zhenfen.Effects of Cp2-EPS on the morphology and photosynthesis characteristics of alfalfa seedlings under salt stress[J].Acta Agrestia Sinica,2024,32(1):229-238.
[39] 聂萌恩,宁娜,张一中,李双双,范昕琦,柳青山,张海平.褪黑素对盐胁迫下高粱种子萌发的缓解效应及生理机制[J].种子,2023,42(4):31-40.NIE Meng’en,NING Na,ZHANG Yizhong,LI Shuangshuang,FAN Xinqi,LIU Qingshan,ZHANG Haiping.The physiological mechanisms and alleviating effect of melatonin on sorghum seed germination under salt stress[J].Seed,2023,42(4):31-40.
[40] HU C H,ZHENG Y,TONG C L,ZHANG D J.Effects of exogenous melatonin on plant growth,root hormones and photosynthetic characteristics of trifoliate orange subjected to salt stress[J].Plant Growth Regulation,2022,97(3):551-558.
[41] 丁东霞,李能慧,李静,唐超男,王成,牛天航,杨滟,杨海涛,颉建明.外源褪黑素对低温弱光胁迫下辣椒叶绿素荧光和抗氧化系统的影响[J].浙江农业学报,2022,34(9):1935-1944.DING Dongxia,LI Nenghui,LI Jing,TANG Chaonan,WANG Cheng,NIU Tianhang,YANG Yan,YANG Haitao,XIE Jianming. Effects of exogenous melatonin on chlorophyll fluorescence and antioxidant system of pepper (Capsicum annuum L.)under low temperature and low light stress[J].Acta Agriculturae Zhejiangensis,2022,34(9):1935-1944.
[42] 万丽嫱,李光达,和秋兰,王正维,张航,海梅荣.外源褪黑素对UV-B 辐射下马铃薯光合、荧光特性的影响[J].华北农学报,2021,36(4):116-123.WAN Liqiang,LI Guangda,HE Qiulan,WANG Zhengwei,ZHANG Hang,HAI Meirong. Effects of exogenous melatonin on photosynthesis and fluorescence characteristics of potato under UV-B radiation[J]. Acta Agriculturae Boreali-Sinica,2021,36(4):116-123.
[43] 褚晶,田晓芹,陈世华,郭善利.外源褪黑素对小麦幼苗生理及光合荧光特性的影响[J].广西植物,2023,43(4):723-731.CHU Jing,TIAN Xiaoqin,CHEN Shihua,GUO Shanli. Effects of exogenous melatonin on physiological and photosynthetic characteristics of wheat seedings[J]. Guihaia,2023,43(4):723-731.
[44] LI J H,YANG Y Q,SUN K,CHEN Y,CHEN X,LI X H.Exogenous melatonin enhances cold,salt and drought stress tolerance by improving antioxidant defense in tea plant[Camellia sinensis(L.)O.Kuntze][J].Molecules,2019,24(9):1826.
[45] CEN H F,WANG T T,LIU H Y,TIAN D Y,ZHANG Y W.Melatonin application improves salt tolerance of alfalfa (Medicago sativa L.) by enhancing antioxidant capacity[J]. Plants,2020,9(2):220.
[46] 廖振锋,刘寒,沈瑗瑗,谢国勇,韦桂丽,秦双双,缪剑华,韦坤华.逆境胁迫下药用植物抗氧化酶系统响应研究进展[J/OL].分子植物育种,2024:1-18(2023-06-14).https://kns.cnki.net/kcms2/detail/46.1068.S.20230613.1233.006.html.LIAO Zhenfeng,LIU Han,SHEN Yuanyuan,XIE Guoyong,WEI Guili,QIN Shuangshuang,MIAO Jianhua,WEI Kunhua.Medicinal plant antioxidant enzyme system response under adversity stress research progress[J/OL]. Molecular Plant Breeding,2024:1-18(2023-06-14). https://kns.cnki.net/kcms2/detail/46.1068.S.20230613.1233.006.html.
[47] 王胜永,孙治国,田浩.外源褪黑素对盐胁迫下紫花苜蓿光合作用和生理指标的影响[J].黑龙江畜牧兽医,2023(5):12-16.WANG Shengyong,SUN Zhiguo,TIAN Hao. Effects of exogenous melatonin on photosynthesis and physiology of alfalfa under salt stress[J]. Heilongjiang Animal Science and Veterinary Medicine,2023(5):12-16.
[48] 谭英,尹豪.盐胁迫下根施AMF 和褪黑素对紫花苜蓿生长、光合特征以及抗氧化系统的影响[J].草业学报,2024,33(6):64-75.TAN Ying,YIN Hao. Effects of root application of an arbuscular mycorrhizal fungus and melatonin on the growth,photosynthetic characteristics,and antioxidant system of Medicago sativa under salt stresss[J].Acta Prataculturae Sinica,2024,33(6):64-75.
[49] 段文静,孟妍君,江丹,刘连涛,张科,张永江,孙红春,白志英,李存东.外源褪黑素对盐胁迫下棉花幼苗形态及抗氧化系统的影响[J].中国生态农业学报(中英文),2022,30(1):92-104.DUAN Wenjing,MENG Yanjun,JIANG Dan,LIU Liantao,ZHANG Ke,ZHANG Yongjiang,SUN Hongchun,BAI Zhiying,LI Cundong. Effects of exogenous melatonin on the morphology and antioxidant enzyme activities of cotton seedlings under salt stress[J]. Chinese Journal of Eco-Agriculture,2022,30(1):92-104.
[50] SHEN J,CHEN D D,ZHANG X P,SONG L R,DONG J,XU Q J,HU M J,CHENG Y Y,SHEN F F,WANG W. Mitigation of salt stress response in upland cotton(Gossypium hirsutum)by exogenous melatonin[J]. Journal of Plant Research,2021,134(4):857-871.
[51] AHMAD S,CUI W W,KAMRAN M,AHMAD I,MENG X P,WU X R,SU W N,JAVED T,EL-SEREHY H A,JIA Z K,HAN Q F. Exogenous application of melatonin induces tolerance to salt stress by improving the photosynthetic efficiency and antioxidant defense system of maize seedling[J]. Journal of Plant Growth Regulation,2021,40(3):1270-1283.
[52] 丁亮,张仲兴,高彦龙,韩聪,王秀,王延秀.外源GABA 对盐胁迫下苹果砧木B9 幼苗光合荧光及生理特性的影响[J].甘肃农业大学学报,2023,58(4):116-126.DING Liang,ZHANG Zhongxing,GAO Yanlong,HAN Cong,WANG Xiu,WANG Yanxiu. Effects of exogenous GABA on photosynthetic fluorescence and physiological characteristics of apple rootstock B9 seedlings under salt stress[J].Journal of Gansu Agricultural University,2023,58(4):116-126.
[53] JIANG C Q,CUI Q R,FENG K,XU D F,LI C F,ZHENG Q S.Melatonin improves antioxidant capacity and ion homeostasis and enhances salt tolerance in maize seedlings[J].Acta Physiologiae Plantarum,2016,38(4):82.
[54] 范海霞,赵飒,李静,辛国奇.外源褪黑素对盐胁迫下金盏菊幼苗生长、光合及生理特性的影响[J]. 热带作物学报,2021,42(5):1326-1334.FAN Haixia,ZHAO Sa,LI Jing,XIN Guoqi. Effects of exogenous melatonin on the growth,photosynthesis and physiological characteristics of Calendula officinalis seedlings under salt stress[J]. Chinese Journal of Tropical Crops,2021,42(5):1326-1334.
[55] 偶春,张敏,姚侠妹,杨丽梅,刘宇,屈长青.褪黑素对盐胁迫下香椿幼苗生长及离子吸收和光合作用的影响[J].西北植物学报,2019,39(12):2226-2234.OU Chun,ZHANG Min,YAO Xiamei,YANG Limei,LIU Yu,QU Changqing.Effect of melatonin on growth,ion absorption and photosynthesis of Toona sinensis seedlings under salt stress[J].Acta Botanica Boreali-Occidentalia Sinica,2019,39(12):2226-2234.
[56] 陈楠,张维,张晓明.褪黑素调控辣椒幼苗响应盐胁迫下的叶片生理特性[J].中国瓜菜,2023,36(5):84-90.CHEN Nan,ZHANG Wei,ZHANG Xiaoming. Melatonin regulates physiological characteristics of pepper seedlings in response to salt stress[J].China Cucurbits and Vegetables,2023,36(5):84-90.