水果表皮覆盖的蜡质层能够抑制果实表面渗透性、减少蒸腾作用以及防止微生物入侵[1-2]。表皮蜡质的合成底物为具有16或18个碳原子的脂肪酸,其主要在细胞质(C16)或质体(C16、C18)中合成。脂肪酸在长链脂酰辅酶A(long-chain-acyl-coenzyme A,LACS)的作用下分别转化为16和18个碳原子的脂酰基辅酶A。在内质网中,经脂肪酸伸长酶复合物(β-酮脂酰辅酶A 合酶,β-ketoacyl-acyl-coenzyme A synthase,KCS;β-酮脂酰辅酶A 还原酶,β-ketoacyl-acyl-coenzyme A reductase,KCR;β-羟酯酰辅酶A脱水酶,β-hydroxy-acyl- coenzyme A dehydrase,HCD;烯酯酰辅酶A 脱水酶,enoyl-CoA reductase,ECR)催化,延伸成非常长链脂肪酸(Very long chain fatty acids,VLCFAs)。VLCFAs又通过酰基还原途径形成伯醇,并通过脱羰基化生成其他组分,如醛、烷烃、仲醇和酮等,最后这些蜡组分穿过细胞壁,到达果实角质层,并进行自我组装形成肉眼可见的白色霜状或油渍状物质[3-6]。
水果在贮藏过程中,果皮蜡质组分由于受到基因的调控而发生性质的改变。Wu 等[7]研究了3 个亚洲梨品种(库尔勒香梨、雪花梨和玉露香梨)在贮藏过程中表皮蜡质合成代谢关键基因的表达模式,结果表明,果实中PyCER6、PyKCS9、PyKCS20 和PyFDH1 基因上调表达,PyCER60、PyDGAT1 和PyMAH1等基因下调表达,这些基因均参与了果皮蜡质的合成。贮藏期果皮蜡质性质的变化还可能导致果实外观品质下降,即果皮油腻化现象。目前果皮油腻化被认为是一种果实采后常见的生理病害,在苹果和梨上均有发生[8-12],这种病害会影响果实外观品质进而降低商品价值[13]。根据笔者课题组多年生产实践调研和实验室研究发现,梨主栽品种玉露香(Pyrus sinkiangensis‘Yuluxiang’)在常温货架前期和冷藏中后期较易油腻化[12,14-16]。已有研究报道,果皮蜡质合成代谢和乙烯合成相关基因的表达水平、乙烯释放量与果皮油腻化程度密切相关[17,18]。Jiang等[19]研究表明,苹果的MdFAD27和MdFAD28基因参与了果实酯类底物和油腻化外观的形成,且果实的油腻化程度与其乙烯释放速率显著相关。因此,研究梨果皮蜡质合成代谢途径及乙烯合成基因的表达情况对探究梨果皮油腻化发生的分子机制具有重要意义。
1-MCP 是一种乙烯抑制剂,它通过与乙烯竞争受体结合位点而抑制乙烯的释放。1-MCP 已广泛应用于果蔬采后贮藏保鲜。Yang 等[20]研究表明,库尔勒香梨的果实经1-MCP处理后,与长链蜡质合成相关基因的上调表达被抑制。笔者实验室前期研究发现,1-MCP 处理可以抑制常温货架期玉露香梨果皮多种蜡质组分包含醇类、醛类、脂肪酸类和烯烃类化合物含量的上升[21]。因此,挖掘1-MCP 调控玉露香梨果皮蜡质合成的关键基因,对阐明1-MCP调控果皮油腻化潜在的分子机制具有重要意义。本研究中,采用转录组测序技术,以玉露香梨为试材,采用1.0 μL·L-1 1-MCP 熏蒸处理24 h,在20 ℃条件下贮藏0、7、14 d,筛选不同时间处理后果皮的差异表达基因,旨在探究1-MCP对货架期玉露香梨果皮蜡质合成代谢基因的调控作用,为梨果采后油腻化防控提供理论依据。
1 材料和方法
1.1 试验材料与处理
供试玉露香梨采摘于辽宁省葫芦岛市赵家沟村,果园管理中上等水平,树龄10 a(年),土壤为壤砂土,采收当年盛花期为4月15日,采收时间为商业采收期9月15日,采摘后于2 h内运送至中国农业科学院果树研究所。挑选大小均一、无病虫害和磕碰伤的果实用于后续试验。采用1.0µL·L-1的1-MCP在室温(20±1)℃条件下熏蒸24 h,以未熏蒸果实为对照,于20 ℃环境下放置21 d,每隔7 d取1次玉露香梨果皮,于-80 ℃超低温冰箱冻存,用于后续分析。
1.2 果面亮度L值
果面亮度L值的检测参照于宛婷等[22]的方法。
1.3 RNA提取与cDNA合成
采用RN53-EASYspin Plus 多糖多酚复杂植物RNA 快速提取试剂盒(艾德莱,北京贝洛生物科技有限公司)提取试验梨果皮的总RNA。利用1%琼脂糖凝胶电泳和超微量分光光度计检测RNA 的完整性、纯度和浓度。将检测合格后(RNA 无显著降解,A260/A280在2.0~2.2 之间)的样品送至广州基迪奥生物科技有限公司进行文库构建和转录组测序工作;另使用cDNA 合成试剂盒(Thermo Scientific™EP0733,北京中泰弘丰科技有限公司)将RNA 反转录成cDNA,用于后续研究。
1.4 转录组数据质控和参考基因组比对分析
所选样品的时间为货架0、7、14 d,每个处理设置3个生物学重复。通过对玉露香梨果皮测序得到的原始数据进行数据过滤,以减少无效数据造成的分析干扰。首先对下机的raw reads 利用fastp[23]进行质控,具体包括去除含接头(adapter)的reads、含N(N 表示无法确定的碱基信息)比例大于10%的reads、含100%A 碱基的reads、低质量reads(质量值Q≤20 的碱基数占整条read 的50%以上),最终得到clean reads。并通过GC含量、Q20、Q30数据指标对clean reads进行评判,得到的clean reads用于后续转录组分析。玉露香梨的参考基因组和基因模型注释文件从NCBI 网站(https://www.ncbi.nlm.nih.gov/genomes/all/GCF_000315295.1)下载。采用HISTA2[24]软件开展基于参考基因组的比对分析,通过全局和局部搜索比对到RNA-Seq测序数据中的spliced reads。
1.5 基因的定量分析和差异表达基因的筛选
基因表达量的准确性依赖于转录本重构结果的完善程度。根据HISTA2 的比对结果,利用Stringtie[25]重构转录本,并利用RSEM[26]计算每个样本中所有基因的表达量。使用FPKM(Fragments Per Kilobase of exon model per Million mapped fragments)矫正测序深度和基因长度对表达量的影响。在基因表达量的基础上通过DESeq2 进行差异表达分析,差异表达基因的筛选标准为基因表达量变化倍数|log2 foldchange|>1和FDR值(falsediscoveryrate)<0.05。
1.6 差异表达基因的富集分析
应用Omicsmart-组学挖掘数据平台(https://www.omicsmart.com/)对差异表达基因进行KEGG(Kyoto Encyclopedia of Genes and Genomes)通路富集分析。KEGG 通路富集以corrected-p value ≤0.05作为显著性富集的阈值,将差异表达基因筛选、分类为不同的代谢通路和次级代谢途径。
1.7 RT-qPCR验证分析
根据1.6 脂质代谢途径共筛选出7 个蜡质合成相关显著差异基因,另筛选2 个乙烯合成显著差异基因,设计引物(表1),根据文献报道的亚洲梨内参基因[7]设计内参引物进行RT-qPCR验证。引物均采购自生工生物工程(沈阳)股份有限公司。利用荧光定量PCR 仪(BioRAD CFX96 Touch,USA),采用Taq Pro Universal SYBR qPCR Master Mix试剂盒的方法测定上述目标基因的相对丰度。qPCR 反应条件如下:95 ℃保持30 s以激活Taq酶,随后95 ℃变性5 s,54 ℃退火及延伸30 s 并循环40 次。溶解曲线采集程序为:95 ℃,15 s;60 ℃,60 s;95 ℃,15 s。最后,根据扩增反应得到相应的Ct值,采用-2△△Ct的方法计算目标基因的相对表达量。
表1 RT-qPCR 实验所用引物Table 1 Primers used in RT-qPCR
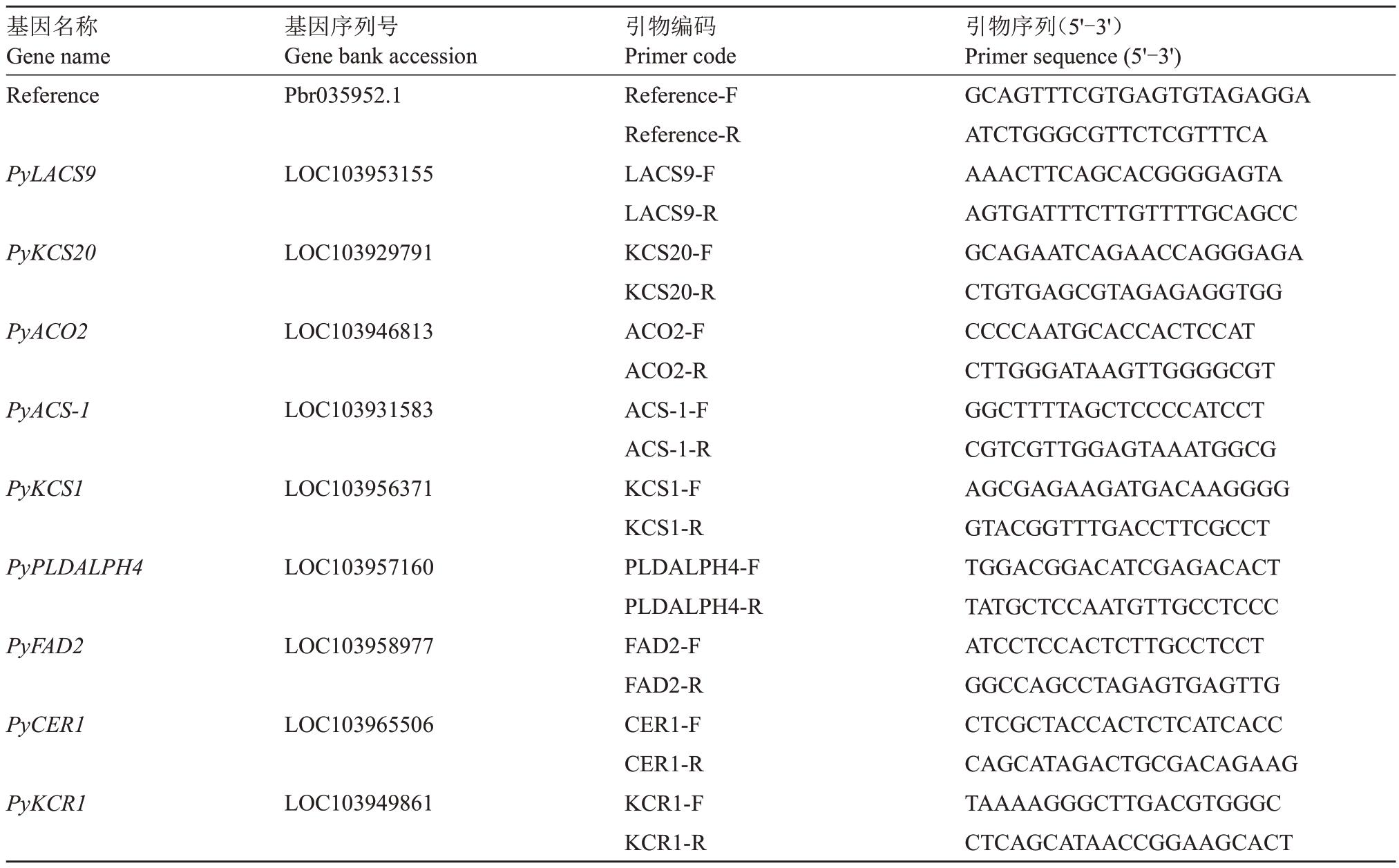
基因名称Gene name Reference基因序列号Gene bank accession Pbr035952.1 PyLACS9 LOC103953155 PyKCS20 LOC103929791 PyACO2 LOC103946813 PyACS-1 LOC103931583 PyKCS1 LOC103956371 PyPLDALPH4 LOC103957160 PyFAD2 LOC103958977 PyCER1 LOC103965506 PyKCR1 LOC103949861引物编码Primer code Reference-F Reference-R LACS9-F LACS9-R KCS20-F KCS20-R ACO2-F ACO2-R ACS-1-F ACS-1-R KCS1-F KCS1-R PLDALPH4-F PLDALPH4-R FAD2-F FAD2-R CER1-F CER1-R KCR1-F KCR1-R引物序列(5'-3')Primer sequence(5'-3')GCAGTTTCGTGAGTGTAGAGGA ATCTGGGCGTTCTCGTTTCA AAACTTCAGCACGGGGAGTA AGTGATTTCTTGTTTTGCAGCC GCAGAATCAGAACCAGGGAGA CTGTGAGCGTAGAGAGGTGG CCCCAATGCACCACTCCAT CTTGGGATAAGTTGGGGCGT GGCTTTTAGCTCCCCATCCT CGTCGTTGGAGTAAATGGCG AGCGAGAAGATGACAAGGGG GTACGGTTTGACCTTCGCCT TGGACGGACATCGAGACACT TATGCTCCAATGTTGCCTCCC ATCCTCCACTCTTGCCTCCT GGCCAGCCTAGAGTGAGTTG CTCGCTACCACTCTCATCACC CAGCATAGACTGCGACAGAAG TAAAAGGGCTTGACGTGGGC CTCAGCATAACCGGAAGCACT
1.8 数据分析
利用Microsoft Excel 2016 软件绘图、计算平均值和标准误差。利用SPSS 25.0软件进行方差分析,采用邓肯法检验组间的差异性。
2 结果与分析
2.1 1-MCP 对玉露香梨货架期果皮颜色和油腻化的影响
如图1所示,随着货架时间的延长,玉露香梨果面绿色逐渐褪去,逐渐转黄且越来越亮,同时伴随油腻化的发生,而1-MCP 处理显著抑制了货架前7 d果皮油腻化的发生。货架第14天,对照组梨果面基本全部转黄且油腻化现象也更加严重,而1-MCP处理组仍保持较好的绿色。货架第21 天,对照和1-MCP 组梨果面均全部转黄,用手摩擦有油腻感,已失去商品价值。

图1 1-MCP 处理对玉露香梨货架期果皮颜色和油腻化的影响
Fig.1 Effects of 1-MCP treatment on Yuluxiang pears’appearance and greasy peel during shelf life
2.2 1-MCP对玉露香梨货架期果面L值的影响
L 值可反映果皮油腻化的程度,L 值越高,果皮越油腻[21,27]。如图2 所示,随着货架时间的延长,对照组L 值不断上升,而1-MCP 处理组L 值变化不明显,且在货架第14 天较前期下降。货架第7 天,对照组果实L值高于1-MCP处理组,但两组差异不显著(p≥0.05)。货架第14天和第21天,对照组果实L值均显著高于1-MCP处理(p<0.05)。
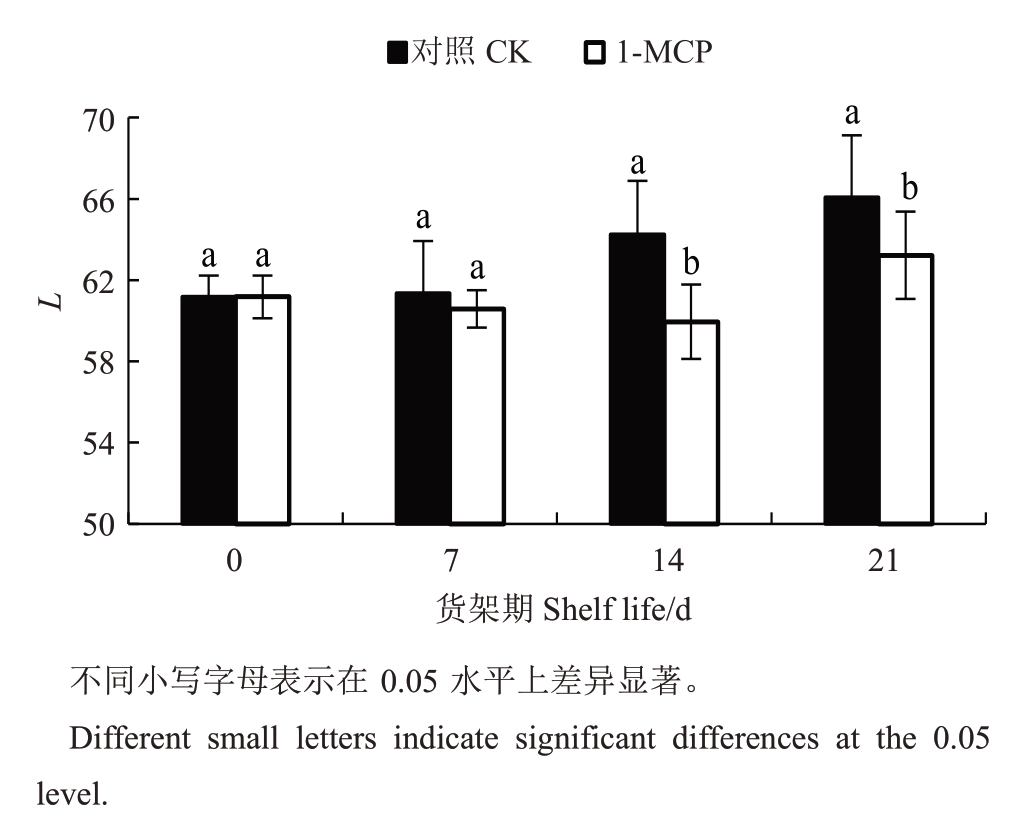
图2 1-MCP 处理对玉露香梨货架期果面L 值的影响
Fig.2 Effect of 1-MCP treatment on L value of Yuluxiang pear during shelf life
2.3 转录组测序数据质量评价
分别对货架0、7、14 d 的玉露香梨果皮进行转录组测序分析,5 组处理、每组3 次重复,构建了15个cDNA 文库,共获得103 283 229 900 条clean reads,其中Q20 所占百分比均在97.90%以上,Q30所占百分比均在93.80%以上,平均每个样品的GC含量为46.03%(表2)。由此可知,本次测序得到的玉露香梨果皮转录组的数据量和质量都较高,可满足下一步基因组比对分析的要求。
表2 玉露香梨果皮转录组测序数据质量信息
Table 2 Quality information of transcriptome sequencing data of Yuluxiang pear
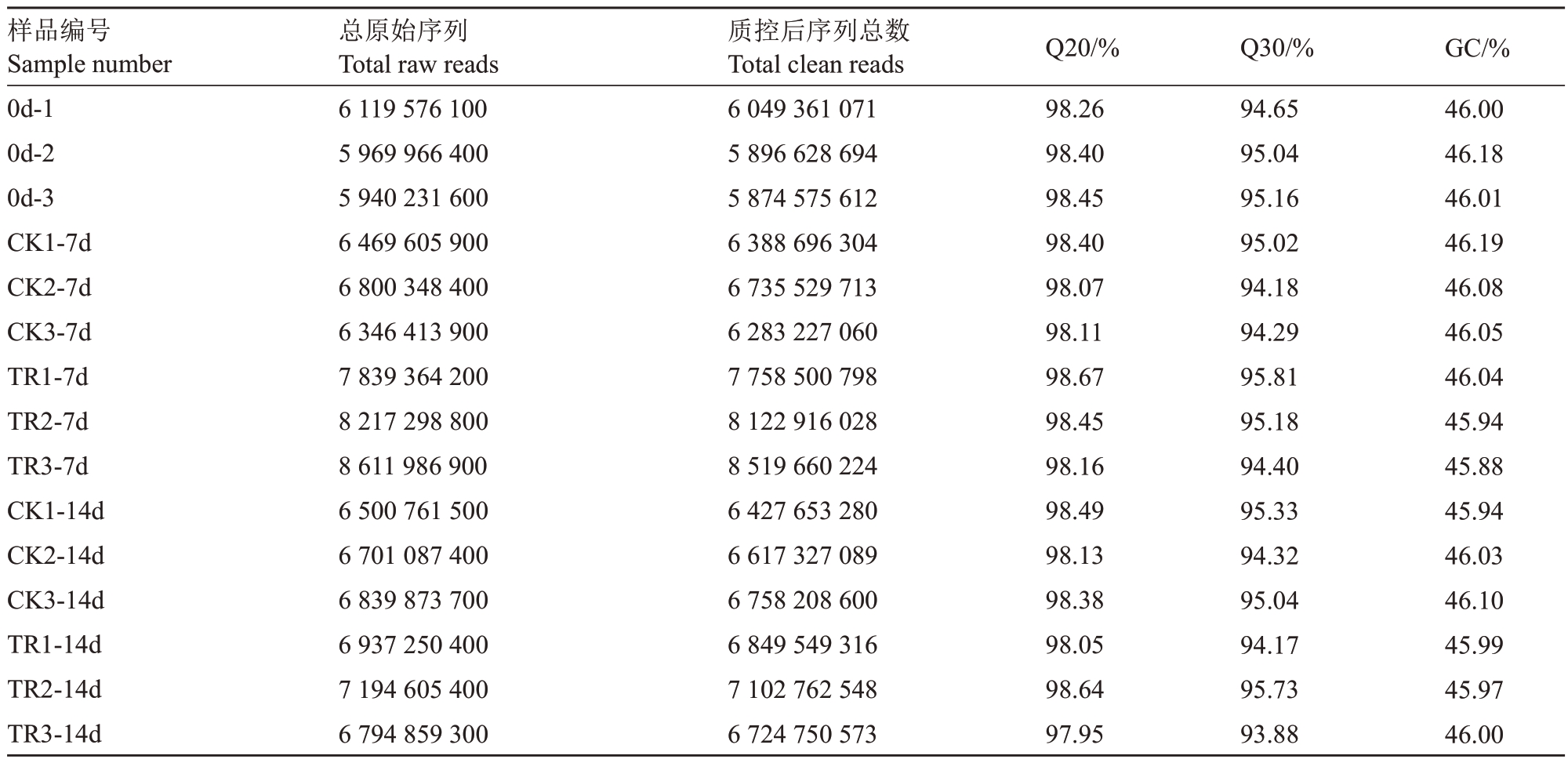
注:TR 代表1-MCP 处理,下同。Q20、Q30 表示Phred 数值大于20、30 的碱基占总碱基数的百分比;GC 表示碱基G 和C 的数量总和占总碱基数量的百分比。
Note:TR represents 1-MCP processing,the same below.Q20 and Q30 represent the percentage of bases with Phred values greater than 20 and 30 in the total number of bases.GC represents the total number of bases G and C as a percentage of the total number of bases.
样品编号Sample number 0d-1 0d-2 0d-3 CK1-7d CK2-7d CK3-7d TR1-7d TR2-7d TR3-7d CK1-14d CK2-14d CK3-14d TR1-14d TR2-14d TR3-14d总原始序列Total raw reads 6 119 576 100 5 969 966 400 5 940 231 600 6 469 605 900 6 800 348 400 6 346 413 900 7 839 364 200 8 217 298 800 8 611 986 900 6 500 761 500 6 701 087 400 6 839 873 700 6 937 250 400 7 194 605 400 6 794 859 300质控后序列总数Total clean reads 6 049 361 071 5 896 628 694 5 874 575 612 6 388 696 304 6 735 529 713 6 283 227 060 7 758 500 798 8 122 916 028 8 519 660 224 6 427 653 280 6 617 327 089 6 758 208 600 6 849 549 316 7 102 762 548 6 724 750 573 GC/%46.00 46.18 46.01 46.19 46.08 46.05 46.04 45.94 45.88 45.94 46.03 46.10 45.99 45.97 46.00 Q20/%98.26 98.40 98.45 98.40 98.07 98.11 98.67 98.45 98.16 98.49 98.13 98.38 98.05 98.64 97.95 Q30/%94.65 95.04 95.16 95.02 94.18 94.29 95.81 95.18 94.40 95.33 94.32 95.04 94.17 95.73 93.88
将检验合格的clean reads与梨参考基因组进行比对分析,结果(表3)显示,能定位到参考基因组上的测序序列的占比(mapping rate)范围在76.45%~78.61%,均大于70%,表明选择的梨基因组合适,且梨样品不存在污染。在参考序列上有唯一比对(uniquely mapping)位置的clean reads的占比范围在68.56%~70.79%。在参考序列上有多个比对位置(multiple mapping)的clean reads 的占比范围在7.73%~8.09%,均小于10%。上述结果表明,玉露香梨果皮的转录组测序数据与梨参考基因组比对结果良好,可用于下一步差异表达基因的分析。
表3 玉露香梨参考基因组比对情况统计
Table 3 Reference genome comparison statistics of Yuluxiang pear
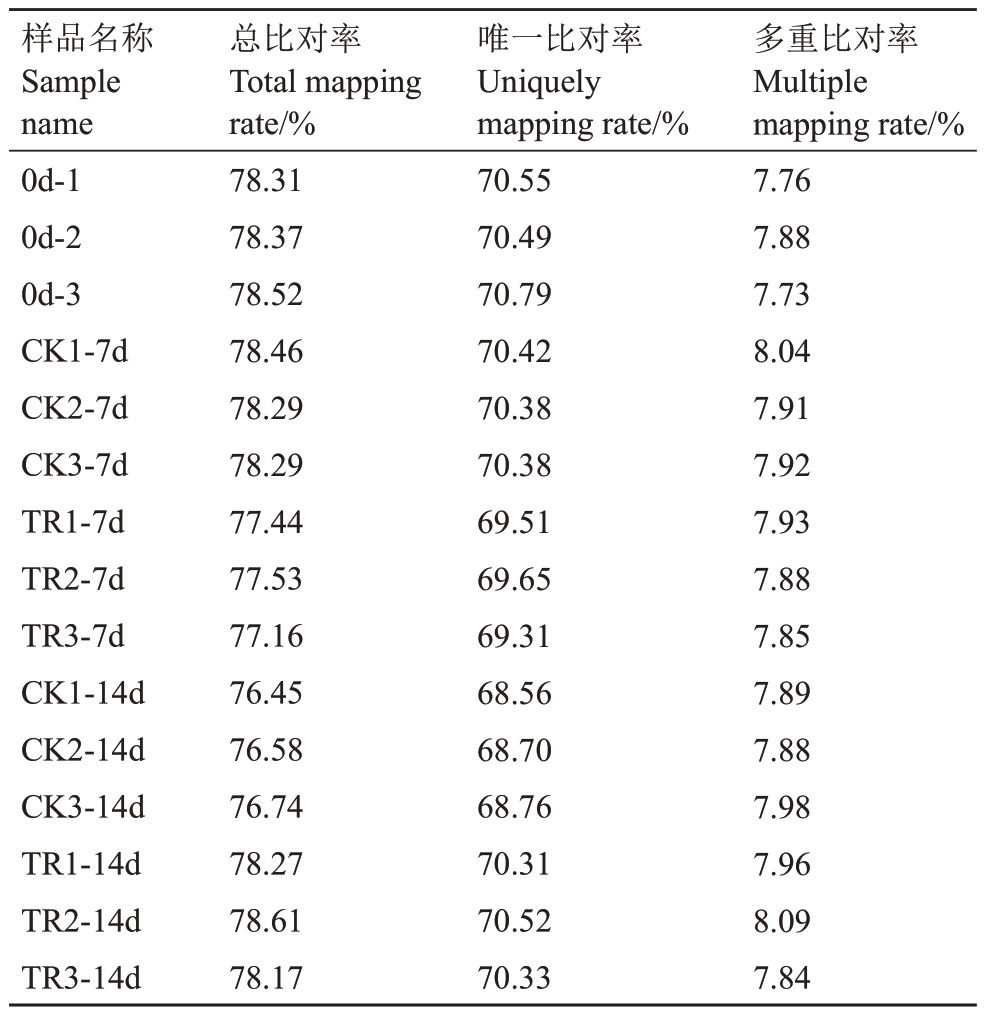
样品名称Sample name 0d-1 0d-2 0d-3 CK1-7d CK2-7d CK3-7d TR1-7d TR2-7d TR3-7d CK1-14d CK2-14d CK3-14d TR1-14d TR2-14d TR3-14d总比对率Total mapping rate/%78.31 78.37 78.52 78.46 78.29 78.29 77.44 77.53 77.16 76.45 76.58 76.74 78.27 78.61 78.17唯一比对率Uniquely mapping rate/%70.55 70.49 70.79 70.42 70.38 70.38 69.51 69.65 69.31 68.56 68.70 68.76 70.31 70.52 70.33多重比对率Multiple mapping rate/%7.76 7.88 7.73 8.04 7.91 7.92 7.93 7.88 7.85 7.89 7.88 7.98 7.96 8.09 7.84
2.4 货架期玉露香梨差异表达基因分析
由图3 可知,与货架0 d 相比,货架7 d 后,对照组共有494个差异基因上调表达,271个差异基因下调表达,1-MCP 组共有2905 个差异基因上调表达,616 个基因下调表达(图3-A、C)。与货架7 d 相比,货架14 d后,对照组共有280个差异基因上调表达,112个差异基因下调表达,1-MCP组共有435个差异基因上调表达,1114 个差异基因下调表达(图3-B、D)。此外,对比同一货架期不同处理的差异基因表达情况发现,与对照组相比,货架7 d 后,1-MCP 组共有2463 个差异基因上调表达,599 个差异基因下调表达(图3-E),货架14 d 后,1-MCP 组共有786 个差异基因上调表达,284个差异基因下调表达(图3-F)。因为货架7 d 后,1-MCP 处理组玉露香梨果实显著上调表达的差异基因数远高于对照组,所以在后续分析中重点关注此时间点。
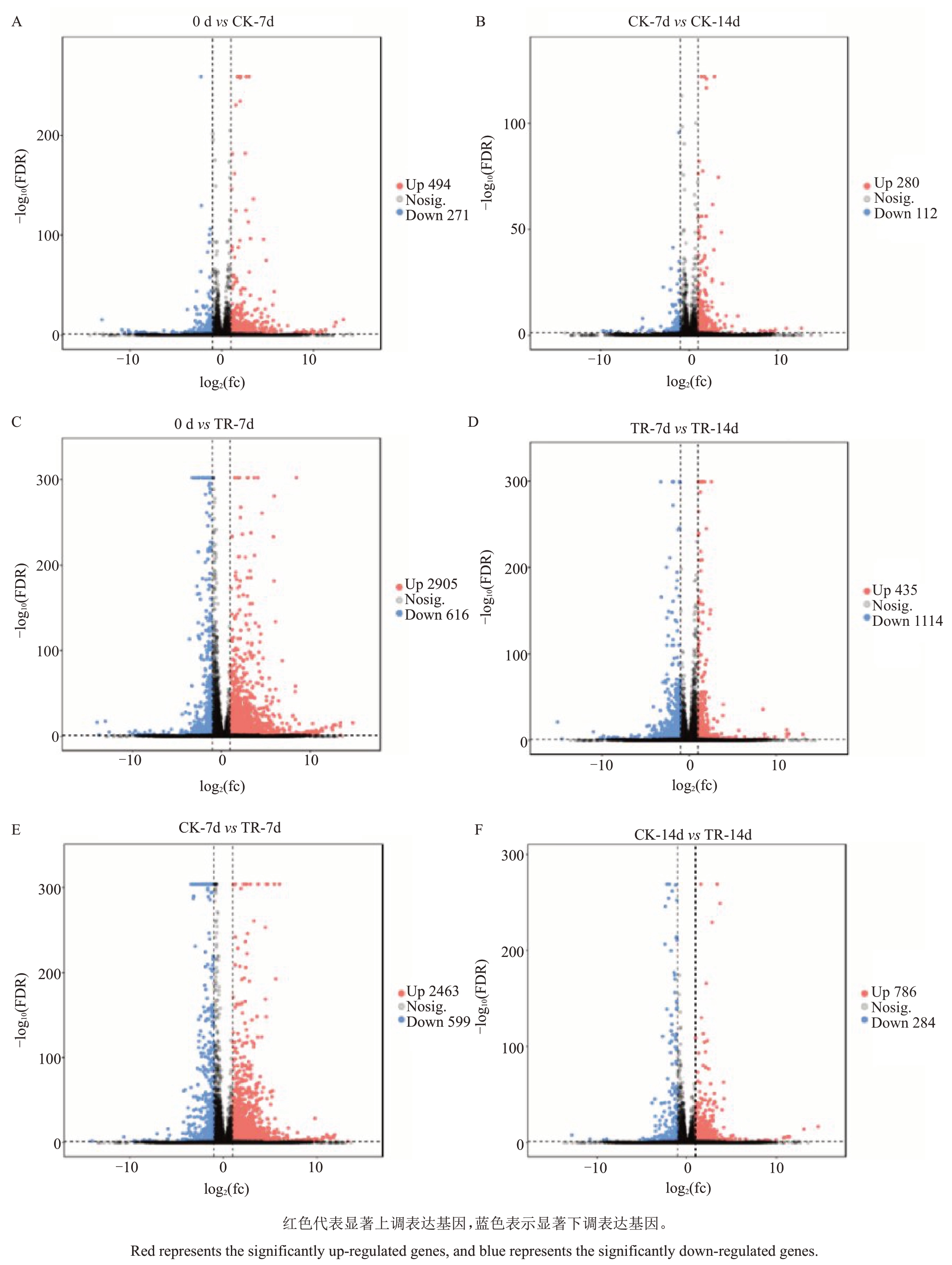
图3 常温货架期1-MCP 处理的玉露香梨差异表达基因火山图
Fig.3 Volcano map of differentially expressed genes of Yuluxiang pear treated with 1-MCP at room temperature during shelf life
2.5 KEGG 富集分析玉露香梨脂质代谢通路和次级代谢途径
对货架前7 d 的对照和处理组玉露香梨果皮显著差异基因进行韦恩图分析,如图4-A所示,而后将除0 d vs CK-7d的95个基因之外的所有显著差异基因进行KEGG富集分析,结果如图4-B所示,货架第7 天,共95 个差异基因富集到脂代谢通路。这些差异基因主要富集在角质(cutin)、软木脂(suberin)和蜡(wax)的生物合成,倍半萜和三萜类生物合成,α-亚麻酸和亚油酸代谢,甘油酯代谢,脂肪酸延伸(fatty acid elongation),脂肪酸生物合成和降解(fatty acid biosynthesis and degradation),不饱和脂肪酸的生物合成等13 个次级脂质代谢途径。根据已有文献报道[28]与蜡质合成代谢直接相关的次级代谢途径分别为角质、软木脂和蜡的生物合成、脂肪酸延伸、脂肪酸生物合成和脂肪酸降解。在本研究中,玉露香梨果皮转录组测序分析结果显示,在与蜡质合成直接相关的途径中共检测到29个差异表达转录本,包括角质、软木脂和蜡的生物合成、脂肪酸降解、脂肪酸生物合成和脂肪酸延伸途径的11、12、3、3个差异表达基因。

图4 差异基因韦恩图分析和KEGG 富集分析次级脂质代谢途径(0~7 d)
Fig.4 Venn diagram analysis of differential expressed gene and KEGG enrichment analysis of secondary lipid metabolic pathway(0--7 d)
对货架7 d后对照组和1-MCP处理的玉露香梨果皮蜡质合成脂质代谢通路图进行分析(图5),共检测到7 个参与脂肪酸延伸途径、脂肪酸脱羧途径和酰基还原途径的差异表达转录本,分别为PyKCS1、PyKCS20、PyKCR1、PyPLDALPHA4、PyLACS9、Py-FAD2、PyCER1。相比于对照,1-MCP 处理导致PyKCS1 上调表达,PyKCS20、PyKCR1、PyCER1、Py-LACS9、PyPLDALPHA4和PyFAD2下调表达。
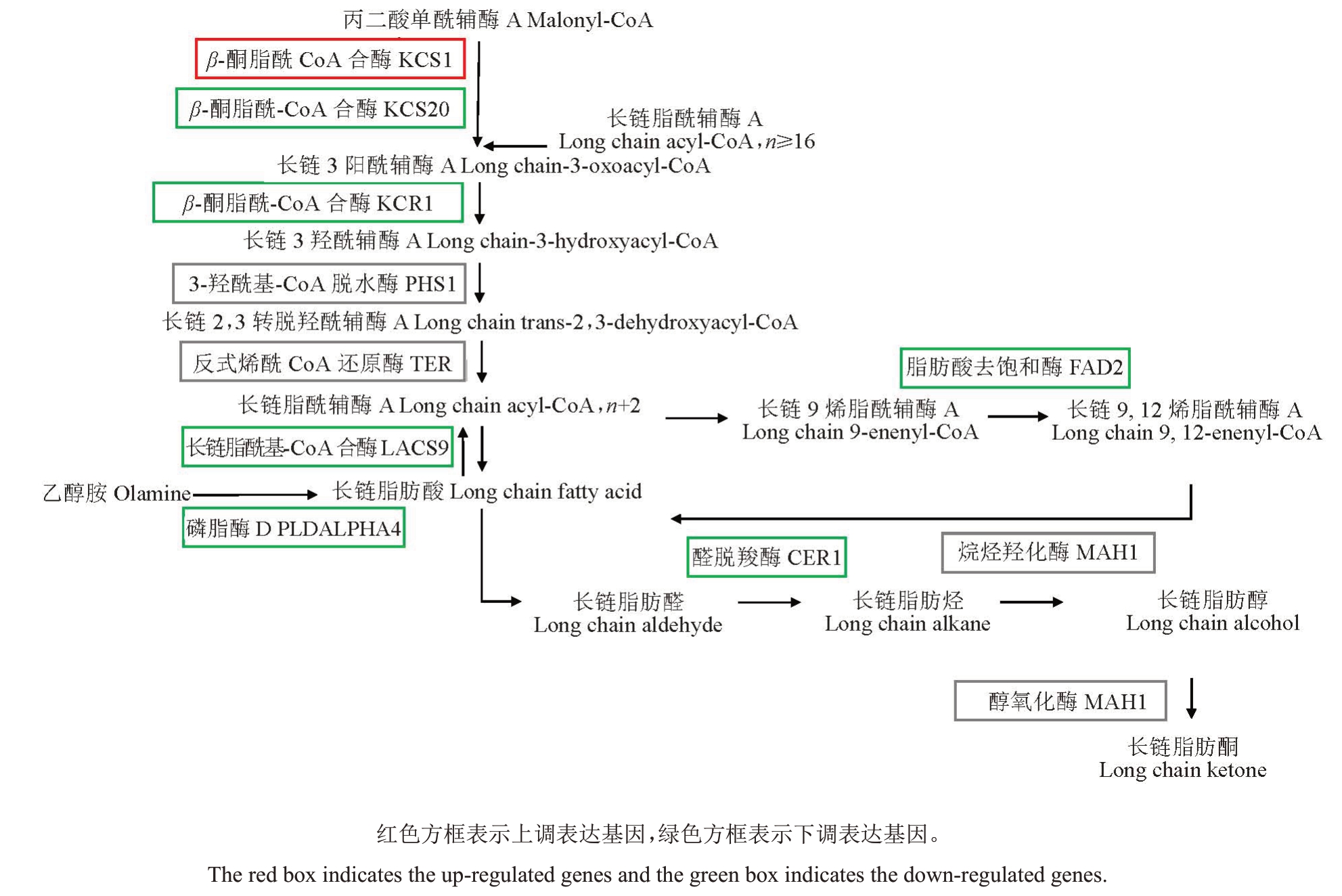
图5 玉露香梨果皮脂质代谢通路图
Fig.5 Lipid metabolism pathway map of Yuluxiang pear peel
2.6 RT-qPCR验证
根据KEGG 富集分析结果,选择7 个与脂质合成代谢相关的基因和2 个乙烯合成相关基因进行RT-qPCR验证。结果表明,与对照相比,货架7 d和14 d后,1-MCP处理均显著抑制PyLACS9、PyKCS20、PyCER1、PyACO2 和PyACS-1 基因的表达,显著促进PyKCS1 基因的表达;货架7 d 后,1-MCP 处理显著抑制PyPLDALPHA4 和PyFAD2 基因的表达(图6)。
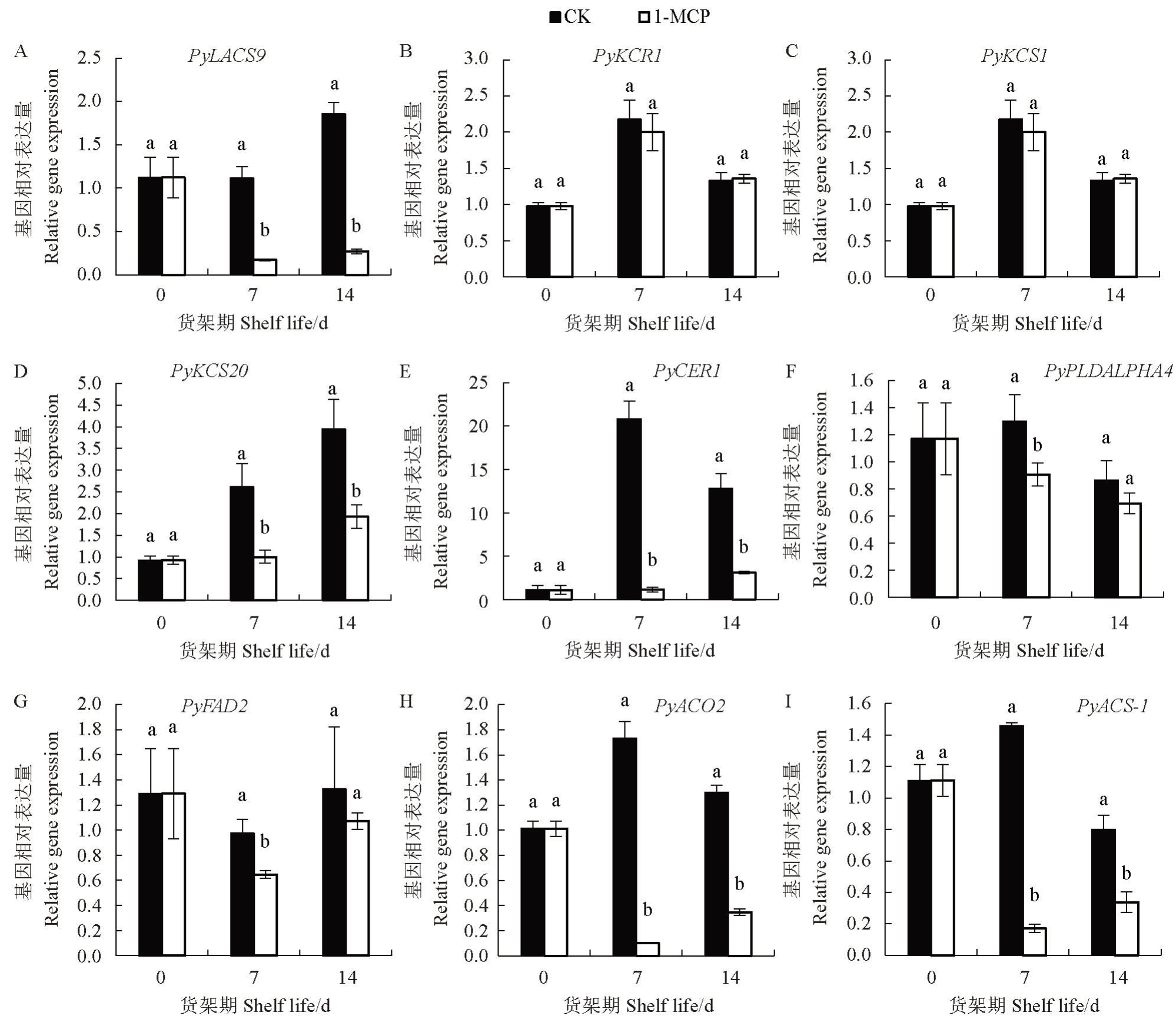
图6 RT-qPCR 验证1-MCP 处理的玉露香梨显著差异表达基因
Fig.6 RT-qPCR verification of significant differentially expressed genes of 1-MCP treated Yuluxiang pear
2.7 差异基因相对表达量与L值的相关性分析
如表4 所示,L 值与PyLACS9 呈显著正相关(r=0.99,p<0.05),与PyKCS20 呈正相关,与PyKCS1、PyPLDALPHA4、PyACS-1呈负相关,与PyKCR1、Py-CER1、PyACO2 呈弱相关。此外,不同差异基因间相关性表现为,PyLACS9与PyACS-1呈负相关,PyKCR1、PyCER1 与PyACO2 呈正相关,PyPLDALPHA4与PyACS-1 呈正相关,PyFAD2 与PyACO2、PyACS-1均呈负相关。
表4 1-MCP 处理的玉露香梨显著差异基因与果面亮度L 值的相关性分析
Table 4 Correlation analysis of significantly differential expressed genes and fruit surface brightness L value of 1-MCP treated Yuluxiang pear
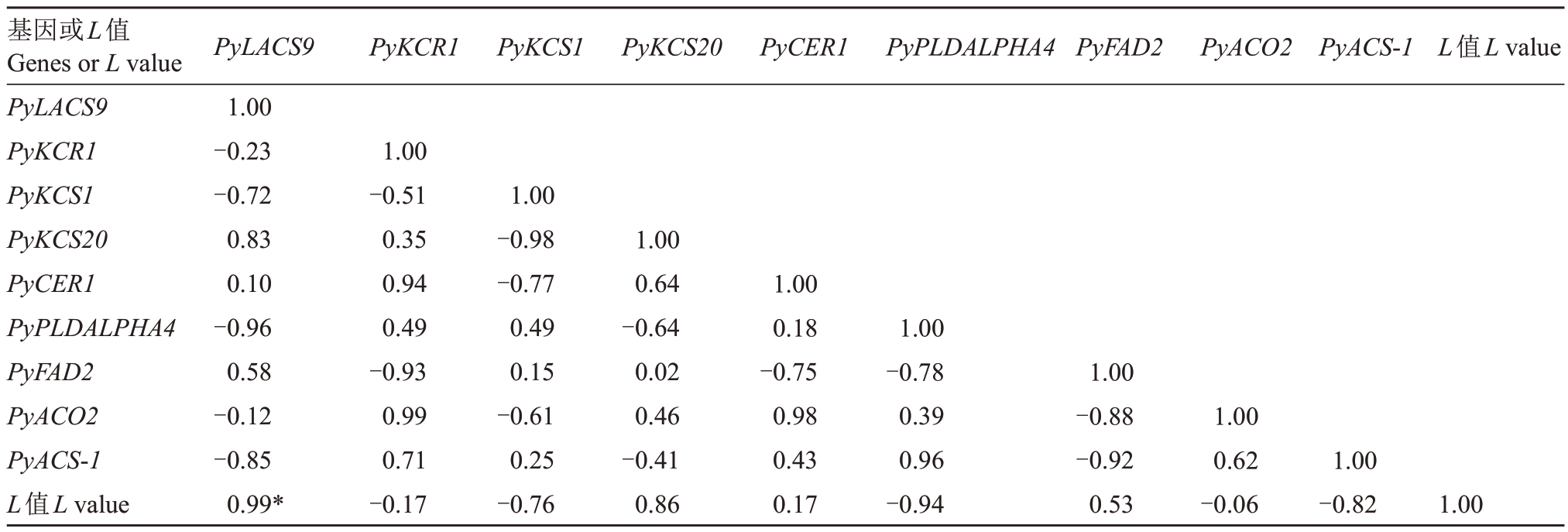
注:*表示在0.05 水平上相关性显著。
Note:*indicates a significant correlation at the 0.05 level.
基因或L值Genes or L value PyLACS9 PyKCR1 PyKCS1 PyKCS20 PyCER1 PyPLDALPHA4 PyFAD2 PyACO2 PyACS-1 L值L value PyLACS9 1.00-0.23-0.72 0.83 0.10-0.96 0.58-0.12-0.85 0.99*PyKCR1 PyKCS1 PyKCS20 PyCER1 PyPLDALPHA4 PyFAD2 PyACO2 PyACS-1 L值L value 1.00-0.51 0.35 0.94 0.49-0.93 0.99 0.71-0.17 1.00-0.98-0.77 0.49 0.15-0.61 0.25-0.76 1.00 0.64-0.64 0.02 0.46-0.41 0.86 1.00 0.18-0.75 0.98 0.43 0.17 1.00-0.78 0.39 0.96-0.94 1.00-0.88-0.92 0.53 1.00 0.62-0.06 1.00-0.82 1.00
3 讨 论
3.1 果皮蜡质合成代谢与油腻化的关系
蜡质组分的合成代谢反应在采前植物的果实、叶片和茎以及采后贮藏的果实中均会发生[29]。植物在生长过程中积累的表皮蜡质具有维持植物体内水分平衡、防止水分流失、保护植物免受病原体入侵和昆虫食草动物的侵袭[30]的功能,而在果实贮藏期间,果皮蜡质合成代谢途径的变化可能会导致果实外观变差,如果面的油渍感和黏腻感[18]。
Li 等[31]以玉露香梨、雪花梨和鸭梨3 个亚洲梨品种为试验材料,果实冷藏45 d 后,15 个表皮蜡质合成代谢和蜡质转运相关基因(PyLACS1、PyKCS2、PyKCS6、PyFDH、PyKCS20、PyGL8、PyCER10、PyCER60、PyLTPG1、PyLTP4、PyABCG12、PyCER1L、PyCAC3、PyCAC3L、PyDGAT1L)的表达量达到峰值,且它们在玉露香梨中的表达量相对更高。在本研究中,笔者发现,货架7 d后,对照组梨果皮蜡质合成代谢基因包括PyLACS9、PyKCR1、PyKCS20 和PyCER1 的表达量上调。LACS9 是脂肪酸长链脂酰基辅酶A 合酶合成的关键基因,在油料作物提高种子含油量中发挥关键作用[32]。此外,本研究中Py-LACS9 与果实L 值呈显著正相关,因此认为它与玉露香梨果实的油腻化程度显著相关。结合Py-LACS9 在玉露香梨脂质代谢途径中发挥作用,推测PyLACS9可能通过调控长链脂酰辅酶A的合成而促进脂肪酸的降解,进而加速果皮油腻化相关组分的合成。
Jiang等[19]研究表明,脂肪酸去饱和酶(FADs)在促进苹果皮油腻化的发生中发挥重要作用,其中MdFAD27 和MdFAD28 作为关键基因通过调控FADs 的活性进而促进果皮油腻化。闫丹[33]在研究中报道,MdFAD2 基因的表达水平与苹果果皮油腻的蜡组分中的酯类物质含量呈显著正相关。在本研究中,笔者挖掘到玉露香梨中脂质合成代谢调控基因PyFAD2。在脂质代谢通路途径中,PyFAD2 可能通过促进FADs 的合成进而促进长链脂肪酸合成,为果皮油腻化组分的合成提供底物,因此推测该基因可作为调控玉露香梨果皮油腻化的候选基因进行深入研究。
3.2 1-MCP 对蜡质合成代谢基因和乙烯合成基因的调控作用
根据Li 等[34]研究报道,1-MCP 抑制了冷藏期间苹果果皮蜡合成代谢基因MdLACS1、MdCER6、Md-CER4 和MdWSD1 的表达,导致果实角质层蜡中的醇类、脂肪酸类和酯类的含量降低。在本研究中,1-MCP 抑制了玉露香梨PyLACS9、PyKCR1、PyKCS20和PyCER1基因的表达。结合玉露香梨外观可发现1-MCP处理延缓了果皮的油腻化进程。因此推测,PyLACS9、PyKCR1、PyKCS20 和PyCER1 可能是调控玉露香梨果皮油腻化的关键基因。相关性分析结果表明,PyLACS9和果面亮度L值呈显著正相关,而L值与果皮油腻化密切相关。因此PyLACS9是调控玉露香梨果皮油腻化的关键基因,而1-MCP处理通过抑制其表达进而抑制果皮油腻化的发生。
此外,在本研究中1-MCP处理还显著抑制了整个货架期间梨果实的乙烯合成基因PyACO2 和Py-ACS-1的表达。Li等[18]的研究结果表明,采用1-MCP处理玉露香梨果实,不仅显著抑制了果皮蜡质合成代谢基因和蜡质转运相关基因,包括PyLACS1、Py-LACS6、PyKCS1、PyKCS2、PyKCS4、PyKCS10L、PyKCS11L、PyKCS20、PyFDH、PyCER10、PyKCR1、PyABCG11L、PyABCG12、PyABCG21L、PyLTPG1、PyLTP4、PyCAC3、PyCAC3L和PyDGAT1L的上调表达,乙烯合成基因PyACO1 和PyACS1 显著下调表达,且上述基因的表达水平存在一定的相关性。在本研究中,相关性分析结果表明,PyLACS9 与Py-ACS-1 呈负相关,PyKCR1、PyCER1 与PyACO2 呈正相关,PyPLDALPHA4 与PyACS-1 呈正相关,Py-FAD2与PyACO2、PyACS-1均呈负相关。由此推测,1-MCP 还可能通过调控乙烯合成相关基因的表达水平进而影响果皮蜡质合成代谢基因的表达。
4 结 论
与对照相比,1-MCP 处理对玉露香梨果皮蜡质合成代谢相关基因的影响主要富集到脂肪酸的延伸、合成和分解等次级脂质代谢途径。经1-MCP处理,PyKCS20、PyCER1、PyLACS9、PyPLDALPHA4 和PyFAD2下调表达,果面亮度L值较对照低。1-MCP可能通过影响上述基因的表达模式来调节果皮蜡质合成代谢途径,进而影响玉露香梨果皮油腻化水平。
[1] ARAUS J L,FEBRERO A,VENDRELL P. Epidermal conductance in different parts of durum wheat grown under Mediterranean conditions:The role of epicuticular waxes and stomata[J].Plant,Cell&Environment,1991,14(6):545-558.
[2] VERAVERBEKE E A,LAMMERTYN J,SAEVELS S,NICOLAÏ B M.Changes in chemical wax composition of three different apple (Malus domestica Borkh.) cultivars during storage[J].Postharvest Biology and Technology,2001,23(3):197-208.
[3] LI D,CHENG Y D,GUAN J F. Effects of 1-methylcyclopropene on surface wax and related gene expression in cold-stored‘Hongxiangsu’pears[J].Journal of the Science of Food and Agriculture,2019,99(5):2438-2446.
[4] BEAUDOIN F,WU X Z,LI F L,HASLAM R P,MARKHAM J E,ZHENG H Q,NAPIER J A,KUNST L. Functional characterization of the Arabidopsis β-beta-ketoacyl-coenzyme A reductase candidates of the fatty acid elongase[J]. Plant Physiology,2009,150(3):1174-1191.
[5] BERNARD A,JOUBÈS J. Arabidopsis cuticular waxes:Advances in synthesis,export and regulation[J]. Progress in Lipid Research,2013,52(1):110-129.
[6] DIETRICH C R,,YANDEAU-NELSON M D,MEELEY R B,NIKOLAU B J,SCHNABLE P S. Characterization of two GL8 paralogs reveals that the 3-ketoacyl reductase component of fatty acid elongase is essential for maize (Zea mays L.) development[J].The Plant Journal,2005,42(6):844-861.
[7] WU X,YIN H,CHEN Y Y,LI L,WANG Y Z,HAO P P,CAO P,QI K J,ZHANG S L.Chemical composition,crystal morphology and key gene expression of cuticular waxes of Asian pears at harvest and after storage[J].Postharvest Biology and Technology,2017,132:71-80.
[8] NOCK J F,WATKINS C B. Repeated treatment of apple fruit with 1-methylcyclopropene (1-MCP) prior to controlled atmosphere storage[J]. Postharvest Biology and Technology,2013,79:73-79.
[9] 王晓飞,任小林,杨艳青,亢键,樊丽,于建娜.‘粉红女士’苹果果皮蜡质油腻化的研究[J]. 果树学报,2014,31(2):201-205.WANG Xiaofei,REN Xiaolin,YANG Yanqing,KANG Jian,FAN Li,YU Jianna. Study on epicuticular wax greasiness of‘Pink Lady’apple fruits[J]. Journal of Fruit Science,2014,31(2):201-205.
[10] 赵晓敏,杨玉荣,李建鲲,袁峰,程俊嘉,李学文.1-MCP 处理对库尔勒香梨采后果皮蜡质变化的影响[J].食品科学,2015,36(18):262-266.ZHAO Xiaomin,YANG Yurong,LI Jiankun,YUAN Feng,CHENG Junjia,LI Xuewen. Effect of 1-methylcyclopropene treatment on postharvest changes in epicuticular wax of Korle fragrant pear fruits during ambient temperature storage[J]. Food Science,2015,36(18):262-266.
[11] 贾晓辉,王文辉,姜云斌,王志华,杜艳民,佟伟.采收成熟度对‘玉露香’梨果实品质和耐贮性的影响[J].果树学报,2016,33(5):594-603.JIA Xiaohui,WANG Wenhui,JIANG Yunbin,WANG Zhihua,DU Yanmin,TONG Wei. Effects of harvest maturity on fruit quality and storage life of‘Yuluxiang’pears[J].Journal of Fruit Science,2016,33(5):594-603.
[12] 于宛婷,王文辉,张鑫楠,阎维巍,孙晓楠,贾晓辉.外源褪黑素对玉露香梨常温贮藏品质和生理特性的影响[J].果树学报,2023,40(8):1583-1591.YU Wanting,WANG Wenhui,ZHANG Xinnan,YAN Weiwei,SUN Xiaonan,JIA Xiaohui. Effects of exogenous melatonin on fruit quality and physiological characteristics during room temperature storage in Yuluxiang pear[J]. Journal of Fruit Science,2023,40(8):1583-1591.
[13] 张微,赵迎丽,杨志国,王亮,陈会燕.‘玉露香’梨果皮蜡质含量提取方法及成分研究[J].食品科技,2022,47(1):34-40.ZHANG Wei,ZHAO Yingli,YANG Zhiguo,WANG Liang,CHEN Huiyan. Extraction method and analysis of waxy components from‘Yuluxiang’pear pericarp[J]. Food Science and Technology,2022,47(1):34-40.
[14] 贾晓辉,王文辉,姜云斌,杜艳民,王志华,佟伟.不同贮藏温度对‘玉露香’梨果实保绿效果和品质维持的影响[J].果树学报,2016,33(增刊1):166-174.JIA Xiaohui,WANG Wenhui,JIANG Yunbin,DU Yanmin,WANG Zhihua,TONG Wei. Effects of storage temperature on green keeping and quality of‘Yuluxiang’pear[J]. Journal of Fruit Science,2016,33(Suppl.1):166-174.
[15] 刘佰霖,王文辉,马风丽,王阳,杜艳民,贾晓辉.自发气调包装和乙烯吸收剂对‘玉露香’梨果实品质及耐贮性的影响[J].果树学报,2019,36(7):911-921.LIU Bailin,WANG Wenhui,MA Fengli,WANG Yang,DU Yanmin,JIA Xiaohui. Effect of modified atmosphere packaging and ethylene absorbents on postharvest fruit quality and storage performance of‘Yuluxiang’pear[J]. Journal of Fruit Science,2019,36(7):911-921.
[16] 马风丽,杜艳民,王阳,佟伟,刘佰霖,王文辉,贾晓辉.1-MCP对‘玉露香’梨采后果实品质和叶绿素保持的影响[J].园艺学报,2019,46(12):2299-2308.MA Fengli,DU Yanmin,WANG Yang,TONG Wei,LIU Bailin,WANG Wenhui,JIA Xiaohui. Effect of 1-methylcyclopropene(1-MCP) on quality and chlorophyll maintenance of postharvest‘Yuluxiang’pear[J]. Acta Horticulturae Sinica,2019,46(12):2299-2308.
[17] LEE J G,EUM H L,LEE E J.Relationship between skin greasiness and cuticular wax in harvested‘Hongro’apples[J]. Food Chemistry,2024,450:139334.
[18] LI D,LI X L,CHENG Y D,GUAN J F.Effect of 1-methylcyclopropene on peel greasiness,yellowing,and related gene expression in postharvest‘Yuluxiang’pear[J]. Frontiers in Plant Science,2023,13:1082041.
[19] JIANG Z T,DING Y D,LIU J,YIN W J,QI Y W,YANG Y Q,REN X L. The MdFAD27 and MdFAD28 play critical roles in the development of greasiness disorder in postharvest apples[J].Postharvest Biology and Technology,2022,191:111990.
[20] YANG Y Q,ZHANG M Z,REN X L,CHENG Y J,PENG X Y,TIAN S W,WANG X S,XU L,ZHANG Y,LI C,SUN C C,ZHANG W,GONG H S. Chemical and thermodynamic analyses of the surface waxes of‘Korla’pears:Relationships between the surface waxes and skin greasiness[J].Postharvest Biology and Technology,2023,196:112156.
[21] YU W T,ZHANG X N,YAN W W,SUN X N,WANG Y,JIA X H.Effects of 1-methylcyclopropene on skin greasiness and quality of‘Yuluxiang’pear during storage at 20 ℃[J].Journal of Integrative Agriculture,2024,23(7):2476-2490.
[22] 于宛婷,杭博,张鑫楠,杜艳民,王文辉,贾晓辉.1-MCP 处理对库尔勒香梨常温保绿效果和果实内在品质的影响[J].中国果树,2023(10):13-18.YU Wanting,HANG Bo,ZHANG Xinnan,DU Yanmin,WANG Wenhui,JIA Xiaohui. Effects of 1-MCP treatment on the greenkeeping effect and internal quality of‘Korla fragrant pear’at normal temperature[J].China Fruits,2023(10):13-18.
[23] CHEN S F,ZHOU Y Q,CHEN Y R,GU J. FASTP:An ultrafast all-in-one FASTQ preprocessor[J].Bioinformatics,2018,34(17):i884-i890.
[24] KIM D,LANGMEAD B,SALZBERG S L. HISAT:A fast spliced aligner with low memory requirements[J]. Nature Methods,2015,12(4):357-360.
[25] PERTEA M,PERTEA G M,ANTONESCU C M,CHANG T C,MENDELL J T,SALZBERG S L. StringTie enables improved reconstruction of a transcriptome from RNA-seq reads[J]. Nature Biotechnology,2015,33(3):290-295.
[26] LI B,DEWEY C N. RSEM:accurate transcript quantification from RNA-Seq data with or without a reference genome[J].BMC Bioinformatics,2011,12:323.
[27] KWON Y S,PARK J T,YOO J,DO V G,KIM J H,CHO Y S,YANG S J,KANG I K,WIN N M. 1-methylcyclopropene improves the postharvest physiological characteristics and fruit quality of‘Colorpple’and‘Manhong’apple cultivars during storage at warm and cold temperatures[J]. Horticultural Science and Technology,2024,42(2):151-166.
[28] ADHIKARY T,GILL P P S,JAWANDHA S K,KAUR N,SINHA A. Exogenous application of oxalic acid improves the storage quality of Asian pears(Patharnakh)by regulating physiological and biochemical changes[J]. Acta Physiologiae Plantarum,2023,46(1):1.
[29] 于姝莉,吕云皓,韩彤,刘忆冬,江英.果实表皮蜡质代谢和调控与品质之间的关系研究进展[J].食品安全质量检测学报,2023,14(14):282-289.YU Shuli,LV Yunhao,HAN Tong,LIU Yidong,JIANG Ying.Research progress on the relationship between fruit epicuticular wax metabolism,regulation and quality[J].Journal of Food Safety&Quality,2023,14(14):282-289.
[30] 王立山,丁兵,李玉花,张旸.植物表皮蜡质合成转运调控相关基因与干旱响应的研究进展[J].园艺学报,2018,45(9):1831-1843.WANG Lishan,DING Bing,LI Yuhua,ZHANG Yang. Reaserch progress of plant cuticular wax biosynthesis,export and regulation related genes responsed to drought[J].Acta Horticulturae Sinica,2018,45(9):1831-1843.
[31] LI D,CHENG Y D,SHANG Z L,GUAN J F. Changing surface wax compositions and related gene expression in three cultivars of Chinese pear fruits during cold storage[J]. PeerJ,2022,10:e14328.
[32] ZHU K M,LI N N,ZHENG X F,SARWAR R,LI Y L,CAO J,WANG Z,TAN X L. Overexpression the BnLACS9 could increase the chlorophyll and oil content in Brassica napus[J].Biotechnology for Biofuels and Bioproducts,2023,16(1):3.
[33] 闫丹.苹果果皮油腻化发生过程中蜡质代谢相关基因的鉴定及功能分析[D].杨凌:西北农林科技大学,2019.YAN Dan.Identification and functional analysis of genes related to wax metabolism in apple skin greasiness[D].Yangling:Northwest A&F University,2019.
[34] LI F J,MIN D D,REN C T,DONG L L,SHU P,CUI X X,ZHANG X H. Ethylene altered fruit cuticular wax,the expression of cuticular wax synthesis-related genes and fruit quality during cold storage of apple (Malus domestica Borkh. cv.Starkrimson) fruit[J]. Postharvest Biology and Technology,2019,149:58-65.