草莓是世界各地广泛种植的浆果,我国已经是世界第一草莓生产大国,大部分地区为冬春季生产。自2012 年以来,我国四季草莓生产迅速发展,目前面积已达6700 hm2,有效填补了夏季草莓鲜果供给缺口。云南省会泽县是我国四季草莓主产区,产量全国占比超过70%[1],该区1 月平均气温在4.6 ℃左右,既能够保障草莓自然越冬又能够打破植株休眠,从而实现多年结果。该地区四季草莓生产主要采用多年一栽模式,一次定植后可以收获3~7 a(年),显著减少了劳动力投入和生产苗用量,是一种低成本和相对低碳的生产模式。草莓是连作障碍现象最明显的果树,在普遍的一年一栽制生产模式下,主要表现为成活率下降、长势不整齐、结果期推迟、产量低、品质下降和病害多发等现象。在不消毒的情况下,草莓重茬死苗问题严重,部分重茬栽培地死苗在70%以上,3~4次补苗仍难以补齐,严重影响经济效益[2]。发达国家草莓生产长期以化学熏蒸处理重茬土[3],主要使用溴化甲烷和氯化苦等熏蒸剂,但该方法也将大多数微生物杀死,对致病微生物不具有选择性,同时降低有益微生物水平。目前我国一年一栽制草莓生产中,普遍采用夏季高温期闷棚配合使用石灰氮[4]。在云南会泽地区的多年一栽制生产模式下,从第3年开始普遍出现草莓产量下降、病害多发问题,拉秧后重新定植出现严重的死苗等连作障碍问题。由于该地区多采用秋冬季收获期结束后整地、次年早春定植的生产模式,不具备高温闷棚作业的条件,因此解析该地区草莓生产土壤的退化机制对优化栽培措施、减缓重茬危害十分必要。
笔者在会泽县选取4 个取样点,对多年一栽制草莓生产园土壤的有机质(soil organic matter,SOM)含量、土壤电导率(electrical conductivity,EC)、pH 和矿质养分(N、P、K、Ca、Fe、Mn、Mg、Cu、Zn 和Mo)含量进行了检测。基于Illumina MiSeq PE300 平台,通过高通量扩增子测序分析土壤微生物群落、预测土壤微生物功能,以确定多年一栽制草莓生产对土壤微生物群落结构和碳循环、氮循环过程微生物功能的影响,综合解析土壤生产力退化的原因,以期为该地区草莓优质高产提供理论依据。
1 材料和方法
1.1 试验地概况
试验地点位于云南省会泽县,属典型的温带高原季风气候,年平均晴日225 d,年日照2100 h,年平均气温12.7 ℃,年均降雨量54亿m3。其中待补镇海拔2600 m、驾车乡海拔2400~2460 m,新街街道海拔2260 m。
1.2 材料
采样园区土壤均为红壤土,前茬作物均为玉米;种植草莓品种均为蒙特瑞,草莓生产在南北向钢架大拱棚设施进行避雨栽培,首次定植每666.7 m2加入发酵农家肥4~5 t,按照垄高55 cm、上部垄面宽度35 cm、基部垄面宽度45 cm 的梯形高垄起垄。3 月中旬双行定植,90 000~97 500 株·hm2,采用滴灌进行肥水一体化管理,肥料以化肥为主,每公顷每年使用20-20-20 NPK 硫酸钾型水溶平衡肥0.75~1.2 t,高钾型水溶平衡肥0.9~1.2 t。每年果品生产至11月结束,然后去除棚膜,植株自然越冬后去除老叶,进行病虫害管理和植株修整,进入下一年度生产管理。
1.3 试验设计
选择待补镇(DB)、驾车乡1(JC1)、驾车乡2(JC2)、新街街道(XJ)的4个草莓园区不同连作年限的土壤进行试验。待补镇园区取种植1~4 a(年)土壤(DB Year 1,DB Year 2,DB Year 3,DB Year 4),驾车乡园区分别取种植1~4 a 土壤(JC1 Year 1,JC1 Year 2,JC1 Year 3,JC1 Year 4)及1~3 a 土壤(JC2 Year 1,JC2 Year 2,JC2 Year 3),新街街道园区取种植1~3 a土壤(XJ Year 1,XJ Year 2,XJ Year 3)。
1.4 测定指标样品采集及测定方法
取样均在7 月盛果期进行,在每个园区采集不同收获年份的土壤样品,在南北方向相邻的两株草莓中间点以土钻取样,随机选择6 个采样点进行混合取样作为1份样品,每个园区单个收获年份采样3份,取样深度0~20 cm。土壤样品过2 mm筛后冷藏保存运输至实验室用于进一步分析。样品分为两部分,分别用于土壤DNA提取和化学性质分析。园区草莓单位面积年产量为4月底至11月底累计值。
土壤样品阴干后进行土壤电导率、pH 和N、P、K、Ca、Fe、Mn、Mg、Cu、Zn、Mo 等矿质养分含量测定,使用改进的凯氏定氮法(Kjeldahl 方法)和中国国家标准系统(HJ 717—2014)测量总N 含量[5]。使用电感耦合等离子体(inductively coupled plasma,ICP)光谱法和中国国家标准系统(HJ 803)分析P、K、Ca、Fe、Mn、Mg、Cu、Zn 和Mo 等其他元素的含量[6]。
1.5 土壤微生物结构分析
使用E.Z.N.A.®土壤DNA 试剂盒(Omega Biotek,美国)从42 个样品中提取总DNA。使用Nano-Drop®Lite Plus 分光光度计(Thermo Scientific Inc.,美国)和1.0%琼脂糖凝胶电泳确定DNA 的质量和浓度。使用引物对338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)扩增细菌16S rRNA V3-V4 区,使用ITS1-1F(CTTGGTCATTTAGAGGAAGTAA) 和 ITS2R(GCTGCGTTCTTCATCGATGC)扩增真菌ITS1区。PCR(Polymerase Chain Reaction,聚合酶链式反应)反应体系和扩增循环条件参照前人研究工作[7]。
PCR 产物以2%琼脂糖凝胶提取和纯化,使用GenEluteTM 凝胶提取试剂盒(Sigma-Aldrich Co.,美国);使用NanoDrop®Lite Plus 分光光度计(Thermo Scientific Inc.,美国)定量。将纯化的扩增子以等摩尔量混合,并按照Majorbio Bio-Pharm Technology Co.Ltd.(上海,中国)使用的标准方法在Illumina MiSeq PE300平台上测序。
获得的原始数据通过质控、过滤、去重,利用UPARSE 7.1 根据97%的序列相似性水平将优化序列聚类成OTUs(operational taxonomic units)[8]。使用RDP 2.2 进行OTU 的分类学信息分析[9],并与16S rRNA 基因数据库(silva138/16s_bacteria)或ITS数据库(unite8.0/its_fungi)进行比对,以0.7 作为置信度阈值。使用HMMER、EPA-NG 和Gapp 对OTU代表性序列对齐和比较。使用BugBase预测细菌群落的表型功能,并使用FAPROTAX(Functional Annotation of Prokaryotic Taxa)预测细菌群落的功能变化[10]。使用FUNGuild预测真菌群落功能[11]。
1.6 数据分析
本研究中土壤的基本生物信息学分析是在Majorbio 云平台(https://cloud.majorbio.com)上进行的。从OTU 信息中获得稀释曲线,使用Mothur v1.30.1计算α多样性指数[12]。使用Vegan v2.5-3包进行主坐标分析(principal coordinate analysis,PCoA)和冗余分析(redundancy analysis,RDA)[13],以研究微生物群落相似性和对土壤物理化学性质的响应。
2 结果与分析
2.1 草莓多年一栽模式对土壤化学性质的影响
由图1 可以看出,所有测试园区的土壤pH 和SOM含量从第一年到第四年呈现显著下降趋势,而土壤EC 呈显著上升趋势。第一年土壤平均pH 为5.58,在第二年、第三年和第四年分别下降到4.35、3.57和2.98。SOM含量在第一年为0.66%,在第四年为0.27%,平均每年下降0.13个百分点。土壤EC在第一年为328.5 μS·cm-1,在第四年为923.7 μS·cm-1,平均每年增加60.40%,以上结果表明多年生产导致土壤有机质含量降低、土壤酸化和盐渍化。同时,大多数园区的Ca 含量总体呈下降趋势,最低的Ca 含量出现在JC1 第四年(0.878 g·kg-1,比第一年低74.4%)。
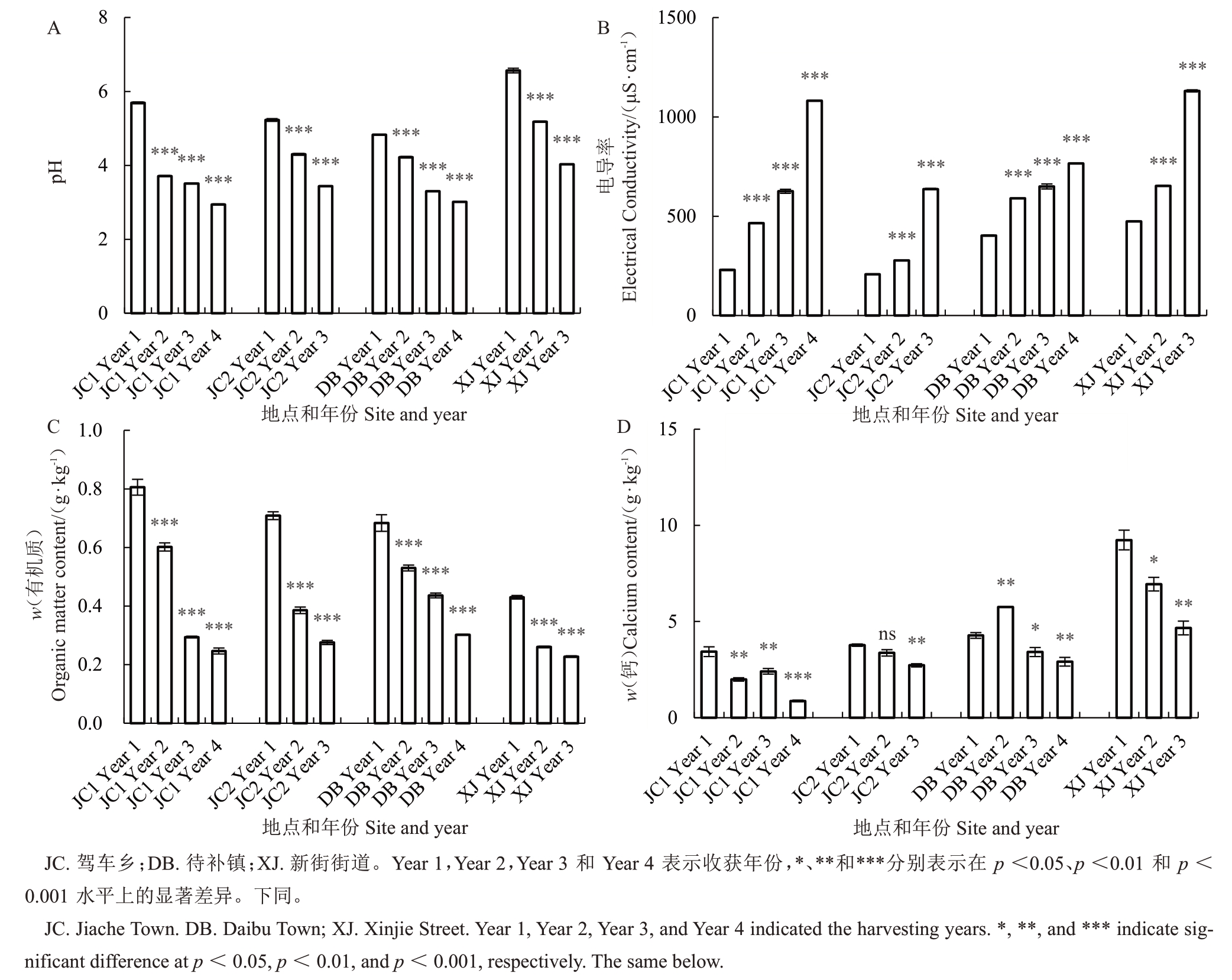
图1 土壤化学性质分析
Fig.1 Variations of soil physicochemical property parameters
如图2所示,与第一年相比,随着草莓种植年限的延长,JC1 土壤中总N 和P 含量先升后降再升,Fe和Cu 含量先降后升,K 和Zn 含量先升后降;JC2 土壤中N、P、Fe、Mn 含量下降,Mg 含量上升;DB 土壤中N、P、K含量先降后升,Fe、Mg、Mn、Zn、Cu含量先升后降;XJ土壤中K含量上升,Fe、Mg、Mn、Zn、Cu、Mo 含量下降。各取样点土壤矿质含量变化趋势各异可能是管理措施差异所致。

图2 土壤矿物元素含量分析
Fig. 2 Variations of soil mineral element content
土壤化学性质参数的相关性分析表明,pH 与SOM 含量呈显著正相关(R=0.502),EC 与pH 呈显著负相关(R=-0.573);EC 与SOM 含量呈显著负相关(R=-0.769)。总N 含量(R=-0.428)和P 含量(R=-0.583)与pH呈显著负相关;Mg含量与pH呈显著正相关(R=0.410)。K 含量与EC 呈显著正相关(R=0.537);Fe含量(R=-0.512)、Cu含量(R=-0.441)、Zn 含量(R=-0.484)和Mo 含量(R=-0.521)与EC 呈显著负相关。
2.2 不同年份草莓栽培生产对土壤微生物多样性的影响
原始数据经过滤后,获得了3 317 973个细菌序列和2 558 395 个真菌序列。在97%的相似性水平下,获得了26 644 个细菌OTUs 和5264 个真菌OTUs。细菌OTUs 属于47 个门、160 个纲、410 个目、679个科和1470个属。真菌OTUs属于16个门、58 个纲、134 个目、319 个科和727 个属。细菌群落的Chao1 指数、Shannon 指数和ACE(Abundancebased Coverage Estimator)指数在收获年份之间显著不同(图3-A~C),Chao1 指数第二年显著下降了13.6%,第三年下降了38.2%,第四年下降了41.8%。在JC1的第四年和JC2的第三年,Chao1指数的最高降幅分别为52.2%和52.5%。在除XJ 外的取样点,真菌多样性的Chao1 指数和ACE 指数在不同生产年份之间存在显著差异。从第一年到第二年,DB取样点的ACE 指数显著下降了28.7%,JC2 显著下降了25.0%,从第二年到第三年,JC1 显著下降了31.7%。XJ 的真菌多样性低于其他3 个地点(图3-D~F)。XJ 样本的平均ACE 为578.7,比DB1 低37.2%,比JC1低25.5%,比JC2低33.2%。
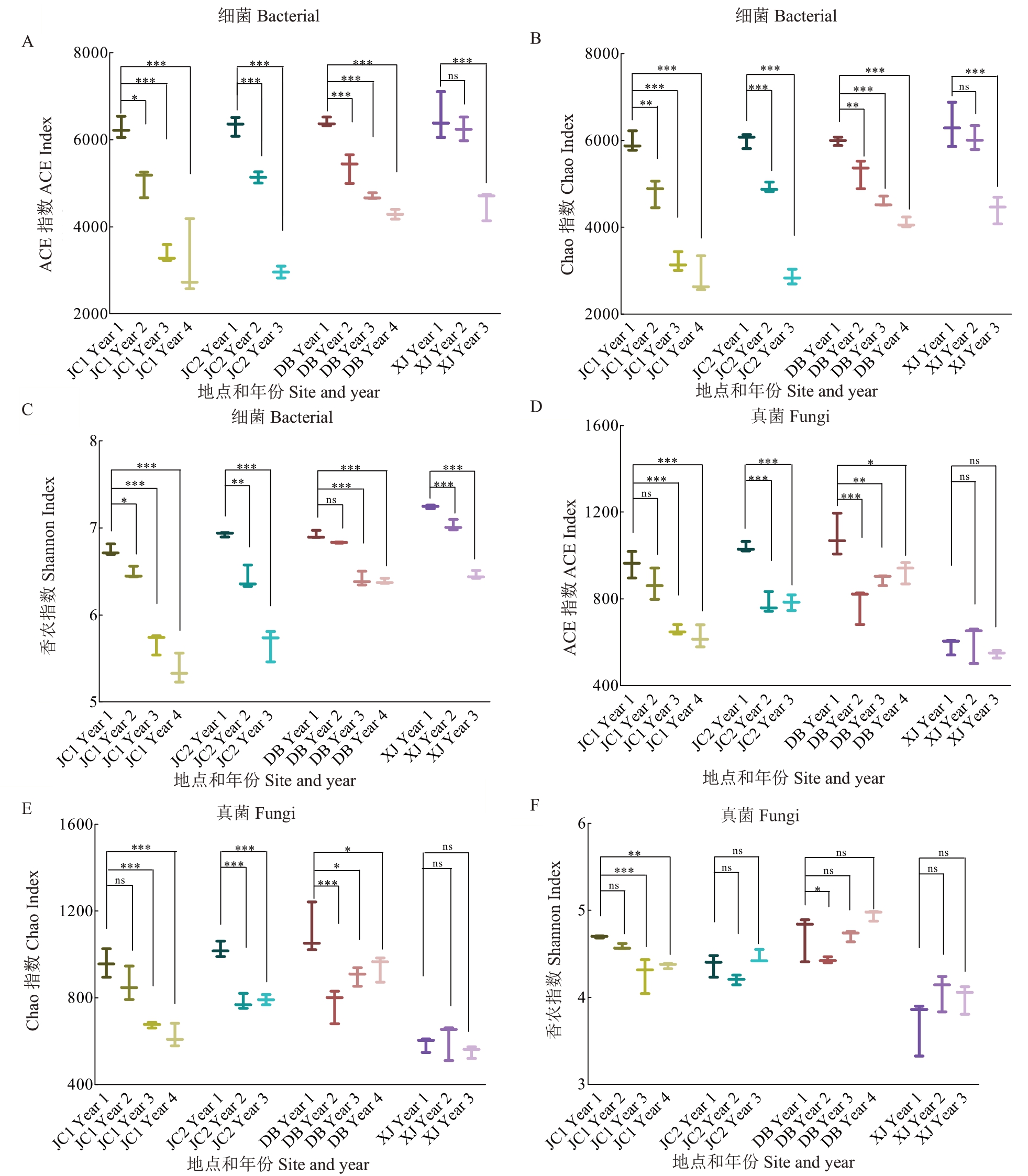
图3 细菌群落和真菌群落的Alpha 多样性指数分析
Fig.3 Analysis of α-diversity indices of bacteria and fungi
细菌群落在门水平上的优势物种组成相似,变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)和绿弯菌门(Chloroflexi)在所有土壤样本中占61.1%~76.7%,其他门细菌在第三年到第四年呈现下降趋势。与第一年相比,酸杆菌门(Acidobacteriota)在JC1的第四年下降到48.5%,芽单胞菌门(Gemmatimonadota)在JC2 的第三年下降到20.2%,黏菌门(Myxococcota)和疣微菌门(Verrucomicrobiota)在JC1的第四年分别下降到4.3%和5.45%。值得注意的是,在DB 和JC1,从第一年到第四年,厚壁菌门(Firmicutes)的比例分别增加了125.9%和181.1%(图4-A)。在所有土壤样本中,子囊菌门(Ascomycota)是门水平上的优势真菌,平均为71.1%。与第一年相比,被孢霉门(Mortierellomycota)在JC1 从30.0%下降到第四年的5.8%。壶菌门(Chytridiomycota)在3~4 年的收获期间呈现下降趋势,在不同地点与第一年相比分别下降了24.4%和63.3%(图4-B)。
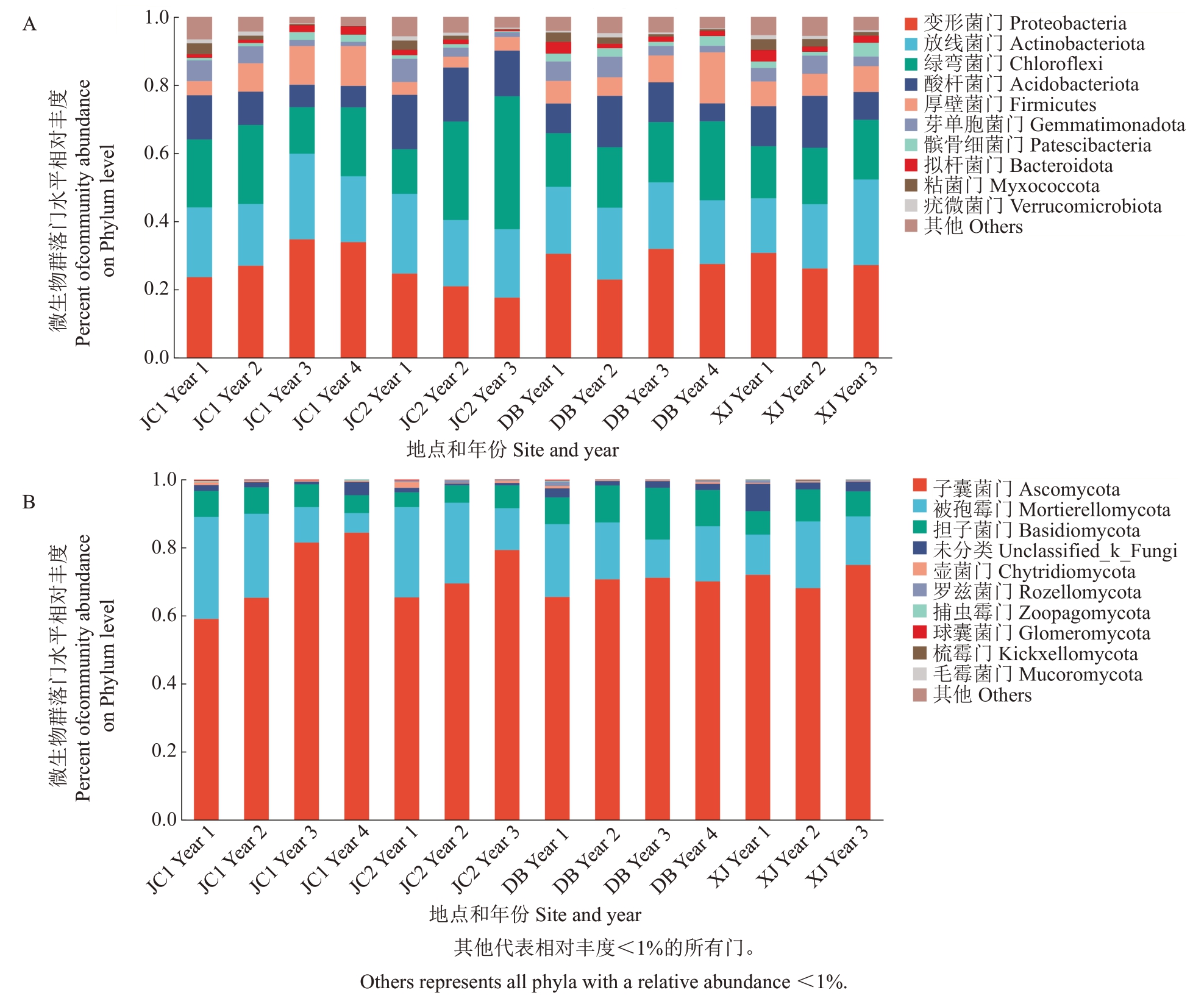
图4 土壤细菌(A)和真菌(B)群落中优势门的相对丰度
Fig.4 Relative abundances of the dominant phylum in soil bacterial(A)and fungal(B)communities
2.3 土壤化学性质与微生物群落结构的关联分析
通过RDA(图5-A、B)分析了微生物群落与环境变量之间的关系。RDA1和RDA2解释了细菌群落结构总变异的56.29%。对于真菌群落结构,RDA1和RDA2解释了总变异的39.19%。SOM、土壤pH和土壤EC 是细菌群落变异的主要贡献者,分别占59.8%、58.9%和51.8%。土壤EC 和SOM 是真菌群落变异的最重要贡献者,分别占83.3%和82.7%。
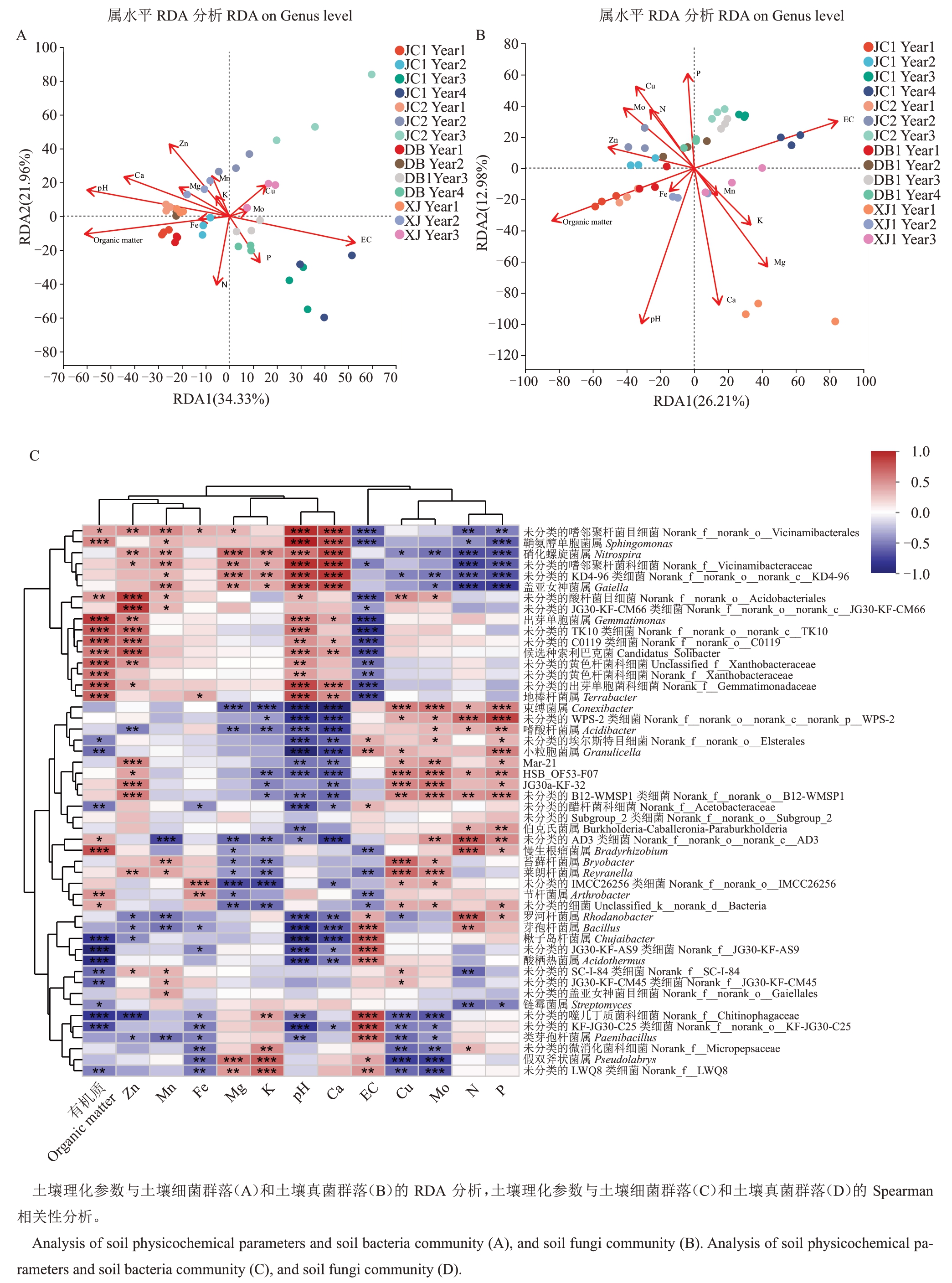
图5 土壤微生物群落与土壤理化参数的相关性分析
Fig.5 Correlation analysis of soil microbial community and soil physicochemical parameters
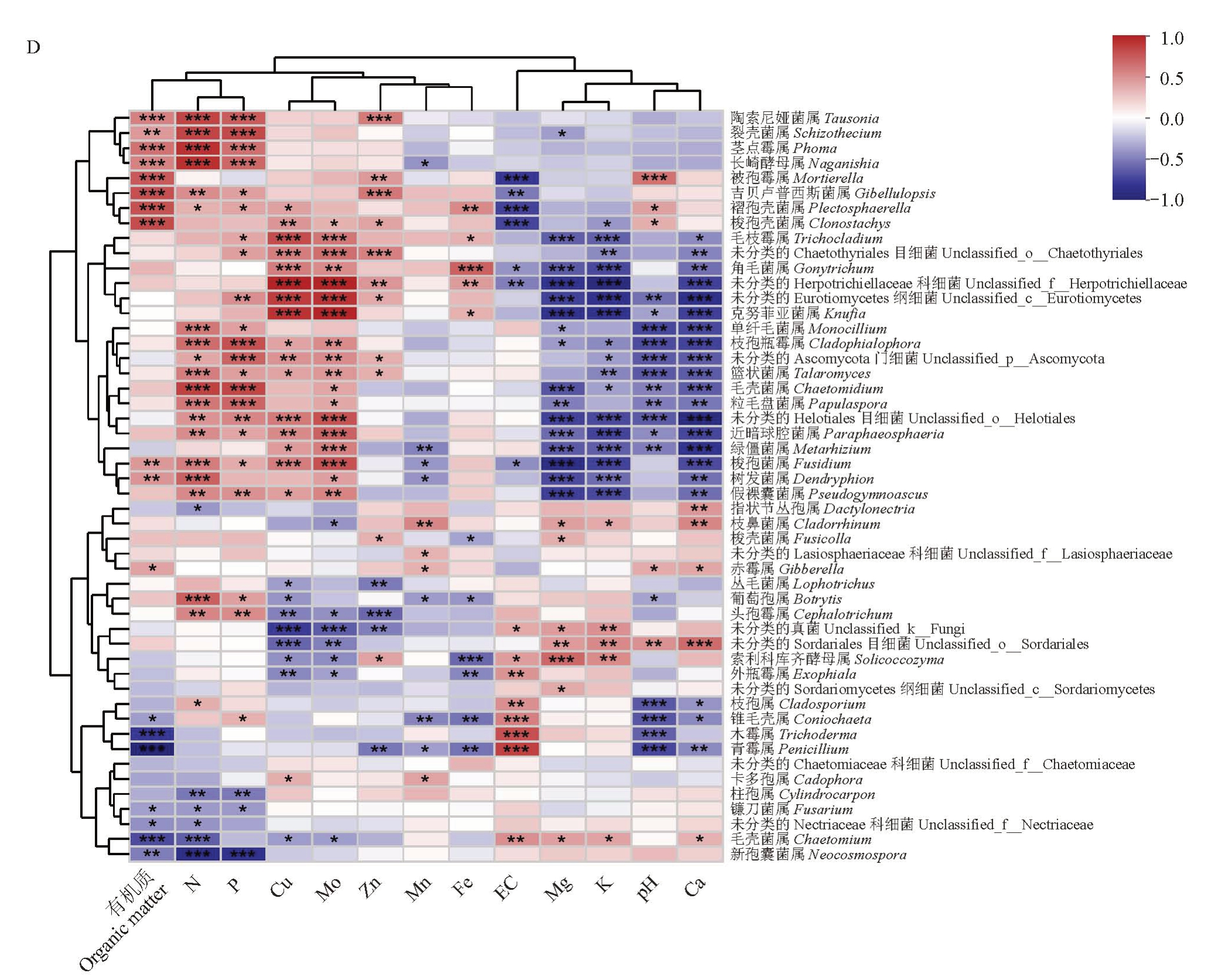
图5 (续) Fig.5 (Continued)
基于Spearman相关性分析,图5-C、D显示了土壤性质与相对微生物丰度(属水平前50)之间的关系。结果表明,细菌属中芽单胞菌属(Gemmatimonas,R=0.78)、嗜酸栖热菌属(Acidothermus,R=-0.74)和慢生根瘤菌属(Bradyrhizobium,R=0.71)与SOM 含量呈显著相关。鞘氨醇单胞菌属(Sphingomonas,R=0.89)、Granulicella(R=-0.83)、Chujaibacter(R=-0.81)和Conexibacter(R=-0.76)与pH呈显著相关。Chujaibacter(R=0.66)和Gemmatimonas(R=-0.64)与EC显著相关。Conexibacter(R=-0.81)、硝化螺旋菌属(Nitrospira,R=0.74)、Gaiella(R=0.72)和鞘氨醇单胞菌属(Sphingomonas,R=0.71)与Ca 含量呈显著相关。对于真菌属,青霉属(Penicillium,R=0.74)、被孢霉属(Mortierella,R=-0.70)和木霉属(Trichoderma,R=0.69)与EC 呈显著相关。青霉属(Penicillium,R=-0.86)、螺旋聚孢霉属(Clonostachys,R=0.71)和木霉属(Trichoderma,R=-0.70)与SOM含量呈显著相关。
2.4 草莓4年栽培生产对土壤微生物群落功能的影响
2.4.1 多年生产对细菌群落功能的影响 利用BugBase 预测细菌群落的表型功能,结果表明从第一年到第四年,厌氧菌、兼性厌氧菌、革兰氏阴性菌和形成生物膜的细菌相对丰度呈现下降趋势;潜在致病菌、逆境耐受菌等相对丰度呈现上升的趋势(图6-A)。

图6 细菌群落的功能组和表型预测
Fig.6 Functional groups and phenotypic prediction of bacterial community
利用FAPROTAX 分析多年生产对细菌群落功能的潜在影响,结果表明,与C 循环相关的细菌,如化学异养菌、好氧化学异养菌和纤维素分解菌的相对丰度呈现显著提高的趋势,而与芳香化合物降解、光养、光异养、烃降解和几丁质分解相关的细菌相对丰度呈现下降趋势(图6-B);与N循环相关的细菌,如硝酸盐还原菌、亚硝酸盐氨化菌和硝酸盐氨化菌的相对丰度呈现提高趋势,而与脲酶、固氮、反硝化、亚硝酸盐反硝化和一氧化二氮反硝化相关的细菌相对丰度呈现下降趋势(图6-C)。相关性分析表明,大多数C 循环和N 循环细菌相对丰度与SOM 含量呈显著正相关,与EC 呈负相关,并且大多数C 循环过程细菌相对丰度与pH呈显著正相关(图6-D~E)。
2.4.2 四年生产对真菌群落潜在功能的影响FUNGuild分析显示,病原菌和腐生菌相对丰度整体上呈提高趋势(图7-A、B),而共生菌相对丰度整体上呈下降趋势(图7-C)。在JC1,腐生菌相对丰度从第一年的23.23%显著提高到第四年的51.10%,共生菌相对丰度从第一年的42.31%显著下降到第四年的9.88%,丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)从第一年的0.24%显著下降到第四年的0%(图7-D)。值得注意的是,在XJ,病原菌从第一年的21.25%提高到第三年的43.20%(图7-A)。

图7 草莓多年一栽制模式对真菌功能组相对丰度的影响
Fig.7 Effects of PC on the relative abundance of fungal functional groups
2.5 不同年份产量与土壤化学指标和微生物指标的相关性
产量分析表明,JC1、JC2、DB 试验园区产量呈先上升后下降趋势,XJ试验园区产量随着种植年限增加逐渐降低,且各试验地点均出现从第三年开始产量下降的趋势(表1)。相关性分析表明,产量与Ca、Mn、Zn 和有机质含量及pH 呈正相关,与P 含量和EC 呈负相关,与N 和K 含量相关性不显著;以产量为变量进行的偏最小二乘回归分析显示,VIP 值大于1的自变量分别为EC(1.738)、pH(1.577)、有机质含量(1.359)、钙含量(1.206)、锌含量(1.203),多年一栽模式草莓产量下降的主要原因是盐分升高、土壤酸化、有机质亏缺和钙、锌等中量元素亏缺。
表1 产量统计分析
Table 1 Statistical analysis of yield(kg·666.7 m-1)
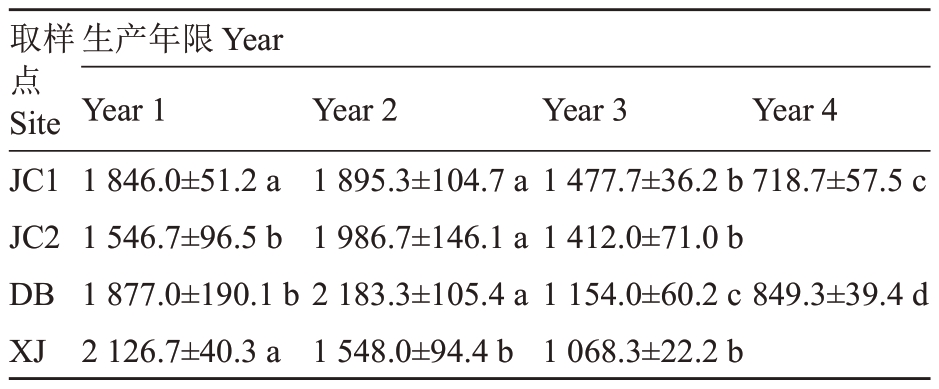
注:同行不同小写字母表示在0.05 水平差异显著。
Note:Different small letters in the same line indicate significant difference at 0.05 level.
取样点Site JC1 JC2 DB XJ生产年限Year Year 1 1 846.0±51.2 a 1 546.7±96.5 b 1 877.0±190.1 b 2 126.7±40.3 a Year 2 1 895.3±104.7 a 1 986.7±146.1 a 2 183.3±105.4 a 1 548.0±94.4 b Year 3 1 477.7±36.2 b 1 412.0±71.0 b 1 154.0±60.2 c 1 068.3±22.2 b Year 4 718.7±57.5 c 849.3±39.4 d
以产量为变量,真菌属丰度为自变量进行的偏最小二乘回归分析(表2)显示,对产量影响权重最高的真菌为镰孢菌属Fusarium,该分析结果与田间观察到的尖孢镰刀菌枯萎病一致,说明导致产量下降的主要病原菌为镰孢菌属真菌。值得注意的是,其他常见真菌病害如炭疽病病原菌Colletotrichum、红叶病病原菌Pestalotiopsis、黄萎病病原菌Verticillium在各年份差异并不显著。
表2 产量和真菌属水平的偏最小二乘回归分析结果
Table 2 Partial least squares regression analysis results of yield and fungal genus level

属Genus镰孢菌属Fusarium毛孢壳属Coniochaeta青霉属Penicillium被孢霉属Mortierella外瓶霉属Exophiala光黑壳属Preussia螺旋聚孢霉属Clonostachys假裸囊菌属Pseudogymnoascus头束霉属Cephalotrichum树粉孢属Oidiodendron权重Weight-0.430-0.277-0.271 0.231-0.227 0.207 0.202-0.192-0.189-0.188投影变量重要性VIP 3.042 993 785 1.958 574 787 1.917 551 417 1.631 290 187 1.603 197 421 1.461 767 238 1.424 934 82 1.358 252 396 1.335 702 335 1.326 856 067
3 讨 论
3.1 草莓多年一栽模式对土壤理化性质的影响
本研究发现,草莓多年一栽模式导致土壤pH和SOM 含量呈现逐年下降趋势,而土壤EC 呈现上升趋势;有机质含量平均每年下降0.13 个百分点,导致土壤碳亏缺。前人研究表明,长期耕作系统中土壤有机碳普遍下降,需要施用有机肥料来维持土壤生产力[14],果园的地面覆盖管理对土壤碳代谢有显著影响,长期施用生物有机肥料和果园生草能够显著提高SOM 含量,改变土壤微生物群落结构,并提高土壤生产力[15-16]。在定植前施足有机肥或通过滴灌补充有机态肥料是补充土壤有机质的重要手段。本研究中该生产模式中以化肥投入为主、有机肥投入不足,但是田间观察叶片形态未有明显的缺素表现;在植株方面,每年进行植株整理、保留1~3 个分蘖,分蘖会重新发出根系,因此整体存活植株的生长势差异不明显,从不同年份矿质养分含量对比可以发现,除有机质以外,其他主要养分含量均在合理区间。
在本研究中观察到了明显的土壤酸化和盐渍化现象。土壤pH 在第四年下降到2.98。土壤酸化降低了磷的生物有效性,并增加了作物被镰刀菌感染的风险[17]。前人研究表明,N 肥的过度使用对区域土壤酸化有显著作用,在25 年的常规施肥后观察到的土壤pH下降2.2[18]。值得注意的是,本研究中每年pH下降0.87。此外,土壤EC每年上升60.40%,SOM含量每年减少0.13 个百分点,表明在多年一栽模式草莓生产中,土壤酸化、盐渍化、有机质含量下降是土壤退化的主要特征。
3.2 土壤微生物多样性变化
微生物对农业可持续发展至关重要,因为其在养分转化、运输和SOM降解中起着关键作用[19]。试验结果表明,多年一栽模式显著影响了土壤微生物群落结构。Chao’指数、Shannon 指数和ACE 指数反映了细菌和真菌微生物多样性的逐年下降。环境因素对土壤细菌和真菌群落的影响不同,对于细菌群落结构,SOM、pH 和EC 是变异的主要贡献者,分别占59.8%、58.9%和51.8%。另一方面,对于真菌群落,土壤EC和SOM 是主要的变异贡献者,分别占83.3%和82.7%。这一发现与先前的研究结果一致,土壤酸化、矿物和氮肥施用是影响土壤微生物群落和功能的主要因素[20],土壤盐渍化指标,如pH和EC对细菌群落结构有显著影响[21]。
在属水平上,青霉菌属(Penicillium)和木霉属(Trichoderma)与EC呈显著正相关,与SOM含量呈显著负相关,这两个属的丰度在多年生产中增加。木霉属是一种丝状真菌属,以其他真菌为食,作为植物生长促进菌影响植物对非生物和生物胁迫的响应[22]。青霉菌属是一种环境中常见的真菌属,许多青霉菌属真菌增强了根对养分(如可溶性P)的吸收[23],并在盐胁迫下产生植物激素,如赤霉素[24]。在连续种植黄瓜的根际土壤中,青霉属与农艺性状显著相关[25]。一些青霉属真菌显示出对某些病原体的天然拮抗活性,青霉属种能有效控制由交链孢霉属(Alternaria sp.)和镰刀菌属(Fusarium sp.)真菌引起的香蕉腐烂病[26]。值得注意的是,田间观察显示镰刀菌引起的枯萎病是草莓多年连作导致田间死苗的常见原因。本试验结果表明,青霉属、木霉属等微生物群体对保护植物免受土壤病原体侵害以及缓解土壤酸化和盐渍化引起的胁迫至关重要。未来研究中应关注第四年或更长年份田间正常生产的植株根际微生物组成和植物生理特征,并尝试从中分离和纯化培养促生菌,如木霉属和青霉属微生物,从而开发新型菌剂用于生产。
3.3 土壤微生物功能变化
革兰氏阴性菌依赖于从植物中获得的简单C化合物[27]。在本研究中,革兰氏阳性菌与革兰氏阴性菌的比例增加表明有机土壤中相对C可用性下降和生态系统生产力下降,这与每年SOM含量下降的现象一致。病原菌和腐生菌比例的增加以及共生菌比例的下降与病害加重和产量下降的现象一致。此外,随着收获年份的增加,丛枝菌根真菌(AMF)的丰度显著下降,AMF 能够促进植物生长和产量提高,特别是在盐胁迫等非生物胁迫下[28-29]。AMF 比例的下降表明随着年份增加,草莓生长的土壤微生物环境恶化。
4 结 论
在本试验条件下,发现多年一栽模式草莓生产产量呈现下降趋势,产量与Ca、Mn、Zn、有机质含量及pH呈正相关,与P含量和EC呈负相关,与N和K含量相关性不显著;多年一栽模式草莓产量下降的主要原因是盐分升高、土壤酸化、有机质亏缺和钙、锌等中量元素亏缺,因此在施肥过程中应增加对有机质与钙、锌等中量元素的补充。同时产量下降与土壤微生态的恶化相关,具体表现为土壤微生物群落多样性降低、病原菌水平提高、与N循环相关的功能弱化、AMF 比例下降等,其中镰孢菌属真菌是导致产量下降的核心病原菌因素。
[1] 万红,阮继伟,曾志伟,罗红,贾乔雅,王连润,杜会明,陶磅.云南四季草莓产业生产现状及发展对策[J].中国蔬菜,2020(2):99-102.WAN Hong,RUAN Jiwei,ZENG Zhiwei,LUO Hong,JIA Qiaoya,WANG Lianrun,DU Huiming,TAO Pang.The production status and development countermeasures of Yunnan four everbearing strawberry industry[J]. China Vegetables,2020(2):99-102.
[2] 杨叶青,范琳娟,刘奇志,李维华,宋兆欣.棉隆和氯化苦熏蒸对重茬草莓土壤线虫群落及养分含量的影响[J].园艺学报,2018,45(4):725-733.YANG Yeqing,FAN Linjuan,LIU Qizhi,LI Weihua,SONG Zhaoxin. Effects of dazomet and chloropicrin on the soil nematode communities and nutrient content of replanted strawberry[J]. Acta Horticulturae Sinica,2018,45(4):725-733.
[3] BAGGIO J S,CORDOVA L G,TOLEDO B F,NOLING J W,PERES N A.A reassessment of the fungicidal efficacy of 1,3-dichloropropene,chloropicrin,and metam potassium against Macrophomina phaseolina in strawberry[J]. Pest Management Science,2022,78(8):3416-3423.
[4] 李军见,王艳丽,于艳梅.不同土壤处理方法防治设施草莓重茬病害效果对比试验[J].陕西农业科学,2011,57(2):23.LI Junjian,WANG Yanli,YU Yanmei. The comparative on the efficacy of different soil management methods in controlling replant diseases in greenhouse strawberries[J]. Shaanxi Journal of Agricultural Sciences,2011,57(2):23.
[5] MARTÍ E,SIERRA J,DOMENE X,MUMBRÚ M,CRUAÑAS R,GARAU M A. One-year monitoring of nitrogen forms after the application of various types of biochar on different soils[J].Geoderma,2021,402:115178.
[6] STAFILOV T,ŠAJN R,BLAŽEVSKA R,TĂNĂSELIA C.Assessment of natural and anthropogenic factors on the distribution of chemical elements in soil from the Skopje region,North Macedonia[J]. Journal of Environmental Science and Health,Part A,2022,57(5):357-375.
[7] WANG X Y,LIANG C,MAO J D,JIANG Y J,BIAN Q,LIANG Y T,CHEN Y,SUN B.Microbial keystone taxa drive succession of plant residue chemistry[J]. The ISME Journal,2023,17(5):748-757.
[8] EDGAR R C. UPARSE:Highly accurate OTU sequences from microbial amplicon reads[J].Nature Methods,2013,10(10):996-998.
[9] WANG Q,GARRITY G M,TIEDJE J M,COLE J R. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied and Environmental Microbiology,2007,73(16):5261-5267.
[10] SANSUPA C,WAHDAN S F M,HOSSEN S,DISAYATHANOOWAT T,WUBET T,PURAHONG W.Can we use functional annotation of prokaryotic taxa (FAPROTAX) to assign the ecological functions of soil bacteria?[J]. Applied Sciences,2021,11(2):688.
[11] NGUYEN N H,SONG Z W,BATES S T,BRANCO S,TEDERSOO L,MENKE J,SCHILLING J S,KENNEDY P G. FUNGuild:An open annotation tool for parsing fungal community datasets by ecological guild[J]. Fungal Ecology,2016,20:241-248.
[12] SCHLOSS P D,WESTCOTT S L,RYABIN T,HALL J R,HARTMANN M,HOLLISTER E B,LESNIEWSKI R A,OAKLEY B B,PARKS D H,ROBINSON C J,SAHL J W,STRES B,THALLINGER G G,VAN HORN D J,WEBER C F. Introducing mothur:Open-source,platform-independent,communitysupported software for describing and comparing microbial communities[J].Applied and Environmental Microbiology,2009,75(23):7537-7541.
[13] DIXON P. VEGAN,a package of R functions for community ecology[J]. Journal of Vegetation Science,2003,14(6):927-930.
[14] LI X L,FANG J C,SHAGAHALEH H,WANG J F,HAMAD A A A,ALHAJ HAMOUD Y. Impacts of partial substitution of chemical fertilizer with organic fertilizer on soil organic carbon composition,enzyme activity,and grain yield in wheat-maize rotation[J].Life,2023,13(9):1929.
[15] WANG L,YANG F,YAOYAO E,YUAN J,RAZA W,HUANG Q W,SHEN Q R. Long-term application of bioorganic fertilizers improved soil biochemical properties and microbial communities of an apple orchard soil[J]. Frontiers in Microbiology,2016,7:1893.
[16] YANG J F,ZHANG T R,ZHANG R Q,HUANG Q Q,LI H K.Long-term cover cropping seasonally affects soil microbial carbon metabolism in an apple orchard[J].Bioengineered,2019,10(1):207-217.
[17] LI X G,CHEN D L,CARRIÓN V J,REVILLINI D,YIN S,DONG Y H,ZHANG T L,WANG X X,DELGADO-BAQUERIZO M.Acidification suppresses the natural capacity of soil microbiome to fight pathogenic Fusarium infections[J]. Nature Communications,2023,14(1):5090.
[18] GUO J H,LIU X J,ZHANG Y,SHEN J L,HAN W X,ZHANG W F,CHRISTIE P,GOULDING K W T,VITOUSEK P M,ZHANG F S. Significant acidification in major Chinese croplands[J].Science,2010,327(5968):1008-1010.
[19] MIR Y H,GANIE M A,SHAH T I,BANGROO S A,MIR S A,SHAH A M,WANI F J,QIN A Z,RAHMAN S U.Soil microbial and enzyme activities in different land use systems of the Northwestern Himalayas[J].PeerJ,2023,11:e15993.
[20] FÜZY A,PARÁDI I,KELEMEN B,KOVÁCS R,CSERESNYÉS I,SZILI-KOVÁCS T,ÁRENDÁS T,FODOR N,TAKÁCS T. Soil biological activity after a sixty-year fertilization practice in a wheat-maize crop rotation[J]. PLoS One,2023,18(9):e0292125.
[21] WANG W N,LIU H J,CHEN L F,KOOREM K,HU Y C,HU L J. Natural restoration alters soil microbial community structure,but has contrasting effects on the diversity of bacterial and fungal assemblages in salinized grasslands[J].Science of the Total Environment,2023,891:164726.
[22] WOO S L,HERMOSA R,LORITO M,MONTE E. Trichoderma:A multipurpose,plant-beneficial microorganism for eco-sustainable agriculture[J]. Nature Reviews. Microbiology,2023,21(5):312-326.
[23] DE OLIVEIRA MENDES G,DE FREITAS A L M,PEREIRA O L,DA SILVA I R,VASSILEV N B,COSTA M D. Mechanisms of phosphate solubilization by fungal isolates when exposed to different P sources[J]. Annals of Microbiology,2014,64(1):239-249.
[24] LEITÃO A L,ENGUITA F J. Gibberellins in Penicillium strains:Challenges for endophyte-plant host interactions under salinity stress[J].Microbiological Research,2016,183:8-18.
[25] ZHANG M M,LIANG G Y,REN S,LI L P,LI C,LI Y J,YU X L,YIN Y P,LIU T,LIU X J. Responses of soil microbial community structure,potential ecological functions,and soil physicochemical properties to different cultivation patterns in cucumber[J].Geoderma,2023,429:116237.
[26] WIN T T,BO B,MALEC P,FU P.The effect of a consortium of Penicillium sp. and Bacillus spp. in suppressing banana fungal diseases caused by Fusarium sp. and Alternaria sp.[J]. Journal of Applied Microbiology,2021,131(4):1890-1908.
[27] FANIN N,KARDOL P,FARRELL M,NILSSON M C,GUNDALE M J,WARDLE D A.The ratio of Gram-positive to Gramnegative bacterial PLFA markers as an indicator of carbon availability in organic soils[J].Soil Biology and Biochemistry,2019,128:111-114.
[28] DASTOGEER K M G,ZAHAN M I,TAHJIB-UL-ARIF M,AKTER M A,OKAZAKI S. Plant salinity tolerance conferred by arbuscular mycorrhizal fungi and associated mechanisms:A meta-analysis[J].Frontiers in Plant Science,2020,11:588550.
[29] WAHAB A,MUHAMMAD M,MUNIR A,ABDI G,ZAMAN W,AYAZ A,KHIZAR C,REDDY S P P.Role of arbuscular mycorrhizal fungi in regulating growth,enhancing productivity,and potentially influencing ecosystems under abiotic and biotic stresses[J].Plants,2023,12(17):3102.