核桃(Juglans regia L.)是胡桃科核桃属的重要经济树种,是世界四大干果之一,具有较高营养价值和药用价值[1]。新疆是中国核桃种植第二大省份,2020 年新疆种植面积已达到4.14×105 hm2,年产量达到1.15×106 t[2]。近年来随着新疆核桃的大面积种植,核桃腐烂病大面积发生,严重制约核桃产业的健康发展[3-5]。目前生产上病害仍然以化学防治为主,但化学杀菌剂存在易污染环境、对人畜不安全、农药残留等一系列问题[6-7]。因此,开发出高效的生防菌株替代化学药剂防治核桃腐烂病,不仅可以有效控制病害的发生与发展,还可以有效规避化学防治带来的系列问题。
土壤细菌是植物根际土壤微生态的优势种群之一,具有分布广、数量多、营养要求简单、繁殖快、竞争定殖力强等特点[8]。土壤细菌能产生吩嗪-1-羧酸(phenazine-1-carboxylic acid,PCA)、2,4-二乙酰基间苯三酚、硝吡咯菌素(pyrrolnitrin,PRN)、藤黄绿脓菌素(pyoluterorin,PLT)、假单胞菌酸(pseudomonicacid)、氢氰酸和植物生长素吲哚乙酸(indole-3-aceticacid,IAA)等次生代谢产物,这些有机化合物不仅能增强植物抗病能力,而且还对植物生长发育产生积极影响[9-10]。目前对于核桃腐烂病的生物防治应用较多的拮抗细菌主要有芽孢杆菌(Bacillus spp.),假单胞杆菌(Pseudomonas spp.)、土壤放射杆菌(Agrobacterium radiobacter)等。例如许多学者利用假单胞菌成功防治了小麦[11]、草莓[12]、小白菜[13]和番茄[14]等作物的部分侵染性病害,同时发现假单胞菌还能促进作物的健康生长[15-16]。魏海雷等[17]在小麦全蚀病的土壤中分离得到一株荧光假单胞菌2P2 4,通过研究发现此荧光假单胞菌产生的多种抗菌物质对枯黄萎病、全蚀病以及根腐病均有较好的生物防治效果。冉隆贤等[18]通过筛选发现3株假单胞杆菌及其缺失嗜铁素对桉树灰霉病具有较好的防治效果,且假单胞菌能否产生嗜铁素直接影响桉树灰霉病的发生与否。刘艳萍等[19]研究表明,恶臭假单胞菌A3 产生的嗜铁素可以显著促进黄瓜幼苗的生长。杨艺炜[20]研究发现绿针假单胞菌XF10 能有效地抑制烟草黑胫病菌菌丝生长,且能够抑制游动孢子囊的产生和孢子的萌发,盆栽防效超过70.00%。史娜艳[21]从核桃树皮分离出一株枯草芽孢杆菌S23,该菌株可以使金黄壳囊孢菌丝发生皱缩、畸形甚至断裂,从而抑制菌丝的生长。展丽然等[22]从土壤中筛选到一株放线菌Z-6,该菌株对腐烂病菌有较强拮抗作用,经过鉴定该放线菌属于链霉菌属(Streptomyces)。
目前对核桃腐烂病的生物防治应用较多的拮抗细菌主要有芽孢杆菌(Bacillus spp.)[23],但是利用绿针假单胞来防治核桃腐烂病还未见报道。如今核桃产业已成为新疆核桃种植区巩固脱贫、促进乡村振兴和增加农民收入的重要支柱性产业。然而核桃腐烂病的发生与蔓延严重阻碍了核桃产业的健康发展。因此,从核桃园土壤中分离筛选活性高、对环境友好且能促进壮苗培育的拮抗菌,对促进新疆核桃产业的健康发展具有重要意义。
1 材料和方法
1.1 试验材料
1.1.1 土壤样品 2023年5月从阿克苏地区温宿县核桃林场采集试验土壤。果园核桃品种为温185,树龄30年,株行距为5 m×7 m。采样时选取长势均匀的核桃树,按照5点采样法采集核桃园土壤,在距离核桃树主干1 m的地方去除0~5 cm表层土,用取土钻采集5~20 cm 的土壤,每个30 年树龄核桃园采集20份土壤样品,共采集90份样品。按照四分法收集土壤,将土壤过2 mm筛并将土样装入无菌袋中,于4 ℃冰箱保存备用。
1.1.2 供试病原菌菌株 核桃腐烂病菌Cytospora chrysosperma 和C.nivea、苹果腐烂病菌Valsa mali、香梨腐烂病菌V. ambiens、沙枣腐烂病菌C. chrysosperma、杏树腐烂病菌C.leucostoma、核桃褐斑病菌Alternaria alternata、棉花黄萎病菌Verticillium dahliae、棉花枯萎病菌Fusarium oxysporum,均由南疆有害生物综合治理兵团重点实验室提供。
1.1.3 培养基 NA培养基:牛肉膏3 g,氯化钠5 g,蛋白胨10 g,琼脂20 g,蒸馏水定容至1000 mL。LB液体培养基:蛋白胨10 g,酵母膏5 g,氯化钠5 g,蒸馏水定容至1000 mL。PDA培养基:马铃薯去皮200 g,葡萄糖20 g,琼脂粉20 g,蒸馏水定容至1000 mL。
1.2 试验方法
1.2.1 拮抗细菌的分离 称取土壤样品10.0 g放入装有90 mL 无菌水和玻璃珠的三角瓶中,于摇床上振荡30 min后制得土壤样品悬液,然后按比例制成10-2、10-3、10-4样品稀释液。分别吸取100 μL 上述处理液于NA 培养基上,通过稀释涂布法分离菌株,30 ℃培养24 h,然后平板上划线纯化、培养并编号,4 ℃存放。
1.2.2 拮抗细菌的筛选 采用平板对峙培养法。将保存的细菌活化培养后,十字交叉等距离(距离病原菌2.5 cm 左右)划线至已接种核桃树腐烂病病原菌C.chrysosperma 的PDA 平板上[24],以只接病原菌为对照,每个处理3个重复。26 ℃恒温培养,待对照菌丝即将长满时,观察菌落形态并且测量菌落直径计算菌落生长抑菌率。
抑菌率/%=(对照平板菌落直径-处理平板菌落直径)/对照平板菌落直径×100。
1.3 拮抗菌株的鉴定
1.3.1 拮抗菌株形态学特征和生理生化特性测定将活化后的菌株WS-04划线接种于NA固体培养基上,30 ℃培养24 h,观察菌落颜色和形态,并参考《伯杰细菌鉴定手册》[25]和《常见细菌系统鉴定手册》[26]测定生理生化指标。
1.3.2 拮抗菌株分子生物学鉴定 拮抗细菌基因组DNA提取采用试剂盒(生工生物科技有限公司),采用细菌通用引物27F5'-AGAGTTTGATCCTGGCTCAG-3';1492R5'-GGTTACCTTGTTACGACTT-3'[27]扩增16S rDNA;扩增采用50 μL 反应体系,PCR 反应条件为95 ℃预变性3 min,95 ℃变性35 s,55 ℃退火35 s,72 ℃延伸2 min,35 个循环,72 ℃延伸10 min,扩增产物用1%的琼脂糖凝胶电泳,使用凝胶成像仪观察结果,最后将检测合格的扩增产物送至上海生物工程股份有限公司测序。利用MEGA 11.0软件采用邻接法构建基于16S基因的系统发育树,明确拮抗菌株的分类地位。
1.4 拮抗菌株抑菌谱测定
采用平板对峙法对核桃树腐烂病另一种病原菌C.nivea、苹果腐烂病菌V.mali、香梨腐烂病菌V.ambiens、杏树腐烂病菌C.leucoostoma、沙枣腐烂病菌C. chysosperma、核桃褐斑病菌A. alternata、棉花黄萎病菌V. dahliae、棉花枯萎病菌F. oxysporum 开展抑菌率测定,方法参照1.2.2。
1.5 拮抗菌株生长曲线的测定
将拮抗菌株用接种环挑取放入盛有LB 液体培养基的250 mL三角瓶中,30 ℃200 r·min-1控温摇床培养,每2 h 测量1 次OD600,培养80 h,记录数据,绘制生长曲线。
1.6 不同浓度梯度发酵滤液对病原菌菌丝抑制率测定
菌悬液的制备:挑取拮抗菌单菌落接种于液体培养基中,30 ℃200 r·min-1培养2 d,获得菌悬液。
发酵液的制备:取100 μL 拮抗菌菌悬液于12 000 r·min-1室温离心2 min,吸取上清液转接于100 mL 的液体培养基中,30 ℃200 r·min-1培养2 d后得到发酵液。
发酵滤液的制备:将发酵液4 ℃、12 000 r·min-1离心20 min 后取上清液,用0.22 μm 滤膜过滤器过滤获得发酵滤液,将获得的发酵滤液放置于4 ℃冰箱中备用。
将发酵滤液和融化好的PDA培养基混合,分别配置成发酵滤液含量为3%、6%、9%、12%、15%的培养基平板,中央接种一个培养3 d的C.chrysosperma菌饼(直径5 mm),以不含发酵滤液的PDA 培养基为对照组,每处理3次重复,26 ℃培养3 d,采取菌丝生长速率法测定抑菌率。
1.7 拮抗菌株发酵滤液热稳定性测定
将5 个装有10 mL 发酵滤液的离心管,分别置于55、65、75、85、95 ℃温度条件下水浴30 min,将发酵滤液与融化冷却至55 ℃的PDA 培养基(1∶3)混合倒板,待培养基凝固后在平板中央放置病原菌菌饼,以没有进行温度处理的发酵滤液和PDA培养基(1∶3)混合为阳性对照,以未加入发酵滤液的PDA培养基为空白对照,每个处理3次重复,26 ℃黑暗培养,直至空白对照组病原菌菌丝长满平皿后,测量病原菌菌落直径,并计算菌丝生长抑制率。
1.8 发酵液对C.chrysosperma菌丝生长的影响
取20 mL冷却的PDA与5 mL发酵液混合后,在灭菌载玻片上倒上一层混合液,凝固后用灭菌刀片划去宽约1 cm 的培养基,挑取培养3 d 的C.chrysosperma 菌丝接种于截面,盖上盖玻片,然后置于湿润的培养皿中26 ℃恒温培养3 d,以不加发酵液的PDA为对照。显微镜下观察菌丝形态变化。
1.9 发酵液对离体枝条的保护作用
枝条处理:采集健康和粗细程度均一的2 年生核桃枝条,剪成10~15 cm 的枝段,在超净工作台用灭菌水冲洗干净后,用0.6%次氯酸钠溶液消毒15~20 min后,无菌水再次清洗3~4次,自然晾干。用水浴锅融化的石蜡封住枝条两端保湿,静置晾干备用,整个过程均在无菌环境进行。
将处理好的枝条用灭菌打孔器(孔径5 mm)打孔,处理组织用灭菌刷子蘸取适量发酵液涂刷枝条5 次,等整体晾干后在枝条已打好的孔径处接种核桃树腐烂病菌菌饼,每个枝条1个接种点,每个处理设置3个重复(每重复为5个枝条),以LB液体培养基代替发酵液为对照,在26 ℃条件下保湿培养15 d后,观察离体枝条腐烂病的发生情况,并测量病斑面积(游标卡尺)。
病斑面积/cm2=1/4×π×长径×短径。
1.10 菌株WS-04发酵滤液对核桃种子和幼苗的促生作用
1.10.1 菌株WS-04对温185核桃种子萌芽率、发芽率和坏种率的影响 选取种仁饱满、无霉无虫,且单果质量≥12 g 的干果作为试验材料,自然晾干。将拮抗菌株WS-04发酵滤液加入到灭菌蒸馏水,设置成5 个质量浓度(50、150、250、350、450 mg·mL-1),以灭菌蒸馏水处理为对照,一个质量浓度处理20粒种子,3次重复。浸泡之前将核桃外壳开口,使其发酵滤液接触核桃仁,浸泡1 d 后用清水洗净,放在湿润的发芽盒内,置于30 ℃恒温培养箱中催芽处理,每日观察种子发芽情况,及时清除腐烂霉变种子。待种子发芽后,播种于花盆(20 cm×20 cm)中,每穴2 粒种子,覆盖l cm 厚基质(蛭石∶珍珠岩∶泥炭∶土壤体积比为1∶1∶1∶1)。统计种子萌动情况,计算种子萌芽率,待种子长出2 枚叶子后统计发芽率和坏种率。

1.10.2 菌株WS-04 发酵滤液对核桃幼苗的促生作用 带壳核桃种子的预处理:将带壳核桃使用核桃夹轻轻裂开,避免核桃仁接触不到拮抗菌发酵滤液。以150 mg·mL-1拮抗菌发酵滤液为试验组,以未添加拮抗菌发酵滤液的培养基为对照,25粒核桃种子为一个处理,5次重复。
浸种催芽处理:核桃种子用75%乙醇表面消毒30 s,无菌水漂洗3次。30 ℃温水浸种4~5 h,种子于28 ℃催芽。种子发芽后,播种于穴盘(32 孔,6 cm×4.5 cm)中,每穴1粒种子,覆盖l cm厚基质(蛭石∶珍珠岩∶泥炭∶土壤体积比为1∶1∶1∶1)。
促生苗处理:(1)穴盘苗处理。将催芽处理的核桃种子播种于穴盘,开始浇灌拮抗菌发酵滤液(试验组浇灌150 mg·mL-1发酵滤液,对照浇灌水),每次每穴浇灌50 mL、每5 d浇灌一次,待种子生长20 d后,将穴盘幼苗移栽至室外大田盆栽。
(2)盆栽苗处理。于2023 年7 月将穴盘盆栽核桃幼苗移栽到塔里木大学节水灌溉试验田(直径为40 cm 花盆),浇灌3 次发酵滤液每次每盆500 mL(每10 d 1次),核桃幼苗移栽生长90 d后,于2023年9月随机选择5株幼苗测量干质量、苗高、主根长、须根数等生物学指标。拔出核桃幼苗时保证植株的完整性,对核桃幼苗的根系整理时,用无菌水缓慢冲洗,确保根部的完整性。
1.11 数据处理
利用Excel 和DPS 软件进行数据统计和分析,利用MEGA 11.0建立系统发育树。
2 结果与分析
2.1 拮抗菌株分离和筛选
采用稀释涂布平板法总共分离得到细菌157株,平皿对峙获得5株对C.chysosperma有较强拮抗作用的菌株,其抑菌率超过70%(表1)。其中菌株WS-04对C.chysosperma抑制作用最强(图1),抑制率达到87.00%。因此本研究中选定菌株WS-04 进一步开展后续研究。
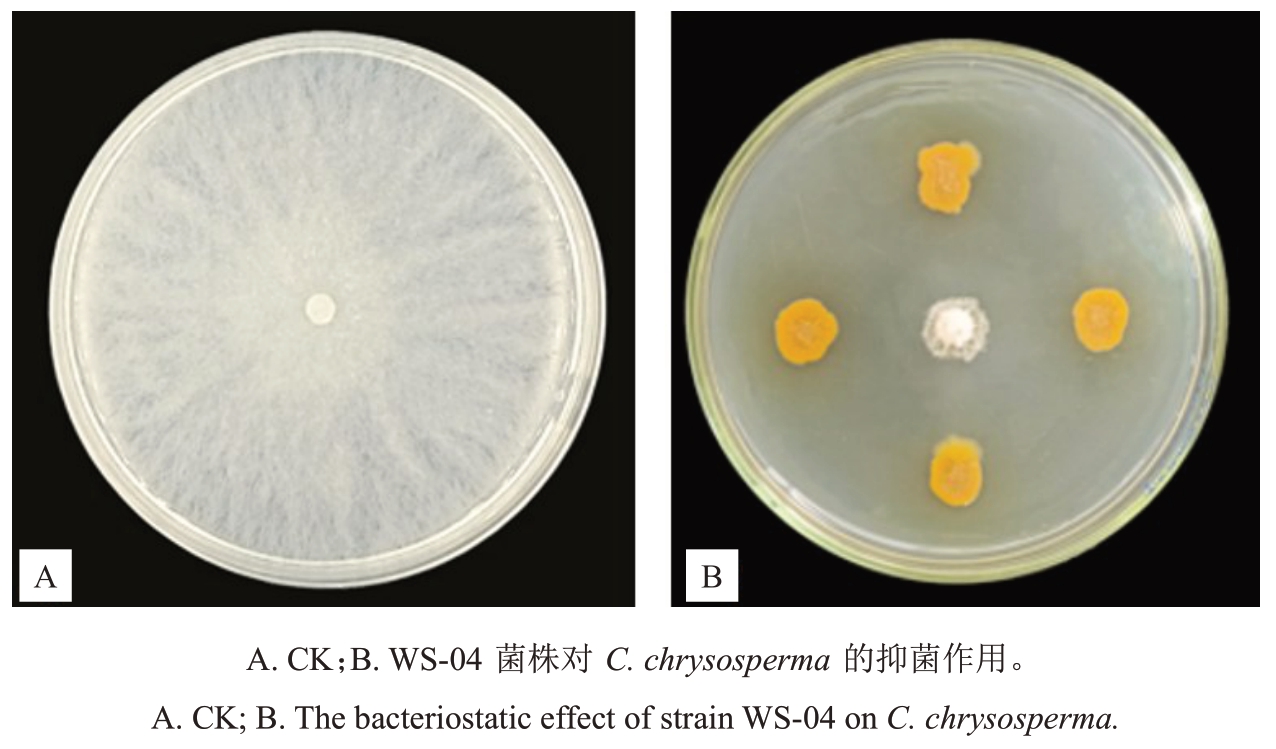
图1 菌株WS-04 对C.chrysosperma 的抑制作用
Fig.1 Strain WS-04 confronted the C.chrysosperma
表1 拮抗菌株的复筛结果
Table 1 Rescreening results of the antagonistic strains
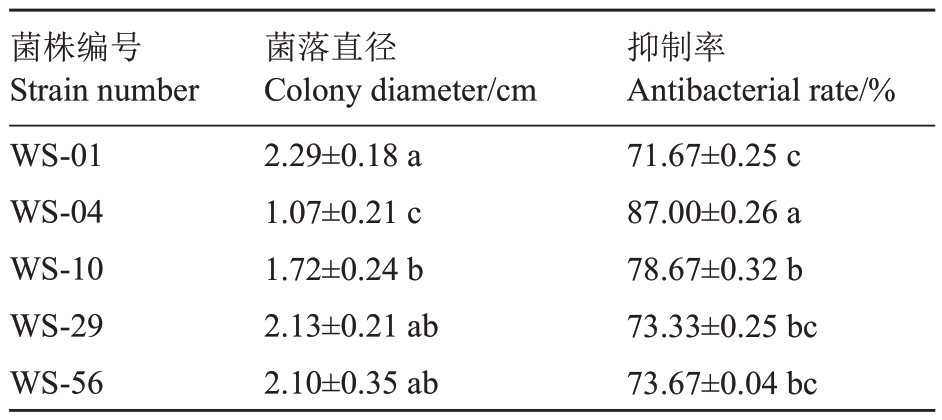
注:表中数据为平均值±标准差,不同小写字母代表差异显著(p<0.05)。下同。
Note:The data are mean±standard deviation, different small letters represent the significant difference(p<0.05).The same below.
抑制率Antibacterial rate/%71.67±0.25 c 87.00±0.26 a 78.67±0.32 b 73.33±0.25 bc 73.67±0.04 bc菌株编号Strain number WS-01 WS-04 WS-10 WS-29 WS-56菌落直径Colony diameter/cm 2.29±0.18 a 1.07±0.21 c 1.72±0.24 b 2.13±0.21 ab 2.10±0.35 ab
2.2 拮抗菌株WS-04的鉴定
2.2.1 形态特征观察 在LB固体培养基上培养24 h后可形成1.2 mm 菌落,菌落橙色,圆形,表面凸起,光滑,较黏稠,易挑起,边缘整齐,电镜扫描菌体形态为杆状(图2)。生理生化测定结果表明,菌株可利用分解无机磷、蛋白酶、铁载体、明胶、多糖、M.R、蔗糖、精氨酸、酯酶、氧化酶、柠檬酸盐。最适生长盐含量(w)为0%~6% NaCl,最适生长pH 为7.0~7.5(表2)。
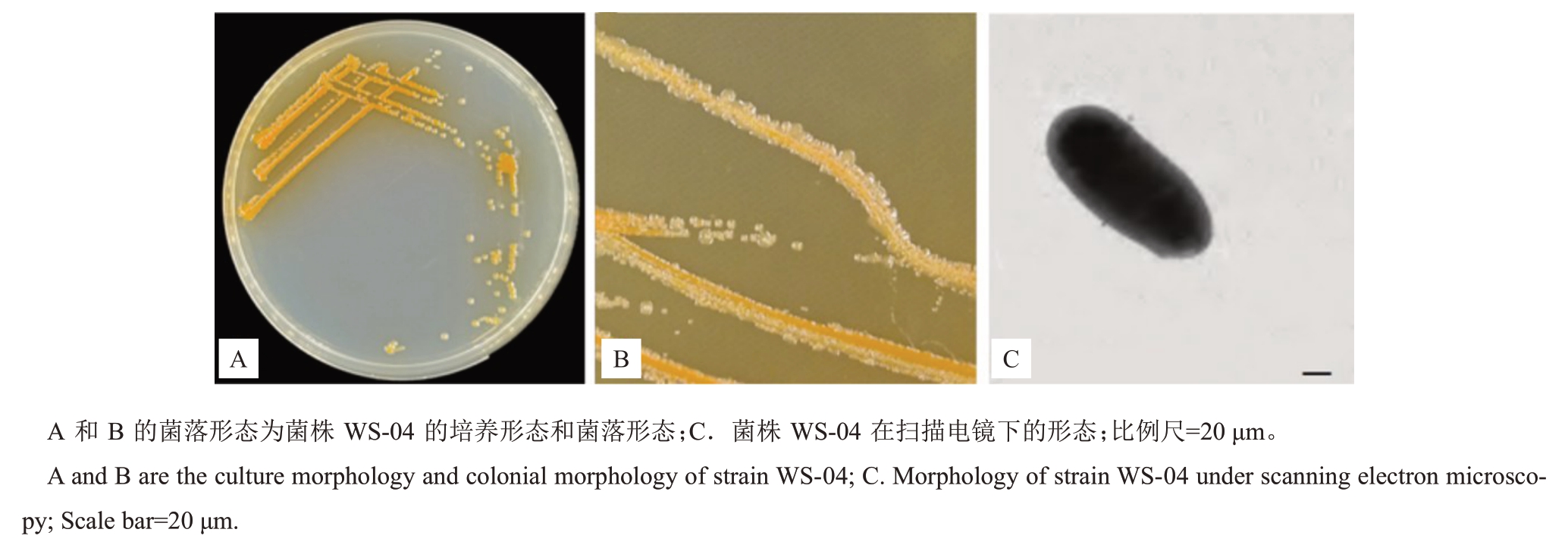
图2 菌株WS-04 形态特征
Fig.2 Colony morphology of strain WS-04
表2 菌株WS-04 的生理生化鉴定
Table 2 Physiological and biochemical identification nof strain WS-04
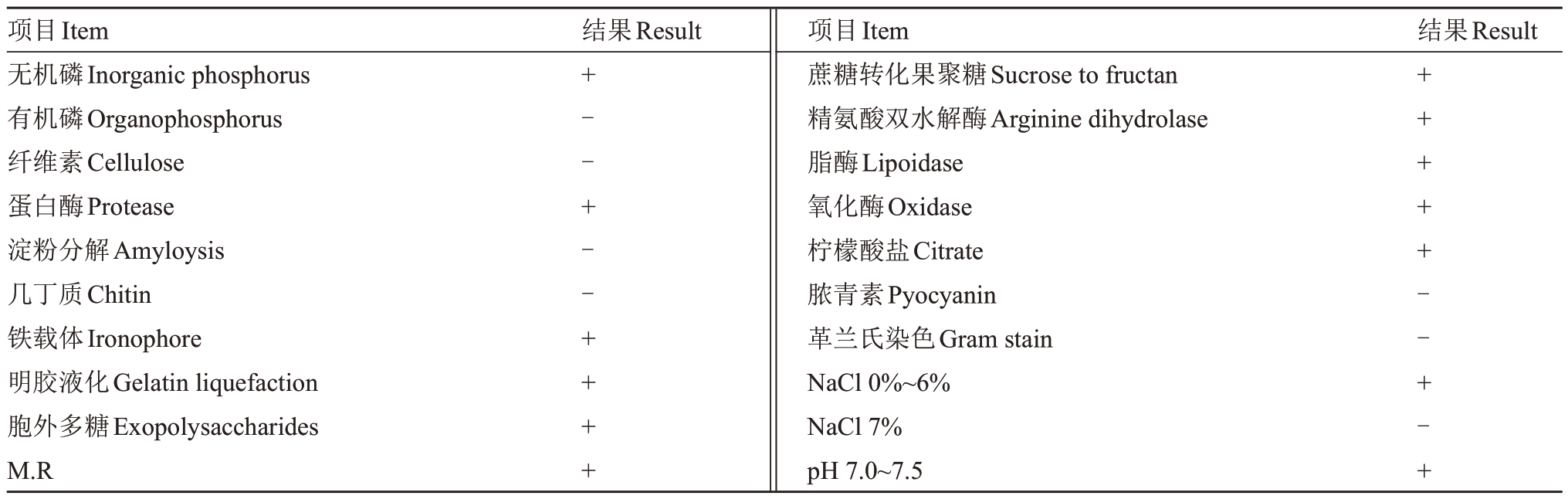
注:“+”.阳性;“-”.阴性。
Note:“+”.Positive or available;“-”.Negative or not available.
项目Item无机磷Inorganic phosphorus有机磷Organophosphorus纤维素Cellulose蛋白酶Protease淀粉分解Amyloysis几丁质Chitin铁载体Ironophore明胶液化Gelatin liquefaction胞外多糖Exopolysaccharides M.R结果Result 结果Result+--+--++++项目Item蔗糖转化果聚糖Sucrose to fructan精氨酸双水解酶Arginine dihydrolase脂酶Lipoidase氧化酶Oxidase柠檬酸盐Citrate脓青素Pyocyanin革兰氏染色Gram stain NaCl 0%~6%NaCl 7%pH 7.0~7.5+++++--+-+
2.2.2 分子生物学鉴定 16S rRNA 基因序列测序后提交GenBank获得登录号PP059680,同源性比对结果显示菌株WS-04 与绿针假单胞菌P. chlororaphis 的同源率为99%。以Bacillus subtilis 为外群构建系统发育树,菌株WS-04与绿针假单胞菌P.chlororaphis聚在同一分支(图3),表明WS-04与P.chlororaphis 的亲缘关系最近,结合形态特征、生理生化特征和分子鉴定结果,最终将菌株WS-04鉴定为绿针假单胞菌P.chlororaphis。
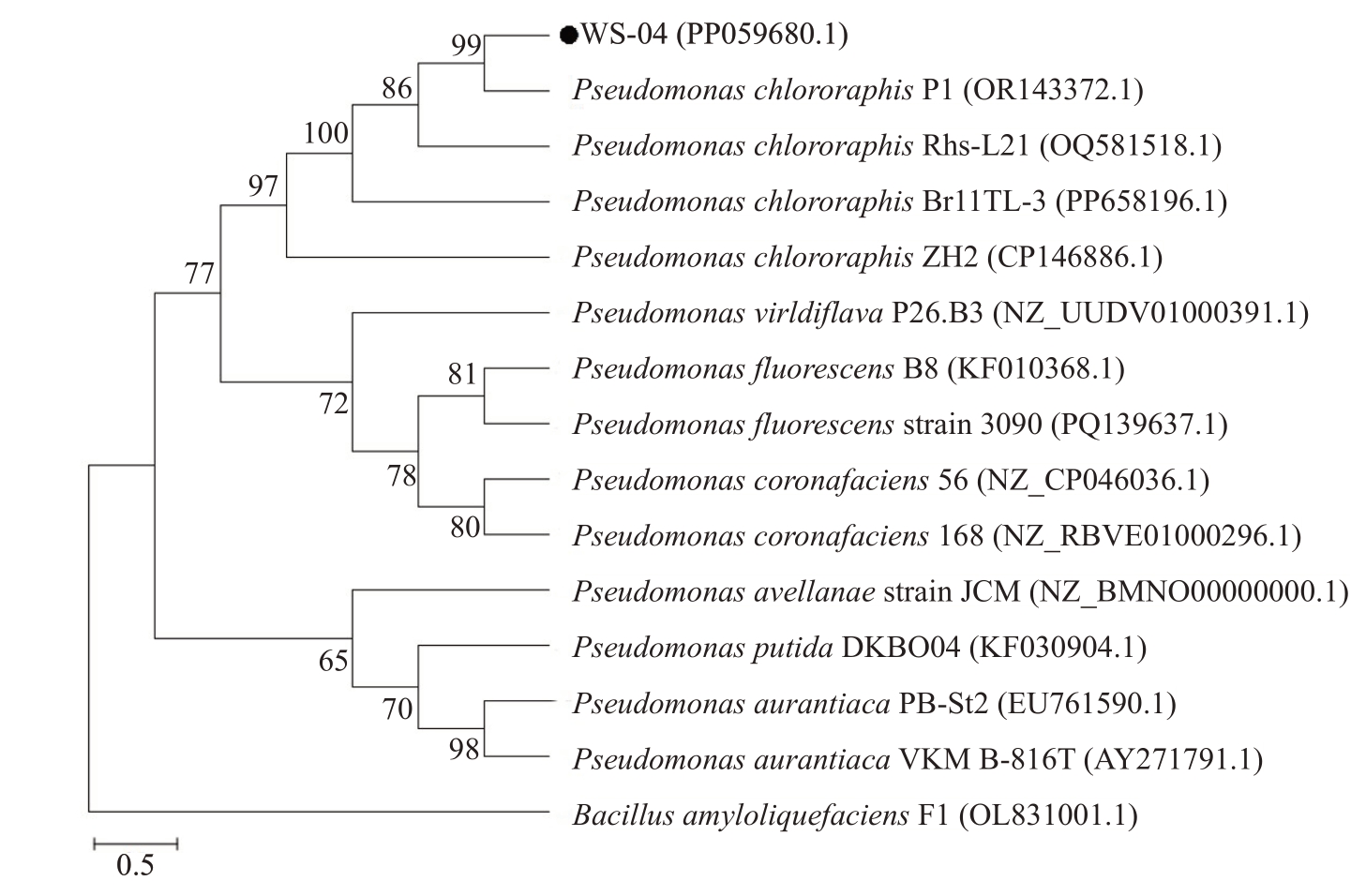
图3 菌株WS-04 基于16S rDNA 基因序列的系统发育树
Fig.3 Phylogenetic tree of strain WS-04 based on the 16S rDNA gene sequences
2.3 拮抗菌株WS-04抑菌谱的测定
抑菌谱测定结果表明,拮抗菌株WS-04 对8 种供试病原菌的抑制率均高于75%(表3)。其中对C. nivea、V. mali、V. ambiens、V. dahliae、C. chrysosperma、A.alternata病原菌的抑制率超过80%,说明菌株WS-04具有较好广谱拮抗效果(图4)。
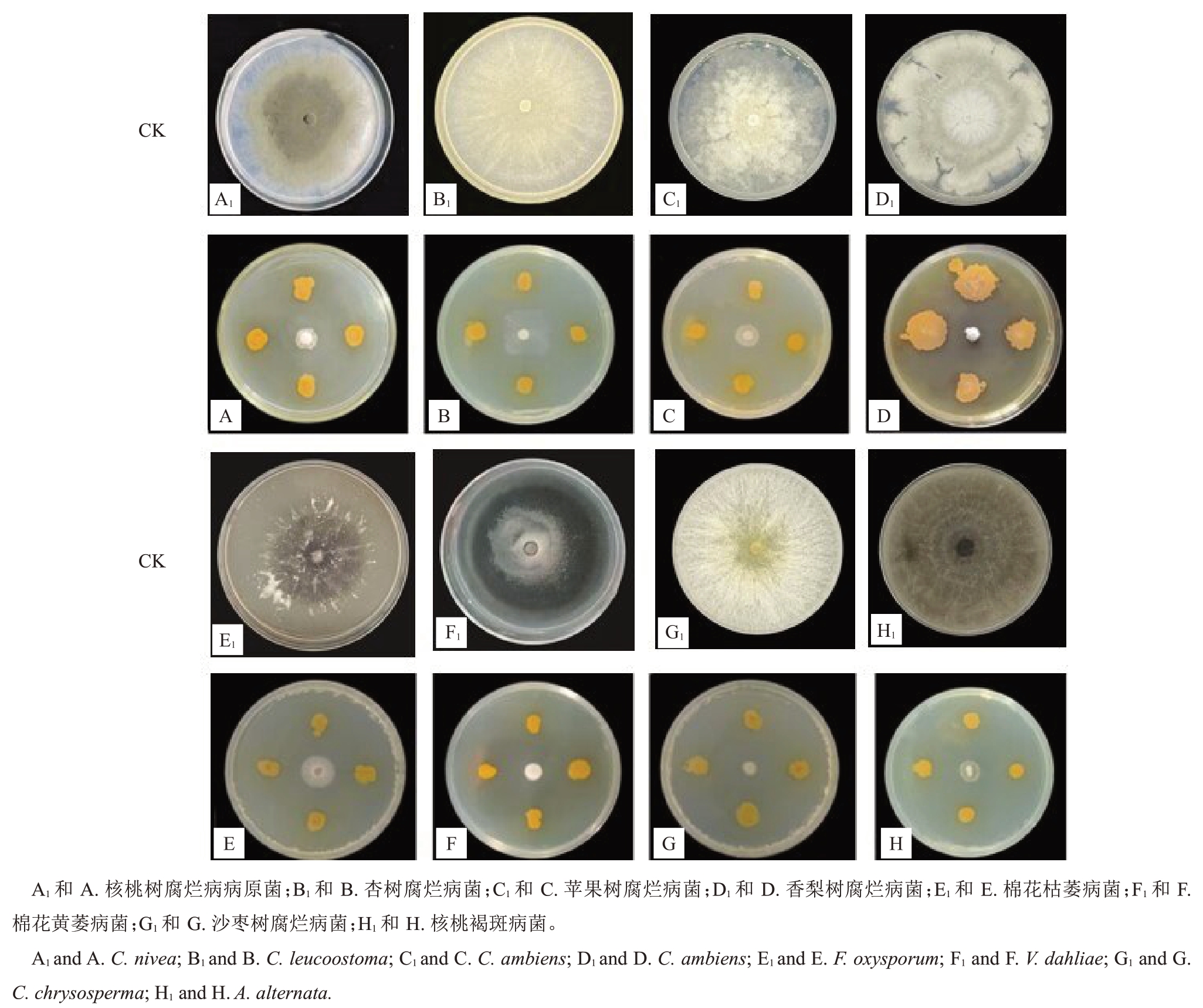
图4 WS-04 对8 种病原菌菌丝生长的影响
Fig.4 Effect of WS-04 on mycelial growth of eight plant pathogens
表3 菌株WS-04 对供试病原菌的抑制率
Table 3 Inhibition rate of biocontrol bacteria WS-04 against the tested pathogens
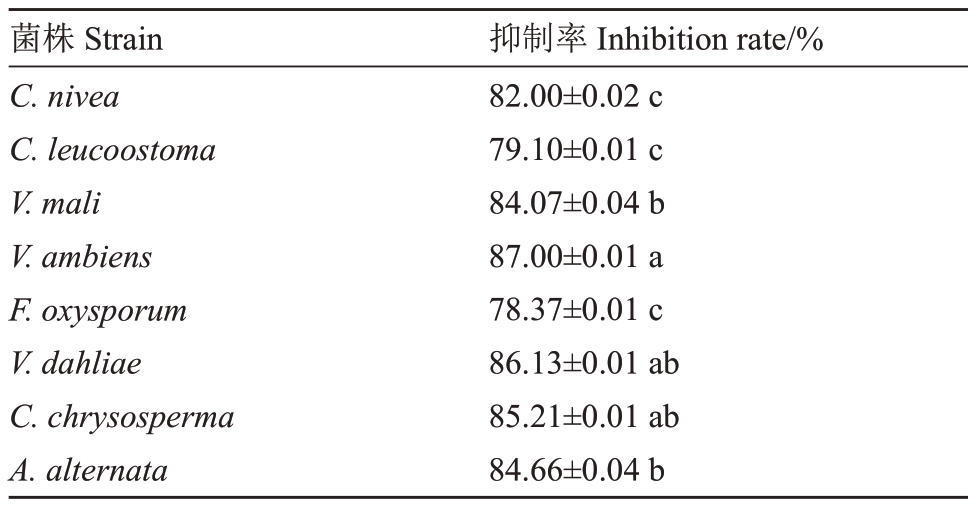
菌株Strain C.nivea C.leucoostoma V.mali V.ambiens F.oxysporum V.dahliae C.chrysosperma A.alternata抑制率Inhibition rate/%82.00±0.02 c 79.10±0.01 c 84.07±0.04 b 87.00±0.01 a 78.37±0.01 c 86.13±0.01 ab 85.21±0.01 ab 84.66±0.04 b
2.4 拮抗菌株WS-04生长曲线的测定
菌株WS-04 的生长曲线如图5 所示,在0~6 h菌株生长缓慢,进入生长延滞期;6 h 以后细菌快速生长,48 h 达到生长高峰期,随后进入生长稳定期;自58 h 以后菌体数量逐渐减少进入衰亡期。研究表明菌株在48~58 h菌悬液数量最多而且活性强。
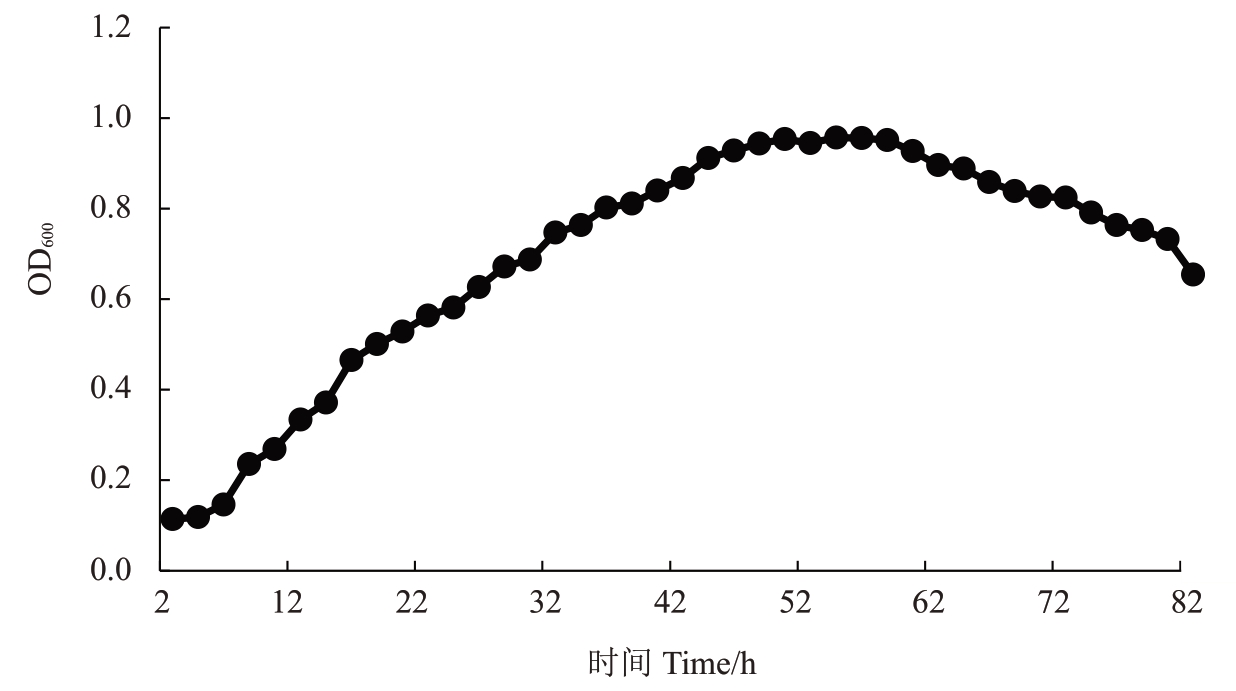
图5 菌株WS-04 的生长曲线
Fig.5 Growth curves of strain WS-04
2.5 不同浓度梯度发酵滤液对病原菌菌丝的抑制率
采用菌丝生长速率法测定不同浓度梯度发酵滤液对C.chrysosperma菌丝生长的抑菌率。结果表明不同浓度梯度发酵滤液对菌丝均具有较好抑制效果(图6),且随着浓度升高,其抑制效果越明显,最高抑制率达到93.65%(表4)。
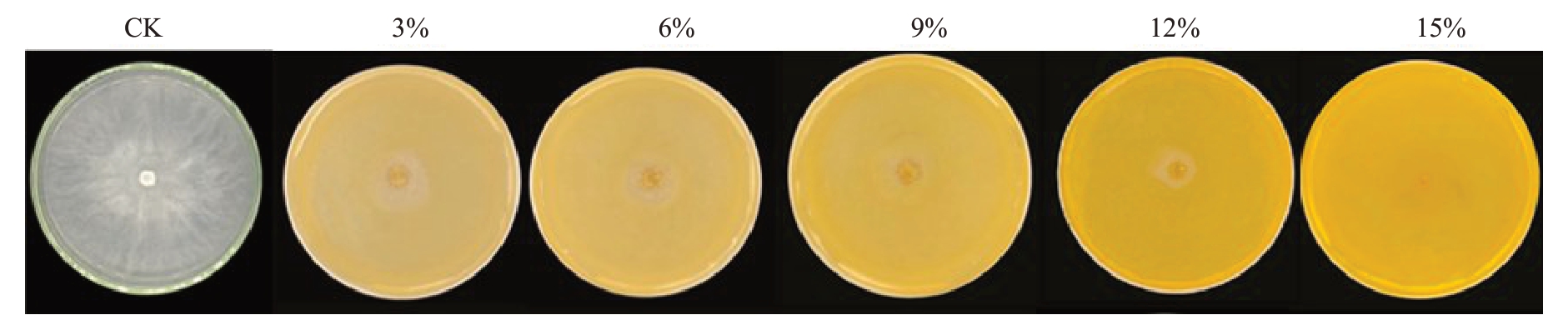
图6 不同浓度发酵滤液对C.chrysosperma 菌丝生长的抑制效果
Fig.6 Inhibition of fermentation filate growth at different concentrations in C.chrysosperma
表4 不同浓度发酵液对病原菌菌丝生长的抑制率
Table 4 Inhibition of hyphal growth of fermentation broth at different concentrations
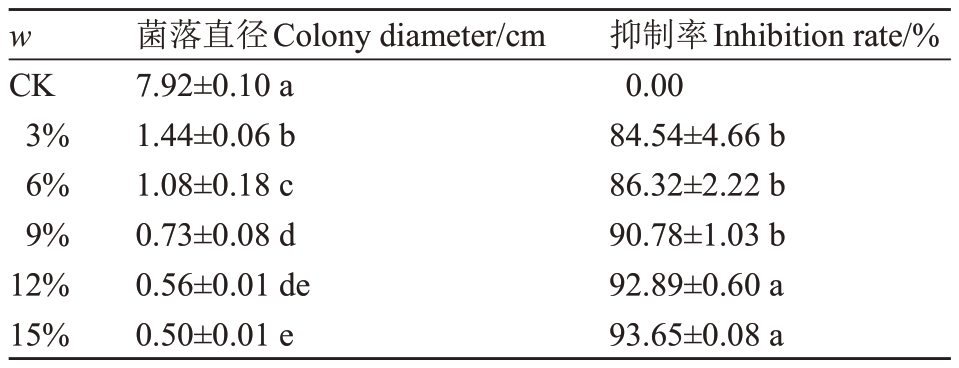
w CK 3%6%9%12%15%菌落直径Colony diameter/cm 7.92±0.10 a 1.44±0.06 b 1.08±0.18 c 0.73±0.08 d 0.56±0.01 de 0.50±0.01 e抑制率Inhibition rate/%0.00 84.54±4.66 b 86.32±2.22 b 90.78±1.03 b 92.89±0.60 a 93.65±0.08 a 35700.8319 36720.8076 37740.7861 38760.7482 39780.7570 40800.7326
2.6 拮抗菌WS-04发酵滤液热稳定性测定
由图7可知,菌株WS-04发酵滤液在不同水浴温度处理后,其抑制率随温度升高而下降,但对C.chrysosperma的抑制率均在85%以上,表现出良好的热稳定性(图7-A、B)。但是95 ℃处理30 min后,其抑制率明显降低。综上可知,拮抗菌WS-04发酵滤液经温度梯度处理以后,对C.chrysosperma 的抑制率有一定的影响,说明温度升高会导致发酵滤液中抑菌成分逐渐丧失活性。
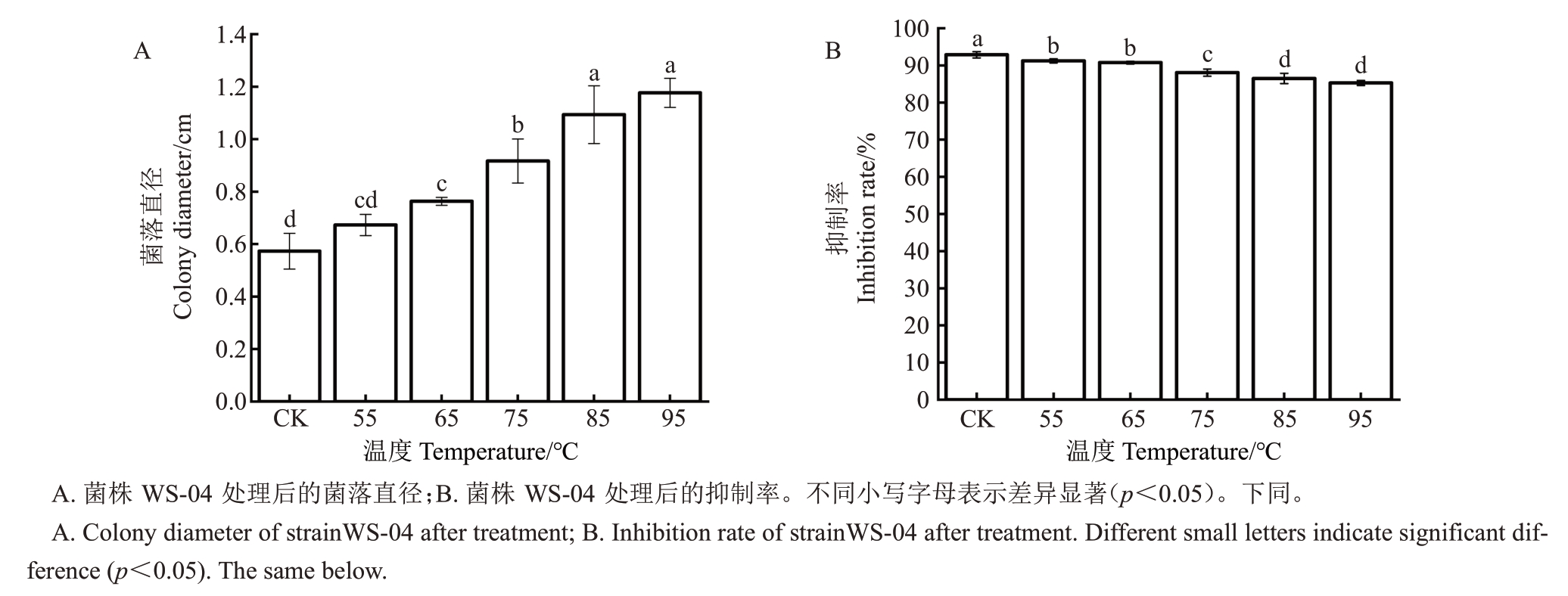
图7 温度对菌发酵滤液抑菌活性的影响
Fig.7 Effect of temperature on bacteriostatic activity of biocontrol bacteria fermentation filtrate
2.7 拮抗菌WS-04 发酵液对C.chrysosperma 菌丝生长的影响
由图8可以看出,C.chrysosperma的菌丝在混合培养基上生长3 d后,菌丝顶端膨大出现皱缩,局部菌丝弯曲变畸,菌丝出现严重消融的现象,菌丝无法正常生长(图8-B、C、E);而对照组C. chrysosperma菌丝细长均匀且表面光滑,形态饱满而完整,能正常生长(图8-A、D)。

图8 绿针假单胞菌WS-04 对C.chrysosperma 抑制效果
Fig.8 Inhibition efficacy of Pseudomonas WS-04 on C.chrysosperma
2.8 离体枝条保护试验
离体枝条保护试验表明(图9),菌株WS-04 对核桃腐烂病具有很好的预防效果,用菌株WS-04发酵液处理过的病斑平均面积为0.85 cm2(图9-B),而对照病斑平均面积达到6.32 cm2(图9-A),防治效果为84.96%(表5)。
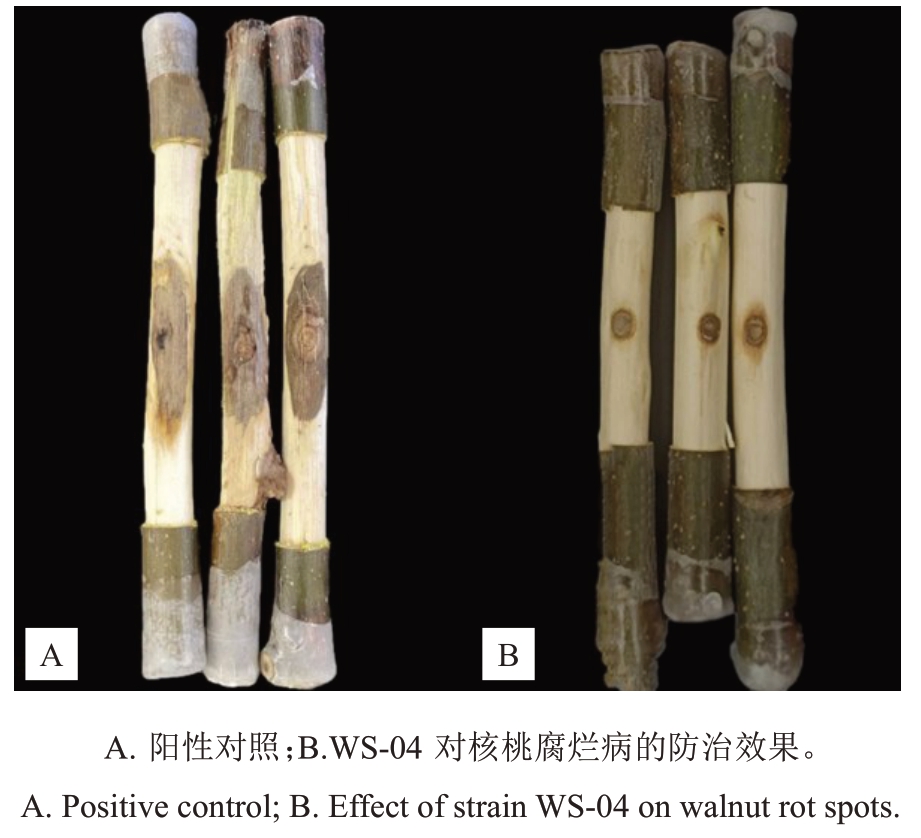
图9 WS-04 发酵滤液对核桃腐烂病的防治作用
Fig.9 Control effect of WS-04 fermentation filtrate on walnut canker disease
表5 WS-04 发酵滤液对核桃腐烂病斑病的防治作用
Table 5 Control effect of WS-04 fermentation filtrate on walnut canker disease

菌株编号Strain number CK WS-04病斑面积Lesion area/cm2 6.32±0.35 a 0.95±0.10 b预防效果Prevention effect/%84.96
2.9 拮抗菌株WS-04 发酵滤液对核桃种子和幼苗的促生作用
2.9.1 拮抗菌株WS-04对核桃种子萌芽率、发芽率和坏种率的影响 由图10-A可知,带壳核桃种子在拮抗菌发酵滤液的处理下,随着菌发酵滤液质量浓度的增加,其萌芽率呈现先上升后下降的趋势,而且处理质量浓度在150 mg·mL-1 和250 mg·mL-1 左右时能显著提高核桃种子萌芽率。绿针假单胞菌WS-04 不同质量浓度发酵滤液处理后的种子萌芽情况为250 mg·mL-1>150 mg·mL-1>350 mg·mL-1>50 mg·mL-1>450 mg·mL-1,各处理均显著高于对照(p<0.05)。因此绿针假单胞菌WS-04 具有促进核桃种子萌芽的作用。
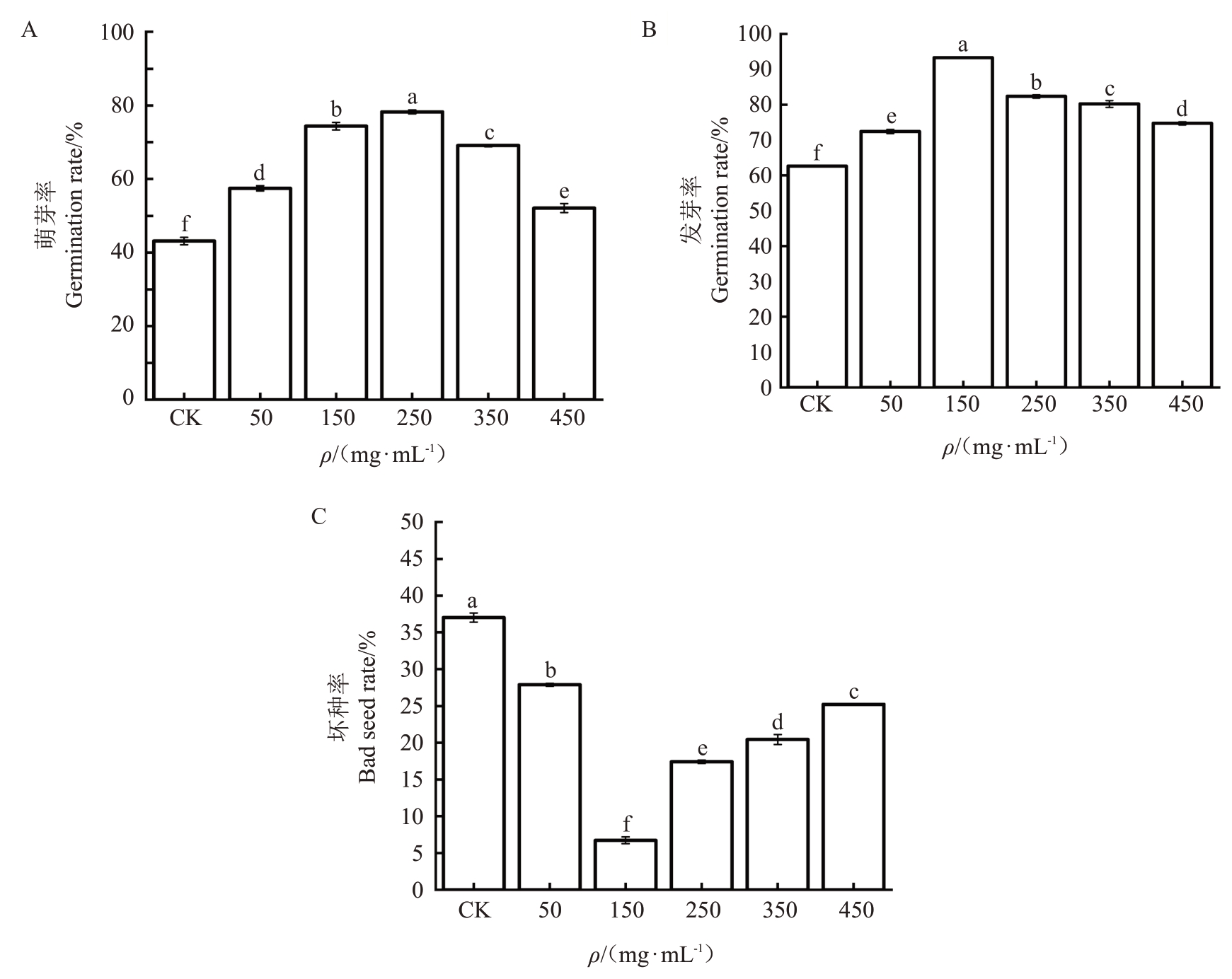
图10 不同发酵滤液质量浓度对带壳核桃种子萌芽率、发芽率以及坏种率的影响
Fig.10 The effects of different fermentation filtrate concentrations on the germination rate,germination rate and bad seed rate of shelled walnut seeds
由图10-B可知,带壳核桃种子在拮抗菌不同质量浓度发酵滤液处理下,发芽率随质量浓度增加呈现先升后降的趋势。绿针假单胞菌WS-04 发酵滤液在50~150 mg·mL-1范围内,核桃种子发芽率逐渐升高,当发酵滤液质量浓度超过250 mg·mL-1时其发芽率逐渐减弱。拮抗菌发酵滤液质量浓度在150~250 mg·mL-1之间时,对核桃种子发芽有着明显促进作用。由图10-C可知,随着发酵滤液质量浓度增加,核桃种子坏种率呈现出先下降后略微升高的趋势。绿针假单胞菌WS-04在质量浓度为150 mg·mL-1时的坏种率最低为6.68%。当拮抗菌发酵滤液质量浓度大于150 mg·mL-1以后坏种率呈现上升趋势,但各质量浓度处理后的坏种率均显著低于对照(p<0.05)。
2.9.2 菌株WS-04 发酵滤液对核桃幼苗的促生作用 由表6可知,用绿针假单胞菌WS-04处理后的核桃幼苗的平均生长指标(图11),其苗高为16.97 cm、主根长18.7 cm、须根数为12.33 条、叶片面积为65.51 cm2、干质量为3.73 g。而对照组核桃幼苗的苗高为13.53 cm,主根长为10.20 cm,须根数为8.33条,叶片面积为52.51 cm2,干质量为2.33 g。与对照相比,其苗高、主根长、须根数、叶片面积和干质量显著增加,其依次增加了25.42%、83.33%、48.02%、24.76%和98.40%。

图11 菌株WS-04 对核桃幼苗的促生试验
Fig.11 Growth promotion test of strain WS-04 on walnut seedlings
表6 菌株WS-04 发酵滤液对核桃幼苗生长指标的影响
Table 6 Effects of fermentation filtrate of strain WS-04 on growth indexes of walnut seedlings

菌株编号Strain number CK WS-04增长率Increase rate/%苗高Plant height/cm 13.53±1.12 b 16.97±1.33 a 25.42主根长Root length/cm 10.20±0.62 b 18.70±13.12 a 83.33须根数Fibrous root number 8.33±1.52 b 12.33±2.08 a 48.02叶片面积Blade area/cm2 52.51±0.73 b 65.51±2.08 a 24.76干质量Dry mass/g 2.33±0.75 b 3.73±0.69 a 98.40
3 讨 论
从核桃园土壤中分离筛选到一株对核桃腐烂病有较强拮抗作用,同时又能提高核桃萌芽率并降低坏种率的绿针假单胞菌WS-04,该菌株可使C.chrysosperma 菌丝消融、萎缩、畸变,其抑制率达到87.00%,核桃离体枝条腐烂病防效亦达到84.96%。经过绿针假单胞菌WS-04 发酵滤液处理过的核桃种子,其萌芽率和发芽率明显提高,同时坏种率也明显下降。这是首次报道绿针假单胞菌在核桃上的应用,但绿针假单胞菌的发酵条件、不同环境核桃园根际定殖能力以及防病促生的机制还有待进一步深入研究。
生物防治是实现植物病害绿色防控的有效手段,发掘对病原物具有拮抗作用的有益微生物是实施生物防治的前提[28]。很多具有拮抗作用的微生物产生的抗菌物质对真菌菌丝形态有明显破坏作用,如P.chlororaphis CY02 处理水稻稻瘟病菌后,导致分生孢子干瘪畸形,菌丝肿胀,隔膜不清晰[29]。Broadbent 等[30]发现假单胞杆菌(Pseudomonas spp.)主要作用机制是菌株产生的抗菌素有溶解烟草黑胫病菌菌丝的功能。假紫色色杆菌的菌株发酵液处理纹枯菌菌丝后,菌丝变形扭曲,萎缩并局部肿胀[31]。绿针假单胞菌菌株SPS-41 产生的挥发性气体3-甲基-1-丁醇、2-甲基-1-丁醇和苯乙醇对甘薯黑斑病病菌有显著的拮抗作用[32]。笔者在本研究中从核桃园土壤中分离到一株绿针假单胞菌WS-04,该菌株能够使C.chrysosperma 菌丝严重畸变甚至消融,表现出了很好的抑菌效果,核桃离体枝条腐烂病的防治效果也非常好,而且还具有一定的热稳定性,该菌株展现出了良好的生物防治前景。绿针假单胞菌WS-04 发酵滤液经5 个温度梯度处理30 min 后,随着温度升高,对C.chrysosperma的抑制率有所下降,但是抑制率均在80%以上,表现出良好的热稳定性。史娜艳从核桃树分离筛选的枯草芽孢杆菌不仅能有效防治真菌病害且还具有热稳定性。说明枯草芽孢杆菌和绿针假单胞菌具有相似的生理特性[21],但是笔者在本研究中发现假单胞菌会提前产生大量色素限制病原菌菌丝的生长[21]。李宝燕等[33]筛选获得一株对果树病害具有较好防治作用的绿针假单胞菌YTBTa14,菌株发酵滤液经温度梯度处理表现出较好的热稳定性,这与本研究结论一致。但是绿针假单胞菌与核桃腐烂病菌的作用方式与抑菌机制还不清楚,同时实验室条件下的抑菌试验和接种试验,与大田环境完全不同,绿针假单胞菌能否在大田中发挥其稳定的作用,也需要进一步研究。
一些拮抗菌株在对病原物产生破坏作用的同时,还能产生对植物起到很好促生作用的次生代谢产物。如番茄根际P.piscium 不仅具有抑制尖孢镰刀菌的能力,而且还有较强的溶磷作用,因此能有效促进盆栽番茄苗的生长[34]。绿针假单胞菌能够产生吩嗪化合物、铁载体、挥发性物质等,对番茄、玉米、小麦等多种农作物具有促生的功能[35-37]。本研究中分离到的绿针假单胞菌,其发酵液能够有效促进核桃种子萌芽,同时还能大大降低坏种率,为核桃育好苗、培壮苗提供了优异的生物制剂材料,而且菌株发酵滤液能促进核桃幼苗苗高、主根长、须根数、叶片面积和干质量显著增加,依次增加了25.40%、83.33%、48.02%、24.76%和98.40%。王娟等[38]从小麦根际筛选的绿针假单胞菌P.chlororaphis HG28-5在盆栽防病试验中对辣椒疫病具有明显的防治效果。秦娟娟等[39]研究发现荧光假单孢杆菌XG32,以卡拉胶和草炭为菌剂,处理组的辣椒苗在株高、根长、鲜质量和干质量等方面都有显著提高。Wu等[40]从铁皮石斛中提取的内生细菌铜绿假单胞菌P.saponiphila,具有促进辣椒幼苗生长的功能,以上研究结论与本研究结果一致。但是绿针假单胞菌促进核桃种子萌发的原因是什么?其作用机制如何还有待进一步深入研究。
4 结 论
从新疆阿克苏地区30 年树龄核桃园土壤中分离并筛选出一株具有广谱抗菌、热稳定性的生防细菌绿针假单胞菌。通过促生特性试验,表明绿针假单胞菌(P. chlororaphis)发酵滤液不仅有效促进核桃种子萌芽和发芽,同时还能促进核桃幼苗的苗高、主根长、须根数、叶片面积和干质量显著增加。
[1] 郗荣庭,张毅萍.中国果树志-核桃卷[M].北京:中国林业出版社,1996:59-63.QIE Rongting,ZHANG Yiping. Chinese fruit trees-walnut roll[M].Beijing:China Forestry Publishing House,1996:59-63.
[2] 新疆维吾尔自治区统计局.新疆统计年鉴[M].北京:中国统计出版社,2022:169-202.Bureau of Statistics of Xinjiang Uygur Autonomous Region.Xinjiang statistical yearbook[M].Beijing:China Statistics Press,2022:169-202.
[3] 马荣,王阳阳,刘晓琳,胡建新,吐尔孙江·买买提艾力.新疆核桃树腐烂病拮抗细菌的筛选及初步鉴定[J].新疆农业科学,2015,52(5):895-901.MA Rong,WANG Yangyang,LIU Xiaolin,HU Jianxin,Tuersunjiang·Maimaitiaili.Isolation and identification of the antagonistic bacteria against walnut canker in Xinjiang[J]. Xinjiang Agricultural Sciences,2015,52(5):895-901.
[4] 马瑜,柯杨,王琴,李勃,李毅.核桃溃疡病症状及其病原菌鉴定[J].果树学报,2014,31(3):443-447.MA Yu,KE Yang,WANG Qin,LI Bo,LI Yi.A stem canker disease of walnut (Juglans regia) caused by Botryosphaeria dothidea[J].Journal of Fruit Science,2014,31(3):443-447.
[5] 张海军,陈春艳,谢映平,田忠科.核桃腐烂病病原菌的分离与鉴定[J].中国植保导刊,2018,38(9):17-20.ZHANG Haijun,CHEN Chunyan,XIE Yingping,TIAN Zhongke. Isolation and identification of pathogen of walnut rot disease[J].China Plant Protection,2018,38(9):17-20.
[6] 郭靖,张王斌,张琦,唐俊煜,李亚鹏,郭众仲.五种杀菌剂对库尔勒香梨腐烂病的防效[J].北方园艺,2014(11):103-105.GUO Jing,ZHANG Wangbin,ZHANG Qi,TANG Junyu,LI Yapeng,GUO Zhongzhong. Control effect of five fungicides rot disease prevention on Korla pear[J].Northern Horticulture,2014(11):103-105.
[7] 杨晓蕾,钱国良,范加勤,胡白石,刘凤权.梨黑斑病菌拮抗细菌的筛选鉴定及其拮抗活性的研究[J].南京农业大学学报,2014,37(1):68-74.YANG Xiaolei,QIAN Guoliang,FAN Jiaqin,HU Baishi,LIU Fengquan. Selection and identification of antagonist Alternaria alternate and initial analysis of its antipathogenic activity[J].Journal of Nanjing Agricultural University,2014,37(1):68-74.
[8] 严婉荣,赵廷昌,肖彤斌,肖敏,赵志祥,陈绵才.生防细菌在植物病害防治中的应用[J]. 基因组学与应用生物学,2013,32(4):533-539.YAN Wanrong,ZHAO Tingchang,XIAO Tongbin,XIAO Min,ZHAO Zhixiang,CHEN Miancai. Applications of biocontrol bacteria in plant disease control[J].Genomics and Applied Biology,2013,32(4):533-539.
[9] 张力群,张俊威.假单胞菌产生的抗生素[J].中国生物防治学报,2015,31(5):750-756.ZHANG Liqun,ZHANG Junwei.Antibiotics produced by Pseudomonas spp.[J]. Chinese Journal of Biological Control,2015,31(5):750-756.
[10] YU Y Y,JIANG C H,WANG C,CHEN L J,LI H Y,XU Q,GUO J H.An improved strategy for stable biocontrol agents selecting to control rice sheath blight caused by Rhizoctonia solani[J].Microbiological Research,2017,203:1-9.
[11] 李永斌,李云龙,关国华,陈三凤.植物根际促生菌的筛选、鉴定及其对小麦的减肥增产效果[J].农业生物技术学报,2020,28(8):1471-1476.LI Yongbin,LI Yunlong,GUAN Guohua,CHEN Sanfeng.Screening,identification of plant growth promoting rhizobacteria and its effect on reducing fertilization while increasing efficiency in wheat (Triticum aestivum)[J]. Journal of Agricultural Biotechnology,2020,28(8):1471-1476.
[12] 刘程程,王媛花,张雯婷,储西平,明亮. 草莓炭疽病拮抗菌SKL108 的分离、鉴定及拮抗活性[J].江苏农业科学,2020,48(10):125-130.LIU Chengcheng,WANG Yuanhua,ZHANG Wenting,CHU Xiping,MING Liang. Screening,identification and evaluation of antagonistic bacteria SKL108 against strawberry anthracnose[J].Jiangsu Agricultural Sciences,2020,48(10):125-130.
[13] 李静,冯淑杰,肖晶,陈维信,刘爱媛. 小白菜内生假单胞菌XBC-PS 的生防作用[J].中国蔬菜,2007(5):21-23.LI Jing,FENG Shujie,XIAO Jing,CHEN Weixin,LIU Aiyuan.The biological control effect of endophytic Pseudomonas XBCPS from pakchoi[J].China Vegetables,2007(5):21-23.
[14] 胡菁.恶臭假单胞菌A1 在番茄青枯病生物防治中的应用[D].福州:福建农林大学,2017.HU Jing. Application of Pseudomonas putida A1 in biological control of bacterial wilt disease[D]. Fuzhou:Fujian Agriculture and Forestry University,2017.
[15] 张伟琼,聂明,肖明.荧光假单胞菌生防机理的研究进展[J].生物学杂志,2007,24(3):9-11.ZHANG Weiqiong,NIE Ming,XIAO Ming. Advances in biocontrol mechanism of Pseudomonas fluorescens[J]. Journal of Biology,2007,24(3):9-11.
[16] ILHAN K,KARABULUT O A. Efficacy and population monitoring of bacterial antagonists for gray mold (Botrytis cinerea Pers. ex. Fr.) infecting strawberries[J]. BioControl,2013,58(4):457-470.
[17] 魏海雷,张力群.荧光假单胞杆菌2P24 中生防相关调控基因gacS 的克隆和功能分析[J].微生物学报,2005,45(3):368-372.WEI Hailei,ZHANG Liqun. Cloning and functional characterization of the gacS gene of the biocontrol strain Pseuodomonas fluorescens 2P24[J]. Acta Microbiologica Sinica,2005,45(3):368-372.
[18] 冉隆贤,向妙莲,周斌,AHMBAKKER P.荧光假单胞杆菌的嗜铁素是控制桉树灰霉病的主要因子[J].植物病理学报,2005,35(1):6-12.RAN Longxian,XIANG Miaolian,ZHOU Bin,AHMBAKKER P. Siderophores are the main determinants of fluorescent Pseudomonas strains in suppression of grey mould in Eucalyptus urophylla[J].Acta Phytopathologica Sinica,2005,35(1):6-12.
[19] 刘艳萍,滕松山,赵蕾.高产嗜铁素恶臭假单胞菌A3 菌株的鉴定及其对黄瓜的促生作用[J].植物营养与肥料学报,2011,17(6):1507-1514.LIU Yanping,TENG Songshan,ZHAO Lei. Identification of a siderophore-producing bacterium Pseudomonas putida A3 and its growth-promoting effects on cucumber seedlings[J]. Plant Nutrition and Fertilizer Science,2011,17(6):1507-1514.
[20] 杨艺炜.绿针假单胞菌XF10 对烟草黑胫病菌的拮抗作用研究[D].北京:中国农业科学院,2018.YANG Yiwei. Antagonic effect of Pseudomonas chlororaphis XF10 on Phytophthora parasitica var. nicotianae[D]. Beijing:Chinese Academy of Agricultural Sciences,2018.
[21] 史娜艳.阿克苏地区核桃树腐烂病优势致病菌群分析及其生防菌筛选[D].阿拉尔:塔里木大学,2023.SHI Nayan.Analysis of dominant pathogen community causing walnut canker disease and screening of biocontrol bacteria in Aksu[D].Alar:Tarim University,2023.
[22] 展丽然,张克诚,冉隆贤,石义萍.苹果腐烂病菌拮抗放线菌的分离与鉴定[J].河北林果研究,2008,23(2):182-186.ZHAN Liran,ZHANG Kecheng,RAN Longxian,SHI Yiping.Isolation and identification of the antagonistic actinomycetes against Valsa mali[J].Hebei Journal of Forestry and Orchard Research,2008,23(2):182-186.
[23] 程亮,游春平,肖爱萍.拮抗细菌的研究进展[J].江西农业大学学报,2003,25(5):732-737.CHENG Liang,YOU Chunping,XIAO Aiping. Advance in the study on antagonistic bacteria[J]. Acta Agriculturae Universitis Jiangxiensis,2003,25(5):732-737.
[24] 李燕,欧婷,焦文莲,张克瑶,刘晓姣,谢洁.桑树内生枯草芽孢杆菌的分离鉴定及其对桑椹菌核病的生防机理[J].微生物学报,2024,64(9):3253-3268.LI Yan,OU Ting,JIAO Wenlian,ZHANG Keyao,LIU Xiaojiao,XIE Jie. Isolation and identification of an endophytic Bacillus subtilis from mulberry and preliminary exploration of its biocontrol mechanisms against mulberry fruit sclerotiniose[J].Acta Microbiologica Sinica,2024,64(9):3253-3268.
[25] 布坎南,吉本斯.伯杰细菌鉴定手册[M].中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,译.8 版.北京:科学出版社,1984.Buchanan R E,GIBBONS N E..Bergey’s manual of determinative bacteriology[M]. Institute of Microbiology, Chinese Academy of Sciences Bergey’s manual of determinative bacteriology.8th ed.Beijing:Science Press,1984.
[26] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:349-398.DONG Xiuzhu,CAI Miaoying. Common bacterial identifcation system manual[M].Beijing:Science Press,2001:349-398.
[27] SELIGER H,GELFAND D H,SINSKY J J,WHITE T J. PCR Protocols:A guide to methods and applications[M]. San Diego,CA:Academic Press,1990:335-335.
[28] 卯婷婷,陶刚,赵兴丽,王琦,李世东.4 种微生物菌剂对辣椒主要病害的生物防治作用[J]. 中国生物防治学报,2020,36(2):258-264.MAO Tingting,TAO Gang,ZHAO Xingli,WANG Qi,LI Shidong. Biological control of four kinds of microbial preparations against main diseases of pepper[J]. Chinese Journal of Biological Control,2020,36(2):258-264.
[29] 张望月,高健,张超,张友明,胡胜标,李岚岚,孙运军,丁学知,夏立秋.五种假单胞菌的分离鉴定及其生物活性[J].微生物学报,2013,53(9):957-965.ZHANG Wangyue,GAO Jian,ZHANG Chao,ZHANG Youming,HU Shengbiao,LI Lanlan,SUN Yunjun,DING Xuezhi,XIA Liqiu. Isolation,identification and characterization of five Pseudomonas strains[J]. Acta Microbiologica Sinica,2013,53(9):957-965.
[30] BROADBENT P,BAKER K F,WATERWORTH Y. Bacteria and actinomycetes antagonistic to fungal root pathogens in Australian soils[J].Australian Journal of Biological Sciences,1971,24(5):925-944.
[31] 谢宗华,高健,王金宇,彭喜旭,唐新科,王海华.一株水稻纹枯菌拮抗细菌的分离与鉴定[J].微生物学通报,2012,39(4):477-485.XIE Zonghua,GAO Jian,WANG Jinyu,PENG Xixu,TANG Xinke,WANG Haihua.Isolation and identification of an antagonistic bacterium against Rhizoctonia solani,the causing agent of rice sheath blight[J].Microbiology China,2012,39(4):477-485.
[32] ZHANG Y,LI T J,LIU Y F,LI X Y,ZHANG C M,FENG Z Z,PENG X,LI Z Y,QIN S,XING K.Volatile organic compounds produced by Pseudomonas chlororaphis subsp. aureofaciens SPS-41 as biological fumigants to control Ceratocystis fimbriata in postharvest sweet potatoes[J]. Journal of Agricultural and Food Chemistry,2019,67(13):3702-3710.
[33] 李宝燕,王英姿,王培松.一种具有广谱抗菌活性的绿针假单胞菌及其应用:CN107099474B[P].2019-12-31.LI Baoyan,WANG Yingzi,WANG Peisong. A Pseudomonas viridans with broad-spectrum antimicrobial activity and its application:CN107099474B[P].2019-12-31.
[34] 李凤.番茄根际微生物组分析及防病促生菌的筛选[D].济南:齐鲁工业大学,2022.LI Feng.Analysis of tomato rhizosphere microbiome and screening of functional bacteria for disease control and growth promotion[D].Jinan:Qilu University of Technology,2022.
[35] 王婧,方蕊,蒋秋悦,肖明. 载体和保护剂对橘黄假单胞菌JD37 微生物肥料活性的影响[J].上海师范大学学报(自然科学版),2012,41(2):179-185.WANG Jing,FANG Rui,JIANG Qiuyue,XIAO Ming. Effects of carrier and protective agent on the biological activities of Pseudomonas aurantiaca JD37 strain microbial fertilizer[J].Journal of Shanghai Normal University (Natural Sciences),2012,41(2):179-185.
[36] GAO X Y,LIU Y,MIAO L L,LI E W,SUN G X,LIU Y,LIU Z P. Characterization and mechanism of anti-Aeromonas salmonicida activity of a marine probiotic strain,Bacillus velezensis V4[J]. Applied Microbiology and Biotechnology,2017,101(9):3759-3768.
[37] ZHANG Y,LI T J,XU M J,GUO J H,ZHANG C M,FENG Z Z,PENG X,LI Z Y,XING K,QIN S.Antifungal effect of volatile organic compounds produced by Pseudomonas chlororaphis subsp.aureofaciens SPS-41 on oxidative stress and mitochondrial dysfunction of Ceratocystis fimbriata[J].Pesticide Biochemistry and Physiology,2021,173:104777.
[38] 王娟,刘东平,丁方丽,李嫚,张忠良,史洪中,申顺善.绿针假单胞菌HG28-5 对辣椒生长及根际土壤微生态的影响[C]//河南省植物保护学会第十一次会员代表大会暨学术讨论会、河南省昆虫学会第十次会员代表大会暨学术讨论会、河南省植物病理学会第五次会员代表大会暨学术讨论会论文集. 许昌,2017:21.WANG Juan,LIU Dongping,DING Fangli,LI Man,ZHANG Zhongliang,SHI Hongzhong,SHEN Shunshan. Effect of Pseudomonas verinens HG 28-5 on pepper growth and soil microgrowth in the rhizosphere[C]//The 11th Member Congress and Academic Symposium of Henan Society of Plant Protection,The 10th Member Congress and Academic Symposium of Henan Society of Entomological,Proceedings of the fifth Member Congress and Academic Symposium of Henan Society of Plant Pathology.Xuchang,2017:21.
[39] 秦娟娟,闫淑珍,刘佳.植物内生细菌固体菌剂对辣椒的促生和防病作用[J].植物保护学报,2010,37(4):325-330.QIN Juanjuan,YAN Shuzhen,LIU Jia. The growth-promotion on pepper and control of Phytophthora capsici by endophytic bacterium agents[J]. Journal of Plant Protection,2010,37(4):325-330.
[40] WU L Q,SHANG H Z,WANG Q,GU H K,LIU G J,YANG S L. Isolation and characterization of antagonistic endophytes from Dendrobium candidum Wall ex Lindl. ,and the biofertilizing potential of a novel Pseudomonas saponiphila strain[J].Applied Soil Ecology,2016,105:101-108.