猕猴桃隶属猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia Lindl.),为多年生功能性雌雄异株木质藤本植物[1]。猕猴桃果实营养价值高,风味独特,富含糖、酸、酚类、氨基酸和维生素,尤其以富含维生素C而闻名。猕猴桃根、茎、叶、花中富含猕猴桃碱等多种生物活性成分,是一种药食同源的食物,具有很高的综合开发利用价值[1]。猕猴桃果实为浆果,果皮可分为外果皮、中果皮和内果皮三部分。其中,外果皮即通常所说的果皮,将果肉和外界环境分隔开,起到保护果实、保持水分、防止病菌侵害等作用[2]。猕猴桃外果皮通常较薄,这使其在生长过程中易遭受风吹擦伤、日晒灼伤及刺吸式害虫叮伤,导致果实表面疤痕累累,不利于果实采后贮藏和运输,增加了果实损耗,降低了果实的商品价值。
植物生长调节剂在果实生产中被广泛使用,从而达到增厚果皮、改善果实品质及防止果实开裂等目的。资阳香橙砧清见杂柑果皮厚度的差异是IAA、GA3、ZT及其代谢相关酶活性和基因表达共同作用的结果。在一定范围内,IAA、GA3和ZT含量越高,合成相关酶活性和基因表达量越高,果皮生长发育程度越高,果皮越厚[3]。在荔枝果实发育早期进行细胞分裂素处理,可降低果实采后失水和果皮褐变,延长荔枝果实的贮藏期[4]。外源ABA 和CaCl2处理樱桃果实,可显著降低樱桃果实开裂,显著提高果实表面的蜡质含量、角质层和表皮厚度[5]。外源GA3处理可以有效地降低柑橘裂果的发生率,而不会显著影响果实品质[6]。IAA 有很强的吸引与调运养分的效应,叶面喷施IAA 能显著增加秋葵植株的高度、枝条数、叶片数、花朵数、果实质量和果实中可溶性固形物含量[7],IAA 处理也可使辣椒幼果迅速膨大并增加产量[8]。
金奉(曾用名奉黄1 号)猕猴桃是从中华猕猴桃金丰实生后代中选育而来的黄肉猕猴桃新品种,具有生长势强、单果质量大、果形均匀一致、果肉金黄、肉质细腻、含糖量高、干物质含量高等综合优势[9]。该品种在江西省宜春市奉新县地区为中晚熟黄肉猕猴桃,在当地栽培表现出适应性和抗逆性强、优质、丰产等特点。然而,生产中发现该品种果皮极薄,极易发生碰伤、擦伤、刮伤等,非常不利于贮藏和长距离运输,对生产和销售造成了极大的影响,在一定程度上影响了该品种的推广[9]。为了改善金奉猕猴桃果皮薄的状况,笔者在本研究中选用多种植物生长调节剂和矿质元素,进行了不同种类、不同质量浓度和不同组合的处理,通过检测处理后的金奉猕猴桃果实品质、果实解剖结构和果皮细胞壁代谢相关酶活性的变化情况,筛选出有利于金奉猕猴桃果皮增厚和提高果实品质的有效措施,为其推广应用提供技术支撑。
1 材料和方法
1.1 试验材料
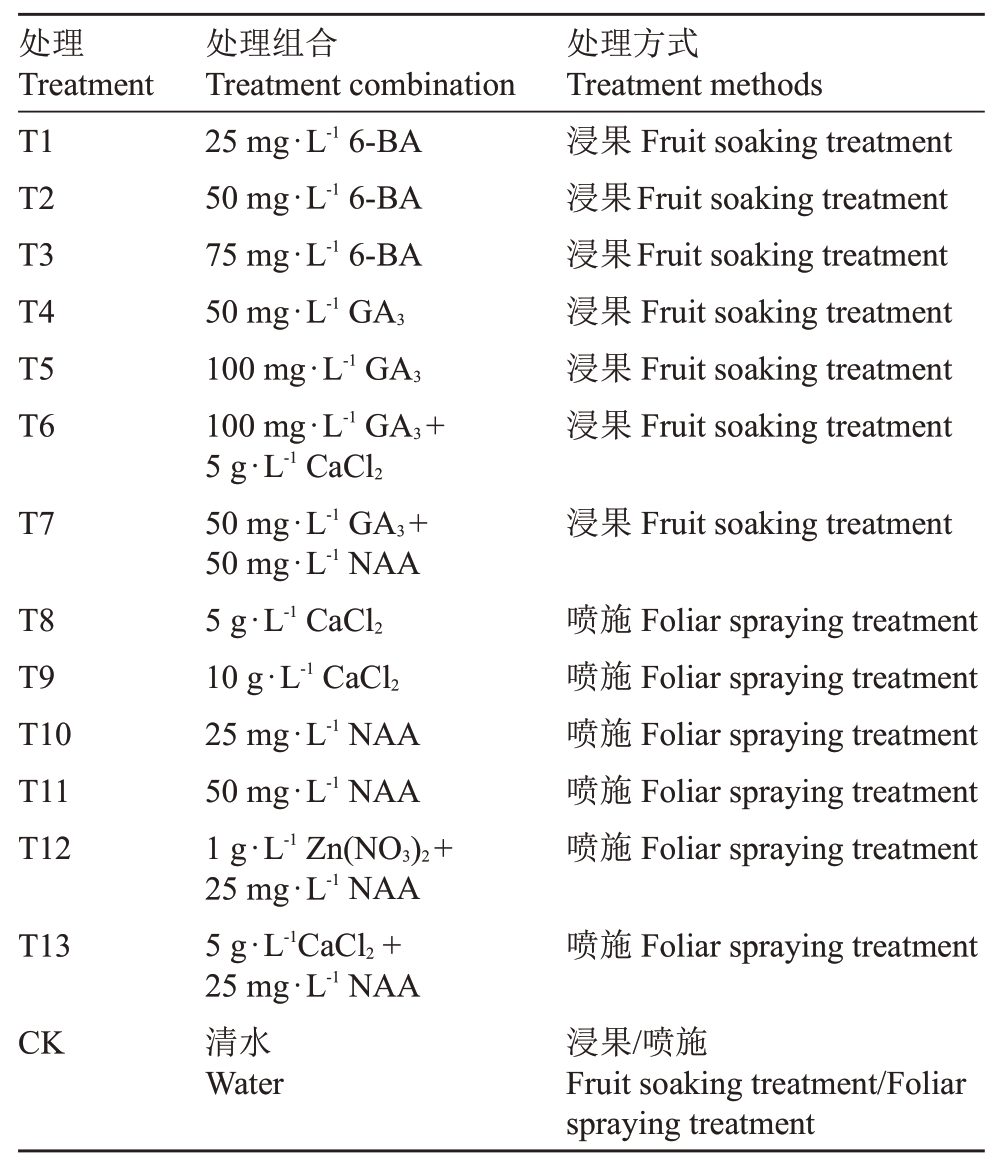
以中华猕猴桃品种金奉为试材。该品种种植在江西省奉新县新西蓝现代农业示范园,嫁接于美味猕猴桃金魁砧木上,树龄6 a(年)。栽培架式为大棚架,常规管理。选用6-苄氨基嘌呤(6-BA)、赤霉素(GA3)和萘乙酸(NAA)三种植物生长调节剂,质量浓度设置如下:6-BA 质量浓度分别为25、50 和75 mg·L-1;GA3 质量浓度分别为50 和100 mg·L-1;NAA质量浓度分别为25和50 mg·L-1。植物生长调节剂处理的同时亦进行了CaCl2和Zn(NO3)2不同质量浓度、不同组合的处理。处理分为浸果和叶面喷施两种,具体处理组合和处理方式详见表1。对于浸果处理,于盛花后15 d将果实完全浸没在处理液中至少3 s,以确保整个果面湿透。每个处理选择生长势基本一致的3株树,每株树随机选择50个主花果进行浸果处理。对于叶面喷施处理,则于盛花后15、25、35 d分别使用农用喷雾器对试验树进行叶面喷施,需喷至叶片正反两面滴水。每个处理均选择生长势基本一致的3株树。以清水浸果或喷施处理作为对照(CK)。果实达到商业采摘期[可溶性固形物含量(w,后同)≥8%]后采摘,每个处理和对照各采摘至少30个大小一致、无病虫害的果实。采后立即运回实验室,并进行果实外观品质指标的检测。果实室温放置达到可食状态(可溶性固形物含量≥17.5%)后进行果实内在品质指标的测定。
表1 不同处理组合和处理方式
Table 1 Different treatment combinations and treatment methods
?
1.2 果实外观品质测定
每个处理每次重复随机选择10个果实,使用千分之一电子天平测定单果质量。使用数显游标卡尺测量果实的横径、纵径,并计算出果形指数。
1.3 果实内在品质测定
采用手持式数显糖度计(ATAGO,PAL-1)测定可溶性固形物含量。采用蒽酮比色法测定可溶性糖含量,采用NaOH 中和滴定法测定果实可滴定酸总含量[10];采用钼蓝比色法测定抗坏血酸含量[11]。采用烘干法测定果实干物质含量,即在猕猴桃果实赤道部位切取约2 mm 厚的带皮薄片,放置于60 ℃的恒温干燥箱内烘干至恒质量,干质量与鲜质量的比值即为干物质含量。
1.4 果皮石蜡切片制作
取果实赤道部位的果皮,切成0.3~0.5 cm 长宽的长方形,用FAA(乙醇醋酸福尔马林混合固定液,按90 mL 70%乙醇+5 mL 冰醋酸+5 mL 甲醛的比例配制)进行固定,采用番红-固绿染色法进行染色观察,然后用正置白光拍照显微镜(Nikon,Eclipse Ci-L)进行观察拍照。采用Image-Pro Plus6.0 软件进行图片测量分析,在垂直果实表面的轴线上测量表皮厚度,并测量表皮细胞的长径和短径。
1.5 果皮细胞壁代谢相关酶活性测定
苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)活性参考高俊凤[11]的方法测定;过氧化物酶(peroxidase,POD)活性采用愈创木酚法[12]测定;多酚氧化酶(polyphenol oxidase,PPO)活性采用邻苯二酚法[13]测定;纤维素酶(cellulase)和果胶酶(pectinase)活性测定分别采用酶联免疫分析(ELISA)试剂盒A138 和A140-1-1(南京建成生物工程研究所)进行,具体测定步骤参照试剂盒使用说明书。
1.6 数据分析
使用Microsoft Excel 2020进行数据整理。使用SPSS 22.0软件进行单因素方差分析(one-way ANOVA),采用Duncan’s 多重极差检验进行样本间差异显著性分析(p<0.05)。利用Origin 2018 进行绘图。
2 结果与分析
2.1 不同处理对金奉猕猴桃果实外在品质的影响
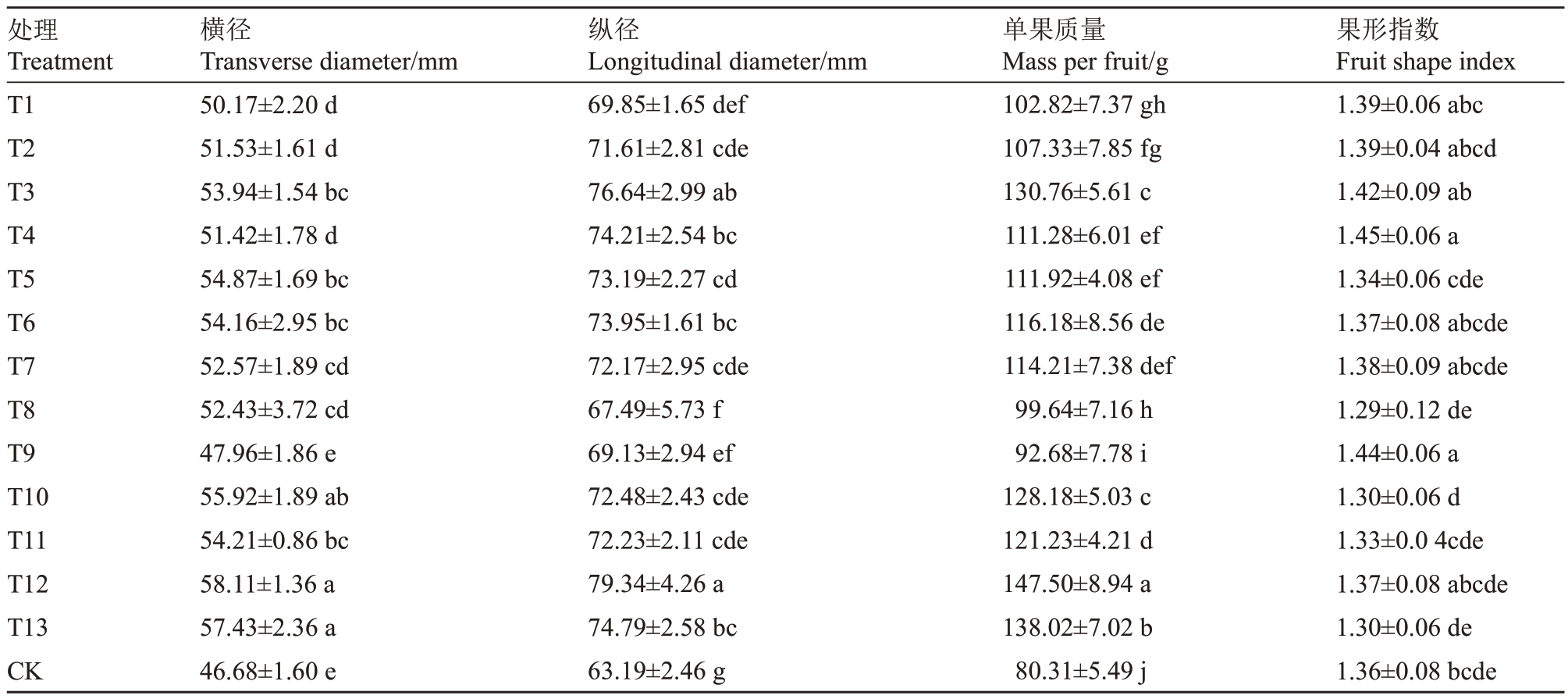
利用不同种类、不同质量浓度的植物生长调节剂和矿质元素的处理组合对金奉猕猴桃果实进行处理,外在品质指标变化结果如表2所示。除T9处理外,其他处理果实的横径均显著大于对照,其中T12处理的横径数值最大,达到58.11 mm,与CK相比增加了24.48%。所有处理均促进了果实纵径和单果质量的增加,其中T12 的单果质量达到最大值,为147.50 g,与CK 相比升高了83.68%;T4、T9 处理的果形指数与CK差异显著,其余处理与CK之间无显著差异。
表2 不同处理对金奉猕猴桃果实外在品质的影响
Table 2 Effects of different treatments on the external quality of Jinfeng kiwifruit
注:同列不同小写字母表示差异显著(p<0.05)。下同。
Note:Different small letters in the same column indicate significant differences at the 0.05 level.The same below.
处理Treatment T1 T2 T3 T4 T5 T6 T7 T8 T9 T10 T11 T12 T13 CK果形指数Fruit shape index 1.39±0.06 abc 1.39±0.04 abcd 1.42±0.09 ab 1.45±0.06 a 1.34±0.06 cde 1.37±0.08 abcde 1.38±0.09 abcde 1.29±0.12 de 1.44±0.06 a 1.30±0.06 d 1.33±0.0 4cde 1.37±0.08 abcde 1.30±0.06 de 1.36±0.08 bcde横径Transverse diameter/mm 50.17±2.20 d 51.53±1.61 d 53.94±1.54 bc 51.42±1.78 d 54.87±1.69 bc 54.16±2.95 bc 52.57±1.89 cd 52.43±3.72 cd 47.96±1.86 e 55.92±1.89 ab 54.21±0.86 bc 58.11±1.36 a 57.43±2.36 a 46.68±1.60 e纵径Longitudinal diameter/mm 69.85±1.65 def 71.61±2.81 cde 76.64±2.99 ab 74.21±2.54 bc 73.19±2.27 cd 73.95±1.61 bc 72.17±2.95 cde 67.49±5.73 f 69.13±2.94 ef 72.48±2.43 cde 72.23±2.11 cde 79.34±4.26 a 74.79±2.58 bc 63.19±2.46 g单果质量Mass per fruit/g 102.82±7.37 gh 107.33±7.85 fg 130.76±5.61 c 111.28±6.01 ef 111.92±4.08 ef 116.18±8.56 de 114.21±7.38 def 99.64±7.16 h 92.68±7.78 i 128.18±5.03 c 121.23±4.21 d 147.50±8.94 a 138.02±7.02 b 80.31±5.49 j
2.2 不同处理对金奉猕猴桃果实内在品质的影响
不同植物生长调节剂和矿质元素处理后金奉猕猴桃果实内在品质的变化情况如表3所示。结果表明,所有样品的可溶性固形物含量在14.6%~18.1%之间,其中T3和T6的可溶性固形物含量与CK无显著差异,其余处理均显著低于CK。干物质含量方面,T3 干物质含量最高,其次为CK。T1、T6、T9 与CK 之间无显著差异,其余处理均显著低于CK。所有样品的可滴定酸含量在0.96%~1.19%之间,其中T12最高,且显著高于CK,其他处理的可滴定酸含量均显著低于CK,T4 和T6 的可滴定酸含量最低。糖酸比是影响口感的重要因素,T4 的糖酸比值最高,达到13.42。T5、T12与CK无显著差异,T8、T9和T11糖酸比显著低于CK。所有样品的抗坏血酸含量在97.84~119.82 mg·100 g-1之间,T3、T6 处理的抗坏血酸含量最高,分别为119.82、119.12 mg·100 g-1,T4、T5、T7、T8 处理抗坏血酸含量均显著高于CK,其余处理的抗坏血酸含量与CK无显著差异。
表3 不同处理对金奉猕猴桃果实内在品质的影响
Table 3 Effects of different treatments on the internal quality of Jinfeng kiwifruit
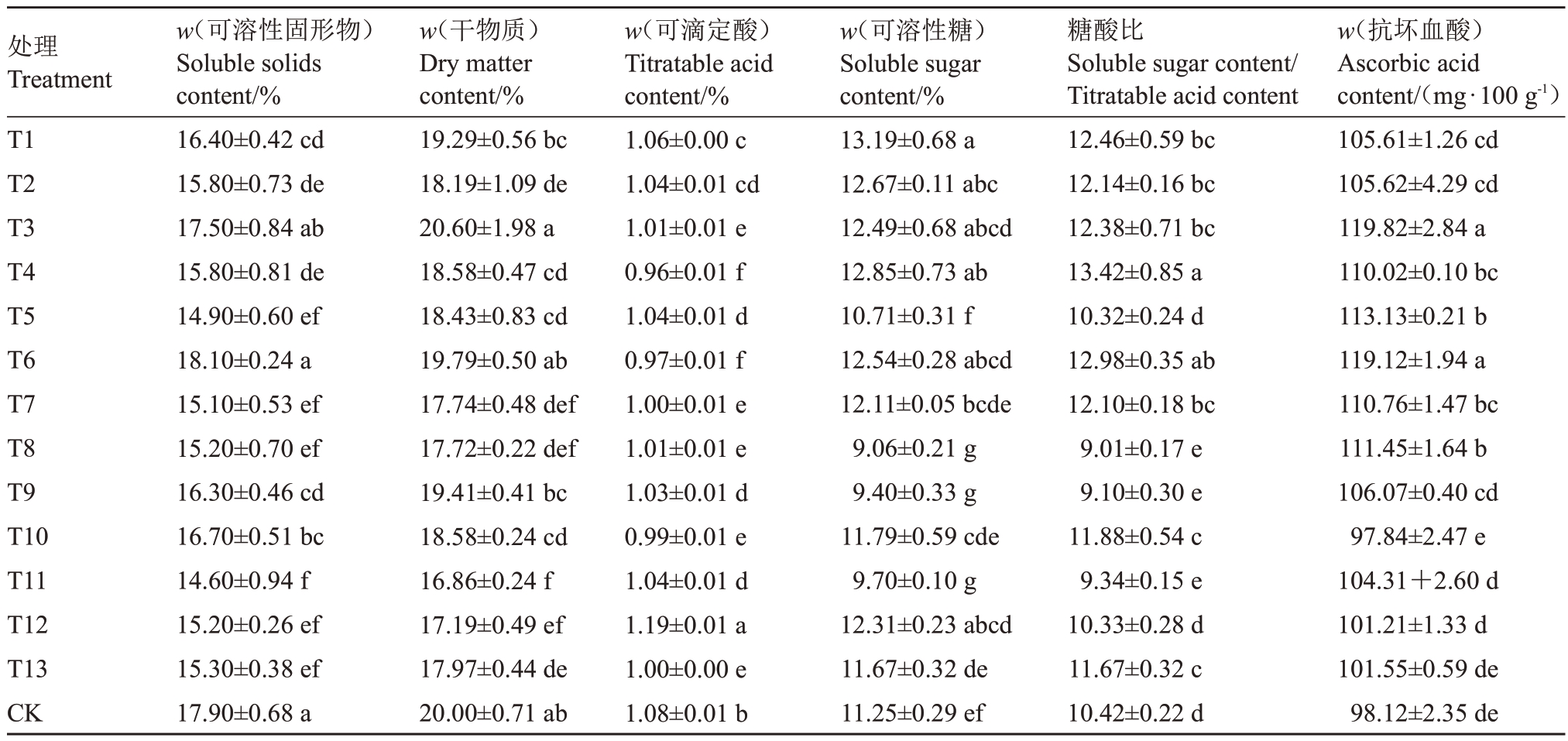
处理Treatment T1 T2 T3 T4 T5 T6 T7 T8 T9 T10 T11 T12 T13 CK w(可溶性固形物)Soluble solids content/%16.40±0.42 cd 15.80±0.73 de 17.50±0.84 ab 15.80±0.81 de 14.90±0.60 ef 18.10±0.24 a 15.10±0.53 ef 15.20±0.70 ef 16.30±0.46 cd 16.70±0.51 bc 14.60±0.94 f 15.20±0.26 ef 15.30±0.38 ef 17.90±0.68 a w(干物质)Dry matter content/%19.29±0.56 bc 18.19±1.09 de 20.60±1.98 a 18.58±0.47 cd 18.43±0.83 cd 19.79±0.50 ab 17.74±0.48 def 17.72±0.22 def 19.41±0.41 bc 18.58±0.24 cd 16.86±0.24 f 17.19±0.49 ef 17.97±0.44 de 20.00±0.71 ab w(可滴定酸)Titratable acid content/%1.06±0.00 c 1.04±0.01 cd 1.01±0.01 e 0.96±0.01 f 1.04±0.01 d 0.97±0.01 f 1.00±0.01 e 1.01±0.01 e 1.03±0.01 d 0.99±0.01 e 1.04±0.01 d 1.19±0.01 a 1.00±0.00 e 1.08±0.01 b w(可溶性糖)Soluble sugar content/%13.19±0.68 a 12.67±0.11 abc 12.49±0.68 abcd 12.85±0.73 ab 10.71±0.31 f 12.54±0.28 abcd 12.11±0.05 bcde 9.06±0.21 g 9.40±0.33 g 11.79±0.59 cde 9.70±0.10 g 12.31±0.23 abcd 11.67±0.32 de 11.25±0.29 ef糖酸比Soluble sugar content/Titratable acid content 12.46±0.59 bc 12.14±0.16 bc 12.38±0.71 bc 13.42±0.85 a 10.32±0.24 d 12.98±0.35 ab 12.10±0.18 bc 9.01±0.17 e 9.10±0.30 e 11.88±0.54 c 9.34±0.15 e 10.33±0.28 d 11.67±0.32 c 10.42±0.22 d w(抗坏血酸)Ascorbic acid content/(mg·100 g-1)105.61±1.26 cd 105.62±4.29 cd 119.82±2.84 a 110.02±0.10 bc 113.13±0.21 b 119.12±1.94 a 110.76±1.47 bc 111.45±1.64 b 106.07±0.40 cd 97.84±2.47 e 104.31+2.60 d 101.21±1.33 d 101.55±0.59 de 98.12±2.35 de
2.3 不同处理对金奉猕猴桃果皮解剖结构的影响
金奉猕猴桃果皮石蜡切片如图1所示。番红可使木质化细胞壁呈现红色,角质化细胞壁呈现透明粉红色,固绿使细胞质和含有纤维素的细胞壁呈蓝绿色。金奉猕猴桃果皮外部细胞层结构是由几层压缩放射状排列的死细胞组成。这些死细胞全部被番红染为红色,证明其主要成分为木质素。死细胞层下面是厚壁组织,由两到三层排列紧密的放射状压缩细胞构成。与厚壁组织相邻的是薄壁细胞,薄壁细胞富含淀粉,更为细长,呈放射状扁平,相比于厚壁组织排列较为疏松,近七八层薄壁细胞的大小和形状基本一致。此外,在这一区域还散布着体积较大的石细胞。
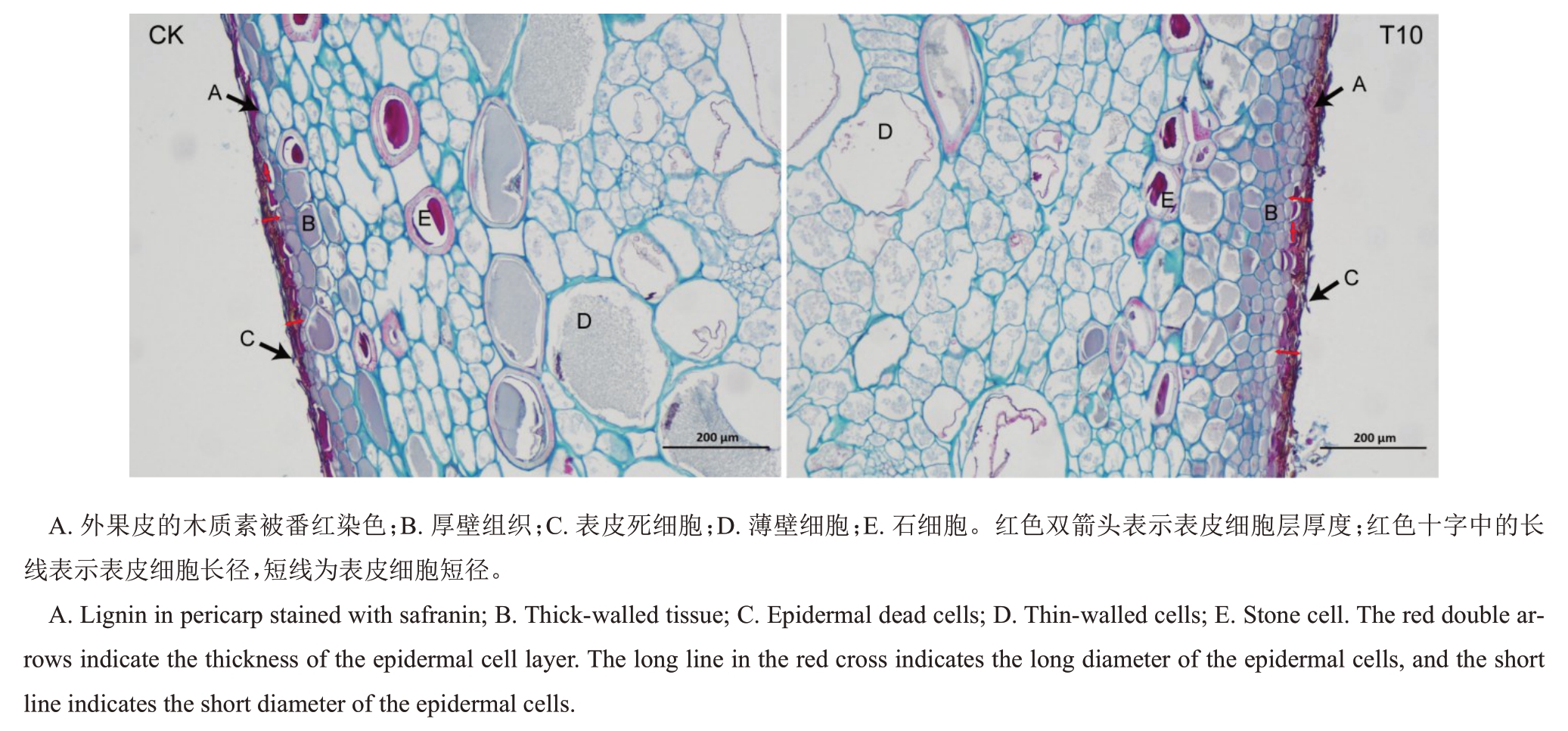
图1 金奉猕猴桃果皮石蜡切片
Fig.1 Paraffin section of the peel of Jinfeng kiwifruit
不同处理的金奉外果皮厚度具有较大差异(图2-A)。T1~T3为不同质量浓度的6-BA处理,其外果皮厚度随试剂质量浓度的增加而下降,T10、T11 为不同质量浓度的NAA 处理,存在同样的规律。T4~T9、T13 与CK 之间无显著差异,其余处理的外果皮厚度较CK均有显著增加(图2-A)。

图2 不同处理对金奉猕猴桃果皮解剖结构的影响
Fig.2 Effects of different treatments on the anatomical structure of the peel of Jinfeng kiwifruit
表皮细胞的长短径受不同处理影响较小(图2-B、C)。T13的表皮层细胞长径最长,其次为T11,均显著高于其他处理。T5的表皮细胞长径最短,显著小于CK。其余处理与CK 无显著差异。T6、T7、T11、T12处理的表皮层细胞短径均显著高于CK,其余处理与CK 无显著差异(图2-C)。不同处理对表皮细胞面积的影响也较小,除T11、T13处理外,其余处理与CK不存在显著差异(图2-D)。
2.4 不同处理对金奉猕猴桃果皮细胞壁代谢相关酶活性的影响
不同处理对金奉猕猴桃果皮细胞壁相关代谢酶活性的影响如图3所示。不同处理均不同程度地降低了PAL的活性(图3-A)。CK的PAL活性最高,其次为T9处理,T13的PAL活性最低,约为CK的46%(图3-A)。不同处理间POD 活性变化较大(图3-B)。T3、T10~T12 处理具有较高的POD 酶活性,约为CK的1.5倍,T8、T9的POD活性较低,约为CK的60%,并显著低于所有处理,T4~T7、T13 与CK 之间无显著差异(图3-B)。不同处理间PPO活性差异明显(图3-C)。T10的PPO活性最高,而T1、T3、T4、T6的PPO 活性最低,且显著低于其他所有处理。T9、T11 与CK 之间无显著差异。T6 的果胶酶活性与CK 无显著差异,T7~T9、T11、T13 的果胶酶活性显著低于CK,其余处理的果胶酶活性均显著高于CK(图3-D)。T4的纤维素酶活性显著高于CK和其他处理,T1、T3、T5、T6、T8、T10 等与CK 无显著差异,T2、T7、T12 显著低于CK,其中T7 的纤维素酶活性最低(图3-E)。
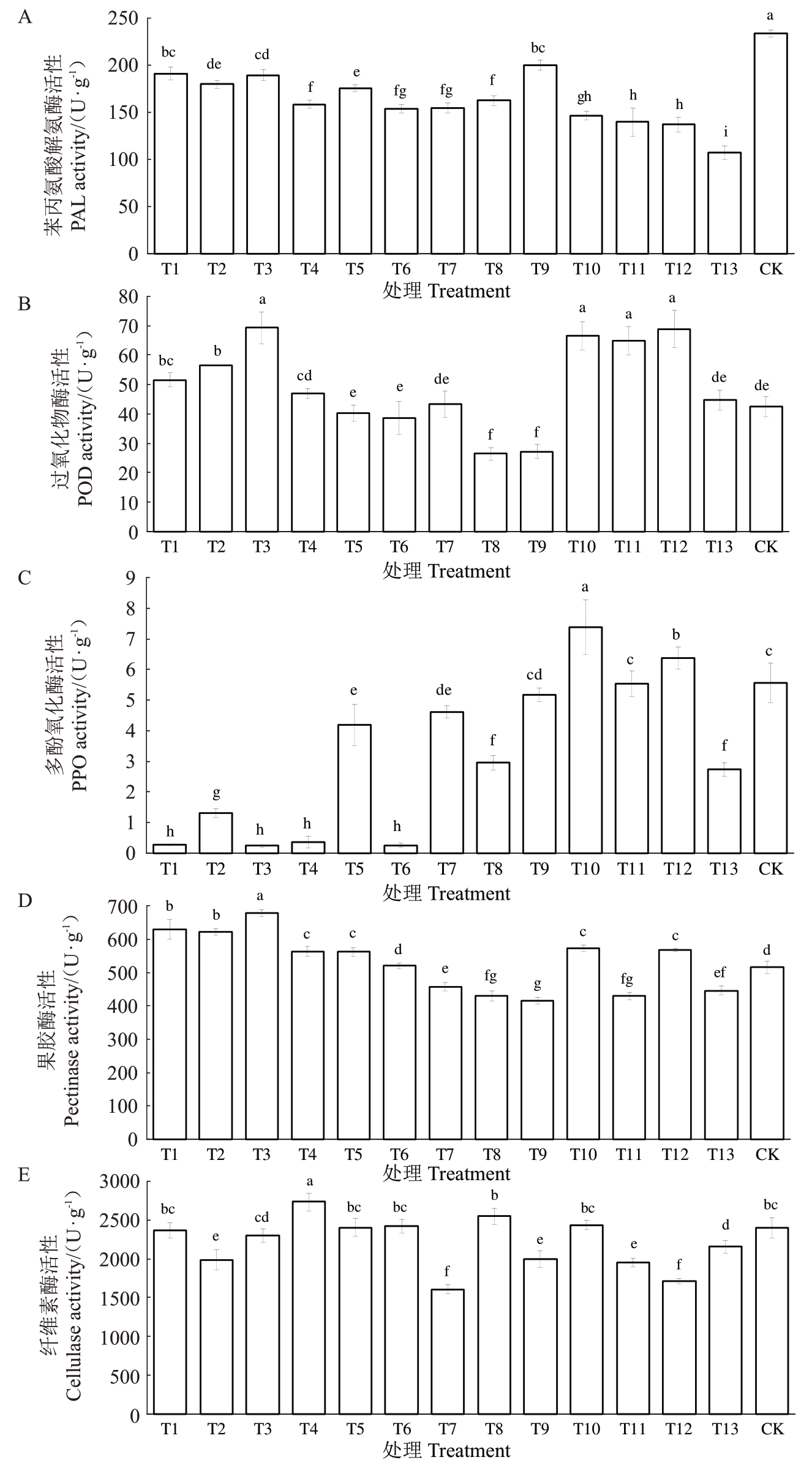
图3 不同处理对金奉猕猴桃果皮细胞壁相关代谢酶活性的影响
Fig.3 Effects of different treatments on cell wall-related metabolic enzyme activities of Jinfeng kiwifruit
3 讨 论
笔者在本研究中针对金奉猕猴桃果皮较薄的问题,主要应用植物生长调节剂和矿质元素进行不同质量浓度、不同方式的处理,通过测定果实品质、细胞壁代谢酶活性,果皮解剖结构观察进行比较分析,以期筛选出促进金奉猕猴桃果皮增厚和果实品质提升的最佳处理。
生长素能刺激细胞壁合成、细胞扩大和细胞分裂,对延缓叶片衰老和果实成熟有着重要的作用。喷施IAA 能显著提高花生叶片光合速率,促进茎、穗和花的生长,最终提高花生平均单荚质量和单株产量[14]。在番茄[15]、梨[16]、蓝莓[17]和草莓[18]等植物上的研究表明,适宜浓度的NAA对促进果实发育和膨大、防止落果、提高果实品质等具有显著的效果。笔者在本研究中使用不同质量浓度的NAA 喷施金奉猕猴桃,结果显示NAA处理后果实单果质量显著增加,表明NAA 有很强的吸引与调运养分的效应,能使果实幼期迅速膨大,增加产量。NAA处理的猕猴桃果实可滴定酸含量显著降低,而抗坏血酸含量与CK 无显著差异,表明NAA 在提升金奉猕猴桃产量的同时,其营养价值未受明显影响。PAL 是催化苯丙氨酸合成途径的第一步,被认为是控制植物木质素积累的关键起始酶[19]。POD由多基因编码且定位在细胞壁上,参与植物木质素的生物合成、细胞伸长、胁迫防御和种子萌发等多种生物过程[20-21]。使用不同质量浓度NAA处理后,猕猴桃果皮中PAL活性显著低于CK,而POD 活性却显著高于CK。在烟草[22]和山杨[23]中的研究表明,木质素含量随POD 活性降低而显著降低。拟南芥POD 编码基因功能缺失突变体中木质素含量也显著减少[24]。在本研究中,施用不同质量浓度NAA 处理后猕猴桃果皮中POD 活性均显著高于CK,而不同质量浓度的NAA处理均显著增加了猕猴桃表皮死细胞层的厚度,这表明POD 可能参与了猕猴桃表皮细胞木质素合成的调控,与猕猴桃表皮细胞木质素含量的积累相关。此外,在试验中笔者还发现NAA处理的果实在相同的室温条件下比其他处理的果实推迟10~15 d变软,这说明NAA 处理延缓了金奉果实的成熟,延长了其软熟时间。与CK 相比,NAA 处理的果实采后果腐病发生概率也较低,这表明NAA还提高了金奉猕猴桃果实的抗病性。
6-BA 为人工合成的细胞分裂素类物质,能通过促进细胞分裂维持新陈代谢与营养物质运输,改善果实品质,实现增产增收[25-26]。在本研究中,T1(25 mg·L-1 6-BA)、T2(50 mg·L-1 6-BA)、T3(75 mg·L-1 6-BA)处理均显著增加了猕猴桃果实的单果质量。此外,6-BA 处理的果实品质也得到一定的提升,如降低了果实可滴定酸含量,提高了果实可溶性糖含量,提高了糖酸比和抗坏血酸含量。6-BA处理显著提高了POD 酶活性,且该酶活性随6-BA 质量浓度的增加而升高。施用不同质量浓度的6-BA 均显著增加了外果皮厚度,表明6-BA处理可促进木质素含量的积累和果皮增厚。
GA3是一种高效的植物生长调节剂,具有促进细胞、茎伸长,打破种子休眠,促进果实生长发育的作用。外源赤霉素能够促进梨的花梗发育,特别是加速木质部和韧皮部组织的增大,进而增加梨果实的大小[27]。外源GA3处理可有效抑制枣果皮细胞壁水解酶活性,从而影响果皮原果胶、纤维素含量,最终增强了果皮的破裂应力,降低了裂果率[28]。外源施用适宜浓度的GA3处理可促进菠萝果实膨大、提高果实质量和改善果实品质[29]。在本研究中,不同质量浓度的GA3(T4 和T5)处理均显著增加了猕猴桃果实的单果质量,说明GA3可促进营养物质向果实的转运。较低质量浓度的GA3处理可显著降低果实可滴定酸含量,增加果实可溶性糖含量、糖酸比和抗坏血酸含量,明显地改善果实的内在品质指标,但是对外果皮厚度影响不大。
T6(100 mg·L-1GA3+5 g·L-1CaCl2)、T7(50 mg·L-1 GA3+50 mg·L-1NAA)、T12(1 g·L-1Zn(NO3)2+25 mg·L-1 NAA)、T13(5 g·L-1CaCl2+25 mg·L-1NAA)为植物生长调节剂的组合处理。这些处理组合均能显著增加果实单果质量,其中T6的可溶性固形物以及干物质含量与CK 无显著差异;T12 处理的糖酸比与CK 无显著差异,其余处理均显著增加了果实的糖酸比;抗坏血酸含量方面,T6、T7 较CK 有显著提升。IAA、GA3以及6-BA无论是单独处理还是混合处理,均能提高猕猴桃的产量,尤其是T6 处理,在增加产量的前提下,显著提高猕猴桃果实的各项内在品质指标。果皮解剖结构观测显示,除T12处理外,其余混合处理不能明显增加外果皮的厚度。4个组合处理明显降低了苯丙氨酸解氨酶活性;T12 的POD 酶活性显著高于CK,其余处理POD活性与CK无显著差异;T12 的PPO 酶活性显著高于CK,其余处理PPO活性显著低于CK;T6 的果胶酶与CK 无显著差异,T12的果胶酶活性显著高于CK,其余处理均显著降低果胶酶活性;T6 的纤维素酶活性与CK 无显著差异,其余处理的纤维素酶活性显著低于CK。
钙是细胞壁的重要组成成分,主要在细胞壁的胞间层沉积,在维持细胞壁的完整性中起着重要作用[30]。喷施不同浓度的CaCl2溶液均显著增加了果实的单果质量,而未影响果实品质。CaCl2处理的PAL、POD 和果胶酶活性均显著降低。钙处理使南果梨木质素及其前体羟基肉桂酸类物质的含量显著降低,木质素合成相关基因的表达水平也明显下调,抑制了木质素单体的合成[31]。在本研究中,CaCl2处理的外果皮厚度与CK 之间无显著差异,这可能是钙处理抑制了木质素的生成。
4 结 论
使用不同种类、不同质量浓度和不同组合的植物生长调节剂和矿质元素处理金奉猕猴桃,结果表明,不同处理均显著增加了果实的单果质量,对果实品质有不同程度的改善效果。其中,100 mg·L-1 GA3+5 g·L-1 CaCl2处理组合的果实品质最佳,但对果皮厚度改善的效果并不明显。不同质量浓度的6-BA和NAA处理均显著增加了外果皮厚度,其中,25 mg·L-1 NAA喷施处理、25 mg·L-1和50 mg·L-1 6-BA浸果处理对金奉猕猴桃外果皮增厚的效果最为显著。综合各处理对金奉猕猴桃果实品质与外果皮厚度的影响,以及操作技术的简单易行,确定25 mg·L-1 NAA叶面喷施为最佳的处理。
[1] 黄宏文.猕猴桃属分类资源驯化栽培[M].北京:科学出版社,2013.HUANG Hongwen. Actinidia taxonomy germplasm domestication cultivation[M].Beijing:Science Press,2013.
[2] TAO J J,JIA H M,WU M T,ZHONG W Q,HUANG Y Q,HUANG L H,XU Y,HUANG C H.Integrated metabolome and transcriptome analysis reveals the mechanism related to the formation of peelability in Actinidia eriantha[J]. Scientia Horticulturae,2024,330:113072.
[3] 荣毅.资阳香橙砧清见杂柑果皮内源激素代谢对其厚度的影响[D].雅安:四川农业大学,2018.RONG Yi. Effect of endogenous hormones metabolism on pericarp thickness of Kiyomi tangor in C.junos(Sieb.)Tanaka rootstock[D].Ya’an:Sichuan Agricultural University,2018.
[4] FAHIMA A,LEVINKRON S,MAYTAL Y,HUGGER A,LAX I,HUANG X M,EYAL Y,LICHTER A,GOREN M,STERN R A,HARPAZ-SAAD S. Cytokinin treatment modifies litchi fruit pericarp anatomy leading to reduced susceptibility to post-harvest pericarp browning[J].Plant Science,2019,283:41-50.
[5] CORREIA S,SANTOS M,GLIŃSKA S,GAPIŃSKA M,MATOS M,CARNIDE V,SCHOUTEN R,SILVA A P,GONÇALVES B. Effects of exogenous compound sprays on cherry cracking:Skin properties and gene expression[J]. Journal of the Science of Food and Agriculture,2020,100(7):2911-2921.
[6] 李永杰,金国强,淳长品,朱潇婷,邱晓莹.柑橘果皮的发育特征及GA3的防裂效果[J].果树学报,2021,38(7):1092-1101.LI Yongjie,JIN Guoqiang,CHUN Changpin,ZHU Xiaoting,QIU Xiaoying. Developmental characteristics of citrus peel and the effect of gibberellic acid on fruit cracking[J].Journal of Fruit Science,2021,38(7):1092-1101.
[7] KHANDAKER M M,AZAM H M,ROSNAH J,TAHIR D,NASHRIYAH M. The effects of application of exogenous IAA and GA3 on the physiological activities and quality of Abelmoschus esculentus (Okra) var. Singa 979[J]. Pertanika Journal of Tropical Agricultural Science,2018,41(1):209-224.
[8] HONDA I,MATSUNAGA H,KIKUCHI K,MATUO S,FUKUDA M,IMANISHI S. Involvement of cytokinins,3-indoleacetic acid,and gibberellins in early fruit growth in pepper (Capsicum annuum L.)[J].The Horticulture Journal,2017,86(1):52-60.
[9] 涂贵庆,廖光联,刘青,李帮明,黄春辉,贾东峰,赵尚高,徐小彪.中华猕猴桃黄肉新品种‘奉黄1 号’的生物学特性及其主要栽培技术[J].中国南方果树,2020,49(2):153-156.TU Guiqing,LIAO Guanglian,LIU Qing,LI Bangming,HUANG Chunhui,JIA Dongfeng,ZHAO Shanggao,XU Xiaobiao. Biological characteristics and main cultivation techniques of a new Actinidia chinensis yellow-fleshed cultivar‘Fenghuang No.1’[J].South China Fruits,2020,49(2):153-156.
[10] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007.CAO Jiankang,JIANG Weibo,ZHAO Yumei. Experiment guidance of postharvest physiology and biochemistry of fruit and vegitables[M].Beijing:China Light Industry Press,2007.
[11] 高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006.GAO Junfeng. Experimental guidance for plant physiology[M].Beijing:Higher Education Press,2006.
[12] 王学奎,黄见良.植物生理生化实验原理与技术[M].3 版.北京:高等教育出版社,2015.WANG Xuekui,HUANG Jianliang. Principles and techniques of plant physiological biochemical experiment[M]. 3rd ed. Beijing:Higher Education Press,2015.
[13] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.LI Hesheng. Principles and techniques of plant physiological biochemical experiment[M]. Beijing:Higher Education Press,2000.
[14] PENG Q,WANG H Q,TONG J H,KABIR M H,HUANG Z G,XIAO L T.Effects of indole-3-acetic acid and auxin transport inhibitor on auxin distribution and development of peanut at pegging stage[J].Scientia Horticulturae,2013,162:76-81.
[15] ABBASI N A,ZAFAR L,KHAN H A,QURESHI A A. Effects of naphthalene acetic acid and calcium chloride application on nutrient uptake,growth,yield and post harvest performance of tomato fruit[J]. Pakistan Journal of Botany,2010,45(5):1581-1587.
[16] MOSA W,EL-MEGEED N,ALY M,PASZT L. The influence of NAA,GA3 and calcium nitrate on growth,yield and fruit quality of‘Le Conte’pear trees[J].American Journal of Experimental Agriculture,2015,9(4):1-9.
[17] MILIĆ B,TARLANOVIĆ J,KESEROVIĆ Z,MAGAZIN N,MIODRAGOVIĆ M,POPARA G. Bioregulators can improve fruit size,yield and plant growth of northern highbush blueberry(Vaccinium corymbosum L.)[J]. Scientia Horticulturae,2018,235:214-220.
[18] AN L,MA J W,QIN D M,WANG H,YUAN Y L,LI H L,NA R S,WU X J.Novel strategy to decipher the regulatory mechanism of 1-naphthaleneacetic acid in strawberry maturation[J]. Journal of Agricultural and Food Chemistry,2019,67(4):1292-1301.
[19] HAMBERGER B,ELLIS M,FRIEDMANN M,DE AZEVEDO SOUZA C,BARBAZUK B,DOUGLAS C J. Genome-wide analyses of phenylpropanoid-related genes in Populus trichocarpa,Arabidopsis thaliana,and Oryza sativa:The Populus lignin toolbox and conservation and diversification of angiosperm gene families[J]. Canadian Journal of Botany,2007,85(12):1182-1201.
[20] SHIGETO J,TSUTSUMI Y. Diverse functions and reactions of class III peroxidases[J]. New Phytologist,2016,209(4):1395-1402.
[21] FRANCOZ E,RANOCHA P,NGUYEN-KIM H,JAMET E,BURLAT V,DUNAND C. Roles of cell wall peroxidases in plant development[J].Phytochemistry,2015,112:15-21.
[22] BLEE K A,CHOI J W,O’CONNELL A P,SCHUCH W,LEWIS N G,BOLWELL G P.A lignin-specific peroxidase in tobacco whose antisense suppression leads to vascular tissue modification[J].Phytochemistry,2003,64(1):163-176.
[23] LI Y H,KAJITA S,KAWAI S,KATAYAMA Y,MOROHOSHI N. Down-regulation of an anionic peroxidase in transgenic aspen and its effect on lignin characteristics[J]. Journal of Plant Research,2003,116(3):175-182.
[24] SHIGETO J,ITOH Y,HIRAO S,OHIRA K,FUJITA K,TSUTSUMI Y. Simultaneously disrupting AtPrx2,AtPrx25 and At-Prx71 alters lignin content and structure in Arabidopsis stem[J].Journal of Integrative Plant Biology,2015,57(4):349-356.
[25] STOVER E,FARGIONE M,RISIO R,YANG X E,ROBINSON T. Fruit weight,cropload,and return bloom of‘Empire’apple following thinning with 6-benzyladenine and NAA at several phenological stages[J].HortScience,2001,36(6):1077-1081.
[26] PÉREZ-LEÓN M I,GONZÁLEZ-FUENTES J A,VALDEZAGUILAR L A,BENAVIDES-MENDOZA A,ALVARADOCAMARILLO D,CASTILLO-CHACÓN C E.Effect of glutamic acid and 6-benzylaminopurine on flower bud biostimulation,fruit quality and antioxidant activity in blueberry[J]. Plants,2023,12(12):2363.
[27] PARK Y,PARK H S. Microstructural changes in the fruit and pedicel of‘Wonhwang’oriental pear induced by exogenous gibberellins[J].Scientia Horticulturae,2017,222:1-6.
[28] 丁改秀,王保明,王小原,仓国营,温鹏飞.GA3 对壶瓶枣细胞壁组分代谢及裂果率的影响[J].山西农业科学,2013,41(8):819-821.DING Gaixiu,WANG Baoming,WANG Xiaoyuan,CANG Guoying,WEN Pengfei. Effect of GA3 on cell wall component metabolism and cracking of Huping jujube[J]. Journal of Shanxi Agricultural Sciences,2013,41(8):819-821.
[29] 李斯宇,华敏,吴晓慧,邓会栋,韩晓蕾,王海波,李向宏.外施GA3对台农17 号菠萝果实品质及内源激素的影响[J].中国果树,2023(10):73-78.LI Siyu,HUA Min,WU Xiaohui,DENG Huidong,HAN Xiaolei,WANG Haibo,LI Xianghong.The effects of GA3 application on fruit quality and endogenous hormones of‘Tainong 17’pineapple[J].China Fruits,2023(10):73-78.
[30] WHITE P J,BROADLEY M R. Calcium in plants[J].Annals of Botany,2003,92(4):487-511.
[31] 汪晓谦,商叶,刘维成,刘畅,杜国栋,吕德国.生长调节剂及钙、硼肥对南果梨萼片脱落、果实品质及木质素代谢的影响[J].沈阳农业大学学报,2019,50(4):399-405.WANG Xiaoqian,SHANG Ye,LIU Weicheng,LIU Chang,DU Guodong,LÜ Deguo.Effect of growth regulators,Ca and B fertilizers on calyx abscission,fruit quality,and lignin metabolism in Nanguo pear[J].Journal of Shenyang Agricultural University,2019,50(4):399-405.