植物的光合性能对生长发育、产量及品质的形成起着至关重要的作用,而提高植物的光合性能则是提升植物产量与品质的重要途径[1]。光合色素是植物进行光合的基石,与碳水化合物的合成有着紧密的联系,而叶绿素含量在某种程度上能够反映对光能的利用率及生产有机物的能力[2-3]。为提高植物的光合性能,常采用合理的水肥、修剪、栽培密度、架形、病虫害防治、激素利用和环境因子调控等措施,创造光合作用充分的营养条件和环境条件,提高植物叶片质量和叶绿素含量,进而提高植物的产量和品质。
多巴胺(dopamine)是一种以酪氨酸为起始物质生成的儿茶酚胺类神经递质[4],在植物中可以调控细胞内的各种生命活动、参与活性氧(ROS)的清除、与植物内源激素互作等,从而影响植株的生长和发育[5]。研究表明,多巴胺对植物的光合系统具有保护和促进作用,能够通过调控植物叶片气孔导度来提高对CO2的利用效率,并维持高浓度的叶绿素[6];多巴胺显著缓解了盐胁迫对植物净光合速率的抑制作用,使植物能够保持正常的生长[7];在整个生育期内,多巴胺均提高了苹果叶片的叶绿素含量和百叶质量[8];多巴胺还可提高植株的光合效率,并能明显抑制叶绿素降解相关基因的表达,进而有效提高苹果叶片的叶绿素含量[9]。
品质的优劣直接影响着植物的经济效益,果实的品质决定着消费者的选择倾向,消费者一般喜欢选择果实饱满、酸甜适度、营养成分含量高的水果。多巴胺在果树、瓜类、马铃薯等植物的品质改善方面有着广泛应用。研究表明,多巴胺能够提高苹果的可溶性固形物和花青苷含量,促进果实对营养元素的吸收[10];多巴胺能够促进苹果果柄的伸长、果实的生长和着色,并提高果形指数和单果质量,进而改善苹果的外观品质[8];100 μmol·L-1的多巴胺处理增加了西瓜果实的纵横径和单瓜质量,显著降低了西瓜果实有机酸含量并提高了蛋白质含量,从而改善了果实品质[11];在马铃薯中,儿茶酚胺类物质(主要包括多巴胺、去甲肾上腺素、肾上腺素)含量的增加会引起果糖、葡萄糖和蔗糖含量的增加,淀粉含量则有所下降[12];在4 ℃的贮藏环境下,加快了马铃薯的呼吸速率与淀粉降解速率,提高了可溶性糖含量,但多巴胺含量却呈明显下降趋势,这进一步证实了儿茶酚胺对植物体内糖代谢的调控作用[13];多巴胺还能促进盐胁迫下菌根植物的蔗糖磷酸合酶、细胞壁转化酶和中性转化酶等基因的表达,进而提高体内果糖和葡萄糖的含量[14]。
有关多巴胺对葡萄光合性能和果实品质影响的研究鲜有报道,因此研究其对葡萄植株光合特性及果实品质的调控效应,从而指导生产实践具有重大意义。甘肃河西走廊地区夏季高温、秋冬冷凉,干旱少雨,土壤贫瘠,并伴有不同程度的盐碱化,容易造成葡萄叶片过早黄化衰老,光合作用减弱使得同化物减少,树体养分贮藏不足,常造成果实成熟不充分,产量下降等问题,从而严重制约着葡萄产业的可持续发展。笔者在本研究中主要以设施延后栽培阳光玫瑰葡萄为试材,通过多巴胺处理,研究其对葡萄叶片光合色素含量、光合参数、叶绿素荧光参数以及果实品质相关指标的影响,探究多巴胺生理作用机制和适宜处理方法,以期为葡萄优质生产提供理论依据。
1 材料和方法
1.1 试验材料和试验地概况
试验以7 年生的自根砧木阳光玫瑰葡萄为试材,挑选生长良好、树势一致且无病害植株,对葡萄进行不同浓度多巴胺处理,于2023 年4—11 月在武威市凉州区林业技术中心葡萄示范基地进行,葡萄行株距3.5 m×2.5 m,T形架,东西走向。
试验地(N 37°23'~38°12',E 101°59'~103°23')海拔1500~2000 m,为温带大陆性干旱气候,四季分明,光照充足,降水量少,昼夜温差大,年均降水量约100 mm,蒸发量约2020 mm,年日照时数约2 873.4 h,昼夜温差约7.9 ℃。
1.2 试验设计
试验以设施延后栽培阳光玫瑰葡萄为试材,通过50 μmol·L-1(T1)、100 μmol·L-1(T2)、150 μmol·L-1(T3)、200 μmol·L-1(T4)多巴胺喷施叶面处理,以清水为对照。分别于初花期、幼果期(花后30 d)、果实膨大期(花后60 d)、转色期(花后90 d)进行处理,以叶片开始滴液为准,每个处理设3个重复,每个重复5株,且在坐果后对树势一致的果穗挂牌标记。
叶片在初花期、幼果期、果实膨大期、转色期及成熟期(花后120 d)5 个时期取样(前4 个时期在多巴胺处理后的第5 天取样),果实只在成熟期取样。取样具体时间为上午08:00—09:00葡萄园可见光条件下进行。每棵树采集功能叶片及果实,叶片放于冰盒中带回实验室,用液氮迅速冷冻后置于-80 ℃超低温冰箱中,以备后续进行各项指标测定。
供试药剂为多巴胺盐酸盐,为4-(2-氨基乙基)-1,2-苯二酚盐酸盐,按干燥品计算,含C8H11NO2·HCl不少于98.0%,常温保存,呈白色结晶性粉末状,易溶于水,对热、光和空气敏感。
1.3 测定指标和方法
1.3.1 叶片光合特性指标的测定 石蜡切片的制作与观察:在各物候期,每个处理挑选3 株树势良好的植株,取健康无病虫害的功能叶片,用剪刀剪取0.3 cm×0.5 cm 的小块,迅速放入FAA 固定液中,抽气待叶片浸入FAA 固定液中备用,然后经脱水、透明、浸蜡、包埋、切片、脱蜡、染色(用甲苯胺蓝母液1%稀释至0.1%染色)后,用中性树胶封片,烘干后待上机镜检。将制作好的石蜡切片置于正倒置一体显微镜下观察并测量叶片厚度、栅栏和海绵组织厚度以及上下表皮厚度,所测数据均为10个视野下的平均值。
光合色素含量测定:取0.1 g 新鲜叶片,加入10 mL 80%丙酮,于黑暗条件下萃取过夜,待叶片变白后用紫外分光光度计(岛津UV-1800)在470、645和663 nm 波长下测定吸光值,用于计算叶绿素a(Chl a)、叶绿素b(Chl b)、总叶绿素(Chl t)和类胡萝卜素(Car)含量。
光合参数测定:参照张振兴等[15]的方法并稍作调整,采用便携式光合仪(Yaxin-1105)测定各处理下功能叶片的光合参数:净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)。
叶绿素荧光参数测定:参照胡琳莉[16]的方法并稍作调整。使用调制叶绿素荧光成像仪IMAGINPAM进行测定。取功能叶片剪掉叶柄,经30 min暗适应后,将叶片放平固定在测定台上测量参数:Fv/Fm、Y(Ⅱ)、qP、qN、Y(NPQ)、ETR。
1.3.2 果实品质相关指标的测定 果实外观品质测定:单粒质量使用电子天平称量。果实纵横径使用数显电子游标卡尺测量。果实硬度使用GY-4 数显水果硬度计测定。
果实内在品质测定:可溶性固形物含量使用手持PAL-1数显折射仪测定。可滴定酸含量采用氢氧化钠滴定法测定[17]。固酸比用可溶性固形物含量与可滴定酸含量之比表示。可溶性总糖含量采用蒽酮-硫酸法测定[18]。维生素C 含量采用2,6-二氯靛酚滴定法测定[19]。
酚类物质含量测定:总酚含量采用Folin-Ciocalteu 试剂法测定[20]。单宁含量采用Folin-Denis 试剂法测定[21]。花青素含量采用pH 示差法测定[22]。总类黄酮含量采用氯化铝比色法测定[23]。
糖组分及含量测定:使用高效液相色谱仪(美国Waters Acquity Arc)进行测定,具体测定方法参照贺雅娟等[24]和李彦彪等[25]的报道。
1.4 数据处理
采用Excel 2019 进行所有试验数据整理,采用SPSS 25.0进行统计学处理和单因素方差分析,检验差异显著性(p<0.05),绘图软件使用Origin 2022。
2 结果与分析
2.1 多巴胺对阳光玫瑰葡萄叶片光合特性的影响
2.1.1 多巴胺对阳光玫瑰葡萄叶片组织结构的影响 从表1 可以看出:在初花期,多巴胺处理下各指标较对照均无显著差异。在幼果期,叶片厚度只有T3 处理较对照差异显著(p<0.05),较对照提高了8.40%;T2 和T3 处理的海绵组织厚度较对照分别显著提高了13.13%和14.16%。在膨大期,多巴胺处理下叶片厚度、栅栏和海绵组织厚度较对照均有所提升,但各处理间无显著差异。在转色期,叶片厚度、栅栏和海绵组织以及上下表皮厚度均达到峰值,其中不同处理下叶片厚度由高到低依次为T2(151.90 μm)>T3(145.87 μm)>T1(145.57 μm)>T4(138.27 μm),较对照(132.43 μm)分别提高了14.70%、10.14%、9.92%和4.40%,其中T1~T3处理显著高于对照(p<0.05);栅栏组织厚度各处理较对照分别增加了22.44%、27.64%、24.96%和14.33%,除T4处理外均达到显著差异水平(p<0.05);海绵组织厚度只有T2 处理较对照显著增加10.51%(p<0.05);T2 和T3 处理的上表皮厚度较对照显著增大(p<0.05);T2 处理的下表皮厚度较对照显著增大(p<0.05)。
表1 外源多巴胺处理对阳光玫瑰葡萄不同物候期叶片组织结构的影响
Table 1 Effects of exogenous dopamine treatment on the leaf tissue structure at different phenological stages of Shine Muscat grapes
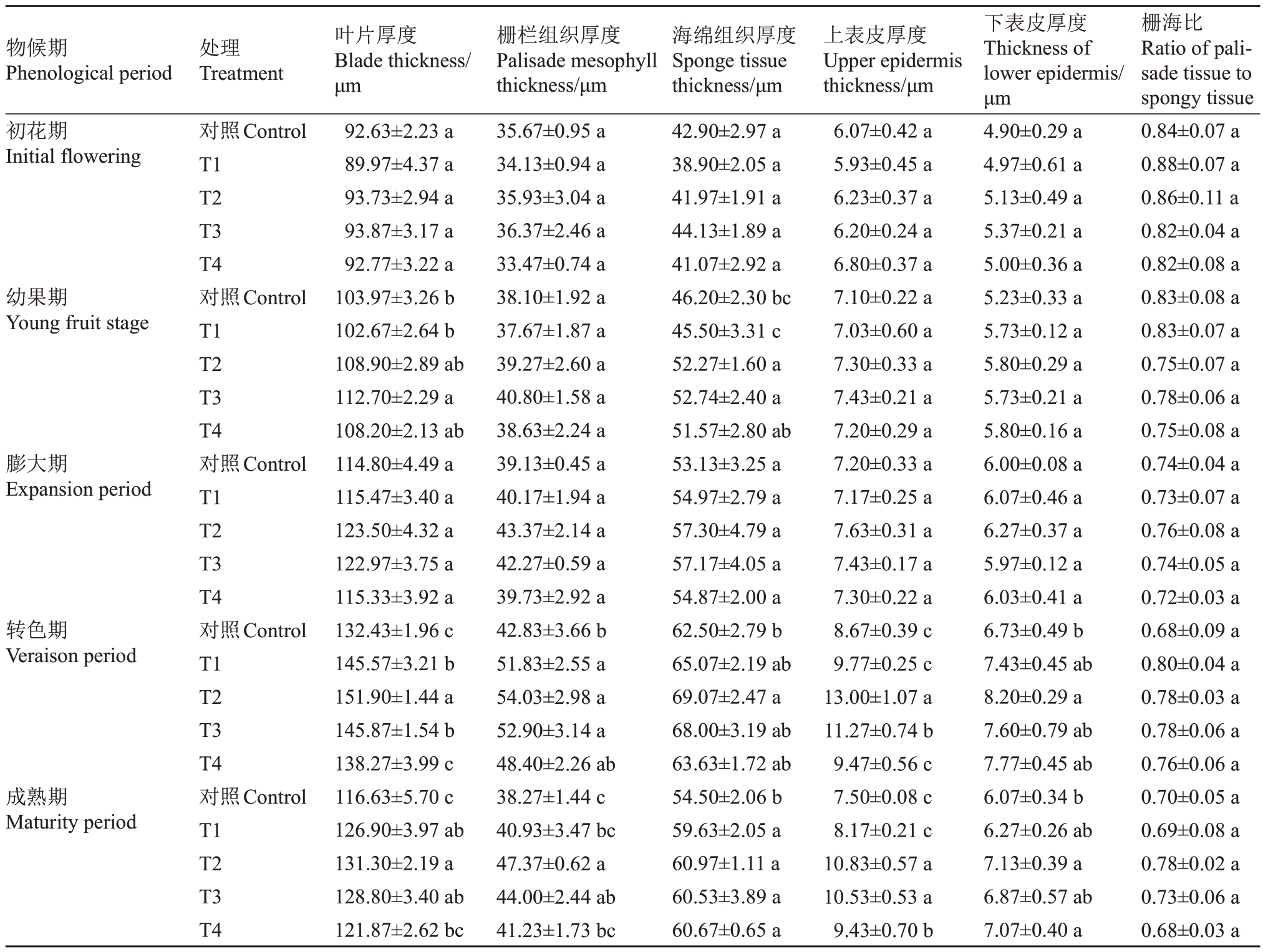
注:不同小写字母表示同一物候期各处理间差异显著(p<0.05)。
Note:Different small letters indicated that there were significant differences among treatments in the same phenological period(p<0.05).
物候期Phenological period处理Treatment初花期Initial flowering幼果期Young fruit stage膨大期Expansion period转色期Veraison period成熟期Maturity period栅海比Ratio of palisade tissue to spongy tissue 0.84±0.07 a 0.88±0.07 a 0.86±0.11 a 0.82±0.04 a 0.82±0.08 a 0.83±0.08 a 0.83±0.07 a 0.75±0.07 a 0.78±0.06 a 0.75±0.08 a 0.74±0.04 a 0.73±0.07 a 0.76±0.08 a 0.74±0.05 a 0.72±0.03 a 0.68±0.09 a 0.80±0.04 a 0.78±0.03 a 0.78±0.06 a 0.76±0.06 a 0.70±0.05 a 0.69±0.08 a 0.78±0.02 a 0.73±0.06 a 0.68±0.03 a对照Control T1 T2 T3 T4对照Control T1 T2 T3 T4对照Control T1 T2 T3 T4对照Control T1 T2 T3 T4对照Control T1 T2 T3 T4叶片厚度Blade thickness/μm 92.63±2.23 a 89.97±4.37 a 93.73±2.94 a 93.87±3.17 a 92.77±3.22 a 103.97±3.26 b 102.67±2.64 b 108.90±2.89 ab 112.70±2.29 a 108.20±2.13 ab 114.80±4.49 a 115.47±3.40 a 123.50±4.32 a 122.97±3.75 a 115.33±3.92 a 132.43±1.96 c 145.57±3.21 b 151.90±1.44 a 145.87±1.54 b 138.27±3.99 c 116.63±5.70 c 126.90±3.97 ab 131.30±2.19 a 128.80±3.40 ab 121.87±2.62 bc栅栏组织厚度Palisade mesophyll thickness/μm 35.67±0.95 a 34.13±0.94 a 35.93±3.04 a 36.37±2.46 a 33.47±0.74 a 38.10±1.92 a 37.67±1.87 a 39.27±2.60 a 40.80±1.58 a 38.63±2.24 a 39.13±0.45 a 40.17±1.94 a 43.37±2.14 a 42.27±0.59 a 39.73±2.92 a 42.83±3.66 b 51.83±2.55 a 54.03±2.98 a 52.90±3.14 a 48.40±2.26 ab 38.27±1.44 c 40.93±3.47 bc 47.37±0.62 a 44.00±2.44 ab 41.23±1.73 bc海绵组织厚度Sponge tissue thickness/μm 42.90±2.97 a 38.90±2.05 a 41.97±1.91 a 44.13±1.89 a 41.07±2.92 a 46.20±2.30 bc 45.50±3.31 c 52.27±1.60 a 52.74±2.40 a 51.57±2.80 ab 53.13±3.25 a 54.97±2.79 a 57.30±4.79 a 57.17±4.05 a 54.87±2.00 a 62.50±2.79 b 65.07±2.19 ab 69.07±2.47 a 68.00±3.19 ab 63.63±1.72 ab 54.50±2.06 b 59.63±2.05 a 60.97±1.11 a 60.53±3.89 a 60.67±0.65 a上表皮厚度Upper epidermis thickness/μm 6.07±0.42 a 5.93±0.45 a 6.23±0.37 a 6.20±0.24 a 6.80±0.37 a 7.10±0.22 a 7.03±0.60 a 7.30±0.33 a 7.43±0.21 a 7.20±0.29 a 7.20±0.33 a 7.17±0.25 a 7.63±0.31 a 7.43±0.17 a 7.30±0.22 a 8.67±0.39 c 9.77±0.25 c 13.00±1.07 a 11.27±0.74 b 9.47±0.56 c 7.50±0.08 c 8.17±0.21 c 10.83±0.57 a 10.53±0.53 a 9.43±0.70 b下表皮厚度Thickness of lower epidermis/μm 4.90±0.29 a 4.97±0.61 a 5.13±0.49 a 5.37±0.21 a 5.00±0.36 a 5.23±0.33 a 5.73±0.12 a 5.80±0.29 a 5.73±0.21 a 5.80±0.16 a 6.00±0.08 a 6.07±0.46 a 6.27±0.37 a 5.97±0.12 a 6.03±0.41 a 6.73±0.49 b 7.43±0.45 ab 8.20±0.29 a 7.60±0.79 ab 7.77±0.45 ab 6.07±0.34 b 6.27±0.26 ab 7.13±0.39 a 6.87±0.57 ab 7.07±0.40 a
在成熟期(成熟期组织结构解剖图见图1),不同处理下叶片厚度排列顺序为:T2>T3>T1>T4>对照,其中T1~T3 处理较对照达到显著差异水平(p<0.05);T2 和T3 处理的栅栏组织厚度显著高于对照(p<0.05),较对照分别增加了23.78%和14.98%;各处理的海绵组织厚度较对照分别显著提高了9.42%、11.87%、11.07%和11.31%(p<0.05);T2~T4 处理的上表皮厚度与对照有显著差异(p<0.05);T2 和T4 处理的下表皮厚度较对照分别显著提高了17.58%和16.48%。各物候期不同处理的栅海比与对照均无显著差异。
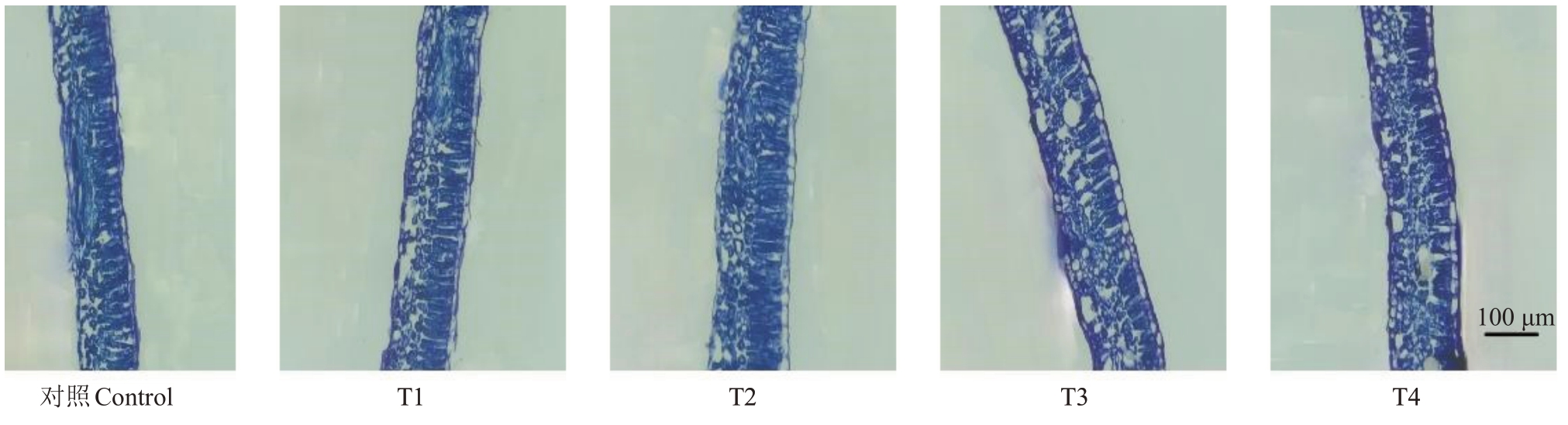
图1 不同处理的葡萄成熟期叶片横切图
Fig.1 Transverse sections of grape leaves at berry maturity stage under different treatments
2.1.2 多巴胺对阳光玫瑰葡萄叶片光合色素含量的影响 由图2可以看出,从初花期到成熟期,不同处理下阳光玫瑰葡萄叶片的Chl a、Chl b、Car 和Chl t含量呈先升后降的变化趋势,多巴胺处理后均提高了叶片不同时期Chl a、Chl b、Car和Chl t含量,其中T2 处理效果最优,显著高于对照(p<0.05)。T2 处理下各时期Chl a 含量较对照分别显著提高14.78%、35.64%、76.33%、31.39%和84.77%;Chl b含量较对照分别显著提高19.84%、64.03%、74.85%、56.47%和94.59%;Car 含量较对照分别显著提高40.05%、75.25%、146.63%、146.73%和145.82%;Chl t含量较对照分别显著提高17.12%、49.06%、75.72%、38.88%和88.25%。

图2 多巴胺处理对阳光玫瑰葡萄叶片光合色素含量的影响
Fig.2 Effects of dopamine treatments on photosynthetic pigment contents in the leaves of Shine Muscat grape
2.1.3 多巴胺对阳光玫瑰葡萄叶片光合参数的影响 由图3可以看出,随着多巴胺处理浓度的增加,叶片Pn、Gs、Tr和WUE大致呈先升后降的变化趋势,叶片Ci呈先降后升的变化趋势。多巴胺处理提升了叶片Pn、Gs、Tr和WUE不同时期平均值,降低了叶片Ci不同时期平均值,其中,T1~T4处理的不同时期Pn平均值较对照分别增加7.09%、16.97%、12.69%和7.86%;不同时期Gs平均值较对照分别增加5.17%、18.28%、14.14%和5.17%;不同时期Tr平均值较对照分别增加3.98%、8.17%、7.45%和4.95%;不同时期WUE 平均值较对照分别增加3.01%、7.83%、4.87%和2.92%;不同时期Ci 平均值较对照分别降低4.55%、6.27%、5.86%和2.48%。且均为T2处理效果最优,显著优于对照(p<0.05)。

图3 多巴胺处理对阳光玫瑰葡萄叶片光合参数的影响
Fig.3 Effects of dopamine treatments on photosynthetic parameters of Shine Muscat grape leaves
2.1.4 多巴胺对阳光玫瑰葡萄叶片叶绿素荧光参数的影响 由图4 可以看出,随着阳光玫瑰葡萄的生长发育,叶片Fv/Fm、Y(Ⅱ)、qN和ETR大致呈先升后降的趋势;叶片qP 呈先升后降再升的趋势;叶片Y(NPQ)呈“降-升-降-升”的波浪形变化趋势。多巴胺处理有效提高了叶片Fv/Fm、Y(Ⅱ)、qP、qN、Y(NPQ)和ETR不同时期平均值,其中,T1~T4处理的Fv/Fm 不同时期平均值较对照分别增加1.91%、7.50%、5.28%和1.99%;T1~T4 处理的Y(Ⅱ)不同时期平均值较对照分别增加8.26%、12.33%、9.79%和4.20%;T1~T3 处理的qP 不同时期平均值较对照分别增加7.62%、10.90%和8.41%,而T4处理在部分时期降低qP;T1~T4 处理的qN 不同时期平均值较对照分别增加7.22%、20.61%、18.48%和8.06%;T1~T4处理的Y(NPQ)不同时期平均值较对照分别增加23.96%、46.19%、45.20%和17.99%;T1~T4 处理的ETR 不同时期平均值较对照分别增加5.91%、17.38%、14.07%和1.27%。以上各指标均为T2和T3处理效果最优,除初花期外,其余各时期均显著高于对照(p<0.05)。

图4 多巴胺处理对阳光玫瑰葡萄叶片叶绿素荧光参数的影响
Fig.4 Effects of dopamine treatments on chlorophyll fluorescence parameters of Shine Muscat grape leaves
2.1.5 阳光玫瑰葡萄叶片光合性能与组织结构的相关性分析 由图5 可以看出,光合性能指标与葡萄叶片组织结构间存在一定的相关性。Chl a 与叶片厚度、栅栏组织厚度和上表皮厚度呈显著正相关(p<0.05);Chl b、Car 和Chl t 三者与栅栏组织厚度均呈极显著正相关(p<0.01),与叶片厚度和上表皮厚度均呈显著正相关(p<0.05);叶片Pn与海绵组织厚度呈极显著正相关(p<0.01);叶片Gs与上表皮厚度呈显著正相关(p<0.05);叶片Ci与叶片厚度和海绵组织厚度显著呈负相关(p<0.05);叶片Tr与栅栏组织厚度呈显著正相关(p<0.05);叶片Fv/Fm与叶片厚度和栅栏组织厚度呈显著正相关(p<0.05);叶片Y(Ⅱ)与叶片厚度呈极显著正相关(p<0.01);叶片qP 与叶片厚度呈显著正相关(p<0.05);叶片qN与叶片厚度呈极显著正相关(p<0.01),与栅栏组织厚度呈显著正相关(p<0.05);叶片Y(NPQ)与叶片厚度和栅栏组织厚度呈显著正相关(p<0.05);叶片ETR与叶片厚度呈显著正相关(p<0.05)。

图5 阳光玫瑰葡萄叶片光合性能与组织结构的相关性分析热图
Fig.5 Heatmap of correlation analysis between parameters of photosynthetic performance and tissue structure of Shine Muscat grape leaves
2.2 多巴胺对阳光玫瑰葡萄果实品质的影响
2.2.1 多巴胺对阳光玫瑰葡萄果实外观品质的影响 由图6可以看出,相较于对照,适宜浓度多巴胺处理下,葡萄果实的单粒质量、果实纵横径和硬度有一定程度的提升。其中,不同处理下单粒质量由高到低依次为T2>T3>T1>T4,较对照分别提高了26.32%、16.56%、7.54%和3.53%(图6-A),T2 和T3处理与对照呈显著差异(p<0.05);果实纵径只有T2处理显著高于对照(p<0.05),提高了12.53%(图6-B);T1~T4 处理的果实横径较对照分别显著提高了7.01%、12.65%、9.68%和5.42%(图6-C);各处理的果形指数较对照均有所下降,但变化幅度比较小(图6-D);T1~T4 处理的果实硬度较对照分别提高了9.27%、33.66%、19.51%和1.46%(图6-E),T1~T3 处理与对照呈显著差异,且T2处理效果最为显著(p<0.05)。
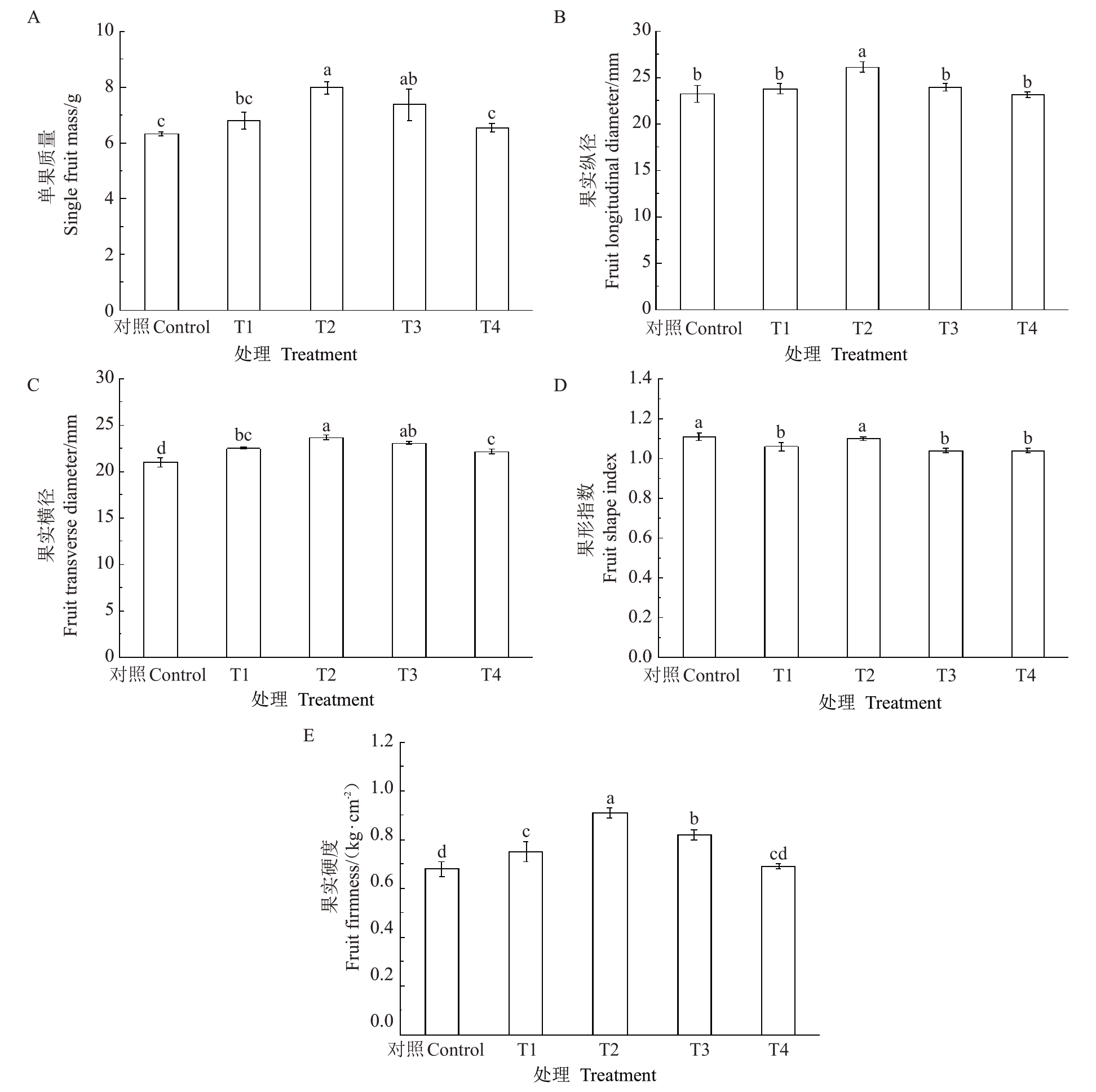
图6 多巴胺处理对阳光玫瑰葡萄果实外观品质的影响
Fig.6 Effects of dopamine treatments on the external quality of Shine Muscat grape berries
2.2.2 多巴胺对阳光玫瑰葡萄果实内在品质的影响 由图7可以看出,相较于对照,适宜浓度多巴胺处理下,葡萄果实固酸比及可溶性固形物、可溶性糖和维生素C 含量均有一定程度的提升,而可滴定酸含量则明显下降。其中,T1~T4 处理的果实可溶性固形物含量较对照分别显著提高了10.64%、13.83%、11.57%和8.38%(图7-A);不同处理下可滴定酸含量由高到低依次为T4>T1>T3>T2,较对照分别降低了6.55%、10.48%、11.79%和21.83%(图7-B),T1~T3处理与对照呈显著差异,T2处理效果最为显著(p<0.05);T1~T4处理的果实固酸比较对照分别提高了15.52%、36.05%、18.47%和7.12%(图7-C),除T4 处理外,均显著高于对照(p<0.05);T1~T4 处理的果实可溶性糖含量较对照分别显著提高了3.32%、4.92%、3.36%和3.12%(图7-D);T1~T3 处理的维生素C 含量较对照分别显著提高61.90%、166.67%和123.81%,T4处理与对照无显著差异(图7-E)。
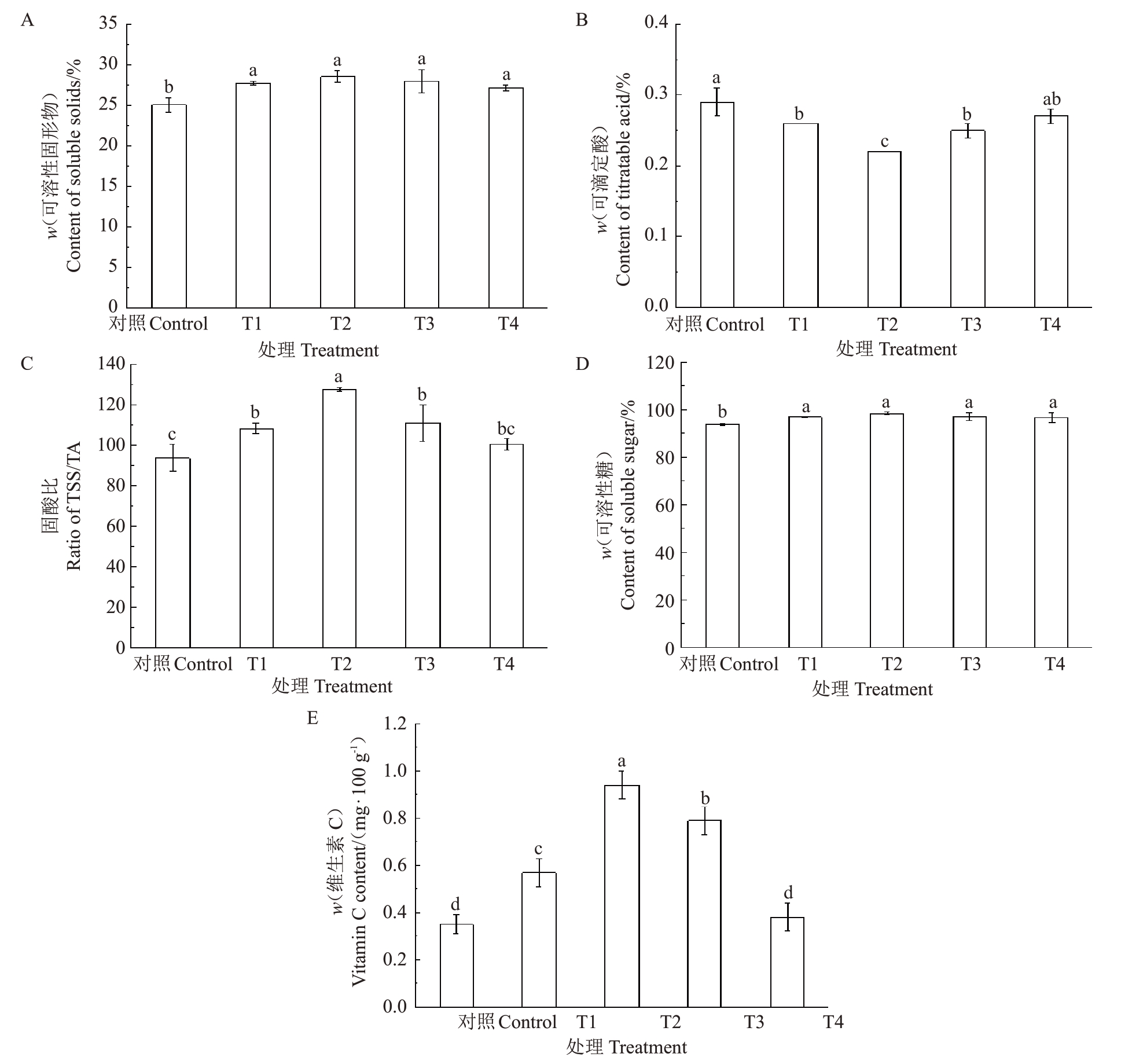
图7 多巴胺处理对阳光玫瑰葡萄果实内在品质的影响
Fig.7 Effects of dopamine treatments on the intrinsic quality of Shine Muscat grape fruit
2.2.3 多巴胺对阳光玫瑰葡萄果实酚类物质含量的影响 由图8可以看出,相较于对照,不同浓度多巴胺处理均可提高阳光玫瑰葡萄果实总酚、花青素和总类黄酮含量,降低单宁含量。其中,各处理的总酚含量由高到低依次为T2(14.21 mg·g-1)>T3(12.20 mg·g-1)>T1(11.33 mg·g-1)>T4(10.75 mg·g-1),较对照(10.09 mg·g-1)分别提高了40.82%、20.86%、12.32%和6.56%,但各处理与对照差异不显著(图8-A);T1~T4 处理的单宁含量均显著低于对照(p<0.05),较对照分别降低了19.78%、26.35%、20.13%和18.45%(图8-B),其中T2 处理效果最为显著,T3处理次之;T1 和T4 处理的花青素含量较对照无显著差异,而T2 和T3 处理较对照分别显著提高了156.71%和113.92%(图8-C),T2 处理效果最为显著;T2处理的总类黄酮含量提高效果最为显著(p<0.05),较对照增加了119.39%,其次为T1、T3 和T4处理,较对照分别显著提高了77.19%、76.32%和55.27%(图8-D)。
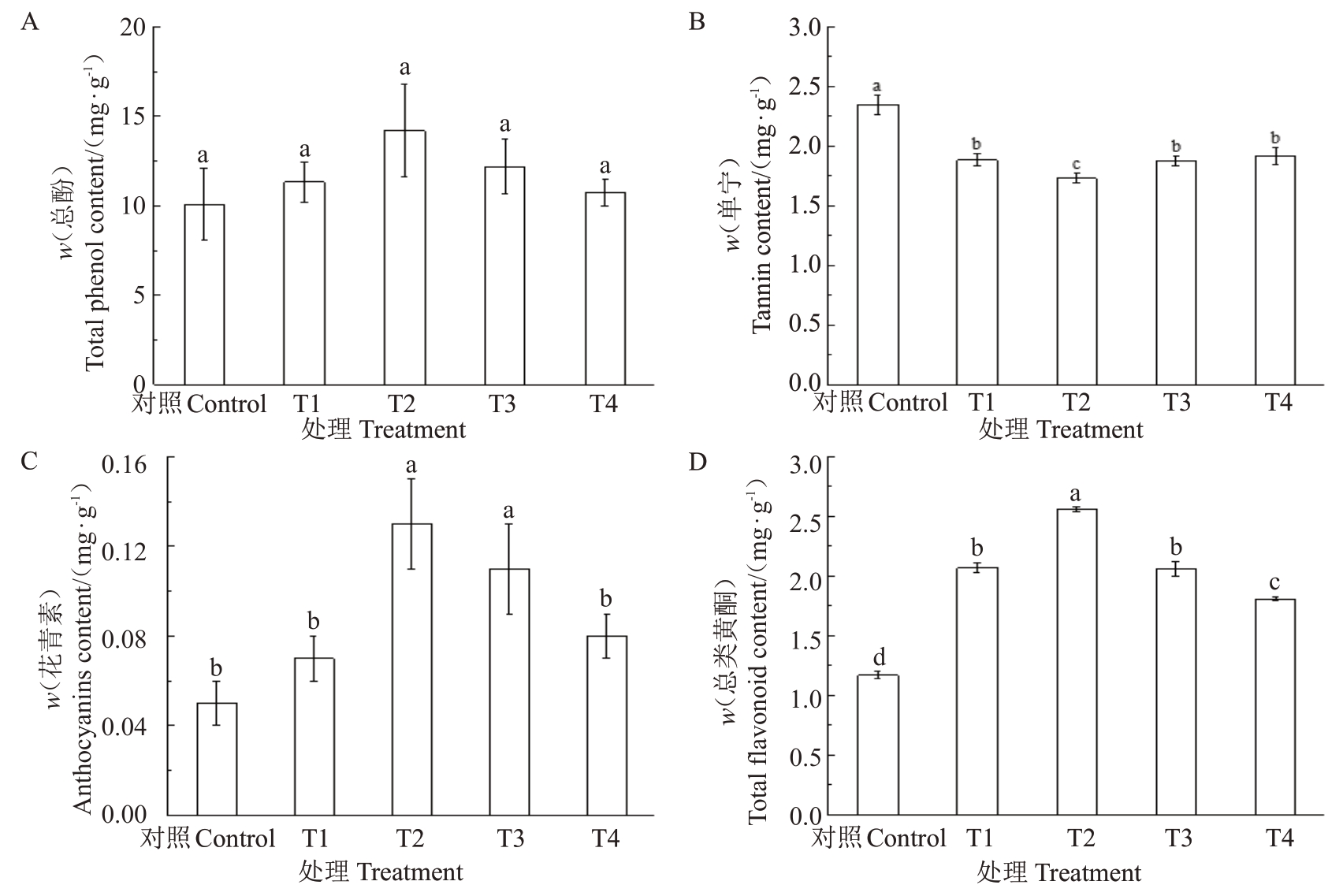
图8 多巴胺处理对阳光玫瑰葡萄果实酚类物质含量的影响
Fig.8 Effects of dopamine treatments on the content of phenols in Shine Muscat grape fruit
2.2.4 多巴胺对阳光玫瑰葡萄果实糖组分含量的影响 由图9可以看出,相较于对照,不同浓度多巴胺处理均可提高阳光玫瑰葡萄果实果糖、葡萄糖和蔗糖含量。其中,T1~T4 处理的果糖含量较对照分别提高了1.78%、7.92%、6.65%和0.06%,但与对照均无显著差异(图9-A);各处理的葡萄糖含量由高到低依次为T2(44.45 mg·g-1)>T3(43.22 mg·g-1)>T1(42.30 mg·g-1)>T4(42.01 mg·g-1),较对照分别显著提高了27.17%、23.64%、21.00%和20.18%(图9-B),且T2 处理效果最为显著(p<0.05);T2 处理下蔗糖含量提高效果最为显著(p<0.05),较对照提高了50.31%,其次为T3、T1 和T4 处理,较对照分别显著提高了49.17%、19.56%和13.42%(图9-C)。
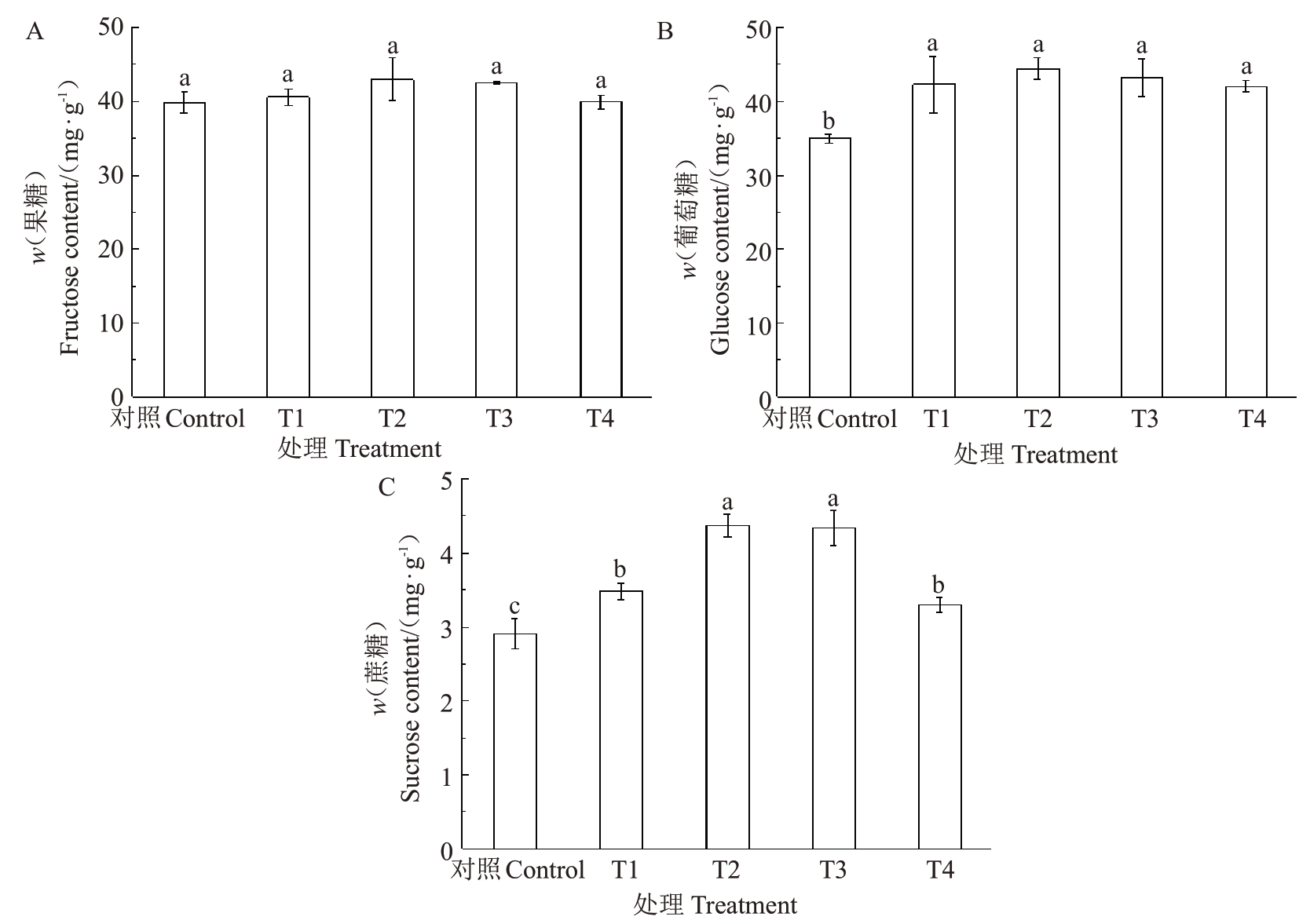
图9 多巴胺处理对阳光玫瑰葡萄果实糖组分含量的影响
Fig.9 Effects of dopamine treatments on sugar components in Shine Muscat grape fruit
2.2.5 多巴胺对阳光玫瑰葡萄果实品质影响的综合评价 通过对葡萄成熟期果实共16 项指标进行主成分分析,由表2可知,阳光玫瑰葡萄提取出2个主成分,各主成分的特征值均大于1,且这两个主成分的累积方差贡献率达到了97.08%,说明阳光玫瑰的2 个主成分总体上可以反映出各指标的所有信息。对不同浓度多巴胺处理阳光玫瑰葡萄的效果进行综合评价,得出综合评价方程,阳光玫瑰葡萄的综合得分由高到低依次为T2>T3>T1>T4>对照,根据得分越高处理效果越好的原则,各处理表现为:T2处理效果最佳,T3次之,说明100 μmol·L-1多巴胺处理下的果实品质最佳。
表2 多巴胺处理阳光玫瑰葡萄的主成分得分
Table 2 The principal component scores of dopamine treatments on Shine Muscat grape
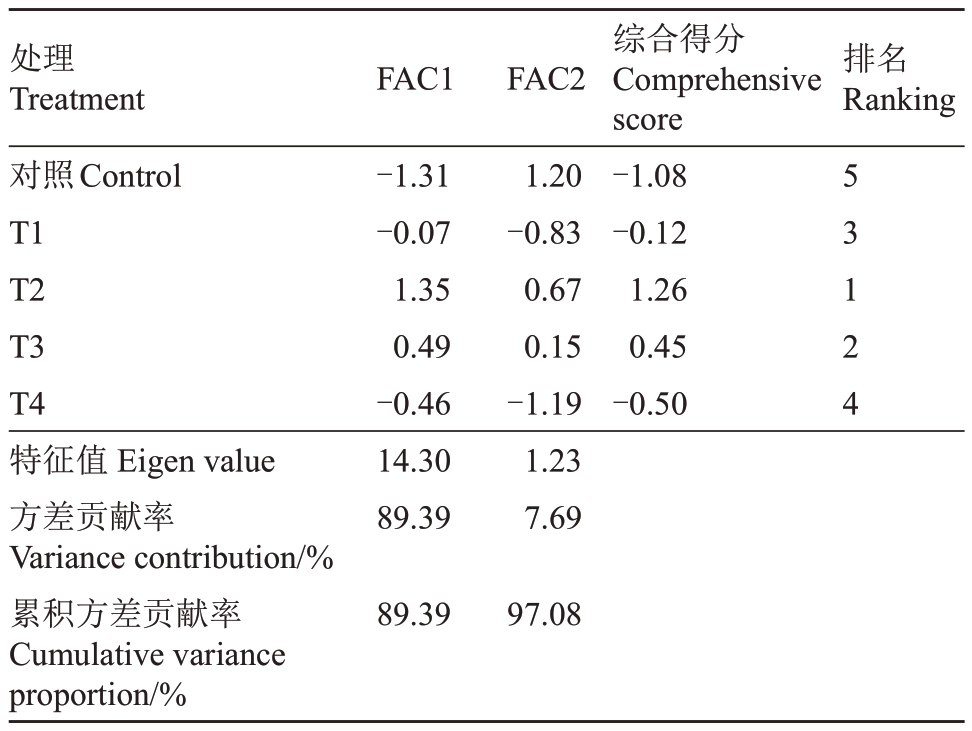
处理Treatment对照Control T1 T2 T3 T4特征值Eigen value方差贡献率Variance contribution/%累积方差贡献率Cumulative variance proportion/%FAC1 FAC2排名Ranking-1.31-0.07 1.35 0.49-0.46 14.30 89.39 1.20-0.83 0.67 0.15-1.19 1.23 7.69综合得分Comprehensive score-1.08-0.12 1.26 0.45-0.50 5 3 1 2 4 89.39 97.08
3 讨 论
3.1 关于多巴胺对阳光玫瑰葡萄叶片光合性能影响的研究
叶片是植物进行光合与蒸腾作用的器官,其解剖组织结构和外部形态在一定程度上表现了植物光合性能的强弱以及对外界环境的适应程度[26]。植物叶片栅栏组织越厚、每层细胞排列整齐度越高,植物水分散失则越慢[27];反之栅栏组织少,且排列疏松,则能提升叶片与外界的气体和水分交换能力[28]。表皮作为植株的保护层之一,由一层薄壁细胞紧密连接构成,充当着保护植物免受不良环境影响的屏障[29]。Shen 等[30]通过对甘草施用外源硅,从而增加了叶片厚度、栅栏和海绵组织厚度。本试验研究结果表明,喷施适宜浓度多巴胺可增加阳光玫瑰葡萄叶片于幼果期至成熟期的叶片厚度、栅栏和海绵组织厚度;同时,增加了叶片在转色和成熟期的上下表皮厚度以及栅海比。笔者在本研究中比较了不同物候期葡萄叶片解剖结构的差异,发现其叶片厚度、栅栏组织厚度、海绵组织厚度及上下表皮厚度随葡萄的生长发育呈单峰变化趋势,且均在转色期达到峰值,为理解葡萄生长周期提供了叶片组织结构变化方面的重要视角。
对于植物而言,光合作用尤为重要,其将太阳能转换为植物生育所需的化学能,植物本身的生长发育状况也在很大程度上受光合作用强弱的影响,且与植物品质紧密相关[31-32]。光合色素含量是植物光合作用中非常关键的一环,参与了光能的吸收、传递和转化,反映了植物对外部光照的适应程度和光合作用强度,高含量光合色素有助于植物维持较高水平的光合效率[33-34]。陈莹等[35]研究发现,施用多巴胺可以提高苹果幼苗Chl a、Chl b、Car 和Chl t 含量。本研究结果表明,不同物候期喷施不同浓度多巴胺均提高了阳光玫瑰葡萄叶片Chl a、Chl b、Car和Chl t含量,表明外源多巴胺在一定程度上可以保护叶绿素不被降解,光合色素含量的增加有利于提高葡萄叶片的光合速率。李超等[36]研究发现,水培施用多巴胺提高了苹果叶片的叶绿素含量和净光合速率。本研究结果表明,适宜浓度(100 μmol·L-1)多巴胺处理显著提高阳光玫瑰葡萄叶片的Pn,在幼果期、膨大期和转色期显著提高叶片的Gs,于幼果期至成熟期显著提高叶片Tr,于幼果期、转色期和成熟期显著降低了叶片Ci。这与唐仲文等[37]的研究结果相似,外源多巴胺提高了铜胁迫下苹果叶片Pn、Gs和Tr。多巴胺在调节光合作用氧还原的过程中起重要作用,在对分离的菠菜叶绿体研究中,多巴胺能介导光合氧还原,这些化合物可能作为化学类似物的自然介质,或者氧还原因子,允许氧还原参与光合作用的能量转换[38]。多巴胺对植物光合作用的促进可能是直接的,也可能是间接的,例如Ci的降低可能受到气孔因素或非气孔因素的共同影响。
此外,植物叶片叶绿素荧光是光合性能的重要组成部分,与植株对光能的吸收利用、转化传递密切相关,不仅影响植株碳循环的动态平衡,同时影响生长发育的进程[39-41]。其中叶片Fv/Fm反映了PSⅡ反应中心光能转化效率,其值越大,则PSⅡ活性越强[42]。Liu等[43]研究发现,外源多巴胺可提高马蹄草的Fv/Fm,与本试验研究结果一致。Y(Ⅱ)包含了高效的光子吸收和电子转移,Y(Ⅱ)会随着PSⅡ功能的变弱而随之降低,高Y(Ⅱ)一般则表示植株有高光合效率[44]。ETR主要反映了植株在实际光强条件下的表观电子传递效率。此外,热耗散是植物所吸收光能消耗的途径之一,具有保护PSⅡ的作用,qP是指植物热耗散的能力[45];Y(NPQ)是指PSⅡ天线色素光能吸收过程中未能被用于光合电子传递而以热形式耗散的部分光能,反映了光系统对过剩光能的耗散能力[46]。本研究结果表明,不同物候期喷施适宜浓度多巴胺可不同程度地提高阳光玫瑰葡萄叶片Y(Ⅱ)、qP、qN、ETR和Y(NPQ)值,说明外源多巴胺可增强葡萄的光合性能,提高其叶片的光能转化和利用效率,同时提升热耗散,推测多巴胺可能在植物生长发育过程中有一定保护作用。这与前人研究结果相似,外源多巴胺有效提高了黄瓜的光合性能和叶绿素荧光参数[47]。这些发现为多巴胺在植物生长调节中的应用提供了新的视角,并可能有助于谋划提高植物光合作用效率的策略。
3.2 关于多巴胺对阳光玫瑰葡萄果实品质影响的研究
鲜食葡萄的果实形态特征是衡量品质的重要指标,果农在追求产量的同时也追求着单果及果穗外观所具有的商业价值,葡萄果实是否饱满可口,形态是否美观也是消费者判断其品质的一大标准。果实硬度很大程度上影响了果实的口感,果实硬度受细胞膨压的影响,果实细胞体积越大,硬度越低[48]。在前人研究中,在苹果盛花期或果实发育早期施用CTK及赤霉素类调节剂,显著提升了果实质量并促进了果实纵径延长[49]。冀泽宇等[50]研究发现,外源多巴胺可以提升霜霉病胁迫下黄瓜的果实纵横径与单瓜质量。本研究结果和前人研究结果一致,在本试验中,不同浓度多巴胺处理提升了阳光玫瑰葡萄成熟期果实的纵横径、单粒质量以及硬度,表明多巴胺的应用对提高葡萄果实的品质具有积极作用,有助于提升其市场竞争力和消费者满意度。
鲜食葡萄的营养也是衡量其品质的重要指标,果农除了追求高产高品相外,还应追求健康良好的营养价值。其中,可溶性固形物和可滴定酸含量及固酸比等是衡量果实品质的重要指标[51],植株通过激素含量的动态变化来调控果实的生长发育进程,进而影响可溶性固形物与可滴定酸含量。本研究结果表明,多巴胺处理提高了阳光玫瑰葡萄果实可溶性固形物含量,降低了可滴定酸含量。这与前人在苹果上的研究结果一致[8]。葡萄果实中可溶性糖与维生素C含量在一定程度上影响着果实的品质。在前人的研究中,外源多巴胺提升了苯丙酸胁迫下黄瓜的可溶性糖和维生素C 含量[52],与本研究结果一致:不同浓度多巴胺处理均提升了葡萄果实可溶性糖和维生素C 含量,多巴胺的应用显示出在增强葡萄营养品质方面的潜力。
果实中酚类物质是一类重要的营养成分,能够中和体内自由基,从而减少氧化应激对细胞造成的损害,在保护健康、预防疾病等方面发挥着重要作用。酚类物质有效成分主要是酚类化合物,包含单宁类、花色苷类以及黄酮类等。在植物中,酚类物质含量会受多种因素影响,如外界环境、栽培管理措施及品种差异等[53]。花青素是一种存在于果皮中的水溶性天然色素,是类黄酮化合物之一。类黄酮是葡萄中最多的一种次生代谢产物,对促进生长发育和提高果实品质都有重大作用[54]。本研究结果表明,多巴胺处理对阳光玫瑰葡萄果皮总酚含量无显著影响;不同浓度多巴胺处理均显著降低了果皮单宁含量,显著提升了总类黄酮含量;而果皮花青素含量在较高浓度(100 μmol·L-1和150 μmol·L-1)多巴胺处理后显著上升。说明多巴胺可以通过提高果实类黄酮和可溶性糖含量,进而改善果实品质[55]。
葡萄果实中糖组分及其含量很大程度影响果实的品质和风味[56],糖不仅能作为基础能源物质供植株生长发育[57],还可用作次生代谢物质的合成原料,改善果实品质[58]。糖分累积是植物叶片将光合产物通过韧皮部运送至果实后通过蔗糖代谢的过程[59]。被输入到葡萄果实中的糖分主要有果糖、葡萄糖和蔗糖,对葡萄果实品质构成有关键作用[60]。植物坐果及其发育受源库互作影响,调节碳水化合物分配,从而调控植物产量与果实品质[61]。王西成等[62]研究表明,随着葡萄果实的逐渐成熟,果糖、葡萄糖和蔗糖含量也随之提高。本研究发现,阳光玫瑰葡萄成熟期果实的糖分积累以果糖、葡萄糖为主,而蔗糖积累相对较少,这种现象可能源于蔗糖本身的低积累量加之受到糖代谢相关酶的调控。先前的研究已经证实,外源多巴胺能够促进黄瓜果实果糖、葡萄糖和蔗糖的积累[50]。本试验结果与之相一致:不同浓度多巴胺处理提高了阳光玫瑰葡萄成熟期果实中果糖、葡萄糖和蔗糖含量,表明多巴胺处理可以促进果实糖分的积累。同时说明了多巴胺可以通过调节植物叶片的组织结构和光合作用效率等,增强植物对有机物的合成及营养物质的吸收能力,进而提高果实的整体品质。这些发现进一步证实了多巴胺在植物生长发育及果实品质形成中的积极作用,为葡萄和其他作物的优质生产提供了新的策略和理论依据。
4 结 论
喷施多巴胺可以增加阳光玫瑰葡萄叶片质量,增强其光合性能,进而提高果实品质,以100 μmol·L-1多巴胺处理效果最佳。该研究对鲜食葡萄的生产具有一定的指导意义。
[1] 尹启源,刘兰兰,王志奎,李红伟.果树施肥技术[J].现代农村科技,2023(10):78-79.YIN Qiyuan,LIU Lanlan,WANG Zhikui,LI Hongwei. Fruit tree fertilization techniques[J]. Modern Rural Science and Technology,2023(10):78-79.
[2] 郭之燕,邓全恩,罗红,段洪浪,崔雍,赵永菊,王港,高超.贵州省2 个主栽花椒品种光合特性的比较[J]. 经济林研究,2023,41(1):196-206.GUO Zhiyan,DENG Quan’en,LUO Hong,DUAN Honglang,CUI Yong,ZHAO Yongju,WANG Gang,GAO Chao.Comparison of photosynthetic characteristics of two major Zanthoxylum bungeanum cultivars in Guizhou province[J]. Non-wood Forest Research,2023,41(1):196-206.
[3] 罗孟容,梁文斌,杨艳,汤玉喜,黎蕾,李永进,张金贵.干旱胁迫对栀子光合作用及叶绿体超微结构的影响[J].经济林研究,2021,39(3):165-174.LUO Mengrong,LIANG Wenbin,YANG Yan,TANG Yuxi,LI Lei,LI Yongjin,ZHANG Jingui.Effect of drought stress on photosynthesis and chloroplast ultrastructure of Gardenia jasminoides[J].Non-wood Forest Research,2021,39(3):165-174.
[4] 王珍,韩超,廖新成.多巴胺含磷衍生物的合成及表征[J].郑州大学学报(理学版),2009,41(1):112-115.WANG Zhen,HAN Chao,LIAO Xincheng.Synthesis and structure characterization of phosphorylated dopamine derivatives[J].Journal of Zhengzhou University (Natural Science Edition),2009,41(1):112-115.
[5] KULMA A,SZOPA J. Catecholamines are active compounds in plants[J].Plant Science,2007,172(3):433-440.
[6] LIANG B W,GAO T T,ZHAO Q,MA C Q,CHEN Q,WEI Z W,LI C Y,LI C,MA F W. Effects of exogenous dopamine on the uptake,transport,and resorption of apple ionome under moderate drought[J].Frontiers in Plant Science,2018,9:755.
[7] LI C,SUN X K,CHANG C,JIA D F,WEI Z W,LI C Y,MA F W. Dopamine alleviates salt-induced stress in Malus hupehensis[J].Physiologia Plantarum,2015,153(4):584-602.
[8] 赵开.外源褪黑素和多巴胺对苹果果实生长发育的影响[D].杨凌:西北农林科技大学,2021.ZHAO Kai. Effects of exogenous melatonin and dopamine on fruit growth and development of apple[D]. Yangling:Northwest A&F University,2021.
[9] ENDRESS R,JÄGER A,KREIS W. Catecholamine biosynthesis dependent on the dark in betacyanin-forming Portulaca callus[J].Journal of Plant Physiology,1984,115(4):291-295.
[10] 梁博文.多巴胺和褪黑素对干旱和养分胁迫下苹果矿质养分吸收的调控研究[D].杨凌:西北农林科技大学,2018.LIANG Bowen.Regulatory function of dopamine and melatonin on mineral nutrient uptake in Malus under drought and nutrient stresses[D].Yangling:Northwest A&F University,2018.
[11] 王改晴.多巴胺预处理对西瓜干旱胁迫的缓解效应研究[D].杨凌:西北农林科技大学,2020.WANG Gaiqing.Study on the alleviating effect of dopamine pretreatment on the drought stress of watermelon[D]. Yangling:Northwest A&F University,2020.
[12] SKIRYCZ A,SWIEDRYCH A,SZOPA J. Expression of human dopamine receptor in potato (Solanum tuberosum) results in altered tuber carbon metabolism[J]. BMC Plant Biology,2005,5:1.
[13] SZOPA J,WILCZYŃSKI G,FIEHN O,WENCZEL A,WILLMITZER L. Identification and quantification of catecholamines in potato plants(Solanum tuberosum)by GC-MS[J].Phytochemistry,2001,58(2):315-320.
[14] GAO T T,ZHANG Z J,LIU X M,WU Q,CHEN Q,LIU Q W,VAN NOCKER S,MA F W,LI C. Physiological and transcriptome analyses of the effects of exogenous dopamine on drought tolerance in apple[J]. Plant Physiology and Biochemistry,2020,148:260-272.
[15] 张振兴,孙锦,郭世荣,童辉.钙对盐胁迫下西瓜光合特性和果实品质的影响[J].园艺学报,2011,38(10):1929-1938.ZHANG Zhenxing,SUN Jin,GUO Shirong,TONG Hui.Effects of supplemental calcium on the photosynthetic characteristics and fruit quality of watermelon under salt stress[J]. Acta Horticulturae Sinica,2011,38(10):1929-1938.
[16] 胡琳莉.铵硝营养缓解小型大白菜幼苗弱光胁迫的生理和分子机制[D].兰州:甘肃农业大学,2016.HU Linli.Physiological and molecular mechanism of the alleviation role of ammonium:nitrate in mini Chinese cabbage under low light intensity[D].Lanzhou:Gansu Agricultural University,2016.
[17] 陈屏昭,杜红波,秦燕芬,杨宏贵,李成树,莫正芬.果蔬品含酸量测定方法的改进及其应用[J].浙江农业科学,2013,54(4):451-453.CHEN Pingzhao,DU Hongbo,QIN Yanfen,YANG Honggui,LI Chengshu,MO Zhengfen. Improvement and application of fruit and vegetable acid content determination method[J]. Journal of Zhejiang Agricultural Sciences,2013,54(4):451-453.
[18] 刘晓涵,陈永刚,林励,庄满贤,方晓娟.蒽酮硫酸法与苯酚硫酸法测定枸杞子中多糖含量的比较[J]. 食品科技,2009,34(9):270-272.LIU Xiaohan,CHEN Yonggang,LIN Li,ZHUANG Manxian,FANG Xiaojuan. Comparison of methods in determination of polysaccharide in Lycium barbarum L.[J]. Food Science and Technology,2009,34(9):270-272.
[19] 胡琼,王森,张自强,邵凤侠,吴毅.不同批次南方鲜食枣枣吊果实品质对比分析[J].中南林业科技大学学报,2017,37(11):63-68.HU Qiong,WANG Sen,ZHANG Ziqiang,SHAO Fengxia,WU Yi. Comparison in quality of southern fresh Zizyphus jujube in different batches[J]. Journal of Central South University of Forestry&Technology,2017,37(11):63-68.
[20] 王洪丽,张彧,韩洋,管玉格,谢婷婷.Folin-Ciocalteu 比色法测定未成熟黄瓜中的总酚含量[J].食品工业,2015,36(9):262-266.WANG Hongli,ZHANG Yu,HAN Yang,GUAN Yuge,XIE Tingting. Determination of the total polyphenol in immature cucumber by folin-ciocalteu colorimetric method[J]. The Food Industry,2015,36(9):262-266.
[21] 耿娜娜,李学英,顾丁,刘林.Folin-Denis 分光光度法测定五倍子中单宁酸的含量[J].安徽农业科学,2013,41(29):11848-11850.GENG Nana,LI Xueying,GU Ding,LIU Lin. Determination of tannic acid content in gallnut by folin-denis spectrophotometry[J]. Journal of Anhui Agricultural Sciences,2013,41(29):11848-11850.
[22] 王艺菲,辛秀兰,陈亮,霍俊伟.pH 示差法测定不同种类蓝果忍冬总花色苷含量[J].食品研究与开发,2014,35(7):75-78.WANG Yifei,XIN Xiulan,CHEN Liang,HUO Junwei.Total anthocyanins content in different species of Lonicera cearulea Linn. by pH-differential spectrophotometry[J]. Food Research and Development,2014,35(7):75-78.
[23] 刘政海,李六林,董志刚,谭伟,李晓梅,唐晓萍.梅鹿辄葡萄4个营养系果实酚类物质变化研究[J].中国酿造,2017,36(7):114-118.LIU Zhenghai,LI Liulin,DONG Zhigang,TAN Wei,LI Xiaomei,TANG Xiaoping. Changes of phenolic compounds in four clones of Merlot grape[J].China Brewing,2017,36(7):114-118.
[24] 贺雅娟,马宗桓,韦霞霞,李玉梅,李彦彪,马维峰,丁孙磊,毛娟,陈佰鸿.黄土高原旱塬区不同品种苹果果实糖及有机酸含量比较分析[J].食品工业科技,2021,42(10):248-254.HE Yajuan,MA Zonghuan,WEI Xiaxia,LI Yumei,LI Yanbiao,MA Weifeng,DING Sunlei,MAO Juan,CHEN Baihong. Comparative analysis of sugar and organic acid contents of different apple cultivars in dryland of Loess Plateau[J].Science and Technology of Food Industry,2021,42(10):248-254.
[25] 李彦彪,马维峰,贾进,牟德生,李生保,毛娟.河西走廊不同产地‘赤霞珠’酿酒葡萄果实品质评价[J]. 西北植物学报,2021,41(5):817-827.LI Yanbiao,MA Weifeng,JIA Jin,MU Desheng,LI Shengbao,MAO Juan. Evaluation on fruit quality of Cabernet Sauvignon wine grapes from different producing areas in Hexi Corridor[J].Acta Botanica Boreali-Occidentalia Sinica,2021,41(5):817-827.
[26] 陈雪峰,景晨娟,赵习平,武晓红.植物叶片组织结构在抗逆研究中的应用进展[J].河北农业科学,2018,22(3):50-53.CHEN Xuefeng,JING Chenjuan,ZHAO Xiping,WU Xiaohong. Advances in application of plant leaf tissue structure in the research of stress tolerance[J]. Journal of Hebei Agricultural Sciences,2018,22(3):50-53.
[27] 郭学民,刘建珍,翟江涛,肖啸,吕亚媚,李丹丹,裴士美,张立彬.16 个品种桃叶片解剖结构与树干抗寒性的关系[J].林业科学,2015,51(8):33-43.GUO Xuemin,LIU Jianzhen,ZHAI Jiangtao,XIAO Xiao,LÜ Yamei,LI Dandan,PEI Shimei,ZHANG Libin.Relationship between leaf anatomical structure and trunk cold resistance of 16 peach cultivars[J].Scientia Silvae Sinicae,2015,51(8):33-43.
[28] 张钢.国外木本植物抗寒性测定方法综述[J].世界林业研究,2005,18(5):14-20.ZHANG Gang. Review on methods for measuring frost hardiness in woody plants abroad[J].World Forestry Research,2005,18(5):14-20.
[29] 李国华,徐涛,陈国云,岳海,梁国平.10 个品种澳洲坚果叶片解剖学的比较研究[J]. 热带作物学报,2009,30(10):1437-1441.LI Guohua,XU Tao,CHEN Guoyun,YUE Hai,LIANG Guoping.Anatomical structure of leaves of 10 Macadamia cultivars[J].Chinese Journal of Tropical Crops,2009,30(10):1437-1441.
[30] SHEN Z H,CHENG X J,LI X,DENG X Y,DONG X X,WANG S M,PU X Z.Effects of silicon application on leaf structure and physiological characteristics of Glycyrrhiza uralensis Fisch.and Glycyrrhiza inflata Bat.under salt treatment[J].BMC Plant Biology,2022,22(1):390.
[31] SINGH J,PANDEY P,JAMES D,CHANDRASEKHAR K,ACHARY V M,KAUL T,TRIPATHY B C,REDDY M K. Enhancing C3 photosynthesis:An outlook on feasible interventions for crop improvement[J]. Plant Biotechnology Journal,2014,12(9):1217-1230.
[32] 王瑞,陈永忠,杨小胡,何高峰,李靖.油茶光合作用及其影响因素研究进展[J].经济林研究,2007,25(2):78-83.WANG Rui,CHEN Yongzhong,YANG Xiaohu,HE Gaofeng,LI Jing.Literature review of researches on photosynthesis in Camellia oleifera L. and its affecting factors[J]. Nonwood Forest Research,2007,25(2):78-83.
[33] 刘兆新,刘妍,刘婷如,何美娟,姚远,杨坚群,甄晓宇,栗鑫鑫,杨东清,李向东.控释复合肥对麦套花生光系统Ⅱ性能及产量和品质的调控效应[J].作物学报,2017,43(11):1667-1676.LIU Zhaoxin,LIU Yan,LIU Tingru,HE Meijuan,YAO Yuan,YANG Jianqun,ZHEN Xiaoyu,LI Xinxin,YANG Dongqing,LI Xiangdong. Effect of controlled-release compound fertilized on photosystem Ⅱperformance,yield and quality of intercropped peanut with wheat[J]. Acta Agronomica Sinica,2017,43(11):1667-1676.
[34] 陆志峰,鲁剑巍,潘勇辉,鲁飘飘,李小坤,丛日环,任涛.钾素调控植物光合作用的生理机制[J]. 植物生理学报,2016,52(12):1773-1784.LU Zhifeng,LU Jianwei,PANYonghui,LU Piaopiao,LI Xiaokun,CONG Rihuan,REN Tao. Physiological mechanisms in potassium regulation of plant photosynthesis[J].Plant Physiology Journal,2016,52(12):1773-1784.
[35] 陈莹.多巴胺对盐胁迫下苹果根系发育及生理特性的影响[D].泰安:山东农业大学,2022.CHEN Ying.Effects of dopamine on root development and physiological characteristics of apple under salt stress[D]. Tai’an:Shandong Agricultural University,2022.
[36] 李超.外源褪黑素和多巴胺对苹果抗旱耐盐性的调控功能研究[D].杨凌:西北农林科技大学,2016.LI Chao. Regulatory function of exogenousmelatonin and dopamine on salt and drought tolerance in Malus[D]. Yangling:Northwest A&F University,2016.
[37] 唐仲文. 多巴胺在调控苹果重金属镉和铜胁迫中的功能研究[D].杨凌:西北农林科技大学,2022.TANG Zhongwen. Function of dopamine in regulating apple heavy metal cadmium and copper stress[D]. Yangling:Northwest A&F University,2022.
[38] KANAZAWA K,SAKAKIBARA H.High content of dopamine,a strong antioxidant,in Cavendish banana[J].Journal of Agricultural and Food Chemistry,2000,48(3):844-848.
[39] 徐兴利,金则新,何维明,王兴龙,车秀霞.不同增温处理对夏蜡梅光合特性和叶绿素荧光参数的影响[J].生态学报,2012,32(20):6343-6353.XU Xingli,JIN Zexin,HE Weiming,WANG Xinglong,CHE Xiuxia. Effects of different day/night warming on the photosynthetic characteristics and chlorophyll fluorescence parameters of Sinocalycanthus chinensis seedlings[J]. Acta Ecologica Sinica,2012,32(20):6343-6353.
[40] 王义婧,李岩,徐胜,何兴元,陈玮,吴娴.高浓度臭氧对美国薄荷(Monarda didyma L.)叶片光合及抗性生理特征的影响[J].生态学杂志,2019,38(3):696-703.WANG Yijing,LI Yan,XU Sheng,HE Xingyuan,CHEN Wei,WU Xian.Effects of elevated ozone concentrations on photosynthetic and resistant physiological characteristics of Monarda didyma L. leaves[J]. Chinese Journal of Ecology,2019,38(3):696-703.
[41] 齐晓媛,王文莉,胡少卿,刘梦雨,郑成淑,孙宪芝.外源褪黑素对高温胁迫下菊花光合和生理特性的影响[J].应用生态学报,2021,32(7):2496-2504.QI Xiaoyuan,WANG Wenli,HU Shaoqing,LIU Mengyu,ZHENG Chengshu,SUN Xianzhi.Effects of exogenous melatonin on photosynthesis and physiological characteristics of Chrysanthemum seedlings under high temperature stress[J]. Chinese Journal of Applied Ecology,2021,32(7):2496-2504.
[42] 王晓芳,相昆,孙岩,崔冬冬,亓雪龙,王来平,翟衡,李勃.叶面肥对‘巨峰’葡萄光氧化胁迫的缓解效应[J].果树学报,2017,34(3):312-320.WANG Xiaofang,XIANG Kun,SUN Yan,CUI Dongdong,QI Xuelong,WANG Laiping,ZHAI Heng,LI Bo.Protective effects of foliar fertilizer on‘Kyoho’grape under photooxidation[J].Journal of Fruit Science,2017,34(3):312-320.
[43] LIU X M,GAO T T,ZHANG Z J,TAN K X,JIN Y B,ZHAO Y J,MA F W,LI C.The mitigation effects of exogenous dopamine on low nitrogen stress in Malus hupehensis[J]. Journal of Integrative Agriculture,2020,19(11):2709-2724.
[44] 蔡倩,白一光.果粮间作对仁用杏生长及叶绿素荧光参数的影响[J].农业科技与装备,2020(6):1-4.CAI Qian,BAI Yiguang. Effect of fruit-grain intercropping on growth and chlorophyll fluorescence parameters of kernel-apricot[J].Agricultural Science &Technology and Equipment,2020(6):1-4.
[45] 王文林,万寅婧,刘波,王国祥,唐晓燕,陈昕,梁斌,庄巍.土壤逐渐干旱对菖蒲生长及光合荧光特性的影响[J].生态学报,2013,33(13):3933-3940.WANG Wenlin,WAN Yinjing,LIU Bo,WANG Guoxiang,TANG Xiaoyan,CHEN Xin,LIANG Bin,ZHUANG Wei.Influence of soil gradual drought stress on Acorus calamus growth and photosynthetic fluorescence characteristics[J].Acta Ecologica Sinica,2013,33(13):3933-3940.
[46] 卢广超,许建新,薛立,张柔,吴彩琼,邵怡若.低温胁迫对4 种幼苗的叶绿素荧光特性的影响[J].中南林业科技大学学报,2014,34(2):44-49.LU Guangchao,XU Jianxin,XUE Li,ZHANG Rou,WU Caiqiong,SHAO Yiruo.Effects of low temperature stress on chlorophyll fluorescence characteristics of four types of tree species seedlings[J]. Journal of Central South University of Forestry &Technology,2014,34(2):44-49.
[47] JI Z Y,LIU Z Y,HAN Y Y,SUN Y. Exogenous dopamine promotes photosynthesis and carbohydrate metabolism of downy mildew-infected cucumber[J].Scientia Horticulturae,2022,295:110842.
[48] 赵邯,刘春菊,李越,李大婧,李斌,牛丽影,肖亚冬,于蕊.果蔬成分与细胞结构对其质地特性的影响[J].核农学报,2024,38(5):931-942.ZHAO Han,LIU Chunju,LI Yue,LI Dajing,LI Bin,NIU Liying,XIAO Yadong,YU Rui. Effects of composition and cell structure on textural characteristics of fruits and vegetables[J]. Journal of Nuclear Agricultural Sciences,2024,38(5):931-942.
[49] 闫国华,甘立军,孙瑞红,张利华,周燮.赤霉素和细胞分裂素调控苹果果实早期生长发育机理的研究[J].园艺学报,2000,27(1):11-16.YAN Guohua,GAN Lijun,SUN Ruihong,ZHANG Lihua,ZHOU Xie. A study on the mechanisms of exo gibberllins and cytokinins in the growth regulation of young apple fruit[J].Acta Horticulturae Sinica,2000,27(1):11-16.
[50] 冀泽宇. 外源多巴胺对黄瓜霜霉病的缓解效应及其机理研究[D].杨凌:西北农林科技大学,2022.JI Zeyu. Alleviation effect and mechanism of exogenous dopamine on cucumber downy mildew[D].Yangling:Northwest A&F University,2022.
[51] 郭欣欣,舒群,刘春秀,马伟荣,何英云.云南14 个砂梨品种(资源)果实品质差异的综合评价[J].中国南方果树,2023,52(6):162-165.GUO Xinxin,SHU Qun,LIU Chunxiu,MA Weirong,HE Yingyun. Comprehensive evaluation of fruit quality differences among 14 varieties of Pyrus pyrifolia in Yunnan[J].South China Fruits,2023,52(6):162-165.
[52] 陆心宇.外源多巴胺对苯丙酸胁迫下黄瓜抑制作用的缓解机理研究[D].杨凌:西北农林科技大学,2021.LU Xinyu. Study on the alleviating mechanism of the inhibitory effect of exogenous dopamine on phenylpropionic acid stress in cucumber[D].Yangling:Northwest A&F University,2021.
[53] 张娟,王晓宇,田呈瑞,赵旗峰,马小河,唐晓萍,马婷婷,马锦锦.基于酚类物质的酿酒红葡萄品种特性分析[J].中国农业科学,2015,48(7):1370-1382.ZHANG Juan,WANG Xiaoyu,TIAN Chengrui,ZHAO Qifeng,MA Xiaohe,TANG Xiaoping,MA Tingting,MA Jinjin.Analysis of phenolic compounds in red grape varieties[J].Scientia Agricultura Sinica,2015,48(7):1370-1382.
[54] 卢素文,郑暄昂,王佳洋,房经贵. 葡萄类黄酮代谢研究进展[J].园艺学报,2021,48(12):2506-2524.LU Suwen,ZHENG Xuan’ang,WANG Jiayang,FANG Jinggui. Research progress on the metabolism of flavonoids in grape[J].Acta Horticulturae Sinica,2021,48(12):2506-2524.
[55] WANG Y P,ZHANG Z J,WANG X C,YUAN X,WU Q,CHEN S Y,ZOU Y J,MA F W,LI C.Exogenous dopamine improves apple fruit quality via increasing flavonoids and soluble sugar contents[J].Scientia Horticulturae,2021,280:109903.
[56] 周敏.刺葡萄矿质营养变化规律与钾对果实糖分积累的影响研究[D].长沙:湖南农业大学,2017.ZHOU Min. Research on nutrients change rule of Vitis davidii Foёx.and influence of potassium to fruit sugar accumulation[D].Changsha:Hunan Agricultural University,2017.
[57] LECOURIEUX F,KAPPEL C,LECOURIEUX D,SERRANO A,TORRES E,ARCE-JOHNSON P,DELROT S.An update on sugar transport and signalling in grapevine[J].Journal of Experimental Botany,2014,65(3):821-832.
[58] ANGELES-NÚÑEZ J G,TIESSEN A.Arabidopsis sucrose synthase 2 and 3 modulate metabolic homeostasis and direct carbon towards starch synthesis in developing seeds[J]. Planta,2010,232(3):701-718.
[59] 李利梅,王秀芹,杨培培,黄卫东,战吉宬.赤霞珠葡萄果实糖积累与糖代谢相关酶的关系[J].中外葡萄与葡萄酒,2011(7):24-27.LI Limei,WANG Xiuqin,YANG Peipei,HUANG Weidong,ZHAN Jicheng. Relationship between sugar accumulation and sugar metabolism related enzymes during Cabernet Sauvignon berries development[J]. Sino-Overseas Grapevine &Wine,2011(7):24-27.
[60] 闫梅玲,王振平,范永,周明,孙盼,单守明,代红军.蔗糖代谢相关酶在赤霞珠葡萄果实糖积累中的作用[J]. 果树学报,2010,27(5):703-707.YAN Meiling,WANG Zhenping,FAN Yong,ZHOU Ming,SUN Pan,SHAN Shouming,DAI Hongjun.Roles of sucrose-metabolizing enzymes in accumulation of sugars in Cabernet Sauvignon grape fruit[J].Journal of Fruit Science,2010,27(5):703-707.
[61] WHITE A C,ROGERS A,REES M,OSBORNE C P. How can we make plants grow faster? A source- sink perspective on growth rate[J].Journal of Experimental Botany,2016,67(1):31-45.
[62] 王西成,吴伟民,赵密珍,钱亚明,王壮伟.NAA 对葡萄果实中糖酸含量及相关基因表达的影响[J].园艺学报,2015,42(3):425-434.WANG Xicheng,WU Weimin,ZHAO Mizhen,QIAN Yaming,WANG Zhuangwei.Effect of NAA treatment on sugar acid content and related gene expression in grape berries[J].Acta Horticulturae Sinica,2015,42(3):425-434.