花色苷是花色素与糖以糖苷键结合而成的酚类化合物,主要呈现红色、紫色或蓝色,是葡萄与葡萄酒的重要呈色物质。花色苷根据结构可分为基本花色苷和经过修饰的衍生物(糖基化花色苷、甲基化花色苷和酰基化花色苷),在葡萄和葡萄酒中,酰基化花色苷因具有较高的稳定性而发挥着关键作用[1-2]。欧亚种葡萄中主要含有花青素、花翠素、甲基花青素、甲基花翠素和二甲花翠素五种花色苷[3]。葡萄果实中花色苷的组分及含量不仅受到基因型、激素水平的影响,还受到光照、温度、栽培条件等环境因素的影响[4-5]。有研究表明,不同光照条件,影响葡萄果实花色苷的合成,进而影响果实着色[6-7]。目前则通过遮阳网覆盖、去除叶片以及铺设反光膜等方法研究果实颜色的变化[8-9]。研究发现,鲜食葡萄栽培中用遮阳网可对葡萄果实大小、糖和酸含量产生影响,进而调节葡萄果实的成熟期[10-11]。赤霞珠葡萄经遮光处理后,可溶性固形物、总糖和总花色苷含量显著下降,总酸及酚类物质含量则上升,适当地遮光,可延迟采收期,有效提升葡萄品质[12]。酿酒葡萄通过遮阳处理,可以改善葡萄生长微气候,显著减缓葡萄果实中糖分的迅速增加和有机酸的快速分解,增加葡萄和葡萄酒中多酚和单宁的浓度,减少花色苷和类黄酮的浓度;在果实成熟期间,遮光处理会干扰光合作用,从而导致与糖类代谢相关的酶基因表达发生变化[13]。研究表明,通过不同温度和光照处理,在较低温度和充足光照条件下,花色苷的合成得到显著增强;而在高温环境或无光条件下,花色苷合成酶基因的活性受到明显抑制,环境条件和遗传因素共同调控着花色苷的合成[14]。
宁夏贺兰山东麓金山产区昼夜温差大,光照强、光照时间长,导致葡萄过快成熟、糖分高、酸度低,花色苷快速积累又迅速降解,酿造的葡萄酒酒精度较高,色泽凋零较快等问题日渐突出。因此,为有效降低光照度和光照时间,提升葡萄果实花色苷组分及结构稳定性,缓解色泽过快凋零的问题,提升葡萄及葡萄酒品质,笔者在本研究中选取马瑟兰葡萄,在转色期至成熟期进行遮阳处理,探究不同时期遮阳对花色苷组分积累及合成相关基因表达量的影响,以期为有效提高花色苷结构稳定性,改善葡萄及葡萄酒的色泽,提升品质提供理论依据。
1 材料和方法
1.1 材料
供试品种为贺兰山东麓金山产区夏木酒庄(38°42′49″N,106°4′11″E)葡萄园内10年生酿酒葡萄马瑟兰(Vitis vinifera‘Marselan’),树势中庸,株行距为0.7 m×3.5 m,南北行向,砾石土壤,透气性好。遮阳网为两针普通型,黑色单层,遮光率为50%,规格为10 m×25 m。设置3个处理,以正常生长不遮阳为空白对照(CK),T1 为转色初期至采收期树体顶端遮阳(7月25日至9月19日:花后50~106 d),T2为完全转色期至采收期树体顶端遮阳(8 月8 日至9 月19日:花后64~106 d),每个处理设置3次重复。
1.2 方法
1.2.1 样品采集与处理 处理后每隔7 d 采集1 次样品,至花后106 d 果实采收,T1 共取样8 次(花后57~106 d),T2共取样6次(花后71~106 d)。采样时兼顾果穗的阴、阳面,果穗的上、中、下部随机选取果粒饱满、大小均匀的果实300粒,带回实验室用液氮速冻,置于冰箱(-80 ℃)保存备用。
1.2.2 理化指标检测 样品带回实验室后,立即进行可溶性固形物、可滴定酸和还原糖含量等理化指标检测。从不同处理的果实样品中随机取出约40粒,分别榨成匀浆、过滤,用手持糖度计测定可溶性固形物含量;采用斐林试剂法测定还原糖含量;采用指示剂滴定法,以酒石酸作为基准物质,测定样品可滴定酸含量[15]。
1.2.3 花色苷定性定量分析检测 花色苷提取:参考王舒伟等[16]的方法,提取花色苷过0.22 μm有机相滤膜。应用超高效液相色谱(UPLC)、光电二极管阵列检测器(PDA)和电喷雾离子化质谱(ESI)综合分析技术(UPLC-PDA-MS/MS-ESI),上样进行分析。
花色苷检测:葡萄果实中花色苷类物质测定方法参照王博[17]和Liang等[18]的略有改动。质谱条件,电喷雾(ESI)离子源,多反应监测(multiple reaction monitoring,MRM)模式,离子源温度为150 ℃,脱溶剂气温度为400 ℃,脱溶剂气的流量为800 L·h-1,锥孔气的流速为50 L·h-1,以及碰撞气(通常使用高纯氩气)的流速为0.14 mL·min-1。色谱条件,色谱柱为Waters ACQUITY UPLC® HSS T3(2.1 mm×150 mm,1.8 μm);乙腈作为流动相A,5%甲酸溶液作为流动相B,进样量设定为2.0 μL,流速控制在0.3 mL·min-1,保持柱温40 ℃;洗脱梯度:0~1.0 min(5%~10%A),1.0~16 min(10%~25%A),16~18 min(25%~40%A),18~19 min(40%~100%A),20 min回到初始状态,平衡10 min。检测器波长设置为520 nm。
1.2.4 转录组分析 RNA 提取、建库:使用植物RNA提取试剂盒从葡萄中分离出总RNA,参考韦伟等[19]的方法,通过Nanodrop 2000 仪器测量RNA 样品的浓度与纯度,利用琼脂糖凝胶电泳技术评估RNA 的完整性,并借助Agilent 5300 设备计算RNA完整性数值(RIN)。利用Oligo(dT)磁珠法纯化总RNA 的mRNA,并将mRNA 进行随机打断,形成片段,以mRNA片段为模板合成cDNA,为了适合后续测序分析,将双链cDNA 的黏性末端修复为平末端。构建的cDNA 文库在Illumimna Novaseq 6000平台(上海美吉生物医药科技有限公司)进行测序。测序数据分析:对原始测序数据进行过滤得到高质量的测序数据,使用Hisat2 软件与参考基因组进行比对,并评估结果。使用RSEM 软件对基因的表达水平进行定量分析,利用DESeq2软件,筛选标准为表达差异倍数|log2FC|≧l 和校正过的P 值(Padjust<0.05),进行基因差异表达分析,筛选出的差异表达基因进行KEGG富集分析。
1.2.5 基因表达量分析 qRT-PCR 验证:使用MJZol total RNA extraction kit(上海美吉生物医药科技有限公司)试剂盒提取总RNA,使用HiScript Q RT SuperMix for qPCR(+gDNA wiper)(南京诺唯赞生物科技有限公司)试剂盒反转录为cDNA,使用ChamQ SYBR Color qPCR Master Mix(2X)(南京诺唯赞生物科技有限公司)试剂盒,用荧光定量PCR仪(ABI7300 型,美国)进行qRT-PCR 检测,选用GAPDH 基因作为内参基因。优化后的条件为预变性95 ℃5 min,变性95 ℃30 s,退火50~55 ℃30 s,35个循环,延伸72 ℃1 min。运用2-△△CT算法计算相对表达量。特异性引物信息见表1。
表1 实时定量PCR 引物序列
Table 1 Primer sequences of real-time quantitative PCR

基因名称Gene name PAL 4CL CHI CHS CHS3 DFR F3H F3'5'H F3'H LDOX UFGT MYB5b MYB90 OMT GST4 GAPDH序列号Accession No.JN858957 KJ013409 KP658975 NM_001280950 AB004547 MT198808 OQ263176 MH618646 MT198816 MW752104 LN736329 NM_001280925 ON009062 NM_001281118 NM_001280940 XM_002263109正向引物(5'-3')Forward primer sequence(5'-3')ACTGCTGTTGGGTCTGGC TGAGGCCCTTCTGGTGAG GGCAAGACTGTGGAGGAG AAGGAAAGGGCACCACAG ACACGTCTTGAGCGAGTATGG TATTGAAGGGATGTTGGG AAGTTGCTGGAGGTGTTGT AACGGCTACTACATCCCA GGCGGGTGATGTTAGGCA TCCACCTCATCTTCCCTG CGGAAACCTAAACTCGCTCTT TCCGAGAACCCATAAGCC GACCCAAGAAGAGGATGT AAGATGGCAAGTATCACGG TGGAGGAGAAAGCGGTAG TTAGGAACCCAGAGGAGA反向引物(5'-3')Reverse primer sequence(5'-3')GAGGGCGTATCGGTCTTG TTCCCTGATGGTGACTTTGG TCTGAATACTGGCGACCC AGCAGCCATTCCCATCTT GTGAGCCCTGGTCCGAAA AGAGTCGGTATGATAGTGATG CTTGAGTCCGAGGGTGAG CCAGCACTATTCCCATTCT ACGCTCGGAACCAGCAGA CATCCCACCAACTTCCTT TGTCGTGACGGTGCCAAA GGTGCCACAGTTAAGGTCA CTACCCGCAATCAAGGAC CCAGAGGGTGTTGTCGTAG GATGACTCAGATCAGCGAGA GCAAGGCAGTTTGTAGTG
1.3 数据处理
采用Microsoft office 2013 进行数据处理,使用Origin 2024 绘图。利用SPSS 17.0 统计软件进行显著性和相关性分析,采用单因素方差分析法(oneway ANOVA)和Duncan法进行方差分析。
2 结果与分析
2.1 遮阳对葡萄果实品质的影响
由表2 可以看出,随着果实逐渐成熟所有处理的可溶性固形物含量(w,后同)均呈上升趋势且在采收期达到最大值。对照为31.47%,T1为27.53%,T2为29.13%,差异达显著水平。遮阳可明显降低果实可溶性固形物含量。
表2 不同时期遮阳处理对葡萄可溶性固形物含量的影响
Table 2 The effect of shading treatment at different stages on the soluble solids content of grape%

注:同一列不同小写字母表示差异达到显著水平(p<0.05)。下同。
Note:Different small letters in the same column indicate significant differences(p<0.05).The same below.
处理Treatments对照CK T1 T2花后时间Time after anthesis/d 57 14.00±0.29 11.93±0.65-106 31.47±0.05 a 27.53±0.05 c 29.13±0.05 b 64 20.80±0.08 17.47±0.05-71 21.30±0.00 b 20.43±0.05 c 21.90±0.00 a 78 24.83±0.47 b 22.63±0.06 c 25.77±0.09 a 85 27.67±0.05 b 24.60±0.08 c 28.47±0.05 a 92 27.23±0.05 b 24.50±0.00 c 27.43±0.09 a 99 29.90±0.00 a 25.83±0.05 c 27.70±0.00 b
随着果实转色至成熟各处理的滴定酸含量逐渐减少(表3),其中花后57~71 d,正值果实转色初期至完全转色期阶段,此阶段的各处理滴定酸含量(ρ,后同)迅速下降,对照由19.00 g·L-1降为4.19 g·L-1,T1由19.56 g·L-1降为4.38 g·L-1。果实成熟期对照滴定酸含量为3.06 g·L-1,T1为3.19 g·L-1,T2为3.16 g·L-1,说明遮阳处理可减缓成熟期果实滴定酸含量的下降趋势,各处理差异不显著。
表3 不同时期遮阳处理对葡萄滴定酸含量的影响
Table 3 The effect of shading treatment at different stages on the titratable acid content of grape(g·L-1)

处理Treatments对照CK T1 T2花后时间Time after anthesis/d 57 19.00±0.23 19.56±0.09-64 8.25±0.15 8.81±0.15-71 4.19±0.09 ab 4.38±0.09 a 4.00±0.09 b 78 3.75±0.08 b 4.03±0.08 a 3.41±0.04 c 85 2.59±0.04 c 4.09±0.04 a 3.06±0.09 b 92 2.88±0.09 c 3.94±0.15 a 3.38±0.15 b 99 3.72±0.04 b 4.00±0.09 a 3.13±0.09 c 106 3.06±0.09 a 3.19±0.15 a 3.16±0.04 a
表4 显示,随着果实转色成熟各处理的还原糖含量呈上升趋势,采收期对照还原糖含量达到243.27 g·L-1,T1为214.47 g·L-1,差异显著,说明转色初期对树体进行遮阳处理明显减少了果实还原糖的积累量;T2 为259.02 g·L-1显著高于对照的含量,说明完全转色期对树体进行遮阳可促进果实还原糖的积累。
表4 不同时期遮阳处理对葡萄还原糖含量的影响
Table 4 The effect of shading treatment at different stages on the reducing sugar content of grape(g·L-1)

处理Treatments对照CK T1 T2花后时间Time after anthesis/d 57 115.38±0.91 120.03±1.96-64 190.48±0.99 167.95±2.49-71 197.15±0.61 b 198.96±3.56 b 220.86±1.02 a 78 198.98±4.08 a 193.68±5.10 a 203.43±2.82 a 85 248.72±10.48 a 234.46±4.49 a 249.74±4.66 a 92 240.01±1.57 b 234.44±4.00 b 248.30±2.41 a 99 226.47±3.49 a 219.58±3.74 a 222.43±6.73 a 106 243.27±2.31 b 214.47±6.26 c 259.02±2.62 a
由图1可以看出,随着果实转色成熟,各处理的糖酸比均呈现逐渐上升而后下降又略有上升的变化趋势,且对照和T2处理的糖酸比始终高于T1处理,果实采收期时T2 的糖酸比比T1 提高了21.63%,差异达显著水平;比对照提高了3.23%,差异不显著。

图1 不同时期遮阳处理糖酸比
Fig.1 Sugar acid ratio of shading treatment in different periods
2.2 遮阳处理对葡萄花色苷组分及含量的影响
2.2.1 遮阳处理对马瑟兰葡萄花色苷组分的影响对马瑟兰葡萄果实花后57~106 d 各处理进行花色苷组分检测,对照、T1和T2中检测到的16种花色苷中(表5),其中,花翠素类(Delphinidin,Dp)3 种,花青素类(Cyanidin,Cy)3 种,甲基花翠素类(Petunidin,Pt)3 种,甲基花青素类(Peonidin,Pn)3 种,二甲基花翠素类(Malvidin,Mv)4种,各处理的花色苷种类均一致,由此说明遮阳处理不会改变葡萄果实中花色苷的组成。
表5 葡萄果实中检测到的花色苷
Table 5 Anthocyanins detected in grape

峰Peak 1-1 1-2 1-3 1-4 1-5 3-1 3-2 3-3 3-4 3-5 4-1 4-2 4-3 4-4 4-5-c 4-5-t花色苷Anthocyanins花翠素-3-O-葡萄糖苷Delphinidin 3-O-glucoside花青素-3-O-葡萄糖苷Cyanidin 3-O-glucoside甲基花翠素-3-O-葡萄糖苷Petunidin 3-O-glucoside甲基花青素-3-O-葡萄糖苷Peonidin 3-O-glucoside二甲花翠素-3-O-葡萄糖苷Malvidin 3-O-glucoside花翠素-3-O-(6-O-乙酰)-葡萄糖苷Delphinidin 3-O-(6-O-acetyl)glucoside花青素-3-O-(6-O-乙酰)-葡萄糖苷Cyanidin 3-O-(6-O-acetyl)glucoside甲基花翠素-3-O-(6-O-乙酰)葡萄糖苷Petunidin 3-O-(6-O-acetyl)glucoside甲基花青素-3-O-(6-O-乙酰)葡萄糖苷Peonidin 3-O-(6-O-acetyl)glucoside二甲花翠素-3-O-(6-O-乙酰)葡萄糖苷Malvidin 3-O-(6-O-acetyl)glucoside花翠素-3-O-(6-O-香豆酰)葡萄糖苷Delphinidin 3-O-(6-O-p-coumaryl)glucoside花青素-3-O-(6-O-香豆酰)葡萄糖苷Cyanidin 3-O-(6-O-p-coumaryl)glucoside甲基花翠素-3-O-(6-O-香豆酰)葡萄糖苷Petunidin 3-O-(6-O-p-coumaryl)glucoside甲基花青素-3-O-(6-O-香豆酰)葡萄糖苷Peonidin 3-O-(6-O-p-coumaryl)glucoside二甲花翠素-3-O-(6-O-香豆酰)葡萄糖苷Malvidin 3-O-(c-6-O-p-coumaryl)glucoside二甲花翠素-3-O-(6-O-对香豆酰)葡萄糖苷Malvidin 3-O-(t-6-O-p-coumaryl)glucoside母离子Parent ion/(m/z)465.2 449.2 479.2 463.2 493.2 507.2 491.2 521.2 505.2 535.2 611.2 595.2 625.2 609.2 639.2 639.2子离子Daughter ions/(m/z)303.1 287.1 317.1 301.1 331.1 303.1 287.1 317.1 301.1 331.1 303.1 287.1 317.1 301.1 331.1 331.1
2.2.2 遮阳处理对马瑟兰葡萄花色苷酰化修饰成分相对含量的影响 由表6 可知,在采收期的马瑟兰葡萄中主要检测到的酰化类花色苷为乙酰化类和香豆酰化类2 类。各处理中,酰化修饰成分相对含量在36.06%~43.89%,T2 的酰化类花色苷相对含量最高为43.89%,对照的酰化类花色苷相对含量最低为36.06%。由此说明,转色期遮阳可提高葡萄果实中酰基化花色苷的比例,进而提高花色苷的稳定性。
表6 不同处理马瑟兰葡萄花色苷各种酰化修饰成分相对含量
Table 6 Relative content of various acylation modified components of anthocyanins in different treatments of Marselan grape%

处理Ttreatments对照CK T1 T2乙酰化类Acetylate 16.43 18.70 16.77香豆酰化类Coumarin acylation 19.63 24.02 27.12总酰化类Total acylation 36.06 42.72 43.89非酰化类Non acylation 63.94 57.28 56.11
2.2.3 遮阳处理对马瑟兰葡萄花色苷含量的影响葡萄转色至采收期,马瑟兰葡萄果实中的总花色苷含量呈先上升后下降的波动变化趋势(图2-A),花后99 d 时达到最大,且对照的总花色苷含量显著高于T1(转色初期-采收期对树体顶端遮阳)和T2(完全转色期-采收期对树体顶端遮阳)的总花色苷含量,对照为2.19 mg·g-1,比T1 增加了83.11%,比T2 增加了13.82%。至花后106 d 葡萄采收时总花色苷含量增幅减缓,含量有所下降,此时T2 的总花色苷含量最高,且T2与T1的差异达显著水平,T2与对照差异不显著。

图2 总花色苷含量和5 种花色素类花色苷含量
Fig.2 Total anthocyanin content and anthocyanin content of 5 types of anthocyanins
由图2-B 可知,葡萄果实从转色至采收,花翠素(Dp)含量呈波动变化趋势,对照的Dp 含量在花后99 d 时达到最高,为0.22 mg · g-1,比T1 高了248.44%,比T2 高了13.20%,差异均达显著水平;T1在花后71 d时达到最高,为0.08 mg·g-1,比对照降低了21.90%,比T2 降低了57.07%,且差异达显著水平;T2在花后85 d达到最高,为0.23 mg·g-1,且Dp含量显著高于对照和T1,比对照高了159.77%,比T1高了326.42%。至葡萄采收时,各处理的Dp含量均降低,对照的Dp 含量高于T1 和T2 的,且各处理间差异显著。
葡萄果实从转色至采收,花青素(Cy)含量的变化趋势同Dp相似(图2-C),其中对照的Cy含量在花后99 d 达到最高,为0.03 mg·g-1,比T1 高了350%,差异达显著水平,比T2高了3.85%,差异不显著;T1的Cy含量在花后71 d时达到最高,为0.01 mg·g-1,比T2 降低了48%,且差异达显著水平;T2 在花后85 d时Cy含量达到最高,为0.03 mg·g-1,且Cy含量显著高于对照和T1,比对照高了211.11%,比T2 高了366.67%。葡萄采收时,对照的Cy含量显著高于T1和T2 的Cy 含量,由此说明,遮阳明显抑制了Cy 含量的积累,且T2比T1的抑制作用更显著。
随着葡萄果实转色至采收,对照的甲基花翠素(Pt)含量在花后99 d达到最高,为0.22 mg·g-1,比T1高了200%,比T2高了10.20%,差异达显著水平;T1的Pt含量在花后71 d时达到最高,为0.09 mg·g-1,比对照降低了19.27%,比T2降低了51.65%,差异均达到显著水平;T2 在花后85 d 时Pt 含量达到最高,为0.21 mg·g-1,且Pt含量显著高于对照和T1,比对照高了113.27%,比T2高了254.24%。葡萄采收时,对照的Pt含量显著高于T1、T2的Pt含量,说明遮阳减缓了Pt含量的积累,T1与T2无显著差异(图2-D)。
由图2-E可知,马瑟兰葡萄果实转色至采收,对照的甲基花青素(Pn)含量在花后99 d 达到最高,为0.16 mg·g-1,比T1高了376.67%,比T2高了15.56%,差异均达显著水平;T1的Pn含量在花后106 d时达到最高,为0.06 mg·g-1,比对照降低了16.22%,比T2增加了19.23%,且差异均达显著水平;T2在花后85 d时Pn 含量达到最高,为0.14 mg·g-1,且Pn 含量显著高于对照和T1,比对照高114.06% ,比T2 高341.94%。葡萄采收时,对照的Pn 含量显著高于T1、T2 的Pn 含量,由此说明,遮阳明显抑制了Pn 含量的积累,且T2比T1的抑制作用更显著。
葡萄果实转色至采收期,二甲花翠素类(Mv)含量逐渐增加(图2-F),对照、T1和T2的Mv含量均在花后99 d达到最大,且对照的Mv含量最高,为1.59 mg·g-1,比T1的Mv含量高55.57%,比T2高14.19%,差异均达到显著水平。葡萄采收时,各处理的Mv 含量均有所下降,T2的Mv含量高于对照和T1的Mv含量,且有显著差异,对照和T1无显著差异。
2.3 遮阳处理对马瑟兰葡萄花色苷转录组的影响
在Illumimna Novaseq 6000 平台完成了花后71 d 和花后99 d的对照、T1和T2共6个样品的转录组分析,为了保证数据质量,在信息分析前对原始数据进行质控,过滤后的Clean reads 在44 236 559 和48 151 904 之间,Q20 在96.35%和96.73%之间,Q30在93.94%和94.39%之间,Clean reads数量最多的为花后71 d的对照样本,数量最少的为花后99 d的T1样本(表7)。
表7 测序数据总体情况
Table 7 General situation of sequencing data

注:Error rate(%)一般在0.1%以下;Q20(%):准确率在99%以上的碱基所占百分比;Q30(%):准确率在99.9%以上的碱基所占百分比。
Note:Error rate(%)is generally below 0.1%;Q20(%):Percentage of bases with an accuracy rate of over 99%;Q30(%):Percentage of bases with an accuracy rate of over 99.9%.
质控数据对应的G和C碱基总和占总碱基的百分比GC content/%46.82 46.91 46.95 45.91 46.41 45.89花后时间Time after anthesis/d 71 99样本名称Sample对照CK T1 T2对照CK T1 T2原始测序数据总条目数Raw reads 48 764 414 46 948 334 46 891 903 48 110 892 44 732 797 45 291 173原始测序总数据量Raw Bases 7 363 426 514 7 089 198 434 7 080 677 303 7 264 744 692 6 754 652 297 6 838 967 073质控后测序数据的总条目数Clean Reads 48 151 904 46 357 361 46 306 554 47 601 669 44 236 559 44 776 131质控后测序总数据量Clean bases 7 058 024 800 6 802 202 525 6 781 976 975 7 019 012 211 6 469 707 661 6 544 765 155质控数据对应的测序碱基平均错误率Error rate/%0.026 5 0.026 9 0.026 9 0.027 1 0.026 6 0.026 5碱基识别准确率Q20/%96.73 96.49 96.48 96.35 96.65 96.66碱基识别准确率Q30/%94.39 94.09 94.09 93.94 94.33 94.34
经比对统计分析,花后99 d 时,对照样本的Total mapped最多,达到43 804 344个,T1样本的最少,为40 408 372 个。Multiple mapped 比例为2.74%~3.58%,花后99 d的对照样本最小,花后71 d的T2样本最大,Uniquely mapped 数量在39 043 793~41 759326 之间,Uniquely mapped 的比例为86.70%~89.29%(表8)。
表8 测序Reads 的比对结果统计
Table 8 Comparison results statistics of sequencing reads
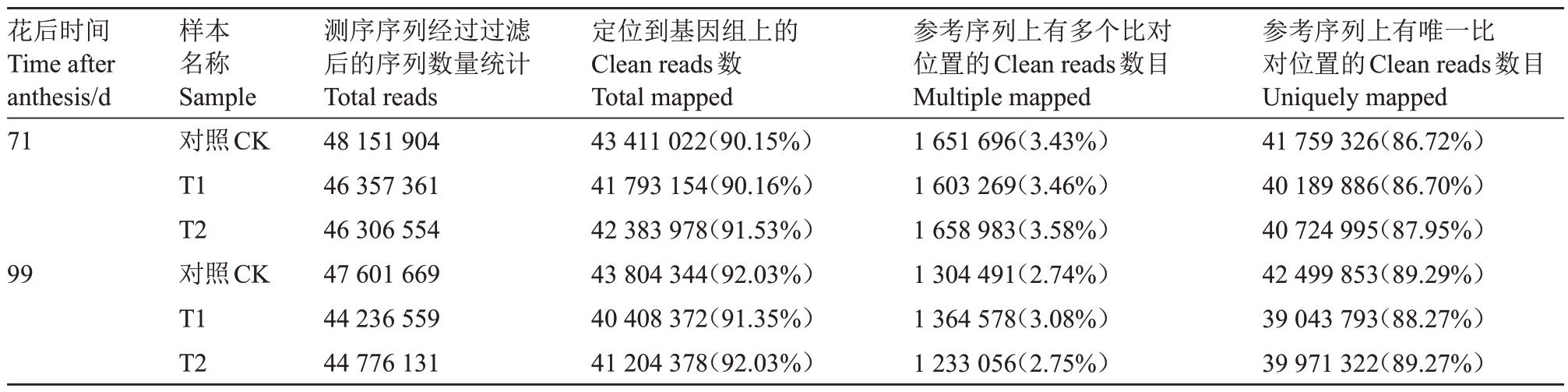
注:Total mapped:能定位到基因组上的Clean reads 数目,百分比为Total Mapped/Clean Reads;Multiple mapped:百分比为Multple Mapped/Total Mapped;Unique mapped:百分比为Uniquely Maped/Total Mapped。
Note:Total mapped:The number of clean reads that can be located on the genome,expressed as a percentage of Total Mapped/Clean Reads.Multiple mapped:The percentage is Multple Mapped/Total Mapped;Unique mapped:The percentage is Unique Mapped/Total Mapped.
参考序列上有唯一比对位置的Clean reads数目Uniquely mapped 41 759 326(86.72%)40 189 886(86.70%)40 724 995(87.95%)42 499 853(89.29%)39 043 793(88.27%)39 971 322(89.27%)花后时间Time after anthesis/d 71 99样本名称Sample对照CK T1 T2对照CK T1 T2测序序列经过过滤后的序列数量统计Total reads 48 151 904 46 357 361 46 306 554 47 601 669 44 236 559 44 776 131定位到基因组上的Clean reads数Total mapped 43 411 022(90.15%)41 793 154(90.16%)42 383 978(91.53%)43 804 344(92.03%)40 408 372(91.35%)41 204 378(92.03%)参考序列上有多个比对位置的Clean reads数目Multiple mapped 1 651 696(3.43%)1 603 269(3.46%)1 658 983(3.58%)1 304 491(2.74%)1 364 578(3.08%)1 233 056(2.75%)
对样本关系分析(图3)发现,马瑟兰葡萄在花后71 d和花后99 d,各处理共有基因为14394个,花后71 d,对照、T1、T2特有基因分别为160个、74个、34 个,花后99 d,对照、T1、T2 特有基因分别为177个、45个、193个。

图3 样本间韦恩图
Fig.3 Venn diagram between samples
不同处理与对照比较,基因表达量差异如图4所示,对照(花后99 d)vs T1(花后99 d)下调基因和上调基因数目均为最多,其中,下调基因达到1393个,上调基因达到979 个,对照(花后71 d)vs T1(花后71 d)下调基因544 个,上调基因220 个,对照(花后71 d)vs T2(花后71 d)下调基因达到740个,上调基因83 个。对照(花后99 d)vs T2(花后99 d)上调基因289个,下调基因330个。
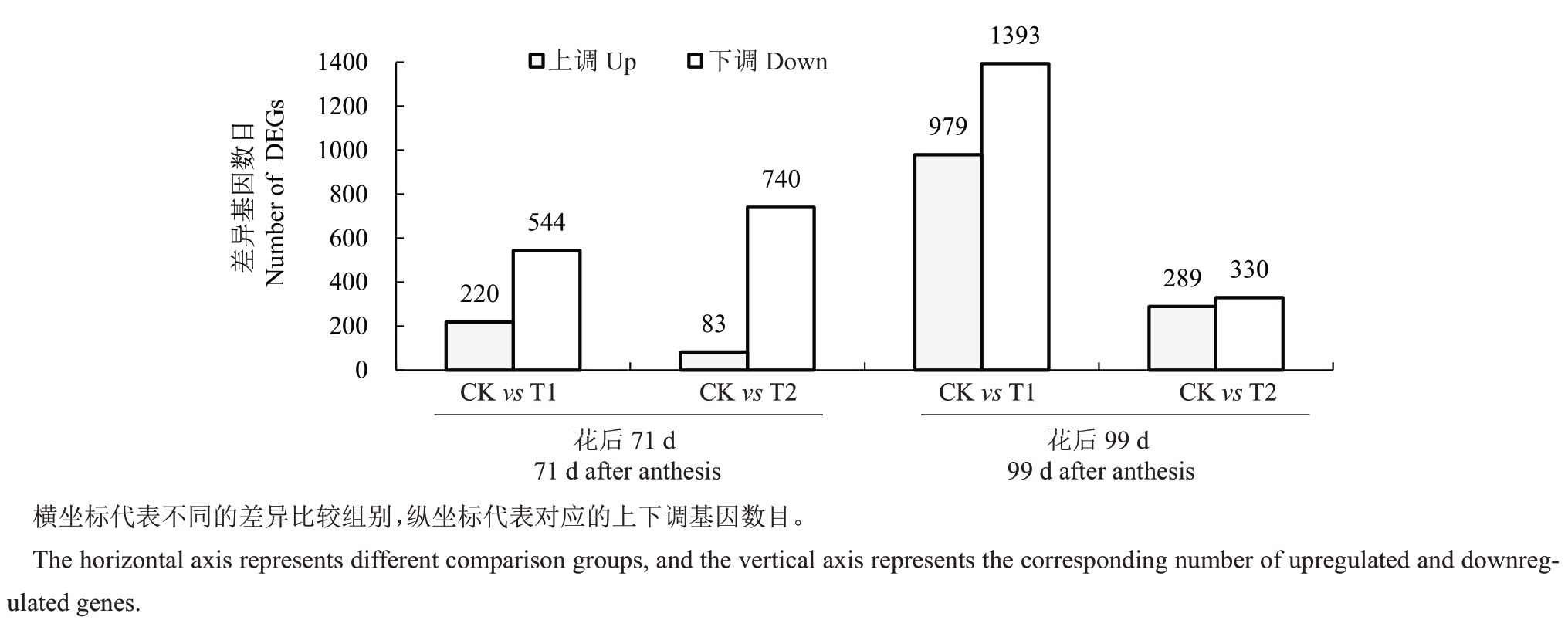
图4 样品间差异基因统计柱状图
Fig.4 Statistical histogram of different expressed genes among samples
不同遮阳处理的基因集分析如图5,对照(花后71 d)vs T1(花后71 d)、对照(花后71 d)vs T2(花后71 d)、对照(花后99 d)vs T1(花后99 d)和对照(花后99 d)vs T2(花后99 d)之间共有基因36 个;对照(花后71 d)vs T1(花后71 d)和对照(花后71 d)vs T2(花后71 d)共有基因428 个,对照(花后99 d)vs T1(花后99 d)和对照(花后99 d)vs T2(花后99 d)共有基因442 个;对照(花后71 d)vs T1(花后71 d)特有基因208 个,对照(花后71 d)vs T2(花后71 d)特有基因231 个,对照(花后99 d)vs T1(花后99 d)特有基因1682个,对照(花后99 d)vs T2(花后99 d)特有基因118个。

图5 样本间基因集分析韦恩图
Fig.5 Gene set analysis between samples using Venn diagram
KEGG富集分析揭示了马瑟兰葡萄在转色期显著差异基因主要参与的代谢途径和信号通路。花色苷是通过类黄酮代谢途径中的特定分支进行生物合成的,该途径也被富集出来(图6、图7)。花后71 d代谢通路的KEGG 富集分析(图6),以P-adjust<0.05 为标准对两两比较后的代谢通路进行选择,对照(花后71 d)vs T1(花后71 d)和对照(花后71 d)vs T2(花后71 d)中,分别有8个和12个代谢途径被显著富集。对照(花后71 d)vs T1(花后71 d)中最显著的几个代谢途径为半乳糖代谢(Galactose metabolism)、植物激素信号转导(Plant hormone signal transduction)、光合作用-天线蛋白(Photosynthesisantenna proteins)、ABC 转运蛋白(ABC transporters)、二萜生物合成(Diterpenoid biosynthesis)、淀粉和蔗糖代谢(Starch and sucrose metabolism)、脂肪酸降解(Fatty acid degradation)、黄酮类化合物生物合成(Flavonoid biosynthesis)。对照(花后71 d)vs T2(花后71 d)中最显著的几个代谢途径为丙烷、哌啶和吡啶生物碱生物合成(Tropane,piperidine and pyridine alkaloid biosynthesis)、植物昼夜节律(Circadian rhythm- plant)、黄酮类化合物生物合成(Flavonoid biosynthesis)、光合作用-天线蛋白(Photosynthesis-antenna proteins)、二苯乙烯类、二芳基庚烷类和姜酚的生物合成(Stilbenoid,diarylheptanoid and gingerol biosynthesis)、植物病原菌互作(Plant-pathogen interaction)、半乳糖代谢(galactose metabolism )、植物激素信号转导(Plant hormone signal transduction)、ABC 转运蛋白(ABC transporters)、单萜类生物合成(Monoterpenoid biosynthesis)、苯丙烷类生物合成(Phenylpropanoid biosynthesis)、氮代谢(Nitrogen metabolism)。
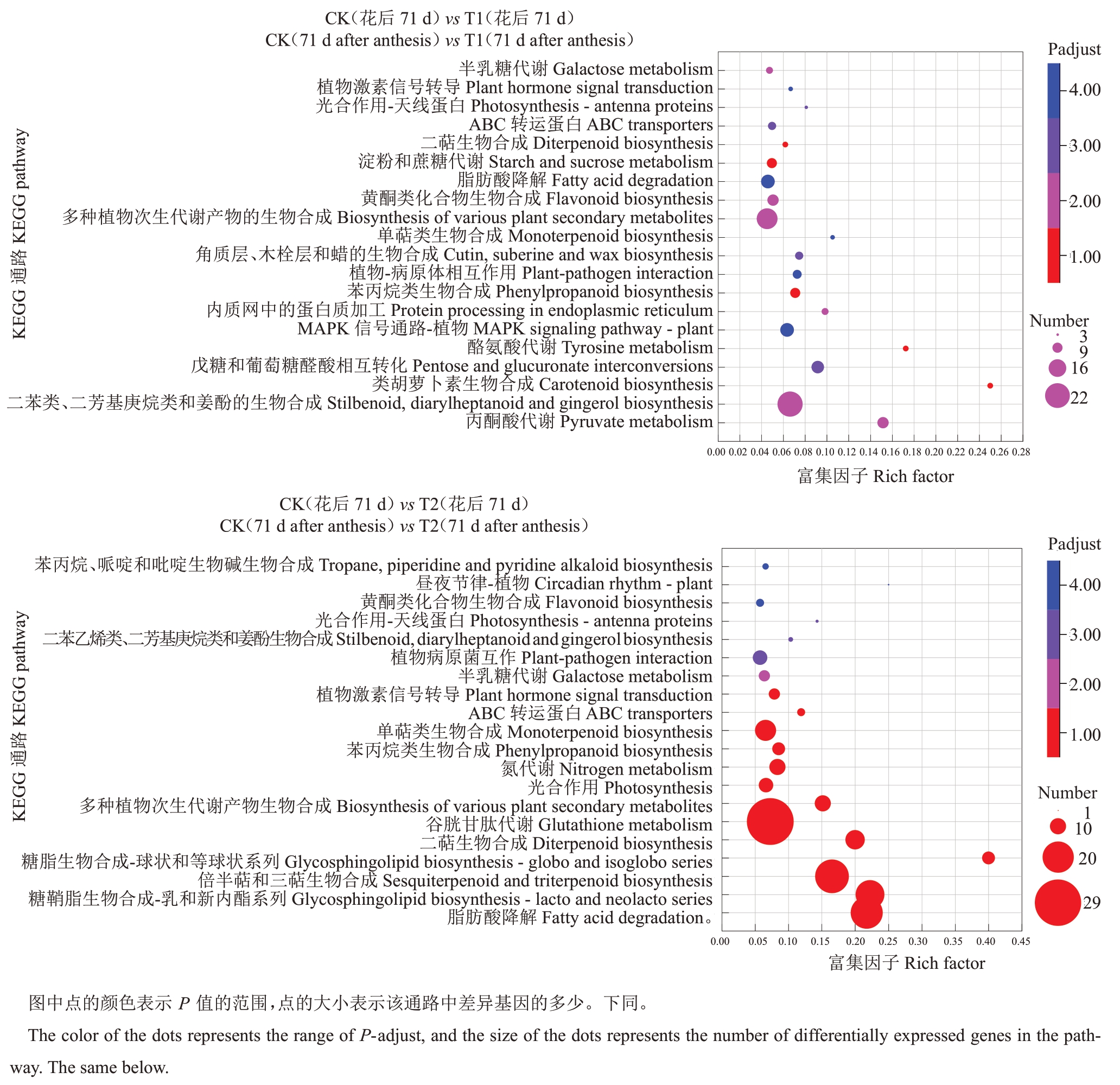
图6 花后71 d 的代谢通路KEGG 富集结果
Fig.6 Enrichment of KEGG of 71 d after anthesis in metabolic pathway
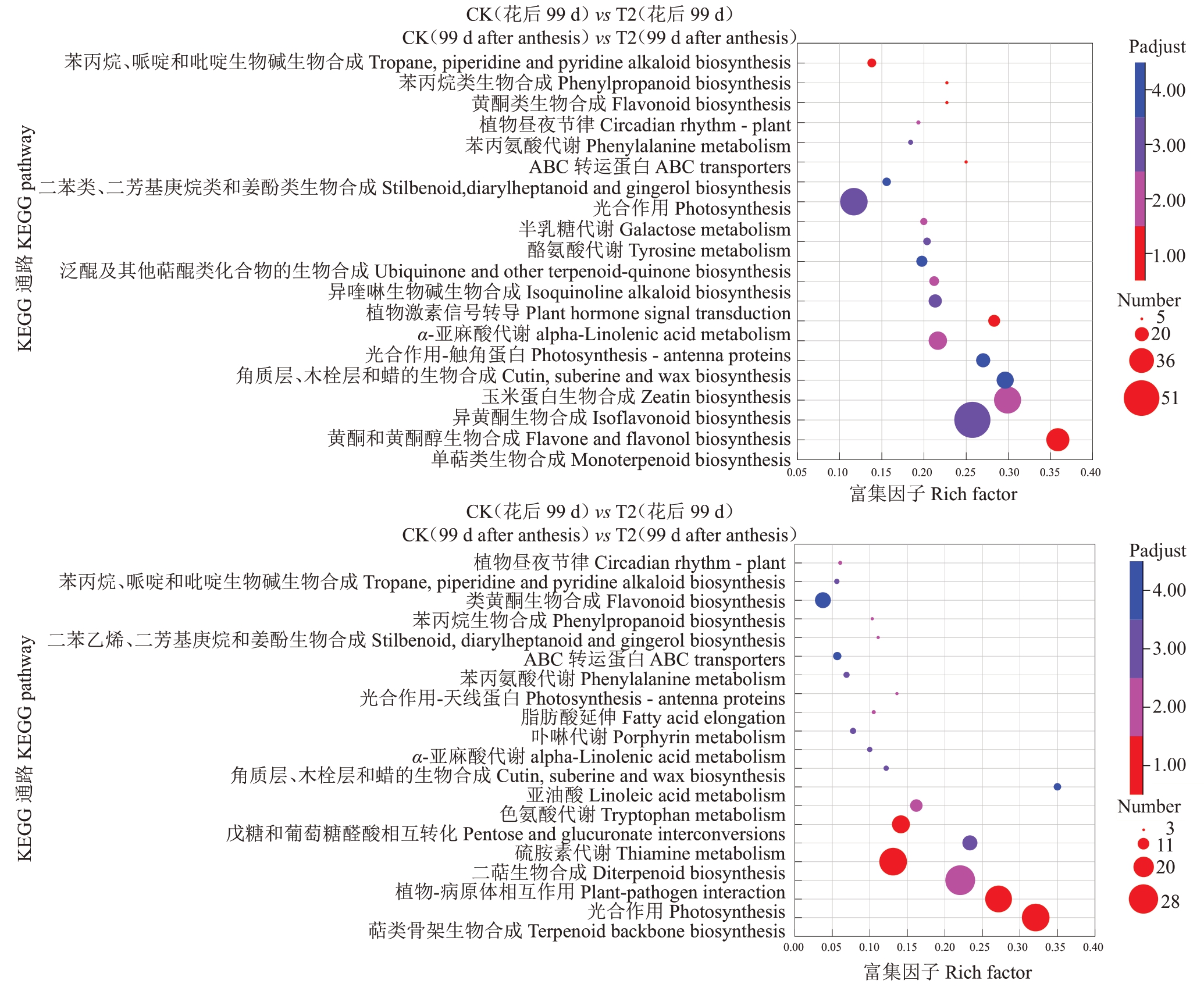
图7 花后99 d 的代谢通路KEGG 富集结果
Fig.7 Enrichment of KEGG of 99 d after anthesis in metabolic pathway
花后99 d 代谢通路的KEGG 富集分析(图7),以P-adjust<0.05 为标准对两两比较后的代谢通路进行选择,对照(花后99 d)vs T1(花后99 d)和对照(花后99 d)vs T2(花后99 d)中,分别有12个和10个代谢途径被显著富集。对照(花后99 d)vs T1(花后99 d)富集到的最为显著的途径有苯丙烷、哌啶和吡啶生物碱生物合成(Tropane,piperidine and pyridine alkaloid biosynthesis),苯丙烷类生物合成(Phenylpropanoid biosynthesis),黄酮类生物合成(Flavonoid biosynthesis),植物昼夜节律(Circadian rhythmplant),苯丙氨酸代谢(Phenylalanine metabolism),ABC 转运蛋白(ABC transporters),二苯类、二芳基庚烷类和姜酚类生物合成(Stilbenoid,diarylheptanoid and gingerol biosynthesis),光合作用(Photosynthesis),半乳糖代谢(Galactose metabolism),酪氨酸代谢(Tyrosine metabolism),泛醌及其他萜醌类化合物的生物合成(Ubiquinone and other terpenoidquinone biosynthesis),异喹啉生物碱生物合成(Isoquinoline alkaloid biosynthesis)。对照(花后99 d)vs T2(花后99 d)富集到植物昼夜节律(Circadian rhythm-plant),苯丙烷、哌啶和吡啶生物碱生物合成(Tropane,piperidine and pyridine alkaloid biosynthesis),类黄酮生物合成(Flavonoid biosynthesis),苯丙烷生物合成(Phenylpropanoid biosynthesis),二苯乙烯,二芳基庚烷和姜酚生物合成(Stilbenoid,diarylheptanoid and gingerol biosynthesis),ABC 转运蛋白(ABC transporters),苯丙氨酸代谢(Phenylalanine metabolism),光合作用-天线蛋白(Photosynthesisantenna proteins),脂肪酸延伸(Fatty acid elongation),卟啉代谢(Porphyrin metabolism)途径最为显著。
通过两两比较之后每个组合均富集到较多的代谢途径,而笔者在本研究中重点关注的是苯丙烷类化合物的生物合成和类黄酮生物合成两个代谢途径。类黄酮代谢途径中在对照(花后71 d)vs T1(花后71 d)、对照(花后71 d)vs T2(花后71 d)、对照(花后99 d)vs T1(花后99 d)和对照(花后99 d)vs T2(花后99 d)中分别富集到的差异基因数目为9 个、21个、38 个和28 个,而苯丙烷类生物合成富集到的基因个数最多达到51个。
2.4 遮阳处理对马瑟兰葡萄花色苷合成相关基因表达的影响
qRT-PCR 验证转录组数据,随机筛选了苯丙烷类生物合成和类黄酮生物合成两个代谢途径中的差异表达基因通过qRT-PCR分析相对表达水平,以此进一步说明转录组数据的可靠性。利用差异表达基因功能富集分析和表达量分析的方法,从马瑟兰葡萄中筛选了15 个与花色苷合成相关的差异表达基因,作为潜在的候选基因(表9)。经基因功能注释分析,这些基因可能与花色苷的生物合成有关。其中,除GAPDH(内参)外,CHS3表达量最高,GST4次之。
表9 基因的表达水平分布TPM 值
Table 9 Distribution of gene expression level TPM value

基因-ID Gene-ID注释Annotation花后时间Time after anthesis/d 71对照CK 109.98 26.60 272.00 255.77 1 805.32 275.36 145.10 354.15 50.34 118.38 220.50 4.83 1 177.52 13.72 22.26 1 806.75 T1 101.47 23.80 259.98 230.43 1 739.00 219.12 164.38 235.89 59.58 98.51 167.81 5.89 1 190.33 11.62 26.97 1 814.64 T2 131.71 33.50 352.75 353.15 2 078.64 297.59 183.79 301.81 81.55 126.11 235.00 1.19 1 363.33 13.15 28.13 1 924.97 99对照CK 111.81 30.53 375.63 322.96 886.74 264.30 587.97 166.60 114.23 18.11 68.21 65.72 511.01 3.67 42.58 1 567.17 T1 VIT_13s0019g04460 VIT_16s0039g02040 VIT_13s0067g03820 VIT_14s0068g00930 VIT_05s0136g00260 VIT_04s0023g03370 VIT_18s0001g12800 VIT_02s0025g04720 VIT_17s0000g07210 VIT_06s0009g02970 VIT_16s0039g02230 VIT_03s0063g00140 VIT_04s0079g00690 VIT_02s0033g00410 VIT_06s0004g00570 XM_002263109 44.95 11.29 279.04 125.27 660.86 137.14 325.18 117.33 75.82 33.83 60.05 11.41 403.37 3.20 33.23 1 939.92 T2 115.31 23.50 397.44 274.41 981.15 292.70 569.99 206.95 108.89 29.81 83.03 53.17 550.17 2.99 38.56 1 632.07 PAL 4CL CHI CHS CHS3 F3H DFR LDOX F3'H F3'5'H UFGT OMT GST4 MYB90 MYB5b GAPDH(内参Actin)
对基因相对表达量进行分析,不同时期遮阳处理对马瑟兰葡萄果实花色苷合成相关基因的影响由图8可以看出,转色期遮阳处理后,葡萄果皮花色苷相关合成的上游基因,均有不同程度的上调表达。随着果实的成熟,T1处理的PAL、F3H、F3’H基因表达类似,呈先下降后上升的变化趋势,花后71 d三个基因的表达量均上调,而后随着果实成熟逐渐下降,PAL和F3’H在花后85 d时达到最小值,且均显著低于对照和T2的基因表达量,F3H在花后92 d时达到最小值,且与对照和T2 的基因表达量差异显著;随着果实成熟至采收,PAL、F3H 和F3’H 基因均逐渐上调表达,花后106 d 时T1 的3 个基因表达量均显著低于对照的基因表达量。T2 处理的4CL 和CHS基因表达呈波动变化趋势,CHI 呈先上升后下降的变化趋势,花后71~85 d,4CL、CHS、CHI基因逐渐上调表达,均在花后85 d时表达量最高,且显著高于对照和T1 的表达水平,花后85~106 d,表达水平有所下调,果实采收时,T2的4CL、CHI、CHS基因表达量水平显著低于对照。花后71~106 d,T1 处理下的CHS3 和F3’5’H 表达水平类似,随着果实成熟花色苷的不断积累,两个基因的表达水平均呈下降-上升-下降的变化趋势,CHS3 在花后71 d 时表达水平最高,而后逐渐下调,至花后99 d表达量略有上升,果实采收期有所下调,且此时的表达量显著低于对照和T2;F3’5’H 在花后71~92 d 表达量逐渐下调,花后99 d表达水平上升至最高,果实采收期又迅速下调,并达到最低水平,表达量亦显著低于对照和T2。T2 处理的CHS3 和F3’5’H 表达水平类似,花后71~106 d,2个基因的表达量初期降低,随后逐渐升高,CHS3的表达水平在花后71 d时达到最高,且显著高于对照和T1 的表达水平,而后下调,并在花后85 d 时达到最低,且显著低于对照的CHS3 表达水平,随着果实转色成熟T2 的CHS3 表达上调,在花后106 d 时CHS3 表达量是T1 的3.3 倍,差异显著;F3’5’H的表达水平在花后71~92 d略有下调,并在花后92 d 时达到最低,而后随着果实转色成熟F3’5’H 表达上调,在花后106 d 时F3’5’H 表达量达到最大,是T1的19.5倍,差异显著。

图8 不同时期遮阳对花色苷合成上游基因表达量的影响
Fig.8 The effect of shading at different stages on the expression levels of upstream genes involved in anthocyanin synthesis
图9 中DFR 在转色前期转录水平较高,在转色中后期下调表达,其中,T1处理在花后106 d时上调表达,比对照高1.5倍,比T2高1.9倍,差异达显著水平。T2处理的LDOX、UFGT和GST4基因表达量在花后71 d~106 d均高于T1,且除了LDOX在花后71 d的表达量差异不显著外,其余各时期3 个基因的表达量均达显著差异水平。T2处理的OMT在转色后至采收前的转录水平呈先升后降的波动变化趋势,采收期时下调表达;T1处理的OMT 在花后106 d 时上调表达,且显著高于对照和T2。调节因子MYB5b和MYB90在转色至成熟前期转录水平较高,近成熟期至采收期转录水平有所下降。qRT-PCR 分析发现,筛选的15 个基因中,CHI、F3H、F3’5’H、F3’H、DFR、LDOX、UFGT 和OMT 在各处理中的表达水平的变化趋势和转录组测序不一致,其他基因的变化趋势与转录组测序结果相吻合。
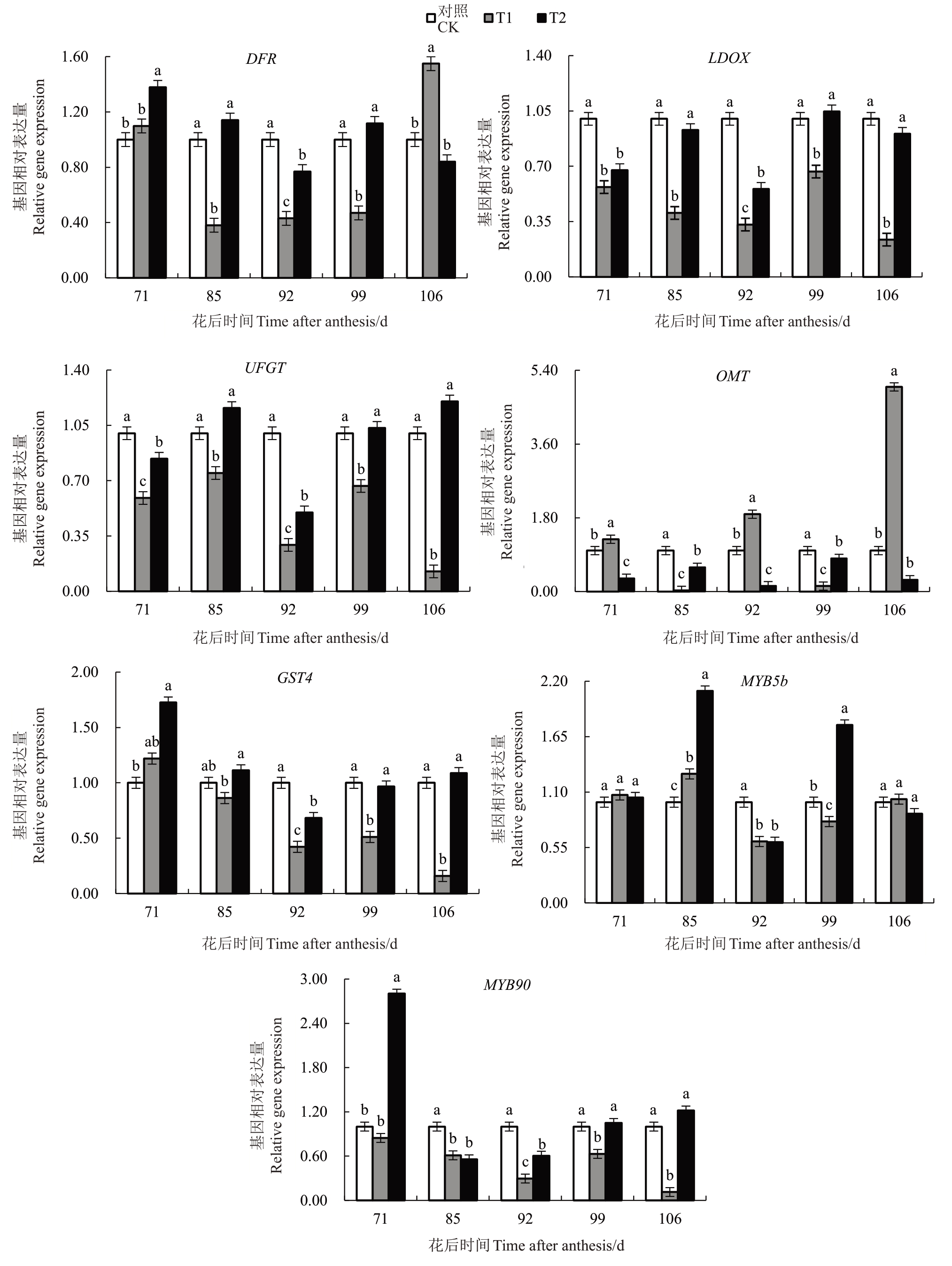
图9 不同时期遮阳对花色苷合成下游基因表达量的影响
Fig.9 The effect of shading at different stages on the expression levels of downstream genes involved in anthocyanin synthesis
2.5 马瑟兰葡萄花色苷含量与花色苷合成相关基因的分析
在马瑟兰葡萄果实成熟过程中,花色苷含量与相关基因表达量的相关性分析除OMT外,均呈正相关(表10)。其中CHI转录水平与Dp和Cy含量显著正相关,相关系数为0.489 和0.512。MYB5b 基因表达水平与Dp、Cy、Pn 及Pt 含量呈显著正相关,说明MYB5b 基因可能参与调节花色苷合成相关结构基因,进而影响花色苷组分及含量的变化。
表10 花色苷含量与相关基因表达量的相关性分析
Table 10 Correlation analysis between anthocyanin content and related gene expression levels

注:**.在0.01 水平(双侧)上显著相关;*.在0.05 水平(双侧)上显著相关。
Note:**.There is a significant correlation at the 0.01 level(bilateral);*.There is a significant correlation at the 0.05 level(bilateral).
基因名Gene name PAL 4CL CHI CHS CHS3 F3H DFR LDOX F3'H F3'5'H UFGT OMT GST4 MYB90 MYB5b二甲花翠素Malvidin 0.015 0.185 0.206 0.034 0.110 0.054 0.081 0.068-0.016 0.133 0.153-0.323 0.128 0.140 0.420花翠素Delphinidin 0.119 0.425 0.489*0.366 0.203 0.233 0.283 0.223 0.028 0.169 0.274-0.290 0.372 0.311 0.592**花青素Cyanidin 0.154 0.439 0.512*0.428 0.223 0.272 0.338 0.233 0.069 0.179 0.279-0.247 0.441 0.365 0.627**甲基花青素Peonidin 0.168 0.379 0.431 0.309 0.223 0.258 0.337 0.220 0.084 0.145 0.251-0.243 0.317 0.276 0.559*甲基花翠素Petunidin 0.129 0.396 0.447 0.344 0.222 0.240 0.272 0.227 0.043 0.177 0.277-0.297 0.362 0.308 0.581**
3 讨 论
贺兰山东麓葡萄酒产区受气候变化影响,干旱少雨,夏季炎热、光照强,日照时数长,导致葡萄过快成熟,糖高酸低,花色苷合成快、色泽凋零也快,进而影响了果实品质。通过遮光、改变栽培方式等方法调节果实糖、酸及酚类物质积累,可有效提升果实品质。花色苷作为果实品质的重要指标之一,其积累受到环境因素和生物合成途径中相关基因表达水平的共同调控。树体遮阳、果穗套袋等方法[20-21]可改变光照度,导致葡萄果实总花色苷含量下降,影响果实着色,延迟采收。套袋对葡萄花色苷种类没有影响,花色苷含量则有所差异[22]。本研究结果表明,各处理中葡萄果实检测的16种花色苷种类均一致,单体含量有所不同,与上述研究结果一致[22]。遮阳显著减少了葡萄果实Dp 类、Cy 类、Pt 类和Pn 类花色苷的含量,转色初期遮阳,除Mv 类花色苷外,总花色苷含量及Dp 类、Cy 类、Pt 类和Pn 类含量则显著下降;完全转色期遮阳,总花色苷和Mv类花色苷含量则增加,进一步说明了不同时期遮阳对花色苷的影响并不相同[23],且Mv类花色苷在5类花色苷中仍占主要地位,与相关研究结果一致[24]。遮阳可降低葡萄果实含糖量,有效增加酸含量[25],显著降低可溶性固形物含量[26]。本研究结果表明,完全转色期遮阳处理促进了还原糖积累,且差异显著,可能由于遮阳减少了光照度,提高了光合能力,促进了果实糖的积累。遮阳减缓了葡萄酸的下降趋势,显著降低了可溶性固形物含量,这与闫雪[26]的研究结果一致。
花色苷合成除受到光照、温度及矿质元素等外部因素的影响外[21],还受到合成途径中调控关键酶表达的相关基因(PAL、CHS、F3'5'H、F3H、DFR、UFGT、OMT、GST等结构基因和MYB等调节基因)的影响。有研究发现,果穗套袋可使PAL、4CL、F3’5’H、DFR、LDOX、OMT、MYB5a等相关基因表达量上调,促进了果实花色苷的合成[27]。本试验主要研究了PAL、4CL、CHI、CHS、CHS3、F3H、F3’5’H、F3’H、GST4、DFR、LDOX、UFGT、OMT、MYB5b、MYB90 基因的表达水平。花后71~106 d,以上基因在果实中均被检测到。转色初期遮阳,采收时CHI、DFR 和OMT基因表达量与其他处理相比有所上调,且DFR和OMT达显著水平,显著降低了CHS和LDOX基因表达水平。完全转色期遮阳,采收期的PAL、CHS3、F3’H、F3’5’H、UFGT、GST4 和MYB90 基因表达量与其他处理相比均有所上调,进一步促进了花色苷的合成,酰化花色苷修饰比例的增加,提升了花色苷的结构稳定性,继而提高其颜色稳定性[28]。对转色至采收期的花色苷含量与相关基因表达量分析表明,MYB5b 与花色苷含量呈显著正相关,对花色苷的合成具有调节作用,与成果[23]的有关研究结果相吻合。F3’H和F3’5’H在花色苷生物合成途径中起着关键作用,二者分别调控着花色苷合成的不同支路,继而形成不同的花色苷[29],F3’H 主要参与生成的Cy 类花色苷和F3’5’H 主要参与生成的Dp 类花色苷含量不同导致果皮颜色也有所不同[27]。笔者在本研究中发现,在转色初期遮阳,采收时F3’H上调表达,F3’5’H下调表达;在完全转色期遮阳,采收时F3’H和F3’5’H均上调表达,而转色初期遮阳处理的Cy类和Dp类花色苷含量均显著高于完全转色期遮阳处理的Cy和Dp含量。可能由于CHI表达水平与Cy 和Dp 含量呈显著正相关,且转色初期遮阳处理的CHI表达水平显著高于完全转色期遮阳处理的CHI表达水平,进而导致转色初期遮阳处理的Cy和Dp 含量显著高于完全转色期遮阳处理的Cy 和Dp含量。亦或是其他关键基因存在差异性表达,导致Cy和Dp含量有所差异,还有待进一步研究。
4 结 论
遮阳显著降低了可溶性固形物含量,增加了滴定酸含量,完全转色期遮阳增加了部分花色苷合成相关基因的表达量,促进了花色苷的合成,提升了总花色苷含量且显著增加了Mv类花色苷的含量。完全转色期遮阳提高了酰化花色苷的修饰比例,增加了花色苷颜色的稳定性,改善果实着色,提升葡萄色泽的稳定性。因此,为有效缓解酿酒葡萄因光强导致花色苷结构不稳定引起色泽过快凋零的问题,可在果实完全转色期进行适当遮阳处理。
[1] 李宁宁,张波,牛见明,史肖,马腾臻,韩舜愈.发酵前咖啡酸和迷迭香酸添加对干红葡萄酒颜色与香气的影响[J].食品与发酵工业,2020,46(10):132-140.LI Ningning,ZHANG Bo,NIU Jianming,SHI Xiao,MA Tengzhen,HAN Shunyu. The influence of pre-fermentative addition of caffeic acid and rosmarinic acid on the color and aroma compounds of dry red wines[J]. Food and Fermentation Industries,2020,46(10):132-140.
[2] 刘霞,邢佳雨,冯敬雯,陈建军,焦扬,杨彬.红葡萄酒辅助呈色作用研究进展[J].中国酿造,2023,42(11):9-14.LIU Xia,XING Jiayu,FENG Jingwen,CHEN Jianjun,JIAO Yang,YANG Bin. Research progress on copigmentation of red wine[J].China Brewing,2023,42(11):9-14.
[3] 韩富亮,李杨,李记明,徐岩.红葡萄酒花色苷结构和颜色的关系研究进展[J].食品与生物技术学报,2011,30(3):328-336.HAN Fuliang,LI Yang,LI Jiming,XU Yan. Relation between anthocyanin structures and color in red wine:A review[J]. Journal of Food Science and Biotechnology,2011,30(3):328-336.
[4] 朱磊,李新月,胡禧熙,刘云清,于昕楚,武欣,臧延青,汤华成.葡萄花色苷的组成及生物合成研究进展[J].黑龙江八一农垦大学学报,2021,33(5):59-66.ZHU Lei,LI Xinyue,HU Xixi,LIU Yunqing,YU Xinchu,WU Xin,ZANG Yanqing,TANG Huacheng. Research progress on composition and biosynthesis of grape anthocyanins[J]. Journal of Heilongjiang Bayi Agricultural University,2021,33(5):59-66.
[5] 史国强.设施栽培对葡萄果实品质及酚类积累的影响[D].太谷:山西农业大学,2019.SHI Guoqiang. Effects of facilities cultivation on the grape berries quality and phenols accumulation[D].Taigu:Shanxi Agricultural University,2019.
[6] 孟祥云,王枝翠,王雨歌,樊新民,赵宝龙,刘怀锋.地面遮阴对新疆‘红地球’葡萄果实着色的影响[J]. 果树学报,2014,31(1):60-65.MENG Xiangyun,WANG Zhicui,WANG Yuge,FAN Xinmin,ZHAO Baolong,LIU Huaifeng. Effects of terrestrial shading on the berry coloring of‘Red Globe’grape (Vitis vinifera L.) in Xinjiang[J].Journal of Fruit Science,2014,31(1):60-65.
[7] DOWNEY M O,HARVEY J S,ROBINSON S P. The effect of bunch shading on berry development and flavonoid accumulation in Shiraz grapes[J]. Australian Journal of Grape and Wine Research,2008,10(1):55-73.
[8] 李艳春.果实成熟期光照对赤霞珠葡萄光合作用、果实品质及养分积累的影响[D].保定:河北农业大学,2009.LI Yanchun. The effect of light on photosynthesis,fruit quality and nutrient accumulation during Cabernet Sauvignon maturation period[D].Baoding:Hebei Agricultural University,2009.
[9] RISTIC R,DOWNEY M O,ILAND P G,BINDON K,FRANCIS I L,HERDERICH M,ROBINSON S P. Exclusion of sunlight from Shiraz grapes alters wine colour,tannin and sensory properties[J]. Australian Journal of Grape and Wine Research,2007,13(2):53-65.
[10] SEN F,OKSAR R E,KESGIN M. Effect of shading and covering on‘Sultana Seedless’grape quality and storability[J]. Journal of Agricultural Science&Technology,2016,18(1):245-254.
[11] SERAT B,KULKARNI S S. Effect of shade net on yield and quality of grapes cv. Thompson seedless[J]. International Journal of Science and Research,2015,4(5):1841-1844.
[12] 倪志婧,马文平,王薇,宋长冰,魏兆军.遮光处理对酿酒葡萄果实品质的影响[J].合肥工业大学学报(自然科学版),2016,39(11):1563-1566.NI Zhijing,MA Wenping,WANG Wei,SONG Changbing,WEI Zhaojun. Effect of shading treatment on the quality of wine grapes[J]. Journal of Hefei University of Technology (Natural Science),2016,39(11):1563-1566.
[13] 刘敏,成正龙,张晋升,鞠延仑,房玉林,孟江飞,张振文.遮阳网对酿酒葡萄果实及葡萄酒品质的影响[J].西北植物学报,2017,37(9):1764-1772.LIU Min,CHENG Zhenglong,ZHANG Jinsheng,JU Yanlun,FANG Yulin,MENG Jiangfei,ZHANG Zhenwen. Influence of shading net on qualities of Cabernet Sauvignon and Syrah berries and wines[J]. Acta Botanica Boreali-Occidentalia Sinica,2017,37(9):1764-1772.
[14] AZUMA A,YAKUSHIJI H,KOSHITA Y,KOBAYASHI S.Flavonoid biosynthesis-related genes in grape skin are differentially regulated by temperature and light conditions[J]. Planta,2012,236(4):1067-1080.
[15] 国家质量监督检验检疫总局,中国国家标准化管理委员会.葡萄酒、果酒通用分析方法:GB/T 15038—2006[S]. 北京:中国标准出版社,2008:2-56.General Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China,Standardization Administration of the People’s Republic of China. Analytical methods of wine and fruit wine:GB/T 15038—2006[S]. Beijing:Standards Press of China,2008:2-56.
[16] 王舒伟,乔丹,徐通通,张轲,邵永明,董荣,张珍珍.葡萄成熟度对‘赤霞珠’葡萄酒酚类物质及抗氧化能力的影响[J].食品与发酵工业,2022,48(12):202-209.WANG Shuwei,QIAO Dan,XU Tongtong,ZHANG Ke,SHAO Yongming,DONG Rong,ZHANG Zhenzhen. Effect of grape maturity on phenolic and antioxidant activity of Cabernet Sauvignon wines[J].Food and Fermentation Industries,2022,48(12):202-209.
[17] 王博.根域限制促进鲜食葡萄果皮花色苷合成的机制研究[D].上海:上海交通大学,2013.WANG Bo. Study on the mechanism of improved anthocyanin biosynthesis under root restriction in table grape berry skin[D].Shanghai:Shanghai Jiao Tong University,2013.
[18] LIANG Z C,SANG M,FAN P G,WU B H,WANG L J,YANG S H,LI S H. CIELAB coordinates in response to berry skin anthocyanins and their composition in Vitis[J].Journal of Food Science,2011,76(3):C490-C497.
[19] 韦伟,单守明,李光宗,许文娣.北红葡萄组织培养生根期愈伤组织的转录组分析[J].甘肃农业大学学报,2023,58(4):127-136.WEI Wei,SHAN Shouming,LI Guangzong,XU Wendi. Transcriptome analysis of callus at rooting stage in Beihong grape tissue culture[J]. Journal of Gansu Agricultural University,2023,58(4):127-136.
[20] 张珍珍,李倩,董荣,乔丹,闫雪,张轲.树体遮光对采收期‘赤霞珠’葡萄果实花色苷类物质积累的影响[J].食品科学,2020,41(4):157-163.ZHANG Zhenzhen,LI Qian,DONG Rong,QIAO Dan,YAN Xue,ZHANG Ke. Effects of shading treatment on accumulation of anthocyanin in grape fruit of‘Cabernet Sauvignon’at harvest[J].Food Science,2020,41(4):157-163.
[21] 马宗桓.光照强度对葡萄果实品质及花青苷合成的调控机理研究[D].兰州:甘肃农业大学,2019.MA Zonghuan. Regulation mechanism of light intensity on fruit quality and anthocyanin synthesis in grape (V. vinifera L.)berry[D].Lanzhou:Gansu Agricultural University,2019.
[22] 靳韦.套袋对沙地“红地球”葡萄果际微气候及品质的影响[D].银川:宁夏大学,2015.JIN Wei. Effects of the bagging on fruiting microenvironments and quality of grape (cv. Red Globe) in the sandy areas[D].Yinchuan:Ningxia University,2015.
[23] 成果.微环境调控‘赤霞珠’葡萄果实花色苷代谢的研究[D].杨凌:西北农林科技大学,2015.CHENG Guo.The research on anthocyanin biosynthesis in‘Cabernet Sauvignon’berries regulated by microenvironment[D].Yangling:Northwest A&F University,2015.
[24] 乔子纯,柳巧禛,代红军.外源6-BA 对‘美乐’葡萄花色苷合成的影响[J].果树学报,2020,37(5):668-676.QIAO Zichun,LIU Qiaozhen,DAI Hongjun. Effects of exogenous 6-BA on anthocyanin synthesis in‘Merlot’grape[J]. Journal of Fruit Science,2020,37(5):668-676.
[25] 李磊,谷威杰,苏旺春,陈可钦,张克坤,房玉林.遮阳网颜色和宽度对‘马瑟兰’葡萄果实和葡萄酒品质的影响[J].西北植物学报,2024,44(9):1355-1364.LI Lei,GU Weijie,SU Wangchun,CHEN Keqin,ZHANG Kekun,FANG Yulin. The quality of‘Marselan’grapes and wines under sunshade nets with different widths and colors[J].Acta Botanica Boreali-Occidentalia Sinica,2024,44(9):1355-1364.
[26] 闫雪.遮光处理对‘赤霞珠’葡萄果实中辅色物质代谢及葡萄酒颜色稳定性的影响[D].乌鲁木齐:新疆农业大学,2021.YAN Xue.Effect of shading treatment on the metabolism of Cocolor substances and wine color stability in‘Cabernet Sauyignon’grape berry[D]. Urumqi:Xinjiang Agricultural University,2021.
[27] 张雷,贾玥,王继源,陶建敏.套袋对‘美人指’葡萄花色苷组分及合成相关基因表达的影响[J].果树学报,2014,31(6):1032-1039.ZHANG Lei,JIA Yue,WANG Jiyuan,TAO Jianmin. Effects of bagging on anthocyanins component and biosynthetic genes expression in‘Manicure Finger’grape[J]. Journal of Fruit Science,2014,31(6):1032-1039.
[28] 王二雷,黄佳莹,段海章,徐彩娜.花色苷稳态化技术研究进展及应用前景[J].食品工业科技,2024,45(18):394-403.WANG Erlei,HUANG Jiaying,DUAN Haizhang,XU Caina.Progress on the stabilization technology of anthocyanins and the application prospects[J].Science and Technology of Food Industry,2024,45(18):394-403.
[29] 栾丽英.油菜素内酯和脱落酸对酿酒葡萄花色苷调控及葡萄酒品质影响的研究[D].杨凌:西北农林科技大学,2014.LUAN Liying. Study on the regulation of anthocyanin synthesis of grape and the quality of wine after brassinolide and abscisic acid treatments[D]. Yangling:Northwest A & F University,2014.