石榴(Punica granatum L.)为千屈菜科(Pomegranate)石榴属(Punica L.)植物,是具有较高营养、经济和医药价值的水果[1]。2021年中国石榴栽培面积(约8.67 万hm2)和产量(约130 万t)稳居世界首位[2]。目前,石榴产业在全球经济市场中逐渐兴起[3],因经济效益显著,已成为助力中国乡村振兴的特色产业[4]。然而石榴产业发展仍然存在效率低、品质劣等问题[5]。目前关于石榴基因功能的研究局限于异源表达,包括拟南芥(Arabidopsis thaliana)[6]、番茄(Solanum lycopersicon Mill.)[7]等植物,这在一定程度上导致石榴的基因功能研究和分子育种进度相对落后,致使石榴产业高质量发展缓慢[8]。因此,建立白花玉石籽石榴遗传转化体系有助于了解石榴基因功能,并为后续石榴遗传改良奠定基础[9]。
目前,由农杆菌介导的遗传转化技术较为常用,已在柑橘(Citrus reticulata Blanco)[10]、苹果(Malus pumila Mill.)[11]、梨(Pisum salivum)[12]等果树中得到运用[13-14]。但是,该方法在石榴中的报道相对缺乏。赵玉洁[15]以石榴胚培苗的子叶、叶片、上下胚轴为外植体,经共培养后,GUS瞬时表达率约70.00%,建立了突尼斯软籽石榴遗传转化体系;刘真真[16]以胚培苗的子叶和叶片为外植体,优化了突尼斯软籽和豫大籽石榴遗传转化体系,成功获得5 株抗性芽嫁接苗;吴亚君[17]和Verma 等[18]均以胚培养苗为试材,初步建立了石榴遗传转化体系。石榴许多品种为杂合体,种子的遗传背景不清晰,其有性后代会出现性状分离等现象,对基因功能验证等相关研究有较大影响。因此,石榴遗传转化技术虽已开展了一些研究,但大多以胚培苗为试材,无法更高效地为后续石榴基因功能验证及育种提供技术支持;同时不同的石榴品种遗传转化所需培养基、激素浓度等存在差异,导致建立的遗传转化体系无法适用于所有石榴品种。针对上述现象,刘真真等[19]认为,建立高效稳定的再生体系是石榴遗传转化体系建立的首要条件。
目前尚未见关于以茎尖为试材,建立白花玉石籽石榴遗传转化体系的相关研究。采用农杆菌介导的白花玉石籽石榴遗传转化技术,不仅可以解决多种问题,包括遗传转化外植体材料要求多、遗传背景不清晰、转化困难等,也能够为石榴的基因功能研究提供良好的技术支持。因此,笔者以白花玉石籽石榴茎尖脱毒获得的无菌苗为试材,拟在已建立的组织培养体系的基础上[20],通过优化石榴再分化体系、筛选卡那霉素(kanamycin,Kan)和特美汀(timentin,TMT)浓度并对预培养时间、菌液浓度、侵染时间、抑菌剂浸洗时间等影响遗传转化的相关因素进行探讨,以期建立稳定的石榴遗传转化体系,为后续石榴的基因功能验证和种质资源改良提供良好的技术支撑。
1 材料和方法
1.1 试验材料
1.1.1 植物材料 白花玉石籽石榴材料由安徽省怀远县中以农业科技有限公司种质圃提供,茎尖脱毒苗的获得参考Qian 等[20]的方法。继代培养2 次后,用于本试验。
1.1.2 载体构建、农杆菌的获得及菌液制备 植物表达载体pRI101-35S::GFP 受赠于南京农业大学,载体图谱如图1 所示,带有卡那霉素抗性标签。利用同源重组的方法[21]将目的基因PgCYP85A1 与表达载体连接,获得重组质粒。采用冻融法[22]将重组质粒pRI101-35S::PgCYP85A1-GFP 转入具有Ach5型背景的农杆菌感受态细胞LBA4404[购自Takara(日本)公司]。农杆菌侵染液制备参考王民炎等[23]的方法,待菌液OD600 为0.5~0.8 时,3000 r·min-1、28 ℃条件下离心5 min,收集菌体,用等体积的侵染液(WPM+30 g 蔗糖+0.22 mg·L-1 6-BA+0.60 mg·L-1IBA+0.1 mol·L-1乙酰丁香酮(Acetosyringone,AS)重悬菌体,室温孵育2 h备用。

图1 pRI101-GFP 载体结构示意图
Fig.1 Schematic diagram of pRI101-GFP carrier structure
1.2 试验方法
1.2.1 不同质量浓度的激素组合对石榴外植体再分化的影响 以无菌苗叶片和嫩茎作为外植体,分别接种于含不同激素组合的WPM 培养基中(表1)。外植体接种程序为:叶片剪成0.50 cm×0.50 cm的小块,背面划口后接种于培养基上;嫩茎去除生长点后剪成0.50 cm小节,接种于培养基上。其中每个外植体为1 次试验重复,共计进行12 次重复。每一激素浓度和外植体的组合为1 个试验组,共进行48 组平行试验。培养35 d后观察记录并计算分化率。

表1 不同激素浓度组合与外植体
Table 1 Different hormone concentration combinations and explants

处理组合Treated combination T1 T2 T3 T4 T5 T6 T7 T8 T9 T10 T11 T12 T13 T14 T15 T16 T17 T18 T19 T20 T21 T22 T23 T24 ρ/(mg·L-1)6-BA 0.18 0.18 0.18 0.18 0.19 0.19 0.19 0.19 0.20 0.20 0.20 0.20 0.21 0.21 0.21 0.21 0.22 0.22 0.22 0.22 0.23 0.23 0.23 0.23IBA 0.40 0.50 0.60 0.70 0.40 0.50 0.60 0.70 0.40 0.50 0.60 0.70 0.40 0.50 0.60 0.70 0.40 0.50 0.60 0.70 0.40 0.50 0.60 0.70外植体Explant叶片Leaves处理组合Treated combination T25 T26 T27 T28 T29 T30 T31 T32 T33 T34 T35 T36 T37 T38 T39 T40 T41 T42 T43 T44 T45 T46 T47 T48 ρ/(mg·L-1)6-BA 0.18 0.18 0.18 0.18 0.19 0.19 0.19 0.19 0.20 0.20 0.20 0.20 0.21 0.21 0.21 0.21 0.22 0.22 0.22 0.22 0.23 0.23 0.23 0.23IBA 0.40 0.50 0.60 0.70 0.40 0.50 0.60 0.70 0.40 0.50 0.60 0.70 0.40 0.50 0.60 0.70 0.40 0.50 0.60 0.70 0.40 0.50 0.60 0.70外植体Explant嫩茎Tender stems
1.2.2 Kan 质量浓度的筛选 以1.2.1 获得的分化率高的植物组织为外植体(下同),将未经农杆菌侵染的石榴外植体分别接种于含0、30、40、50、60 和70 mg·L-1 Kan的分化培养基(1.2.1筛选的最佳激素浓度组合,下同)中,每个浓度处理接种60 个外植体,其中10个外植体·皿-1,3次重复。35 d后统计不同处理中外植体分化率。
1.2.3 TMT 质量浓度的筛选 将用农杆菌侵染(OD600=0.6~0.8)后的外植体接种至含50、100、150、200、250、300 mg·L-1共6个质量浓度梯度TMT的分化培养基中,每个浓度处理接种60 个外植体,其中10个外植体·皿-1。3次重复。35 d后统计外植体分化率及污染率,确定适宜的TMT质量浓度。

1.2.4 不同遗传转化因子对农杆菌介导的白花玉石籽石榴遗传转化效率的影响 根据遗传转化的基本步骤[24-25],为了筛选白花玉石籽石榴遗传转化4个转化因子的最佳水平,设置了预培养时间(A)梯度为1、2、3、4 d;设置农杆菌菌液OD600(B)梯度为0.5、0.6、0.7、0.8,将预培养的外植体放入不同浓度的侵染液中;设置侵染时间(C)为5、10、15、20 min,在不同浓度的农杆菌侵染液中侵染固定时间;设置抑菌剂浸洗时间(D)梯度为15、20、25、30 min,将共培养结束后的外植体放入添加了200 mg·L-1 TMT 的无菌水中浸洗。按照L16(45)进行四因素四水平的正交试验设计,共16个处理组合(表2),每个处理组合均接种50个外植体,每组设3次重复。
表2 正交试验方案
Table 2 Orthogonal test design

处理组合Treatment combination 123456789 10 11 12 13 14 15 16预培养时间(A)Pre-culture time/d 1(1)1(1)1(1)1(1)2(2)2(2)2(2)2(2)3(3)3(3)3(3)3(3)4(4)4(4)4(4)4(4)菌液浓度(B)Concentration of Agrobacterium 1(0.5)2(0.6)3(0.7)4(0.8)1(0.5)2(0.6)3(0.7)4(0.8)1(0.5)2(0.6)3(0.7)4(0.8)1(0.5)2(0.6)3(0.7)4(0.8)侵染时间(C)Infection time/min 1(5)2(10)3(15)4(20)2(10)1(5)4(20)3(15)3(15)4(20)1(5)2(10)4(20)3(15)2(10)1(5)抑菌剂浸洗时间(D)Soaking time of antibacterial agents/min 1(15)2(20)3(25)4(30)3(25)4(30)1(15)2(20)4(30)3(25)2(20)1(15)2(20)1(15)4(30)3(25)
1.2.5 转基因植株的鉴定 培养35 d 后,待抗性芽长到2~3 cm 时,切下芽点置于生根培养基中(添加0.8 mg·L-1 IBA 和1.2.3、1.2.4 中最适Kan、TMT 质量浓度)培养成苗。将生根培养35 d 的抗性植株与未转化的植株,利用倒置荧光显微镜(Thermo Fisher Scientific,美国)观察根系GFP 荧光,统计并记录荧光苗率。
1.3 数据分析
采用Excel 2019 录入和整理数据,采用SPSS 18.0软件进行方差分析。
2 结果与分析
2.1 不同激素组合和外植体对石榴再生途径优化的影响
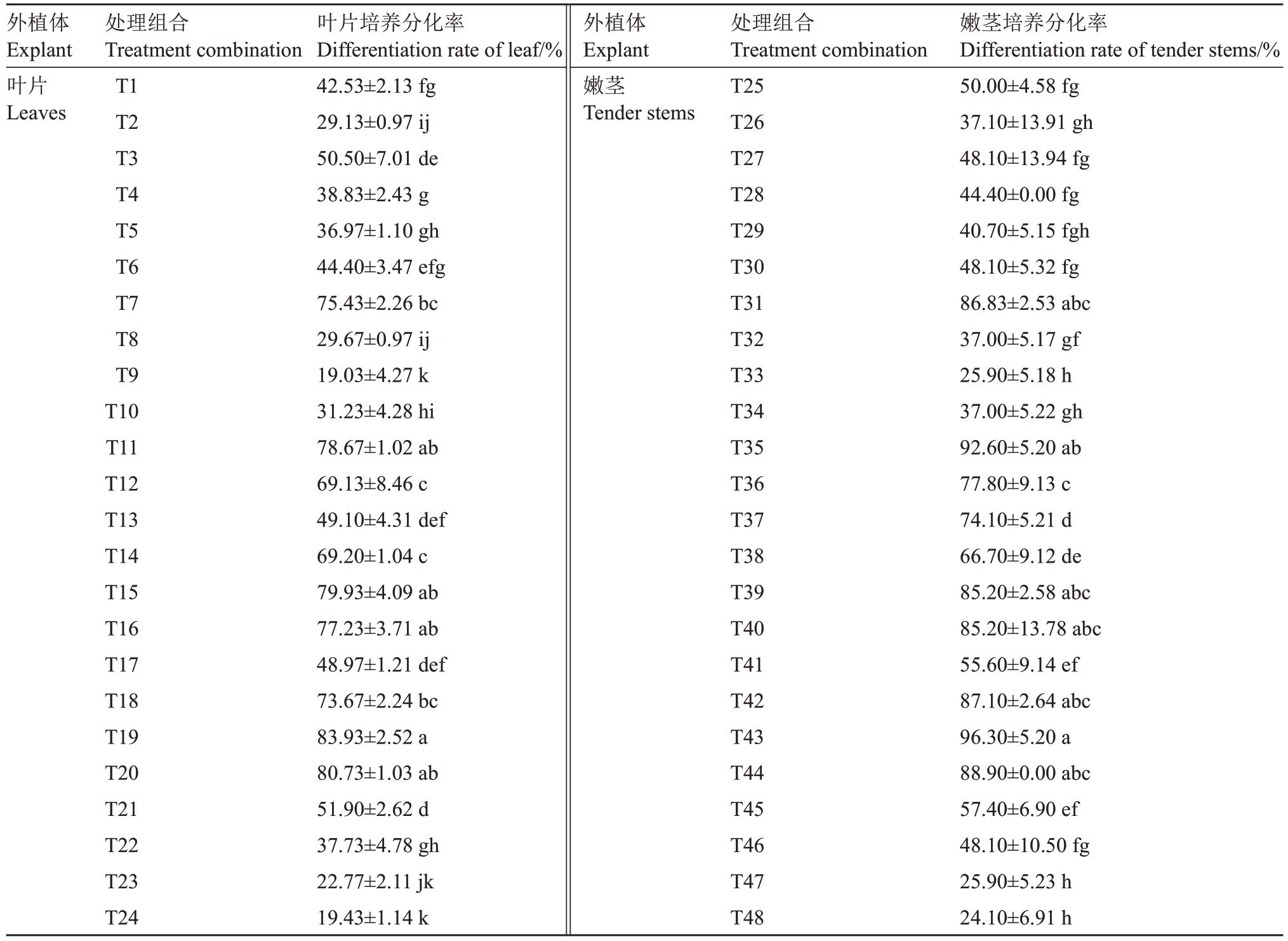
将石榴无菌苗叶片和嫩茎接种到含不同激素组合的WPM培养基中,培养35 d后进行观察和数据统计。由表3可知,添加不同质量浓度6-BA和IBA组合均可诱导叶片和嫩茎分化出芽。当添加0.22 mg·L-1 6-BA时,叶片和嫩茎的分化效果较好,与添加0.50、0.60、0.70 mg·L-1 IBA 配比组合后显著高于添加0.40 mg·L-1 IBA的激素组合;其中,IBA为0.60 mg·L-1时,叶片和嫩茎的分化率最高,分别为83.93%和96.30%,嫩茎分化率较叶片提高了14.74%(图2)。综合分析可得,石榴再生体系中不定芽分化最适外植体为嫩茎,分化培养基的最佳激素配比组合为0.22 mg·L-1 6-BA和0.60 mg·L-1 IBA。
表3 不同激素组合对外植体分化率的影响
Table 3 Effects of different hormone combinations on the differentiation rate of explants
注:不同小写字母表示差异显著(p<0.05)。下同。
Note:Different small letters indicate significant differences among treatments(p<0.05).The same below.
外植体Explant叶片Leaves处理组合Treatment combination T1 T2 T3 T4 T5 T6 T7 T8 T9 T10 T11 T12 T13 T14 T15 T16 T17 T18 T19 T20 T21 T22 T23 T24叶片培养分化率Differentiation rate of leaf/%42.53±2.13 fg 29.13±0.97 ij 50.50±7.01 de 38.83±2.43 g 36.97±1.10 gh 44.40±3.47 efg 75.43±2.26 bc 29.67±0.97 ij 19.03±4.27 k 31.23±4.28 hi 78.67±1.02 ab 69.13±8.46 c 49.10±4.31 def 69.20±1.04 c 79.93±4.09 ab 77.23±3.71 ab 48.97±1.21 def 73.67±2.24 bc 83.93±2.52 a 80.73±1.03 ab 51.90±2.62 d 37.73±4.78 gh 22.77±2.11 jk 19.43±1.14 k外植体Explant嫩茎Tender stems处理组合Treatment combination T25 T26 T27 T28 T29 T30 T31 T32 T33 T34 T35 T36 T37 T38 T39 T40 T41 T42 T43 T44 T45 T46 T47 T48嫩茎培养分化率Differentiation rate of tender stems/%50.00±4.58 fg 37.10±13.91 gh 48.10±13.94 fg 44.40±0.00 fg 40.70±5.15 fgh 48.10±5.32 fg 86.83±2.53 abc 37.00±5.17 gf 25.90±5.18 h 37.00±5.22 gh 92.60±5.20 ab 77.80±9.13 c 74.10±5.21 d 66.70±9.12 de 85.20±2.58 abc 85.20±13.78 abc 55.60±9.14 ef 87.10±2.64 abc 96.30±5.20 a 88.90±0.00 abc 57.40±6.90 ef 48.10±10.50 fg 25.90±5.23 h 24.10±6.91 h

图2 不同外植体愈伤组织分化
Fig.2 Different explants callus differentiation
A.嫩茎分化的不定芽;B.叶片分化的不定芽。标尺=1 cm。下同。
A.Adventitious buds differentiated from tender stems;B.Adventitious buds differentiated from leaves.Bar=1 cm.The same below.
2.2 不同质量浓度Kan对石榴嫩茎分化的影响
将石榴无菌苗嫩茎(去生长点,不包含芽原基部分)接种到含不同质量浓度Kan 的分化培养基中培养35 d。表4和图3结果显示,不添加Kan时愈伤组织分化的不定芽生长状况最佳,分别表现在嫩茎诱导的愈伤组织为嫩绿色,不定芽的分化率达到88.33%,显著高于其他处理,分化能力旺盛;随着Kan 质量浓度的增加,石榴嫩茎愈伤组织诱导率及分化率逐渐下降;当Kan 质量浓度为50 mg·L-1时,嫩茎愈伤组织诱导率由80.00%降至56.67%,且愈伤组织出现黄化现象,不定芽分化能力较弱;当Kan质量浓度增加至60~70 mg·L-1时,对外植体毒害作用逐渐加重,表现为石榴嫩茎愈伤组织诱导率低至30%以下,愈伤组织褐化严重甚至死亡,分化率为0。因此,采用50 mg·L-1 Kan 作为石榴嫩茎愈伤组织分化的临界质量浓度进行转化苗的筛选。
表4 不同Kan 质量浓度处理下外植体诱导率及分化率
Table 4 Explants induction and differentiation rate under different Kan concentration treatments
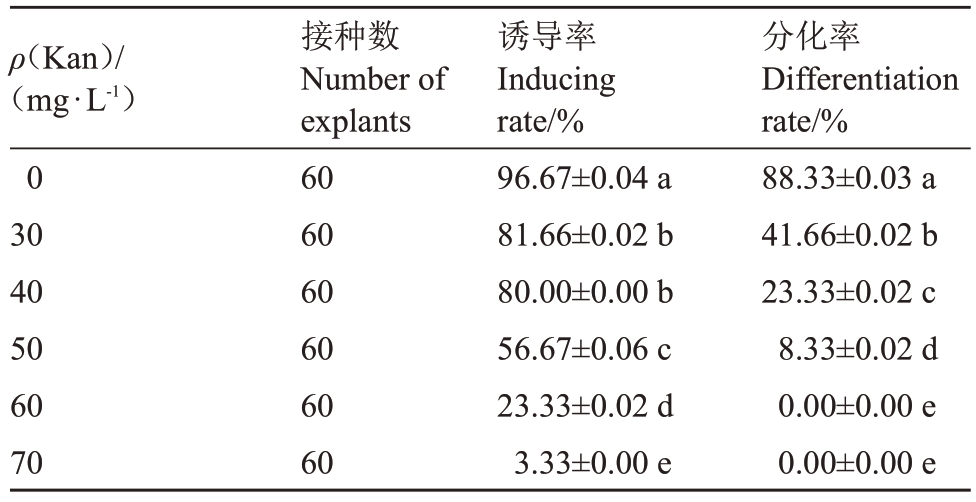
ρ(Kan)/(mg·L-1)0 30 40 50 60 70接种数Number of explants 60 60 60 60 60 60诱导率Inducing rate/%96.67±0.04 a 81.66±0.02 b 80.00±0.00 b 56.67±0.06 c 23.33±0.02 d 3.33±0.00 e分化率Differentiation rate/%88.33±0.03 a 41.66±0.02 b 23.33±0.02 c 8.33±0.02 d 0.00±0.00 e 0.00±0.00 e

图3 不同Kan 质量浓度对外植体分化的影响
Fig.3 Effects of different concentrations on explants differentiation
A.0 mg·L-1;B.30 mg·L-1;C.40 mg·L-1;D.50 mg·L-1;E.60 mg·L-1;F.70 mg·L-1。
2.3 不同质量浓度TMT对石榴嫩茎分化的影响
将农杆菌菌液侵染后的嫩茎接种于含不同TMT质量浓度的分化培养基35 d后进行观察,结果如表5 所示,不同质量浓度的TMT均能够较好抑制农杆菌生长,但随着TMT质量浓度的增加,石榴嫩茎分化率和污染率呈逐渐下降的趋势。在50 mg·L-1 TMT 处理下,嫩茎分化率最高为67.22%,但外植体污染率显著高于其他处理;当TMT质量浓度增加至200 mg·L-1时,在基本抑制农杆菌生长的同时,嫩茎不定芽分化率能超过50%;250~300 mg·L-1 TMT 虽完全抑制了农杆菌的生长,但外植体分化率逐渐降低,表明TMT质量浓度过高会对芽点的生长造成一定的影响。因此综合考虑,选取200 mg·L-1 TMT作为遗传转化的抑菌质量浓度。
表5 不同TMT 质量浓度处理下外植体污染率及分化率
Table 5 Explants contamination and differentiation rate
under different TMT concentration treatments
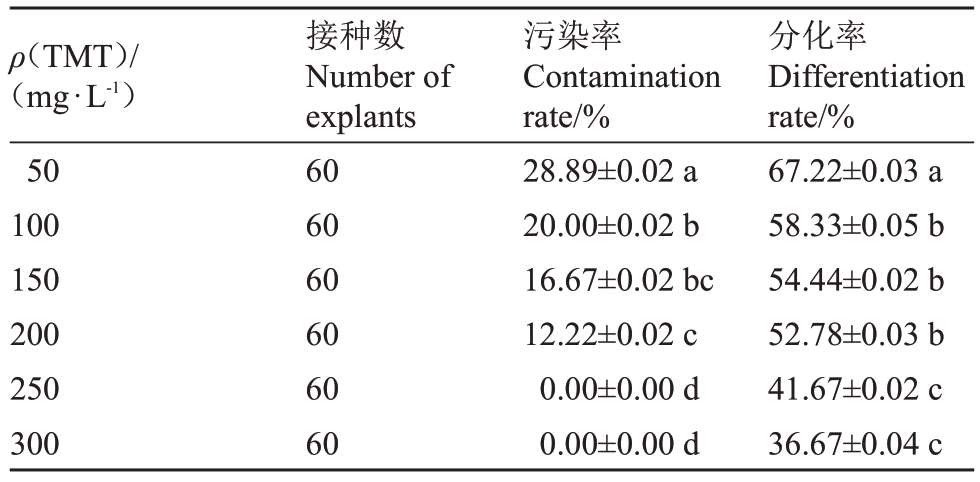
ρ(TMT)/(mg·L-1)50 100 150 200 250 300接种数Number of explants 60 60 60 60 60 60污染率Contamination rate/%28.89±0.02 a 20.00±0.02 b 16.67±0.02 bc 12.22±0.02 c 0.00±0.00 d 0.00±0.00 d分化率Differentiation rate/%67.22±0.03 a 58.33±0.05 b 54.44±0.02 b 52.78±0.03 b 41.67±0.02 c 36.67±0.04 c
2.4 农杆菌介导石榴遗传转化条件的影响
方差分析结果表明,4 个转化因子中预培养时间和菌液浓度对转化率有极显著影响,而侵染时间和抑菌剂浸洗时间的影响不显著(表6)。通过正交试验结果直观分析(表7),在16 组不同水平处理的转化因子组合试验中组合间差异显著,各处理组合转化率差异较大,极差结果看出预培养时间>菌液浓度>侵染时间>抑菌剂浸洗时间。比较均值发现转化率随着预培养时间和菌液浓度的增加呈“S”形曲线上升(预培养时间的转化率均值依次为9.67%、2.50%、19.33%、3.33%;菌液浓度的转化率均值依次为5.00%、7.83%、12.17%、9.83%),预培养时间3 d和菌液OD600=0.7 时的转化率达到了最高值。侵染时间和抑菌剂浸洗时间对转化率虽没有显著影响,但侵染10 min 和抑菌剂浸洗15 min 的转化率均值高于其他处理。进一步的单因素方差分析和多重比较(表8)可知,不同预培养时间的转化率具有显著差异,预培养3 d 的转化率与预培养1、2 和4 d的转化率之间有显著差异,预培养1 d 的转化率与预培养4 d的转化率之间没有显著差异;不同菌液浓度水平下OD600=0.7 的转化率与OD600=0.6 和0.8 的转化率间差异不显著,与OD600=0.5 之间差异显著;侵染时间和抑菌剂浸洗时间各水平间差异不显著。综合各因子试验结果,得到农杆菌介导石榴嫩茎遗传转化的最佳转化因子组合是A3B4C2D1(组合12),即预培养3 d、菌液OD600=0.8、侵染时间10 min 和抑菌剂浸洗时间15 min 为白花玉石籽石榴遗传转化体系建立的最佳条件组合(图4)。
表6 4 个转化因子组合转化率的方差分析
Table 6 Analysis of variance for conversion rate of four conversion factor combinations

注:**表示在0.01 水平上差异显著。
Note:**indicates significant difference at 0.01 level.
变异来源Source of variation df F F0.05 F0.01 ABCD SS 22 3.29 5.42区组Block试验误差Test error总变异Total variance 31001 33332 MS 7.25 1.11 0.26 0.04 0.04 0.08 88.77**13.59**3.17 0.50 0.50 4.54 8.68 31 15 29
表7 4 个转化因子组合正交试验分析
Table 7 Orthogonal test analysis of four transformation factors combination

处理组合Treatment combination因素Factor A B C D 123456789 10 11 12 13 14 15 16 1(1)1(1)1(1)1(1)2(2)2(2)2(2)2(2)3(3)3(3)3(3)3(3)4(4)4(4)4(4)4(4)9.67 2.50 19.33 3.33 16.83 1(0.5)2(0.6)3(0.7)4(0.8)1(0.5)2(0.6)3(0.7)4(0.8)1(0.5)2(0.6)3(0.7)4(0.8)1(0.5)2(0.6)3(0.7)4(0.8)5.00 7.83 12.17 9.83 7.17 1(5)2(10)3(15)4(20)2(10)1(5)4(20)3(15)3(15)4(20)1(5)2(10)4(20)3(15)2(10)1(5)6.67 10.17 9.00 9.00 3.50 1(15)2(20)3(25)4(30)3(25)4(30)1(15)2(20)4(30)3(25)2(20)1(15)2(20)1(15)4(30)3(25)9.33 8.00 8.50 9.00 1.33接种数Number of explants 50 50 50 50 50 50 50 50 50 50 50 50 50 50 50 50转化率Transformationrate/%1.33 fg 7.33 d 16.67 c 13.33 c 2.00 efg 3.33 efg 4.67 def 0.00 g 14.00 c 15.33 c 22.00 b 26.00 a 2.67 efg 5.33 de 5.33 de 0.00 g x1 x2 x3 x4 R
表8 4 个转化因子转化率的方差分析
Table 8 Analysis of variance for conversion rate of four transformation factors
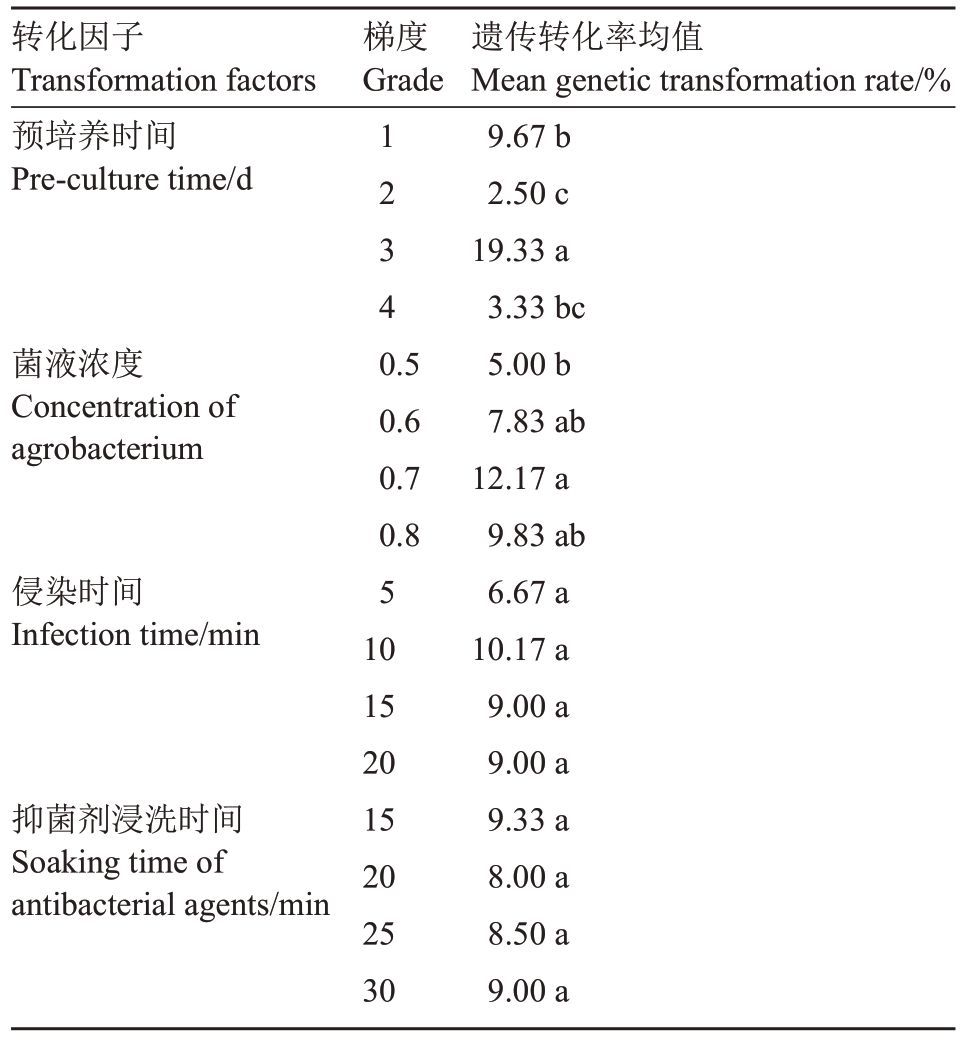
转化因子Transformation factors预培养时间Pre-culture time/d梯度Grade 1234菌液浓度Concentration of agrobacterium 0.5 0.6 0.7 0.8侵染时间Infection time/min抑菌剂浸洗时间Soaking time of antibacterial agents/min 5 10 15 20 15 20 25 30遗传转化率均值Mean genetic transformation rate/%9.67 b 2.50 c 19.33 a 3.33 bc 5.00 b 7.83 ab 12.17 a 9.83 ab 6.67 a 10.17 a 9.00 a 9.00 a 9.33 a 8.00 a 8.50 a 9.00 a

图4 白花玉石籽石榴遗传转化流程
Fig.4 The genetic transformation process of Baihuayushizi pomegranate
A.预培养3 d;B.农杆菌侵染嫩茎;C.分化培养10 d;D.愈伤组织表面出现芽点;E.不定芽形成植株;F.转移到生根培养基的再生苗;G~H.炼苗与移栽。
A. Pre culture for 3 d; B.Agrobacterium infection of tender stems; C. Selective culture for 10 d; D. Bud points appeared on the surface of callus;E.Adventitious buds form plants;F.Regenerated seedlings transferred to rooting medium;G-H.Hardening and transplanting.
2.5 石榴转基因植株的鉴定
通过荧光显微镜能够在特定波长的蓝色激发光源下,观察到GFP 在细胞中绿色荧光的表达情况。笔者取筛选后的石榴健康植株根系为样本进行荧光显微镜检测(图5)。经过统计,在最优体系条件下,接种50 株外植体,获得荧光苗13 株,转化效率为26.00%。

图5 GFP 在转基因植株根系中的表达
Fig.5 The expression of GFP in the roots of transgenic plants
标尺=100 μm。Bar=100 μm.
3 讨 论
高效遗传转化技术是进行基因功能验证最直接、最广泛的方法。目前,石榴遗传转化体系的研究存在不同品种差异较大、外植体遗传背景不清晰、转化率低等问题,其根本原因是石榴组织培养技术体系建立得不完善。建立稳定、高效的再生体系,是遗传转化的关键环节[26]。通常石榴组织培养体系建立不完善会出现材料褐化[27]、再生率低[28]等问题。笔者以此为切入点,在已克服外植体褐化问题、建立石榴组织培养体系的基础上,优化外植体再生途径;进行筛选剂、抑菌剂的浓度确定;最后通过探究预培养时间、菌液浓度、侵染时间等影响白花玉石籽石榴遗传转化的重要因子,得到遗传转化率为26.00%。研究表明,红腺忍冬(Lonicera hypoglauca Miq.)遗传转化率最高为8.56%[29];甜瓜(Cucumis melo L.)则仅为6.70%[30];通过对柑橘遗传转化体系进行优化,其转化率为13.00%~36.00%[31]。白城小黑杨(Populus simonii×P.nigra‘Baicheng’)[32]、万寿菊(Tagetes erecta)[33]等植物转化效率均低于5.00%。因此,笔者建立了相对完善的白花玉石籽石榴遗传转化体系,为后续石榴基因功能及调控、分子育种等方向的研究提供坚实的技术支撑。
不定芽的发生方式一般可以分为2 种,即直接发生型和间接发生型[34]。直接发生型操作过程简化且能够缩短育种周期。在研究白术(Atractylodes macrocephala)胚轴和胚根直接分化不定芽的再生体系的过程中,梁玉玲等[35]发现采用间接发生型的方式获得植株,极容易出现褐变、体细胞变异等情况,这与朱雅静等[36]对紫果西番莲(Passiflora edulis)子叶再生体系的建立结果相似,最终均采用了直接发生型的方式获得不定芽。因此,笔者通过对石榴再生途径的优化,获得石榴最佳直接发生型的不定芽诱导途径,在一定程度上避免了遗传转化过程中嵌合体的出现,提高了遗传转化率。笔者采用嫩茎和叶片为外植体进行不定芽分化,发现嫩茎分化率显著高于叶片,分化率达96.30%。因此,选用嫩茎为白花玉石籽石榴遗传转化体系的受体材料,为成功建立遗传转化体系奠定了基础。
在遗传转化过程中,需要两种类型的抗生素,分别为转化受体材料的筛选剂及抑制农杆菌生长的抑菌剂。因此,选择适宜的抗生素种类及浓度是遗传转化体系建立的重要环节[37]。Kan作为遗传转化中广泛使用的抗生素,其质量浓度会对遗传转化效率产生关键影响。研究发现,添加50 mg·L-1 Kan的筛选效果较好,能稳定地进行石榴遗传转化,大岩桐(Sinningia speciosa Benth)[38]和甜椒(Capsicum annuum)[39]遗传转化相关因素优化均证明50 mg·L-1 Kan 可提高遗传转化效率。在抑制农杆菌生长中,周赓等[40]关于黄瓜(Cucumis sativus L.)对不同浓度TMT的抑菌作用研究表明,共培养后用脱菌处理可显著抑制农杆菌的生长。本研究也发现,适宜的抑菌剂浓度有助于在植物分化与抑制农杆菌生长中找到平衡点,从而成功建立遗传转化体系。
预培养时间[41]、农杆菌浓度与侵染时间[42]及抑菌剂浸洗时间[43]是遗传转化研究中讨论较多的影响因素。一般来讲,预培养时间过短,细胞未进入最佳分化阶段,外源基因的整合较少;时间过长,外植体伤口会产生保护层,阻碍农杆菌与分裂细胞的接触。笔者以石榴嫩茎为受体材料,发现遗传转化过程中预培养3 d 时转化率最高。本研究结果与赵玉洁[15]以突尼斯软籽石榴子叶和叶片为受体材料建立遗传转化体系得到的预培养时间一致;唐伶俐等[30]以甜瓜子叶为受体材料进行遗传转化研究,结果表明子叶进行3 d预培养可明显提高转化率,这说明不同植物材料对预培养时间的要求基本一致。合适的菌液浓度和最佳的侵染时间有利于提高转化效率,如果农杆菌菌液浓度过低或侵染时间过短,导致侵染后受体内农杆菌含量过低,转化效果不理想;反之,会使农杆菌过量生长,不利于受体材料的恢复及脱菌困难。笔者发现嫩茎侵染条件为菌液OD600=0.8、侵染时间为10 min 效果较好,与李跃霞[44]以实生苗叶片为受体材料进行遗传转化得到的最佳侵染时间相同,但菌液浓度差异较大,原因可能是进行遗传转化的石榴品种不同、受体材料不同或受体材料来源不同造成结果有差异;郭利军等[45]以菠萝[Ananas comosus(L.)Merr.]愈伤组织为受体材料进行遗传转化时侵染时间差异较大,分析其原因可能是外植体不同造成结果有差异,愈伤组织作为外植体较难受到农杆菌的侵染,而导致试验结果有较大差异。研究发现,选择培养前受体材料在抗生素中的浸洗时间对植物生长分化也有不同的影响,通过前期试验发现,200 mg·L-1 TMT对农杆菌的抑制作用比较明显,对受体材料的转化率影响较小。但共培养后植株会染菌,因此对受体材料表面的农杆菌进行浸洗,能够避免因农杆菌脱菌困难造成遗传转化率低等问题,郭红艳等[43]结果同样表明,适宜的TMT溶液浸洗时间能抑制农杆菌的生长,是外植体转化的关键,这一结论与本研究结果相似。
4 结 论
笔者以白花玉石籽石榴无菌苗为材料,对石榴再生体系中的外植体类型和激素组合进行了再优化,筛选了适宜石榴嫩茎分化的Kan、TMT 质量浓度,并探究了影响农杆菌介导的白花玉石籽石榴嫩茎遗传转化因子。结果表明,WPM 培养基中加入0.22 mg·L-1 6-BA 和0.60 mg·L-1 IBA 能显著促进石榴外植体的再分化,分化率超过96.00%;以分化率高的石榴嫩茎为受体材料,50 mg·L-1 Kan、200 mg·L-1 TMT 为筛选抗性芽的最佳质量浓度。白花玉石籽石榴嫩茎最适的遗传转化步骤为(:1)石榴嫩茎预培养3 d后,置于菌液OD600=0.8中侵染10 min,侵染后用无菌滤纸吸干菌液,接种于添加0.1 mol·L-1 AS的分化培养基中,于(25±2)℃条件下暗培养2 d;(2)暗培养后,将嫩茎放入添加200 mg·L-1 TMT的无菌水中浸洗,浸洗后使用无菌滤纸吸干多余水分,接种于含添加50 mg·L-1 Kan、200 mg·L-1 TMT的分化培养基中进行培养;(3)培养35 d后,待抗性芽长到2~3 cm时,切下芽点置于生根培养基中(WPM+0.8 mg·L-1IBA+50 mg·L-1 Kan+200 mg·L-1 TMT)培养成苗。通过以上方法获得的植株通过GFP荧光检测,阳性植株获得率为26.00%。综上所述,笔者成功建立了以嫩茎为受体材料的白花玉石籽石榴遗传转化体系,为石榴基因功能验证和品种改良提供技术支撑和理论依据。
[1] 刘司瑜,林艺灵,王令宇,夏家欣,杨毓贤,房经贵,王晨,上官凌飞.石榴ATG 基因家族鉴定及其在非生物胁迫下的表达模式分析[J].植物资源与环境学报,2022,31(5):37-49.LIU Siyu,LIN Yiling,WANG Lingyu,XIA Jiaxin,YANG Yuxian,FANG Jinggui,WANG Chen,SHANGGUAN Lingfei.Identification of ATG gene family of Punica granatum and analysis on their expression pattern under abiotic stress[J]. Journal of Plant Resources and Environment,2022,31(5):37-49.
[2] 侯乐峰,罗华,毕润霞,郝兆祥,谭伟,张立华.我国石榴育种四十年回顾与展望[J].北方园艺,2022(24):139-147.HOU Lefeng,LUO Hua,BIRunxia,HAO Zhaoxiang,TAN Wei,ZHANG Lihua. Review and prospect of pomegranate breeding in China in the past 40 years[J].Northern Horticulture,2022(24):139-147.
[3] 关思慧,柴亚倩,杨元玲,刘慧英,郝庆,刁明.低温胁迫对石榴光合特性和抗氧化能力的影响[J]. 中国农学通报,2024,40(3):66-75.GUAN Sihui,CHAIYaqian,YANG Yuanling,LIU Huiying,HAO Qing,DIAO Ming. Effects of low temperature stress on photosynthetic characteristics and antioxidant capacity of pomegranate[J]. Chinese Agricultural Science Bulletin,2024,40(3):66-75.
[4] 刘春,储思媛,李锦锦.石榴离体再生体系建立及遗传转化技术研究进展[J].安徽农学通报,2023,29(4):17-21.LIU Chun,CHU Siyuan,LIJinjin. Research progress on establishment of in vitro regeneration system and genetic transformation technology of pomegranate[J]. Anhui Agricultural Science Bulletin,2023,29(4):17-21.
[5] 冯玉增,宋梅亭. 我国石榴产业现状及发展建议[J]. 农技服务,2006,23(5):6-8.FENG Yuzeng,SONG Meiting. Present situation and development suggestions of pomegranate industry in China[J].Agricultural Technology Service,2006,23(5):6-8.
[6] DANISMAN S,VAN DIJK A D J,BIMBO A,VAN DER WAL F,HENNIG L,DE FOLTER S,ANGENENT G C,IMMINK R G H.Analysis of functional redundancies within the Arabidopsis TCP transcription factor family[J]. Journal of Experimental Botany,2013,64(18):5673-5685.
[7] PARAPUNOVA V,BUSSCHER M,BUSSCHER-LANGE J,LAMMERS M,KARLOVA R,BOVY A G,ANGENENT G C,DE MAAGD R A. Identification,cloning and characterization of the tomato TCP transcription factor family[J]. BMC Plant Biology,2014,14:157.
[8] QIAN J J,WANG N,REN W X,ZHANG R F,HONG X Y,CHEN L Y,ZHANG K J,SHU Y J,HU N B,YANG Y C. Molecular dissection unveiling dwarfing effects of plant growth retardants on pomegranate[J]. Frontiers in Plant Science,2022,13:866193.
[9] 陈梅,陈露倩,陈思,杜长霞,樊怀福.农杆菌介导的黄瓜遗传转化体系优化研究[J].四川农业大学学报,2024,42(3):540-545.CHEN Mei,CHEN Luqian,CHEN Si,DU Changxia,FAN Huaifu.Optimization of the genetic transformation system of cucumber mediated by Agrobacterium tumefaciens[J]. Journal of Sichuan Agricultural University,2024,42(3):540-545.
[10] DOMINGUEZ M M,PADILLA C S,MANDADIK K.A versatile Agrobacterium-based plant transformation system for genetic engineering of diverse Citrus cultivars[J]. Frontiers in Plant Science,2022,13:878335.
[11] JAMES D J,PASSEY A J,BARBARA D J,BEVAN M.Genetic transformation of apple (Malus pumila Mill.) using a disarmed Ti-binary vector[J].Plant Cell Reports,1989,7(8):658-661.
[12] GAO M,MURAYAMA H,MATSUDA N,ISUZUGAWA K,DANDEKAR A M,NAKANO H. Development of Agrobacterium-mediated transformation of pear (Pyrus communis L.) with cotyledon explants and production of transgenic pears using ACC oxidase cDNA[J].Plant Biotechnology,2002,19(5):319-327.
[13] ORBOVIC V,PRIETO H. Editorial:New developments in Agrobacterium mediated transformation of tree fruit crops,volume II[J].Frontiers in Plant Science,2023,14:1249563.
[14] SONG G Q,PRIETO H,ORBOVIC V.Agrobacterium-mediated transformation of tree fruit crops:Methods,progress,and challenges[J].Frontiers in Plant Science,2019,10:226.
[15] 赵玉洁.‘突尼斯软子’石榴遗传转化体系建立及转化ICE1基因的研究[D].郑州:河南农业大学,2017.ZHAO Yujie. Establishment of genetic transformation system and transformed ICE1 gene into‘Tunisia soft-seed’pomegranate[D].Zhengzhou:Henan Agricultural University,2017.
[16] 刘真真.石榴遗传转化体系优化和石榴PgICE1 克隆及功能初探[D].郑州:河南农业大学,2019.LIU Zhenzhen. Optimization of genetic transformation system and cloning and function of PgICE1[D].Zhengzhou:Henan Agricultural University,2019.
[17] 吴亚君. 石榴不同外植体再生体系建立及遗传转化体系初探[D].郑州:河南农业大学,2015.WU Yajun. Establishment of regeneration system on different explants and transformation in pomegranate[D]. Zhengzhou:Henan Agricultural University,2015.
[18] VERMA V,KANWAR K,TUFCHIM,KASHYAP M.Agrobacterium-mediated Cry1A(b) gene transfer in Punica granatum L.cv. Kandhari Kabuli using different in vitro regeneration pathways[J]. Journal of Crop Science and Biotechnology,2014,17(1):1-10.
[19] 刘真真,赵玉洁,胡青霞,谭彬,陈延惠,简在海,史江莉,万然.石榴试管嫁接技术研究[J].果树学报,2019,36(4):521-528.LIU Zhenzhen,ZHAO Yujie,HU Qingxia,TAN Bin,CHEN Yanhui,JIAN Zaihai,SHIJiangli,WAN Ran. Study on micrografting in vitro of pomegranate[J]. Journal of Fruit Science,2019,36(4):521-528.
[20] QIAN J J,GE W Q,WANG N N,HU Y J.De building of tissue culture system and post-transplant quality comparison of‘Baihuayushizi’pomegranates (Punica granatum L.)[J]. Pakistan Journal of Botany,2021,53(2):531-540.
[21] 李晓军,安轶,黄李超,曾为,卢孟柱.银腺杨84K 茎段瞬时转化体系的建立[J].林业科学,2021,57(4):82-89.LIXiaojun,AN Yi,HUANG Lichao,ZENG Wei,LU Mengzhu.Establishment of a transient transformation system for stem segments of poplar 84K[J].Scientia Silvae Sinicae,2021,57(4):82-89.
[22] WANG X Q,SHEN X,HE Y M,REN T N,WU W T,XIT.An optimized freeze-thaw method for transformation of Agrobacterium tumefaciens EHA105 and LBA4404[J]. Pharmaceutical Biotechnology,2011,18(5):382-386.
[23] 王民炎,俞文仙,赵耘霄,陈益存,高暝,吴立文,吴善群,汪阳东.农杆菌介导的山苍子遗传转化体系的构建[J].林业科学研究,2022,35(5):71-80.WANG Minyan,YU Wenxian,ZHAO Yunxiao,CHEN Yicun,GAO Ming,WU Liwen,WU Shanqun,WANG Yangdong. Establishment of Agrobacterium mediated genetic transformation system of Litsea cubeba[J].Forest Research,2022,35(5):71-80.
[24] 刘闵豪,徐郡儡,叶靖,李周岐,范睿深,李龙.农杆菌介导的杜仲叶片愈伤组织遗传转化体系[J].林业科学,2020,56(2):79-88.LIU Minhao,XU Junlei,YE Jing,LIZhouqi,FAN Ruishen,LILong. Agrobacterium tumefaciens-mediated transformation of leaf callus in Eucommia ulmoides[J]. Scientia Silvae Sinicae,2020,56(2):79-88.
[25] 岑云昕,刘佳,陈发菊,杨敬元,刘强,王韬,梁宏伟.农杆菌介导的楸树遗传转化体系[J].林业科学,2021,57(8):195-204.CEN Yunxin,LIU Jia,CHEN Faju,YANG Jingyuan,LIU Qiang,WANG Tao,LIANG Hongwei.Agrobacterium-mediated genetic transformation system of Catalpa bungei[J].Scientia Silvae Sinicae,2021,57(8):195-204.
[26] 赵宁,冯建灿,叶霞,谭彬,李继东,郑先波,齐贤,连晓东.枣组织培养及相关生物技术研究进展[J].果树学报,2015,32(6):1241-1252.ZHAO Ning,FENG Jiancan,YE Xia,TAN Bin,LIJidong,ZHENG Xianbo,QIXian,LIAN Xiaodong. A review of tissue culture and biotechnology in Chinese jujube[J]. Journal of Fruit Science,2015,32(6):1241-1252.
[27] 李林瑜,周龙,程云霞,马梦婷,姚春苑.加州软籽甜石榴茎段和叶片组织培养研究初探[J].中国南方果树,2018,47(1):132-135.LILinyu,ZHOU Long,CHENG Yunxia,MA Mengting,YAO Chunyuan. Preliminary study on stem and leaf tissue culture of California soft-seed sweet pomegranate[J]. South China Fruits,2018,47(1):132-135.
[28] 王菲,陶吉寒,尹燕雷,冯立娟,杨雪梅.4 个优良石榴品种叶片高频再生体系的建立[J].中国农学通报,2015,31(13):100-107.WANG Fei,TAO Jihan,YIN Yanlei,FENG Lijuan,YANG Xuemei. Establishment of adventitious shoot regeneration system from leaves of 4 pomegranate cultivars in vitro[J].Chinese Agricultural Science Bulletin,2015,31(13):100-107.
[29] 谭木秀,莫乔程,刘凤鸣,潘晓思,林绍洁,师凤华.红腺忍冬遗传转化体系的优化[J].中药材,2021,44(9):2045-2050.TAN Muxiu,MO Qiaocheng,LIU Fengming,PAN Xiaosi,LIN Shaojie,SHIFenghua. Optimization of genetic transformation system of Lonicera hypoglauca[J]. Journal of Chinese Medicinal Materials,2021,44(9):2045-2050.
[30] 唐伶俐,徐龙兰,徐永阳,贺玉花,田小琴,张健,孔维虎,李文东,赵光伟.农杆菌介导的厚皮甜瓜遗传转化体系的建立[J].果树学报,2024,41(3):533-542.TANG Lingli,XU Longlan,XU Yongyang,HE Yuhua,TIAN Xiaoqin,ZHANG Jian,KONG Weihu,LIWendong,ZHAO Guangwei. Establishment of genetic transformation system mediated by Agrobacterium in muskmelon[J]. Journal of Fruit Science,2024,41(3):533-542.
[31] XIAO Y X,DUTT M,MA H J,CUIX,ZHU T,WANG Z Q,HE X J,SUN Z H,QIU W M.Establishment of an efficient root mediated genetic transformation method for gene function verification in citrus[J].Scientia Horticulturae,2023,321:112298.
[32] 何旭,高源,张群野,周晨光,李伟,李爽.白城小黑杨遗传转化体系建立及其应用[J].植物研究,2023,43(5):667-678.HE Xu,GAO Yuan,ZHANG Qunye,ZHOU Chenguang,LIWei,LIShuang. Establishment and application of genetic transformation system for Populus simonii×P.nigra‘Baicheng’[J].Bulletin of Botanical Research,2023,43(5):667-678.
[33] 余晓敏,王亚琴,刘雨菡,易庆平,程文翰,朱钰,段枫,张莉雪,何燕红.根癌农杆菌介导万寿菊遗传转化体系的建立[J].植物学报,2023,58(5):760-769.YU Xiaomin,WANG Yaqin,LIU Yuhan,YIQingping,CHENG Wenhan,ZHU Yu,DUAN Feng,ZHANG Lixue,HE Yanhong.Establishment of Agrobacterium tumefaciens-mediated genetic transformation system of marigold (Tagetes erecta)[J]. Chinese Bulletin of Botany,2023,58(5):760-769.
[34] 王焕丽,刘大军,冯国军,刘畅,杨晓旭,范有君,闫志山.菜豆再生体系及遗传转化体系研究进展[J].中国农学通报,2019,35(16):69-76.WANG Huanli,LIU Dajun,FENG Guojun,LIU Chang,YANG Xiaoxu,FAN Youjun,YAN Zhishan. Regeneration and genetic transformation system of Phaseolus vulgaris:Research advances[J]. Chinese Agricultural Science Bulletin,2019,35(16):69-76.
[35] 梁玉玲,鲜于梁艳,刘雯雯,张媛媛.白术胚轴和胚根直接分化不定芽的再生体系[J].河北大学学报(自然科学版),2020,40(2):171-175.LIANG Yuling,XIANYU Liangyan,LIU Wenwen,ZHANG Yuanyuan.Direct shoot regeneration in vitro forAtractylodes macrocephala using epicotyl and radicle as explants[J]. Journal of Hebei University(Natural Science Edition),2020,40(2):171-175.
[36] 朱雅静,王亚楠,赵李姗,余俊玲,王雪,许玉兰,蔡年辉,唐军荣.紫果西番莲子叶再生植株体系的建立[J].西部林业科学,2021,50(4):107-112.ZHU Yajing,WANG Yanan,ZHAO Lishan,YU Junling,WANG Xue,XU Yulan,CAINianhui,TANG Junrong. Establishment of plant regeneration system from cotyledons of Passiflora edulis[J].Journal of West China Forestry Science,2021,50(4):107-112.
[37] 李逸菲,王瑞博,夏惠婷,任璞玉,赵丹丹,秦肖洁,李永华,张开明.农杆菌介导四季秋海棠遗传转化体系建立[J].东北农业大学学报,2023,54(5):19-27.LIYifei,WANG Ruibo,XIA Huiting,REN Puyu,ZHAO Dandan,QIN Xiaojie,LIYonghua,ZHANG Kaiming. Establishment of Agrobacterium-mediated genetic transformation system for Begonia semperflorens[J]. Journal of Northeast Agricultural University,2023,54(5):19-27.
[38] 郭丽,程征.根癌农杆菌介导大岩桐遗传转化体系探究[J].分子植物育种,2019,17(14):4638-4642.GUO Li,CHENG Zheng.Research on Gloxinia genetic transformation system mediated by Agrobacterium tumefaciens[J]. Molecular Plant Breeding,2019,17(14):4638-4642.
[39] 苏振华,张俊华,张泽鑫,李妹芳,郭尚敬,曹雪松,冀芦沙.农杆菌介导的甜椒遗传转化体系的建立[J]. 江西农业学报,2019,31(6):9-15.SU Zhenhua,ZHANG Junhua,ZHANG Zexin,LIMeifang,GUO Shangjing,CAO Xuesong,JILusha. Establishment of Agrobacterium-mediated genetic transformation system of Capsicum annuum[J].Acta Agriculturae Jiangxi,2019,31(6):9-15.
[40] 周赓,刘昌龙,陈惠明,刘晓虹,杨侃侃,陈宸.华南生态型黄瓜‘CU2’遗传转化体系的优化[J].辣椒杂志,2024,22(1):52-59.ZHOU Geng,LIU Changlong,CHEN Huiming,LIU Xiaohong,YANG Kankan,CHEN Chen. Optimization of the genetic transformation system for the ecotype cucumber‘CU2’in South China[J].Journal of China Capsicum,2024,22(1):52-59.
[41] 贾红梅,王碧玉,刘迪,毛洪玉.农杆菌介导CBL 基因对菊花品种‘C008’的转化[J].西北林学院学报,2017,32(1):184-189.JIA Hongmei,WANG Biyu,LIU Di,MAO Hongyu.Agrobacterium- mediated transformation of Chrysanthemum morifolium‘C008’with CBL gene[J]. Journal of Northwest Forestry University,2017,32(1):184-189.
[42] 曹尚杰,焦孟月,张彦妮,岳莉然.矮牵牛‘梅林’遗传转化体系的建立[J].西北林学院学报,2018,33(5):123-129.CAO Shangjie,JIAO Mengyue,ZHANG Yanni,YUE Liran.Establishment of genetic transformation system of Petunia hybrida‘Merlin’[J]. Journal of Northwest Forestry University,2018,33(5):123-129.
[43] 郭红艳,隋益虎,胡能兵.辣椒遗传转化技术的研究[J].安徽科技学院学报,2022,36(3):21-26.GUO Hongyan,SUIYihu,HU Nengbing. Study on genetic transformation technology of Capsicum[J].Journal of Anhui Science and Technology University,2022,36(3):21-26.
[44] 李跃霞.‘突尼斯软籽’石榴遗传转化体系的构建和ISSRPCR 反应体系的优化[D].郑州:河南农业大学,2012.LIYuexia. Construction of genetic transformation system and optimization of ISSR-PCR system of‘Tunisia soft-seed’pomegranate[D].Zhengzhou:Henan Agricultural University,2012.
[45] 郭利军,梁其干,范春节,邓会栋,华敏,冯学杰,罗志文,陈哲.农杆菌介导台农17 号菠萝遗传转化相关因素优化[J].安徽农学通报,2021,27(21):22-26.GUO Lijun,LIANG Qigan,FAN Chunjie,DENG Huidong,HUA Min,FENG Xuejie,LUO Zhiwen,CHEN Zhe. Optimization of factors related to genetic transformation of Tainong 17 pineapple mediated by Agrobacterium tumefaciens[J].Anhui Agricultural Science Bulletin,2021,27(21):22-26.