在柑橘的贮运过程中,果实采后腐烂严重,烂果率为10%~30%,其中由意大利青霉(Penicillium italicum)侵染引起的青霉病是果实腐烂的主要致病原因之一[1],目前主要通过化学药剂控制该病害。由于使用防治的化学药剂在一定程度上也会抑制柑橘果实的生理活性,且长期使用化学试剂会降低植物对病原菌的抵御能力,使防治效果大大降低,以及公众对食品健康和环境污染的日益关注,因此,开发出更多绿色安全高效的方法来控制柑橘果实采后病害具有重要的生产意义。活性氧(ROS)的积累是由于植物遭受生物或非生物胁迫时,抗氧化防御系统不能及时消除其体内过量的ROS 而产生的氧化应激反应;其后果是破坏植物代谢平衡,导致植物生理紊乱甚至衰老死亡[2-3]。
茉莉酸甲酯(methyl jasmonate,MeJA)是一种重要的天然植物生长调节剂,可以作为植物抵抗病原体侵染产生防御反应的诱抗剂[4]。王瀚博[5]在研究MeJA预处理采后蓝莓果实对灰霉病抗性的影响中发现,MeJA可通过增强超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)等抗氧化酶活性,减轻活性氧损伤进而增强采后蓝莓果实对灰霉病的抗性。Wang等[6]的研究发现,MeJA能诱导杨梅抗氧化能力的增强,提高果实对橘青霉病菌(P. citrinum)的抗性。在外源MeJA 诱导猕猴桃抗软腐病的研究中发现,MeJA 诱导了果实中过氧化物酶(POD)、CAT和SOD等抗氧化酶活性的提高,同时也有效提高了相关酶基因AcPOD、AcSOD的表达量[7]。Cao等[8]的研究表明,10 μmol·L-1 MeJA处理采后枇杷果实可通过增加多胺的含量来抑制炭疽病的发生。王建伟等[9]研究表明外源施加MeJA后能够减轻盐胁迫对菜用甘薯光合系统的伤害,并且提高抗氧化酶活性和渗透调节物质的含量,促进菜用甘薯有机物质的积累,从而提高产量。以上研究表明,外源MeJA 的应用能够诱导采后果蔬产生防御反应,激活相关防御酶活性,促进抗病物质积累,从而有效增强其对病原菌的抗性[4]。目前有关MeJA诱导脐橙果实抗青霉病的报道较少。笔者课题组在前期的试验中表明MeJA在调控脐橙果实抗青霉病中发挥重要作用,与其提高果实中防御酶POD、多酚氧化酶(PPO)以及病程相关蛋白几丁质酶(CHI)、β-1,3-葡聚糖酶(GLU)活性密切相关,但MeJA诱导抗病与脐橙果实活性氧代谢之间的关系仍需要进一步探究。本试验中,以纽荷尔和龙回红脐橙果实为试材,探究外源MeJA 熏蒸处理对采后脐橙果实活性氧代谢相关酶活性及其酶基因表达的影响,旨在进一步探究MeJA 调控脐橙果实抗采后青霉病的作用机制,为MeJA 应用于果实贮藏保鲜提供理论依据。
1 材料和方法
1.1 试验材料
试验用果:纽荷尔、龙回红脐橙果实,于2021年11 月12 日采自江西省赣州市南康县龙回镇俊萍果业示范园(25.66° N,114.76° E),翌日运回实验室。选出大小均匀、成熟度一致、无病虫害和机械损伤的果实作为试验用果。先用自来水清洗,再用0.05%次氯酸钠溶液浸洗2 min,最后使用自来水冲洗干净。室温下晾干后使用保鲜袋单果套袋,入库备用(冷库温度:7~8 ℃)。
供试青霉病菌(P.italicum):由果蔬贮藏与保鲜江西省重点实验室提供。从典型脐橙发病果实中单孢分离,用马铃薯葡萄糖琼脂培养基(PDA)进行纯化培养。试验前于恒温箱[(25±1)℃]培养5~7 d,用无菌水洗脱孢子,经灭菌脱脂棉过滤后,配置浓度为1.25×106 spores·mL-1孢子悬浮液,备用。
试验试剂:茉莉酸甲酯(MeJA):纯度95%,水杨苷异羟肟酸(salicyhydroxamic acid,SHAM,茉莉酸生物合成抑制剂)购自美国Sigma-Aldrich 公司,配制浓度为100 μmol·L-1,待用。
1.2 脐橙果实处理
预试验筛选出最适浓度50 μmol·L-1和最适熏蒸时间24 h的MeJA处理,在(26±1)℃、相对湿度85%~95%环境下密闭熏蒸处理纽荷尔和龙回红脐橙果实;以无菌水处理为对照,另设100 μmol·L-1 SHAM喷施处理,共3组处理,24 h后于超净工作台上通风1 h 后接种。脐橙果实表面经75%乙醇消毒后,用接种针在其赤道部等距离刺伤,伤口大小为直径2 mm,深度3 mm;注入浓度为1.25×106 spores·mL-1的P. italicum 孢子悬浮液20 µL。每组处理3 次重复,每次重复30个果实,每处理共90个果实,处理后置于温度(26±1)℃、相对湿度85%~95%培养箱。接种后0~7 d 逐日从各处理中随机选取10 个果实,取3 组处理脐橙果实病健交界处1 cm 果皮组织,用液氮迅速冷冻研磨装袋,于-80 ℃超低温保存。
1.3 活性氧代谢相关酶活性和物质含量的测定
谷胱甘肽还原酶(GR)、APX 活性,还原型谷胱甘肽(GSH)、抗坏血酸(AsA)含量和超氧阴离子(O2.-)产生速率和丙二醛(MDA)含量参照曹建康等[10]方法测定,SOD活性、过氧化氢(H2O2)含量采用试剂盒(南京建成生物技术有限公司,南京,中国)测定。CAT 活性参考李合生[11]的方法测定。DPPH 自由基清除率参考张昭等[12]的方法测定。单脱氢抗坏血酸还原酶(MDHAR)和脱氢抗坏血酸还原酶(DHAR)活性参考Wei等[13]的方法测定。
1.4 活性氧代谢途径关键基因表达分析
参考马巧利[14]的方法,采用改良Trizol法提取果皮总RNA,使用微量核酸分析仪和1%琼脂糖凝胶电泳检测RNA 质量。使用Hifair®Ⅲ试剂盒(翌圣,上海)反转录RNA 合成cDNA 链。制备的cDNA 保存-80 ℃超低温冰箱用于后续qRT-PCR试验。基因表达测定:以甜橙CsActin 基因为定量的内参基因,通过qRT-PCR方法检测6种活性氧代谢抗病相关基因的表达量。引物序列如表1所示。PCR反应程序为:95 ℃预变性30 s,95 ℃持续5 s,60 ℃退火持续30 s,72 ℃延伸30 s,共反应40个循环。反应体系为10 μL,包含1 μLcDNA+0.3 μLF primer(10 mmol·L-1)+0.3 μL R primer(10 mmol·L-1)+ 5 μL TB Green®Premix Ex Taq™+3.4 μL ddH2O。每个样品3次重复测定,基因表达水平计算采用2-ΔΔCt方法[15]。
表1 引物序列
Table 1 Sequences of primers

甜橙基因名称Orange gene name CsCAT片段大小Fragment size/bp 248 NCBI号NCBIcode XM_006473731.3 Cu-ZnSOD 173 XM_006471743.2 CsGR 165 XM_006493645.3 CsAPX 309 XM_006492612.2 CsMDHAR 246 XM_006476437.3 CsDHAR3 136 XM_006482068.3 CsActin引物序列Primer sequence(5'→3')F-TAAACCTAACCCAAAGTCTCACA R-TTGCCTCATCTTCCAATAAACAC F-CTTGGTGGAACTGAGGGTGT R-GGGTTAAAGTGGGGTCCAGT F-CTTGGAGCATCAATGTGTGG R-AGCAACACGTCTCGTCACAG F-CGATCCGTTGCTTTGTCAG R-GCATAGTTCCCTCAGTTGCTT F-TGTGGGTGGAATACAGGTTGA R-ACTTTCCTGGGGCTTCCTTC F-GACTCGGCGACTGTCCATTT R-GGAACTTTACCTTCGGGGCT F-CATCCCTCAGCACCTTCC R-CCAACCTTAGCACTTCTCC 195 XM_006464503.3
1.5 数据处理与分析
试验按照完全随机试验设计,全部试验指标设3次生物学重复。数据采用Excel 2018和SPSS 20.0软件进行统计整理和单因素方差分析(ANOVA)。采用Origin 2018 软件作图,图中所有数据以平均值(mean)±标准误差(SE)表示。
2 结果与分析
2.1 MeJA 处理对脐橙果实GR 活性和GSH 含量的影响
从图1-A 可知,除接种后第1 天和第6 天外,纽荷尔MeJA处理组GR活性在接种后7 d内均显著高于对照(CK)和SHAM 处理组(p<0.05),其中在接种后第5 天到达峰值,分别是对照和SHAM 处理组的1.10倍和1.13倍。从图1-B可知,龙回红MeJA处理组GR 活性在除接种后第4 天和第6 天外均显著高于CK 和SHAM 处理组(p<0.05);MeJA 处理组的GR 活性在接种后第5 天最高,分别是CK 和SHAM处理组的1.13和1.16倍。
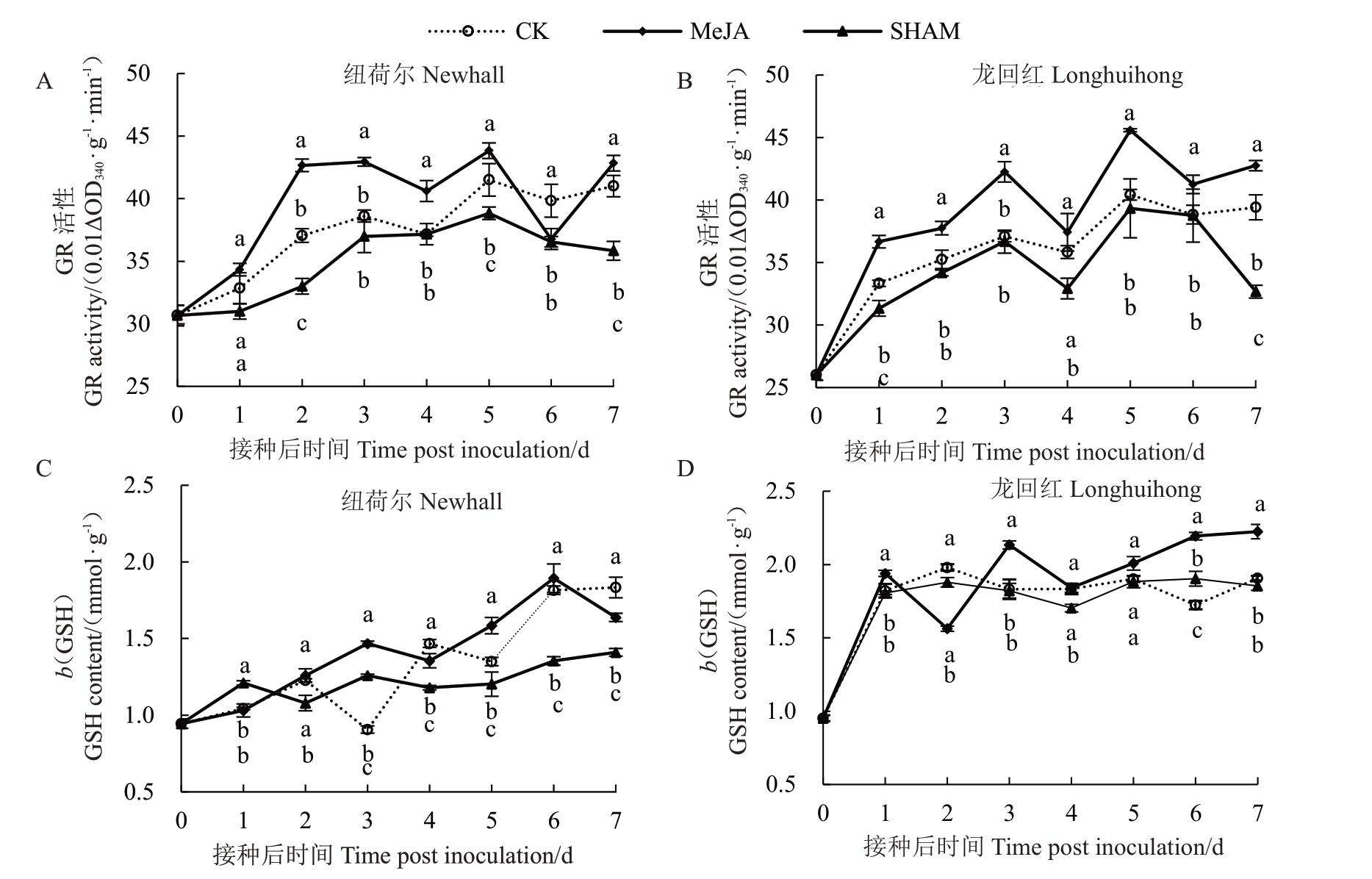
图1 MeJA 处理对脐橙果实GR 活性(A、B)和GSH 含量(C、D)的影响
Fig.1 Effect of MeJA treatment on GR activity(A,B)and GSH content(C,D)in navel orange fruits
每个时间节点上,不同小写字母表示不同处理之间经Duncan’s 新复极差法检验在(p<0.05)水平上差异显著。下同。
At each time point, different small letters represent significant difference between different treatments at (p<0.05) level by Duncan’s multiple range test.The same below.
在接种后第3天和第5~6天,纽荷尔MeJA处理组GSH含量显著高于CK和SHAM处理组(p<0.05);且在接种后第6天最高,分别是CK和SHAM处理组的1.17和1.32倍(图1-C)。在接种后第1、3天和第6~7天,龙回红MeJA 处理组GSH 含量显著高于CK 和SHAM处理组(p<0.05);且在接种后第7天最高,分别是CK和SHAM处理组的1.17和1.20倍(图1-D)。
2.2 MeJA 处理对脐橙果实APX 活性和AsA 含量的影响
纽荷尔脐橙MeJA 和CK 处理组APX 活性呈先上升后下降、然后再上升最后又下降的趋势,在接种后第3 天最高,MeJA 处理组显著高于CK 和SHAM处理组(p<0.05),分别是CK 和SHAM 处理组的1.16、1.22 倍(图2-A);龙回红MeJA 和CK 处理组APX 活性总体呈先上升后下降趋势,CK 和处理组APX活性均在接种后第4天最高,MeJA处理组显著高于CK 和SHAM 处理组(p<0.05),分别是CK 和SHAM处理组的1.49、1.45倍(图2-B)。随着接种时间的延长,纽荷尔MeJA和SHAM处理组均呈双峰趋势。在接种后除第4天外,纽荷尔MeJA处理组AsA含量均显著高于CK 和SHAM 处理组(p<0.05)(图2-C);MeJA 处理组AsA 含量在接种后第6 天最高,分别是CK和SHAM处理组的1.12和1.16倍。于接种后第1~7天,龙回红3组处理均大致呈先上升后下降趋势。在接种后第1天和第3~6天,龙回红MeJA处理组AsA含量显著高于CK和SHAM处理组(p<0.05)(图2-D);MeJA处理组AsA含量在接种后第4天最高,为CK和SHAM处理组的1.20和1.14倍。

图2 MeJA 处理对脐橙果实APX 活性(A、B)和AsA 含量(C、D)的影响
Fig.2 Effect of MeJA treatment on APX activity(A,B)and AsA content(C,D)in navel orange fruits
2.3 MeJA处理对脐橙果实SOD和CAT活性的影响
由图3-A 可知,纽荷尔3 组处理SOD 活性出现双峰趋势。在除接种后第6 天外,MeJA 处理SOD活性均显著高于CK 组(p<0.05);且在接种后第5天最高,分别是CK 和SHAM 处理组的1.12 和1.27倍。如图3-B 可知,龙回红MeJA 处理SOD 活性在接种后第3、7 天显著高于CK 组(p<0.05);且在接种后第6天最高,分别是CK和SHAM处理组的1.02和1.10倍。

图3 MeJA 处理对脐橙果实SOD 和CAT 活性的影响
Fig.3 Effect of MeJA treatment on SOD and CAT activity in navel orange fruits
纽荷尔3 组处理呈先上升后下降趋势(图3-C)。在接种后第1、6、7 天,MeJA 处理CAT 活性显著高于CK 和SHAM 处理组(p<0.05);在接种后第6 天最高,分别是CK 和SHAM 处理组的1.69 和2.10倍。龙回红MeJA处理组CAT活性在接种后除第6 天外均显著高于CK 和SHAM 处理组(p<0.05);MeJA 处理组CAT 活性于接种后第4 天最高,分别是CK 和SHAM 处理组的1.41 和1.96 倍(图3-D)。
2.4 MeJA处理对脐橙果实H2O2含量和O2.-产生速率的影响
如图4-A 所示,纽荷尔3 组处理H2O2含量呈先上升后下降趋势,于接种后第6天最高。MeJA处理H2O2含量在接种后第1~4 天和第7 天显著低于CK和SHAM 处理组(p<0.05);且在接种后第4 天,仅为CK 和SHAM 处理组的51.21%和44.37%。如图4-B 所示,龙回红3 组处理H2O2含量大致呈上升趋势。在接种后第3~5天,MeJA处理H2O2含量显著低于CK 组(p<0.05);于接种后第4 天,分别为CK 和SHAM处理组的84.67%和90.93%。
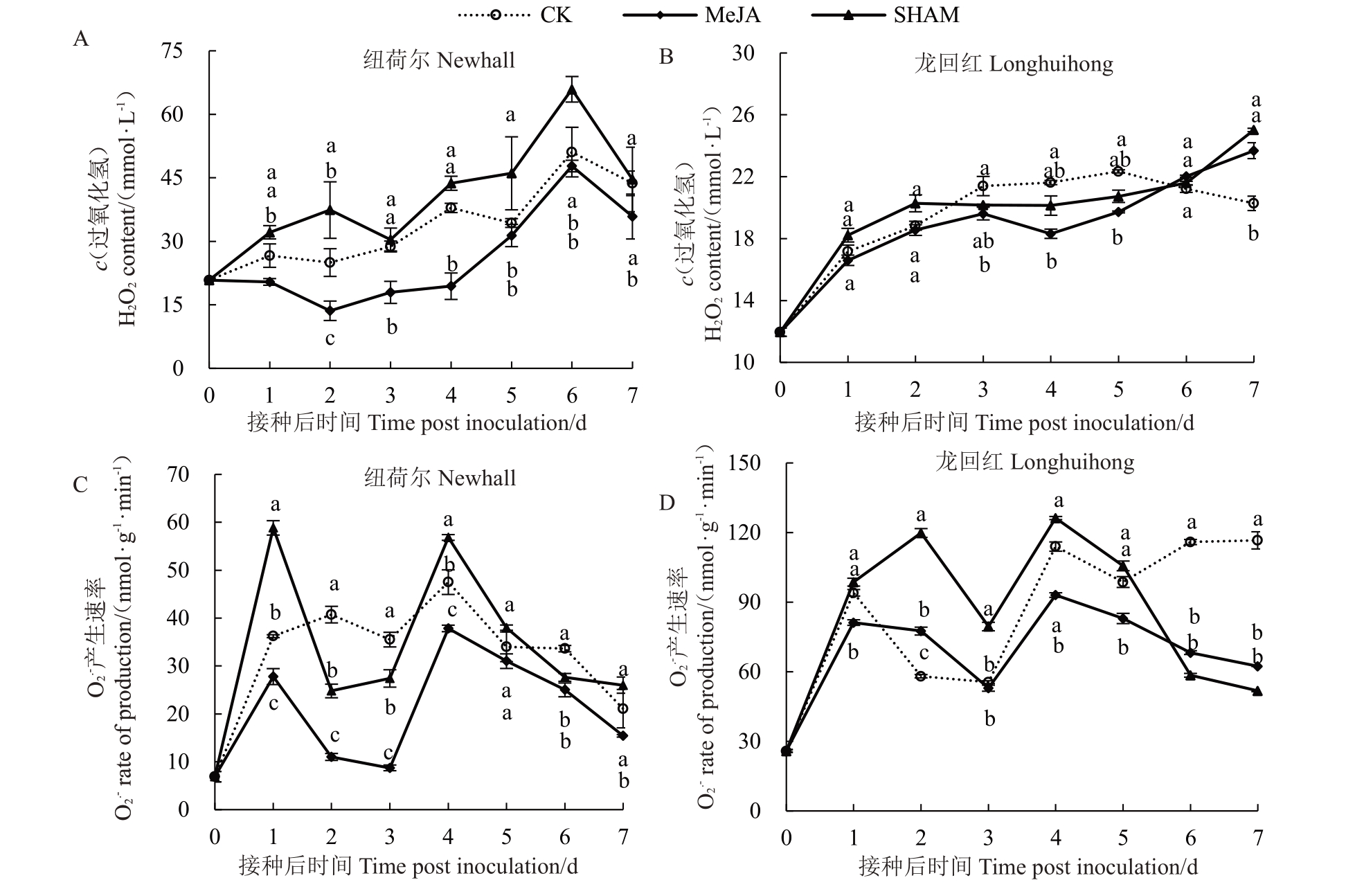
图4 MeJA 处理对脐橙果实H2O2和O2.-含量的影响
Fig.4 Effect of MeJA treatment on H2O2 and O2.-content in navel orange fruits
从图4-C和图4-D可知,MeJA和SHAM处理组O2.-产生速率呈双峰趋势。在除接种后第5天外,纽荷尔MeJA处理O2.-产生速率均显著低于CK组(p<0.05);在接种后第3天最低,仅为CK和SHAM处理组的24.56%和31.84%。龙回红MeJA 处理O2.-产生速率在接种后第1 天和第4~7 天显著低于CK 组(p<0.05);于接种后第3 天最低,分别为CK 和SHAM处理组的95.33%和66.56%。
2.5 MeJA 处理对脐橙果实MDA 含量和DPPH 自由基清除率的影响
如图5-A和图5-B所示,纽荷尔和龙回红3组处理MDA 含量均随接种时间的延长呈大致上升趋势。纽荷尔MeJA 处理在接种后除第5 天外显著低于CK 组(p<0.05);在接种后第3 天最低,分别为CK 和SHAM 处理组的64.08%和67.46%。龙回红MeJA处理组MDA含量在接种后第2~5天显著低于CK 组(p<0.05);于接种后第5 天,含量是CK 和SHAM处理组的74.93%和71.89%。
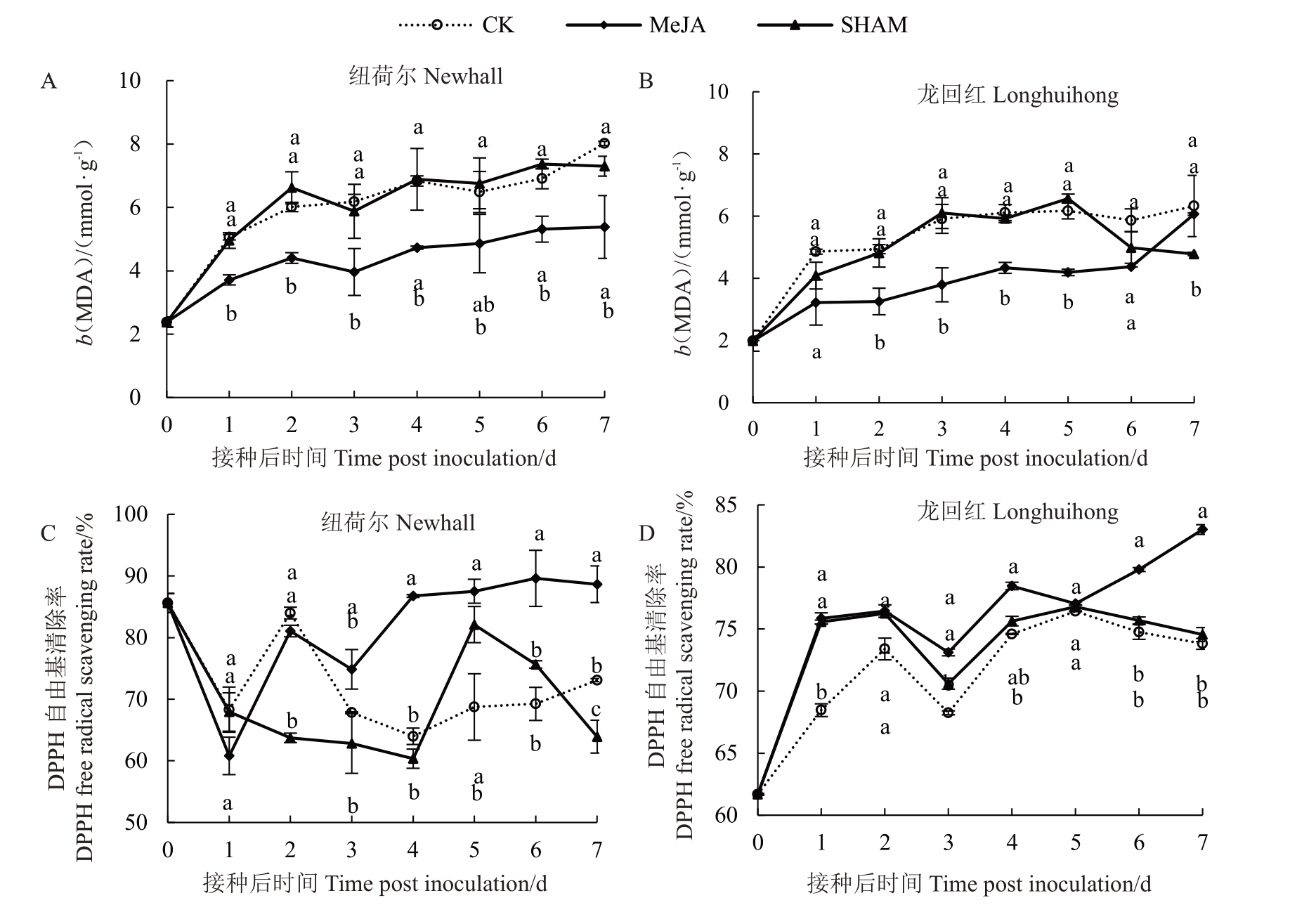
图5 MeJA 处理对脐橙果实MDA 含量和DPPH 自由基清除率的影响
Fig.5 Effect of MeJA treatment on MDA content and DPPH free radical scavenging rate in navel orange fruits
在接种后第3~7天,纽荷尔MeJA处理DPPH自由基清除率显著高于CK 组(p<0.05);在接种后第6 天,MeJA 处理DPPH 自由基清除率最高,分别是CK 和SHAM 处理组的1.29 和1.19 倍(图5-C)。在除接种后第2、5天外,龙回红MeJA处理DPPH自由基清除率均显著高于CK组(p<0.05);于接种后第7天,MeJA处理DPPH自由基清除率最高,分别是CK和SHAM处理组的1.18和1.11倍(图5-D)。
2.6 MeJA 处理对脐橙果实MDHAR 和DHAR 活性的影响
由图6-A可知,纽荷尔MeJA处理MDHAR活性在接种后第3~7 天显著高于CK 和SHAM 处理组(p<0.05);于接种后第3 天达到峰值,MeJA 处理MDHAR 活性分别是CK 和SHAM 处理组的1.21 和1.78 倍。由图6-B 可知,除在接种后第6 天龙回红MeJA 处理MDHAR 活性与SHAM 处理无显著差异外,在接种后第2~7 天显著高于CK 和SHAM 处理组(p<0.05);于接种后第5天最高,MDHAR活性分别是CK和SHAM处理组的1.26和1.53倍。

图6 MeJA 处理对脐橙果实MDHAR 和DHAR 活性的影响
Fig.6 Effect of MeJA treatment on MDHAR and DHAR activities in navel orange fruits
随着接种时间的延长,纽荷尔MeJA 和SHAM处理组DHAR活性出现双峰趋势(图6-C)。于接种后第1天和第4~6天,MeJA处理DHAR活性显著高于CK 和SHAM 处理组(p<0.05);在接种后第5 天最高,分别是CK 和SHAM 处理组的1.43 和1.47倍。从图6-D 可知,龙回红3 组处理DHAR 活性均大致呈先上升后下降的趋势。于接种后第4天,Me-JA 处理DHAR 活性最高,分别是CK 和SHAM 处理组的1.79和1.91倍。
2.7 MeJA处理对脐橙果实活性氧代谢途径关键酶基因表达的影响
由图7-A 所示,于接种后第3~4 天和第6~7 天,纽荷尔MeJA处理组CsGR相对表达量显著高于CK和SHAM 处理组(p<0.05);在接种后第7 天,MeJA处理组CsGR相对表达量最高,分别是CK和SHAM处理组的1.16 和1.86 倍。由图7-B 所示,除接种后第7天外,龙回红MeJA处理组CsGR相对表达量显著高于CK 和SHAM 处理组(p<0.05);于接种后第4 天,MeJA 处理组CsGR 相对表达量最高,分别是CK和SHAM处理组的2.98和2.52倍。

图7 MeJA 处理对脐橙果实CsGR、CsAPX、Cu-ZnSOD、CsCAT、CsMDHAR 和CsDHAR3 基因相对表达量的影响
Fig.7 Effects of MeJA treatment on the relative expression of CsGR,CsAPX,Cu-ZnSOD,CsCAT,CsMDHAR and CsDHAR3 in navel orange fruits
纽荷尔MeJA处理组CsAPX相对表达量除接种后第1 天外均显著高于CK 和SHAM 处理组(p<0.05)(图7-C);MeJA 处理组CsAPX 相对表达量在接种后第5 天最高,分别是CK 和SHAM 处理组的1.42和1.24倍。龙回红MeJA处理组CsAPX相对表达量在接种后第2~6 天显著高于CK 和SHAM 处理组(p<0.05)(图7-D);MeJA 处理组CsAPX 相对表达量于接种后第5 天最高,分别是CK 和SHAM 处理组的1.59和3.01倍。
如图7-E 所示,在接种后除第3、4 和6 天外,纽荷尔MeJA 处理组Cu-ZnSOD 相对表达量显著高于CK 和SHAM 处理组(p<0.05);于接种后第7 天,MeJA 处理组Cu-ZnSOD 相对表达量最高,分别是CK 和SHAM 处理组的1.36 和1.17 倍。如图7-F 所示,在接种后第3 天,龙回红MeJA 处理组Cu-Zn-SOD 相对表达量达到峰值,分别是CK 和SHAM 处理组的1.79和1.20倍。
在接种后第2~4天和第6天,纽荷尔MeJA处理组CsCAT相对表达量显著高于CK和SHAM处理组(p<0.05);MeJA 处理组CsCAT 相对表达量于接种后第6 天最高,分别是CK 和SHAM 处理组的1.56和4.41 倍(图7-G)。在接种后除第2 天外,龙回红MeJA 处理组CsCAT 相对表达量均显著高于CK 和SHAM 处理组(p<0.05);在接种后第4 天,MeJA 处理组CsCAT 相对表达量最高,分别是CK 和SHAM处理组的1.10和6.75倍(图7-H)。
从图7-I可知,纽荷尔MeJA 处理组CsMDHAR相对表达量在接种后第1、4天和第6~7天显著高于CK 和SHAM 处理组(p<0.05);其中在接种后第6天,MeJA 处理组CsMDHAR 相对表达量最高,分别是CK 和SHAM 处理组的1.58 和1.29 倍。从图7-J可知,除接种后第1、6 天外,龙回红MeJA 处理组CsMDHAR 相对表达量均显著高于CK 和SHAM 处理组(p<0.05);MeJA 处理组CsMDHAR 相对表达量在接种后第7天最高,分别是CK和SHAM处理组的1.57和1.96倍。
由图7-K 所示,在接种后除第2、3 天外,纽荷尔MeJA 处理组CsDHAR3 相对表达量显著高于CK 和SHAM 处理组(p<0.05);于接种后第6 天,MeJA 处理组CsDHAR3 相对表达量最高,分别是CK 和SHAM 处理组的2.32 和1.91 倍。由图7-L 所示,在接种后第3天和第5~6天,龙回红MeJA处理组CsDHAR3 相对表达量显著高于CK 和SHAM 处理组(p<0.05);MeJA处理组CsDHAR3相对表达量在接种后第7天达到峰值,分别是CK和SHAM处理组的1.31和1.03倍。
3 讨 论
MeJA 作为一种抗病信号分子,可以诱导提高多种采后果蔬对病原菌侵染的抵抗能力。前人研究表明使用MeJA 处理提高了果实抗氧化酶CAT、APX 和SOD 活性且促进了GSH、AsA 含量增加,并降低了O2.-产生速率、抑制H2O2含量积累[16-18]。笔者在本试验结果中显示,与对照组相比,50 μmol·L-1 MeJA 熏蒸处理纽荷尔和龙回红脐橙果实,均显著提高了GR、APX、SOD 和CAT 活性,降低了H2O2含量和O2.-产生速率,并促进了GSH和AsA积累,表明外源MeJA 处理激发了活性氧代谢途径,显著增强了SOD 活性,将不稳定的O2.-分解成为更稳定的H2O2;同时H2O2又在CAT和APX的作用下被分解为H2O 和O2,以及在GR 的催化下GSSG 被还原形成GSH。在MeJA 处理下,脐橙果实体内活性氧过度积累被清除,恢复了活性氧动态平衡,从而减轻了果实采后青霉病的发生。可见在外源激发因子的诱导下果蔬抗氧化酶活性增强同时抗氧化合物增加,清除了过度积累的活性氧,从而增强了果蔬抵抗病原菌侵染的能力。MDA是膜脂质过氧化的重要产物,其含量可以直接反映对植物细胞膜的破坏程度,是寄主抗病能力的重要指标[19]。DPPH 自由基清除率是植物组织内的自由基清除率的判定指标。ROS清除系统中包含AsA-GSH 循环,GR、APX、MDHAR和DHAR是AsA-GSH循环中的关键酶。APX催化AsA 产生MDHA,并消除H2O2;MDHA 在MDHAR催化下可形成AsA,GSH为DHAR提供电子将DHA 催化为AsA。笔者在本研究中发现,与CK 组和SHAM 组比较,MeJA 熏蒸处理影响两品种脐橙果实活性氧代谢,果实内MDHAR 和DHAR 活性得到显著提高,DPPH自由基清除率显著提升,进而有效延缓了MDA 的积累。试验结果与前人用MeJA与氯化钠联合处理提高了玉米芽中抗氧化酶活性和清除自由基能力的结论相一致[20]。同时,为应对冷害、盐胁迫和病害等生物或非生物胁迫,前人在研究MeJA 处理对番茄[21]、玉米[22]和枇杷[23]的影响中发现,MeJA 能够不同程度地提高抗氧化物质GSH、AsA 的含量和AsA-GSH 循环中关键酶MDHAR、DHAR 的活性,进而诱导果蔬增强对外界环境的抗性。由此推测MeJA处理诱导脐橙果实对青霉病的抗性与其调控活性氧代谢相关酶活性及物质含量有关,且笔者前期研究表明,龙回红脐橙果实病斑直径在接种第3 天显著小于纽荷尔脐橙果实病斑直径,说明龙回红比纽荷尔脐橙果实抗青霉病,可能导致了MeJA处理调控活性氧代谢相关酶活性及物质含量在脐橙不同品种间存在差异,但其原因还需要进一步深入研究。
植物在遭受病原微生物侵染时,不同外源诱导剂可调控植物次生代谢,激活多种相关防御基因的表达,诱导植物产生防御反应。前人研究表明外源MeJA处理后均能增加果实体内活性氧代谢关键酶基因的表达量从而增强果实对病原菌的抗性[24-26]。此外,其他诱抗剂如苯并噻重氮(acibenzolar-Smethyl,ASM)和褪黑素(melatonin,MT)在对梨果实抗采后黑斑病的研究中指出,ASM处理激活了果实中抗病相关基因PcSOD、PcCAT、PcAPX和PcDHAR显著表达;以及MT 预处理显著提高了果实中防御酶基因PpCAT、PpSOD、PpCHI 和PpGLU 的表达且在后期维持高水平表达,进而有效提高梨果实抗采后黑斑病的能力[27-28]。本试验结果表明,于接种前用MeJA 熏蒸处理脐橙果实后,能诱导脐橙果实活性氧代谢相关防御酶基因(CsGR、CsAPX、Cu-ZnSOD、CsCAT、CsMDHAR和CsDHAR3)不同程度地显著表达。由此推测MeJA诱导采后脐橙对青霉病的抗性可能与其活性氧代谢中相关防御酶基因的高表达密切相关。
4 结 论
在接种P.italicum 前采用外源50 μmol·L-1 Me-JA熏蒸处理纽荷尔和龙回红脐橙果实24 h,显著提高了活性氧代谢相关酶(GR、APX、SOD、CAT、MDHAR和DHAR)活性,促进了AsA、GSH含量的增加,降低了O2.-产生速率和H2O2含量、抑制了MDA 的积累并提高了果实内DPPH自由清除率水平;同时激活了相关防御酶基因(CsGR、CsAPX、Cu-ZnSOD、Cs-CAT、CsMDHAR和CsDHAR3)的显著表达,进而提升了脐橙果实抵抗青霉病菌侵染的能力。
[1] 解淑慧,邵兴锋,王可,张兴龙,王鸿飞.柑橘采后腐烂主要致病菌的分离鉴定及丁香精油对其抑制作用研究[J].果树学报,2013,30(1):134-139.XIE Shuhui,SHAO Xingfeng,WANG Ke,ZHANG Xinglong,WANG Hongfei. Isolation and identification of dominant pathogen on citrus fruit and the antifungal effect of clove oil on these fungi[J].Journal of Fruit Science,2013,30(1):134-139.
[2] HASANUZZAMAN M,NAHAR K,HOSSAIN M S,MAHMUD J A,RAHMAN A,INAFUKU M,OKU H,FUJITA M. Coordinated actions of glyoxalase and antioxidant defense systems in conferring abiotic stress tolerance in plants[J]. International Journal of Molecular Sciences,2017,18(1):200.
[3] TORRES M A.ROS in biotic interactions[J].Physiologia Plantarum,2010,138(4):414-429.
[4] ASGHARIM. Impact of jasmonates on safety,productivity and physiology of food crops[J].Trends in Food Science&Technology,2019,91:169-183.
[5] 王瀚博.茉莉酸甲酯对蓝莓果实采后品质及抗病性调控机制研究[D].南京:南京林业大学,2021.WANG Hanbo. The regulatory mechanism of physiology,biochemistry and disease resistance mediated by methyl jasmonate in postharvest blueberries[D].Nanjing:Nanjing Forestry University,2021.
[6] WANG K T,JIN P,HAN L,SHANG H T,TANG S S,RUIH J,DUAN Y F,KONG F Y,KAIX,ZHENG Y H. Methyl jasmonate induces resistance against Penicillium citrinum in Chinese bayberry by priming of defense responses[J]. Postharvest Biology and Technology,2014,98:90-97.
[7] PAN L Y,ZHAO X Y,CHEN M,FU Y Q,XIANG M L,CHEN J Y. Effect of exogenous methyl jasmonate treatment on disease resistance of postharvest kiwifruit[J]. Food Chemistry,2020,305:125483.
[8] CAO S F,CAIY T,YANG Z F,JOYCE D C,ZHENG Y H.Effect of MeJA treatment on polyamine,energy status and anthracnose rot of loquat fruit[J].Food Chemistry,2014,145:86-89.
[9] 王建伟,许光龄,陈艳丽,朱国鹏,陈玥,刘金伟.外源茉莉酸甲酯对盐胁迫下菜用甘薯生长生理的影响[J].中国瓜菜,2022,35(6):69-75.WANG Jianwei,XU Guangling,CHEN Yanli,ZHU Guopeng,CHEN Yue,LIU Jinwei. Exogenous methyl jasmonate affects growth and physiology of leafy sweet potato under salt stress[J].China Cucurbits and Vegetables,2022,35(6):69-75.
[10] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007.CAO Jiankang,JIANG Weibo,ZHAO Yumei. Experimental guidance of postharvest physiology and biochemistry of fruits and vegetables[M].Beijing:China Light Industry Press,2007.
[11] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.LIHesheng. Principles and techniques of plant physiological biochemical experiment[M]. Beijing:Higher Education Press,2000.
[12] 张昭,吕泽芳,吴洪梅,周志钦,于杰.重庆市10 大名柚果实酚类物质质量分数及抗氧化活性研究[J].西南大学学报(自然科学版),2015,37(5):58-65.ZHANG Zhao,LÜ Zefang,WU Hongmei,ZHOU Zhiqin,YU Jie. Phenolic contents of ten famous Chongqing pummelo (Citrus grandis)cultivars and their antioxidant capacities[J].Journal of Southwest University(Natural Science Edition),2015,37(5):58-65.
[13] WEIM L,GE Y H,LIC Y,HAN X,QIN S C,CHEN Y R,TANG Q,LIJ R.G6PDH regulated NADPH production and reactive oxygen species metabolism to enhance disease resistance against blue mold in apple fruit by acibenzolar-S-methyl[J].Postharvest Biology and Technology,2019,148:228-235.
[14] 马巧利.2,4-二氯苯氧乙酸保鲜柑橘果实采后品质机理[D].武汉:华中农业大学,2014.MA Qiaoli. Mechanism underlying 2,4-dichlorophenoxyacetic acid maintaining citrus fruit postharvest quality[D]. Wuhan:Huazhong Agricultural University,2014.
[15] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2- ΔΔCt Method[J].Methods,2001,25(4):402-408.
[16] HABIBIF,RAMEZANIAN A,GUILLÉN F,SERRANO M,VALERO D. Blood oranges maintain bioactive compounds and nutritional quality by postharvest treatments with γ-aminobutyric acid,methyl jasmonate or methyl salicylate during cold storage[J].Food Chemistry,2020,306:125634.
[17] DONG Y,ZHIH H,XU J,ZHANG L H,LIU M P,ZONG W.Effect of methyl jasmonate on reactive oxygen species,antioxidant systems,and microstructure of Chinese winter jujube at two major ripening stages during shelf life[J]. Journal of Horticultural Science and Biotechnology,2016,91(3):316-323.
[18] 王英珍,程瑞,张绍铃,白彬,何子顺,张虎平.采前茉莉酸甲酯(MeJA)处理对梨果实抗病性的影响[J].果树学报,2016,33(6):694-700.WANG Yingzhen,CHENG Rui,ZHANG Shaoling,BAIBin,HE Zishun,ZHANG Huping. Effect of pre-harvest methyl jasmonate treatment on disease resistance in pear fruit[J]. Journal of Fruit Science,2016,33(6):694-700.
[19] DIETZ K J,MITTLER R,NOCTOR G. Recent progress in understanding the role of reactive oxygen species in plant cell signaling[J].Plant Physiology,2016,171(3):1535-1539.
[20] HE W W,LUO H,XU H,ZHOU Z Y,LID J,BAO Y H,FU Q,SONG J F,JIAO Y,ZHANG Z Y. Effect of exogenous methyl jasmonate on physiological and carotenoid composition of yellow maize sprouts under NaCl stress[J]. Food Chemistry,2021,361:130177.
[21] 李子龙.SlMYC2 调控茉莉酸甲酯介导AsA-GSH 循环提高番茄果实抗冷性的机制研究[D].淄博:山东理工大学,2022.LIZilong.The roles of SlMYC2 in regulating ascorbate-glutathione cycle mediated by methyl jasmonate in postharvest tomato fruits under cold stress[D]. Zibo:Shandong University of Technology,2022.
[22] 陈芳,杨双龙,张莉,佟祎鑫,张志华,虞凡枫,贾凌云.外源茉莉酸甲酯对盐胁迫下玉米幼苗AsA-GSH 循环的影响[J].生物学通报,2021,56(11):44-48.CHEN Fang,YANG Shuanglong,ZHANG Li,TONG Yixin,ZHANG Zhihua,YU Fanfeng,JIA Lingyun. Effects of exogenous methyl jasmonate on ascorbate-glutathione cycle in Zea mays seedlings under salt stress[J].Bulletin of Biology,2021,56(11):44-48.
[23] 蔡玉婷.MeJA 处理减轻枇杷采后冷害和病害的机理研究[D].南京:南京农业大学,2012.CAIYuting. Study on mechanism of MeJA treatment on chilling injury and disease of loquat after harvest[D]. Nanjing:Nanjing Agricultural University,2012.
[24] PAN L Y,CHEN X R,XU W,FAN S S,WAN T,ZHANG J,CAIY L. Methyl jasmonate induces postharvest disease resistance to decay caused by Alternaria alternata in sweet cherry fruit[J].Scientia Horticulturae,2022,292:110624.
[25] SAAVEDRA G M,SANFUENTES E,FIGUEROA P M,FIGUEROA C R.Independent preharvest applications of methyl jasmonate and chitosan elicit differential upregulation of defense-related genes with reduced incidence of gray mold decay during postharvest storage of Fragaria chiloensis fruit[J]. International Journal of Molecular Sciences,2017,18(7):1420.
[26] 赵显阳.外源茉莉酸甲酯(MeJA)对梨果实抗青霉病及其保鲜作用的研究[D].南昌:江西农业大学,2020.ZHAO Xianyang. Effects of exogenous methyl jasmonate (Me-JA) induced resistance to blue mold and storage preservation in postharvest pear fruit[D]. Nanchang:Jiangxi Agricultural University,2020.
[27] LIX,LIC Y,CHENG Y,HOU J B,ZHANG J H,GE Y H.Postharvest application of acibenzolar- S-methyl delays the senescence of pear fruit by regulating reactive oxygen species and fatty acid metabolism[J].Journal of Agricultural and Food Chemistry,2020,68(17):4991-4999.
[28] 向妙莲,吴帆,李树成,马巧利,王印宝,肖刘华,陈金印,陈明.外源褪黑素调控活性氧代谢诱导梨果实抗采后黑斑病[J].园艺学报,2022,49(5):1102-1110.XIANG Miaolian,WU Fan,LIShucheng,MA Qiaoli,WANG Yinbao,XIAO Liuhua,CHEN Jinyin,CHEN Ming. Exogenous melatonin regulates reactive oxygen metabolism to induce resistance of postharvest pear fruit to black spot[J]. Acta Horticulturae Sinica,2022,49(5):1102-1110.