核桃是重要的坚果和木本油料树种,具有较高的经济价值。新疆是我国最早种植核桃的地区之一,也是中国核桃主要产区之一。据统计,全疆核桃种植面积42 万hm2,产量125 万t,面积居全国第六位,产量居全国第二位[1]。核桃产业已成为果农增收致富的主导产业之一,甚至是有些县、乡的支柱产业[2]。我国核桃种质资源丰富,据统计,我国保存核桃资源超过900份[3]。新疆现有厚壳、薄壳、纸皮、露仁等不同硬壳厚度的核桃品种,为核桃壳的研究提供了良好的材料基础。新疆特有核桃品种新露出现了核桃内果皮发育不完全、局部区域缺失现象,导致在贮藏加工过程中易出现污染[3-4],但新露露仁品种是一种研究核壳发育的理想品种,通过对新疆特有核桃品种新露内果皮(硬壳)发育的研究,初步阐述露仁机制以及对新疆薄壳的发生机制提供理论参考。
木质素的合成代谢贯穿核桃内果皮的发育过程,是植物细胞壁的重要组成成分,为细胞壁提供强支撑[5]。在木质素合成过程中会产生14种中间代谢物,改变代谢物质的组成或含量会使木质素单体组成或木质素的空间结构发生变化[6],从而影响最终合成的木质素含量。肉桂酸和4-香豆酸是木质素合成途径中所产生的中间代谢物之一,鱼尚奇等[6]在核桃内果皮木质素合成中间代谢物分析及露仁相关基因筛选研究中发现,露仁核桃中4-香豆酸以及肉桂酸含量出现反常现象,具体表现为非木质化区域肉桂酸呈现低水平状态,4-香豆酸呈现高水平状态,与内果皮木质素正常沉积的部位表现相反趋势。此外,4-香豆酸是苯丙氨酸在苯丙氨酸解氨酶(PAL)和肉桂酸-4-羟化酶(C4H)两种酶催化作用下生成的,再经过4-香豆酸辅酶A连接酶(4CL)的催化,形成不同的肉桂醇以及酚类等具有抗氧化能力的物质[7],肉桂醇再由肉桂醇脱氢酶(CAD)催化成不同的木质素单体。李姚瑶等[8-9]发现外源4-香豆酸是过氧化氢酶和多酚氧化酶的抑制剂,但能增强苯丙烷类代谢途径中PAL、C4H和4CL的活性,从而促进木质素合成。曹毛毛[10]研究表明,4-香豆酸可以抑制POD 活性,从而激活苯丙烷类代谢途径。研究表明,与易受瓜实蝇侵染的佛手瓜相比,未发生侵染的佛手瓜通过激活苯丙烷代谢途径,促进了4-香豆酸积累,从而进一步合成木质素[11]。肉桂酸与4-香豆酸具有极其相似的结构。Yin 等[12]在2003 年发现,在高等植物(芸薹属植物)中存在天然的顺式肉桂酸。顺式肉桂酸能促进生长,产生向生反应,延缓果实成熟,多年来被认为是一种合成的植物生长调节剂[13]。肉桂酸和4-香豆酸不仅是植物体中次生代谢的产物,还在植物生长发育过程中扮演着重要角色。因此,笔者通过探究外源喷施肉桂酸和4-香豆酸对核桃内果皮组成成分含量、木质素合成关键酶,以及总酚和总糖含量的影响,为核桃内果皮发育以及木质素合成研究提供理论参考。
1 材料和方法
1.1 材料
试验材料为新露核桃,取自新疆维吾尔自治区阿克苏市试验林场,树龄均为17 a(年),株行距为5 m×6 m,选择生长健壮一致,无病虫害且水肥管理一致的树体进行试验。于花后约60 d(2023年6月8日),硬化开始时选择外观大小基本一致的核桃果实,对其结果枝及果实分别喷施0(对照,CK)、50(R1)、100(R2)、150(R3)和200 mg·L-1(R4)5个浓度(ρ,后同)的肉桂酸及0(CK)、50(X1)、100(X2)、150(X3)和200 mg·L-1(X4)5 个浓度的4-香豆酸,每个处理3次重复。药剂现配现用,并在光照度较弱、处理后4 h 无降水的情况下进行。按照处理0.2、0.5、1.5、4、9、14、24、34 d(共8次)采集果实,采集的果实全部在低温无菌条件下分离出内果皮作为试验样品,迅速将样品切至颗粒状并用液氮冷却后放入超低温冰箱保存。
1.2 方法
1.2.1 木质素沉积变化分析 木质素染色观察:采用Wiesner法检测木质素沉积[4],将处理后的核桃果实切片。从首次处理开始,每12 h取样1次,不同浓度各取3 个果实,利用1%的间苯三酚-乙醇-盐酸染液,将核桃果实切片置于染色液中染色5~6 min,待显色后取出拍照。
1.2.2 木质素、纤维素、半纤维素含量 分别取不同浓度肉桂酸和4-香豆酸处理后的内果皮硬化组织样本,参考赵玉雪等[14]的方法,测定木质素、纤维素和半纤维素含量。
1.2.3 PAL,CAD,C4H,POD 酶活性 采用北京索莱宝有限公司的试剂盒分别测定植物苯丙氨酸裂解酶(PAL)、植物肉桂醇脱氢酶(CAD)、植物肉桂酸-4-羟化酶(C4H)、过氧化物酶(POD)活性。
1.2.4 总酚含量 利用福林酚法测定总酚含量[15]。
式中,C 为标准曲线求出的总酚质量浓度(µg·L-1);25 为定容体积(mL);A 为样品稀释倍数;M为样品质量(g);1000为换算系数。
1.2.5 总糖含量 采用蒽酮-硫酸法测定总糖含量[16]。
1.3 数据分析
采用Excel2007进行数据处理与整理,采用Origin 2021 绘制图形,采用DPS 软件对所得的试验数据进行LSD分析。
2 结果与分析
2.1 肉桂酸和4-香豆酸对核桃内果皮木质素沉积变化的影响
采用间苯三酚染色法观察核桃硬化期内果皮木质素沉积变化,如图1所示,核桃内果皮在硬化的过程中,木质素的沉积发生了显著变化。6月8日(约花后60 d),与对照相比,肉桂酸处理后的木质素沉积无明显变化;6月12日(约花后64 d),靠近维管束的位置先开始沉积,6月17日(约花后69 d),维管束染色颜色从浅红转为深红,染色区域由维管束延伸到了内果皮。7 月12 日(约花后94 d),大部分内果皮染上色。如图1-A 所示,与对照相比,4-香豆酸处理后,X1,X2,X3处理的木质素含量均有上升,硬化前期和中期X2处理的木质素含量均有显著增加,最高可达69.69%;X4 处理显著降低,最高可达30.03%;X1 和X3处理的木质素含量增加但与对照差异不显著。由图1-B可知,与对照相比,肉桂酸处理后的核桃内果皮木质素含量均有上升,其中处理0.5~35 d时,R2和R3 处理的木质素含量显著增加,最高可达58.98%。7月2日时R3处理的木质素含量(w,后同)达到最大值,为286.18 mg·g-1。以上结果说明,4-香豆酸处理下,X1、X2、X3 浓度促进木质素生成,X4 浓度抑制木质素生成;肉桂酸处理下均会促进木质素生成,但是R2、R3浓度处理优于R1、R4浓度处理。
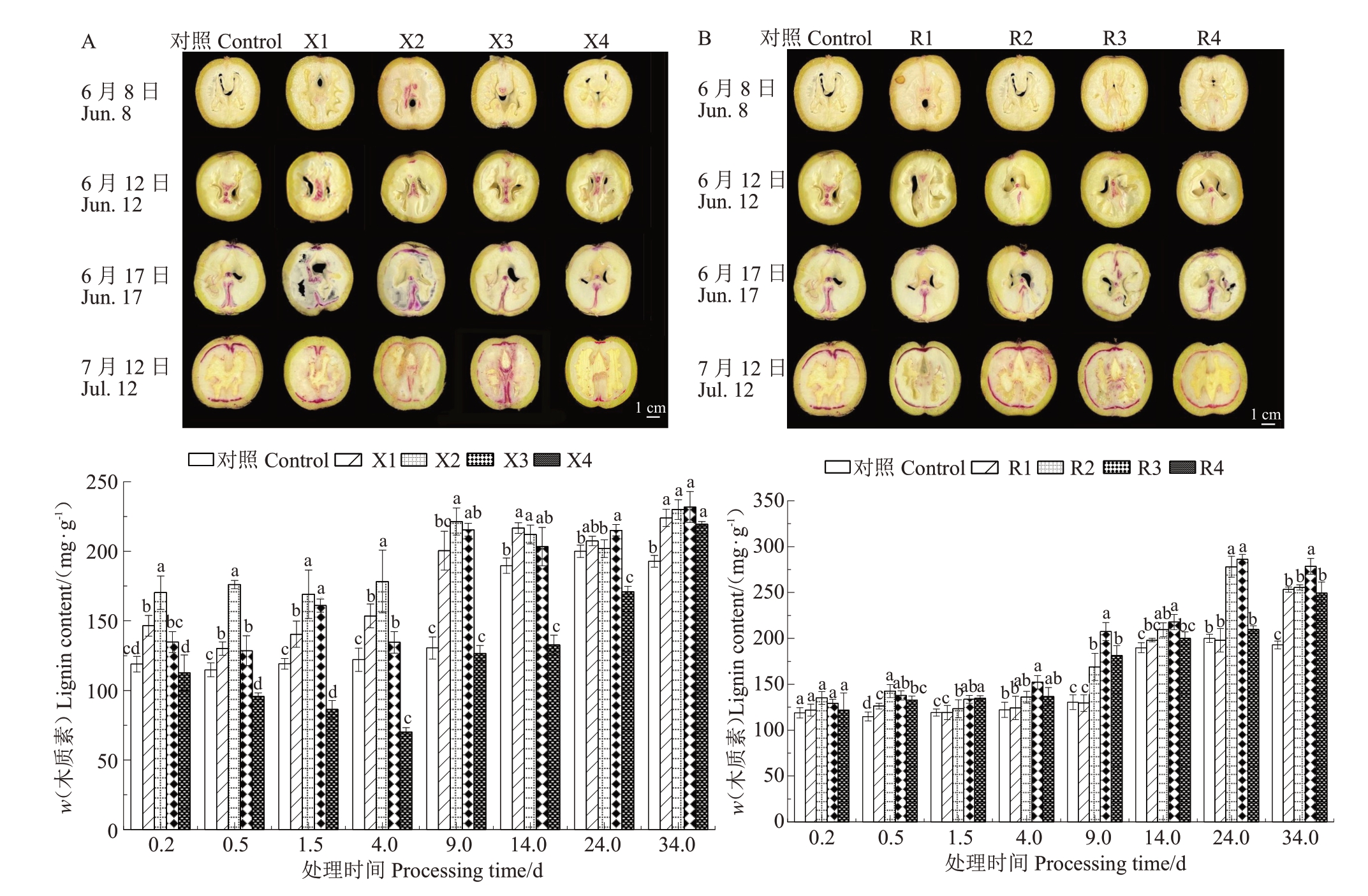
图1 核桃内果皮发育过程及内果皮木质素沉积变化
Fig.1 Development process of walnut endocarp and changes in lignin deposition in endocarp
A.不同浓度4-香豆酸处理后木质素沉积变化;B.不同浓度肉桂酸处理后木质素沉积变化。不同小写字母表示在0.05 水平差异显著。下同。
A. Changes of lignin deposition after treatment with different concentrations of 4-coumaric acid; B. Changes of lignin deposition after treatment with different concentrations of cinnamic acid. Different small letters indicate significant difference at 0.05 level.The same below.
2.2 肉桂酸和4-香豆酸对纤维素、半纤维素含量的影响
由图2-A可知,随时间的延长,4-香豆酸处理的纤维素含量整体呈上升趋势,与对照相比,在处理后0.2~1.5 d,X2、X3处理的纤维素含量显著升高,分别最高提高了33.92%、23.46%。由图2-B 可知,肉桂酸处理的纤维素含量整体呈上升趋势,R1、R2、R3处理下的纤维素含量高于对照(24 d除外),其中R3与对照呈显著差异(9 d 除外),平均提高了21.72%。喷施不同浓度肉桂酸处理的核桃内果皮纤维素含量在处理后34 d表现为R3>R2>R1>对照>R4。由图2-C 可知,不同浓度4-香豆酸处理的半纤维素含量变化趋势存在差异。其中X2 处理的半纤维素含量与对照相比均显著增加,最高增加了19.6%,处理14 d 时半纤维素含量达到最高且变化上升速率最快,上升了56.04 mg·g-1。X4 处理的半纤维素含量与对照相比均有减少。由图2-D 可知,R2、R3 处理的半纤维素含量与对照相比显著增加,最高分别增加17.40%、29.16%,核桃硬化中后期时R3提高效果最为显著,其中处理后9 d达到了峰值,相较对照,半纤维素含量提高了24%。以上结果说明喷施低浓度的4-香豆酸可以促进纤维素、半纤维素生成,高浓度4-香豆酸会抑制纤维素、半纤维素的生成;肉桂酸处理下均会促进纤维素生成,但是R2、R3浓度处理优于R1、R4浓度处理。

图2 核桃内果皮纤维素、半纤维素含量变化
Fig.2 Changes of cellulose content in walnut pericarp
A.不同浓度4-香豆酸处理后纤维素含量变化;B.不同浓度肉桂酸处理后纤维素含量变化;C.不同浓度4-香豆酸处理后半纤维素含量变化;D.不同浓度肉桂酸处理后半纤维素含量变化。
A. Changes of cellulose content after treatment with different concentrations of 4-coumaric acid; B. Changes of cellulose content after treatment with different concentrations of cinnamic acid; C. Changes in Hemicellulos content after treatment with different concentrations of 4-cinnamic acid;D.Changes in Hemicellulos content after treatment with different concentrations of cinnamic acid.
2.3 肉桂酸和4-香豆酸对代谢酶活性的影响
2.3.1 肉桂酸和4-香豆酸对PAL活性的影响 PAL是植物体内苯丙烷类代谢的关键酶,如图3-A所示,核桃硬化前期PAL 活性较高,后期活性降低,X1、X2、X3处理后0.2~4 d PAL活性均较对照有所提高,其中在处理后1.5 d,X2 处理的PAL 活性达到最高,为447.25 U·g-1,显著高于对照。由图3-B可知,R2、R3、R4处理后,0.2~1.5 d PAL活性均显著高于对照,R3 处理0.2 d 的PAL 活性出现峰值,较对照显著提高了12.91%。以上结果说明低浓度4-香豆酸处理可以促进硬化前期PAL 活性提高。在硬化前期,与对照相比,肉桂酸处理的PAL 活性均不同程度的提高,且R2、R3、R4浓度处理下优于R1。

图3 核桃内果皮PAL 活性变化
Fig.3 Changes of PAL activity in walnut pericarp
A.不同浓度4-香豆酸处理后PAL 活性变化;B. 不同浓度肉桂酸处理后PAL 活性变化。
A.Changes of PAL activity after treatment with different concentrations of 4-coumaric acid;B.Changes of PAL activity after treatment with different concentrations of cinnamic acid.
2.3.2 肉桂酸和4-香豆酸对CAD 活性的影响 肉桂醇脱氢酶(CAD)催化香豆醇、芥子醛等生成与之相应的肉桂醇,是木质素合成途径中的关键酶。如图4-A 所示,在核桃硬化的过程中,核桃CAD 活性整体上呈先上升后下降的趋势,X1、X2、X3 处理的CAD活性均高于对照,其中处理后1.5 d时,X3处理的CAD 活性达到最高,为118.53 U·g-1;且X3 处理后4 d 提高效果最为显著,较对照显著提高126%。如图4-B所示,在R3处理9 d后CAD活性达到峰值,比对照显著提高121%。R1 处理的CAD 活性均低于R3、R2处理,表明R2、R3处理促进CAD活性效果比R1 更佳。以上结果说明低浓度4-香豆酸促进CAD 活性提高,高浓度4-香豆酸会抑制CAD 活性;R2、R3肉桂酸处理的CAD活性优于R1、R4处理。

图4 核桃内果皮CAD 活性变化
Fig.4 Changes of CAD activity in walnut pericarp
A.不同浓度4-香豆酸处理后CAD 活性变化;B.不同浓度肉桂酸处理后CAD 活性变化。
A.Changes of CAD activity after treatment with different concentrations of 4-coumaric acid;B.Changes of CAD activity after treatment with different concentrations of cinnamic acid.
2.3.3 肉桂酸和4-香豆酸对C4H活性的影响 如图5-A所示,C4H活性整体上呈先上升后下降的趋势,对照处理的C4H 活性从第4 天开始迅速下降,4-香豆酸处理的C4H活性从处理后第9天开始迅速下降;其中X3处理在第9天达到峰值,为207.89 U·g-1。X1处理的C4H活性均低于对照,最大值为90.51 U·g-1,说明低浓度4-香豆酸抑制C4H活性。如图5-B所示,在处理后4~24 d,不同浓度肉桂酸处理的核桃均提高了C4H 活性,最高较对照显著提高109%。以上结果说明一定浓度下4-香豆酸和肉桂酸可以延迟C4H活性的下降。

图5 核桃内果皮C4H 活性变化
Fig.5 Changes of C4H activity in walnut pericarp
A.不同浓度4-香豆酸处理后C4H 活性变化;B. 不同浓度肉桂酸处理后C4H 活性变化。
A.Changes of C4H activity after treatment with different concentrations of 4-coumaric acid;B.Changes of C4H activity after treatment with different concentrations of cinnamic acid.
2.3.4 肉桂酸和4-香豆酸对POD 活性的影响 如图6-A所示,POD活性在核桃硬化过程中,整体上呈现出下降趋势。在硬化前期(0.2~4.0 d),不同浓度4-香豆酸处理的POD活性均低于对照,最高较对照显著降低32.46%,在X3 处理0.5 d 时与对照极差为23.77 U·g-1。如图6-B 所示,除了处理第4 天外,其他时间R2、R3 处理的POD 活性均低于对照,且R4处理后9 d的POD活性与对照呈显著差异。以上结果说明在一定浓度处理下4-香豆酸和肉桂酸会降低POD活性。
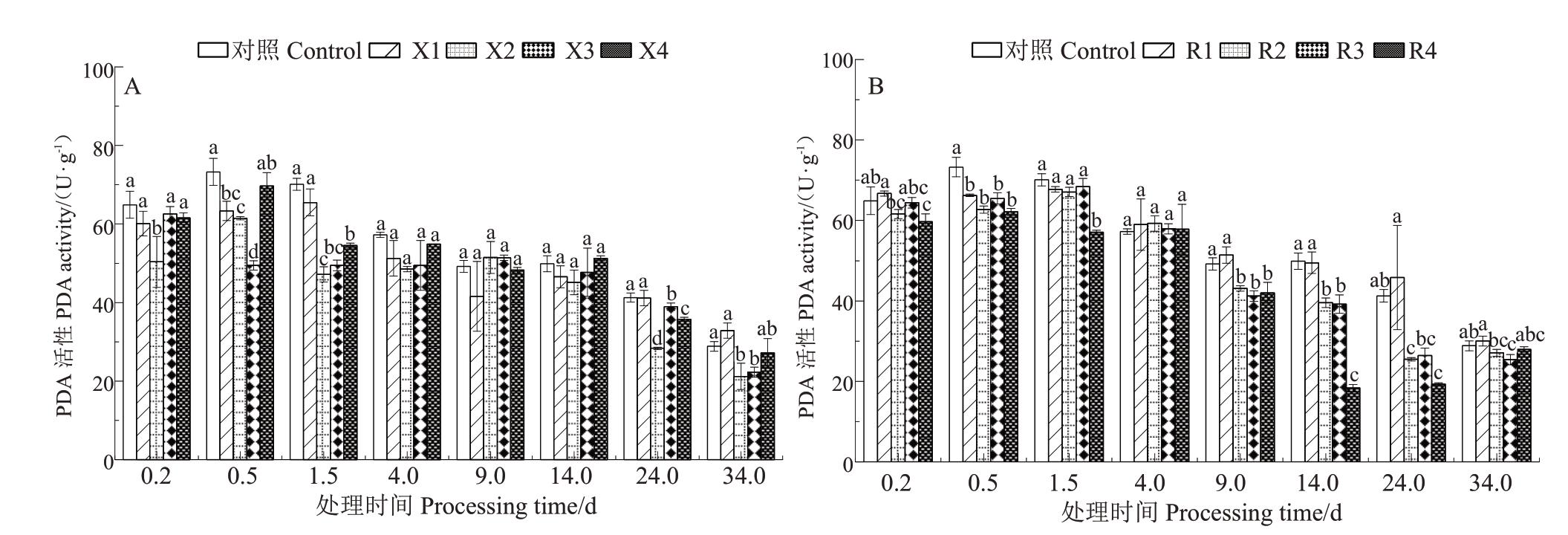
图6 核桃内果皮POD 活性变化
Fig.6 Changes of POD activity in walnut pericarp
A.不同浓度4-香豆酸处理后POD 活性变化;B.不同浓度肉桂酸处理后POD 活性变化。
A.Changes of POD activity after treatment with different concentrations of 4-coumaric acid;B.Changes of POD activity after treatment with different concentrations of cinnamic acid.
2.4 肉桂酸和4-香豆酸对总酚含量的影响
如图7-A所示,随着核桃内果皮的发育,不同浓度4-香豆酸处理的总酚含量变化趋势存在差异。在处理0.2 d后,X1、X2、X3处理的总酚含量高于对照且总酚含量变化为X2>X3>X1>对照>X4。如图7-B所示,随着核桃内果皮的发育,不同浓度肉桂酸处理的总酚含量变化趋势存在差异,X1处理在0.2 d后出现峰值,为49.6 mg·g-1,显著高于对照。

图7 核桃内果皮总酚含量变化
Fig.7 Changes of total phenol activity in walnut pericarp
A.不同浓度4-香豆酸处理后总酚含量变化;B.不同浓度肉桂酸处理后总酚含量变化。
A. Changes of total phenol content after treatment with different concentrations of 4-coumaric acid; B. Changes of total phenol content fter treatment with different concentrations of cinnamic acid.
2.5 肉桂酸和4-香豆酸对总糖含量的影响
如图8-A所示,总糖在核桃内果皮中的含量非常低,X2处理后14 d与对照极值最大,为7.67 mg·g-1。X1,X2,X3 处理后1.5 d,总糖含量与对照呈显著差异,X3处理在处理1.5~34 d总糖含量较对照均有提高,最高提高4.82 mg·g-1。如图8-B所示,R3处理1.5~14 d总糖含量均高于对照,平均提高2.69 mg·g-1。R2处理4~9 d时总糖含量小于对照,平均降低0.87 mg·g-1。
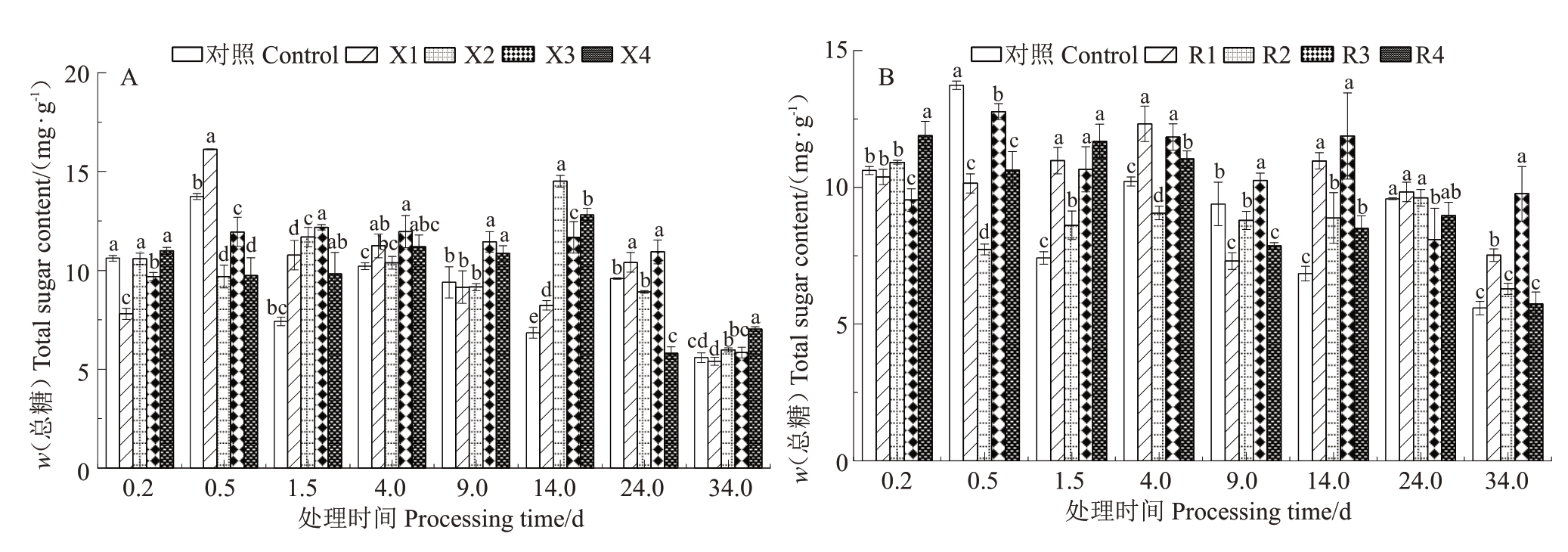
图8 核桃内果皮总糖含量变化
Fig.8 Changes of total sugar content in walnut pericarp
A.不同浓度4-香豆酸处理后总糖含量变化;B. 不同浓度肉桂酸处理后总糖含量变化。
A.Changes of total sugar content after treatment with different concentrations of 4-coumaric acid;B.Changes of total sugar content fter treatment with different concentrations of cinnamic acid.
2.6 木质素组成成分及木质素代谢酶相关性分析
通过对新露核桃硬壳主要成分(木质素、纤维素、半纤维素)含量,PA、CAD、C4H、POD 活性以及总糖和总酚含量进行相关性分析(图9),发现木质素含量与纤维素和半纤维素含量呈显著正相关,说明木质素含量越高,纤维素和半纤维素含量越高。核桃硬壳主要成分(木质素、纤维素、半纤维素)含量与PAL、CAD、POD 活性呈显著负相关,说明PAL、CAD、POD是核桃硬壳组成成分的关键酶。在肉桂酸处理下半纤维素含量与C4H活性呈显著正相关,说明C4H活性对核桃硬壳的成长发育也具有影响。

图9 木质素合成途径中物质组分含量及相关酶活性的相关性
Fig.9 Correlation between the content of substance components and related enzymes activity in lignin synthesis pathway
A. 不同浓度4-香豆酸处理后木质素合成途径中物质组分含量及相关酶活性的相关性。B.不同浓度肉桂酸处理后木质素合成途径中物质组分含量及相关酶活性的相关性。
A.Correlation of 4-coumaric acid with different concentrations on the content of substances and related enzymes activity in lignin synthesis pathway.B.Correlation of coumaric acid with different concentrations on the content of substances and related enzymes activity in lignin synthesis pathway.
3 讨 论
核桃内果皮是核桃的天然保护屏障,核桃木质素沉积不足会使核桃出现核桃内果皮发育不完全,从而出现露仁情况,影响核桃的口感及贮运,降低核桃的商业价值和经济价值。
笔者通过对新露核桃进行肉桂酸和4-香豆酸处理,发现肉桂酸和4-香豆酸处理下木质素沉积与对照相比都出现了不同的变化,本团队前期研究发现核桃木质素沉积先开始于核桃顶部和基部[17],与本试验结果一致。李姚瑶等[9]研究表明,4-香豆酸处理可以激活核桃果实中木质素合成关键酶的活性,促进木质素合成。Islam等[18]发现,通过外源4-香豆酸喷洒处理,可以诱导中国小白菜中对羟基肉桂酸和黄酮类物质的合成,并且4-香豆酸处理还可以通过诱导欧洲小油菜苯丙烷代谢途径中相关酶活性的增强,进一步激活茉莉酸信号分子,从而调控木质素合成,减轻欧洲小油菜黑腐病的发生[19],本试验中喷施4-香豆酸同样增强了木质素合成通路中关键酶的活性;且低浓度4-香豆酸促进木质素合成,高浓度4-香豆酸抑制木质素合成。肉桂酸具有与4-香豆酸相似的结构,本试验中不同浓度肉桂酸处理的木质素含量均高于对照且随浓度升高木质素含量呈先上升后下降的趋势,说明一定浓度下肉桂酸促进木质素的合成。文菁等[20]研究发现纤维素、半纤维素含量变化与木质素含量变化趋势大致相同。本试验中低浓度4-香豆酸促进纤维素、半纤维素合成,高浓度4-香豆酸抑制纤维素、半纤维合成;不同浓度肉桂酸处理的纤维素和半纤维含量均高于对照(R4除外),且随肉桂酸浓度升高纤维素和半纤维素含量呈先上升后下降的趋势,可能是因为核桃内果皮是由木质素、纤维素和半纤维素组成[21],且木质素分散于纤维素纤维中,半纤维素贯穿于木质素和纤维素纤维之间,连接二者[22],木质素的积累表现为次生细胞壁增厚,而半纤维素、纤维素是细胞壁的主要组成成分,因此纤维素、半纤维素含量的变化与木质素含量的变化基本一致。
通过相关性分析发现,木质素、纤维素、半纤维素合成过程中主要是由PAL、CAD、POD 等关键酶共同调控。PAL催化L-苯丙氨酸裂解为反式肉桂酸和氨,有研究表明,PAL是木质素合成途径中的关键酶和光调控酶[23-24],PAL 活性高的位置木质素沉积多。文菁等[20]研究表明,核桃内果皮分化的初期较高,然后降低,是因为引起木质素的积累需要PAL活性达到一定水平。本试验中低浓度4-香豆酸可以促进硬化前期PAL活性提高,高浓度4-香豆酸会抑制硬化前期PAL 活性。肉桂酸处理的PAL 活性增强,且在硬化前期R2、R3处理下效果更好。但是4-香豆酸X2 处理后第9 天和第14 天低于对照;R2 处理后9 d、14 d 低于对照;R1 处理后4 d、24 d 低于对照,可能是光照因素导致PAL活性降低。CAD是木质素合成过程中最后起作用的酶,作用于单木质素生物合成的最后步骤,在聚合成木质素聚合物之前将肉桂醛催化还原成肉桂醇[25]。郭永翠等[26]研究表明,核桃硬化过程中CAD 基因参与调控木质素合成。研究表明,在拟南芥CAD 双基因突变体中,相比于野生型突变体,成熟茎中木质素含量降低了40%,引起了其茎秆木质素结构的改变[27]。汪灿等[28]的研究结果表明,荞麦品种中木质素含量高的茎秆,CAD 活性相对较强。说明CAD 活性与木质素含量有关,本试验中CAD活性整体呈先上升后下降的趋势,低浓度4-香豆酸、肉桂酸促进CAD活性升高,而高浓度4-香豆酸抑制CAD 活性。可能是因为CAD是木质素合成最后一个步骤的关键酶,外施一定浓度的4-香豆酸和肉桂酸可以使上游产物阿魏辅酶A和阿魏酸增多,致使上游产物增加,CAD活性升高,促进木质素合成,且有研究发现阿魏酸的累积量与木质素含量有关[29];但当4-香豆酸和肉桂酸浓度极高时,植物会产生负反馈,导致CAD活性降低,木质素合成量降低。研究表明,POD 能维持细胞代谢平衡,提高植物的抗旱性,与木质素形成和植物的抗氧化能力有关[30]。李夕勃[31]研究表明,POD 活性在核桃硬壳发育过程中较低,且POD活性与木质素含量呈负相关,与本试验结果一致。IAA 在内果皮硬化发育中扮演重要的角色,鱼尚奇等[18]研究表明,在核桃硬化时期IAA含量最高可达25.067 mg·g-1,并且通过转录组和蛋白组的联合分析得出,Jr IAA9、Jr IAA16 和Jr IAA27 在新露核桃内果皮硬化过程中发挥着重要的调控作用。李义霞等[4]在外源IAA对核桃内果皮生长发育的影响研究中发现,IAA 参与调控核桃内果皮的发育,影响内果皮木质素的积累。研究表明,POD 活性与木质素含量成反比[10],并且POD活性上升会使植物内源IAA含量降低[32]。推测是因为4-香豆酸抑制POD活性,再通过复杂的代谢反应,提高核桃内源IAA含量,从而激活苯丙烷代谢途径。本试验结果表明,核桃内果皮的总酚含量较少,且变化量小,4-香豆酸和肉桂酸处理均不同程度提高了总酚含量,可能是因为肉桂酸和4-香豆酸提高了PAL 活性,而PAL 是合成总酚的关键酶[33]。外源物质肉桂酸和4-香豆酸可能通过改变关键酶的活性以及核桃内果皮中的物质含量,从而使木质素含量发生改变,调控核桃内果皮的发育。
4 结 论
通过对新露核桃进行不同浓度外源物质(肉桂酸和4-香豆酸)处理,与对照相比,50~150 mg·L-1肉桂酸和50~150 mg·L-1 4-香豆酸处理对核桃内果皮木质素的积累起促进作用,200 mg·L-1 4-香豆酸抑制木质素的合成,对核桃内果皮木质素的积累起抑制作用,主要表现在木质素沉积,木质素、纤维素和半纤维素含量以及PAL、CAD 和POD 活性等方面,表明外源肉桂酸和4-香豆酸对核桃内果皮的发育有一定的作用。
[1] 王一峰,陈耀年,王瀚,赵淑玲,孙杰,王让军.我国核桃杂交育种研究进展[J].现代农业,2020(4):15-17.WANG Yifeng,CHEN Yaonian,WANG Han,ZHAO Shuling,SUN Jie,WANG Rangjun. Research progress of cross breeding of walnut in China[J].Modern Agriculture,2020(4):15-17.
[2] 武朋辉,杨红军,马红梅.西安鲜食核桃产业发展方向及面临的问题[J].陕西林业科技,2021,49(1):100-105.WU Penghui,YANG Hongjun,MA Hongmei.The development direction and problems of fresh walnut industry in Xi’an[J].Shaanxi Forest Science and Technology,2021,49(1):100-105.
[3] 阿卜杜许库尔·牙合甫,木合塔尔·扎热,马凯,张强,黄闽敏,宁万军.核桃主栽品种新新2 和温185 光合特性与其品质和产量的关系[J].新疆农业科学,2020,57(7):1243-1250.Abduxukur Yakup,Muhtar Zari,MA Kai,ZHANG Qiang,HUANG Minmin,NING Wanjun. Comparison of fruit quality,yield and photosynthetic characteristics of walnut varieties Xinxin 2 and Wen 185[J].Xinjiang Agricultural Sciences,2020,57(7):1243-1250.
[4] 李义霞,鱼尚奇,郭众仲,付嘉智,鹿宏丽,王红霞,张锐,木塔力甫.外源IAA 对核桃内果皮生长发育的影响[J/OL].果树学报,2024:1-16(2024-02-26). https://doi.org/10.13925/i.cnki.gsxb.20230524.LIYixia,YU Shangqi,GUO Zhongzhong,FU Jiazhi,LU Hongli,WANG Hongxia,ZHANG Rui,MU Talifu. Effect of exogenous IAA on the growth and development of walnut endocarp[J/OL]. Journal of Fruit Science,2024:1-16(2024-02-26). https://doi.org/10.13925/i.cnki.gsxb.20230524.
[5] MEENTS M J,WATANABE Y,SAMUELS A L.The cell biology of secondary cell wall biosynthesis[J]. Annals of Botany,2018,121(6):1107-1125.
[6] 鱼尚奇.核桃内果皮木质素合成中间代谢物分析及露仁相关基因筛选研究[D].阿拉尔:塔里木大学,2020.YU Shangqi. Analysis of lignin synthesis intermediate metabolites and screeningof genes related to bared-nut in walnut endocarp[D].Alar:Tarim University,2020.
[7] 于百杰.外源p-香豆酸处理对冷藏南果梨抗冷性的调控研究[D].沈阳:沈阳农业大学,2023.YU Baijie. Effect of exogenous p-coumaric acid treatment on cold resistance of‘Nanguo’pear under cold storage[D]. Shenyang:Shenyang Agricultural University,2023.
[8] 李姚瑶,曹毛毛,王小璐,苏金龙,高慧.外源p-香豆酸处理对采后桃果实苯丙烷代谢和抗氧化能力的影响[J].食品科学,2019,40(23):227-232.LIYaoyao,CAO Maomao,WANG Xiaolu,SU Jinlong,GAO Hui.Effect of exogenous p-coumaric acid on phenylpropanoid metabolism and antioxidant capacity of postharvest peach fruit[J].Food Science,2019,40(23):227-232.
[9] 李姚瑶.p-香豆酸处理调控采后桃果实冷害的机理研究[D].西安:西北大学,2020.LIYaoyao. The regulation mechanism of p-coumaric acid treatment alleviates chilling injury in postharvest peach fruit[D]. Xi’an:Northwest University,2020.
[10] 曹毛毛. p-香豆酸调控猕猴桃果实采后衰老的作用机制研究[D].西安:西北大学,2019.CAO Maomao. Mechanism of p-coumaric acid regulation on postharvest senescence of kiwifruit[D]. Xi’an:Northwest University,2019.
[11] SHIVASHANKAR S,SUMATHIM,KRISHNAKUMAR N K,RAO V K. Role of phenolic acids and enzymes of phenylpropanoid pathway in resistance of chayote fruit (Sechium edule)against infestation by melon fly,Bactrocera cucurbitae[J]. Annals of Applied Biology,2015,166(3):420-433.
[12] YIN Z Q,WONG W,YE W C,LIN.Biologically active Cis-cinnamic acid occurs naturally in Brassica parachinensis[J]. Chinese Science Bulletin,2003,48(6):555-558.
[13] 刘元卫,李胜,马绍英,柴强,张绪成.肉桂酸对豆科和禾本科作物的化感效应[J].分子植物育种,2017,15(9):3637-3641.LIU Yuanwei,LISheng,MA Shaoying,CHAIQiang,ZHANG Xucheng. Allelopathic effect of cinnamic acid on leguminous and gramineous crops[J]. Molecular Plant Breeding,2017,15(9):3637-3641.
[14] 赵玉雪,朱佳敏,杨霞,娄丽.核桃青皮中木质素、纤维素、半纤维素测定初报[J].贵州林业科技,2021,49(2):7-10.ZHAO Yuxue,ZHU Jiamin,YANG Xia,LOU Li.A preliminary report on the determination of lignin,cellulose and hemicellulose in walnut green husk[J]. Guizhou Forestry Science and Technology,2021,49(2):7-10.
[15] 贾昌路,张锐利,张宏,徐崇志,高山,张琦,张锐.新疆阿克苏地区核桃品质分析[J].江苏农业科学,2016,44(4):351-354.JIA Changlu,ZHANG Ruili,ZHANG Hong,XU Chongzhi,GAO Shan,ZHANG Qi,ZHANG Rui. Quality analysis of walnut in Aksu Region of Xinjiang[J]. Jiangsu Agricultural Sciences,2016,44(4):351-354.
[16] 高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006.GAO Junfeng. Experimental guidance for plant physiology[M].Beijing:Higher Education Press,2006.
[17] 鱼尚奇,张锐,郭众仲,宋岩,付嘉智,武鹏雨,马治浩.核桃内果皮硬化期生长素动态变化及差异表达基因分析[J].园艺学报,2021,48(3):487-504.YU Shangqi,ZHANG Rui,GUO Zhongzhong,SONG Yan,FU Jiazhi,WU Pengyu,MA Zhihao.Dynamic changes of auxin and analysis of differentially expressed genes in walnut endocarp during hardening[J].Acta Horticulturae Sinica,2021,48(3):487-504.
[18] ISLAM M T,LEE B R,DAS P R,LA V H,JUNG H I,KIM T H. Characterization of p-Coumaric acid-induced soluble and cell wall-bound phenolic metabolites in relation to disease resistance to Xanthomonas campestris pv.campestris in Chinese cabbage[J]. Plant Physiology and Biochemistry,2018,125:172-177.
[19] ISLAM M T,LEE B R,LA V H,LEE H,JUNG W J,BAE D W,KIM T H. P-Coumaric acid induces jasmonic acid-mediated phenolic accumulation and resistance to black rot disease in Brassica napus[J]. Physiological and Molecular Plant Pathology,2019,106:270-275.
[20] 文菁,赵书岗,王红霞,张志华,李夕勃.核桃硬壳发育期内果皮木质素与相关酶活性的变化[J]. 园艺学报,2015,42(11):2144-2152.WEN Jing,ZHAO Shugang,WANG Hongxia,ZHANG Zhihua,LIXibo.Changes of lignin content and its related enzyme activities in endocarp during walnut shell development period[J].Acta Horticulturae Sinica,2015,42(11):2144-2152.
[21] 郑志锋,邹局春,陈浪,张宏健,凌敏. 核桃壳木质素的1HNMR 分析[J].西北林学院学报,2007,22(2):131-133.ZHENG Zhifeng,ZOU Juchun,CHEN Lang,ZHANG Hongjian,LING Min.Analysis of walnut shell lignin by1H-NMR[J].Journal of Northwest Forestry University,2007,22(2):131-133.
[22] 石吴娟,滕建文,夏宁,韦保耀,黄丽.百香果皮细胞壁多糖的顺序提取与理化性质分析[J/OL].食品工业科技,2024:1-15(2024-03-21).https://doi.org/10.13386/j.issn1002-0306.2023110001.SHIWujuan,TENG Jianwen,XIA Ning,WEIBaoyao,HUANG Li. Sequential extraction and physicochemical property analysis of cell wall polysaccharides from the passion fruit peels[J/OL].Food Industry Science and Technology,2024:1-15(2024-03-21).https://doi.org/10.13386/j.issn1002-0306.2023110001.
[23] BUTLAND S L,CHOW M L,ELLIS B E.A diverse family of phenylalanine ammonia-lyase genes expressed in pine trees and cell cultures[J].Plant Molecular Biology,1998,37(1):15-24.
[24] KUMAR A,ELLIS B E.The phenylalanine ammonia-lyase gene family in raspberry Structure,expression,and evolution[J]. Plant Physiology,2001,127(1):230-239.
[25] 王芬,吴婷,张萍,张强,刘丽.核桃内果皮发育研究进展[J].四川林业科技,2024,45(1):1-7.WANG Fen,WU Ting,ZHANG Ping,ZHANG Qiang,LIU Li.Research advances on endocarp development of walnut[J].Journal of Sichuan Forestry Science and Technology,2024,45(1):1-7.
[26] 郭永翠,秦江南,袁雨婷,张锐.新疆核桃WJ-CAD 和ZJ-CAD基因克隆及时空表达分析[J].基因组学与应用生物学,2020,39(3):1215-1221.GUO Yongcui,QIN Jiangnan,YUAN Yuting,ZHANG Rui.Cloning and expression analysis of WJ-CAD and ZJ-CAD genes of walnut in Xinjiang[J]. Genomics and Applied Biology,2020,39(3):1215-1221.
[27] SIBOUT R,EUDES A,MOUILLE G,POLLET B,LAPIERRE C,JOUANIN L,SÉGUIN A. CINNAMYL ALCOHOL DEHYDROGENASE-C and-D are the primary genes involved in lignin biosynthesis in the floral stem of Arabidopsis[J]. The Plant Cell,2005,17(7):2059-2076.
[28] 汪灿,阮仁武,袁晓辉,胡丹,杨浩,林婷婷,何沛龙,李燕,易泽林.荞麦茎秆解剖结构和木质素代谢及其与抗倒性的关系[J].作物学报,2014,40(10):1846-1856.WANG Can,RUAN Renwu,YUAN Xiaohui,HU Dan,YANG Hao,LIN Tingting,HE Peilong,LIYan,YIZelin. Relationship of anatomical structure and lignin metabolism with lodging resistance of culm in buckwheat[J].Acta Agronomica Sinica,2014,40(10):1846-1856.
[29] 翁飞.氮素对水稻茎秆强度的影响及其生理机制[D].南京:南京农业大学,2019.WENG F.Effects of nitrogen on rice stem strength and its physiological mechanism[D].Nanjing:Nanjing Agricultural University,2019.
[30] 龚天芝,张德健.外源硒对核桃硒含量和果实品质的影响及生理作用机制[J].果树学报,2022,39(8):1443-1449.GONG Tianzhi,ZHANG Dejian. Effect of exogenous selenium application on selenium content and fruit quality as well as its physiological mechanism in walnut[J]. Journal of Fruit Science,2022,39(8):1443-1449.
[31] 李夕勃.核桃坚果硬壳发育与木质素代谢关系的研究[D].保定:河北农业大学,2012.LIXibo. Studies on relationship between lignin metabolism and shell development of Juglans regia L.[D]. Baoding:Hebei Agricultural University,2012.
[32] 谈宏鹤,李小方,黄祥辉.甘蓝下胚轴不同切段内源IAA 水平与不定根发生能力的研究[J].华东师范大学学报(自然科学版),2000(4):84-90.TAN Honghe,LIXiaofang,HUANG Xianghui. Studies on endogenous IAA levels and adventitious root formation capactity of different hypocotyl segments of cabbage[J]. Journal of Eastchina Normal University(Natural Science),2000(4):84-90.
[33] 李玉杰,刘少康,周涛,郝建雄,饶欢,赵丹丹,刘学强,王成祥.盐胁迫对芝麻萌发过程中活性成分、抗氧化性及抗氧化酶活性的影响[J/OL]. 食品工业科技,2024:1-14(2024-03-12).https://doi.org/10.13386/j.issn1002-0306.2023110056.LIYujie,LIU Shaokang,ZHOU Tao,HAO Jianxiong,RAO Huan,ZHAO Dandan,LIU Xueqiang,WANG Chengxiang. Effects of salt stress on active components,antioxidant activity and antioxidant oxidase activity of sesame during germination[J/OL].Science and Technology of Food Industry,2024:1-14(2024-03-12).https://doi.org/10.13386/j.issn1002-0306.2023110056.