中国柑橘生产规模居世界首位,其中以鲜食柑橘为主,外观品质是影响鲜食柑橘商品性的关键因素。柑橘果实日灼主要引起果皮组织的灼伤,降低柑橘外观品质。柑橘果皮由外果皮(有色层)、中果皮(白皮层)和内果皮发育而来的囊衣共同组成,柑橘果实的日灼症状主要发生在有色层,轻则果皮褪绿转色,重则形成伤斑。在柑橘产区中,几乎所有柑橘品种都会发生日灼,极大地降低了经济效益。但对于柑橘果实日灼发生的内在机制以及伤斑的形成仍不清楚。Barber 和Sharpe[1]首次提出了紫外线辐射、热和受热组织光动力学是造成果实日灼病害的直接原因。Rabinowitch等[2]也认为日灼与果实表面温度及果实耐热性密切相关,并提出温度“阈值”这一概念。Liu 等[3]认为环境温度过高会造成叶片受损及果实发生日灼现象。由此可见,高温是柑橘果实日灼产生的重要原因。
在植物中,热应激转录因子(heat shock transcription factor,Hsf)是响应高温应激反应的主要调节因子,且属于进化保守的一类基因家族。Hsf 家族成员有5 个保守结构域:DNA 结合域(DBD)、低聚结构域(OD)、C-末端活化域(CTAD)、核定位信号(NLS)以及核出口信号(NES)[4-6]。在这些结构域中,DBD位于Hsf蛋白的N端,该结构域的特征是疏水性以及中心螺旋-转弯-螺旋基序结构,其独特结构和特性是高度选择相互作用元件的关键,经热应激环境活化后的Hsf可识别HSP基因上游启动子区域的热应激元件(HSEs,nGAAnnTTCn 或nTTCnnGAAn)并进行转录[7];OD是由15~80个氨基酸残基组成连接到DBD 的一段序列,OD 结构域的A/B 区插入的氨基酸残基的有无及数量作为Hsf 的分簇标准;CTAD 包含一个阻遏物结构域(LFGV肽[8]),直接调节热应激反应;NLS 和NES 负责调节Hsf蛋白的跨核转运[9]。Hsf位于热应激信号传递途径的下游,当植物处在热环境中时,Hsf可激活HSP,还可激活其他应激反应蛋白如抗坏血酸、过氧化物酶和过氧化氢酶等,以清除热胁迫产生的活性氧来抵御高温[10-12]。
Hsf 在参与调节植物的生长和发育中发挥重要作用。在番茄中,HsfA1a 通过增强抗氧化能力、蛋白质修复和降解的功能来提高其花粉活力[13]。在拟南芥中,HsfA9 可控制种子发育过程中热激蛋白的表达[14-15]。在烟草中,过表达HsfA9则可以促进烟草的早期发育,具体表现为光合色素的提前积累和子叶的提前展开[16]。在小麦中,不育和可育花药中TaHsfA2b 显著差异表达,推测其可能参与小麦的花药发育[17]。在矮牵牛中发现,PhHsf19 正向调节PhPAL2的表达,从而表明PhHsf19可能在调节苯类/苯丙类生物合成中发挥作用[18]。在柑橘中,果实发育和成熟过程中CrHsfB2a 和CrHsfB5 可以参与热处理下的柠檬酸降解[19]。
Hsf同样参与植物抵御高温等逆境胁迫,包括植物的信号接收与传递[20]、基因表达调控[15,21]及抗逆性[7]等。Scharf等[6]首次在番茄中克隆并鉴定了3种由热应激诱导出的Hsf,开启了Hsf在植物中的表征与功能研究。在拟南芥中,Hsf在高温等逆境方面发挥重要作用,HsfA2过表达株系耐热性显著增强,且盐胁迫和渗透胁迫同样诱导HsfA2、HsfA6b和HsfA4的表达[20,22-24]。芹菜AgHSFa6-1 异源过表达拟南芥可上调拟南芥下游基因AtHSP98.7、AtHSP70-1、At-BOB1、AtCPN60B、AtADH2、AtAPX1、AtGOLS1 的表达,显著提高植株耐热性[25]。水稻OsHsfB2b作为负调控因子参与水稻盐胁迫过程,OsHsfB2b过表达植株的耐旱性和耐盐性显著降低,而OsHsfB2b-RNAi植株则显著增强[26]。在猕猴桃中,盐处理可以强烈诱导AeHsfA2b/2c 和AeHsfB1c/1d/2c/3b 的表达,且AeHsfA2b 在拟南芥中异源过表达增强了AtRS5、At-GolS1和AtGolS2的表达,显著提高了植株对盐胁迫的耐受性[27]。在苹果中,HsfA8a介导了ABA途径的耐旱性,并通过调节类黄酮合成从而增强植株的耐旱功能[7]。
本研究中基于橙类(Citrus sinensis)、宽皮柑橘类(Citrus reticulata)、柚类(Citrus maxima)的全基组序列鉴定柑橘属Hsf 家族基因,并在基因组水平上对系统进化发育、基因结构、启动子顺式作用元件、共线性以及组织表达谱等进行分析,并进一步对温州蜜柑日灼果皮组织(有色层和白皮层)及热处理金柑果皮中进行qRT-PCR检测,旨在对柑橘Hsfs进行全基因组鉴定,并挖掘可能在柑橘果实日灼发生中发挥作用关键Hsfs基因,为今后柑橘Hsfs基因功能研究及产业上解决柑橘日灼问题提供理论参考。
1 材料和方法
1.1 植物材料
日灼果实材料来源于湖南省宁乡市左家山村果园(28.47°N,112.65°E)大分四号温州蜜柑,根据湖南省宁乡市天气状况,于2022 年8月中旬日灼高发期取样,样品取至少15 株树的外膛正常果(normal fruit,NF)、轻度日灼果(light sunburn fruit,LSF)和重度日灼果(severe sunburn fruit,SSF),果实采摘后立即对果皮进行分离,并区分外果皮(epicarp,EP)和中果皮(albedo,AL)。除分离正常果外果皮(normal epicarp of normal fruit,NEN)和中果皮(normal albedo of normal fruit,NAN)、轻度日灼果日灼面外果皮(sunburn epicarp of light sunburn fruit,SEL)和中果皮(sunburn albedo of light sunburn fruit,SAL)、重度日灼果日灼面外果皮(sunburn epicarp of severe sunburn fruit,SES)和中果皮(sunburn albedo of severe sunburn fruit,SAS)外,并分离重度日灼果正常面外果皮(normal epicarp of severe sunburn fruit,NES)和中果皮(normal albedo of severe sunburn fruit,NAS),每分离6 个果作一个混样,3 个生物学重复,样品经过液氮速冻并于-80 ℃冰箱保存。
热处理材料来源于湖南农业大学国家柑橘改良中心长沙分中心试验棚内滑皮金柑,样品选择绿熟期无伤斑和病虫害的健康果实,样品采摘后分别进行常温(25 ℃)和高温(45 ℃)处理,处理时长为0、2、4、6 h,处理结束后立即分离总果皮,每6个果一个混样,3个生物学重复,样品经过液氮速冻并于-80 ℃冰箱保存。
1.2 分析方法
1.2.1 柑橘Hsf家族成员鉴定和相关生物信息学分析 分别从拟南芥数据库(http://www.arabidopsis.org)和甜橙数据库(http://citrus.hzau.edu.cn/)下载拟南芥(Arabidopsis thaliana)、甜橙[C. sinensis.(L.)Osbeck]、克里曼丁橘(C. clementina Hort. ex. Tanaka)和晚白柚[C. maxima(Burm.)Merr.‘Wanbaiyou’]基因组数据和gff 注释文件。首先,获得拟南芥的Hsf 家族成员蛋白序列,并利用TBtools[28]软件从gff文件获取蛋白信息,以拟南芥Hsf成员蛋白作为模板,与甜橙、克里曼丁橘和晚白柚的蛋白组并进行双向比对,e-value≤1e-5作为柑橘Hsfs 候选基因。其次,从Pfam 数据库(http://pfam.xfam.prg)下载Hsf的隐马尔科夫模型(PF03330)和(PF00447)文件,使用LINUX 虚拟机系统利用hmmsearch 搜索工具对甜橙、克里曼丁橘、晚白柚Hsf 成员进行筛选(设定阈值为E<1e-5),手动删除冗余序列,然后,使用Ex-PASy(https://www.expasy.org/)进一步分析Hsf 蛋白序列的理化特征,包括分子质量、等电点和蛋白长度等信息。最后,通过在线网站Cell-PLoc2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)预测Hsfs蛋白的亚细胞定位。
基于甜橙基因组数据库下载的甜橙、克里曼丁橘、晚白柚gff 注释文件,使用MEME(Multiple EM for Motif Elicitation,https://meme- suite.orgmeme tools meme)工具在线分别分析CsHsfs、CgHsfs、CcHsfs 蛋白序列保守基序数量、长度和序列信息,最高基序选择20。使用TBtools[28]软件Gene Structure View(Advanced)程序进行基因结构及蛋白基序的可视化。
基于甜橙、克里曼丁橘、晚白柚的蛋白序列,利用MEGA 5.0软件将甜橙、克里曼丁橘、晚白柚及拟南芥的Hsfs蛋白序列进行多重序列比对,最后用邻接法构建系统进化树,采用默认参数。
使用TBtools[28]软件提取甜橙、克里曼丁橘、晚白柚基因组中上游2000 bp的启动子序列,然后利用在线预测网站PlantCARE(http://bioinformatics.psb.ugent.be/we- btools/plantcare/html/)预测 CsHsfs、CgHsfs、CcHsfs启动子区域顺式作用元件,预测结果用Excel 进行统计,用TBtools[28]软件HeatMap 程序绘制热图,并使用TBtools[28]软件Simple BioSequence Viewer程序对顺式作用元件分布进行可视化。
根据甜橙、克里曼丁橘及晚白柚基因组文件,使用TBtools[28]软件Fasta Stats 程序获得染色体信息。利用TBtools[28]软件One StepMCScanX-Super Fast等程序分析CsHsfs、CgHsfs、CcHsfs 物种内共线性关系,筛选压设为30,并使用TBtools[28]软件Advanced Circos 程序对结果进行可视化。根据甜橙、克里曼丁橘、晚白柚及拟南芥基因及gff 注释文件,使用TBtools[28]软件One StepMCScanX-Super Fast程序获取染色体分布信息及物种间共线性关系,并使用TBtools[28]软件Dual systeny plot for MCScanX 程序对结果进行可视化。
1.2.2 CsHsf 家族成员的不同组织表达谱分析 基于已发表的转录组数据,分别获得了奉节脐橙[29]不同果实发育时期[50、80、120、155、180、220 DAF(days after flowering,DAF)]的外果皮、中果皮、囊衣(segment membrane,SM)、汁胞(juice sacs,JS),光热胁迫条件下枳橙(C. sinensis × Poncirus trifoliata)[30]叶片,温州蜜柑(C. unshiu)[31]不同发育时期(30、80、170 DAF)粗皮大果(peel roughing-disordered large fruits,PD)的转录组数据,并对其FPKM值进行分析,然后使用TBtools[28]软件HeatMap程序绘制热图。
1.2.3 温州蜜柑日灼及正常果皮厚度测定 选择日灼面在果实赤道线附近的日灼果实和正常果实,采用体式显微镜进行果皮厚度测定,每个果实延赤道线切开,正常果实随机测6个点,日灼果实日灼面和对立正常面各测3个点,依次为正常果果皮(normal peel of normal fruit,NPN)、轻度日灼果正常面果皮(normal peel of light sunburn fruit,NPL)、轻度日灼果日灼面果皮(sunburn peel of light sunburn fruit,SPL)、重度日灼果正常面果皮(normal peel of severe sunburn fruit,NPS)和重度日灼果日灼面果皮(sunburn peel of severe sunburn fruit,SPS),10 个果实作为一个重复,共3个生物学重复。
1.2.4 CsHsfs基因在温州蜜柑日灼果皮中表达模式分析 采用RNAprep 植物试剂盒(天根,北京,中国)分别提取大分四号温州蜜柑不同果皮样品RNA,用酶标仪测定RNA 的质量与浓度。使用Evo-M-MLV 反转录试剂盒(艾科瑞,湖南,中国)合成cDNA,使用Talent 荧光定量检测试剂盒(SYBR Green,天根,中国)和CFX96(Bio-Rad,Hercules,CA,USA)实时PCR 检测系统进行定量PCR。以柑橘Actin 作内参基因,qRT-PCR 扩增程序为:预变性95 ℃3 min,变性95 ℃5 s,退火58 ℃10 s,延伸72 ℃15 s,40个循环。
1.3 数据统计分析
将获得的数据整理于Excel中并进行处理,使用SPSS 20.0 进行差异显著性分析,利用SigmaPlot 10.0软件作图。
2 结果与分析
2.1 柑橘Hsfs成员的鉴定与理化性质分析
通过同源性搜索和结构域确认,分别从橙类(甜橙)、宽皮柑橘类(克里曼丁橘)、柚类(晚白柚)鉴定得到了14、20、16 个Hsf 家族成员,并分别命名为CsHsf1~14、CcHsf1~20、CgHsf1~16。进一步探究柑橘属Hsfs 蛋白长度、等电点及分子质量等特征,发现甜橙蛋白序列长度为271 aa(CsHsf1)~517 aa(CsHsf12),对应的等电点范围为4.80(CsHsf5)~8.09(CsHsf4),分子质量范围为30.1 ku(CsHsf1)~56.3 ku(CsHsf12);克里曼丁的蛋白序列长度范围为208 aa(CcHsf8)~505 aa(CcHsf14),对应的等电点范围为4.65(CcHsf6、CcHsf7)~9.56(CcHsf8),分子质量范围为24.1 ku(CcHsf8)~56.2 ku(CcHsf14);柚的蛋白序列长度范围为261 aa(CgHsf13)~516 aa(CgHsf14),对应的等电点范围为4.65(CgHsf3)~8.09(CgHsf5),分子质量范围为29.8 ku(CgHsf13)~56.1 ku(CgHsf14)。亚细胞定位预测显示,柑橘属3 个Hsf家族成员均定位在细胞核,与其转录因子特征一致(表1)。
表1 柑橘Hsfs 成员理化性质分析
Table 1 Physicochemical properties analysis of Hsfs members in citrus
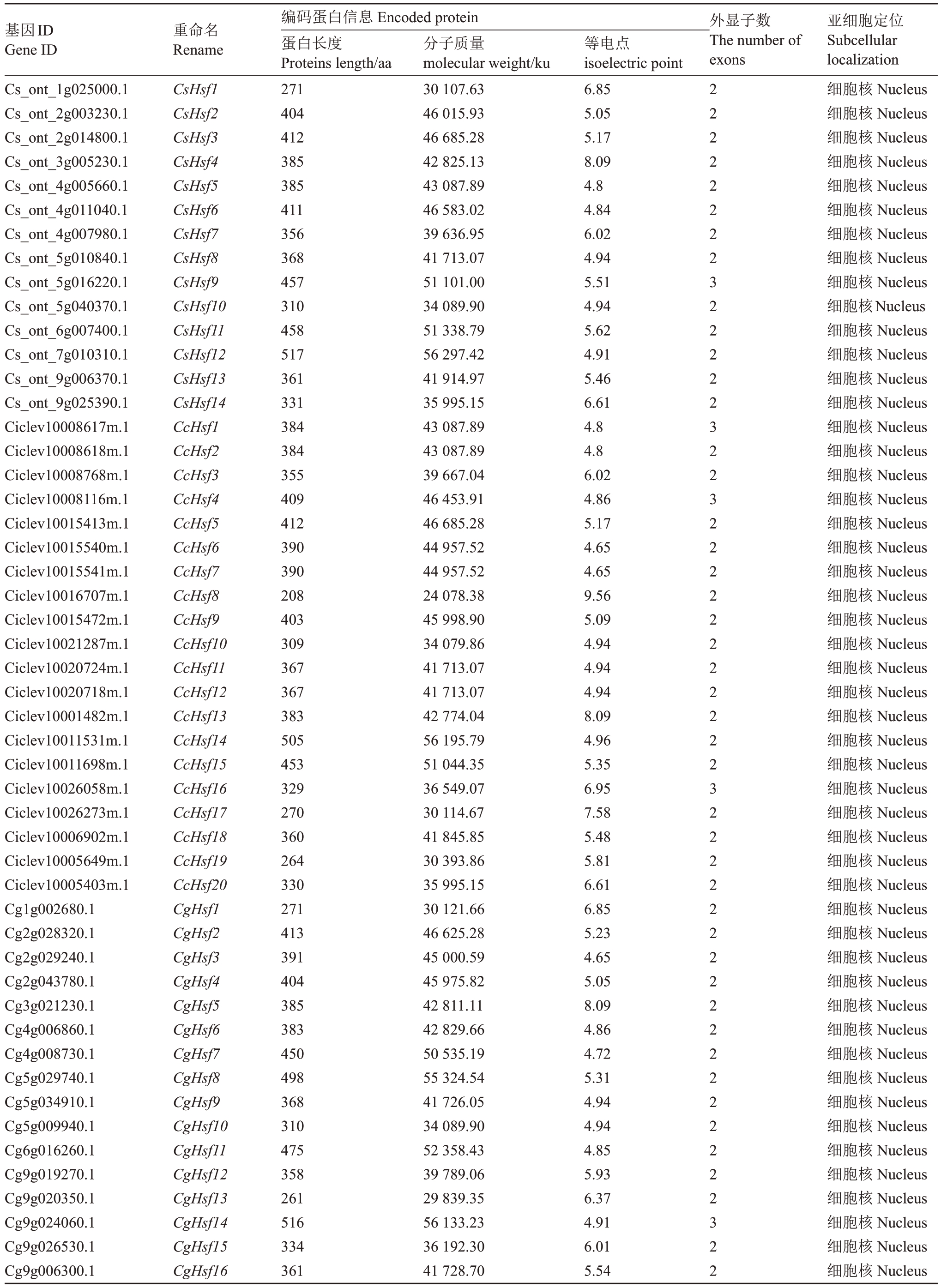
基因ID Gene ID重命名Rename外显子数The number of exons Cs_ont_1g025000.1 Cs_ont_2g003230.1 Cs_ont_2g014800.1 Cs_ont_3g005230.1 Cs_ont_4g005660.1 Cs_ont_4g011040.1 Cs_ont_4g007980.1 Cs_ont_5g010840.1 Cs_ont_5g016220.1 Cs_ont_5g040370.1 Cs_ont_6g007400.1 Cs_ont_7g010310.1 Cs_ont_9g006370.1 Cs_ont_9g025390.1 Ciclev10008617m.1 Ciclev10008618m.1 Ciclev10008768m.1 Ciclev10008116m.1 Ciclev10015413m.1 Ciclev10015540m.1 Ciclev10015541m.1 Ciclev10016707m.1 Ciclev10015472m.1 Ciclev10021287m.1 Ciclev10020724m.1 Ciclev10020718m.1 Ciclev10001482m.1 Ciclev10011531m.1 Ciclev10011698m.1 Ciclev10026058m.1 Ciclev10026273m.1 Ciclev10006902m.1 Ciclev10005649m.1 Ciclev10005403m.1 Cg1g002680.1 Cg2g028320.1 Cg2g029240.1 Cg2g043780.1 Cg3g021230.1 Cg4g006860.1 Cg4g008730.1 Cg5g029740.1 Cg5g034910.1 Cg5g009940.1 Cg6g016260.1 Cg9g019270.1 Cg9g020350.1 Cg9g024060.1 Cg9g026530.1 Cg9g006300.1 CsHsf1 CsHsf2 CsHsf3 CsHsf4 CsHsf5 CsHsf6 CsHsf7 CsHsf8 CsHsf9 CsHsf10 CsHsf11 CsHsf12 CsHsf13 CsHsf14 CcHsf1 CcHsf2 CcHsf3 CcHsf4 CcHsf5 CcHsf6 CcHsf7 CcHsf8 CcHsf9 CcHsf10 CcHsf11 CcHsf12 CcHsf13 CcHsf14 CcHsf15 CcHsf16 CcHsf17 CcHsf18 CcHsf19 CcHsf20 CgHsf1 CgHsf2 CgHsf3 CgHsf4 CgHsf5 CgHsf6 CgHsf7 CgHsf8 CgHsf9 CgHsf10 CgHsf11 CgHsf12 CgHsf13 CgHsf14 CgHsf15 CgHsf16编码蛋白信息Encoded protein蛋白长度Proteins length/aa 271 404 412 385 385 411 356 368 457 310 458 517 361 331 384 384 355 409 412 390 390 208 403 309 367 367 383 505 453 329 270 360 264 330 271 413 391 404 385 383 450 498 368 310 475 358 261 516 334 361分子质量molecular weight/ku 30 107.63 46 015.93 46 685.28 42 825.13 43 087.89 46 583.02 39 636.95 41 713.07 51 101.00 34 089.90 51 338.79 56 297.42 41 914.97 35 995.15 43 087.89 43 087.89 39 667.04 46 453.91 46 685.28 44 957.52 44 957.52 24 078.38 45 998.90 34 079.86 41 713.07 41 713.07 42 774.04 56 195.79 51 044.35 36 549.07 30 114.67 41 845.85 30 393.86 35 995.15 30 121.66 46 625.28 45 000.59 45 975.82 42 811.11 42 829.66 50 535.19 55 324.54 41 726.05 34 089.90 52 358.43 39 789.06 29 839.35 56 133.23 36 192.30 41 728.70等电点isoelectric point 6.85 5.05 5.17 8.09 4.8 4.84 6.02 4.94 5.51 4.94 5.62 4.91 5.46 6.61 4.8 4.8 6.02 4.86 5.17 4.65 4.65 9.56 5.09 4.94 4.94 4.94 8.09 4.96 5.35 6.95 7.58 5.48 5.81 6.61 6.85 5.23 4.65 5.05 8.09 4.86 4.72 5.31 4.94 4.94 4.85 5.93 6.37 4.91 6.01 5.54 22222222322222322322222222222322222222222222222322亚细胞定位Subcellular localization细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus细胞核Nucleus
2.2 柑橘Hsfs基因的多序列比对、系统发育分析和分类
为了进一步明确Hsf 家族成员的亲缘进化关系,对3类柑橘品种及拟南芥的Hsf家族成员进行系统发育分析。结果(图1)显示,甜橙、克里曼丁、晚白柚及拟南芥Hsf 家族成员主要分为3 个簇:HSF A~C。甜橙、克里曼丁橘、晚白柚Hsfs家族成员均为A 簇数目最多,分别有9 个、12 个、10 个;B 簇其次,分别为4个、7个、5个成员;C簇最少,每个物种成员均只有1 个。这些结果表明,柑橘Hsfs 在进化过程中都比较保守。

图1 柑橘Hsfs 进化发育分析
Fig.1 Evolutionary development analysis of Hsfs genes in citrus
蓝色三角、绿色圆圈、红色圆圈和白色五角星分别代表来自甜橙、克里曼丁橘、晚白柚和拟南芥的Hsf 基因。Hsf 的3 个簇在不同的分支被很好地分离,并用不同颜色表示。
Blue triangles, green circles, red circles, and white pentagrams represent Hsf genes from sweet orange, clementine mandarin, wanbai pomelo, and Arabidopsis,respectively.The three clusters of Hsf genes are well separated on different branches and are distinguished by different colors.
2.3 柑橘Hsfs的基因结构和保守基序分析
为了研究柑橘Hsfs基因的结构特征,在3个柑橘属的Hsfs蛋白序列中共鉴定出20个不同的基序,长度从15到50个氨基酸不等(表2)。基序1、2组装构成了保守的DBD 蛋白结构域,基序5 和7 的全序列组装在一起形成了完整的ACD区域(图2-B)。整体而言,同簇中的Hsfs成员之间具有高度保守的基序特征。所有柑橘Hsfs成员都包含基序1、基序2。此外,有些基序是某些簇所特有的,如基序6、8、17仅在A簇成员中出现,而基序15仅在B簇成员中出现,基序5仅在A、B簇成员中出现,基序4仅在A、C两簇成员中出现。

图2 柑橘Hsfs 基因结构分析
Fig.2 Structural analysis of Hsfs genes in citrus
A.Hsfs 进化树。Hsfs 的3 个簇分别用不同颜色表示;B.氨基酸基序,数字1~20 的基序用不同的颜色的方框表示;C.内含子和外显子结构,黄色方框和黑色线分别表示外显子和内含子。
A.Evolutionary tree of Hsf genes.The three clusters of Hsfs genes are represented by different colors;B.Amino acid motifs.Motifs numbered 1 to 20 are represented by colored squares;C.Exon-intron structure.Yellow boxes and black lines represent exons and introns,respectively.
表2 20 种基序对应蛋白序列
Table 2 Correspondence between 20 motifs and protein sequences

基序Motif Motif 1 Motif 2 Motif 3 Motif 4 Motif 5 Motif 6 Motif 7 Motif 8 Motif 9 Motif 10 Motif 11 Motif 12 Motif 13 Motif 14 Motif 15 Motif 16 Motif 17 Motif 18 Motif 19 Motif 20蛋白序列Proteins Sequences WSSSGNSFIVWBPAEFSRDLLPKYFKHNNFSSFVRQLNTY GFRKVDPDRWEFANEGFLRGZKHLLKNIRRRKT EGLHDNGPPPFLTKTYEMVDDPSTDSIVS RLRQQQQNTRSQLQAMEQRLQGTEKRQQQMMSFLAKALQNP GLDEENERLRRDNNVLMQELV SFGVQLVQQKEKRRE EEEPPSSNKSSVBDTFWEDFLTEDPIAEB SPSNSGEEQQETSNSSPVALDAGSVID NTENVDVLTEQMGYL KKKRKFIRHQPIELGESDSSDDGZGVSYIDELAVPGGATKATEVMASGASSSSNFDPH ZGSCDYJLDGLVGIGSGREDMVSSFENLK PQQQAVGACVEVGKF PQVAINHHHHHHQHPHSHSPVLVNGPSFFPFPNRVSISPSDSDEHVNNWC ELTPLSMEMZAFPSTVZENEN EETIVCGGSHEMKKVEPSAPYIPSSKVCN PYYMIKEEQPGGIPSESGADEAAVMTMMM MQSELTDMLPADSTNIDTTDTPPAFQALMDDDGLCRSPIQDLKGNVMCTCILCVAEQEDIPBLDMDAEPAVSAEEEERL KPDNQLVRYHPPIDETPKPVLHPVTDVGN长度Length/aa 40 33 29 41 21 15 29 27 15 29 29 29 15 50 21 29 29 50 29 29
通过基因结构分析发现,同一簇Hsfs 成员间基因结构也比较保守,大多数成员结构域均包含2 个外显子,少数包含3 个外显子(图2-C)。A 簇中,除CsHsf9/11、CcHsf4/15 包含3 个外显子外,其余都包含2个外显子;B簇中除CcHsf16含有3个外显子外,其余基因均含有2 个外显子;而C 簇所有成员都只含有2个外显子。
2.4 柑橘Hsfs基因启动子区顺式作用元件的分析
为了进一步明确柑橘Hsfs家族成员的调控模式及潜在功能,对甜橙类、宽皮橘类以及柚类Hsfs基因启动子顺式作用元件进行分析。结果显示,柑橘Hsfs 基因家族成员检测到9 种激素类和5 种胁迫类顺式作用元件(图3)。激素类响应元件包括生长素(auxin,IAA)响应元件(TGA- element、AuxRRcore)、赤霉素(gibberellic acid,GA)响应元件(GARE-motif、P-box、TATC-box)、茉莉酸甲酯(Methyl Jasmonate,MeJA)响应元件(TGACG-motif、CGTCA-motif)、ABA 响应元件(ABRE)、水杨酸响应元件(TCA-element)。其中,MeJA 响应元件和ABA 响应元件分布最多,特别是CsHsf2/4、CcHsf3/13、CgHsf5 含有8~12 个MeJA 元件,CsHsf2/6/8、CcHsf4、CgHsf7/9 含有8~9 个ABA 元件。Hsfs 基因启动子中胁迫响应元件包括TC-rich repeats、WUNmotif、MBS、LTR、ARE。其中,MBS、ARE元件分布最多,特别是CsHsf8/11/13、CcHsf11/12/14/15/18、CgHsf9 含有3~5 个MBS 元件,CcHsf6/7/9/10 含有3个ARE元件。

图3 柑橘Hsfs 基因启动子区主要顺式作用元件分析
Fig.3 Analysis of major cis-acting elements in the promoter regions of Hsfs genes in citrus
A.Hsf 进化树。Hsfs 的3 个簇分别用不同颜色表示。B.Hsfs 启动子顺式作用元件的数量。顺式作用元件的丰富程度和数量分别用网格的颜色和编号表示。C.顺式作用元件在Hsfs 启动子上的位置。不同类型的元件分别用不同彩色圆圈表示。
A. Evolutionary tree of Hsf genes. The three clusters of Hsfs genes are represented by different colors. B. Number of cis-acting elements in Hsfs promoter regions.The abundance and quantity of cis-acting elements are represented by grid color and number, respectively. C. Distribution of cisacting elements in Hsfs promoter regions.Different types of elements are represented by different colored circles.
2.5 柑橘Hsfs基因共线性分析
3 个柑橘品种Hsfs 家族成员在9 条染色体上呈不均匀分布特征。其中甜橙除8 号染色体不存在CsHsfs成员外,其余8条染色体都有分布;而克里曼丁橘除了4、8 号染色体不存在CcHsfs 外,其余成员分布较为集中,特别是1、2 号染色体,分别分布了4个和5个CcHsfs成员;晚白柚同样有两条染色体(4、7 号)上不存在CgHsfs 成员,其中9 号染色体,分布了5个CgHsf成员(图4-A)。

图4 柑橘Hsfs 基因共线性分析
Fig.4 Collinearity analysis of Hsfs genes in citrus
A.Hsfs 物种内共线性。环外基因分布表示基因在染色体定位,红色基因名代表具有共线性的基因,环内红色线条代表物种内的片段重复基因对。B.柑橘属及拟南芥Hsfs 物种间共线性。绿色长条代表染色体及染色体长度,红色线条代表物种间的重复基因对,红色线条与绿色长条交叉点代表Hsfs 基因在染色上的位置。
A.Intraspecific Collinearity of Hsfs genes.Genes distributed outside the circle represent gene chromosomal locations,with gene names in red indicating genes with collinearity. Red lines inside the circle represent intraspecific segmental duplicate gene pairs. B. Interspecific collinearity of Hsfs genes in citrus and arabidopsis. Green bars represent chromosomes and their lengths. Red lines represent duplicate gene pairs between species, with intersections between red lines and green bars indicating the chromosomal positions of Hsfs genes.
通过MCscan分析,鉴定了柑橘Hsf家族的串联重复和片段重复基因对。种内共线性分析发现,甜橙类、橘类、柚类中均没有串联重复事件序列(图4-A)。但3 个柑橘品种内均存在3 个片段重复事件,其中甜橙中分别为CsHsf5/7、CsHsf8/13 和CsHsf10/14;克里曼丁中分别为CcHsf2/4、CcHsf10/20 和CcHsf12/18;柚子中分别为CgHsf6/7、CgHsf8/16 和CgHsf10/12(图4-A)。结果表明片段重复在基因进化中起主导作用。
此外,构建了3 种类型柑橘品种间及其与模式植物拟南芥间的共线性关系。结果表明,甜橙、克里曼丁橘、晚白柚与拟南芥Hsf 成员分别存在11、15、16 对共线性关系,而甜橙与克里曼丁橘、甜橙与晚白柚、克里曼丁橘和晚白柚分别存在17、20、20对共线性关系。其中,CsHsf13、CcHsf18和CgHsf12分别互为同源基因,且同时与拟南芥3 个基因(AtHsfA6b、AtHsfA7b、AtHsfA6a)存在共线性关系;同样,CsHsf8、CcHsf12和CgHsf9分别互为同源基因,且同时拟南芥两个基因(AtHsfA6b、AtHsfA7b)存在共线性关系(图4-B)。
2.6 柑橘转录组及CsHsfs表达谱分析
为了挖掘在柑橘果实日灼发生过程中的CsHsfs关键候选基因,对奉节脐橙不同发育时期的不同果实组织的时空转录组、光热处理枳橙叶片转录组以及温州蜜柑粗皮大果转录组进行分析。果实时空表达分析显示,不同CsHsfs基因在柑橘果实不同组织中表达模式特异,其中大部分CsHsfs 基因在外果皮或中果皮特异性表达,如CsHsf2、CsHsf7 主要在外果皮中表达,CsHsf5/8/10/11/12 主要在中果皮表达,且表达量基本随着果实发育呈下降趋势(图5-A)。在温州蜜柑中,CsHsf9、CsHsf11在30 DAF粗皮大果中表达量较正常果高,CsHsf4、CsHsf10在80 DAF粗皮大果中表达量较正常果高,CsHsf5、CsHsf13 则在170 DAF 较正常果上调表达,特别是CsHsf5 在不同果实发育时期粗皮大果中较正常果上调表达(图5-C),暗示在粗皮大果发育时期可能受多个基因分别控制调节。在光热胁迫处理枳橙叶片后,CsHsf2/7/8受到光胁迫显著诱导,CsHsf4/9/12 受到热胁迫显著诱导,而CsHsf1/5/6/10/11/13受到光热胁迫协同诱导(图5-B)。
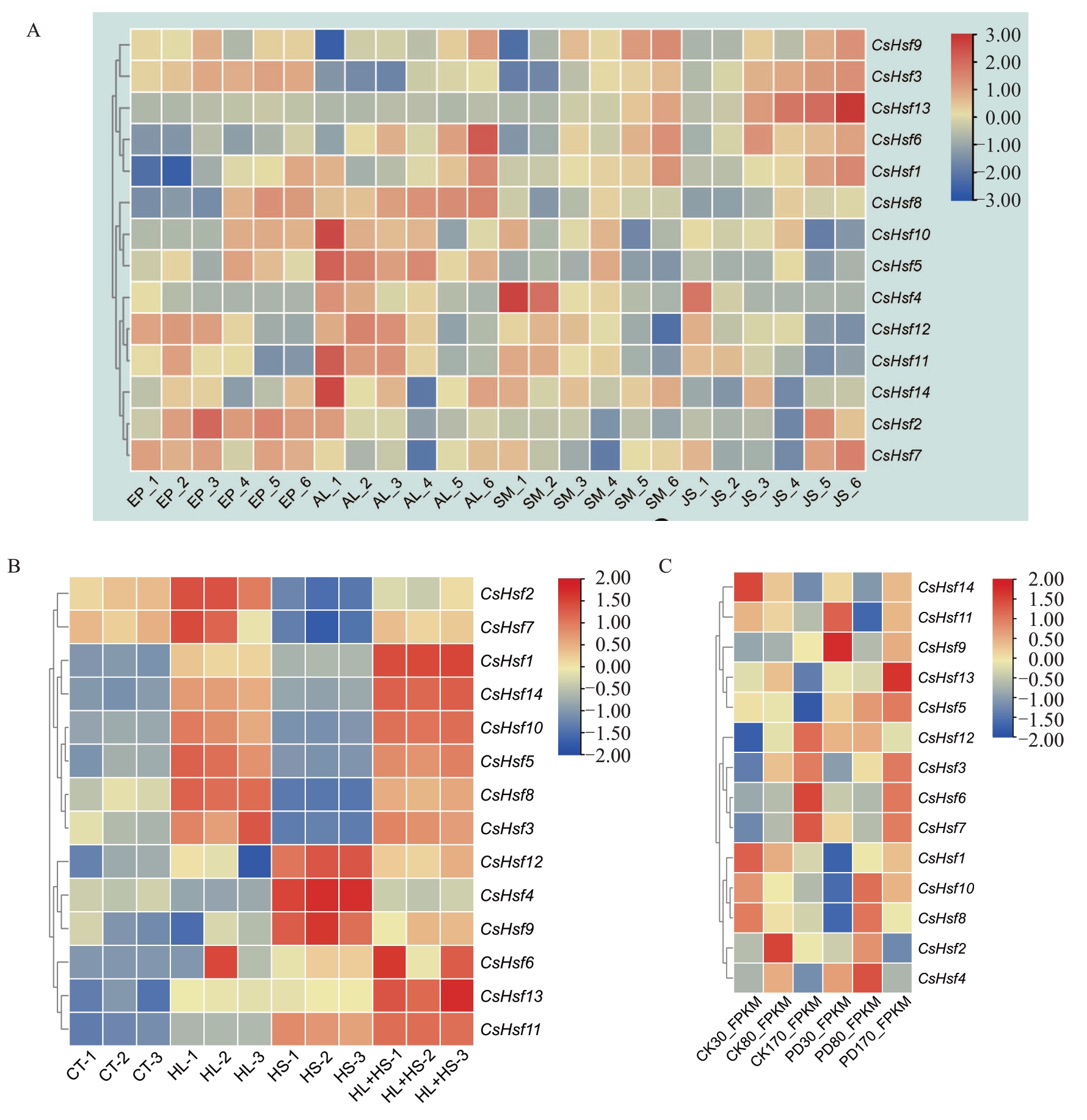
图5 CsHsfs 在不同转录组中的表达模式
Fig.5 Expression patterns of CsHsfs in different transcriptomes
A.CsHsfs 在奉节脐橙果实不同发育时期的组织表达。EP 表示外果皮,AL 表示中果皮,SM 表示囊衣,JS 表示汁胞,数字1~6 分别代表50、80、120、155、180、220 DAF。B.CsHsf 在光热处理柑橘叶片中的表达。CT 表示无处理(CK),HL 表示高光处理,HS 表示高热处理,HL+HS 表示高光高热混合处理。C.CsHsfs 在粗皮大果果皮中的表达,PD 表示粗皮大果,30、80、170 分别代表30、80、170 DAF。
A. Tissue expression of CsHsfs in different developmental stages of Fengjie navel orange fruit. EP represents epicarp,AL represents albedo, SM represents segment membrane, JS represents juice sacs. Numbers 1-6 represent 50, 80, 120, 155, 180, 220 DAF. B. Expression of CsHsfs in citrus leaves under light and heat treatments.CT represents no treatment(CK),HL represents high light treatment,HS represents high heat treatment,HL+HS represents combined high light and heat treatment.C.Expression of CsHsfs in the peel roughing-disordered large fruit.PD represents peel roughing-disordered of satsuma mandarin large fruits,30,80,170 represent 30,80,170 DAF.
2.7 CsHsfs在温州蜜柑日灼果皮中的表达模式
于柑橘果实日灼高发期(8—9月)对田间日灼果实进行监测发现,日灼果实表面温度大幅度升高,造成果皮变黄甚至形成黑色伤斑,从而引起果实日灼面一侧生长受阻,果实形态发生改变;解剖发现日灼果皮褪色深入内部,外皮层部分油胞破裂,果皮水分减少,白皮层松软,絮状化严重,同时观察发现,日灼果皮明显增厚,统计分析得出轻度日灼、重度日灼相较于正常果皮分别增厚了46.12%和52.63%(图6-A~B)。

图6 CsHsfs 在温州蜜柑日灼果皮中的表达模式
Fig.6 Expression pattern of CsHsfs in sunburned peel of Satsuma Mandarin
A.温州蜜柑日灼表型;B.不同程度日灼果皮厚度统计;C.CsHsfs 在温州蜜柑不同果皮织中的表达模式。外果皮和中果皮表达量用虚线隔开分别进行差异显著分析。*不同小写字母表示差异显著(p<0.05)。
A. Sunburn phenotype of satsuma mandarin; B. Statistical analysis of fruit peel thickness under different degrees of sunburn; C. Expression patterns of CsHsfs in different peel tissues of satsuma mandarin.Expression levels in epicarp and albedo are separated by dashed lines for differential significance analysis.*and different small letters indicate significant differences(p<0.05).
为了明确CsHsfs 在温州蜜柑日灼果皮中的表达模式,对不同程度日灼果果皮(外果皮、中果皮)进行qRT-PCR分析。结果显示,多数CsHsfs基因在日灼果皮与正常果皮中存在显著差异表达,其中CsHsf6、CsHsf8、CsHsf11 在外果皮和中果皮中均显著上调表达6 倍以上;CsHsf4 在外果皮和中果皮中显著下调表达超过90%。另外,CsHsf5、CsHsf7、CsHsf10、CsHsf14在中果皮中分别上调表达了12.8、26.2、16.1 和7.8 倍,而CsHsf3 在中果皮中下调表达了92.7%(图6-C)。
2.8 CsHsfs在滑皮金柑热处理果皮中的表达模式
基于CsHsfs在3个转录组中的表达模式,筛选到9 个(CsHsf1/2/5/6/8/10/11/12/13)在柑橘果皮特异性表达或枳橙叶片中高度响应光热诱导的基因,同时基于CsHsfs 在日灼果皮中的表达分析,筛选到7 个(CsHsf1/2/5/6/8/9/11)在日灼果外果皮及中果皮中显著上调表达的基因,二者取交集,最后筛选到CsHsf1/5/6/8/11 五个基因,并分别在常温处理(CK)和热处理(heat stress,HS)0、2、4、6 h 滑皮金柑果皮中进行定量表达分析。结果显示,这5个基因积极响应热胁迫的诱导,其中CsHsf5、CsHsf6、CsHsf11在热处理下均显著上调表达,且CsHsf5 和CsHsf11 都在热处理2 h 表达量达到峰值,之后缓慢下降;而CsHsf1和CsHsf8在热处理下显著下调表达(图7)。

图7 CsHsfs 在滑皮金柑热处理果皮中的表达模式
Fig.7 Expression pattern of CsHsfs in Huapi kumquat peel under heat stress
CK 表示常温无处理,HS 表示45 ℃高温处理。*表示差异显著(p<0.05)。
CK stands for no treatment at room temperature,and HS stands for 45 ℃high temperature treatment.*indicate significant differences(p<0.05).
3 讨 论
日灼在多数作物中都有发生,并严重影响作物的生长和发育,因此在柑橘[32]、苹果[33]、葡萄[34]和番茄[2]等作物中都有相关研究,且被认为是高温和光照共同作用的结果,然而关于日灼分子方面相关研究甚少。Hsf作为非生物胁迫尤其是高温胁迫的重要调节因子极有可能参与日灼的发生。Hsfs广泛存在于所有植物中,目前在芹菜[25]、丹参[35]、菜豆[36]、紫花苜蓿[37]、桃[38]等物种中Hsfs 家族均有报道。然而,关于柑橘属Hsfs家族研究较少,因此本研究首次对柑橘属橙类(甜橙)、宽皮橘类(克里曼丁橘)、柚类(晚白柚)3个物种Hsf 家族进行系统全面地分析,并对其在柑橘果实日灼果皮中的表达模式进行分析。
笔者在本研究中分别从甜橙、克里曼丁橘和晚白柚基因组中鉴定了14、20、16 个Hsf 基因成员,并根据系统发育分析将它们分为HSF A、B、C3 个簇。3 个柑橘属Hsf 家族成员的分布遵循与其他物种相似的模式,与C簇相比,A簇和B簇的Hsfs成员数量更多,此外,3个柑橘种A簇和B簇Hsfs成员数量均较拟南芥少,这表明3 个柑橘属和拟南芥在早期分化后,柑橘Hsfs 成员可能经历了全基因组复制事件[9]。多数物种中Hsfs基因家族扩增主要为片段重复事件[27,39]。在本研究中,3个柑橘属的Hsfs基因家族所有的基因重复事件都来源于片段复制,这似乎意味着片段重复才是Hsfs家族扩张的原因。此外,表达分析发现,具有共线性关系的基因对一般表现出相似的表达模式。例如,CsHsf5/7、CsHsf10/14 分别为甜橙中两组共线性基因对,且这4 个基因均在日灼果皮尤其是中果皮中显著上调表达。在拟南芥中,作为CsHsf5 的同源基因AtHsfA2 能够提高高温胁迫下种子的发芽率并增强其抗氧化能力[40],CsHsf7的同源基因AtHsfC1也提高了拟南芥植株的耐热性[41];而作为CsHsf14和CsHsf10在拟南芥的同源基因AtHsfB2a 和AtHsfB2b 同样被热处理强烈诱导[42],说明柑橘中CsHsf5 和CsHsf7、CsHsf10 和CsHsf14可能发挥着相似的功能。
植物在生长发育过程中,需要整合不同组织或环境信号来调节基因表达,转录起始调控便是其中重要的一环,顺式作用元件作为转录因子特异结合的位点,其重要性不言而喻。柑橘Hsfs 基因启动子上含有多个MeJA 和ABA 响应元件,MeJA 和ABA作为植物重要的信号传导激素,调控植物抵御多种逆境。多数研究证明,Hsfs 参与包括MeJA 和ABA在内的多种信号途径下的非生物胁迫响应[36,43-44],在拟南芥中,ABA 处理显著增强了HsfA6b 的转录活性,且转录激活必须结合其上游启动子上ABRE 元件[20]。外源MeJA 处理多年生黑麦草,显著增强了Hsf-HSPs响应热胁迫的网络调控[45]。作为多种信号通路的关键组成部分[7],Hsf极有可能通过调控HSP或其他胁迫诱导基因的表达,从而在抵御高温等胁迫中发挥重要作用。HSP作为分子伴侣广泛存在于原核和真核生物体内,参与高温、寒冷、干旱、盐胁迫、病原菌侵染等多种非生物胁迫[46-48],当生物体受到环境胁迫时,HSP 基因被诱导表达或其蛋白通过折叠、组装、移位、降解等方式维持细胞内稳态,从而减轻胁迫对生物体的伤害[49-50]。因此,推测当柑橘果实等受到高温等逆境胁迫后,可能通过激活MeJA和ABA信号途径,从而结合Hsfs启动子上的顺式作用元件促进Hsfs的转录,进而诱导下游HSP及抗氧化酶等基因表达,以帮助植株抵御高温等胁迫环境。组织表达谱聚类分析显示,在囊衣和汁胞中主要是A簇成员特异性表达;在枳橙叶片中,单独响应热诱导的也主要为A簇成员,表明CsHsfs家族演化和基因表达聚类具有一定关联性。
CsHsfs在胁迫下的表达模式及组织表达谱很大程度上反映了其基因功能。在萝卜中,8 个RsHSF基因在皮层、形成层和木质部高度表达,推测参与萝卜的生长发育[51]。在本研究中,CsHsf5、CsHsf8、CsHsf11 在奉节脐橙果实果皮组织尤其在中果皮中特异表达,CsHsf5粗皮大果在整个发育时期较正常果均持续上调表达,表明CsHsfs可能参与柑橘果皮的发育。日灼表型显示,温州蜜柑日灼区域果皮黄化甚至褐化,明显是遭受胁迫所致;表达分析也显示多数CsHsfs 在温州蜜柑日灼果皮与热处理的滑皮金柑果皮中都显著上调表达,表明果实日灼受到热因素的影响。在拟南芥中,HsfB1和HsfB2b作为热诱导型抑制因子,其双突变植株相较于野生型表现出更强的耐热性[52];另外,Baniwal 等[53]研究发现AtHsfA5 可通过与AtHsfA4 结合从而抑制其转录活性,可能参与调控病原体感染或由ROS引发的细胞死亡。在本研究中,CsHsf3、CsHsf4 在日灼果中果皮显著下调表达,暗示这2 个基因同样可能作为转录抑制因子参与调控日灼的发生。这些结果都表明Hsf极有可能参与调控柑橘果皮日灼的发生。
笔者在本研究中发现CsHsf5 不仅在柑橘果皮中特异性表达,同时积极响应热胁迫的诱导,并且在温州蜜柑日灼果皮中显著上调表达;在拟南芥中,CsHsf5 同源基因AtHsfA2 因响应多种胁迫(热、盐、渗透胁迫等)被广泛报道[22-23,54]。最新研究发现,热处理后的拟南芥幼苗中不仅果胶甲酯酶活性显著增强,同时伴随着AtHsfA2 和AtHSP22 高度表达[55],表明AtHsfA2积极响应热诱导并且可能参与果胶甲酯酶的合成。因此,推测CsHsf5在柑橘中极有可能发挥类似的功能,即可能在调控果皮发育及缓解日灼/热胁迫中发挥重要作用,下一步将围绕CsHsf5-HSP介导的柑橘高温响应或果皮发育机制进行研究。
4 结 论
笔者在本研究中首先对柑橘属橙类、宽皮柑橘类、柚类的Hsfs 家族成员进行鉴定,分别得到了14个CsHsfs、20 个CcHsfs、16 个CgHsfs 成员,并分为HSF A~C3个簇;其次,柑橘Hsfs 启动子中茉莉酸甲酯响应元件(TGACG-motif、CGTCA-motif)、脱落酸响应元件(ABRE)及干旱诱导响应元件(MBS)分布最为广泛;最后,Hsfs 基因表达分析发现多数CsHsf成员在柑橘果皮中特异性表达,且在日灼果与正常果果皮中显著差异表达;尤其是CsHsf5在多个柑橘组织表达谱及温州蜜柑日灼果皮和热处理金柑果皮中均显著上调表达,推测其可能在抵御柑橘果实日灼发生中有重要作用。
[1] BARBER H N,SHARPE P J H.Genetics and physiology of sunscald of fruits[J].Agricultural Meteorology,1971,8:175-191.
[2] RABINOWITCH H D,KEDAR N,BUDOWSKIP.Induction of sunscald damage in tomatoes under natural and controlled conditions[J].Scientia Horticulturae,1974,2(3):265-272.
[3] LIU C Y,SU Y,LIJ Y,JIA B T,CAO Z,QIN G H.Physiological adjustment of pomegranate pericarp responding to sunburn and its underlying molecular mechanisms[J]. BMC Plant Biology,2022,22(1):169.
[4] GUO M,LIU J H,MA X,LUO D X,GONG Z H,LU M H.The plant heat stress transcription factors (HSFs):Structure,regulation,and function in response to abiotic stresses[J]. Frontiers in Plant Science,2016,7:114.
[5] SCHARF K D,BERBERICH T,EBERSBERGER I,NOVER L.The plant heat stress transcription factor(Hsf)family:Structure,function and evolution[J]. Biochimica et Biophysica Acta(BBA)-Gene Regulatory Mechanisms,2012,1819(2):104-119.
[6] SCHARF K D,ROSE S,ZOTT W,SCHÖFFL F,NOVER L.Three tomato genes code for heat stress transcription factors with a region of remarkable homology to the DNA-binding domain of the yeast HSF[J].EMBO Journal,1990,9(13):4495-4501.
[7] WANG N,LIU W J,YU L,GUO Z W,CHEN Z J,JIANG S H,XU H F,FANG H C,WANG Y C,ZHANG Z Y,CHEN X S.HEAT SHOCK FACTOR A8a modulates flavonoid synthesis and drought tolerance[J].Plant Physiology,2020,184(3):1273-1290.
[8] FRAGKOSTEFANAKIS S,RÖTH S,SCHLEIFF E,SCHARF K D. Prospects of engineering thermotolerance in crops through modulation of heat stress transcription factor and heat shock protein networks[J]. Plant,Cell & Environment,2015,38(9):1881-1895.
[9] WANG X M,SHIX,CHEN S Y,MA C,XU S B. Evolutionary origin,gradual accumulation and functional divergence of Heat shock factor gene family with plant evolution[J]. Frontiers in Plant Science,2018,9:71.
[10] OHAMA N,SATO H,SHINOZAKIK,YAMAGUCHI-SHINOZAKIK. Transcriptional regulatory network of plant heat stress response[J].Trends in Plant Science,2017,22(1):53-65.
[11] AKERFELT M,MORIMOTO R I,SISTONEN L. Heat shock factors:Integrators of cell stress,development and lifespan[J].Nature Reviews.Molecular Cell Biology,2010,11(8):545-555.
[12] CHARNG Y Y,LIU H C,LIU N Y,HSU F C,KO S S.Arabidopsis Hsa32,a novel heat shock protein,is essential for acquired thermotolerance during long recovery after acclimation[J]. Plant Physiology,2006,140(4):1297-1305.
[13] XIE D L,HUANG H M,ZHOU C Y,LIU C X,KANWAR M K,QIZ Y,ZHOU J. HsfA1a confers pollen thermotolerance through upregulating antioxidant capacity,protein repair,and degradation in Solanum lycopersicum L.[J]. Horticulture Research,2022,9:uhac163.
[14] KOTAK S,PORT M,GANGULI A,BICKER F,VON KOSKULL-DÖRING P.Characterization of C-terminal domains of Arabidopsis heat stress transcription factors(Hsfs)and identification of a new signature combination of plant class A Hsfs with AHA and NES motifs essential for activator function and intracellular localization[J].Plant Journal,2004,39(1):98-112.
[15] KOTAK S,VIERLING E,BÄUMLEIN H,VON KOSKULLDÖRING P. A novel transcriptional cascade regulating expression of heat stress proteins during seed development of Arabidopsis[J].The Plant Cell,2007,19(1):182-195.
[16] PRIETO-DAPENAP,ALMOGUERAC,PERSONAT J M,MERCHAN F,JORDANO J. Seed-specific transcription factor HSFA9 links late embryogenesis and early photomorphogenesis[J].Journal of Experimental Botany,2017,68(5):1097-1108.
[17] YE J L,YANG X T,HU G,LIU Q,LIW,ZHANG L L,SONG X Y.Genome-wide investigation of heat shock transcription factor family in wheat (Triticum aestivum L.) and possible roles in anther development[J]. International Journal of Molecular Sciences,2020,21(2):608.
[18] FU J X,HUANG S Y,QIAN J Y,QING H S,WAN Z Y,CHENG H F,ZHANG C. Genome-wide identification of Petunia HSF genes and potential function of PhHSF19 in benzenoid/phenylpropanoid biosynthesis[J].International Journal of Molecular Sciences,2022,23(6):2974.
[19] LIN Q,JIANG Q,LIN J Y,WANG D L,LIS J,LIU C R,SUN C D,CHEN K S. Heat shock transcription factors expression during fruit development and under hot air stress in Ponkan(Citrus reticulata Blanco cv. Ponkan) fruit[J]. Gene,2015,559(2):129-136.
[20] HUANG Y C,NIU C Y,YANG C R,JINN T L.The heat stress factor HSFA6b connects ABA signaling and ABA-mediated heat responses[J].Plant Physiology,2016,172(2):1182-1199.
[21] SCHRAMM F,GANGULIA,KIEHLMANN E,ENGLICH G,WALCH D,VON KOSKULL-DÖRING P. The heat stress transcription factor HsfA2 serves as a regulatory amplifier of a subset of genes in the heat stress response in Arabidopsis[J]. Plant Molecular Biology,2006,60(5):759-772.
[22] NISHIZAWA A,YABUTA Y,YOSHIDA E,MARUTA T,YOSHIMURA K,SHIGEOKA S.Arabidopsis heat shock transcription factor A2 as a key regulator in response to several types of environmental stress[J].Plant Journal,2006,48(4):535-547.
[23] OGAWA D,YAMAGUCHIK,NISHIUCHIT. High-level overexpression of the Arabidopsis HsfA2 gene confers not only increased themotolerance but also salt/osmotic stress tolerance and enhanced callus growth[J].Journal of Experimental Botany,2007,58(12):3373-3383.
[24] PÉREZ-SALAMÓ I,PAPDIC,RIGÓ G,ZSIGMOND L,VILELA B,LUMBRERAS V,NAGY I,HORVÁTH B,DOMOKIM,DARULA Z,MEDZIHRADSZKY K,BÖGRE L,KONCZ C,SZABADOS L. The heat shock factor A4A confers salt tolerance and is regulated by oxidative stress and the mitogen-activated protein kinases MPK3 and MPK6[J].Plant Physiology,2014,165(1):319-334.
[25] LIM Y,ZHANG R,ZHOU J,DU J G,LIX Y,ZHANG Y,CHEN Q,WANG Y,LIN Y X,ZHANG Y T,HE W,WANG X R,XIONG A S,LUO Y,TANG H R. Comprehensive analysis of HSF genes from celery (Apium graveolens L.) and functional characterization of AgHSFa6-1 in response to heat stress[J].Frontiers in Plant Science,2023,14:1132307.
[26] XIANG J H,RAN J,ZOU J,ZHOU X Y,LIU A L,ZHANG X W,PENG Y,TANG N,LUO G Y,CHEN X B. Heat shock factor OsHsfB2b negatively regulates drought and salt tolerance in rice[J].Plant Cell Reports,2013,32(11):1795-1806.
[27] LING C C,LIU Y Y,YANG Z C,XU J L,OUYANG Z Y,YANG J,WANG S H.Genome-wide identification of HSF gene family in kiwifruit and the function of AeHSFA2b in salt tolerance[J]. International Journal of Molecular Sciences,2023,24(21):15638.
[28] CHEN C J,CHEN H,ZHANG Y,THOMAS H R,FRANK M H,HE Y H,XIA R. TBtools:An integrative toolkit developed for interactive analyses of big biological data[J]. Molecular Plant,2020,13(8):1194-1202.
[29] FENG G Z,WU J X,XU Y H,LU L Q,YIH L.High-spatiotemporal-resolution transcriptomes provide insights into fruit development and ripening in Citrus sinensis[J]. Plant Biotechnology Journal,2021,19(7):1337-1353.
[30] BALFAGÓN D,ZANDALINAS S I,DOS REIS DE OLIVEIRA T,SANTA-CATARINA C,GÓMEZ-CADENAS A. Reduction of heat stress pressure and activation of photosystem IIrepairing system are crucial for Citrus tolerance to multiple abiotic stress combination[J].Physiologia Plantarum,2022,174(6):e13809.
[31] 李菲菲,廉雪菲,尹韬,常媛媛,金燕,马小川,陈岳文,叶丽,李云松,卢晓鹏.柑橘果实囊衣发育与化渣性的形成[J].中国农业科学,2023,56(2):333-344.LIFeifei,LIAN Xuefei,YIN Tao,CHANG Yuanyuan,JIN Yan,MA Xiaochuan,CHEN Yuewen,YE Li,LIYunsong,LU Xiaopeng. The relationship between mastication and development of segment membranes in Citrus fruits[J].Scientia Agricultura Sinica,2023,56(2):333-344.
[32] KIM M,PARK Y,YUN S K,KIM S S,JOA J,MOON Y E,DO G R. The anatomical differences and physiological responses of sunburned Satsuma mandarin (Citrus unshiu Marc.) fruits[J].Plants,2022,11(14):1801.
[33] MORALES-QUINTANA L,WAITE J M,KALCSITS L,TORRES C A,RAMOS P. Sun injury on apple fruit:Physiological,biochemical and molecular advances,and future challenges[J].Scientia Horticulturae,2020,260:108866.
[34] GAMBETTA J M,HOLZAPFEL B P,STOLL M,FRIEDEL M.Sunburn in grapes:A review[J]. Frontiers in Plant Science,2020,11:604691.
[35] QU R J,WANG S W,WANG X X,PENG J M,GUO J,CUIG H,CHEN M L,MU J,LAIC,HUANG L Q,WANG S,SHEN Y. Genome-wide characterization and expression of the Hsf gene family in Salvia miltiorrhiza (Danshen) and the potential thermotolerance of SmHsf1 and SmHsf7 in yeast[J]. International Journal of Molecular Sciences,2023,24(10):8461.
[36] ZHANG Q,GENG J,DU Y L,ZHAO Q,ZHANG W J,FANG Q X,YIN Z G,LIJ H,YUAN X K,FAN Y R,CHENG X,DU J D. Heat shock transcription factor (Hsf) gene family in common bean (Phaseolus vulgaris):Genome-wide identification,phylogeny,evolutionary expansion and expression analyses at the sprout stage under abiotic stress[J]. BMC Plant Biology,2022,22(1):33.
[37] MA J,ZHANG G Z,YE Y C,SHANG L X,HONG S D,MA Q Q,ZHAO Y,GU C H. Genome-wide identification and expression analysis of HSF transcription factors in alfalfa (Medicago sativa)under abiotic stress[J].Plants,2022,11(20):2763.
[38] TAN B,YAN L,LIH N,LIAN X D,CHENG J,WANG W,ZHENG X B,WANG X B,LIJ D,YE X,ZHANG L L,LIZ Q,FENG J C. Genome-wide identification of HSF family in peach and functional analysis of PpHSF5 involvement in root and aerial organ development[J].PeerJ,2021,9:e10961.
[39] LIU M Y,HUANG Q,SUN W J,MA Z T,HUANG L,WU Q,TANG Z Z,BU T L,LIC L,CHEN H.Genome-wide investigation of the heat shock transcription factor (Hsf) gene family in Tartary buckwheat(Fagopyrum tataricum)[J].BMC Genomics,2019,20(1):871.
[40] PAN C L,ZHOU Y Y,YAO L X,YU L Y,QIAO Z,TANG M Q,WEIF. Amomum tsaoko DRM1 regulate seed germination and improve heat tolerance in Arabidopsis[J]. Journal of Plant Physiology,2023,286:154007.
[41] GUAN Q M,YUE X L,ZENG H T,ZHU J H.The protein phosphatase RCF2 and its interacting partner NAC019 are critical for heat stress-responsive gene regulation and thermotolerance in Arabidopsis[J].The Plant Cell,2014,26(1):438-453.
[42] 大濱直彦,吉田拓実,溝井順哉,篠崎一雄,篠崎和子.シロイヌナズナの高温ストレス応答における転写因子HSFBの機能解析[C].日本植物生理学会年会およびシンポジウム,講演要旨集,2011:0815.OHAMA N,YOSHIDA T,MIZOIJ,SHINOZAKIK,SHINOZAKIK. Functional analysis of B-class heat shock transcription factors in Arabidopsis[C]. Plant and Cell Physiology Supplement,2011:0815.
[43] YU X X,ZHANG W J,ZHANG Y,ZHANG X J,LANG D Y,ZHANG X H. The roles of methyl jasmonate to stress in plants[J].Functional Plant Biology,2019,46(3):197-212.
[44] HONG J H,SEAH S W,XU J.The root of ABA action in environmental stress response[J]. Plant Cell Reports,2013,32(7):971-983.
[45] NIE G,ZHOU J,JIANG Y W,HE J,WANG Y,LIAO Z C,APPIAH C,LID D,FENG G Y,HUANG L K,WANG X,ZHANG X Q. Transcriptome characterization of candidate genes for heat tolerance in perennial ryegrass after exogenous methyl Jasmonate application[J].BMC Plant Biology,2022,22(1):68.
[46] YANG M L,ZHANG Y X,ZHANG H H,WANG H B,WEIT,CHE S Y,ZHANG L P,HU B Q,LONG H,SONG W Q,YU W W,YAN G R. Identification of MsHsp20 gene family in Malus sieversii and functional characterization of MsHsp16.9 in heat tolerance[J].Frontiers in Plant Science,2017,8:1761.
[47] KIM J H,LIM S D,JANG C S. Oryza sativa heat-induced RING finger protein 1 (OsHIRP1) positively regulates plant response to heat stress[J]. Plant Molecular Biology,2019,99(6):545-559.
[48] ALSHAMERIA,AL-QURAINY F,GAAFAR A R,KHAN S,NADEEM M,ALANSIS. Identification of heat- responsive genes in guar [Cyamopsis tetragonoloba (L.) Taub.][J]. International Journal of Genomics,2020,2020:3126592.
[49] JACOB P,HIRT H,BENDAHMANE A.The heat-shock protein/chaperone network and multiple stress resistance[J]. Plant Biotechnology Journal,2017,15(4):405-414.
[50] PARK C J,SEO Y S. Heat shock proteins:A review of the molecular chaperones for plant immunity[J]. Plant Pathology Journal,2015,31(4):323-333.
[51] TANG M J,XU L,WANG Y,CHENG W W,LUO X B,XIE Y,FAN L X,LIU L W. Genome-wide characterization and evolutionary analysis of heat shock transcription factors (HSFs) to reveal their potential role under abiotic stresses in radish (Raphanus sativus L.)[J].BMC Genomics,2019,20(1):772.
[52] IKEDA M,MITSUDA N,OHME-TAKAGIM.Arabidopsis HsfB1 and HsfB2b act as repressors of the expression of heat-inducible Hsfs but positively regulate the acquired thermotolerance[J].Plant Physiology,2011,157(3):1243-1254.
[53] BANIWAL S K,CHAN K Y,SCHARF K D,NOVER L. Role of heat stress transcription factor HsfA5 as specific repressor of HsfA4[J]. Journal of Biological Chemistry,2007,282(6):3605-3613.
[54] LIN K F,TSAIM Y,LU C G,WU S J,YEH C H.The roles of Arabidopsis HSFA2,HSFA4a,and HSFA7a in the heat shock response and cytosolic protein response[J]. Botanical Studies,2018,59(1):15.
[55] PINEDA- HERNÁNDEZ E,CRUZ- VALDERRAMA J E,GÓMEZ-MAQUEO X,MARTÍNEZ-BARAJAS E,GAMBOADEBUEN A. BIIDXI,a DUF642 cell wall protein that regulates pectin methyl esterase activity,is involved in thermotolerance processes in Arabidopsis thaliana[J].Plants,2022,11(22):3049.