猕猴桃(Actinidia chinensis Planch.)因具有丰富的营养和独特的风味而深受消费者的青睐,已成为世界范围内重要的经济作物[1-4]。随着猕猴桃产业的快速发展,猕猴桃软腐病已成为制约产业发展的重要因素,在贮藏、运输、销售和货架期造成大量果实腐烂,病果率为20%~50%[5-6],降低果实的贮藏品质并缩短贮藏时间,对果农和产业造成严重损失[7]。
软腐病是一种真菌性病害,又称熟腐病和褐腐病,其主要致病菌为葡萄座腔菌(Botryosphaeria dothidea)[8-12]。一般在果实后熟期显现症状,病斑圆形或椭圆形,褐色,病健交界处呈暗绿色水渍状环形晕圈,病部表面无明显凹陷。从出现水渍状褐色小圆斑至全果软腐一般约3 d,病害极易在密闭空间内迅速传播,甚至一个病果可引起整箱果实快速变软甚至腐烂,并挥发出难闻的酸臭味,影响果实的品质[8,13]。此外,大量看似健康的果实去皮后也有腐烂现象[14],因此猕猴桃软腐病对果农和生产造成的损失往往被低估。
目前在猕猴桃软腐病的防治措施中,化学防治仍然为首选,生产上广泛使用的药剂有甲基硫菌灵、苯醚甲环唑等[15-16],以生长期田间喷施为主。针对猕猴桃软腐病防治药剂的报道不多,胡容平等[17]、吴文能等[18]通过室内毒力测定,发现咪鲜胺、苯醚甲环唑、丙环唑对猕猴桃软腐病菌的抑制效果较好,但未进一步开展田间试验验证;莫飞旭等[19]通过田间试验发现,四霉素与戊唑醇复配后在生长期施用对采后猕猴桃软腐病有较好的预防效果,但未与其他药剂进行对比;对贮藏期病害的防治,一般选择在贮藏前对果实进行浸药处理,该措施已广泛应用且效果显著[20-23],但针对猕猴桃软腐病在贮藏前浸药鲜有报道。
B.dothidea寄主范围广,可危害苹果、梨、蓝莓、猕猴桃等多种重要的经济作物[9,24-26]。前人针对B.dothidea 已筛选出嘧菌酯、戊唑醇、吡唑醚菌酯、咯菌睛、咪鲜胺等低毒、低残留杀菌剂。其中,嘧菌酯对葡萄溃疡病菌(B.dothidea)有显著的抑制作用且田间防效较好[27],戊唑醇、吡唑醚菌酯、氟硅唑已用于防治苹果轮纹病菌(B.dothidea)[28-30]。咯菌睛、咪鲜胺对梨轮纹病菌(B.dothidea)的菌丝生长也有很强的抑制作用[31]。氟硅唑、吡唑醚菌酯对杧果蒂腐病病原菌(B.dothidea)的生长有较好的抑制作用[32]。但用于猕猴桃软腐病的生长期及贮藏期防治的药剂鲜有报道,由于缺乏科学的用药指导,导致防效不佳,乱用、滥用农药的现象极普遍。为此,本文针对猕猴桃软腐病,通过室内高效药剂筛选,结合生长期和贮藏期的药效试验,旨在筛选出高效、低毒、低残留杀菌剂用于该病害的防治。
1 材料和方法
1.1 试验材料
供试原药(毒力测定):95%戊唑醇、97%咪鲜胺、98%氟啶胺、97.5%吡唑醚菌酯、95%氟硅唑、93%丙环唑、75%抑霉唑硫酸盐,均由四川农业大学无公害农药实验室提供。
供试杀菌剂(药效试验):具体名称、剂型、施药浓度及生产厂家见表1。施药浓度采用厂家推荐的最佳浓度。
表1 供试杀菌剂概况
Table 1 Information on the fungicides that were used in this study
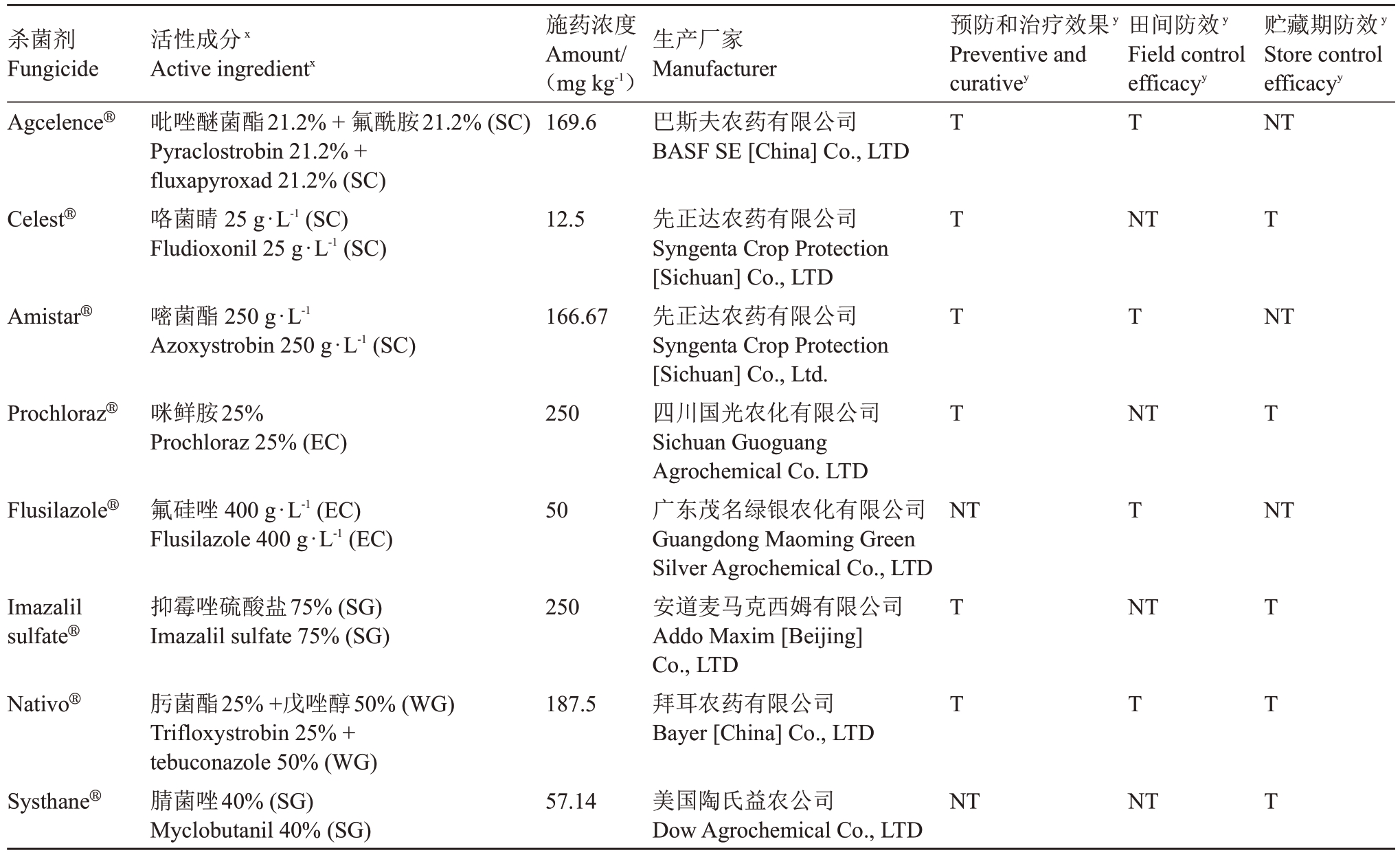
注:x 括号内的值表示配制的类型:SC=悬浮剂;EC=乳油;WG=水分散粒剂;SG=可湿性粉剂。yT 表示进行了测试,NT 表示未测试。
Note:x Values in parentheses indicate the formulated type:SC=suspension concentrate;EC=emulsifiable concentrate;WG=water-dispersible granule;SG=soluble granule agent.y T indicates testing was conducted,NT indicates untested.
杀菌剂Fungicide Agcelence®施药浓度Amount/(mg kg-1)169.6生产厂家Manufacturer巴斯夫农药有限公司BASF SE[China]Co.,LTD预防和治疗效果y Preventive and curativey田间防效y Field control efficacyy T贮藏期防效y Store control efficacyy NT Celest®活性成分x Active ingredientx吡唑醚菌酯21.2%+氟酰胺21.2%(SC)Pyraclostrobin 21.2%+fluxapyroxad 21.2%(SC)咯菌睛25 g·L-1(SC)Fludioxonil 25 g·L-1(SC)12.5 NT T Amistar®嘧菌酯250 g·L-1 Azoxystrobin 250 g·L-1(SC)166.67 T NT Prochloraz®咪鲜胺25%Prochloraz 25%(EC)250 NT T Flusilazole®氟硅唑400 g·L-1(EC)Flusilazole 400 g·L-1(EC)50 T T T T N T NT Imazalil sulfate®抑霉唑硫酸盐75%(SG)Imazalil sulfate 75%(SG)250 NT Nativo®187.5先正达农药有限公司Syngenta Crop Protection[Sichuan]Co.,LTD先正达农药有限公司Syngenta Crop Protection[Sichuan]Co.,Ltd.四川国光农化有限公司Sichuan Guoguang Agrochemical Co.LTD广东茂名绿银农化有限公司Guangdong Maoming Green Silver Agrochemical Co.,LTD安道麦马克西姆有限公司Addo Maxim[Beijing]Co.,LTD拜耳农药有限公司Bayer[China]Co.,LTD T Systhane®肟菌酯25%+戊唑醇50%(WG)Trifloxystrobin 25%+tebuconazole 50%(WG)腈菌唑40%(SG)Myclobutanil 40%(SG)57.14美国陶氏益农公司Dow Agrochemical Co.,LTD T T T NT NT T T T
供试菌株:猕猴桃软腐病原菌B.dothidea(菌株编号为ZC56),对猕猴桃果实具有强致病性,分离自四川省都江堰市胥家镇猕猴桃产区。
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂粉10 g,水1 L。
试验地位于四川农业大学现代农业研发基地,4年生红阳猕猴桃果园(地理坐标30°56′26″ N,103°65′16″E),平均海拔为538 m,属四川盆地亚热带湿润季风气候,年平均气温为15.9 ℃,年降水量达973.5 mm,雨热同期。供试果园土壤类型为壤土,地势平坦、肥力均匀。
供试品种:选用四川省猕猴桃主产区大面积种植的红阳品种,易感猕猴桃软腐病。
1.2 方法
1.2.1 室内毒力测定 采用菌丝生长速率法进行供试药剂的室内毒力测定。将7 种原药分别溶于丙酮,配置成10 g·L-1母药备用(现配现用)。用0.05%吐温80 的无菌水将7 种原药母液按下列梯度进行稀释,其中戊唑醇、咪鲜胺、氟啶胺、丙环唑和抑霉唑硫酸盐的质量浓度梯度均为50、25、12.5、6.25、3.175 μg·mL-1,吡唑醚菌酯的浓度梯度为200、100、50、25、12.5 μg·mL-1,氟硅唑的浓度梯度为100、50、25、12.5、6.25 μg·mL-1。以无菌吐温水中加入相同体积丙酮处理作为空白对照。将不同浓度的7种原药母液加入45 ℃的PDA培养基中(PDA培养基∶原药=9∶1,体积比),制备成含药PDA培养基。其中戊唑醇、咪鲜胺、氟啶胺、丙环唑和抑霉唑硫酸盐的浓度梯度均为5、2.5、1.25、0.625、0.317 5 μg·mL-1,吡唑醚菌酯的浓度梯度为20、10、5、2.5、1.25 μg·mL-1,氟硅唑的浓度梯度为10、5、2.5、1.25、0.625 μg·mL-1。
将猕猴桃软腐病菌菌株ZC56用PDA培养基暗培养(25 ℃)约7 d,用打孔器在菌落边缘等距离切取直径5 mm的菌饼。将菌饼接种于不同浓度的含药PDA培养基和对照培养基上,每个处理3次重复,置于25 ℃恒温培养箱中暗培养,7 d后采用“十字交叉法”测量菌落直径,并按照下式计算菌丝生长抑制率。

运用SPSS 19.0软件对数据进行分析,以药剂质量浓度的对数值为横坐标、抑制率对应的概率值为纵坐标进行作图,得到毒力回归方程及有效抑制中浓度(EC50)值。
1.2.2 离体防效评价 取健康的红阳猕猴桃用75%乙醇浸泡10 min 后置于超净工作台中紫外杀菌晾干,并标记接种点,备用。选用6 种杀菌剂,以无菌水为空白对照,分预防与治疗效果测定两组,共14个处理,每个处理3次重复,每个重复15个果实。预防效果测定:先将药剂喷施于果实表面,晾干后分别于24 h和72 h接种5 mm的菌饼;治疗效果测定:先将5 mm菌饼接种在果实表面,保湿培养24 h和72 h后再喷施药剂。所有果实在25 ℃和相对湿度85%条件下贮藏,待果实软化后测定病菌侵染直径,按下式计算防效[33]。
1.2.3 生长期田间药效试验(1)试验设计。采取随机区组进行田间试验,试验田四周设保护行。根据前期药剂筛选结果选用氟硅唑、唑醚·氟酰胺、嘧菌酯、肟菌酯·戊唑醇4 种杀菌剂,以清水为空白对照,共5个处理,每个处理3个重复小区,每个小区5株树。分别于2020年4月20日(谢花后)、5月20日(幼果期)、6 月24 日(果实膨大期)、7 月24 日(采前30 d)喷施药剂。
(2)试验调查。至果实成熟时,每株树随机采收30 个果子,每个处理共计450 个果实,置于25 ℃恒温贮存。待果实软熟后调查果实发病率及病害严重程度,统计果实发病情况,计算病情指数、发病率及防治效果[34],病害严重程度分级标准见表2。

表2 猕猴桃软腐病病害严重程度分级标准
Table 2 Grading standard for severity of kiwifruit soft rot
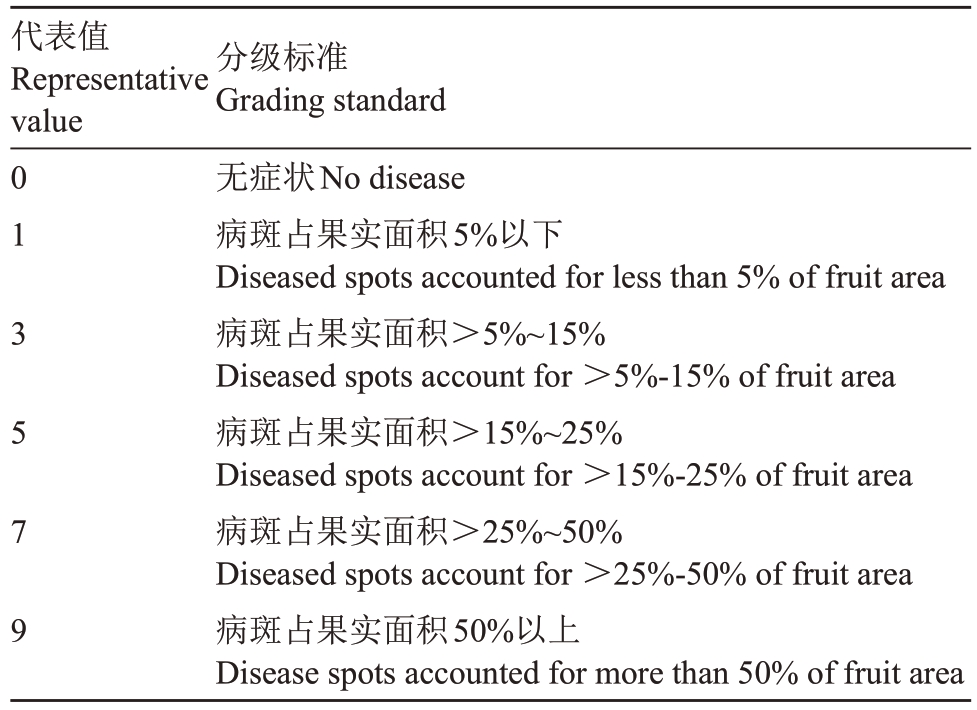
代表值Representative value 0 1 3 5 7 9分级标准Grading standard无症状No disease病斑占果实面积5%以下Diseased spots accounted for less than 5%of fruit area病斑占果实面积>5%~15%Diseased spots account for >5%-15%of fruit area病斑占果实面积>15%~25%Diseased spots account for >15%-25%of fruit area病斑占果实面积>25%~50%Diseased spots account for >25%-50%of fruit area病斑占果实面积50%以上Disease spots accounted for more than 50%of fruit area
1.2.4 贮藏期药效试验(1)试验设计。果实采收后,除去病、虫、机械伤果,根据前期药剂筛选结果并参考生产常用药剂选用肟菌酯·戊唑醇、咪鲜胺、咯菌睛、抑霉唑硫酸盐、腈菌唑5 种杀菌剂,施药浓度采用厂家推荐的最佳浓度,以清水为对照,共6个处理,每个处理3次重复,每个重复100个果实。将果实放入各药液或清水中均匀浸果1 min,随后捞起晾干,入库贮藏。冻库温度为(1.5±0.5)℃,湿度为93%±0.5%。贮藏90d后调查果实发病情况,计算果实发病率及病情指数(分级标准见表2)。
(2)数据分析。使用SPSS 19.0软件对数据进行分析。在田间生长期和贮藏期药效试验中,均采用单因素方差分析(ANOVA)和双尾检验比较不同组间的差异显著性水平。所有的统计细节可以在表及图例中找到。
(3)安全性评价。入库贮藏90 d后,取清水处理和防治效果最佳处理的猕猴桃样品,送至诺安实力可商品检验(青岛)有限公司进行单个农药定量分析检测,基于EQuEChERS 方法建立戊唑醇、肟菌酯、咪鲜胺、吡唑醚菌酯残留的提取和纯化步骤,然后使用高效气相色谱-质谱法(GC-MS)对戊唑醇进行定量检测,使用高效液相色谱-质谱法(LC-MS)对肟菌酯和咪鲜胺进行定量检测。依据《食品安全国家标准食品中农药最大残留限量》GB 2763—2021[35]规定的最大残留限量,对本次试验中的杀菌剂进行残留安全性评价。
2 结果与分析
2.1 不同药剂对猕猴桃软腐病菌的室内毒力测定
由表3 和图1 可知,在浓度测试范围内,8 种药剂均在一定程度上抑制猕猴桃软腐病菌菌丝的生长,但毒力存在明显差异。97%咪鲜胺毒力最强,EC50 值仅为0.134 9 μg·mL-1,其次是98%氟啶胺、95%戊唑醇、75%抑霉唑硫酸盐、95%氟硅唑、96%嘧菌酯、93%丙环唑效果较好,EC50 分别为0.180 1、0.240 9、0.261 3、0.326 1、0.638 1、0.781 9 μg·mL-1,EC50值均小于0.80 μg·mL-1;97.5%吡唑醚菌酯虽然对病原菌生长有一定的抑制作用,但抑制效果相对较差,EC50为9.998 7 μg·mL-1,毒力最低。
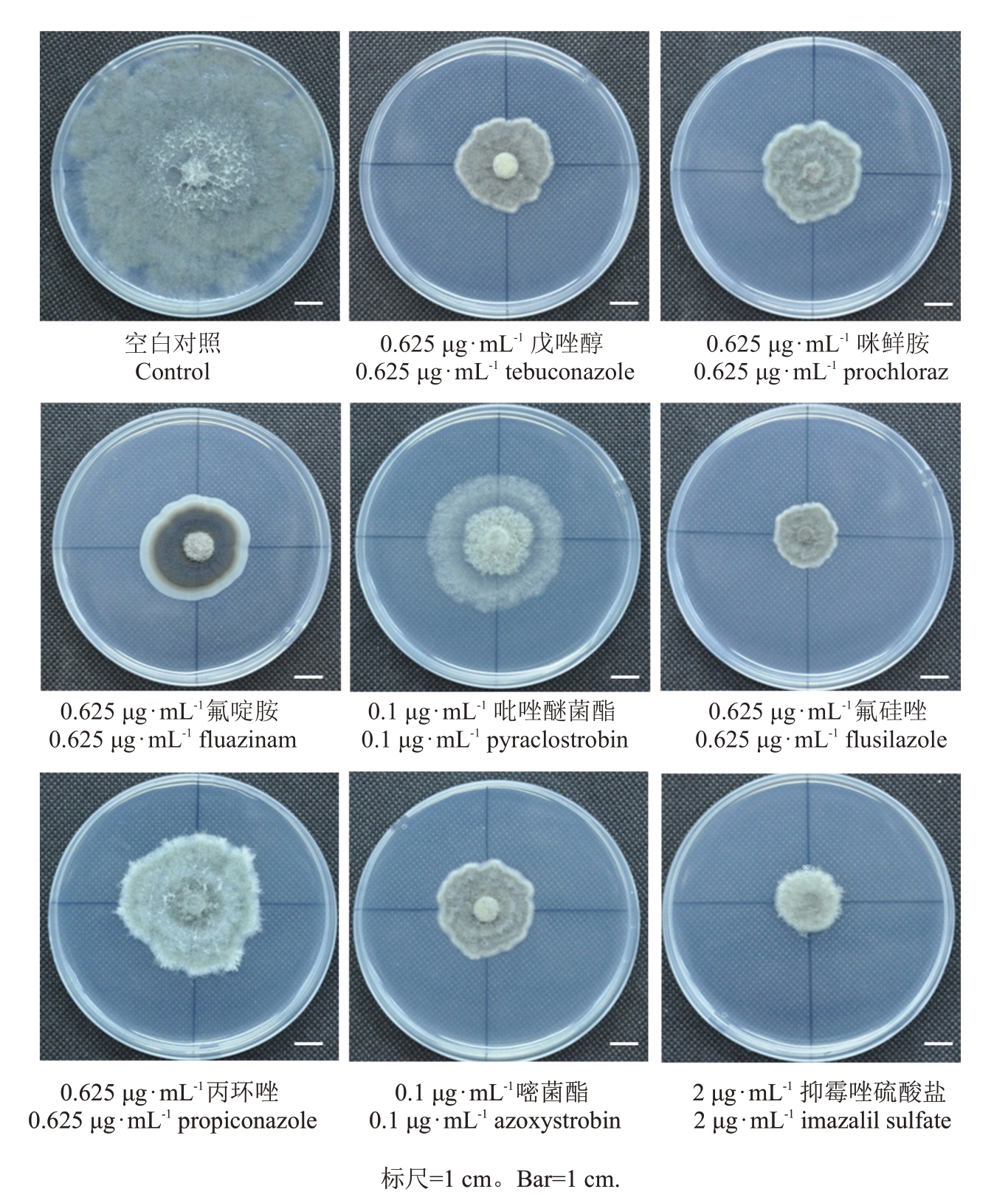
图1 不同质量浓度的8 种杀菌剂对葡萄座腔菌(B.dothidea)菌丝生长的抑制作用
Fig.1 Inhibitory activities of different concentrations of fungicides against mycelial growth of B.dothidea
表3 8 种药剂对猕猴桃软腐病菌菌丝生长的抑制作用
Table 3 Inhibitory activities of eight fungicides against mycelial growth of B.dothidea
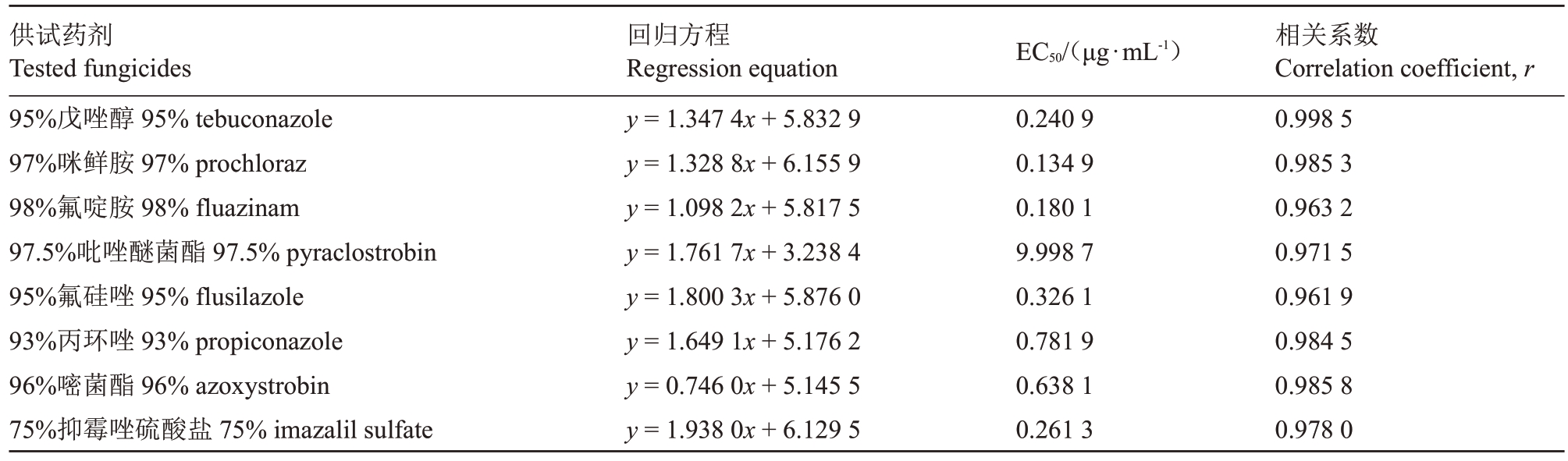
供试药剂Tested fungicides 95%戊唑醇95%tebuconazole 97%咪鲜胺97%prochloraz 98%氟啶胺98%fluazinam 97.5%吡唑醚菌酯97.5%pyraclostrobin 95%氟硅唑95%flusilazole 93%丙环唑93%propiconazole 96%嘧菌酯96%azoxystrobin 75%抑霉唑硫酸盐75%imazalil sulfate回归方程Regression equation y=1.347 4x+5.832 9 y=1.328 8x+6.155 9 y=1.098 2x+5.817 5 y=1.761 7x+3.238 4 y=1.800 3x+5.876 0 y=1.649 1x+5.176 2 y=0.746 0x+5.145 5 y=1.938 0x+6.129 5 EC50/(μg·mL-1)0.240 9 0.134 9 0.180 1 9.998 7 0.326 1 0.781 9 0.638 1 0.261 3相关系数Correlation coefficient,r 0.998 5 0.985 3 0.963 2 0.971 5 0.961 9 0.984 5 0.985 8 0.978 0
2.2 离体防效评价
2.2.1 不同药剂对猕猴桃软腐病的预防效果评价由表4和图2可知,6种杀菌剂对猕猴桃软腐病的预防效果不一,防效由强到弱依次为75%肟菌酯·戊唑醇WG>25 g·L-1 咯菌睛SC>42.4%唑醚·氟酰胺SC>25%咪鲜胺EC>75%抑霉唑硫酸盐SG>250 g·L-1嘧菌酯SC;其中75%肟菌酯·戊唑醇WG对葡萄座腔菌(B.dothidea)的预防效果最好,在喷药后24 h、72 h 接种病原菌,防效分别为78.15%和70.65%,25 g·L-1 咯菌睛SC 对葡萄座腔菌(B.dothidea)的预防效果较好,在喷药后24 h、72 h接种病原菌,防效分别为71.98%和68.36%;250 g·L-1嘧菌酯SC预防效果最差,防效分别为46.17%、35.61%。
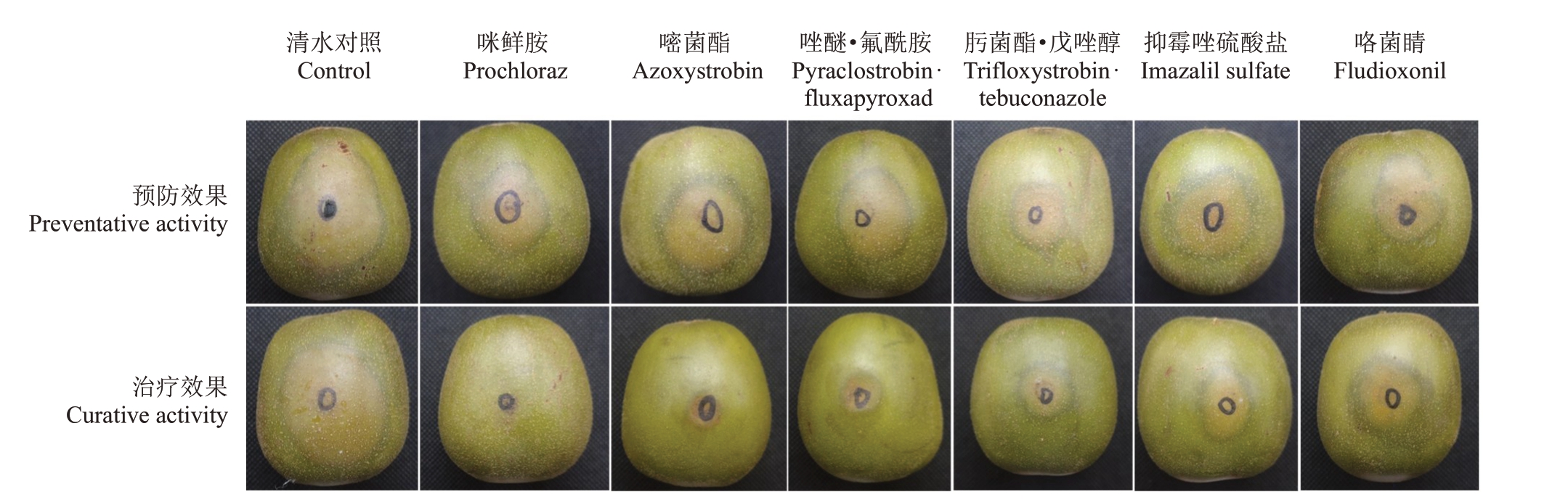
图2 猕猴桃软腐病预防效果(喷药72 h 后接种)和治疗效果(接种72 h 后喷药)的病斑扩展情况
Fig.2 Representative soft rot lesion development in preventive(applied 72 h pre-inoculation)and curative(applied 72 h postinoculation)treatments
表4 6 种杀菌剂在离体果实上对葡萄座腔菌(B.dothidea)的预防效果
Table 4 The preventive effects of six fungicides in fruits with B.dothidea
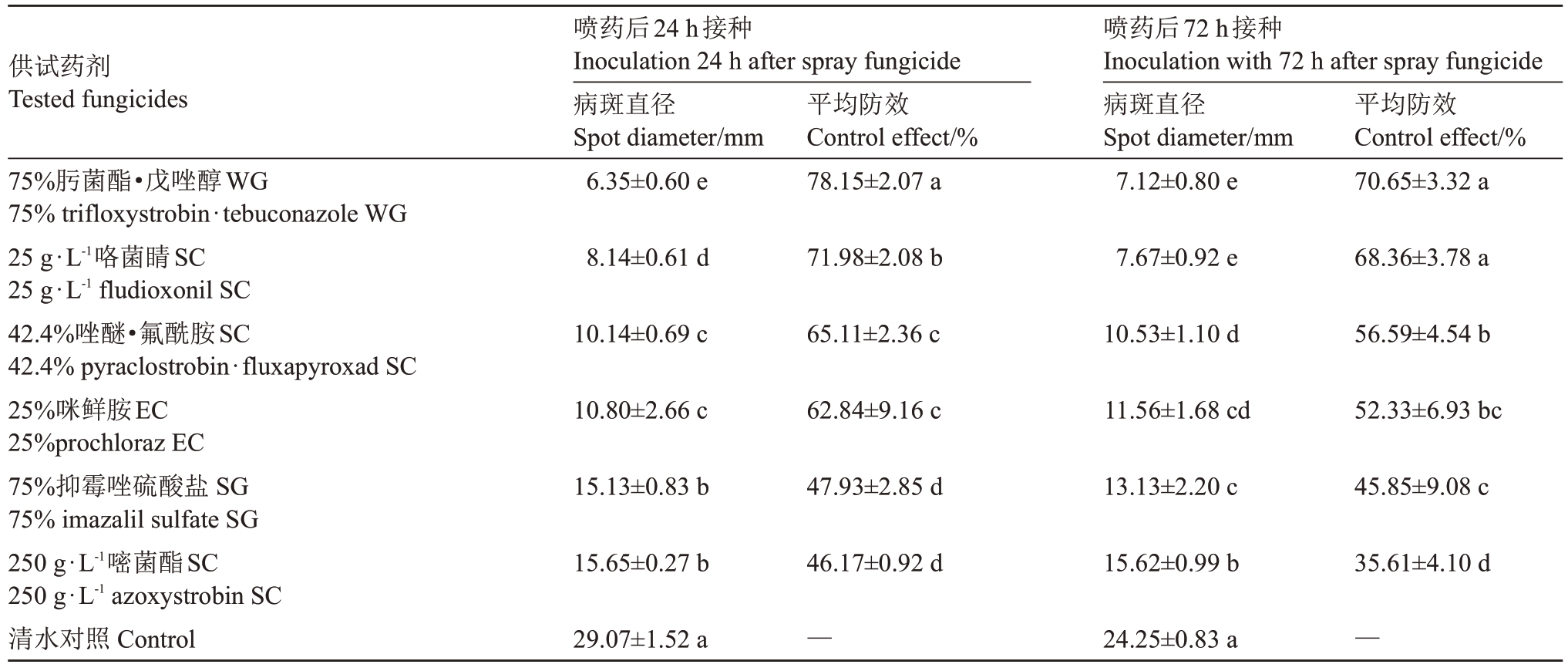
注:每个值为平均值±标准差,平均值包括3 次生物独立的重复。同一列不同字母表示以p<0.05 为差异有统计学意义(采用单因素方差分析和最小显著差异法LSD 检验进行多重比较)。下同。
Note: Each value is mean ± SD and the average include three biologically independent replicates.Different letters indicate significant differences at p<0.05 in the same column(one-way ANOVA followed by two-sided least significant difference(LSD)test for multiple-comparisons).The same below.
供试药剂Tested fungicides 75%肟菌酯·戊唑醇WG 75%trifloxystrobin·tebuconazole WG 25 g·L-1咯菌睛SC 25 g·L-1 fludioxonil SC 42.4%唑醚·氟酰胺SC 42.4%pyraclostrobin·fluxapyroxad SC 25%咪鲜胺EC 25%prochloraz EC 75%抑霉唑硫酸盐SG 75%imazalil sulfate SG 2 2 5 5 0 0 g g··L L--11 嘧a z菌ox酯yst S roC bin SC清水对照Control喷药后24 h接种Inoculation 24 h after spray fungicide病斑直径Spot diameter/mm 6.35±0.60 e平均防效Control effect/%78.15±2.07 a喷药后72 h接种Inoculation with 72 h after spray fungicide病斑直径Spot diameter/mm 7.12±0.80 e平均防效Control effect/%70.65±3.32 a 8.14±0.61 d 71.98±2.08 b 7.67±0.92 e 68.36±3.78 a 10.14±0.69 c 65.11±2.36 c 10.53±1.10 d 56.59±4.54 b 10.80±2.66 c 62.84±9.16 c 11.56±1.68 cd 52.33±6.93 bc 15.13±0.83 b 47.93±2.85 d 13.13±2.20 c 45.85±9.08 c 15.65±0.27 b 46.17±0.92 d 15.62±0.99 b 35.61±4.10 d 29.07±1.52 a —24.25±0.83 a —
2.2.2 不同药剂对猕猴桃软腐病的治疗效果评价由表5和图2可知,6种杀菌剂对猕猴桃软腐病均有一定的治疗效果,接种72 h 后,25%咪鲜胺EC 和250 g·L-1嘧菌酯SC效果显著(p<0.05)高于其他药剂,防效由强到弱依次为25%咪鲜胺EC>250 g·L-1嘧菌酯SC>42.4%唑醚·氟酰胺SC;其中25%咪鲜胺EC对葡萄座腔菌(B.dothidea)的治疗效果最好,在接种病原菌24 h、72 h 后喷药,防效分别为89.38%、84.24%;25 g·L-1咯菌睛SC 治疗效果最差,防效分别为52.30%、45.33%。
表5 6 种杀菌剂在离体果实上对葡萄座腔菌(B.dothidea)的治疗效果
Table 5 The curative effects of six fungicides in fruits with B.dothidea
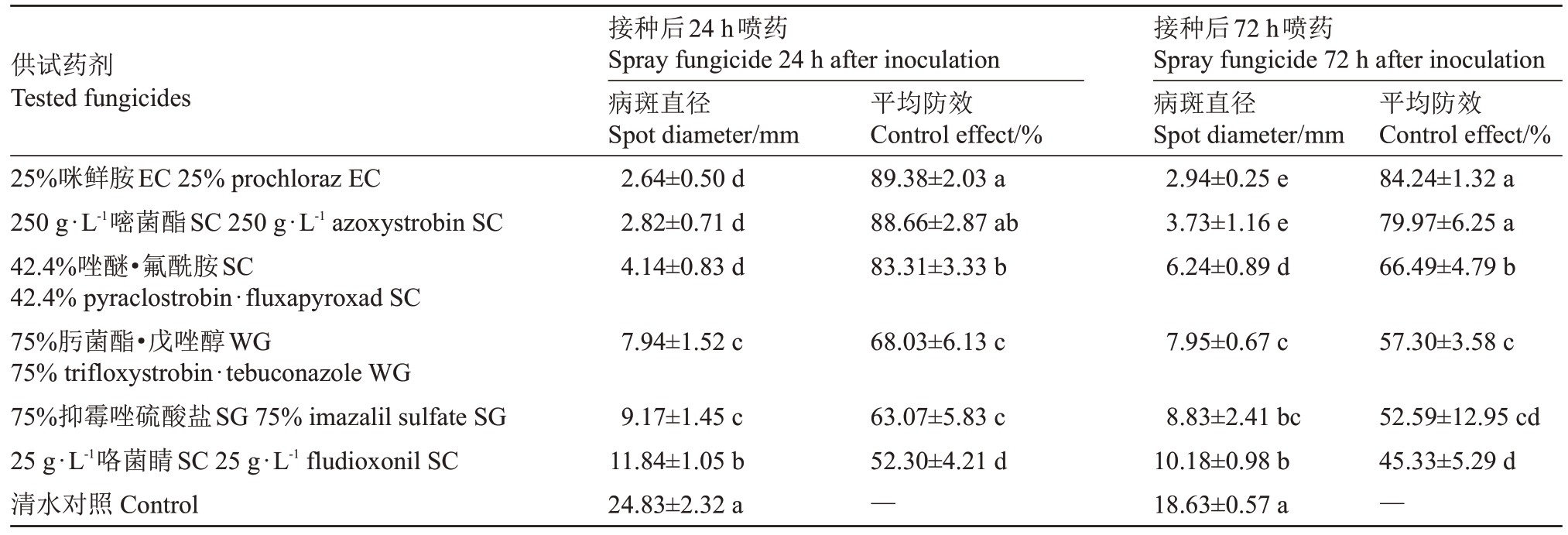
供试药剂Tested fungicides 25%咪鲜胺EC 25%prochloraz EC 250 g·L-1嘧菌酯SC 250 g·L-1 azoxystrobin SC 42.4%唑醚·氟酰胺SC 42.4%pyraclostrobin·fluxapyroxad SC 75%肟菌酯·戊唑醇WG 75%trifloxystrobin·tebuconazole WG 75%抑霉唑硫酸盐SG 75%imazalil sulfate SG 25 g·L-1咯菌睛SC 25 g·L-1 fludioxonil SC清水对照Control接种后24 h喷药Spray fungicide 24 h after inoculation病斑直径Spot diameter/mm 2.64±0.50 d 2.82±0.71 d 4.14±0.83 d平均防效Control effect/%89.38±2.03 a 88.66±2.87 ab 83.31±3.33 b接种后72 h喷药Spray fungicide 72 h after inoculation病斑直径Spot diameter/mm 2.94±0.25 e 3.73±1.16 e 6.24±0.89 d平均防效Control effect/%84.24±1.32 a 79.97±6.25 a 66.49±4.79 b 7.94±1.52 c 68.03±6.13 c 7.95±0.67 c 57.30±3.58 c 9.17±1.45 c 11.84±1.05 b 24.83±2.32 a 63.07±5.83 c 52.30±4.21 d—8.83±2.41 bc 10.18±0.98 b 18.63±0.57 a 52.59±12.95 cd 45.33±5.29 d—
2.3 不同药剂对猕猴桃软腐病的田间防治效果
由表6 可知,空白对照区猕猴桃软腐病发病严重,平均病情指数达到31.18,生长期不同时期喷雾施药4次后,4种杀菌剂中有3种对猕猴桃软腐病的防治效果较好,75%肟菌酯·戊唑醇WG防效显著高于其他药剂(p<0.05),为92.30%;其次是42.4%唑醚·氟酰胺SC 和250 g·L-1嘧菌酯SC,防效分别为80.90%和78.78%;以400 g·L-1氟硅唑EC 防治效果最差,仅32.84%。从施药到调查结束,各杀菌剂处理后对猕猴桃均未产生药害。
表6 4 种杀菌剂对猕猴桃软腐病的田间防治效果
Table 6 Control efficacy of four fungicides on kiwifruit soft rot in fields
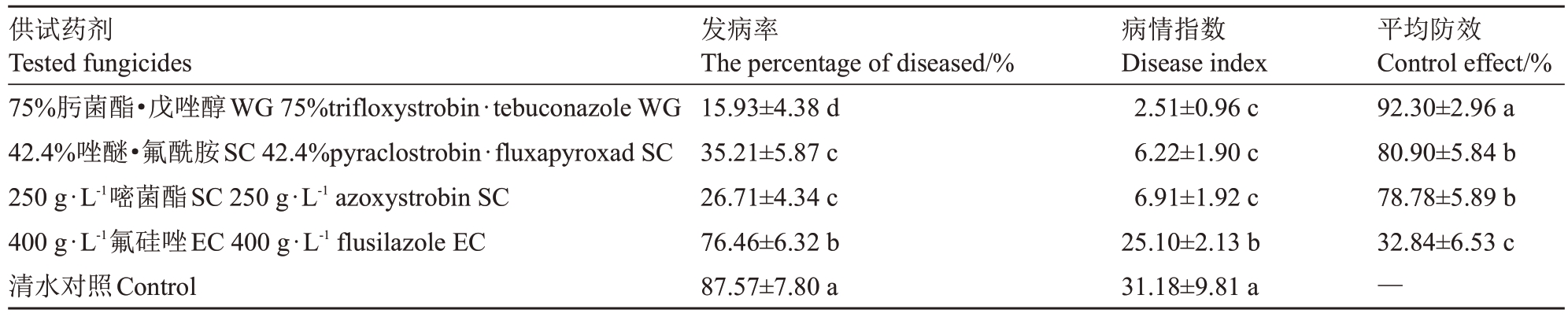
供试药剂Tested fungicides 75%肟菌酯·戊唑醇WG 75%trifloxystrobin·tebuconazole WG 42.4%唑醚·氟酰胺SC 42.4%pyraclostrobin·fluxapyroxad SC 250 g·L-1嘧菌酯SC 250 g·L-1 azoxystrobin SC 400 g·L-1氟硅唑EC 400 g·L-1 flusilazole EC清水对照Control发病率The percentage of diseased/%15.93±4.38 d 35.21±5.87 c 26.71±4.34 c 76.46±6.32 b 87.57±7.80 a病情指数Disease index 2.51±0.96 c 6.22±1.90 c 6.91±1.92 c 25.10±2.13 b 31.18±9.81 a平均防效Control effect/%92.30±2.96 a 80.90±5.84 b 78.78±5.89 b 32.84±6.53 c—
2.4 贮藏期防效验证及安全评价
2.4.1 果实贮藏前浸药的防效验证 由表7可知,5种杀菌剂对猕猴桃软腐病均有一定的防治效果,冷库贮藏90 d 后调查,25%咪鲜胺EC 防治效果最佳,达95.98%,其次为40%腈菌唑SG和75%肟菌酯·戊唑醇,防效分别为91.14%和86.30%。肟菌酯·戊唑醇、咪鲜胺及腈菌唑在果实采后浸果处理对猕猴桃软腐病的防治效果较好,从药剂浸果到调查结束,猕猴桃未发生任何异常情况,各杀菌剂处理后对猕猴桃均未产生药害。
表7 5 种杀菌剂对贮藏期猕猴桃软腐病的防治效果
Table 7 Control efficacy of five fungicides on kiwifruit soft rot during storge period
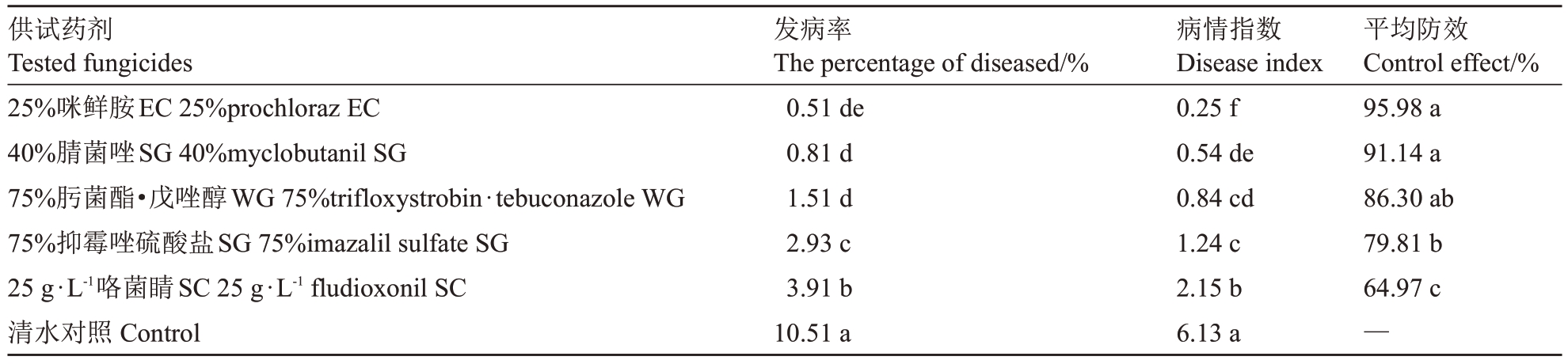
供试药剂Tested fungicides 25%咪鲜胺EC 25%prochloraz EC 40%腈菌唑SG 40%myclobutanil SG 75%肟菌酯·戊唑醇WG 75%trifloxystrobin·tebuconazole WG 75%抑霉唑硫酸盐SG 75%imazalil sulfate SG 25 g·L-1咯菌睛SC 25 g·L-1 fludioxonil SC清水对照Control发病率The percentage of diseased/%0.51 de 0.81 d 1.51 d 2.93 c 3.91 b 10.51 a病情指数Disease index 0.25 f 0.54 de 0.84 cd 1.24 c 2.15 b 6.13 a平均防效Control effect/%95.98 a 91.14 a 86.30 ab 79.81 b 64.97 c—
2.4.2 果实贮藏前浸药的安全评价 猕猴桃采后软腐病发病率极高,猕猴桃果实在贮藏期的杀菌剂最大残留量评估对规范猕猴桃采后病害防治具有重要意义。由表8 可见,清水对照处理的猕猴桃中戊唑醇、肟菌酯、咪鲜胺的残留量:0.015、0.011和<0.01 mg·kg-1;用75%肟菌酯·戊唑醇WG 浸果处理90 d 的猕猴桃中戊唑醇、肟菌酯的残留量分别为0.45 mg·kg-1和0.22 mg·kg-1;用25%咪鲜胺EC浸果处理90 d的猕猴桃中咪鲜胺的残留量为0.59 mg·kg-1。由于肟菌酯和咪鲜胺在猕猴桃上并未进行登记,为此参考浆果和其他小粒水果分类中葡萄上的最大残留限量(MRL),经对比,3种处理中的农药残留均远小于在猕猴桃或葡萄上的MRL值,未出现农药残留超标。
表8 肟菌酯、戊唑醇和咪鲜胺在猕猴桃中的最终残留量
Table 8 Terminal residues of trifloxystrobin,tebuconazole and prochloraz in kiwifruit
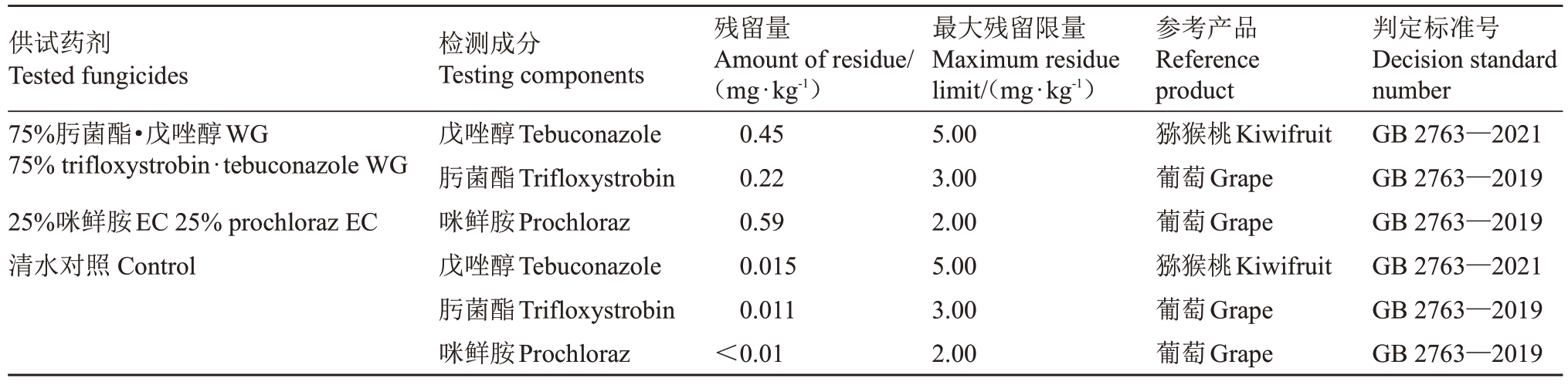
供试药剂Tested fungicides 75%肟菌酯·戊唑醇WG 75%trifloxystrobin·tebuconazole WG 25%咪鲜胺EC 25%prochloraz EC清水对照Control检测成分Testing components戊唑醇Tebuconazole肟菌酯Trifloxystrobin咪鲜胺Prochloraz戊唑醇Tebuconazole肟菌酯Trifloxystrobin咪鲜胺Prochloraz残留量Amount of residue/(mg·kg-1)0.45 0.22 0.59 0.015 0.011<0.01最大残留限量Maximum residue limit/(mg·kg-1)5.00 3.00 2.00 5.00 3.00 2.00参考产品Reference product猕猴桃Kiwifruit葡萄Grape葡萄Grape猕猴桃Kiwifruit葡萄Grape葡萄Grape判定标准号Decision standard number GB 2763—2021 GB 2763—2019 GB 2763—2019 GB 2763—2021 GB 2763—2019 GB 2763—2019
3 讨 论
猕猴桃软腐病发病迅速且难以防治,已成为制约猕猴桃产业发展的主要因子,目前化学防治仍是猕猴桃软腐病的主要防治途径[8,15-16]。甾醇脱甲基酶抑制剂(DMI)和甲氧基丙烯酸酯类(QoIs)的多个产品已注册用于由B.dothidea引起苹果轮纹病的化学防治,其中包括戊唑醇、肟菌酯及吡唑醚菌酯(http://www.chinapesticide.org.cn),然而在中国未有杀菌剂注册用于控制由B.dothidea 引起的猕猴桃软腐病。本研究中,笔者依据室内药剂毒力测定和果实离体防效评价结果,选用了不同的药剂应用于后续的田间及贮藏期药效试验,筛选出可用于猕猴桃软腐病防治的三种杀菌剂,以咪鲜胺对软腐病菌菌丝生长的抑制活性最强,肟菌酯·戊唑醇的预防效果较好,而咪鲜胺的治疗效果较好;在最佳推荐浓度下,肟菌酯·戊唑醇和唑醚·氟酰胺在生长期田间喷施对软腐病防效较好,咪鲜胺在贮藏前浸果对软腐病的防效较好。本试验中筛选出的生长期和贮藏期的最佳防治药剂略有差别,究其原因可能是杀菌剂作用机制不同造成的。因此,笔者推测生长期喷施预防效果更好的杀菌剂,更能显著地降低软腐病的发生;而在采摘和运输过程中,会对果实有一定程度的损伤,采后的果实更加有利于病原菌的侵染[36],此时治疗效果更好的杀菌剂防控效果更显著。
戊唑醇和咪鲜胺同属于甾醇脱甲基酶抑制剂(DMI)类杀菌剂[37-40],抑制病原菌麦角甾醇的生物合成从而影响病原菌细胞壁的形成,属羟乙基三唑衍生物,戊唑醇和咪鲜胺对白粉菌属、柄锈菌属、喙孢属、核腔菌属和壳针孢属菌引起的病害防治效果较好[37-40];而吡唑醚菌酯为广谱甲氧基丙烯酸酯类(QoIs)杀菌剂[41],是线粒体呼吸作用抑制剂,通过影响细胞色素b和c1间电子传递而抑制线粒体呼吸作用,使线粒体不能产生和提供细胞正常代谢所需要的能量,最终导致细胞死亡,具有广谱、低毒和内吸性等特点,广泛应用于由子囊菌、担子菌和卵菌等真菌引起的病害,如葡萄霜霉病、葡萄白粉病、柑橘黑星病、苹果轮纹病等[29]。长期使用单一作用方式的药剂容易导致病原菌产生抗药性,若采用不同机制的杀菌剂交替或复配使用将能延缓和阻止病原菌抗药性加剧[42]。为了降低抗药性产生的风险,建议在田间及采后防治时,将上述药剂交替使用,也可同其他药剂混用或复配,同时限制喷施次数与浓度,并及时进行药剂的敏感性监测,延长药剂使用寿命,避免盲目用药。
笔者在本研究中结果表明,在生长期用药和采后用药对猕猴桃软腐病有显著的防效,但果品中农药残留是否达标是消费者最关心的问题。红阳猕猴桃一般在8 月底至9 月初采收,货架期短,大多数果实采收后需及时入冷库贮藏。由于贮藏温度对果品中农药残留影响很大,一般农药在冷藏条件下消解速度比室温更慢,比如梨中的咪鲜胺和戊唑醇在25 ℃的半衰期为8.8~10.3 d,而在2 ℃的半衰期为173.3~346.6 d[43]。在本研究中,对猕猴桃软腐病防效显著的两种药剂使用后其残留量均远小于在猕猴桃或葡萄上的最大残留限量值,未出现农药残留超标现象,可推荐生产上使用。
除此之外,增强猕猴桃果实的抗逆性也会极大地降低病害的发生率,笔者研究发现吡唑醚菌酯在室内毒力测定中活性最弱,但在田间试验中防效却达80%,能有效防控猕猴桃软腐病。据报道,吡唑醚菌酯可以刺激大豆生长,增加叶绿素含量,并降低丙二醛的水平[44],吡唑醚菌酯拌种还可以提高小麦种子的发芽率,促进小麦生物量的积累,提高株高和鲜质量[45]。这可能是由于吡唑醚菌酯增强了猕猴桃的抗逆性,从而控制了猕猴桃软腐病的发生。综上所述,在生产上推荐肟菌酯·戊唑醇、唑醚·氟酰胺在生长期田间交替轮换使用,推荐咪鲜胺在贮藏前对果实进行浸果处理,同时还应尽量避免采收、运输中果实损伤,科学高效地防控猕猴桃软腐病。
4 结 论
本研究开展了不同杀菌剂的室内毒力测定及离体防效评价,并应用于田间及贮藏期药效试验,筛选出防治猕猴桃软腐病效果较好的三种杀菌剂。在田间防治中肟菌酯·戊唑醇、唑醚·氟酰胺有很好的防治效果,在贮藏期咪鲜胺对果实进行浸果处理有较好的防治效果,可在生产中大面积推广,交替使用。
[1] 朱鸿云.猕猴桃[M].北京:中国林业出版社,2009.ZHU Hongyun.Kiwifruit[M].Beijing:China Forestry Publishing House,2009.
[2] 姚春潮,李建军,刘占德.猕猴桃高效栽培与病虫害防治彩色图谱[M].北京:中国农业出版社,2021.YAO Chunchao,LI Jianjun,LIU Zhande.Color atlas of efficient cultivation and pest control of kiwifruit[M].Beijing:China Agriculture Press,2021.
[3] 钟彩虹,黄宏文.中国猕猴桃科研与产业四十年[M].合肥:中国科学技术大学出版社,2018.ZHONG Caihong,HUANG Hongwen.Chinese kiwifruit research and industry for 40 years[M].Hefei:University of Science and Technology of China Press,2018.
[4] 钟彩虹.猕猴桃栽培理论与生产技术[M].北京:科学出版社,2020.ZHONG Caihong.Cultivation theory and production technology of kiwifruit[M].Beijing:Science Press,2020.
[5] 李黎,潘慧,邓蕾,李文艺,冯丹丹,钟彩虹.猕猴桃真菌性软腐病的发生规律及综合防治技术[J].中国果树,2020(6):1-5.LI Li,PAN Hui,DENG Lei,LI Wenyi,FENG Dandan,ZHONG Caihong.Occurrence rule and comprehends control of kiwifruit rot disease[J].China Fruits,2020(6):1-5.
[6] 封露,陈凡可,林杨,程家森,谢甲涛,付艳苹.我国主产区猕猴桃采后腐烂病病原多样性研究[J].植物病理学报,2022,52(1):1-8.FENG Lu,CHEN Fanke,LIN Yang,CHENG Jiasen,XIE Jiatao,FU Yanping.Pathogen diversity of postharvest diseases of kiwifruit at major cultivation areas in China[J].Acta Phytopathologica Sinica,2022,52(1):1-8.
[7] WANG Q P,ZHANG C,WU X M,LONG Y H,SU Y.Chitosan augments tetramycin against soft rot in kiwifruit and enhances its improvement for kiwifruit growth,quality and aroma[J].Biomolecules,2021,11(9):1257.
[8] 龚国淑,李庆,张敏,崔永亮.猕猴桃病虫害原色图谱与防治技术[M].北京:科学出版社,2020.GONG Guoshu,LI Qing,ZHANG Min,CUI Yongliang.Kiwifruit disease and insect pest original color map and control technology[M].Beijing:Science Press,2020.
[9] ZHOU Y,GONG G S,CUI Y L,ZHANG D X,CHANG X L,HU R P,LIU N,SUN X F.Identification of Botryosphaeriaceae species causing kiwifruit rot in Sichuan Province,China[J].Plant Disease,2015,99(5):699-708.
[10] 刘平平,莫权辉,叶开玉,龚弘娟,王发明,蒋桥生,齐贝贝,李洁维.广西猕猴桃果实病害病原菌分离与鉴定[J].中国南方果树,2023,52(4):92-99.LIU Pingping,MO Quanhui,YE Kaiyu,GONG Hongjuan,WANG Faming,JIANG Qiaosheng,QI Beibei,LI Jiewei.Isolation and identification of fruit diseases pathogens of kiwifruit in Guangxi[J].South China Fruits,2023,52(4):92-99.
[11] 左盼盼,付苏,彭丽桃,范刚,杨书珍,李杰.猕猴桃采后软腐病病原菌鉴定及香芹酚对其控制效果[J].华中农业大学学报,2020,39(6):15-22.ZUO Panpan,FU Su,PENG Litao,FAN Gang,YANG Shuzhen,LI Jie.Identification of soft rot pathogens in postharvest kiwifruit and its control effect by carvacrol[J].Journal of Huazhong Agricultural University,2020,39(6):15-22.
[12] 李忆,尹全,张瑶,孙雷明,庄启国.黄肉猕猴桃‘金实4 号’果实采后蒂腐病病原菌的分离及鉴定[J].北方园艺,2024(13):91-96.LI Yi,YIN Quan,ZHANG Yao,SUN Leiming,ZHUANG Qiguo.Isolation and identification of pathogenic fungi causing post-harvest stem-end rot of‘Jinshi No.4’kiwifruit[J].Northern Horticulture,2024(13):91-96.
[13] LI X J,ZENG S X,LIU J,WANG Y,SUI Y.Introduction and multiplex management strategies of postharvest fungal diseases of kiwifruit:A review[J].Biological Control,2022,176:105096.
[14] KOH Y J,HUR J S,JUNG J S.Postharvest fruit rots of kiwifruit(Actinidia deliciosa) in Korea[J].New Zealand Journal of Crop and Horticultural Science,2005,33(3):303-310.
[15] 邓蕾,潘慧,张莹华,钟彩虹,胡秋舲,谢义福,周鹏,雷靖,李黎.猕猴桃果实腐烂病高效防治药剂的田间验证[J].中国南方果树,2020,49(4):127-129.DENG Lei,PAN Hui,ZHANG Yinghua,ZHONG Caihong,HU Qiuling,XIE Yifu,ZHOU Peng,LEI Jing,LI Li.Field validation of an effective control agent for kiwifruit fruit rot[J].South China Fruits,2020,49(4):127-129.
[16] 高磊,罗轩,张蕾,陈庆红.猕猴桃采后真菌腐烂病害发生与防治技术研究进展[J].中国果树,2018(3):72-76.GAO Lei,LUO Xuan,ZHANG Lei,CHEN Qinghong.Advances in occurrence and control technology researches on postharvest fungal rot of kiwifriut[J].China Fruits,2018(3):72-76.
[17] 胡容平,石军,林立金,叶慧丽,姚琳,周游.四川猕猴桃软腐病防治初步研究[J].西南农业学报,2017,30(2):366-370.HU Rongping,SHI Jun,LIN Lijin,YE Huili,YAO Lin,ZHOU You.Preliminary study on control efficiency against soft rot disease of kiwifruit in Sichuan[J].Southwest China Journal of Agricultural Sciences,2017,30(2):366-370.
[18] 吴文能,张起,雷霁卿,黄亚欣,陈晨蕰,王瑞,曹森.‘贵长’猕猴桃软腐病病原菌分离鉴定及抑菌药剂筛选[J].北方园艺,2018(16):47-54.WU Wenneng,ZHANG Qi,LEI Jiqing,HUANG Yaxin,CHEN Chenwen,WANG Rui,CAO Sen.Identification and pharmaceutical screening of kiwifruit soft rot disease on‘Guichang’gooseberry[J].Northern Horticulture,2018(16):47-54.
[19] 莫飞旭,石金巧,潘东妹,黄亚欣,吴素芳,尹显慧,龙友华.四霉素与戊唑醇复配对猕猴桃软腐病的防控效果[J].中国植保导刊,2019,39(2):71-74.MO Feixu,SHI Jinqiao,PAN Dongmei,HUANG Yaxin,WU Sufang,YIN Xianhui,LONG Youhua.Controlling efficiency of tetramycin and tebuconazole mixture against kiwifruit soft rot disease[J].China Plant Protection,2019,39(2):71-74.
[20] SAITO S,WANG F,XIAO C L.Efficacy of natamycin against gray mold of stored mandarin fruit caused by isolates of Botrytis cinerea with multiple fungicide resistance[J].Plant Disease,2020,104(3):787-792.
[21] THOMIDIS T,PRODROMOU I.Evaluation of the effectiveness of three fungicides against pathogens causing postharvest fruit rot of kiwifruit[J].Australasian Plant Pathology,2018,47(5):485-489.
[22] 刘萍,何建军,阳廷密,丁萍,唐艳,邓崇岭.6 种常见杀菌剂用于沙糖桔采后保鲜的效果及其残留[J].中国南方果树,2019,48(6):7-11.LIU Ping,HE Jianjun,YANG Tingmi,DING Ping,TANG Yan,DENG Chongling.Effect of six fungicides for postharvest fresh keeping of shatangju fruits and their residual[J].South China Fruits,2019,48(6):7-11.
[23] DING J,LIU C Y,HUANG P,ZHANG Y W,HU X J,LI H Y,LIU Y,CHEN L W,LIU Y W,QIN W.Effects of thymol concentration on postharvest diseases and quality of blueberry fruit[J].Food Chemistry,2023,402:134227.
[24] DONG X L,CHENG Z Z,LENG W F,LI B H,XU X M,LIAN S,WANG C X.Progression of symptoms caused by Botryosphaeria dothidea on apple branches[J].Phytopathology,2021,111(9):1551-1559.
[25] ZHANG Z W,ZHANG Y,WANG Y,FAN J Q,XIE Z H,QI K J,SUN X,ZHANG S L.Exogenous dopamine improves resistance to Botryosphaeria dothidea by increasing autophagy activity in pear[J].Plant Science,2023,329:111603.
[26] WANG H X,FU L,MENG J,DING R H,WANG Y D,WANG X Y,HAN C Y,LI L M,ZHU C Y.Antagonistic activity and biocontrol effects of Streptomyces sp.CX3 cell-free supernatant against blueberry canker caused by Botryosphaeria dothidea[J].Crop Protection,2022,162:106072.
[27] 刘梅,张玮,宋雅琴,吴江,严红,李兴红.4 种杀菌剂对葡萄溃疡病病菌的抑制作用及对病害的防治效果[J].中国果树,2013(6):58-61.LIU Mei,ZHANG Wei,SONG Yaqin,WU Jiang,YAN Hong,LI Xinghong.Inhibition and control of four fungicides on grape canker[J].China Fruits,2013(6):58-61.
[28] 姜莉莉,付丽,薛雯,曲健禄,武海斌,范昆.9 种三唑类杀菌剂对苹果轮纹病菌的毒力及田间防效[J].植物保护,2021,47(2):243-248.JIANG Lili,FU Li,XUE Wen,QU Jianlu,WU Haibin,FAN Kun.Toxicity of nine triazole fungicides to Botryosphaeria dothidea and their control efficacy on apple ring rot[J].Plant Protection,2021,47(2):243-248.
[29] FAN K,WANG J,FU L,ZHANG G F,WU H B,FENG C C,QU J L.Baseline sensitivity and control efficacy of pyraclostrobin against Botryosphaeria dothidea isolates in China[J].Plant Disease,2019,103(7):1458-1463.
[30] FAN K,FU L,LIU H M,QU J L,ZHANG G F,ZHANG S A,QIAO K.Reduced sensitivity to tebuconazole in Botryosphaeria dothidea isolates collected from major apple production areas of China[J].Plant Disease,2022,106(11):2817-2822.
[31] 张璐,刘奇志,张国珍.6 种梨果实对轮纹病的抗性差异及4种杀菌剂对轮纹病菌的抑菌作用[J].植物保护,2019,45(4):224-228.ZHANG Lu,LIU Qizhi,ZHANG Guozhen.Resistance of six pear variety’s fruits to ring rot and inhibition effects of four fungicides to Botryosphaeria dothidea[J].Plant Protection,2019,45(4):224-228.
[32] 滕虎亮,欧阳浩,龚凤鲜,黎耀鸿,樊瑞冬,冯泽锐,刘增亮,胡小京,宋理洪,陈孝玉龙.芒果蒂腐病病原菌分离鉴定及其室内防治药剂筛选[J].南方农业学报,2023,54(12):3619-3629.TENG Huliang,OUYANG Hao,GONG Fengxian,LI Yaohong,FAN Ruidong,FENG Zerui,LIU Zengliang,HU Xiaojing,SONG Lihong,CHEN Xiaoyulong.Pathogen isolation and identification of mango stem-end rot and in-door fungicide screening for disease control[J].Journal of Southern Agriculture,2023,54(12):3619-3629.
[33] ZHANG C,LONG Y H,LI J H,LI M,XING D K,AN H M,WU X M,WU Y Y.A chitosan composite film sprayed before pathogen infection effectively controls postharvest soft rot in kiwifruit[J].Agronomy,2020,10(2):265.
[34] 张凯东,强遥,邹曼飞,秦双林,胡叶开,李帮明,蒋军喜.6 种诱抗剂对奉新猕猴桃2 种真菌病害的田间防效试验[J].中国南方果树,2020,49(4):130-132.ZHANG Kaidong,QIANG Yao,ZOU Manfei,QIN Shuanglin,HU Yekai,LI Bangming,JIANG Junxi.Field experiment on the control effects of six inducers and resistance agents on two fungal diseases in Fengxin kiwifruit[J].South China Fruits,2020,49(4):130-132.
[35] 中华人民共和国国家卫生健康委员会,中华人民共和国农业农村部,国家市场监督管理总局.食品安全国家标准食品中农药最大残留限量:GB 2763—2021[S].北京:中国标准出版社,2021.National Health Commission of the People’s Republic of China,Ministry of Agriculture and Rural Affairs of the People’s Republic of China,State Administration for Market Regulation.National food safety standard·Maximum residue limits for pesticides in food:GB 2763—2021[S].Beijing:Standards Press of China,2021.
[36] 李广旭,沈永波,高艳敏,陈杰,严在烈. Botryosphaeria dothidea 在苹果果实上的侵染过程[J].果树学报,2006,23(1):69-72.LI Guangxu,SHEN Yongbo,GAO Yanmin,CHEN Jie,YAN Zailie.Infection process of Botryosphaeria dothidea in apple fruit[J].Journal of Fruit Science,2006,23(1):69-72.
[37] 吴小美,王海霞,云英子,马忠华.植物病原真菌对杀菌剂抗性的研究进展[J].植物保护,2023,49(5):243-259.WU Xiaomei,WANG Haixia,YUN Yingzi,MA Zhonghua.Research progresses on fungicide resistance in plant pathogenic fungi[J].Plant Protection,2023,49(5):243-259.
[38] KEINATH A P,RENNBERGER G,WECHTER P.Widespread resistance to tebuconazole and cross-resistance to other DMI fungicides in Stagonosporopsis citrulli isolated from watermelon in South Carolina[J].Plant Disease,2023,107(12):3896-3905.
[39] PENG Q,LI X H,LI G X,HAO X C,LIU X L.Resistance risk assessment of mefentrifluconazole in Corynespora cassiicola and the control of cucumber target spot by a two-way mixture of mefentrifluconazole and prochloraz[J].Pesticide Biochemistry and Physiology,2024,198:105719.
[40] CUAN R R,LIU S T,ZHOU C Y,WANG S Q,ZHENG Y L,YUAN Y Z.Transcriptome analysis of mfs2-defective Penicillium digitatum mutant to reveal importance of Pdmfs2 in developing fungal prochloraz resistance[J].Microorganisms,2024,12(5):888.
[41] 赵健钦,金京,陈杰.QoI 类杀菌剂应用与抗性机制研究进展[J].世界农药,2023,45(7):19-30.ZHAO Jianqin,JIN Jing,CHEN Jie.Research progress on application and resistance of QoI fungicides[J].World Pesticide,2023,45(7):19-30.
[42] 毛玉帅,段亚冰,周明国.琥珀酸脱氢酶抑制剂类杀菌剂抗性研究进展[J].农药学学报,2022,24(5):937-948.MAO Yushuai,DUAN Yabing,ZHOU Mingguo.Research progress of the resistance to succinate dehydrogenase inhibitors[J].Chinese Journal of Pesticide Science,2022,24(5):937-948.
[43] FANG Q K,WU R F,HU G X,LAI A P,WU K X,ZHANG L W,FENG J J,CAO H Q.Dissipation behavior,residue distribution and risk assessment of three fungicides in pears[J].Journal of the Science of Food and Agriculture,2020,100(4):1757-1763.
[44] LI P L,SUN P Y,LI D,LI D L,LI B H,DONG X L.Evaluation of pyraclostrobin as an ingredient for soybean seed treatment by analyzing its accumulation-dissipation kinetics,plant-growth activation,and protection against Phytophthora sojae[J].Journal of Agricultural and Food Chemistry,2020,68(43):11928-11938.
[45] 芦勇.吡唑醚菌酯拌种防治小麦纹枯病的研究[D].泰安:山东农业大学,2017.LU Yong.Studies on controlling sharp eye spot of wheat by seed coating of pyraclostrobin[D].Tai’an:Shandong Agricultural University,2017.