猕猴桃作为一种肉质根类果树,根系含水量高且分布较浅,导致猕猴桃对干旱环境尤为敏感,对土壤水分管理的要求也较其他果树更为苛刻。猕猴桃的叶片肥大,还拥有发达的输导组织和气孔,这些特性使叶面蒸腾作用强烈,耗水量极大[1],水分亏缺会严重影响猕猴桃的产量和品质。
在干旱胁迫下,植物会通过减少水分散失以及提高水分利用率来维持正常生长。植物通过大量积累脯氨酸、可溶性糖、可溶性蛋白以及无机离子等渗透调节物质降低细胞渗透势,从而降低水势,稳定膜结构和大分子结构表面的水化层,提高水分利用率,增强植物在干旱胁迫下的耐受力[2-4]。干旱胁迫促使植物体内会产生过量的活性氧自由基,由于活性氧具有极强的氧化性,为了维持植物正常的生理代谢,体内有一套减轻和消除活性氧自由基的保护系统。植物保护系统包括酶促清除系统和非酶促清除系统[5]。酶促清除系统主要包括过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、过氧化物酶(POD)、谷胱甘肽过氧化物酶(GSH-PX)、抗坏血酸过氧化物酶(APX)等[6],这些抗氧化酶之间相互协调,维持植物体内氧化-抗氧化平衡,从而保障植物正常的生命活动[7]。
受干旱胁迫诱导表达的基因,根据其功能特性,可被划分为两大类。第一类是功能蛋白基因,这类基因编码的蛋白质在植物抗旱机制中发挥着直接的防护作用,包括渗透物质合成酶、糖代谢调节基因、抗氧化保护剂基因以及转运蛋白基因等[8-9]。相较于其他不耐旱的砧木品种,苹果矮化砧木SH6在遭受干旱胁迫时,叶片中的超氧化物歧化酶基因SOD1、抗坏血酸过氧化物酶基因APX1、脱氢抗坏血酸还原酶基因DHAR2以及过氧化氢酶基因CAT1的表达量会显著上调,展现出更强的表达活性[10]。第二类基因则主要参与调控干旱胁迫下的基因表达或信号转导过程,主要为转录因子[11]。以ZmCCT 为例,它能够与膜蛋白ZmFra a 1、泛素连接酶ZmWIPF2 以及IAA 家族的转录因子ZmAux/IAA8 发生相互作用,从而促进IAA的合成,并进一步调控下游靶标基因的表达,以此来调节玉米的抗旱性能[12]。
笔者以具有不同抗旱能力的猕猴桃种质资源为研究对象,通过综合研究分析各猕猴桃资源在干旱胁迫下的植株表型、旱害指数,评价不同猕猴桃类型的抗旱能力差异;通过测定不同猕猴桃类型干旱胁迫下的叶片丙二醛和过氧化氢含量及过氧化氢酶和超氧化物歧化酶活性等生理指标,解析抗旱的生理基础;进一步以猕猴桃资源根系为研究对象,通过转录组测序挖掘抗旱基因。
1 材料和方法
1.1 材料
供试材料保存于国家西南特色园艺作物种质资源圃猕猴桃分圃,分别为美味猕猴桃(Actinidia deliciosa)Bruno,对萼猕猴桃(A.valvata)DJY-DE-1、葛枣猕猴桃(A.polygama)XD-GZ-7 和软枣猕猴桃(A.arguta)XD-RZ-1。
1.2 模拟干旱处理
对猕猴桃幼苗每天浇灌600 mL 的25% PEG-6000溶液模拟干旱胁迫,若底部托盘有渗出液则倒回营养钵中。试验于干旱胁迫后第0、2、4、6、8天分别取猕猴桃自上而下第5~6片完全叶,用纯水洗净后将表面残留纯水吸拭干净,立即放置于液氮中,保存于超低温(-80 ℃)冰箱内,后续进行相关指标的测定。
1.3 旱害指数调查
从干旱胁迫开始,观察猕猴桃砧木叶片变化。评价标准主要参考樊卫国等[13]在野生梨耐旱性的旱害分级标准,根据猕猴桃干旱胁迫下的植株形态变化,将旱害分为以下等级:0级,植株正常,无明显差异;1 级,植物叶片发生轻度萎蔫;2 级,植株叶片发生中度萎蔫;3 级,植株叶片发生重度萎蔫(植株叶片发生全株萎蔫);4级,植株叶片严重萎蔫且约1/3叶片干枯;5 级,植株有叶片干枯现象并伴随脱落。旱害指数/%=Σ(代表级值×株数)/(最高级值×处理总株数)×100。
1.4 生理指标测定
MDA含量测定采用硫代巴比妥酸法,H2O2含量测定采用过氧化氢-四氯化钛反应方法,Pro含量测定采用茚三酮-磺基水杨酸法,SOD含量测定采用氮蓝四唑(NBT)法,CAT含量测定采用双氧水法。
1.5 转录组测序
以干旱胁迫第0、4、8天的DJY-DE-1和Bruno根系为样本,进行转录组测序,每个处理3次生物学重复,共计18个样本。转录组测序由上海派森诺生物科技股份有限公司完成。利用无参考基因组进行转录组分析,首先对原始数据进行过滤,将带接头、长度小于50 bp、序列平均质量在Q20 以下的Reads 进行去除,对得到的高质量序列进行从头拼接得到转录本序列,对转录本进行聚类,挑选最长的转录本作为Unigene,最后用Unigene 进行后续GO 和KEGG分析。采用DESeq 对基因表达进行差异分析,以表达差异倍数|log2FoldChange|>1、显著性P-value<0.05为标准筛选差异表达基因。
1.6 差异表达基因的实时荧光定量PCR
使用RNAprep Pure 多糖多酚植物总RNA 提取试剂盒提取猕猴桃根系RNA,利用HiScript ⅡQ RT SuperMix for qPCR 试剂盒反转录合成cDNA,使用HiScript ⅡQ RT SuperMix 进行实时荧光定量PCR反应。反应体系为:cDNA 模板1 μL,2×HiScript II Q RT SuperMix 10 μL,上下游引物(表1)各0.5 μL,ddH2O 8 μL,仪器为荧光PCR 仪480,利用2(-ΔΔCT)法计算基因的相对表达量。
表1 实时定量PCR 反应中各基因的引物序列
Table 1 Primer sequence for quantitative real-time PCR reaction

基因名称Gene name AcAld AcRAP2-4 AcEFL AcSus3正向引物Forward primer(5'-3')ACCTGATCACCTCCTCCTCC CCAGCCCACTTCTTACCCAG TGGAAAGCGAGAAGGGCAAT TTCCTCCGAGCACACAAACA反向引物Reverse primer(5'-3')TGCGAACCCCTTCTTTGTGT GGAGGGACGCTTCTTAGACG ATGATGGTGAGCTTGCGGAA ACCCTGTAATTCGGCAGCAA
2 结果与分析
2.1 干旱胁迫下猕猴桃植株表型及旱害指数分析
利用25%PEG-6000 模拟干旱胁迫对4 份猕猴桃材料进行处理,结果表明,Bruno 在处理后的第4天即出现明显的叶片失水和下垂现象,随着干旱胁迫时间的延长,萎蔫程度逐渐加重,并在第6天时植株基部叶片出现干枯,第8 天时整株叶片均已干枯。XD-GZ-7 在干旱胁迫的第4 天时叶片开始下垂,第8 天基部叶片边缘出现干枯现象。XD-RZ-1在第6 天表现出叶片下垂,第8 天基部叶片开始萎蔫。而DJY-DE-1虽然在第8天出现明显下垂,但并未发生叶片萎蔫,其受干旱胁迫的损伤程度低于其他材料(图1)。

图1 干旱胁迫下猕猴桃植株表型的变化
Fig.1 Phenotypic changes of kiwifruit plants under drought stress
对4份猕猴桃材料在干旱胁迫下的旱害指数进行统计分析,结果表明,各材料的旱害指数均随胁迫时间的延长持续升高。第8 天时,旱害指数从高到低依次为Bruno(87%)、XD-GZ-7(67%)、XD-RZ-1(60%)和DJY-DE-1(33%)(表2)。
表2 4 份猕猴桃材料在各时期的旱害指数
Table 2 Drought injury index of four kiwifruit in each period%
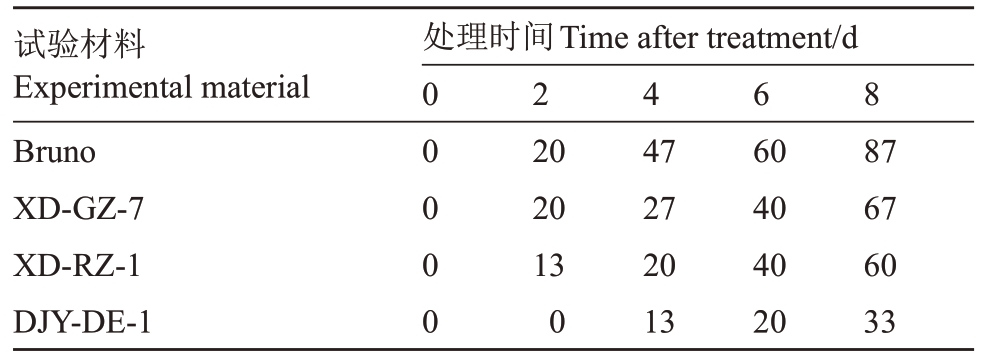
试验材料Experimental material Bruno XD-GZ-7 XD-RZ-1 DJY-DE-1处理时间Time after treatment/d 00 0 0 0 2 4 6 8 20 20 13 0 47 27 20 13 60 40 40 20 87 67 60 33
2.2 干旱胁迫下猕猴桃叶片生理指标的变化
随着干旱时间的延长,Bruno 和XD-GZ-7 叶片中的MDA 含量持续升高。其中,Bruno 叶片中的MDA在干旱胁迫第4天时相比0 d增加了113.79%,而XD-GZ-7 在干旱胁迫第6 天时相比0 d 增加了74.48%。XD-RZ-1的MDA含量出现先升高后降低的趋势,DJY-DE-1呈现先下降后上升再下降最后上升的趋势,且变化相对平缓,最后基本恢复到干旱胁迫前的水平(图2-A)。随着干旱的加剧,DJY-DE-1和XD-RZ-1体内的脯氨酸含量一直呈上升趋势,其中,DJY-DE-1干旱胁迫8 d相比0 d升高了168%,而XD-RZ-1 干旱胁迫8 d 相比0 d 升高了253%。XDGZ-7随着干旱时间的持续,脯氨酸含量呈先升高后下降的趋势。Bruno体内的脯氨酸含量随干旱时间的延长呈先升高后下降的趋势,并且在干旱胁迫4 d时达到最高峰,为对照的2 倍,然后开始快速下降,到干旱胁迫8 d时低于干旱处理前(图2-B)。
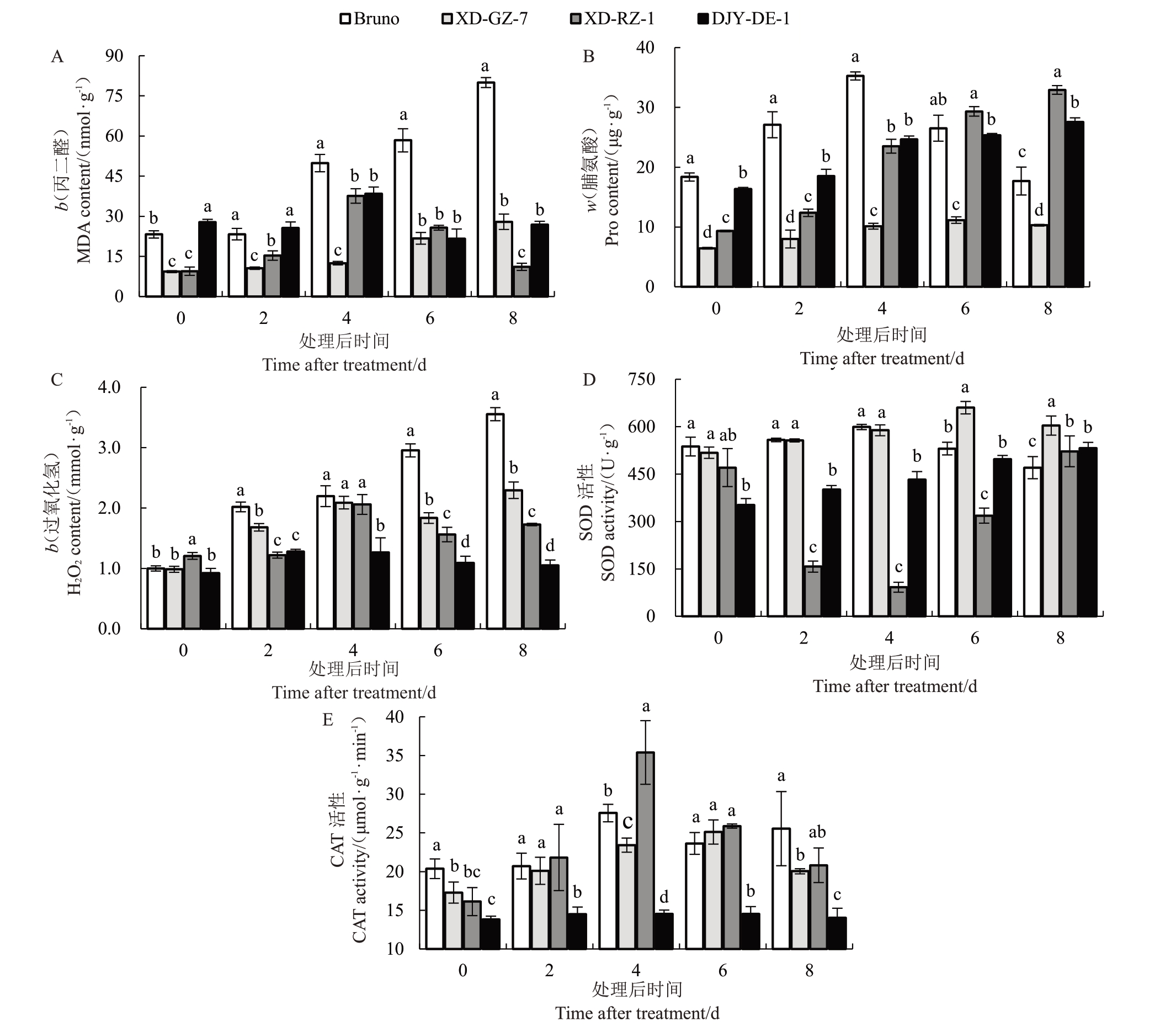
图2 干旱胁迫下猕猴桃生理指标的变化
Fig.2 Changes in physiological indicators of different kiwifruit under drought stress
柱形图中同一时期不同的小写字母代表不同处理之间具有显著差异(p<0.05)。
Different lowercase letters in the bar graph for the same period represent significant difference between treatments(p<0.05).
随着干旱胁迫时间的延长,Bruno 叶片H2O2含量呈现持续上升趋势;XD-GZ-7 和XD-RZ-1 叶片H2O2含量呈先上升后下降再上升的趋势;DJY-DE-1随着干旱时间的延长,叶片H2O2的含量相对稳定,除干旱胁迫2 d和4 d稍有升高外,其余时间均无显著变化(图2-C)。Bruno和XD-GZ-7的叶片SOD活性呈先上升后下降的趋势,分别在干旱胁迫4 d和6 d上升到最大值,为598 U·g-1和660 U·g-1。DJY-DE-1叶片SOD活性随干旱时间的延长持续升高,干旱胁迫8 d升高到最大值,为0 d的1.6倍(图2-D)。随着干旱的加剧,XD-RZ-1和XD-GZ-7的叶片CAT活性均呈先上升后下降的趋势,XD-RZ-1在干旱胁迫4 d上升到最大值,为35.39 μmol·g-1·min-1;XD-GZ-7 在干旱胁迫6 d 达到最大值,为25.11 μmol·g-1·min-1。Bruno的CAT活性均呈先升高后降低再升高的趋势,在干旱胁迫4 d上升到最大值,为27.56 μmol·g-1·min-1。而DJY-DE-1 的CAT活性在整个干旱胁迫下均无显著变化(图2-E)。
2.3 转录组数据质量分析
笔者选取了最耐受干旱和干旱敏感的DJY-DE-1 和Bruno 在干旱处理不同时期的根系进行转录组测序分析,旨在从分子水平探究猕猴桃抗旱的机制。将转录组测序得到的图像文件转化生成FASTQ的原始数据(Raw Data),对每个样品的原始数据分别进行统计,文库的Q20 值在99.2%以上,Q30 值在97.6%以上(表3),说明测序质量可靠,可进行下一步分析。
表3 转录组数据质量评估
Table 3 Quality evaluation of offline data
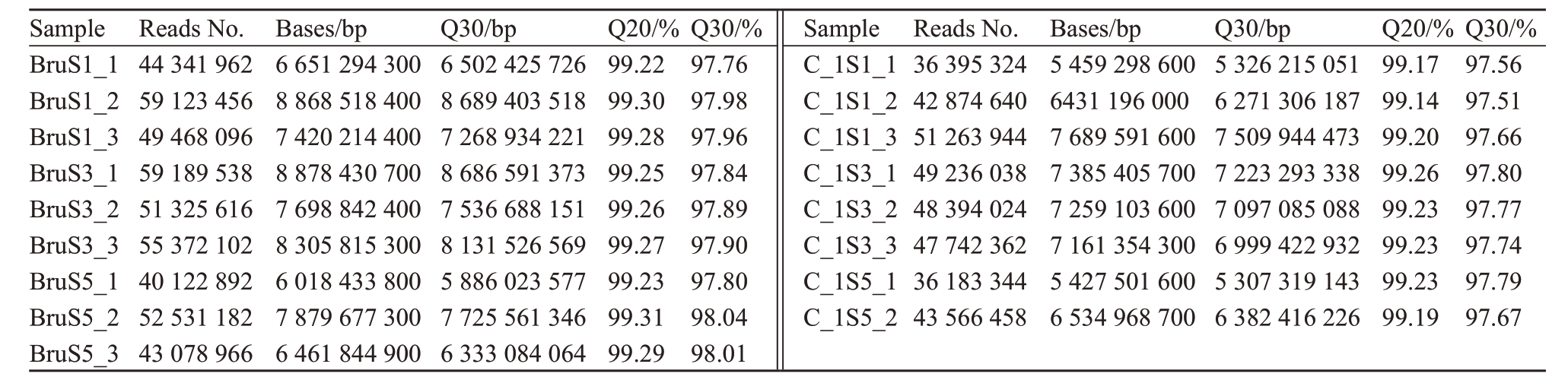
注:Bru 表示Bruno,C_1 表示DJY-DE-1,S1、S3、S5 分别表示干旱胁迫第0、4、8 天,3 次重复。
Note:Bru represents Bruno,C_1 represents DJY-DE-1,S1,S3 and S5 represent the 0,4 and 8 days of drought stress,respectively,with each condition having three replicates..
Sample BruS1_1 BruS1_2 BruS1_3 BruS3_1 BruS3_2 BruS3_3 BruS5_1 BruS5_2 BruS5_3 Reads No.44 341 962 59 123 456 49 468 096 59 189 538 51 325 616 55 372 102 40 122 892 52 531 182 43 078 966 2468处理天数Days after treatment/d Bases/bp 6 651 294 300 8 868 518 400 7 420 214 400 8 878 430 700 7 698 842 400 8 305 815 300 6 018 433 800 7 879 677 300 6 461 844 900 Q30/bp 6 502 425 726 8 689 403 518 7 268 934 221 8 686 591 373 7 536 688 151 8 131 526 569 5 886 023 577 7 725 561 346 6 333 084 064 Q20/%99.22 99.30 99.28 99.25 99.26 99.27 99.23 99.31 99.29 Q30/%97.76 97.98 97.96 97.84 97.89 97.90 97.80 98.04 98.01 Sample C_1S1_1 C_1S1_2 C_1S1_3 C_1S3_1 C_1S3_2 C_1S3_3 C_1S5_1 C_1S5_2 Reads No.36 395 324 42 874 640 51 263 944 49 236 038 48 394 024 47 742 362 36 183 344 43 566 458 Bases/bp 5 459 298 600 6431 196 000 7 689 591 600 7 385 405 700 7 259 103 600 7 161 354 300 5 427 501 600 6 534 968 700 Q30/bp 5 326 215 051 6 271 306 187 7 509 944 473 7 223 293 338 7 097 085 088 6 999 422 932 5 307 319 143 6 382 416 226 Q20/%99.17 99.14 99.20 99.26 99.23 99.23 99.23 99.19 Q30/%97.56 97.51 97.66 97.80 97.77 97.74 97.79 97.67
2.4 差异表达基因筛选
在进行差异基因表达分析之前,利用皮尔逊相关系数对样品间基因表达水平的相关性进行分析,如图3-A 所示,本研究样品的相关系数均为1,说明样品间具有极强相关性。将得到的Clean reads利用Trinity 进行从头组装,总共获得435 047 个转录本。根据转录组数据分析筛选出两个猕猴桃砧木品种的干旱响应差异表达基因如图3 所示,两个猕猴桃砧木品种在S1 时期差异表达基因共有102 588 个,其中,下调表达基因50 895 个,上调表达基因51 693个;在S3 时期差异表达基因共有100 951 个,其中,下调表达基因49 058个,上调表达基因51 893个;在S5时期差异表达基因共有104 974个,其中,下调表达基因57 385个,上调表达基因47 589个(图3-B)。

图3 样品相关性检验及差异表达基因分析
Fig.3 Sample correlation test and differentially expressed genes analysis
2.5 差异表达基因的GO和KEGG分析
针对差异基因进行GO功能分类。结果如图4-A 所示,在生物过程、细胞组分和分子功能三个GO功能分类中,Unigenes 被划分到61 个GO 亚类中,富集在生物过程中的细胞过程、代谢过程、发育过程的差异基因较多;在细胞组分方面,细胞、细胞部分和膜富集到较多的差异基因;分子功能中的结合、催化活性和转运蛋白活性富集到较多的差异基因。

图4 差异表达基因的GO 和KEGG 分析
Fig.4 GO and KEGG analysis of differentially expressed genes
为进一步揭示差异基因的生物学功能,探索干旱胁迫下猕猴桃砧木资源的代谢调控网络,对差异基因进行KEGG富集分析,结果如图4-B所示,富集到较多差异基因的通路为信号转导、运输和分解代谢、糖代谢、折叠、分类和降解、氨基酸代谢等。
2.6 加权基因共表达网络分析
笔者采用加权基因共表达网络分析(WGCNA)算法来进行模块的构建,如图5所示,在干旱胁迫的背景下,基于拓扑重叠的不同基因聚类树状图,并结合特定的模块颜色,鉴定出17 个不同的模块,筛选出与干旱高度相关的两个模块MEgreenyellow 和MEpurple,结合GO分析最终筛选出4个可能参与根系干旱响应的差异基因TRINITY_DN11629_c0_g1(ethylene- responsive transcription factor RAP2- 4 like)、TRINITY_DN257031_c0_g1(sucrose synthase 3)、TRINITY_DN3814_c0_g1(protein EARLY FLOWERING like)和TRINITY_DN16120_c0_g1(alpha-dioxygenase)。
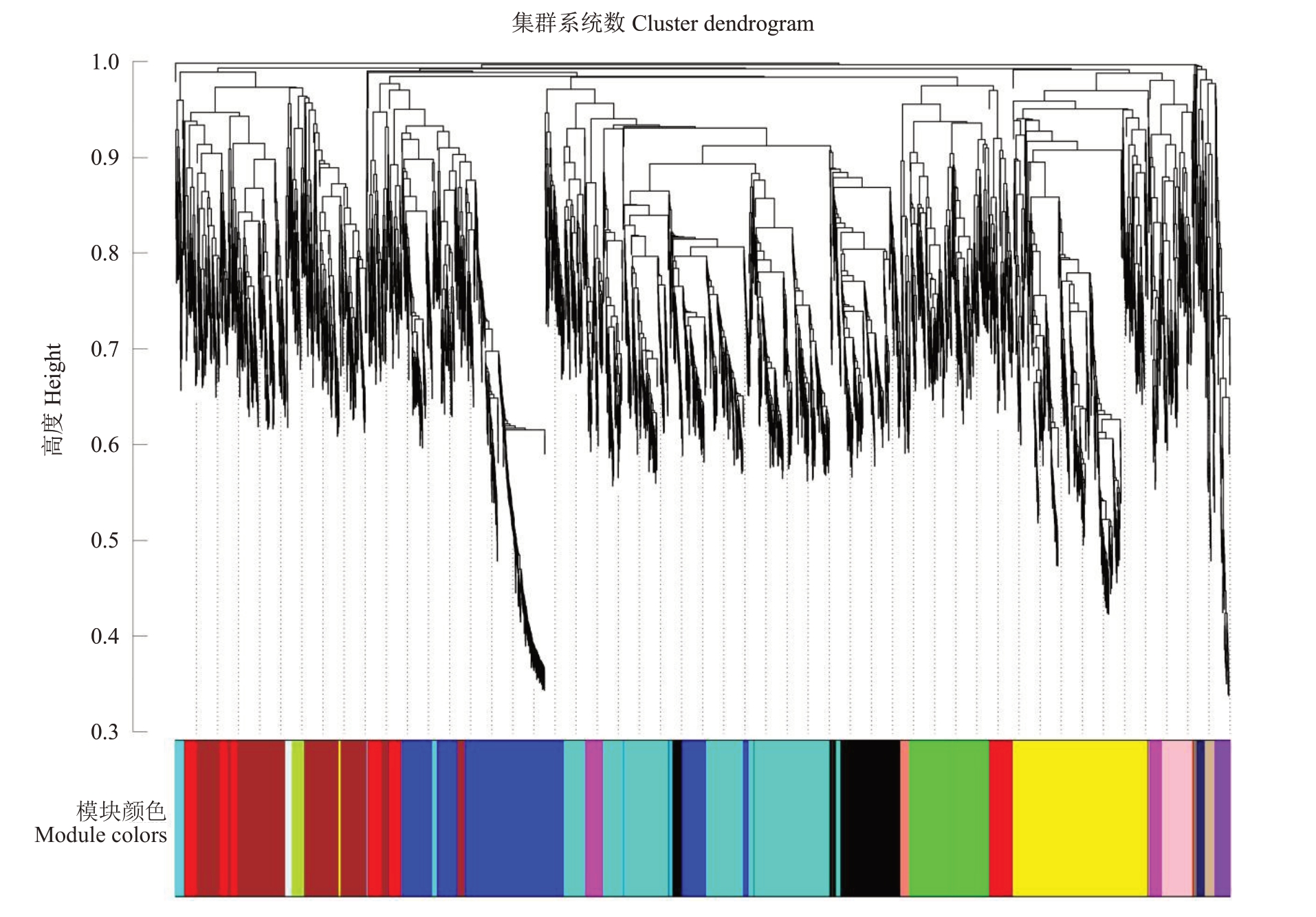
图5 加权基因共表达网络分析结果
Fig.5 Results of weighted gene co-expression network analysis
2.7 差异表达基因的荧光定量PCR分析
为了进一步验证RNA-seq 结果,结合WGCNA分析,对筛选得到的4 个基因采用qRT-PCR 的方法对测序的样品进行了验证。qRT-PCR结果如图6所示,4个候选基因的表达量在干旱胁迫后S3和S5时期均呈升高趋势,与RNA-seq 结果相吻合,表明RNA-seq获得的基因相对表达水平结果可靠。
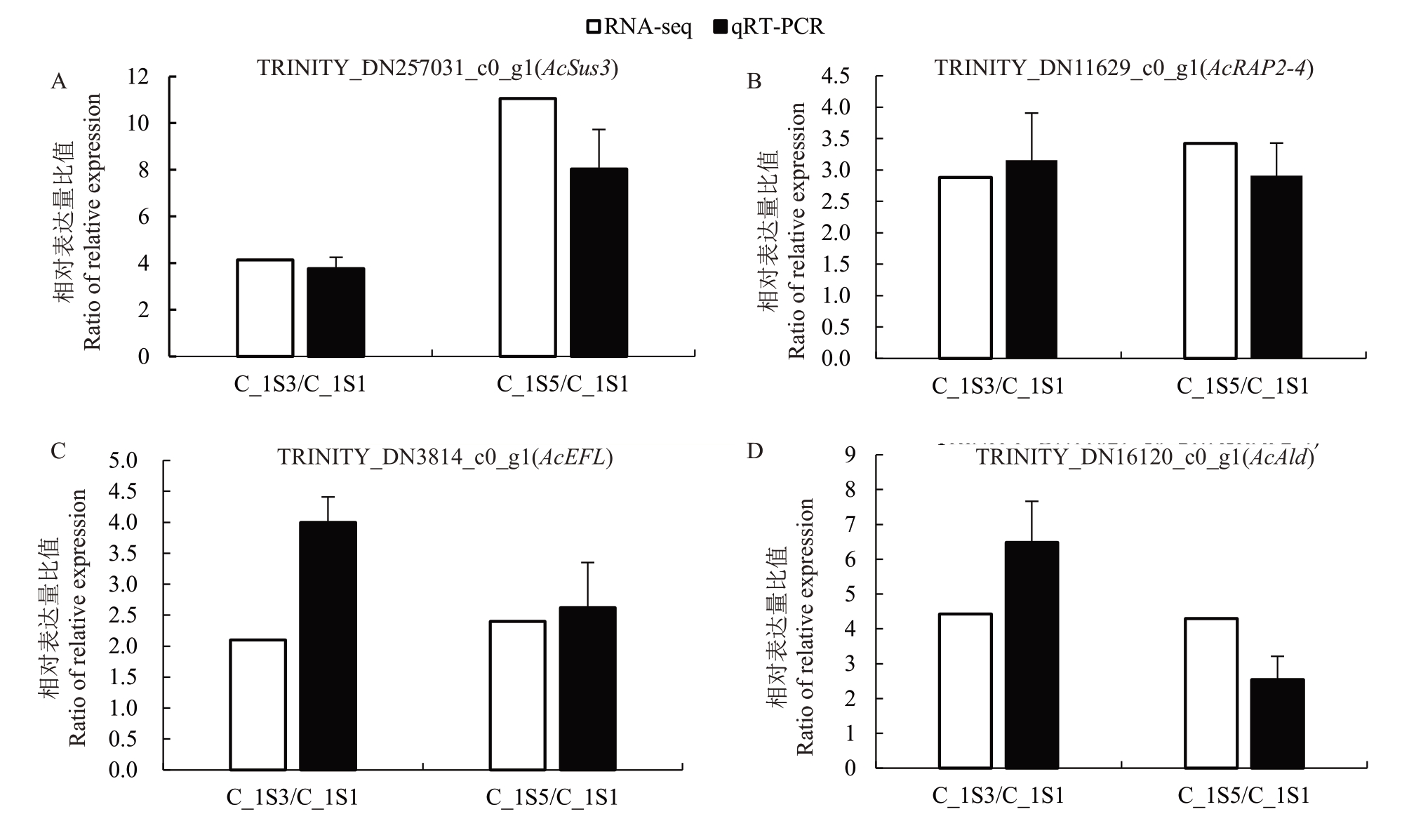
图6 干旱胁迫下差异表达基因的荧光定量PCR 分析
Fig.6 qRT-PCR analysis of differentially expressed genes
3 讨 论
植物应对干旱胁迫是个动态的过程,受损情况取决于干旱胁迫的持续时长[13],为了适应干旱胁迫,植物发生生理生化的变化。在干旱胁迫下,植物细胞膜脂过氧化加剧,对细胞结构造成破坏,过氧化氢(H2O2)和丙二醛(MDA)是膜脂过氧化作用的重要产物,可以反映细胞膜受伤害的程度。大量研究表明,干旱胁迫前H2O2 和MDA 在植物体内含量较低[14]。本试验中,在干旱胁迫下不同种质猕猴桃呈现出不同的变化趋势,与耐旱性呈正相关。随着干旱胁迫的加剧,干旱敏感的品种H2O2和MDA 含量持续升高,意味着细胞膜透性一直在增强,抗旱性强的品种叶片中H2O2和MDA 含量在后期逐渐下降,可能是自由基清除系统发挥了作用。本研究中对干旱越敏感的品种,有害物质的含量越高于干旱处理前;抗性越强的品种,有害物质的含量越接近于干旱处理前,这与魏桦[14]的研究结果一致。
在受到干旱胁迫时,植物会通过渗透调节,降低渗透势,从而适应干旱环境[15]。脯氨酸(Pro)含量的增加可以降低植物的脱水能力,保持植物体内水分平衡,提高植物抗旱性[16]。在本研究中,干旱敏感的猕猴桃Pro含量先升高后降低,抗性强的猕猴桃Pro含量持续升高,这表明干旱胁迫会抑制干旱敏感品种Pro的积累,降低植物的耐旱性。这与胡晓健等[17]在马尾松幼苗中的研究一致,汪娅琴等[18]在蓝莓上也证实了这一观点。
植物除了会通过渗透调节物质来响应干旱胁迫,还会调动酶促保护系统相互协作,共同清除自由基,SOD通过将H2O2分解为O2-从而防御自由基对细胞产生的破坏,产生的O2-再由CAT 进一步消除[14]。本研究中大部分猕猴桃种质资源SOD 活性呈先上升后下降的趋势,说明在SOD和CAT在前中期的干旱胁迫中起作用,激活了抗旱性保护机制,酶活性增强,协同清理自由基,在接受外界环境变化刺激以后,用以抵御外界逆境环境的变化[19]。在后期,干旱敏感的猕猴桃砧木SOD和CAT活性下降,说明随着干旱胁迫时间的延长,活性氧等有害物质持续积累,超出了植物三大保护酶的清除能力,植物体内环境平衡被破坏,酶活性降低。
笔者鉴定到的Ethylene-responsive transcription factor RAP2-4 like 属于AP2/ERF 转录因子家族,为植物所特有。AP2/ERF 转录因子AP2 结构域能够识别干旱(DRE/CRT)和冷诱导(A/GCCGAC)响应元件,对植物抵抗干旱和低温等非生物胁迫至关重要[20-21]。在拟南芥中,RAP2.4 被证实能够通过激活叶片表皮蜡质的生物合成途径提高植株对干旱胁迫的耐受性[22]。与拟南芥RAP2.4 序列同源性最高的Medicago truncatula WXP1 在转基因苜蓿中同样表现出更强的耐旱性[23]。蔗糖合酶3(sucrose synthase 3)广泛参与植物对干旱胁迫响应的过程,Lu等[24]的研究表明,高粱在10%PEG 6000 模拟干旱处理时,SbSusy3 基因的表达量在最初的12 h 内持续上升。大麦的HvSus3 基因在干旱胁迫的第10 天与对照相比,表达量上调了约4倍[25]。此外,Chen等[26]的研究表明,在干旱胁迫条件下,黄瓜的CsSus3 基因表达上调,不仅增强了蔗糖合酶的活性,还促进了己糖的积累。这一过程可能通过加速植物生长和清除活性氧(ROS)来增强黄瓜的抗旱能力。植物Alpha-dioxygenase可用于产生脂质衍生分子,从而保护植物组织免受氧化应激和细胞死亡[27],而EARLY FLOWERING like 主要参与植物的开花过程[28],本研究为上述基因在抗旱中的功能研究开拓了新的视角。
4 结 论
4 份材料中,美味猕猴桃(A.deliciosa)Bruno 抗旱能力最弱,对萼猕猴桃(A.valvata)DJY-DE-1抗旱能力最强,TRINITY_DN11629_c0_g1(Ethylene-responsive transcription factor RAP2-4 like)、TRINITY_DN257031_c0_g1(Sucrose synthase 3)、TRINITY_DN3814_c0_g1(Protein EARLY FLOWERING like)和TRINITY_DN16120_c0_g1(Alpha-dioxygenase)4 个差异表达基因可能通过调控猕猴桃植株的生理变化参与抗旱过程。
[1] 何科佳,王中炎,王仁才.高温干旱强光对猕猴桃生长发育的影响及其生理基础[J].湖南农业科学,2005(3):42-44.HE Kejia,WANG Zhongyan,WANG Rencai.Effects of high temperature,drought and strong light on kiwifruit growth and development and their physiology[J].Hunan Agricultural Sciences,2005(3):42-44.
[2] 冯瑛.樱桃砧木抗旱性评价及应对干旱胁迫响应的生理和分子机制[D].杨凌:西北农林科技大学,2019.FENG Ying.Evaluation on drought resistance of cherry rootstocks and study on the physiological and molecular mechanism to drought stress[D].Yangling:Northwest A & F University,2019.
[3] 周兴元,曹福亮.遮阴对假俭草抗氧化酶系统及光合作用的影响[J].南京林业大学学报(自然科学版),2006,30(3):32-36.ZHOU Xingyuan,CAO Fuliang.Effects of shading on the antioxidant enzymatic system and photosynthesis of centipedegrass[J].Journal of Nanjing Forestry University(Natural Sciences Edition),2006,30(3):32-36.
[4] 曹潘攀.蝴蝶花对干旱和遮阴胁迫的生理响应研究[D].雅安:四川农业大学,2019.CAO Panpan.Physiological response of Iris japonica to drought and shade stress[D].Yaan:Sichuan Agricultural University,2019.
[5] GULENTURK C,ALP-TURGUT F N,ARIKAN B,TOFAN A,OZFIDAN-KONAKCI C,YILDIZTUGAY E.Polyamine,1,3-diaminopropane,regulates defence responses on growth,gas exchange,PSII photochemistry and antioxidant system in wheat under arsenic toxicity[J].Plant Physiology and Biochemistry,2023,201:107886.
[6] 杨秋悦,罗影子,杨洋,阮宝丽,黄明进.干旱胁迫对铁皮石斛生理及不同部位活性成分的影响[J].江苏农业科学,2023,51(13):142-149.YANG Qiuyue,LUO Yingzi,YANG Yang,RUAN Baoli,HUANG Mingjin.Influences of drought stress on physiology and active components of different parts of Dendrobium officinale[J].Jiangsu Agricultural Sciences,2023,51(13):142-149.
[7] 唐佳莉,姬新颖,郑旭,李敖,张俊佩.盐胁迫下东部黑核桃生理生化与营养器官结构的动态响应[J].果树学报,2024,41(2):294-313.TANG Jiali,JI Xinying,ZHENG Xu,LI Ao,ZHANG Junpei.Dynamic responses of physiology,biochemistry and structure of vegetative organs of Juglans nigra to salt stress[J].Journal of Fruit Science,2024,41(2):294-313.
[8] XIAO B Z,CHEN X,XIANG C B,TANG N,ZHANG Q F,XIONG L Z.Evaluation of seven function-known candidate genes for their effects on improving drought resistance of transgenic rice under field conditions[J].Molecular Plant,2009,2(1):73-83.
[9] WANG S C,LIANG D,LI C,HAO Y L,MA F W,SHU H R.Influence of drought stress on the cellular ultrastructure and antioxidant system in leaves of drought-tolerant and drought-sensitive apple rootstocks[J].Plant Physiology and Biochemistry,2012,51:81-89.
[10] 李兴亮,张军科,李民吉,周贝贝,周佳,张强,魏钦平.不同类型苹果矮化砧木抗旱评价与基因表达分析[J].农业生物技术学报,2018,26(3):401-409.LI Xingliang,ZHANG Junke,LI Minji,ZHOU Beibei,ZHOU Jia,ZHANG Qiang,WEI Qinping.Evaluation and gene expression analysis of different apple (Malus × domestica) dwarfing stocks on drought resistance[J].Journal of Agricultural Biotechnology,2018,26(3):401-409.
[11] SAIBO N J M,LOURENÇO T,OLIVEIRA M M.Transcription factors and regulation of photosynthetic and related metabolism under environmental stresses[J].Annals of Botany,2009,103(4):609-623.
[12] ZHANG Z H,QU J Y,LU M,ZHAO X Y,XU Y,WANG L,LIU Z J,SHI Y Y,LIU C T,LI Y P,WANG C,XU M L,NAN Z J,CAO Q Q,PAN J B,LIU W D,LI X R,SUN Q P,WANG W X.The maize transcription factor CCT regulates drought tolerance by interacting with Fra a 1,E3 ligase WIPF2,and auxin response factor Aux/IAA8[J].Journal of Experimental Botany,2024,75(1):103-122.
[13] 樊卫国,李迎春.部分梨砧木的叶片组织结构与抗旱性的关系[J].果树学报,2008,25(1):17-21.FAN Weiguo,LI Yingchun.Study on the relationship between lamina anatomical structure and drought resistance of pear rootstocks[J].Journal of Fruit Science,2008,25(1):17-21.
[14] 魏桦.不同猕猴桃种质资源抗旱性及抗寒性综合评价[D].杨凌:西北农林科技大学,2021.WEI Hua.Comprehensive evaluation of drought resistance and cold resistance of different germplasm of kiwifruit[D].Yangling:Northwest A&F University,2021.
[15] 贾鑫,孙窗舒,李光跃,李国斌,陈贵林.干旱胁迫对蒙古黄芪生长和生理生化指标及其黄芪甲苷积累的影响[J].西北植物学报,2018,38(3):501-509.JIA Xin,SUN Chuangshu,LI Guangyue,LI Guobin,CHEN Guilin.Effect of drought stress on the growth and physiological characteristics and the accumulation of astragaloside Ⅳsecondary metabolites of Astragalus membranaceus(Fisch.)var.mongholicus (Bge.) Hsiao[J].Acta Botanica Boreali-Occidentalia Sinica,2018,38(3):501-509.
[16] 杨艳,陈景震,吉悦娜,陈韵竹,李培旺,叶传财,李力,潘雨虹,夏栗,李党训.紫色土干旱胁迫对栀子生长及生理的影响[J].湖南林业科技,2023,50(5):28-33.YANG Yan,CHEN Jingzhen,JI Yuena,CHEN Yunzhu,LI Peiwang,YE Chuancai,LI Li,PAN Yuhong,XIA Li,LI Dangxun.Effects of drought stress on growth and physiological indexes of Gardenia jasminoides in purple soil[J].Hunan Forestry Science&Technology,2023,50(5):28-33.
[17] 胡晓健,杨春霞,谭世才,谷振军,唐山,喻方圆.干旱胁迫对不同种源马尾松幼苗中脯氨酸及内源激素含量的影响[J].南方林业科学,2020,48(6):24-28.HU Xiaojian,YANG Chunxia,TAN Shicai,GU Zhenjun,TANG Shan,YU Fangyuan.Effects of drought stress on proline and endogenous hormones content in Pinus massoniana seedlings from different provenances[J].South China Forestry Science,2020,48(6):24-28.
[18] 汪娅琴,郭小兰,李培培,王德炉.4 个兔眼蓝莓品种对持续干旱的生理响应及其抗旱性评价[J].经济林研究,2021,39(3):186-196.WANG Yaqin,GUO Xiaolan,LI Peipei,WANG Delu.Physiological response of four rabbit- eye blueberry cultivars to drought stress and evaluation of drought resistance[J].Nonwood Forest Research,2021,39(3):186-196.
[19] 陈钏.PEG 模拟干旱胁迫对福建山樱花种子萌发及幼苗生理的影响[D].长沙:中南林业科技大学,2022.CHEN Chuan.Effect of PEG stress on seed germination and seedling physiological of Cerasus campanulata cherry[D].Changsha:Central South University of Forestry & Technology,2022.
[20] XIE Z L,NOLAN T,JIANG H,TANG B Y,ZHANG M C,LI Z H,YIN Y H.The AP2/ERF transcription factor TINY modulates brassinosteroid- regulated plant growth and drought responses in Arabidopsis[J].The Plant Cell,2019,31(8):1788-1806.
[21] JIANG W,PAN R,WU C,XU L,ABDELAZIZ M E,OELMÜLLER R,ZHANG W Y.Piriformospora indica enhances freezing tolerance and post-thaw recovery in Arabidopsis by stimulating the expression of CBF genes[J].Plant Signaling &Behavior,2020,15(4):1745472.
[22] YANG S U,KIM H,KIM R J,KIM J,SUH M C.AP2/DREB transcription factor RAP2.4 activates cuticular wax biosynthesis in Arabidopsis leaves under drought[J].Frontiers in Plant Science,2020,11:895.
[23] ZHANG J Y,BROECKLING C D,BLANCAFLOR E B,SLEDGE M K,SUMNER L W,WANG Z Y.Overexpression of WXP1, a putative Medicago truncatula AP2 domain-containing transcription factor gene,increases cuticular wax accumulation and enhances drought tolerance in transgenic alfalfa (Medicago sativa)[J].Plant Journal,2005,42(5):689-707.
[24] LU Y L,HAN S P,ZHOU C,CHENG Y W,LV Y,ZENG G J,ZHANG D C,GAO X Q,HU Y F,SHEN X L.Molecular identification and expression analysis of five sucrose synthase genes in Sorghum bicolor[J].Physiology and Molecular Biology of Plants,2022,28(4):697-707.
[25] BARRERO- SICILIA C, HERNANDO- AMADO S,GONZÁLEZ-MELENDI P,CARBONERO P.Structure,expression profile and subcellular localisation of four different sucrose synthase genes from barley[J].Planta,2011,234(2):391-403.
[26] CHEN L,ZHENG F H,FENG Z L,LI Y,MA M X,WANG G P,ZHAO H B.A vacuolar invertase CsVI2 regulates sucrose metabolism and increases drought tolerance in Cucumis sativus L.[J].International Journal of Molecular Sciences,2021,23(1):176.
[27] DE LEÓN I P,SANZ A,HAMBERG M,CASTRESANA C.Involvement of the Arabidopsis alpha-DOX1 fatty acid dioxygenase in protection against oxidative stress and cell death[J].Plant Journal,2002,29(1):61-62.
[28] TIAN M M,WU A M,ZHANG M,ZHANG J J,WEI H L,YANG X,MA L,LU J H,FU X K,WANG H T,YU S X.Genome-wide identification of the Early flowering 4 (ELF4) gene family in cotton and silent GhELF4-1 and GhEFL3-6 decreased cotton stress resistance[J].Frontiers in Genetics,2021,12:686852.