猕猴桃(Actinidia spp.)隶属猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia Lindl.),是一种重要的经济作物,由于其果实风味独特、营养丰富、抗坏血酸含量高而备受关注[1-2]。根据联合国粮食及农业组织(FAO)最新数据,2022年我国猕猴桃收获面积近20万hm2,占全球的70%;年产量是238 万t,占全球的52%,远超意大利、新西兰、伊朗、希腊等国家[3-4]。猕猴桃细菌性溃疡病是丁香假单胞杆菌猕猴桃致病变种(Pseudomonas syringae pv.actinidiae,Psa)引起的病害,该病害于1984年在日本静冈的美味猕猴桃上首次报道,目前已成为世界猕猴桃生产的最大制约因素,严重危害产业健康发展[4]。生产上对猕猴桃溃疡病防治以防御性措施为主,如避雨栽培和一些化学药剂(铜制剂、春雷霉素等抗生素)。但这些措施的使用会增加生产成本,也不利于猕猴桃产业的绿色健康发展[5]。因此,挖掘和筛选抗性品种对溃疡病的控制至关重要[6]。中国拥有丰富的猕猴桃种质资源,对猕猴桃种质进行抗溃疡病评价,挖掘可利用的优质猕猴桃种质资源,从中筛选出抗病性较强的种质,可为品种抗病遗传改良奠定重要基础。
植物在长期适应环境的过程中,为抵御微生物病原体的侵染,进化出组成型和诱导型防御机制[7]。
植物本身的形态结构构成阻止病原菌渗透的组成型防御机制,如叶片厚度、栅栏组织厚度、下表皮厚度、海绵组织厚度、气孔大小和密度等。研究发现枇杷叶斑病抗性与叶片厚度、海绵组织厚度和气孔密度显著相关[8];核桃叶片的气孔长度和面积与疫病病情指数呈显著正相关,海绵组织与栅栏组织厚度比与病情指数呈显著负相关,海绵组织越密集、栅栏组织越发达,品种的抗性就越强[9]。脐橙抗溃疡病品种的气孔密度和大小都明显低于感病品种[10];猕猴桃溃疡病抗性与叶片的气孔密度和长度呈负相关,与全叶厚度呈正相关[11-12]。
病原菌突破组成型防御后会引起植物启动诱导型防御机制,产生一系列生理生化反应增强寄主对病菌的抗性。植物抵御病原菌侵染的第一步就是诱导合成酚类物质,如植保素、木质素等酚类化合物[13]。水稻总酚含量与细菌性枯萎病抗性呈显著正相关[14];石榴枯萎病抗性品种中总酚、类黄酮和抗氧化物质含量相对更高[15]。糖类物质不仅是植物体内的能量储存和转移介质,也是病原菌繁殖的营养物质,其含量变化与抗病性密切相关。相较于感病品种,杧果角斑病抗性品种的可溶性糖含量更高[16],猕猴桃溃疡病抗病品种、棉花黄萎病抗病品种的木质素含量明显高于感病品种[17-19]。
中国是猕猴桃原产地,野生猕猴桃种质资源丰富。全世界猕猴桃属植物共有54 个种,21 个变种,中国分布有52 个种,其中有44 个种为中国特有[20]。目前商业栽培猕猴桃品种主要由中华猕猴桃和美味猕猴桃驯化培育而来[21],对溃疡病抗性较差。野生猕猴桃种质资源中含有丰富的抗性基因,但大量的野生猕猴桃资源并未开展溃疡病抗性评价,种质抗感性与抗性生理指标的关系研究报道也较少。宋雅林等[22]发现29 个不同猕猴桃品种对溃疡病抗病性具有显著差异。温欣等[23]对51 份软枣猕猴桃种质的溃疡病抗性进行分析,发现中高抗资源33 份,中抗资源18 份。李黎等[24]对国家猕猴桃资源圃中29个种82份种质资源进行了抗性评价,发现不同猕猴桃种质的抗性差异显著,筛选到高抗种质5份,中抗种质9份。笔者在本研究中以国家猕猴桃资源圃中的84份山梨63101与中华猕猴桃磨山雄7号杂交群体为材料,基于离体枝条接种进行溃疡病抗性鉴定,并选取19个抗性不同的株系对叶片结构、气孔器特征和生理生化指标进行分析,明确与抗病相关的指标,为猕猴桃抗性资源利用和抗性育种提供理论依据。
1 材料和方法
1.1 材料
供试菌株Psa M228 为猕猴桃溃疡病病原菌丁香假单胞菌猕猴桃致病变种Pseudomonas syringae pv.actinidiae(Psa),由西北农林科技大学果树病害病原生物学及综合防治研究团队实验室提供[25],中国科学院武汉植物园植物种质创新与特色农业重点实验室保存。
2019 年,武汉植物园猕猴桃课题组选择母本(山梨猕猴桃63101)与父本(中华猕猴桃磨山雄7号)进行杂交,获得的种子进行播种,共得到后代252株,倍性均为2倍体,树势生长良好,均保存于国家猕猴桃资源圃内,选择其中84株为试验材料。
1.2 方法
1.2.1 菌株培养 将供试菌株M228 接种于LB 固体培养基活化培养,于25 ℃下培养36 h后,挑取单菌落至5 mL 液体LB 培养基中。于28°C、180 r·min-1摇床上培养过夜,12 000 r·min-1离心5 min,取沉淀,用无菌水稀释悬浮液至OD600=1,浓度为109 CFU·mL-1,备试验使用。
1.2.2 采用离体枝条进行接种 分别于2022 年冬和2023 年冬选取直径约为0.8 cm 长势一致且健康的1 年生枝条,剪成12~14 cm 的小枝条,用石蜡封住枝条两端,防止水分流失;用75%乙醇对枝条进行表面消毒,用打孔器在枝条中部切割伤口,切口3 mm 宽,深至木质部,伤口上滴加10µL的菌液;每种材料接种6 根枝条,以无菌水为对照。待菌液完全风干后,置于底部铺有湿滤纸的托盘中,伤口朝上,用保鲜膜覆盖密封保证枝条水分,托盘内留有多余水分,内部湿度保持80%,放于16°C、16 h光照/8 h黑暗条件下培养;培养42 d后用无菌刀削去枝条外皮层,观察测量病菌侵染后形成的病斑。根据枝条病斑长度进行种质抗性等级划分,参照裴艳刚等[26]及Wang等[27]的方法略作调整:抗病(resistant,R),病斑长度≤7.0 mm;耐病(tolerant,T),7.0 mm<病斑长度≤9.0 mm;感病(susceptible,S),9.0 mm<病斑长度≤11.0 mm;高感(high susceptible,HS),病斑长度>11.0 mm。
1.2.3 石蜡切片与观察 参照张俊环等[28]的方法略作调整:使用番红-固绿对染的方法制作切片,切取1 cm×1 cm 新鲜叶片组织,放入FAA 固定液中固定24 h以上,再经脱水、透明、浸蜡、包埋、切片处理,最后用番红-固绿染色,树脂胶封片。制作完成的切片由武汉赛维尔生物科技有限公司进行全视野数字切片扫描(whole slide imaging),通过CaseViewer 2.4软件测量叶片上表皮厚度、下表皮厚度、海绵组织厚度及栅栏组织厚度等生理指标。
1.2.4 扫描电镜观察 参照胡光明等[29]的方法略作调整:切取1 cm×0.5 cm大小的新鲜叶片组织,用4%的甲醛室温固定2 h,再转移至4 ℃保存;将固定好的样品依次转入30%、50%、75%、90%和100%5 个浓度梯度的乙醇中脱水,每次40 min;脱水后的样品放进二氧化碳临界点干燥仪内进行干燥后转入离子溅射镀膜仪日立样品台进行喷金处理;最后利用台式扫描电镜观察并拍照,用Image-J图像处理软件分别对气孔密度和气孔长度、宽度进行测量,并将密度相关指标换算成每平方毫米的数目。
1.2.5 生理生化指标测定 参考李小方等[30]《植物生理学实验指导》测量生理指标。总酚(TP)含量采用福林酚法测定,称取0.1 g 新鲜样本,加入1.5 mL的60%乙醇研磨后,60 ℃水浴振荡提取2 h,离心后取上清液待测。可溶性糖(SS)含量采用蒽酮比色法测定,取待测样本0.1 g,加入1 mL水,研磨后沸水浴10 min后,离心取上清液稀释50倍后待测。取总酚、可溶性糖待测液,按照南京建成生物工程研究所提取试剂盒说明书加入试剂提取,利用多功能酶标仪测量。样本研磨后使用武汉力博瑞公司ELISA科研试剂盒提取木质素,并计算木质素含量。每个生理生化指标测定3次重复,取平均值。
1.3 数据统计
所有指标用Excel 2019整理,利用SPSS 21.0软件对数据进行单因素方差分析(one-way ANOVA)和Duncan’s 差异显著性检验和Pearson 相关性分析,表中数据用平均值±标准误差表示。
2 结果与分析
2.1 山梨中华群体种质抗性评价
以东红为对照,连续2 a(年)对杂交群体进行离体枝条接种试验,根据病斑长度从低到高划分为四个抗性等级:抗病(R)、耐病(T)、感病(S)、高感(HS)。从表1和图1中可以看出84份种质枝条发病后病斑大小有差异显著,病斑长度在3~22 mm 之间。84 份种质中含抗病种质67 份,占比79.76%;耐病种质13 份,占比15.48%;感病种质3 份,占比3.57%;高感种质仅有1份,占比1.19%。其中杂交群体母本(山梨猕猴桃63101)的病斑均值为4.24 mm,父本(中华猕猴桃磨山雄7号)的病斑均值为7.32 mm。由表1 中结果可以得出二者杂交所产生的后代群体抗性较强,抗病种质总体占比高达79.76%。2022 年枝条接种结果与2023 年接种结果之间相关系数为0.77,呈显著相关,说明群体抗性比较稳定(图2)。
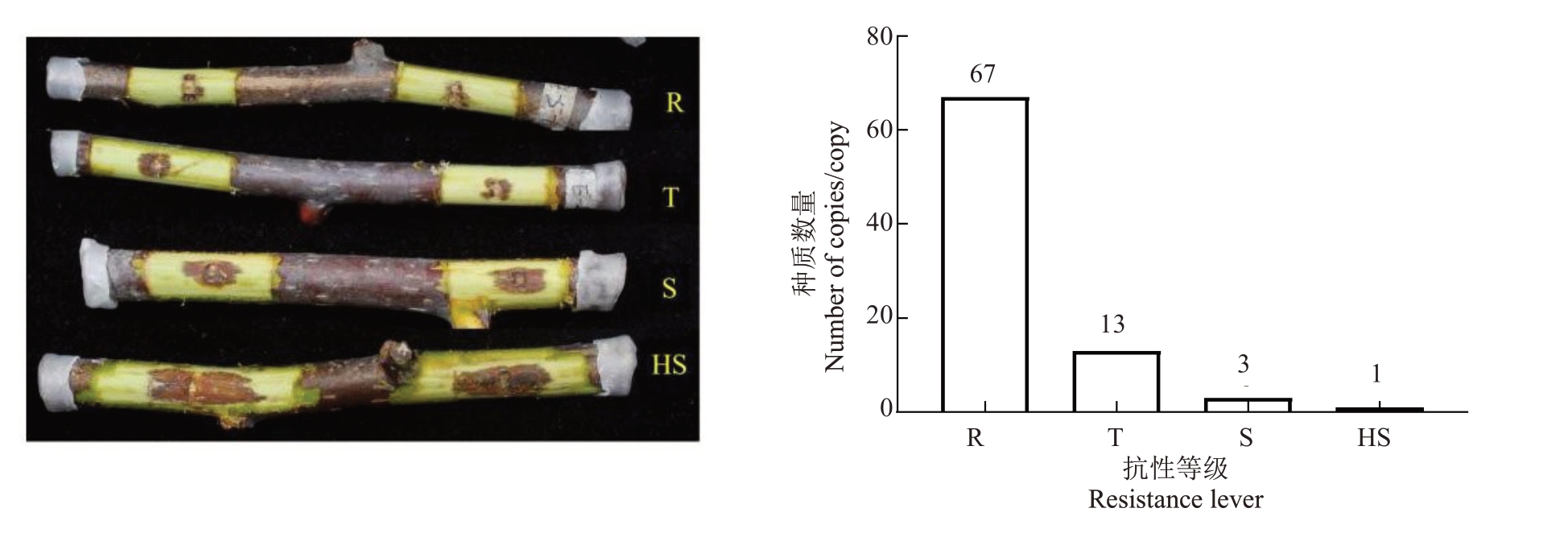
图1 不同抗性等级对应的病斑示例及对应等级种质数量
Fig.1 Lesion corresponding to different resistance degrees and the number of different resistance categories
A.抗病等级示意图;B.抗病种质数目分布图。R.抗病;T.耐病;S.感病;HS.高感。下同。
A.The lesion of four resistance degree on detached branches;B.Germplasm number of different resistance categories.R.Resistant;T.Tolerant;S.Susceptible;HS.High susceptible.The same below.
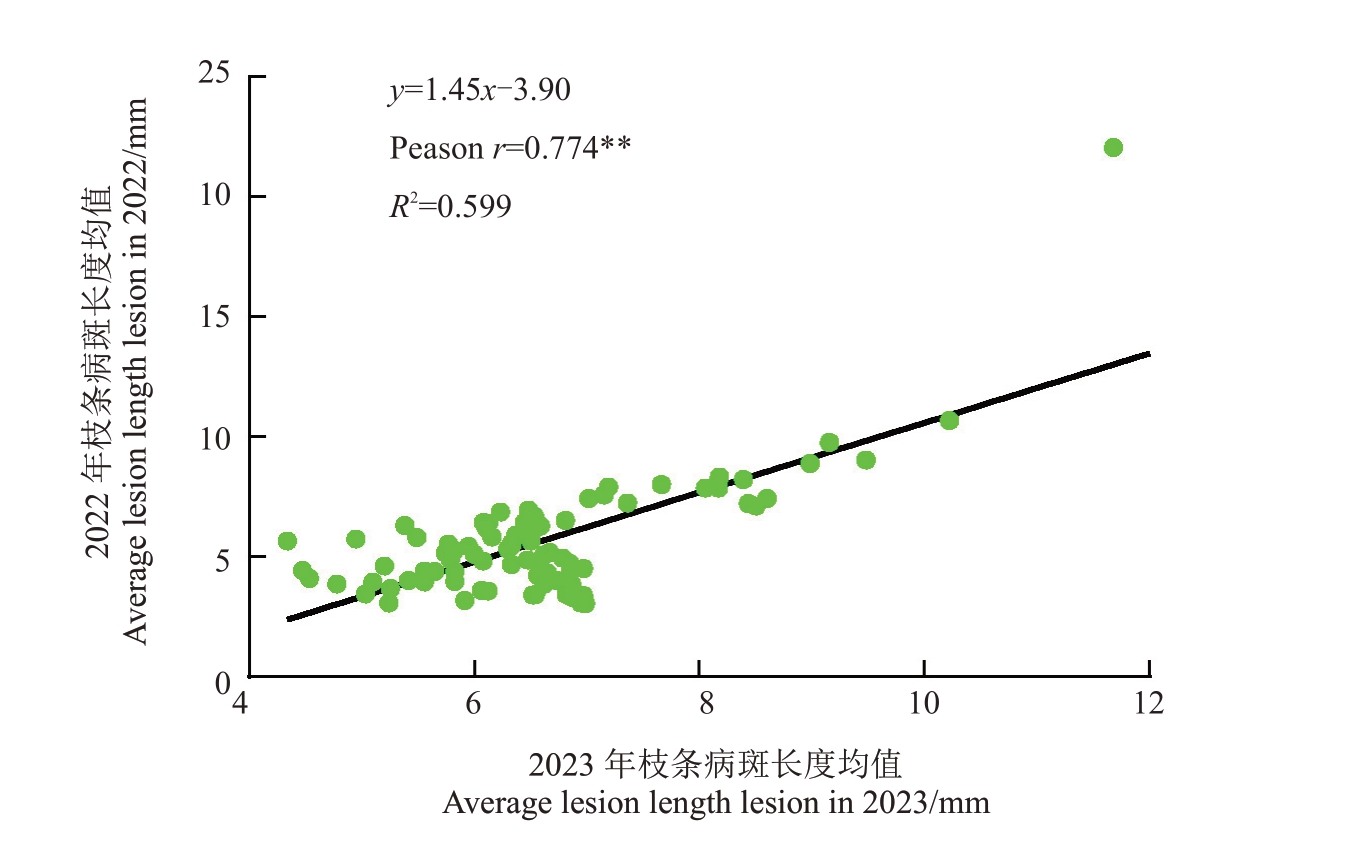
图2 2022、2023 年种质的枝条病斑长度相关性
Fig.2 Correlation of average lesion between 2022 and 2023
表1 连续2 a 群体枝条平均病斑长度及抗性等级
Table 1 The average lesion and resistance grade of the detached branches of two consecutive years

种质资源Germplasm resource 2022年枝条病斑长度Lesion length of 2022/mm抗性等级Resistance category 2023年枝条病斑长度Lesion length of 2023/mm抗性等级Resistance category两年平均枝条病斑长度Average lesion length of two years/mm综合抗性等级Combined resistance category E1032 E1051 E1125 E1131 E125 E1334 E1441 E153 E1531 E1544 E172 E1822 E1853 E2012 E2064 E2135 E2241 E225 E2353 E2441 E2532 E2545 E263 E2663 E2732 E2751 E3031 E3041 E3061 E3082 E3152 E3173 E3181 E3223 E3242 E3261 E3381 E364 E451 E525 E533 E643 E674 E721 E771 E782 6.95±0.47 5.83±0.21 7.42±0.59 7.21±0.33 6.42±0.19 6.95±0.17 5.91±0.21 8.23±0.27 4.43±0.38 5.10±0.21 7.87±0.30 3.95±0.05 6.38±0.22 7.86±0.24 7.24±0.17 9.75±0.47 5.46±0.36 4.38±0.17 5.8±0.21 7.58±0.37 8.32±0.29 5.65±0.29 5.26±0.29 7.42±0.17 5.54±0.26 6.04±0.30 4.43±0.15 5.57±0.23 6.17±0.29 6.43±0.28 5.43±0.21 7.92±0.21 6.86±0.25 8.00±0.40 6.27±0.19 6.52±0.16 5.16±0.24 5.73±0.06 6.31±0.36 4.09±0.18 3.87±0.09 4.61±0.15 10.67±0.55 3.94±0.17 8.89±0.36 4.41±0.25 R R T T R R R T R R T R R T T S R R R T T R R T R R R R R R R T R T R R R R R R R R S R T R 6.10±0.46 6.16±0.35 8.60±0.60 8.44±0.13 6.08±0.36 6.48±0.36 6.37±0.36 8.40±0.25 6.86±0.28 6.00±0.30 8.06±0.24 5.56±0.11 6.13±0.33 8.17±0.30 7.36±0.26 9.16±0.53 6.34±0.32 5.83±0.31 5.49±0.26 7.15±0.35 8.18±0.24 4.34±0.20 5.82±0.17 7.02±0.41 5.77±0.22 6.52±0.39 4.47±0.46 6.34±0.37 6.11±0.26 6.45±0.44 5.95±0.22 7.19±0.41 6.24±0.19 7.66±0.30 6.59±0.17 6.81±0.17 5.74±0.19 4.95±0.21 5.39±0.16 4.53±0.28 6.62±0.29 5.20±0.40 10.22±0.54 5.10±0.23 8.98±0.50 5.56±0.08 R R T T R R R T R R T R R T T S R R R T T R R T R R R R R R R T R T R R R R R R R R S R T R 6.53±0.42 6.00±0.16 8.01±0.59 7.82±0.61 6.25±0.17 6.71±0.23 6.14±0.23 8.31±0.08 5.64±1.22 5.55±0.45 7.96±0.09 4.75±0.81 6.25±0.12 8.02±0.15 7.3.0±0.06 9.45±0.30 5.90±0.44 5.10±0.72 5.65±0.16 7.37±0.21 8.25±0.07 4.99±0.65 5.54±0.28 7.22±0.20 5.65±0.12 6.28±0.24 4.45±0.02 5.95±0.39 6.14±0.03 6.44±0.01 5.69±0.26 7.55±0.36 6.55±0.31 7.83±0.17 6.43±0.16 6.67±0.15 5.45±0.29 5.34±0.39 5.85±0.46 4.31±0.22 5.25±1.38 4.91±0.30 10.45±0.22 4.52±0.58 8.94±0.05 4.98±0.58 R R T T R R R T R R T R R T T S R R R T T R R T R R R R R R R T R T R R R R R R R R S R T R
表1 (续) Table 1 (Continued)
注:Pearson 相关性分析,**表示存在极显著相关性。下同。
Note:Pearson correlation analysis,**indicates highly significant correlation.The same as below.
种质资源Germplasm resource 2022年枝条病斑长度Lesion length of 2022/mm抗性等级Resistance category 2023年枝条病斑长度Lesion length of 2023/mm抗性等级Resistance category两年平均枝条病斑长度Average lesion length of two years/mm综合抗性等级Combined resistance category E844 E941 F1111 F1143 F1181 F1371 F1492 F1543 F1563 F1583 F1665 F192 F2034 F2103 F2361 F2374 F2463 F2745 F282 F2824 F2865 F2942 F2964 F3031 F3125 F3141 F3365 F351 F4132 F442 F482 F492 F5143 F572 F852 F915 F971 F993东红对照Comparison of Donghong相关系数Correlation coefficient,r线性方程Linear equation 4.67±0.24 6.68±0.25 5.33±0.32 4.33±0.15 4.94±0.12 5.66±0.35 22.05±1.71 4.82±0.22 4.39±0.38 3.3±0.11 4.52±0.26 3.18±0.17 4.90±0.23 4.02±0.17 4.86±0.22 5.07±0.68 3.86±0.16 4.00±0.38 3.08±0.05 3.86±0.14 4.71±0.14 9.04±0.10 3.43±0.06 7.12±0.43 5.18±0.61 3.39±0.09 4.48±0.15 3.40±0.12 3.08±0.11 3.68±0.06 3.97±0.08 3.99±0.10 4.21±0.14 3.58±0.05 3.44±0.08 3.05±0.18 3.42±0.14 3.59±0.09 13.20±0.63 R R R R R R H S R R R R R R R R R R R R R R S R T R R R R R R R R R R R R R R HS 6.33±0.10 6.53±0.34 6.30±0.50 6.65±0.35 6.79±0.22 6.50±0.99 11.68±0.34 6.08±0.18 5.65±0.37 6.87±0.43 6.97±0.43 5.92±0.54 5.79±0.46 5.41±0.31 6.47±0.27 6.62±0.60 4.78±0.21 6.73±0.35 5.24±0.32 6.87±0.21 6.85±0.28 9.48±0.44 6.82±0.37 8.5±0.54 6.67±0.39 6.97±0.31 6.60±0.32 6.52±0.27 6.95±0.17 5.25±0.28 5.83±0.23 5.82±0.29 6.57±0.27 6.12±0.22 5.03±0.24 6.99±0.44 6.54±0.28 6.07±0.19 12.29±0.53 R R R R R R H S R R R R R R R R R R R R R R S R T R R R R R R R R R R R R R R HS 5.50±0.83 6.61±0.07 5.82±0.49 5.49±1.16 5.87±0.92 6.08±0.42 16.87±5.18 5.45±0.63 5.02±0.63 5.09±1.78 5.75±1.23 4.55±1.37 5.34±0.45 4.72±0.70 5.67±0.81 5.84±0.78 4.32±0.46 5.37±1.37 4.16±1.08 5.36±1.50 5.78±1.07 9.26±0.22 5.12±1.7 7.81±0.69 5.92±0.75 5.18±1.79 5.54±1.06 4.96±1.56 5.01±1.94 4.47±0.79 4.90±0.93 4.91±0.91 5.39±1.18 4.85±1.27 4.24±0.80 5.02±1.97 4.98±1.56 4.83±1.24 12.75±0.45 R R R R R R H S R R R R R R R R R R R R R R S R T R R R R R R R R R R R R R R HS 0.774**y=1.45x-3.90
2.2 不同抗性猕猴桃种质叶片组织结构比较
选取19 份抗病性存在差异的种质进行叶片组织结构比较(表2),可见猕猴桃叶片结构均由表皮、叶肉细胞和叶脉组成,上下表皮细胞均由一层体积较大、形状不规则、紧密贴合的单层细胞构成。叶片栅栏组织与海绵组织分化明显,为典型的异面叶。栅栏组织紧密排列呈栅状,垂直于上表皮细胞下方,内含大量的叶绿体。海绵组织位于栅栏组织与下表皮之间,排列疏松,呈海绵状。研究结果表明,19份种质的栅栏组织厚度分布在75.3~136.29 μm 之间,与病斑值无显著相关性。海绵组织厚度分布在74.47~130.05 μm之间,与枝条病斑长度值呈显著正相关,即病斑长度越长,抗性越低,则海绵组织越厚。种质上表皮厚度分布在28.70~11.60 μm 之间,比下表皮厚度(14.93~8.36 μm)要大,但上下表皮厚度与猕猴桃抗病能力不相关。
表2 不同猕猴桃种质叶片组织结构与枝条病斑长度的相关性
Table 2 Correlation between leaf tissue structure and lesion on detached branches of different kiwifruit germplasm

注:Duncan's 显著性检验,同列数据后不同小写字母表示不同种质资源间差异显著(p<0.05)。下同。
Note: Duncan's test of significance, different small leters in the same column indicate significant diference among diferent germplasm resources(p<0.05).The same as below.
下表皮厚度Thickness of lower epidermis cell/μm 9.52±0.27 fgh 14.93±0.56 a 9.23±0.55 gh 9.66±0.43 efgh 10.88±0.71 cdefg 8.90±0.69 gh 9.29±0.81 gh 13.08±0.57 abc 9.98±0.41 efgh 10.74±0.75 cdefgh 10.63±0.62 defgh 8.36±0.49 h 14.18±1.09 ab 10.57±1.07 defgh 12.59±0.57 bcd 11.97±0.85 bcde 11.81±0.64 cdef 9.98±0.82 efgh 10.9±0.83 cdefg 0.12 y=0.12x+10.08种质资源Germplasm resource E2545 E3031 E525 F2463 E364 F852 E721 E451 F1181 E2441 E3173 F4142 E2064 E172 E2532 E1131 E1125 E771 E674相关系数Correlation coefficient,r线性方程Linear equation病斑长度均值Average lesion length/mm 4.34±0.20 e 4.47±0.46 e 4.53±0.28 e 4.78±0.21 e 4.95±0.21 e 5.03±0.24 e 5.10±0.23 e 5.39±0.16 e 6.79±0.22 d 7.15±0.35 cd 7.19±0.41 cd 7.32±0.44 cd 7.36±0.26 cd 8.06±0.24 bc 8.18±0.24 bc 8.44±0.13 b 8.60±0.60 b 8.98±0.50 b 10.22±0.54 a抗性等级Resistance category R R R R R R R R R T T T T T T T T T S海绵组织厚度Thickness of spongy tissue/μm 83.91±0.80 o 53.09±0.63 q 88.17±0.69 l 120.9±0.77 c 85.25±0.97 n 85.67±0.97 m 89.19±0.92 l 96.99±1.06 j 106.34±0.60 g 100.63±1.05 i 103.65±0.55 h 102.62±0.61 hi 113.87±0.42 e 74.47±0.72 p 110.97±0.61 f 126.26±0.40 b 116.11±0.61 d 93.17±0.61 k 130.05±0.74 a 0.584**y=-6.14x+58栅栏组织厚度Thickness of palisade tissue/μm 87.93±1.00 i 97.00±1.74 h 104.26±1.12 g 90.82±1.37 i 136.29±1.85 b 121.26±1.23 d 75.30±0.61 j 111.45±1.21 ef 73.94±2.44 j 105.44±0.78 fg 164.13±3.65 a 126.73±1.67 c 104.06±2.95 g 108.99±0.88 efg 96.84±1.70 h 108.54±2.15 efg 111.84±2.93 e 88.76±1.95 i 106.49±3.41 efg 0.09 y=1.10x+98.96上表皮厚度Thickness of upper epidermiscell/μm 17.69±0.60 cd 26.59±0.92 ab 15.57±0.54 cd 18.28±1.76 bcd 18.04±1.39 bcd 11.60±0.70 d 16.45±0.83 cd 17.52±0.92 cd 14.68±0.90 cd 16.60±0.84 cd 28.70±11.12 a 17.10±0.95 cd 20.02±1.57 bcd 22.88±1.14 abc 17.32±1.20 cd 18.64±0.88 bcd 15.44±0.70 cd 23.71±1.60 abc 21.57±1.19 abc 0.24 y=0.56x+15.1
2.3 不同抗性猕猴桃种质气孔特征比较
19 份猕猴桃种质气孔特征如表3 所示,气孔均分布在下表皮,形状为椭圆形或宽圆形,气孔器由两个肾形保卫细胞组成。密度分布在855.2~331.05个·mm-2,其中同一视野中E674 气孔密度最大,为855.2 个·mm-2,其病斑长度均值最长,抗病性最差;E2545 气孔密度最小,为331.05 个·mm-2,其病斑长度均值最小,抗病性最强。气孔长度分布在16.78~7.68 μm 之间,其中抗性最强种质为E2545,气孔长度为7.68 μm;抗性最弱种质为E674,气孔长度为16.78 μm。由此可见,随着抗性降低,猕猴桃种质的叶片气孔密度与气孔长度增大。气孔宽度最大为2.68 μm,最小为1.02 μm。其中E2545抗性最强,气孔宽度为1.27 mm,E674抗性最弱,气孔宽度为1.61 mm。
表3 不同猕猴桃种质叶片气孔特征与溃疡病病斑长度的相关性
Table 3 Correlation between leaf stomatal characteristics and lesion length of different kiwifruit germplasm
种质资源Germplasm resource E2545 E3031 E525 F2463 E364 F852 E721 E451 F1181 E2441 E3173 F4142 E2064 E172 E2532 E1131 E1125 E771 E674相关系数Correlation coefficient,r线性方程Linear equation病斑长度均值Average lesion length/mm 4.34±0.20 e 4.47±0.46 e 4.53±0.28 e 4.78±0.21 e 4.95±0.21 e 5.03±0.24 e 5.10±0.23 e 5.39±0.16 e 6.79±0.22 d 7.15±0.35 cd 7.19±0.41 cd 7.32±0.44 cd 7.36±0.26 cd 8.06±0.24 bc 8.18±0.24 bc 8.44±0.13 b 8.60±0.60 b 8.98±0.50 b 10.22±0.54 q抗性等级Resistance category R R R R R R R R R T T T T T T T T T S气孔密度Stomatal density/(No.·mm-2)331.05±31.86 h 367.84±18.39 gh 482.79±13.79 f 625.32±8.39 de 584.86±33.11 e 617.97±20.64 de 735.67±36.78 bc 606.93±31.86 de 634.52±15.93 cde 625.32±36.78 de 441.40±31.86 fg 625.32±48.66 de 675.90±47.12 bcde 698.89±18.39 bcd 680.50±6.78 bcde 689.69±15.93 bcde 754.06±18.39 bc 772.46±31.86 ab 855.22±35.62 a 0.715**y=53.45x+264.40气孔长度Stomatal length/μm 7.68±0.53 h 8.85±0.47 gh 9.37±0.34 efgh 10.77±0.40 def 10.37±0.32 defg 10.43±0.69 defg 8.53±0.56 fgh 10.53±0.73 defg 11.62±0.50 cd 10.88±0.56 cdef 11.07±0.50 cde 11.25±0.82 cde 11.73±0.26 cd 12.42±0.67 cd 11.95±0.42 cd 12.24±0.64 cd 12.95±0.50 bc 14.45±1.14 b 16.78±0.96 a 0.905**y=1.05x+4.26气孔宽度Stomatal width/μm 1.27±0.11 ef 1.40±0.20 ef 1.79±0.16 bcdef 2.38±0.18 ab 2.33±0.27 abc 1.84±0.35 bcde 1.42±0.15 ef 1.49±0.12 def 1.34±0.24 ef 2.21±0.24 abcd 2.68±0.34 a 1.42±0.23 ef 1.75±0.14 bcdef 1.16±0.09 ef 1.47±0.20 def 1.02±0.15 f 1.19±0.08 ef 1.70±0.43 bcdef 1.61±0.28 cdef-0.231 y=-0.06x+2.05
气孔密度与病斑均值相关系数为0.715,气孔长度与病斑长度均值相关系数为0.905,均呈现极显著正相关,进一步证实抗病种质的气孔密度与长度小于感病种质,整体随抗性增强呈现递减趋势。气孔宽度与病斑长度均值相关系数为-0.231,不存在相关性(图3)。
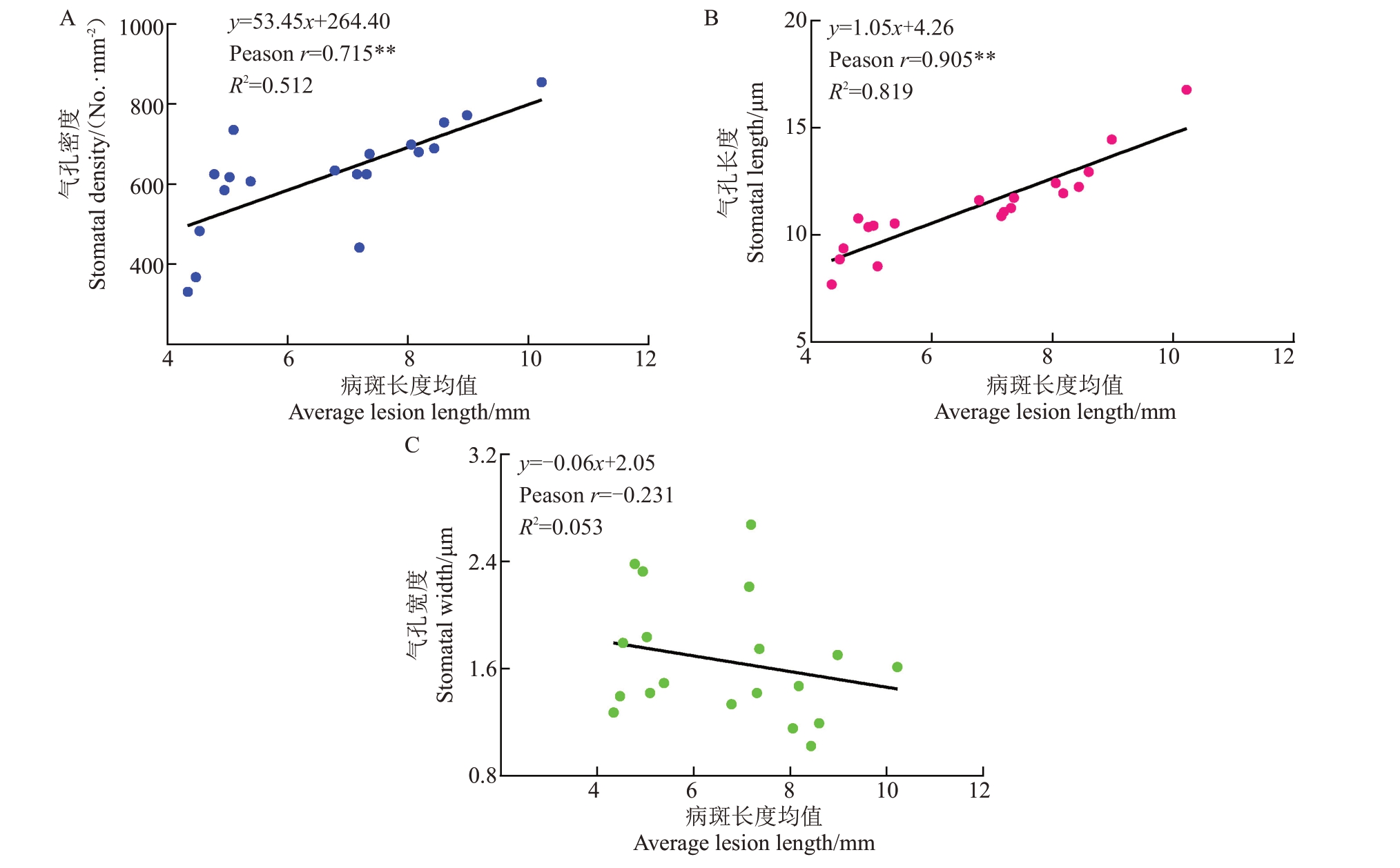
图3 气孔密度、气孔长度、气孔宽度与枝条病斑长度均值的相关性
Fig.3 Correlation of stomatal density,stomatal length,stomatal width and lesion on detached branch
A.气孔密度与枝条病斑均值的相关性;B.气孔长度与枝条病斑长度均值的相关性;C.气孔宽度与枝条病斑长度均值的相关性。
A.Correlation between the stomatal density content and the avreage lesion length; B.Correlation between stomatal length and the avreage lesion length;C.Correlation between the stomatal width and the avreage lesion length.
2.4 不同野生猕猴桃种质生理生化指标比较
对上述19份猕猴桃种质采集叶片进行生理指标测定,发现不同种质的生理数据间存在差异。根据表4 可知,每g 叶片的总酚含量(w,后同)在23.15~52.23 mg·g-1之间,枝条抗性最高的种质为E2545,其总酚含量最高,为52.23 mg·g-1;抗性最差的种质E674总酚含量为25.57 mg·g-1。同样,可溶性糖含量分布在51.05~33.05 mg·g-1 之间,抗性最高的种质为E2545,可溶性糖含量最高为51.05 mg·g-1;抗性最差的种质E674可溶性糖含量最低为33.05 mg·g-1。不同种质叶片木质素含量差异显著,在96.72~80.41 mg·g-1之间,木质素含量(96.72 mg·g-1)最高的为E2545 种质,其抗性也最强;含量(80.41 mg·g-1)最低的种质为E2532。
表4 猕猴桃种质生理生化指标差异与溃疡病病斑长度的相关性
Table 4 The correlation between physiological and biochemical indexes of kiwifruit germplasm and the lesion length of kiwifruit canker
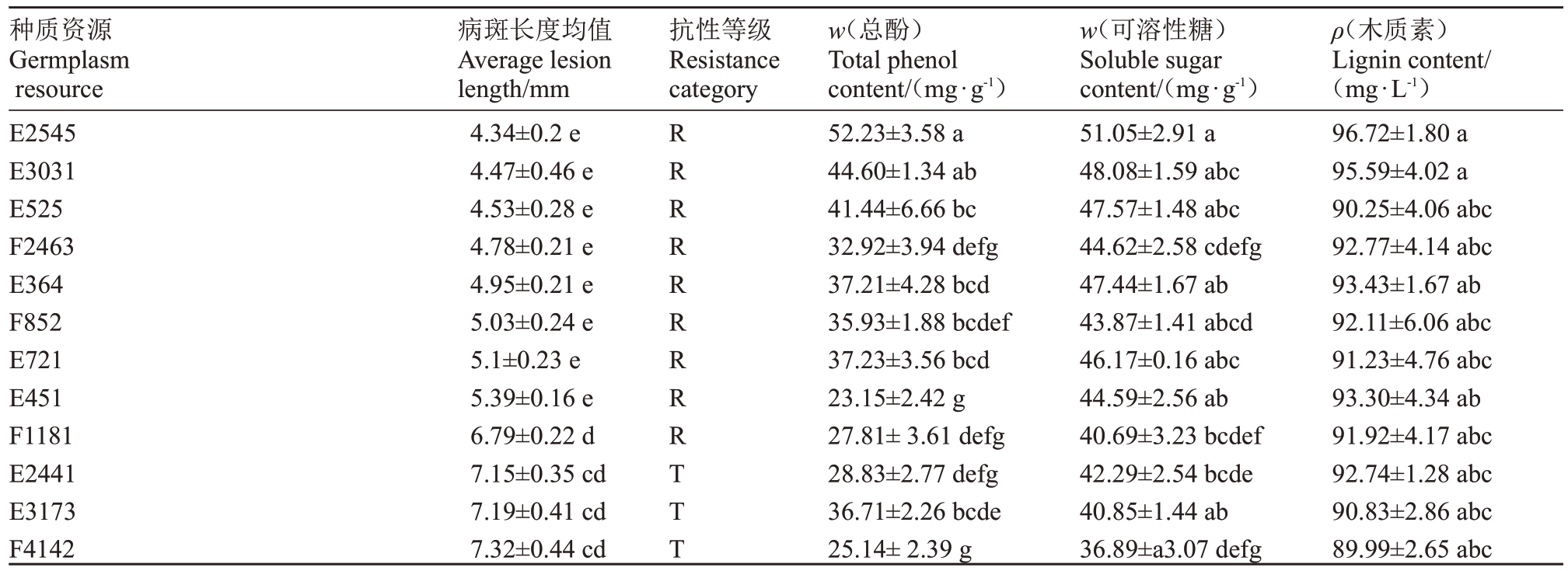
种质资源Germplasm resource E2545病斑长度均值Average lesion length/mm 4.34±0.2 e抗性等级Resistance category R w(总酚)Total phenol content/(mg·g-1)52.23±3.58 a w(可溶性糖)Soluble sugar content/(mg·g-1)51.05±2.91 a ρ(木质素)Lignin content/(mg·L-1)96.72±1.80 a E3031 E525 F2463 E364 F852 E721 E451 F1181 E2441 E3173 F4142 4.47±0.46 e 4.53±0.28 e 4.78±0.21 e 4.95±0.21 e 5.03±0.24 e 5.1±0.23 e 5.39±0.16 e 6.79±0.22 d 7.15±0.35 cd 7.19±0.41 cd 7.32±0.44 cd R R R R R R R R T T T 44.60±1.34 ab 41.44±6.66 bc 32.92±3.94 defg 37.21±4.28 bcd 35.93±1.88 bcdef 37.23±3.56 bcd 23.15±2.42 g 27.81±3.61 defg 28.83±2.77 defg 36.71±2.26 bcde 25.14±2.39 g 48.08±1.59 abc 47.57±1.48 abc 44.62±2.58 cdefg 47.44±1.67 ab 43.87±1.41 abcd 46.17±0.16 abc 44.59±2.56 ab 40.69±3.23 bcdef 42.29±2.54 bcde 40.85±1.44 ab 36.89±a3.07 defg 95.59±4.02 a 90.25±4.06 abc 92.77±4.14 abc 93.43±1.67 ab 92.11±6.06 abc 91.23±4.76 abc 93.30±4.34 ab 91.92±4.17 abc 92.74±1.28 abc 90.83±2.86 abc 89.99±2.65 abc
表4 (续) Table 4 (Continued)
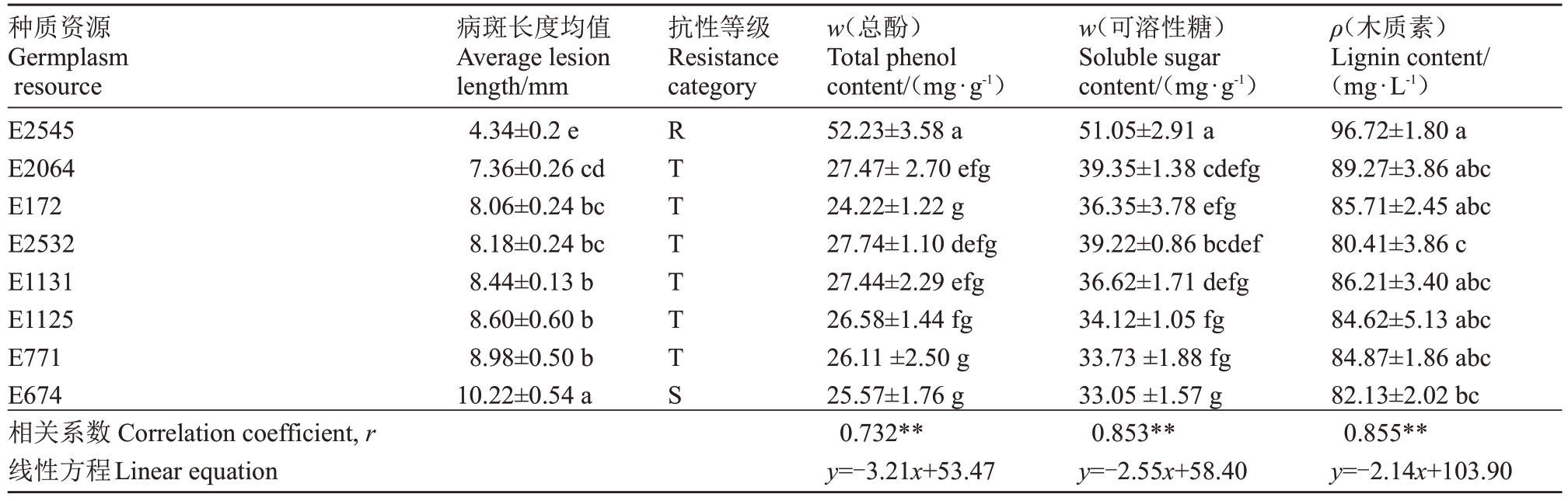
种质资源Germplasm resource E2545病斑长度均值Average lesion length/mm 4.34±0.2 e抗性等级Resistance category R w(总酚)Total phenol content/(mg·g-1)52.23±3.58 a w(可溶性糖)Soluble sugar content/(mg·g-1)51.05±2.91 a ρ(木质素)Lignin content/(mg·L-1)96.72±1.80 a E2064 E172 E2532 E1131 E1125 E771 E674相关系数Correlation coefficient,r线性方程Linear equation 7.36±0.26 cd 8.06±0.24 bc 8.18±0.24 bc 8.44±0.13 b 8.60±0.60 b 8.98±0.50 b 10.22±0.54 a T T T T T T S 27.47±2.70 efg 24.22±1.22 g 27.74±1.10 defg 27.44±2.29 efg 26.58±1.44 fg 26.11±2.50 g 25.57±1.76 g 0.732**y=-3.21x+53.47 39.35±1.38 cdefg 36.35±3.78 efg 39.22±0.86 bcdef 36.62±1.71 defg 34.12±1.05 fg 33.73±1.88 fg 33.05±1.57 g 0.853**y=-2.55x+58.40 89.27±3.86 abc 85.71±2.45 abc 80.41±3.86 c 86.21±3.40 abc 84.62±5.13 abc 84.87±1.86 abc 82.13±2.02 bc 0.855**y=-2.14x+103.90
抗性种质叶片中的总酚、可溶性糖、木质素含量显著高于感病种质。随着抗性降低,19份种质的总酚、可溶性糖、木质素含量均呈现下降趋势。对不同种质间生理指标与枝条病斑长度进行相关性分析,如图4 所示,可见总酚含量、可溶性糖含量、木质素含量均与枝条病斑长度呈极显著负相关,相关系数分别为-0.732、-0.853、-0.855。
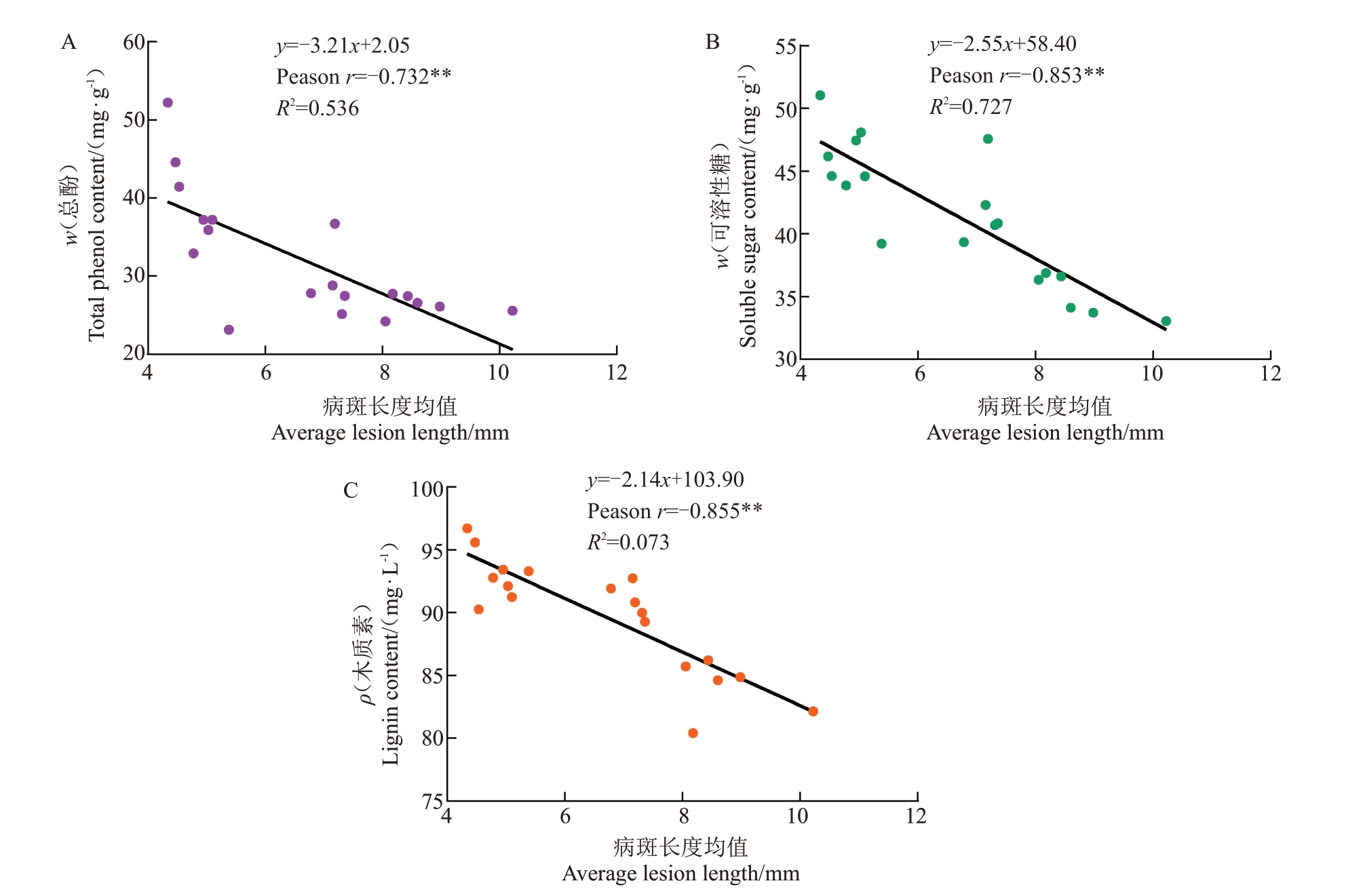
图4 总酚含量、可溶性糖含量、木质素含量与病斑长度均值的相关性
Fig.4 Correlation of total phenol content,soluble sugar content,lignin content and average lesion length on detached branch
A.总酚含量与枝条病斑长度均值的相关性;B.可溶性糖含量与枝条病斑长度均值的相关性;C.木质素含量与枝条病斑长度均值的相关性。
A.Correlation between the total phenol content and the avreage lesion length;B.Correlation between soluble sugar content and the avreage lesion length;C.Correlation between the lignin content and the avreage lesion length.
综合而言,溃疡病菌接种枝条后病斑越短,种质抗病性越高,对应生理指标中的总酚、可溶性糖及木质素含量越高。相反,溃疡病菌接种枝条后病斑长度越长,种质感病性越高,对应生理指标中的总酚、可溶性糖及木质素含量越低。
3 讨 论
防治猕猴桃溃疡病最直接有效的方法就是培育和栽培抗性品种[31]。对种质资源进行抗性鉴定,是选育抗性品种的前提。关于猕猴桃溃疡病鉴定方法,田间鉴定的结果最具直观性,但易受环境等诸多因素的影响,鉴定结果不稳定且容易导致病原菌扩散[5]。室内离体枝条接种具有安全、高效、可靠等优点,在梨[32]、苹果[33]、猕猴桃[23,34-35]、柑橘[36]、山楂[37]上应用广泛。温欣等[23]对51 份软枣猕猴桃种质进行溃疡病菌离体枝条和叶片接种,结果表明离体叶片接种、离体叶脉接种、半木质化离体枝条接种法均可作为抗性鉴定方法,其中离体枝条接种的结果较为准确。Hoyte 等[38]对75 个商业品系及中华/软枣、中华/黑蕊、中华/对萼3 个类型的2000 余份杂交群体实生苗进行离体木质化枝条及嫩枝接种,发现两种方法均可有效用于猕猴桃对溃疡病抗性评价。
我国野生猕猴桃种质资源极其丰富,近年来国内学者也开展了系列抗性评价工作。崔丽红等[39]、王发明等[5]、裴艳刚等[26]研究结果均表明就溃疡病抗性而言,毛花猕猴桃品种>美味猕猴桃品种>中华猕猴桃品种。刘娟[40]、宋雅林等[22]、Datson 等[41]研究证实不同种或变种猕猴桃资源的抗病性差异显著,毛花、软枣、京梨、葛枣等种的抗病性较强,中华、阔叶、长叶相对较感病。Hoyte 等[38]研究证实软枣、黑蕊、对萼与中华杂交后代部分抗性增强,种内抗性存在明显分化。李黎等[24]研究证实山梨、毛花及软枣等野生种质抗性较强,但抗性存在种内分化。本研究所用材料为山梨与中华杂交后代,研究结果表明群体材料抗性虽存在分化,但整体后代抗性较强。
植物的表型结构与抗性密切相关。叶面是植物与病原菌接触的第一层屏障,叶片结构差异直接影响病原菌侵染的难易程度。李伯凌等[42]认为高抗品种木薯叶片的栅栏组织细胞和海绵组织细胞排列较感病品种更整齐紧密。田丽波等[43]认为海绵组织厚度越厚、叶片结构越疏松的苦瓜品系,越容易受到白粉病的侵染。本研究通过显著性相关分析,发现不同种质的猕猴桃叶片海绵组织厚度存在显著差异,海绵组织越厚植物抗病性越弱,但上下表皮厚度、栅栏组织厚度与抗病性没有相关性,规律与上述文献[42-43]一致。气孔是植物与外界进行气体交换的场所,也是病原菌的主要入侵点,植物表皮的气孔数量与形态结构与抗病性息息相关。在油茶[44]、枇杷[8]、核桃[45]等植物中,气孔密度越大,气孔越长,植物越易感病。本研究结果证明猕猴桃叶片的气孔密度、长度与猕猴桃种质抗性呈显著正相关,与贺占雪等[11]、李淼等[12]、李靖等[46]在猕猴桃中的研究结果相同。综上,不同种质猕猴桃的海绵组织厚度和气孔器大小、密度与抗溃疡病相关性显著,这些微表观特征也可为猕猴桃溃疡病抗病选育提供形态学参考。
当植物被病原菌感染时,感染部位会通过苯丙烷途径大量合成木质素,促进植物细胞壁的木质化,抵抗病原菌的进一步感染[47]。可溶性糖含量低会抑制病原菌在植物体内的繁殖与生长[48]。李亚等[49]、郑磊等[16]认为核桃对黄单胞杆菌抗性、杧果对细菌性角斑病抗性均与可溶性含糖量呈显著正相关。酚类物质是木质素合成的前体,植物感病组织中酚类化合物的积累会抑制病原菌的入侵,是诱导植物发挥抗性的主要物质[50]。陈浩等[51]发现接种霜霉病菌后,抗病荔枝品种的总酚和类黄酮含量显著高于感病品种;李国平等[52]认为杧果叶片的总酚、类黄酮、阿魏酸、木质素相对含量与对细菌性角斑病抗性呈正相关。Qin等[53]研究发现,高感中华猕猴桃品种红阳和抗性毛花品种中存在22 个参与木质素合成的差异表达基因,表明木质素含量与溃疡病抗性呈正相关。本研究中猕猴桃叶片中木质素、可溶性糖、总酚含量均与抗病性呈显著正相关,与上述研究结果规律一致。
猕猴桃产业的持续发展需要溃疡病抗病品种的栽培推广,野生型猕猴桃经过长期的自然选择与遗传变异有着丰富的抗性基因[24],山梨猕猴桃抗旱、耐涝或耐高湿及抗病性的能力较强,且果实风味淡甜、果面无毛[54]。目前大部分商业栽培的中华猕猴桃品种虽风味浓郁、果实较大,但对溃疡病感病或中抗,且遗传背景比较狭窄。杂交育种可以使后代具有亲本双方的优良性状,实现优异多基因聚合的育种目标,从而可以培育出满足消费者和生产者需求的优良品种。申素云等[55]对山梨与中华杂交果实进行品质与感官评价,发现山梨与中华杂交种类的整体喜好度平均值最高,风味喜好度和浓烈程度也较高。结合本试验的结果,有望筛选到产量高、品质佳且溃疡病抗性强的优质高抗山梨中华杂交子代。
此外,基于种质抗性评价结果,可进一步对抗性基因进行QTL 群体定位或者挖掘关键抗性基因。Tahir等[56-57]利用简化基因组测序GBS在中华猕猴桃染色体LG27 上发现1 个主要效应QTL 位点,随后进一步在四倍体中华猕猴桃中鉴定到4个关键QTL位点。Zhao 等[6]和Liu 等[58]从高感红阳基因组中鉴定出3 个抗溃疡病关键基因,并基于抗感猕猴桃种质的转录组差异鉴定获得了2 个抗溃疡病关键因子。本研究对山梨与中华杂交群体进行了抗性评价,后续可根据该评价结果进一步挖掘抗性基因,为阐明猕猴桃抗溃疡病机制奠定材料基础。
4 结 论
研究评价了84 份山梨与中华猕猴桃杂交群体种质的溃疡病抗性,筛选出67 份抗病种质,并发现海绵组织厚度、气孔密度、气孔长度、木质素含量、可溶性糖含量、总酚含量6个指标与猕猴桃抗性相关,其中海绵组织厚度、气孔密度、气孔长度与猕猴桃抗病性呈显著负相关,木质素含量、可溶性糖含量、总酚含量与猕猴桃抗病性呈显著正相关。研究结果为猕猴桃抗性育种及抗性机制研究奠定了基础。
[1] 吕正鑫,王海令,贺艳群,刘青,黄春辉,贾东峰,徐小彪.基于HS-SPME-GC-MS 的5 份猕猴桃种质风味品质研究[J].果树学报,2022,39(1):47-59.LÜ Zhengxin,WANG Hailing,HE Yanqun,LIU Qing,HUANG Chunhui,JIA Dongfeng,XU Xiaobiao.Flavor quality analysis of five kiwifruit germplasm based on HS-SPMEGC-MS[J].Journal of Fruit Science,2022,39(1):47-59.
[2] 徐子怡,罗晨宇,占坤,邱荣辉,黄春辉,徐小彪,贾东峰.猕猴桃OSCA 基因家族鉴定及其在非生物胁迫下的表达分析[J].果树学报,2024,41(3):436-447.XU Ziyi,LUO Chenyu,ZHAN Kun,QIU Ronghui,HUANG Chunhui,XU Xiaobiao,JIA Dongfeng.Genome-wide identification of OSCA gene family members and their expression under different abiotic stresses in kiwifruit[J].Journal of Fruit Science,2024,41(3):436-447.
[3] 钟彩虹,黄文俊,李大卫,张琼,李黎.世界猕猴桃产业发展及鲜果贸易动态分析[J].中国果树,2021(7):101-108.ZHONG Caihong,HUANG Wenjun,LI Dawei,ZHANG Qiong,LI Li.Dynamic analysis of global kiwifruit industry development and fresh fruit trade[J].China Fruits,2021(7):101-108.
[4] ZHONG C H,HUANG W J,WANG Z P,LI L,LI D W,ZHANG Q,ZHAO T T,ZHANG P.The breeding progress and development status of the kiwifruit industry in China[J].Acta Horticulturae,2022(1332):445-454.
[5] 王发明,莫权辉,叶开玉,龚弘娟,蒋桥生,刘平平,李洁维.猕猴桃溃疡病抗性育种研究进展[J].广西植物,2019,39(12):1729-1738.WANG Faming,MO Quanhui,YE Kaiyu,GONG Hongjuan,JIANG Qiaosheng,LIU Pingping,LI Jiewei.Research progress on kiwifruit resistance breeding to Pseudomonas syringae pv.actinidiae[J].Guihaia,2019,39(12):1729-1738.
[6] ZHAO C,LIU W,ZHANG Y L,LI Y Z,MA C,TIAN R Z,LI R,LI M J,HUANG L L.Two transcription factors,AcREM14 and AcC3H1,enhance the resistance of kiwifruit Actinidiachinensis var. chinensis to Pseudomonas syringae pv. actinidiae[J].Horticulture Research,2023,11(1):uhad242.
[7] YANG S M,XU T L,YANG Y,PEI W Y,LUO L,YU C,WANG J,CHENG T R,ZHANG Q X,PAN H T.H2O2 accumulation plays critical role in black spot disease resistance in roses[J].Horticulture,Environment,and Biotechnology,2023,64(1):1-14.
[8] 陈依丽,陈雨琼,邓颖,李春雨,彭泽,杨向晖.枇杷属植物叶片结构与叶斑病抗性的相关性研究[J].果树学报,2022,39(11):2133-2140.CHEN Yili,CHEN Yuqiong,DENG Ying,LI Chunyu,PENG Ze,YANG Xianghui.Analysis of correlation between leaf structure and resistance to leaf spot in Eriobotrya[J].Journal of Fruit Science,2022,39(11):2133-2140.
[9] YANG H B,HAN S,HE D,JIANG S J,CAO G L,WAN X Q,CHEN L H,XIAO J J,ZHU P.Resistance evaluation of walnut(Juglans spp.) against Xanthomonas arboricola and the correlation between leaf structure and resistance[J].Forest Pathology,2021,51(1):e12659.
[10] WANG Y,FU X Z,LIU J H,HONG N.Differential structure and physiological response to canker challenge between‘Meiwa’kumquat and‘Newhall’navel orange with contrasting resistance[J].Scientia Horticulturae,2011,128(2):115-123.
[11] 贺占雪,李欣,朱太富,苏效兰,王连春.野生猕猴桃枝叶组织结构与抗溃疡病的关系分析[J].中国植保导刊,2023,43(10):9-14.HE Zhanxue,LI Xin,ZHU Taifu,SU Xiaolan,WANG Lianchun.Analysis of the relationship between the resistance of wild kiwifruit to canker and the tissue structure of its branches and leaves[J].China Plant Protection,2023,43(10):9-14.
[12] 李淼,檀根甲,李瑶,承河元,李珂.猕猴桃品种叶片组织结构与抗溃疡病的关系[J].安徽农业科学,2002,30(5):740-742.LI Miao,TAN Genjia,LI Yao,CHENG Heyuan,LI Ke.Study on the leaf tissue structure of kiwifruit cultivars in relation to bacterial canker disease resistance[J].Journal of Anhui Agricultural Sciences,2002,30(5):740-742.
[13] 任艳芳,宋雅萍,肖桂云,张黎明,何俊瑜,林肖,王艳玲.一氧化氮介导水杨酸诱导的采后杧果果实炭疽病抗性反应[J].植物生理学报,2021,57(3):632-642.REN Yanfang,SONG Yaping,XIAO Guiyun,ZHANG Liming,HE Junyu,LIN Xiao,WANG Yanling.Nitric oxide mediates salicylic acid-induced defense responses in mango fruit against anthracnose disease[J].Plant Physiology Journal,2021,57(3):632-642.
[14] SHASMITA,MOHAPATRA D,MOHAPATRA P K,NAIK S K,MUKHERJEE A K.Priming with salicylic acid induces defense against bacterial blight disease by modulating rice plant photosystem II and antioxidant enzymes activity[J].Physiological and Molecular Plant Pathology,2019,108:101427.
[15] PRIYA B T,MURTHY B N S,GOPALAKRISHNAN C,ARTAL R B,JAGANNATH S.Identification of new resistant sources for bacterial blight in pomegranate[J].European Journal of Plant Pathology,2016,146(3):609-624.
[16] 郑磊,詹儒林,柳凤,李国平,赵艳龙,常金梅,何衍彪.杧果感染细菌性角斑病菌后的生理代谢变化[J].广东农业科学,2016,43(4):67-72.ZHENG Lei,ZHAN Rulin,LIU Feng,LI Guoping,ZHAO Yanlong,CHANG Jinmei,HE Yanbiao.Physiological metabolic changes of mango infected by bacterial leaf spot pathogen[J].Guangdong Agricultural Sciences,2016,43(4):67-72.
[17] 李亚巍.猕猴桃漆酶基因AcLac35 的克隆及抗溃疡病的功能分析[D].合肥:安徽农业大学,2019.LI Yawei.Isolation of laccase Aclac35 in kiwifruit and analysis its role in defense to bacterial canker[D].Hefei:Anhui Agricultural University,2019.
[18] MENDU L,ULLOA M,PAYTON P,MONCLOVA-SANTANA C,CHAGOYA J,MENDU V.Lignin and cellulose content differences in roots of different cotton cultivars associated with different levels of Fusarium wilt race 4 (FOV4) resistance-response[J].Journal of Agriculture and Food Research,2022,10:100420.
[19] ZHANG Y,WU L Z,WANG X F,CHEN B,ZHAO J,CUI J,LI Z K,YANG J,WU L Q,WU J H,ZHANG G Y,MA Z Y.The cotton laccase gene GhLAC15 enhances Verticillium wilt resistance via an increase in defence-induced lignification and lignin components in the cell walls of plants[J].Molecular Plant Pathology,2019,20(3):309-322.
[20] 孙雷明,方金豹.我国猕猴桃种质资源的保存与研究利用[J].植物遗传资源学报,2020,21(6):1483-1493.SUN Leiming,FANG Jinbao.Conservation,research and utilization of kiwifruit germplasm resources in China[J].Journal of Plant Genetic Resources,2020,21(6):1483-1493.
[21] WU H L,MA T,KANG M H,AI F D,ZHANG J L,DONG G Y,LIU J Q.A high-quality Actinidia chinensis (kiwifruit) genome[J].Horticulture Research,2019,6:117.
[22] 宋雅林,林苗苗,钟云鹏,陈锦永,齐秀娟,孙雷明,方金豹.猕猴桃品种(系)溃疡病抗性鉴定及不同评价指标的相关性分析[J].果树学报,2020,37(6):900-908.SONG Yalin,LIN Miaomiao,ZHONG Yunpeng,CHEN Jinyong,QI Xiujuan,SUN Leiming,FANG Jinbao.Evaluation of resistance of kiwifruit varieties (line) against bacterial canker disease and correlation analysis among evaluation indexes[J].Journal of Fruit Science,2020,37(6):900-908.
[23] 温欣,秦红艳,艾军,王月,韩先焱,李昌禹.软枣猕猴桃种质资源溃疡病抗性鉴定方法的建立与评价[J].植物保护,2021,47(2):193-199.WEN Xin,QIN Hongyan,AI Jun,WANG Yue,HAN Xianyan,LI Changyu.Establishment and evaluation of resistance identification method for Pseudomonas syringae pv. actinidiae disease in Actinidia arguta germplasm resources[J].Plant Protection,2021,47(2):193-199.
[24] 李黎,潘慧,李文艺,汪祖鹏,钟彩虹.中国野生猕猴桃资源的溃疡病抗性种质筛选[J].植物科学学报,2022,40(6):801-809.LI Li,PAN Hui,LI Wenyi,WANG Zupeng,ZHONG Caihong.Screening of wild Actinidia germplasms resistant to bacterial canker disease in China[J].Plant Science Journal,2022,40(6):801-809.
[25] ZHAO Z B,GAO X N,HUANG Q L,HUANG L L,QIN H Q,KANG Z.Identification and characterization of the causal agent of bacterial canker of kiwifruit in the Shaanxi province of China[J].Journal of Plant Pathology,2013,95(1):155-162.
[26] 裴艳刚,马利,岁立云,崔永亮,刘晓敏,龚国淑.不同猕猴桃品种对溃疡病菌的抗性评价及其利用[J].果树学报,2021,38(7):1153-1162.PEI Yangang,MA Li,SUI Liyun,CUI Yongliang,LIU Xiaomin,GONG Guoshu.Resistance evaluation and utilization of different kiwifruit cultivars to Pseudomonas syringae pv. actinidiae[J].Journal of Fruit Science,2021,38(7):1153-1162.
[27] WANG F M,LI J W,YE K Y,GONG H J,LIU P P,JIANG Q S,QI B B,MO Q H.Preliminary report on the improved resistance towards Pseudomonas syringae pv. actinidiae of cultivated kiwifruit (Actinidia chinensis) when grafted onto wild Actinidia guilinensis rootstock in vitro[J].Journal of Plant Pathology,2021,103(1):51-54.
[28] 张俊环,张美玲,杨丽,姜凤超,于文剑,王玉柱,孙浩元.基于叶片显微结构综合评价杏不同品种(系)的抗旱性[J].果树学报,2023,40(11):2381-2390.ZHANG Junhuan,ZHANG Meiling,YANG Li,JIANG Fengchao,YU Wenjian,WANG Yuzhu,SUN Haoyuan.Comprehensive evaluation of drought resistance of different apricot cultivars(lines)based on leaf microstructure[J].Journal of Fruit Science,2023,40(11):2381-2390.
[29] 胡光明,肖涛,彭家清,李大卫,田华,王华玲,肖丽丽,程均欢,黄海雷,吴伟,钟彩虹.基于叶片形态及显微特征评价12 个猕猴桃栽培品种的抗旱性[J].果树学报,2024,41(5):911-928.HU Guangming,XIAO Tao,PENG Jiaqing,LI Dawei,TIAN Hua,WANG Hualing,XIAO Lili,CHENG Junhuan,HUANG Hailei,WU Wei,ZHONG Caihong.Evaluation of drought resistance of 12 kiwifruit cultivars based on leaf morphology and microscopic characteristics[J].Journal of Fruit Science,2024,41(5):911-928.
[30] 李小方,张志良.植物生理学实验指导[M].5 版.北京:高等教育出版社,2016.LI Xiaofang,ZHANG Zhiliang.Experimental guidance of plant physiology[M].5th ed.Beijing:Higher Education Press,2016.
[31] 张敏,唐冬梅,赵志博,仲伟敏.贵州产区黄肉猕猴桃品种及优系溃疡病抗性评价[J].分子植物育种,2021,19(23):7892-7899.ZHANG Min,TANG Dongmei,ZHAO Zhibo,ZHONG Weimin.Evaluation of canker resistance on yellow-fleshed kiwifruit cultivars and superior lines in Guizhou[J].Molecular Plant Breeding,2021,19(23):7892-7899.
[32] 陈励坤,徐叶挺,王永鹏,何临梓,曾斌,艾沙江·买买提.新疆梨种质资源的火疫病抗性评价[J].中国果树,2022(8):16-22.CHEN Likun,XU Yeting,WANG Yongpeng,HE Linzi,ZENG Bin,Aisajan·Mamat.Evaluation on fire blight resistance of Pyrus sinkiangensis Yu germplasm resources[J].China Fruits,2022(8):16-22.
[33] 曹雅芝,陈卫民,张胜军,陆彪,崔志军,李克梅,韩丽丽,张学超,张晓倩,阿依达娜·阿思克别列.83 份新疆野苹果种质资源对梨火疫病菌的抗病性评价[J].植物检疫,2024,38(1):33-46.CAO Yazhi,CHEN Weimin,ZHANG Shengjun,LU Biao,CUI Zhijun,LI Kemei,HAN Lili,ZHANG Xuechao,ZHANG Xiaoqian,Ayidana·Asikebielie.Evaluation of disease resistance of 83 Malus sieversii germplasm resources to Erwinia amylovora[J].Plant Quarantine,2024,38(1):33-46.
[34] QIN H Y,ZHAO Y,CHEN X L,ZHANG B X,WEN X,LI C Y,FAN S T,WANG Y,YANG Y M,XU P L,LIU Y X,AI J.Pathogens identification and resistance evaluation on bacterial canker in Actinidia arguta germplasm[J].Journal of Plant Pathology,2023,105(3):973-985.
[35] WANG F M,MO Q H,YE K Y,GONG H J,QI B B,LIU P P,JIANG Q S,LI J W.Evaluation of the wild Actinidia germplasm for resistance to Pseudomonas syringae pv. actinidiae[J].Plant Pathology,2020,69(6):979-989.
[36] 占爽,吴望,胡军华,吴玉珠,乔兴华,陈力,程兰,周彦.重庆万州疑似柑桔轮斑病的病原鉴定及防治药剂筛选[J].中国南方果树,2021,50(1):1-7.ZHAN Shuang,WU Wang,HU Junhua,WU Yuzhu,QIAO Xinghua,CHEN Li,CHENG Lan,ZHOU Yan.Identification and fungicides screening for Pseudofabraea citricarpa like pathogen caused citrus target spot disease in Wanzhou,Chongqing[J].South China Fruits,2021,50(1):1-7.
[37] 王杰花,韩丽丽,张胜军,陈卫民,张学超.新疆山楂种质资源对梨火疫病的抗性鉴定与评价[J].北方园艺,2023(24):30-37.WANG Jiehua,HAN Lili,ZHANG Shengjun,CHEN Weimin,ZHANG Xuechao.Identification and evaluation of resistance of hawthorn germplasm resources to pear fire blight in Xinjiang[J].Northern Horticulture,2023(24):30-37.
[38] HOYTE S,REGLINSKI T,ELMER P,MAUCHLINE N,STANNARD K,CASONATO S,AH CHEE A,PARRY F,TAYLOR J,WURMS K,YU J,CORNISH D,PARRY J.Developing and using bioassays to screen for Psa resistance in New Zealand kiwifruit[J].Acta Horticulturae,2015(1095):171-180.
[39] 崔丽红,高小宁,张迪,黄丽丽,黄蔚,陈继富.湘西地区猕猴桃细菌性溃疡病抗性资源筛选及其抗性机理研究[J].植物保护,2019,45(3):158-164.CUI Lihong,GAO Xiaoning,ZHANG Di,HUANG Lili,HUANG Wei,CHEN Jifu.Screening of resistance resource and resistance mechanism of kiwifruit to Pseudomonas syringae pv.actinidiae in Xiangxi area[J].Plant Protection,2019,45(3):158-164.
[40] 刘娟.猕猴桃溃疡病抗性材料评价及其亲缘关系的ISSR 聚类分析[D].雅安:四川农业大学,2015.LIU Juan.Evaluation of resistant varieties on kiwifruit bacterial canker and cluster analysis of genetic relations by ISSR markers[D].Yaan:Sichuan Agricultural University,2015.
[41] DATSON P,NARDOZZA S,MANAKO K,HERRICK J,MARTINEZ-SANCHEZ M,CURTIS C,MONTEFIORI M.Monitoring the Actinidia germplasm for resistance to Pseudomonas syringae pv. actinidiae[J].Acta Horticulturae,2015(1095):181-184.
[42] 李伯凌,霍本君,朱寿松,熊茜,李可,罗丽娟,李春霞,陈银华.木薯叶片组织结构及生理生化特征与其抗细菌性枯萎病的关系[J].热带生物学报,2017,8(3):292-300.LI Boling,HUO Benjun,ZHU Shousong,XIONG Qian,LI Ke,LUO Lijuan,LI Chunxia,CHEN Yinhua.The structure and physiological characteristics of cassava leaves and their relationship with the resistance to bacterial blight[J].Journal of Tropical Biology,2017,8(3):292-300.
[43] 田丽波,商桑,杨衍,司龙亭,李丹丹.苦瓜叶片结构与白粉病抗性的关系[J].西北植物学报,2013,33(10):2010-2015.TIAN Libo,SHANG Sang,YANG Yan,SI Longting,LI Dandan.Relationship between the leaf structure of bitter melon and resistance to powdery mildew[J].Acta Botanica Boreali-Occidentalia Sinica,2013,33(10):2010-2015.
[44] 王文峰,乔新派,胡孝明,陈圆圆,卜付军,张党权,杨超臣.油茶叶片形态结构及内含物与炭疽病抗性的相关性[J].经济林研究,2024,42(2):103-111.WANG Wenfeng,QIAO Xinpai,HU Xiaoming,CHEN Yuanyuan,BU Fujun,ZHANG Dangquan,YANG Chaochen.Relationship between leaf structure and inclusions of Camellia oleifera and anthracnose resistance[J].Non-wood Forest Research,2024,42(2):103-111.
[45] 何丹.四川核桃品种(系)对黑斑病的抗性评价及与叶结构的相关性[D].雅安:四川农业大学,2018.HE Dan.The resistance of Sichuan walnut varieties (clones) to walnut blight and the correlation between leaf structure and walnut blight[D].Yaan:Sichuan Agricultural University,2018.
[46] 李靖,涂美艳,钟程操,孙淑霞,陈栋,宋海岩,刘飘,廖明安,江国良.6 个猕猴桃品种抗溃疡病差异及生理机制研究[J].西南农业学报,2019,32(11):2579-2585.LI Jing,TU Meiyan,ZHONG Chengcao,SUN Shuxia,CHEN Dong,SONG Haiyan,LIU Piao,LIAO Ming’an,JIANG Guoliang.Study on difference of canker-resistance and physiological mechanism of six kiwifruit varieties[J].Southwest China Journal of Agricultural Sciences,2019,32(11):2579-2585.
[47] 张烨婧,陈捷胤,李冉,戴小枫.棉花抗黄萎病生理生化机制研究进展[J].植物保护,2024,50(2):19-36.ZHANG Yejing,CHEN Jieyin,LI Ran,DAI Xiaofeng.Recent advances in physiological and biochemical mechanisms of cotton resistance to Verticillium wilt[J].Plant Protection,2024,50(2):19-36.
[48] 王芳,肖玉,糜加轩,时羽杰,万雪琴,杨汉波.不同抗性泡核桃对褐斑病病原菌侵染的生理生化响应[J].西北植物学报,2022,42(12):2083-2092.WANG Fang,XIAO Yu,MI Jiaxuan,SHI Yujie,WAN Xueqin,YANG Hanbo.Physiological and biochemical responses of different resistant walnuts to brown spot infection by Ophiognomonia leptostyla[J].Acta Botanica Boreali-Occidentalia Sinica,2022,42(12):2083-2092.
[49] 李亚,韩颖,杨斌,赵宁.黄单胞杆菌侵染后不同品种核桃抗病性相关生理指标的测定[J].福建农林大学学报(自然科学版),2020,49(4):453-458.LI Ya,HAN Ying,YANG Bin,ZHAO Ning.Assessing resistance against Xanthomonasar boricola in 4 walnuts cultivars using physiological indexes[J].Journal of Fujian Agriculture and Forestry University(Natural Science Edition),2020,49(4):453-458.
[50] GU G F,YANG S,YIN X H,LONG Y H,MA Y,LI R Y,WANG G L.Sulfur induces resistance against canker caused by Pseudomonas syringae pv. actinidae via phenolic components increase and morphological structure modification in the kiwifruit stems[J].International Journal of Molecular Sciences,2021,22(22):12185.
[51] 陈浩,孙进华,王树军,李焕苓,王果,王家保.霜疫霉侵染对不同荔枝品种果皮苯丙烷类代谢的影响[J].热带作物学报,2021,42(6):1694-1699.CHEN Hao,SUN Jinhua,WANG Shujun,LI Huanling,WANG Guo,WANG Jiabao.Effects of phenylpropanoid metabolism in different Litchi varieties during the infection of Phytophthora litchii[J].Chinese Journal of Tropical Crops,2021,42(6):1694-1699.
[52] 李国平,郑磊,柳凤.杧果细菌性角斑病菌对杧果酚类代谢的影响[J].中国南方果树,2021,50(1):66-70.LI Guoping,ZHENG Lei,LIU Feng.Effect of bacterial ceratospora mangifera on phenolic metabolites of mango[J].South China Fruits,2021,50(1):66-70.
[53] QIN X B,ZHANG M,LI Q H,CHEN D L,SUN L M,QI X J,CAO K,FANG J B.Transcriptional analysis on resistant and susceptible kiwifruit genotypes activating different plant-immunity processes against Pseudomonas syringae pv. actinidiae[J].International Journal of Molecular Sciences,2022,23(14):7643.
[54] 韩飞,赵婷婷,刘小莉,张琦,李大卫,田华,彭珏,钟彩虹.山梨猕猴桃与中华猕猴桃种间杂交后代果实性状的遗传倾向分析[J].植物科学学报,2022,40(4):505-512.HAN Fei,ZHAO Tingting,LIU Xiaoli,ZHANG Qi,LI Dawei,TIAN Hua,PENG Jue,ZHONG Caihong.Genetic analysis of fruit traits in Actinidia rufa (Siebold and Zuccarini) Planchon ex Miquel ×Actinidia chinensis var. chinensis C.F.Liang kiwifruit hybrid population[J].Plant Science Journal,2022,40(4):505-512.
[55] 申素云,王周倩,张琦,杨洁,韩飞,钟彩虹,王传华,黄文俊.36份猕猴桃种质资源的果实品质与感官评价分析[J].植物科学学报,2023,41(4):540-551.SHEN Suyun,WANG Zhouqian,ZHANG Qi,YANG Jie,HAN Fei,ZHONG Caihong,WANG Chuanhua,HUANG Wenjun.Analysis of fruit quality and sensory evaluation of 36 kiwifruit(Actinidia) germplasm accessions[J].Plant Science Journal,2023,41(4):540-551.
[56] TAHIR J,HOYTE S,BASSETT H,BRENDOLISE C,CHATTERJEE A,TEMPLETON K,DENG C,CROWHURST R,MONTEFIORI M,MORGAN E,WOTTON A,FUNNELL K,WIEDOW C,KNAEBEL M,HEDDERLEY D,VANNESTE J,MCCALLUM J,HOEATA K,NATH A,CHAGNÉ D,GEA L,GARDINER S E.Multiple quantitative trait loci contribute to resistance to bacterial canker incited by Pseudomonas syringae pv. actinidiae in kiwifruit (Actinidia chinensis)[J].Horticulture Research,2019,6:101.
[57] TAHIR J,BRENDOLISE C,HOYTE S,LUCAS M,THOMSON S,HOEATA K,MCKENZIE C,WOTTON A,FUNNELL K,MORGAN E,HEDDERLEY D,CHAGNÉ D,BOURKE P M,MCCALLUM J,GARDINER S E,GEA L.QTL mapping for resistance to cankers induced by Pseudomonas syringae pv.actinidiae(Psa)in a tetraploid Actinidia chinensis kiwifruit population[J].Pathogens,2020,9(11):967.
[58] LIU W,ZHAO C,LIU L,HUANG D,MA C,LI R,HUANG L L.Genome-wide identification of the TGA gene family in kiwifruit(Actinidia chinensis spp.) and revealing its roles in response to Pseudomonas syringae pv. actinidiae(Psa) infection[J].International Journal of Biological Macromolecules,2022,222:101-113.