猕猴桃隶属猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia Lindl.)植物,该属有54个种和21个变种,共75 个分类群[1]。猕猴桃果实风味独特,富含维生素C、膳食纤维和多种矿物质。红阳猕猴桃属于中华猕猴桃(Actinidia chinensis Planch.),富含维生素、矿物质、氨基酸、膳食纤维等,营养价值极高[2]。猕猴桃是一种不耐盐碱的果树,当土壤含盐量达0.2%时,植株地上部和地下部干质量均极显著降低,并存在少数植株死亡的情况[3]。
土壤盐渍化问题在全球范围内日渐严重,据统计,目前全球盐渍土面积已达11 亿hm2[4]。我国的盐渍土分布广泛,总面积约为1 亿hm²,其中具有农业利用潜力的盐渍土总面积近666.67 万hm²[5]。盐渍土也影响植物的正常生长,给生态环境带来了不利影响,造成土壤板结,导致土壤的通透性变差,还会使植物体内离子间动态失衡[6]。
研究发现,植物通过提升可溶性蛋白、脯氨酸、可溶性糖等有机渗透调节物质含量,来调节细胞内渗透势,这些有机化合物能够帮助植物在盐胁迫条件下维持正常的细胞渗透压和代谢活动[7]。而植物激素通过感知传递盐胁迫信号和建立防御系统以调节植物在盐胁迫下的生长和发育适应性[8]。同时盐胁迫促进了植株根茎中脱落酸、乙烯等抑制生长类激素的产生[9]。在盐胁迫条件下,植物体内一系列的抗氧化酶如SOD、CAT、POD 等,能够通过相互协作清除氧化胁迫产生的过量活性氧自由基(ROS)。SOD是ROS清除系统的第一道防线,负责将超氧阴离子(O2-)转变为过氧化氢(H2O2)和氧气(O2),高浓度的H2O2再由CAT分解为H2O和O2,由此缓解氧化胁迫[8]。在盐胁迫条件下,植物还会激发胁迫相关基因的表达,目前植物中已经研究报道了大量盐胁迫相关基因。因此,在生理生化和分子机制水平上研究盐胁迫对红阳猕猴桃生理特性的影响,可以更好地揭示其抗性的内在作用机制,为进一步开展猕猴桃逆境抗性研究打好坚实基础,对提高猕猴桃产量和品质具有重要意义[10]。
1 材料和方法
1.1 试验材料
选用鲁东大学农林工程研究院植物培养室生长良好且长势一致的红阳猕猴桃苗为试验材料。
1.2 试验设计
选取生长健壮、长势相同的猕猴桃苗15盆,分为5 组,每组3 盆,每盆1 株。盐胁迫处理方法采用每隔3 d浇1次Hoagland营养液,设置Hoagland营养液中NaCl浓度分别为0、50、100、150和200 mmol·L-1。猕猴桃苗温室的温度设定为(24±2)℃,光周期为14 h 光照/10 h 黑暗,培养室的湿度60%~70%,所有猕猴桃苗生长条件一致。盐胁迫处理时间为10 d。电导率和光合速率的测定在处理结束后立即进行,测定结束后对试验材料进行取材,液氮速冻,置于-80 ℃冰箱保存,用于后续生理指标和总RNA的提取。盐胁迫处理、取材及相关指标的测定均设3次生物学重复。
1.3 生理指标的测定
1.3.1 净光合速率的测定 处理结束后,选取不同处理组植株相同生理部位的叶片,采用Li-6800便携式光合速率测定仪于当日09:00左右开始测定植物气体交换参数,测定其净光合速率(Pn),设3 次重复。光合仪系统控制叶片温度25 ℃,测定系统采用开放式气路,设置CO2含量400 μmol·mol-1,环境湿度为70%。
1.3.2 相对电导率的测定 相对电导率(REC)采用电导法测定[11]。
1.3.3 抗氧化酶活性、渗透调节物质含量的测定丙二醛(MDA)含量采用硫代巴比妥酸法[12]测定;SOD酶活性采用氮蓝四唑(NBT)还原法比色法[12]测定;POD活性采用愈创木酚法[12]测定;CAT活性采用钼酸铵比色法[12]测定;可溶性蛋白含量采用南京建成生物试剂盒利用考马斯亮蓝法测定;可溶性糖含量采用硫代巴比妥酸法[13]测定;脯氨酸(Pro)含量采用磺基水杨酸法[14]测定。
1.3.4 维生素C(VC)含量的测定 维生素C含量采用南京建成生物工程研究所试剂盒利用比色法测定。
1.3.5 猕猴桃总RNA 提取和qRT-PCR 分析 按照FastPure®Plant Total RNA Isolation Kit(Vazyme,Beijing China)RNA提取试剂盒的操作流程对猕猴桃不同胁迫处理后的试验样品材料分别提取总RNA。按照反转录试剂盒HiScript Ⅲ1st Strand cDNA Synthesis Kit(+gDNA wiper)(Vazyme,Beijing China)的操作说明进行反转录获得cDNA。
利用引物设计软件PrimerPrimer 5.0 设计引物,并交由生工®生物有限公司(Sangon Biotech)进行引物的合成(表1)。实时荧光定量PCR 选用ChamQ Universal SYBR qPCR Master Mix(Vazyme,Beijing China)荧光定量PCR试剂,采用20 μL的反应体系:2×ChamQ Universal SYBR qPCR Master Mix 10 μL、基因上下游引物各0.6 μL、模板cDNA 2 μL、50×Reference Dye 2 μL 和ddH2O 4.8 μL。荧光定量PCR 的反应程序:95 ℃15 min;95 ℃10 s,60 ℃20 s,共40个循环。以猕猴桃AcActin 作为内参基因,采用2-△△Ct法计算分析各基因的表达情况。
表1 qRT-PCR 所用的引物序列
Table 1 Primer sequences for qRT-PCR

基因名称Gene name Acc09764 Acc02578 Acc03074 Acc16343 Acc33422 Acc04179 Acc09261 Acc04722 ACC24491 Acc20521 Acc15636 Acc21754 AcActin上游引物Forward primer(5'-3')CGGGTCTCCTCCTTCT GCCGAACAATGGGAAGG TTGTGCGATAAGGTTGG CTATGCAGCGACCAATCCT CTTGTTGAGTTGGGTAGG TTGAAGAGTCCCAGCAT GCTCGTATAATGATCCCTCTAATG ACCTTCTGGGCTGTCT CATTTCAGGGACGACG TGAACCTTTGTGGGATT TTCGGCACTAATAAACCC TGCTCGGACGCAAGAC TGCATGAGCGATCAAGTTTCAAG下游引物Reverse primer(5'-3')GCTGCAACGCACAAA GCACAGCACATAACACGAAA CCTGCTCCTGGTGATTT ACCTACATCCACCACCGAGT TTTGCTGCACGGTTG TCCCGTCACTCATAACC CGTGCTTGGACCCAGTGTAT AGTTTCGGGTCGTCAT GACGCCACAAGACCAG GGATTTGATGCTGCTACT GCTCCGTCTGAACCACC GCTCACCGCCGTACTTT TGTCCCATGTCTGGTTGATGACT
1.4 数据处理与分析
使用Excel 2018整理统计数据,使用软件SPSS 17.0 对试验数据进行单因素方差分析和相关性分析,并比较不同数据组间的差异显著性(LSD,α=0.05)。采用GraphPad Prism 8.0.2软件作图,图中数据均为3次生物学重复的平均值。
2 结果与分析
2.1 不同浓度盐处理抑制猕猴桃的生长
用0、50、100、150 和200 mmol·L-1 NaCl 的Hoagland 营养液,每隔3 d 处理一次红阳猕猴桃苗,处理10 d。结果如图1 所示,随着NaCl 浓度的升高,红阳猕猴桃的生长状况逐渐变差,植株生长受到限制,植株矮化并开始出现萎蔫,叶片黄化,其中50和100 mmol·L-1的盐浓度对红阳猕猴桃苗的影响较小,150 mmol·L-1处理后植株开始出现明显黄化并开始萎蔫,植株矮化,200 mmol·L-1处理后植株萎蔫严重,并出现落叶现象。随着NaCl浓度的升高,植株叶片逐渐变小并且表现出卷边、焦边、叶色暗绿并出现枯斑等,不同浓度处理下植株和叶片形态差异明显,表明盐胁迫显著抑制了红阳猕猴桃正常的生长发育。

图1 NaCl 处理后植株及叶片形态变化
Fig.1 Morphological changes of plants after NaCl treatment
2.2 不同浓度盐处理降低了猕猴桃叶片的净光合速率
基于盐胁迫下猕猴桃植株生长缓慢、矮小的表型,首先对植株叶片的光合速率进行了测定。结果如图2 所示,随着盐处理浓度的升高,猕猴桃叶片净CO2代谢速率逐渐降低,且各盐处理浓度之间呈现出显著差异。上述结果说明,盐处理显著抑制了猕猴桃的光合作用和净光合速率,进而引起植株生长缓慢、植株矮小,并且盐浓度越高抑制作用越明显。
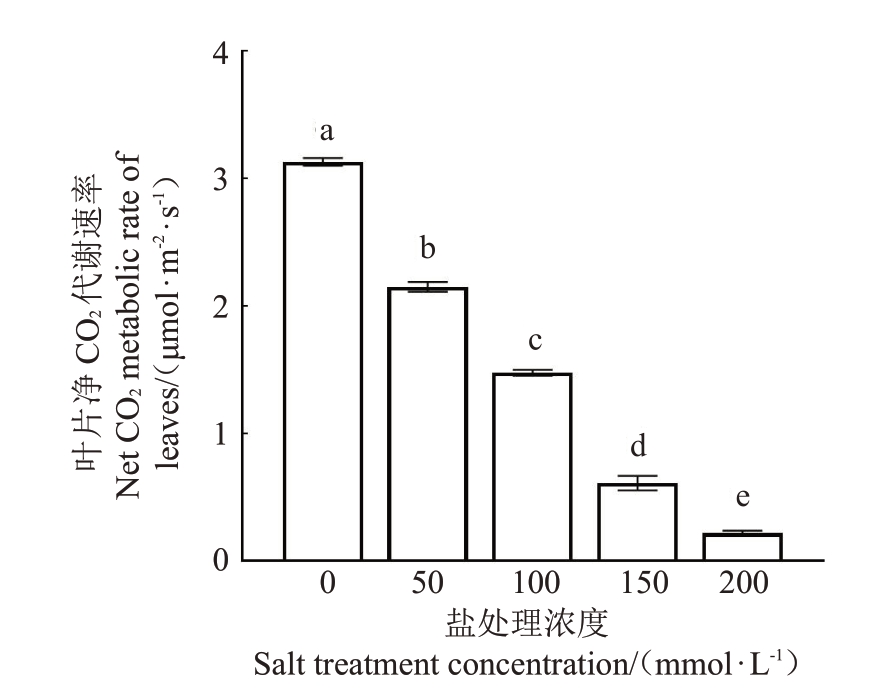
图2 不同浓度NaCl 处理下猕猴桃叶片的净光合速率
Fig.2 Net photosynthetic rate of leaves under different NaCl concentrations
2.3 不同浓度的盐处理影响了猕猴桃细胞质膜透性
研究表明,细胞膜作为细胞与环境之间的屏障,植物遭受逆境伤害时细胞膜结构最先遭到损伤,细胞内的电解质会外渗[15]。由图3 可知,随着盐处理浓度的增加,相对电导率呈上升趋势,表明细胞膜受损程度增大。200 mmol·L-1时相对电导率达到最高,与0、50、100和150 mmol·L-1盐处理浓度相比差异显著,表明此时红阳猕猴桃的细胞质膜已遭受到严重伤害。显著性差异分析显示,100 mmol·L-1时相对电导率与对照之间就出现了显著差异,之后再随着盐处理浓度的持续增高,细胞膜透性的增幅越大。高浓度的盐分甚至破坏了猕猴桃的质膜系统。
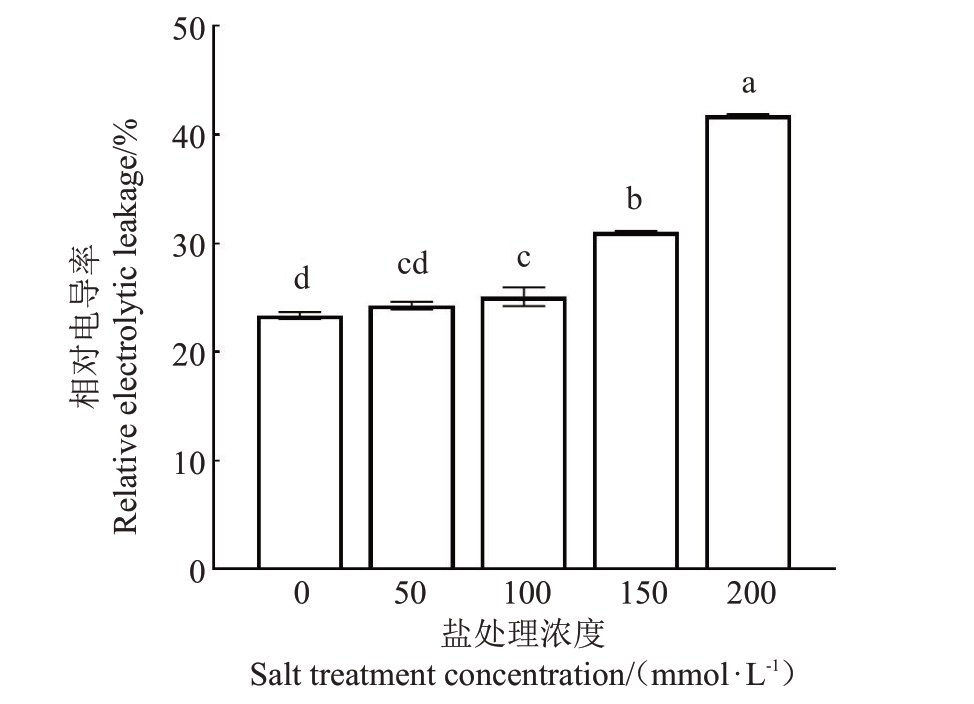
图3 不同浓度盐处理下的相对电导率
Fig.3 The relative electrical conductivity under different NaCl concentrations
2.4 不同浓度盐处理下红阳猕猴桃抗氧化酶活性的变化
POD 是广泛存在于植物体内的氧化还原酶,其作用在于维持细胞结构的完整性,增强细胞的抗衰老能力以及对抗不良环境的影响[16]。由图4 可以看出,随着NaCl 浓度的增加,POD 活性呈先下降后上升的趋势。50和100 mmol·L-1盐处理下POD活性显著低于对照,100 mmol·L-1时,POD活性最低。随着盐浓度的继续升高,POD活性开始增加,200 mmol·L-1时,POD 活性达到最高,与对照相比差异显著,说明POD对不同的盐浓度有不同的响应。
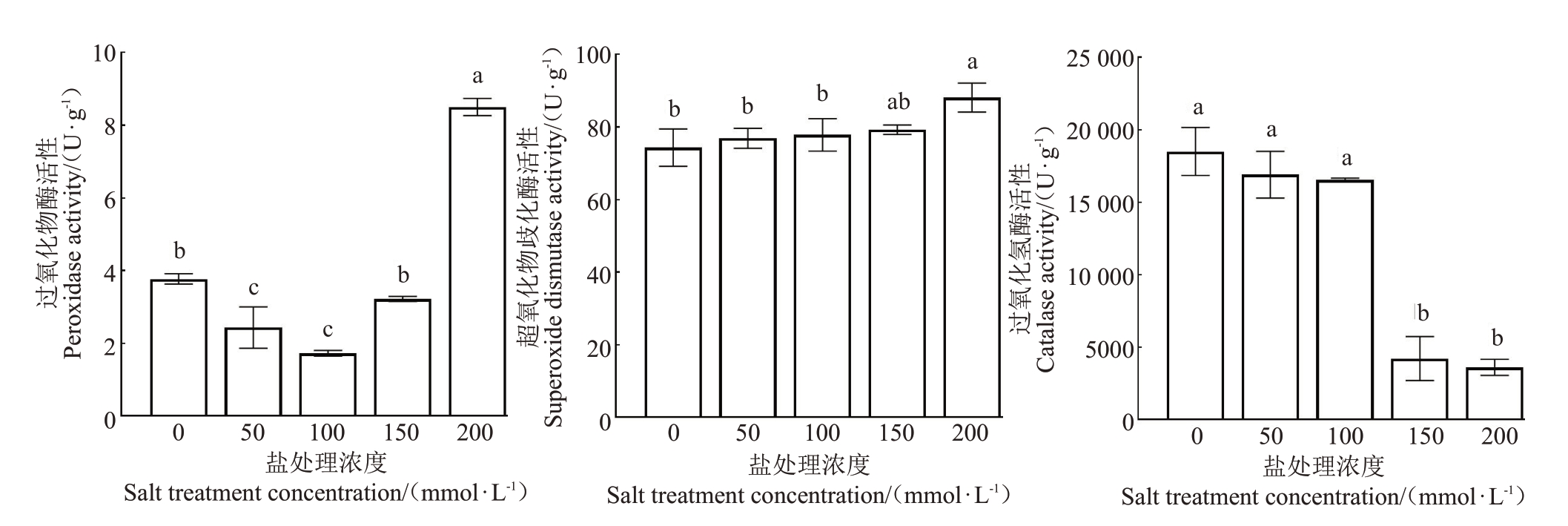
图4 不同浓度NaCl 处理下抗氧化物酶活性
Fig.4 Antioxidant activities under different NaCl concentrations
SOD 可催化歧化反应,作为植物体第一道防线清除累积的ROS,保护细胞免受氧化损伤[17]。由图4可以看出,随着NaCl 处理浓度的增加,SOD 活性呈现上升趋势,当盐处理浓度为200 mmol·L-1时,SOD活性达到最高,与对照相比差异显著。说明盐处理浓度越高,红阳猕猴桃遭受的氧化胁迫越严重,SOD活性升高可以保护细胞免受氧化胁迫。
CAT作为一种专门去除H2O2的保护酶,其活性与植物的抗逆性息息相关,当H2O2积累时会引发破坏性氧化反应,而CAT与SOD的协同作用则可有效去除植物体内的H2O2,避免其对植物细胞膜系统造成破坏[18]。由图4 可以看出,盐处理下CAT 活性总体呈下降趋势,说明盐胁迫对植物的过氧化伤害不是通过产生过量的H2O2。特别是50和100 mmol·L-1之间,CAT 的活性变化不显著。当盐浓度为150 和200 mmol·L-1时,CAT 活性显著低于对照,说明两种浓度的盐胁迫已经对植物体造成了较严重的伤害。
2.5 不同浓度盐处理下猕猴桃渗透物质的变化
当受到盐胁迫时,植物会通过调节渗透调节物质的合成来调节自身细胞的渗透压,从而缓解盐胁迫[19]。因此当植物受到胁迫时,细胞内的渗透调节剂含量将会发生变化[20]。由图5 可以看出,随着盐处理浓度的升高,可溶性糖和可溶性蛋白含量变化一致,呈现出先增加后降低的趋势。盐处理浓度为100 mmol·L-1时,可溶性糖和可溶性蛋白含量均达到最大,说明红阳猕猴桃在此盐胁迫条件下,通过积累可溶性糖和可溶性蛋白来维持细胞渗透势,缓解盐害。当盐处理浓度大于100 mmol·L-1时,随着盐处理浓度的升高,可溶性糖和可溶性蛋白含量逐渐增加,说明当盐浓度超过100 mmol·L-1时,超过了猕猴桃细胞可调节的渗透势范围。随着盐处理浓度的升高,脯氨酸含量逐渐上升,在盐处理浓度为200 mmol·L-1时,达到最高。说明在盐胁迫条件下,红阳猕猴桃通过提高脯氨酸含量以提高细胞水势,从而提高自身对盐胁迫的抵抗能力。
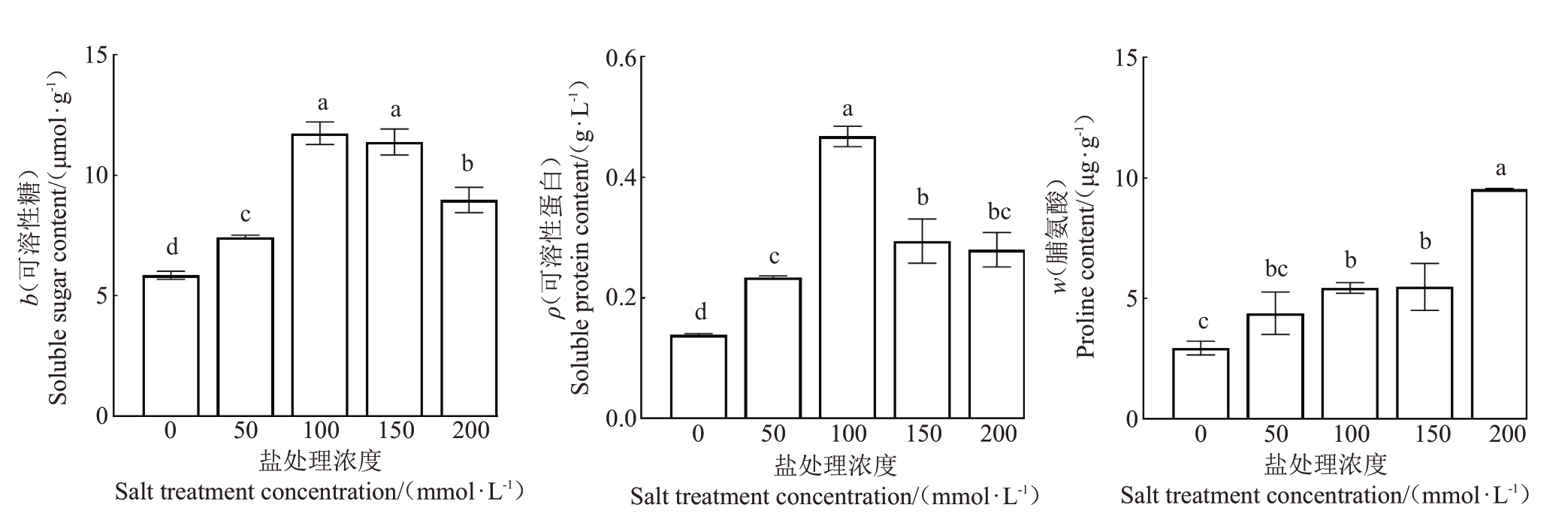
图5 不同浓度NaCl 处理下红阳猕猴桃渗透调节物质含量的变化
Fig.5 Contents of osmoregulatory substances in kiwifruit under different NaCl concentrations
2.6 不同浓度盐处理下MDA和VC含量的变化
MDA含量反映了植物质膜过氧化的程度,可间接评价植物细胞膜的受损状况,也是鉴定植物耐盐性的重要生理指标[21]。由图6 可以看出,随着盐处理浓度的升高,MDA含量先升高后降低。在盐浓度为100 mmol·L-1时,含量达到最高,说明红阳猕猴桃盐胁迫下活性氧大量积累,膜脂发生过氧化,MDA含量升高。当盐浓度超过100 mmol·L-1时,MDA含量不再持续升高,推测此时超出了红阳猕猴桃对膜脂过氧化的有效调节范围。
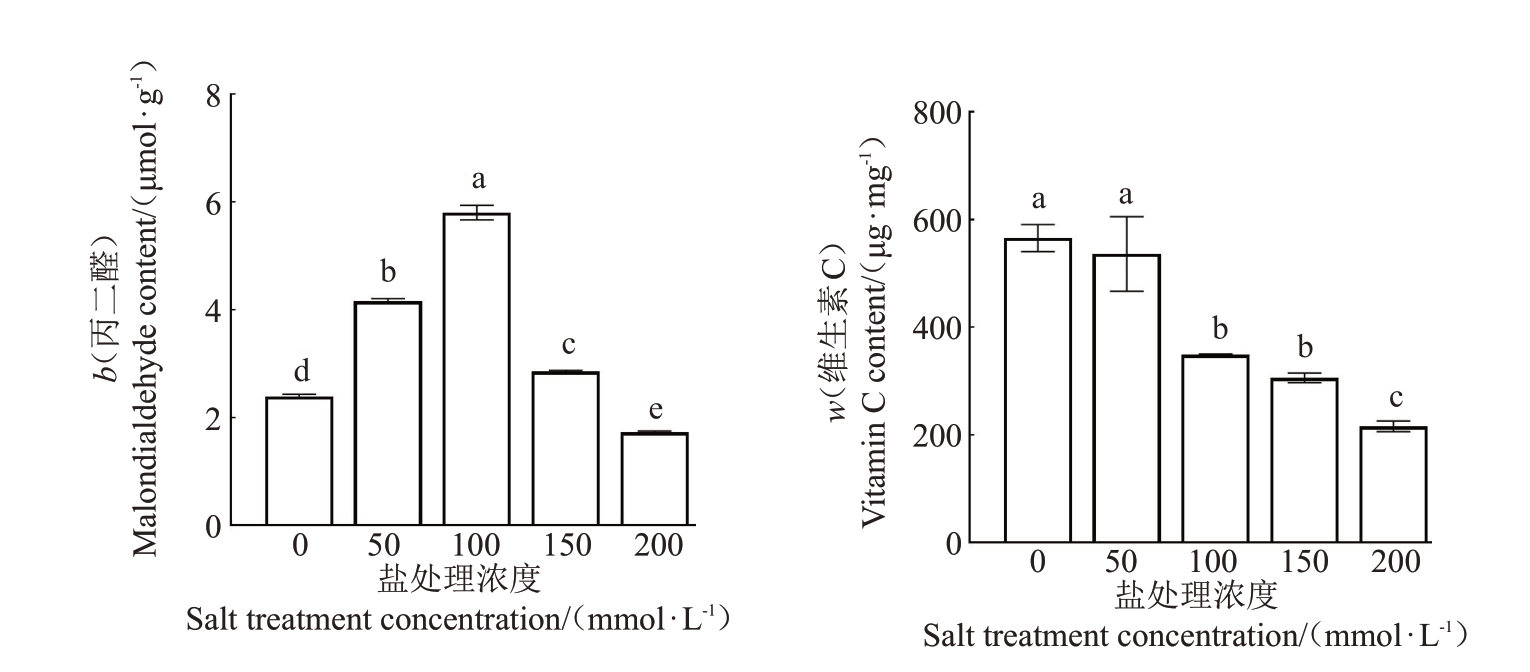
图6 不同浓度NaCl 处理下猕猴桃中的丙二醛和维生素C 含量情况
Fig.6 Contents of MDA and vitamin C in kiwifruit under different NaCl concentrations
在植物中,维生素C是重要的还原剂,可以清除生物和非生物胁迫产生的活性氧,从而保护植物细胞免受活性氧伤害,增强其抗逆能力[22-23]。由图6可以看出,随着盐处理浓度的升高,VC 含量逐渐降低。当盐浓度为50 mmol·L-1时,VC含量虽然相比对照有所下降,但是差异不显著;当盐浓度为100 mmol·L-1时,VC 含量相比对照显著降低,说明此浓度下,猕猴桃植株体内发生了一定程度的氧化胁迫;200 mmol·L-1时,VC 含量进一步显著降低,说明更多的VC用于清除生成的过氧化产物。
2.7 不同浓度盐处理下盐胁迫相关基因表达情况
为了从分子水平上进一步探究红阳猕猴桃对盐胁迫的响应,笔者在本研究中通过荧光定量PCR技术对盐胁迫相关基因的表达情况进行了分析,结果如图7所示。在盐浓度为150 mmol·L-1时,乙烯受体基因Acc04179 和Acc33422 表达量显著升高,在50和100 mmol·L-1时Acc04179 和Acc33422 的表达量无显著变化。说明红阳猕猴桃受到高盐胁迫时,通过对乙烯信号通路的调节响应盐胁迫。褪黑素途径响应基因Acc02578 和Acc03074 的表达变化大致相同,在50、100 和150 mmol·L-1时,基因表达升高;当盐浓度为200 mmol·L-1时,基因表达降低。而褪黑素另一响应基因Acc16343 在高盐处理下表达量明显升高,说明不同褪黑素响应途径的基因对不同盐处理浓度的敏感程度不同,盐处理会促进褪黑素途径基因的表达来响应盐胁迫[24]。
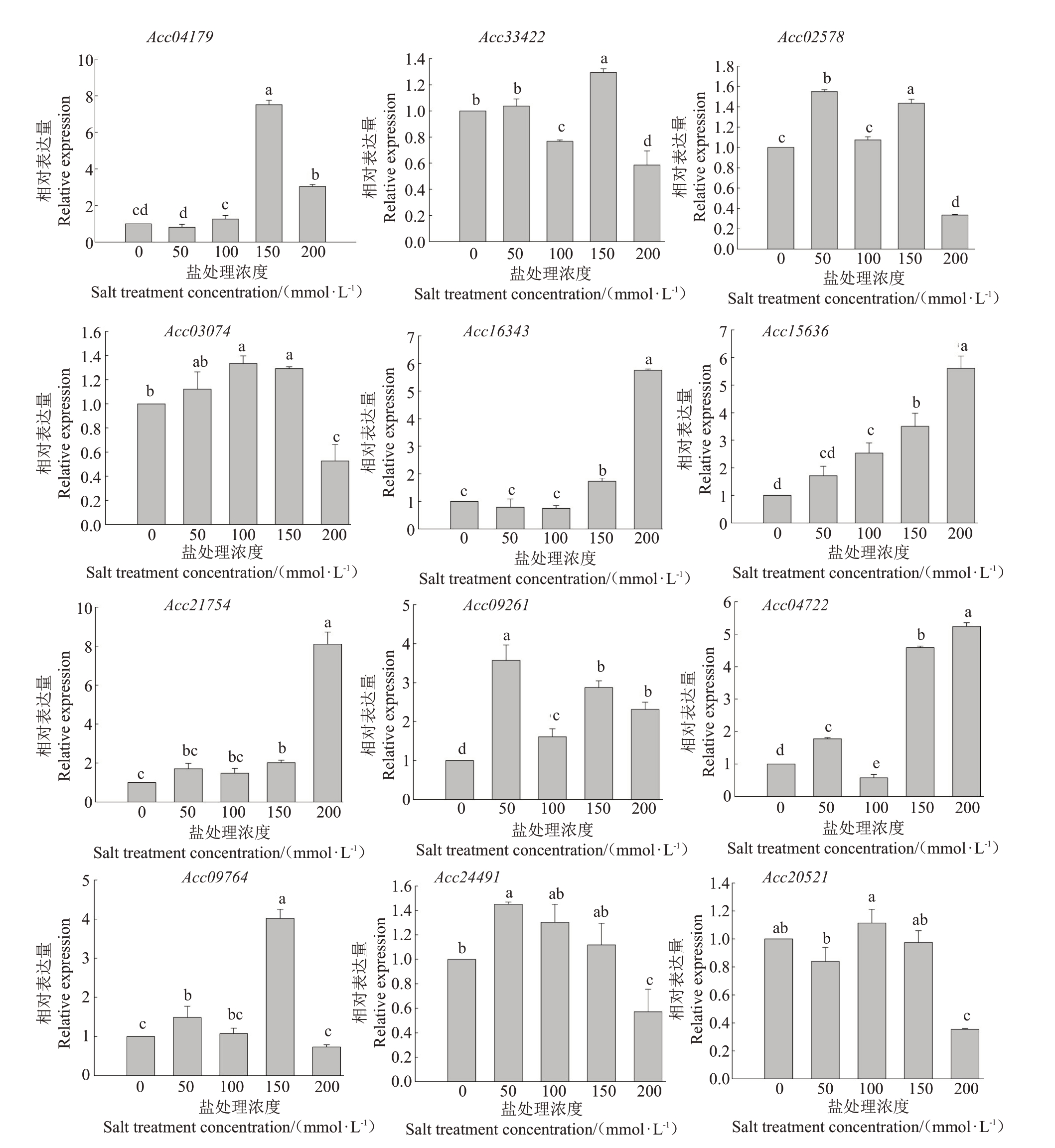
图7 不同浓度NaCl 处理下红阳猕猴桃相关基因的表达
Fig.7 Expressions of related genes in kiwifruit under different NaCl concentrations
由图7 可以看出,盐处理下耐盐基因Acc15636和Acc21754的表达量均上调,参与红阳猕猴桃对盐胁迫的应答响应。其中Acc15636 的表达量随着盐浓度的增加而上升,说明盐处理浓度越高,猕猴桃对盐胁迫的响应越明显,这与本研究中SOD活性和脯氨酸含量的变化趋势相同。Acc21754 在盐浓度为200 mmol·L-1时表达量明显上升,说明高盐处理显著促进了耐盐基因的表达,猕猴桃从分子水平上通过调动耐盐基因的表达来响应盐胁迫。
Acc09261基因可以促进植物体中ABA的积累,在ABA生物合成中发挥重要作用[25]。由图7可以看出,盐处理下Acc09261 上调,说明盐处理促进了红阳猕猴桃植株中ABA的积累。基因Acc04722编码了ABA 羟基化作用过程中关键限速酶——ABA 羟化酶[26]。Liu等[27]通过RNAi技术抑制水稻中该基因OsABA8oxl 的表达,提高了水稻内源ABA 水平,显著提高了水稻对碱胁迫的耐受性。由图7 可以看出,红阳猕猴桃在100 mmol·L-1盐处理下Acc04722基因的表达显著降低,抑制了ABA 的分解代谢,提高了植株中的ABA 含量;而在150 和200 mmol·L-1盐处理下Acc04722 显著上调,加速了ABA 降解使ABA 含量下降。说明当盐胁迫在猕猴桃可调控范围内时,其通过抑制ABA 的分解代谢以提高ABA含量,提高植株的耐盐能力,而高浓度盐胁迫则可能超出了猕猴桃ABA代谢调节的可控范围。
Acc09764 和Acc24491 分别为渗透调节响应基因和活性氧(H2O2)生成调节基因,由图7可以看出,Acc09764和Acc24491的表达量变化趋势大致相同,先上升后下降,说明盐胁迫促进了红阳猕猴桃渗透胁迫相应基因的表达,进而提高自身的耐盐性;而活性氧合成基因的表达会使猕猴桃积累大量活性氧,因此高盐处理抑制了渗调基因和活性氧合成基因的表达。Acc20521 为VC 生物合成途径基因,由图7可以看出,盐胁迫下Acc20521 的表达量变化不明显,说明红阳猕猴桃未通过提高VC 含量的途径来提高自身的抗盐能力。但本研究的生理指标测定显示盐处理后VC含量下降,推测是植株原有的VC被氧化的结果。
3 讨 论
盐胁迫引起土壤盐渍化和离子失衡,导致植物代谢紊乱、营养缺乏和氧化损伤等,对光合作用、呼吸作用和能量代谢等一系列生理过程产生抑制作用[28]。本试验探究了不同盐浓度处理下红阳猕猴桃植株形态、渗透调节物质、抗氧化物酶活性以及相关基因表达量的变化。本试验中随着盐浓度的升高,红阳猕猴桃开始出现植株矮化、萎蔫、叶片黄化等现象并且植株净光合速率降低,细胞质膜透性增大,这与吕廷良等[29]盐处理紫荆所测Pn变化结果以及刘会超等[30]盐处理三色堇所测细胞质膜透性变化结果一致。盐胁迫会抑制红阳猕猴桃的光合作用,破坏膜系统的稳定性并影响其正常的生长发育。
本研究中,随着盐处理浓度的升高,POD 活性呈先下降后上升的趋势,低中浓度盐处理对红阳猕猴桃POD活性影响较大,这一结果与刘会超等[30]盐胁迫导致三色堇茎POD 活性变化的结果一致。SOD 活性呈现上升趋势,盐处理浓度越高,红阳猕猴桃遭受的氧化胁迫越严重,SOD活性的提高可保护细胞免受氧化胁迫,这一结果与王舒钥[31]对软枣猕猴桃进行盐处理,SOD 活性上升的结果一致。CAT活性总体呈下降趋势,表明红阳猕猴桃CAT活性受盐胁迫影响较大。
在渗透调节物质变化方面,本研究发现随着盐处理浓度升高,猕猴桃植株中可溶性糖和蛋白质含量呈现出先增加后减少的趋势,这与张伟等[32]对盐处理红花草莓托斯卡纳,所得可溶性糖和蛋白质含量变化趋势一致。当盐浓度为100 mmol·L-1时,可溶性糖和蛋白含量达到最大。说明猕猴桃在盐胁迫下,通过积累可溶性糖和蛋白来维持细胞渗透势,保护细胞结构,缓解盐害。MDA含量反映了植物质膜过氧化的程度,间接评价植物细胞膜的受损状况,也是鉴定植物耐盐性的重要生理指标[21]。植物遭受盐胁迫伤害后,会造成植物体内MDA的大量累积,其原因是植物体内活性氧清除能力和活性氧的产生能力的动态平衡被破坏,活性氧水平的提高,导致植物自身膜脂过氧化,此时的植物膜蛋白就会受到损伤,植物的细胞结构就遭到了损害[33]。红阳猕猴桃MDA 含量随盐浓度的增加呈现出先升高后降低的趋势,在100 mmol·L-1时,MDA含量达到最高,说明此时膜脂过氧化程度最高。维生素C是重要的抗氧化剂,可以清除生物和非生物胁迫产生的活性氧,从而保护植物细胞免受活性氧伤害,增强其抗逆能力,调节其正常生长发育[22-23]。笔者在本研究中也发现随着盐浓度的升高,VC 含量逐渐降低,在猕猴桃的抗氧化损伤中具有重要作用。
通过分析红阳猕猴桃盐胁迫相关基因的表达发现,在一定NaCl浓度下,乙烯受体基因、ROS生成调节基因、耐盐基因、ABA正反馈调节基因、渗透胁迫响应基因和褪黑素响应基因被诱导表达。VC 合成和ABA 分解代谢基因的表达被抑制,这与汪文杰等[34]对盐胁迫猕猴桃叶片维生素C合成基因表达分析和梁旺利等[35]对NaCl 胁迫下宁夏枸杞ABA 代谢相关基因差异表达分析的结果一致。已有研究证明褪黑素途径基因的表达可促进猕猴桃叶片中脯氨酸和可溶性糖积累,进而增加可溶性蛋白含量[24]。本研究中盐胁迫相关基因表达变化也与生理指标所测结果具有一致性,因此盐胁迫下,红阳猕猴桃也通过调节胁迫相关基因表达,来缓解氧化胁迫,提高抗盐能力。
4 结 论
在一定的盐浓度条件下,红阳猕猴桃可以通过渗透调节、抗氧化酶系统调节以及抗逆基因的响应来调节自身的新陈代谢,维持正常的生命活动,维持体内水分平衡,清除有毒有害物质,提高自身的耐盐能力。本研究结果表明100 mmol·L-1的NaCl 浓度为红阳猕猴桃可有效调节的最大范畴,为猕猴桃在盐碱地的大面积种植提供了参考。
[1] 吕正鑫,贺艳群,贾东峰,黄春辉,钟敏,廖光联,朱壹,袁开昌,刘传浩,徐小彪.猕猴桃种质资源表型性状遗传多样性分析[J].园艺学报,2022,49(7):1571-1581.LÜ Zhengxin,HE Yanqun,JIA Dongfeng,HUANG Chunhui,ZHONG Min,LIAO Guanglian,ZHU Yi,YUAN Kaichang,LIU Chuanhao,XU Xiaobiao.Genetic diversity analysis of phenotypic traits for kiwifruit germplasm resources[J].Acta Horticulturae Sinica,2022,49(7):1571-1581.
[2] 黄亚欣,李秋萍,朱童,焦玉茹,杨慧,权美英,吴素芳,谭永元,赵晓蕾,牛艳艳,马华,李添群,刘艺,侯开宇.不同品种猕猴桃的营养品质对比分析[J].中国食品,2024(6):154-157.HUANG Yaxin,LI Qiuping,ZHU Tong,JIAO Yuru,YANG Hui,QUAN Meiying,WU Sufang,TAN Yongyuan,ZHAO Xiaolei,NIU Yanyan,MA Hua,LI Tianqun,LIU Yi,HOU Kaiyu.Comparative analysis of nutritional quality of different varieties of kiwifruit[J].China Food,2024(6):154-157.
[3] 齐贝贝,莫权辉,王发明,叶开玉,李洁维.猕猴桃逆境胁迫研究进展[J].现代农业科技,2024(18):72-77.QI Beibei,MO Quanhui,WANG Faming,YE Kaiyu,LI Jiewei.Research progress on adversity stress of kiwifruit[J].Modern Agricultural Science and Technology,2024(18):72-77.
[4] 赵起越,夏夜,邹本东.土壤盐渍化成因危害及恢复[J].农业与技术,2022,42(11):115-119.ZHAO Qiyue,XIA Ye,ZOU Bendong.Genetic damage and restoration of soil salinization[J].Agriculture and Technology,2022,42(11):115-119.
[5] 李春景,刘山林.盐碱地改良技术评价及应用研究:评《盐碱地改良技术实用问答及案例分析》[J].灌溉排水学报,2024,43(4):121.LI Chunjing,LIU Shanlin.Research on evaluation and application of saline:Alkali land improvement technology-review of Practical Questions and Case Analysis of Saline-alkali Land Im-provement Technology[J].Journal of Irrigation and Drainage,2024,43(4):121.
[6] 陆宝金,田生昌,左忠,杨英,张祯.盐渍化土地可持续利用研究综述及展望[J].宁夏大学学报(自然科学版),2023,44(1):79-88.LU Baojin,TIAN Shengchang,ZUO Zhong,YANG Ying,ZHANG Zhen.Review and prospect on sustainable utilization of salinized land[J].Journal of Ningxia University (Natural Science Edition),2023,44(1):79-88.
[7] 林余乐.盐生植物对盐胁迫的响应机制综述[J].福建轻纺,2024(6):29-32.LIN Yule.Review on response mechanism of halophytes to salt stress[J].The Light & Textile Industries of Fujian,2024(6):29-32.
[8] 魏国庆.基于多组学联合分析杨树MPK7 基因应答盐胁迫的调控机制[D].泰安:山东农业大学,2023.WEI Guoqing.Analysis of the regulatory mechanism of poplar MPK7 gene in response to salt stress based on the combination of multi-omics[D].Tai’an:Shandong Agricultural University,2023.
[9] 赵昊阳,朱俊杰.植物激素对盐胁迫的响应、适应及调控机制研究进展[J/OL].分子植物育种,2023:1-22(2023-07-24).https://kns.cnki.net/kcms/detail/46.1068.S.20230724.1431.005.html.ZHAO Haoyang,ZHU Junjie.Research progress on response,adaptation and regulation mechanisms of plant hormones to salt stress[J/OL].Molecular Plant Breeding,2023:1-22(2023-07-24).https://kns.cnki.net/kcms/detail/46.1068.S.20230724.1431.005.html.
[10] ABID M,GU S C,ZHANG Y J,SUN S H,LI Z,BAI D F,SUN L M,QI X J,ZHONG Y P,FANG J B.Comparative transcriptome and metabolome analysis reveal key regulatory defense networks and genes involved in enhanced salt tolerance of Actinidia(kiwifruit)[J].Horticulture Research,2022,9:uhac189.
[11] 邹琦.植物生理生化实验指导[M].北京:中国农业出版社,2003.ZOU Qi.Plant Physiology and biochemistry experimental manual[M].Beijing:China Agricultural Press,2003.
[12] 王学奎.植物生理生化实验原理和技术[M].2 版.北京:高等教育出版社,2006.WANG Xuekui.Principles and techniques of plant physiological biochemical experiment[M].2nd ed.Beijing:Higher Education Press,2006.
[13] 李合生.现代植物生理学[M].3 版.北京:高等教育出版社,2012:361-366.LI Hesheng.Modern plant physiology[M].3rd ed.Beijing:Higher Education Press,2012:361-366.
[14] 汪耀富,张瑞霞,胡筱岚,靖军领.渗透胁迫下氮肥形态对烟叶脯氨酸和内源激素含量的影响[J].安徽农业科学,2004,32(4):738-741.WANG Yaofu,ZHANG Ruixia,HU Xiaolan,JING Junling.Effect of osmotic stress on proline and endogenous hormone content in flue-cured tobacco leaves under different nitrogen forms[J].Journal of Anhui Agricultural Sciences,2004,32(4):738-741.
[15] 姚玉涛,张国新,丁守鹏,孙叶烁.盐胁迫对草莓苗期生长及氧化还原系统的影响[J].北方园艺,2021(17):22-29.YAO Yutao,ZHANG Guoxin,DING Shoupeng,SUN Yeshuo.Effects of salt stress on strawberry seedling growth and antioxidant system[J].Northern Horticulture,2021(17):22-29.
[16] 黄一波,汪结明,李瑞雪,向言词,宋禹,颜玲玉.7 种木莲属植物抗寒性评价及其生理机制[J].热带亚热带植物学报,2021,29(5):519-529.HUANG Yibo,WANG Jieming,LI Ruixue,XIANG Yanci,SONG Yu,YAN Lingyu.Evaluation of cold resistance and physiological mechanism of seven Manglietia species[J].Journal of Tropical and Subtropical Botany,2021,29(5):519-529.
[17] 鲁松松,黄宇哲,张梦洋.红尾沙蜥超氧化物歧化酶适应高原的分子机制[J].兰州大学学报(自然科学版),2022,58(1):69-78.LU Songsong,HUANG Yuzhe,ZHANG Mengyang.Molecular mechanism of superoxide dismutase’s adaptation to plateau in Phrynocephalus erythrurus[J].Journal of Lanzhou University(Natural Sciences),2022,58(1):69-78.
[18] 位杰,张琦,林彩霞,蒋媛.不同梨品种(系)叶片解剖结构及其与抗寒性的关系[J].河南农业科学,2021,50(8):103-112.WEI Jie,ZHANG Qi,LIN Caixia,JIANG Yuan.Relationship between cold tolerance and leaf structure of different pear varieties(strains)[J].Journal of Henan Agricultural Sciences,2021,50(8):103-112.
[19] 何子华.盐胁迫下胀果甘草和乌拉尔甘草渗透调节特征的比较分析[D].兰州:兰州大学,2022.HE Zihua.Comparative analysis on the osmoregulatory characteristics of Glycyrrhiza inflata and G.uralensis under salt stress[D].Lanzhou:Lanzhou University,2022.
[20] 倪强.NaCl 胁迫对不同种源黑果枸杞组培苗生理及荧光特性的影响[D].兰州:甘肃农业大学,2020.NI Qiang.Effect of NaCl stress on physiological and fluorescence characteristics of different provenances Lycium ruthenicum Murr.tissue culture seeding[D].Lanzhou:Gansu Agricultural University,2020.
[21] 张晓婷,王雪松,贾文飞,徐振彪,王颖,吴林.植物在盐处理下的研究进展[J].北方园艺,2021(6):137-143.ZHANG Xiaoting,WANG Xuesong,JIA Wenfei,XU Zhenbiao,WANG Ying,WU Lin.Research progress of plants under salt treatment[J].Northern Horticulture,2021(6):137-143.
[22] HAN X,ZHANG Y L,ZHANG Q,MA N,LIU X Y,TAO W J,LOU Z Y,ZHONG C H,DENG X W,LI D W,HE H.Two haplotype-resolved,gap-free genome assemblies for Actinidia latifolia and Actinidia chinensis shed light on the regulatory mechanisms of vitamin C and sucrose metabolism in kiwifruit[J].Molecular Plant,2023,16(2):452-470.
[23] 陈卫芳,袁伟玲,刘志雄,严承欢,陈磊夫,张文格.植物抗坏血酸合成调控研究进展[J].植物生理学报,2023,59(3):481-489.CHEN Weifang,YUAN Weiling,LIU Zhixiong,YAN Chenghuan,CHEN Leifu,ZHANG Wenge.Research progress on regulation of ascorbic acid synthesis in plant[J].Plant Physiology Journal,2023,59(3):481-489.
[24] 倪知游,夏惠,高帆,刘继,胡容平,梁东.外源褪黑素对猕猴桃幼苗盐胁迫的缓解作用[J].四川农业大学学报,2017,35(4):535-539.NI Zhiyou,XIA Hui,GAO Fan,LIU Ji,HU Rongping,LIANG Dong.Alleviation of exogenous melatonin on kiwifruit seedlings under salt stress[J].Journal of Sichuan Agricultural University,2017,35(4):535-539.
[25] LI Y X,ZHOU J H,LI Z,QIAO J Z,QUAN R D,WANG J,HUANG R F,QIN H.Salt and ABA response ERF1 improves seed germination and salt tolerance by repressing ABA signaling in rice[J].Plant Physiology,2022,189(2):1110-1127.
[26] YOSHIDA T,CHRISTMANN A,YAMAGUCHI-SHINOZAKI K,GRILL E,FERNIE A R.Revisiting the basal role of ABAroles outside of stress[J].Trends in Plant Science,2019,24(7):625-635.
[27] LIU X L,XIE X Z,ZHENG C K,WEI L X,LI X W,JIN Y Y,ZHANG G H,JIANG C J,LIANG Z W.RNAi-mediated suppression of the abscisic acid catabolism gene OsABA8ox1 increases abscisic acid content and tolerance to saline-alkaline stress in rice (Oryza sativa L.)[J].The Crop Journal,2022,10(2):354-367.
[28] ZHU D,LUO F,ZOU R,LIU J X,YAN Y M.Integrated physiological and chloroplast proteome analysis of wheat seedling leaves under salt and osmotic stresses[J].Journal of Proteomics,2021,234:104097.
[29] 吕廷良,孙明高,宋尚文,马万侠,张鹏.盐、旱及其交叉胁迫对紫荆幼苗净光合速率及其叶绿素含量的影响[J].山东农业大学学报(自然科学版),2010,41(2):191-195.LÜ Tingliang,SUN Minggao,SONG Shangwen,MA Wanxia,ZHANG Peng.Study on photosynthesis characteristics of Cercis chinensis bunge under drought and salt stress[J].Journal of Shandong Agricultural University (Natural Science Edition),2010,41(2):191-195.
[30] 刘会超,姚连芳,贾文庆,朱婷婷.盐胁迫对三色堇茎CAT、POD 及细胞质膜透性的影响[J].贵州农业科学,2010,38(4):51-53.LIU Huichao,YAO Lianfang,JIA Wenqing,ZHU Tingting.Effects of salt stress on CAT,POD and the cell membrane permeability of Viola tricolor stems[J].Guizhou Agricultural Sciences,2010,38(4):51-53.
[31] 王舒钥.光照及盐水灌溉对软枣猕猴桃叶片生理功能的影响[D].乌鲁木齐:新疆农业大学,2022.WANG Shuyue.Effects of light and saline irrigation on the physiological functions in leaves of Actinidia arguta[D].Urumqi:Xinjiang Agricultural University,2022.
[32] 张伟,陈毓蔚,牛亚菲,冯悦,侯非凡,亢秀萍.红花草莓‘托斯卡纳’盐胁迫下的生长发育及生理响应[J].北方园艺,2023(13):28-35.ZHANG Wei,CHEN Yuwei,NIU Yafei,FENG Yue,HOU Feifan,KANG Xiuping.Growth and physiological responses of red-flowered strawberry‘Toscana’under salt stress[J].Northern Horticulture,2023(13):28-35.
[33] LI M,WU Z Y,GU H,CHENG D W,GUO X Z,LI L,SHI C Y,XU G Y,GU S C,ABID M,ZHONG Y P,QI X J,CHEN J Y.AvNAC030,a NAC domain transcription factor,enhances salt stress tolerance in kiwifruit[J].International Journal of Molecular Sciences,2021,22(21):11897.
[34] 汪文杰,刘晓莹,成畅,解潇冬,李璐璐,白洁,刘普,钟彩虹,李大卫.盐和干旱胁迫及光质对猕猴桃叶片维生素C 含量与合成基因表达的影响[J].果树学报,2022,39(2):203-210.WANG Wenjie,LIU Xiaoying,CHENG Chang,XIE Xiaodong,LI Lulu,BAI Jie,LIU Pu,ZHONG Caihong,LI Dawei.Effects of salt and drought stresses and light quality on vitamin C content and expression of synthetic genes in kiwifruit leaves[J].Journal of Fruit Science,2022,39(2):203-210.
[35] 梁旺利,于雯静,胡进红,宋繁,王玲霞,梁文裕.NaCl 胁迫下宁夏枸杞ABA 代谢相关基因差异表达分析[J].西北农业学报,2024,33(4):664-672.LIANG Wangli,YU Wenjing,HU Jinhong,SONG Fan,WANG Lingxia,LIANG Wenyu.Differential expression of ABA metabolism-related genes in Lycium barbarum under NaCl stress[J].Acta Agriculturae Boreali-occidentalis Sinica,2024,33(4):664-672.