猕猴桃为猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia)果树,起源于中国,因其果实营养价值高和口感丰富而深受消费者喜爱[1],该属共有54个种,21个变种,共约75个分类单元[2],猕猴桃的驯化栽培历史仅百余年,是近代由野生到商品化栽培最成功的植物驯化案例[3]。猕猴桃的繁育主要通过嫁接繁育、扦插繁育和组织培养等方式,其中嫁接繁育是猕猴桃商品生产、保持品种一致性的最主要和最常规的方式,选择品种特性不同且亲和的砧木不仅可以利用砧木的优势,调节接穗品种的长势、开花结果习性、果实产量和品质等,还可以提高接穗品种的抗逆性和适应性,提高生产效率[4]。生产上主要使用的砧木为美味猕猴桃(A.chinensis var.deliciosa)实生苗[5]。实生砧木遗传变异较大,对接穗树势、果实品质和果实产量等均有影响[6],通过营养系砧木繁育可以保证苗木的一致性,有利于苗期管理,同时可以提高接穗果实品质的整齐度和均一性[7],而对萼猕猴桃扦插极易成活。猕猴桃根为肉质须根系,土壤中分布较浅,对水分敏感,极其不耐涝,易受涝害胁迫。涝害已成为制约许多猕猴桃产区品质和规模的重要因素之一[8]。常用的美味实生砧木,虽然出苗率高且整齐粗壮,但根系对旱涝盐碱抗性差,不耐贫瘠[9]。因此,选育猕猴桃耐涝砧木成为猕猴桃产业发展的关键环节。湖南省湘西永顺县的猕猴桃种植户于2003年率先使用野生的“水杨桃”作为砧木,以对萼猕猴桃为主,嫁接猕猴桃优良品种,提高了接穗品种耐涝性[10]。“水杨桃”是湘西地区对软枣猕猴桃(A.arguta)、对萼猕猴桃(A.valvata)、大籽猕猴桃(A.macrosperma)和四萼猕猴桃(A.tetramera)等的俗称,因其扦插易生根,且与中华系猕猴桃品种嫁接亲和性较好[11],可以作为良好的营养系砧木。“水杨桃”常见的4个种作砧木的表现各异,在生产实践应用中也有不同的表现,不同基因型个体能显著影响接穗品种[12]。对萼猕猴桃为砧木耐涝性强[13],在淹水条件下的抗缺氧能力优于其他猕猴桃种[14];用对萼猕猴桃作砧木嫁接中华系或美味系猕猴桃,不仅可以提高植株的长势和耐涝性,还可使果实提前成熟,促进果实膨大、提高产量等[15]。目前对于“水杨桃”的应用并没有明确的分类,因此生产上常用的对萼猕猴桃种质遗传背景混乱,种植户自育的砧木来源复杂,没有达到营养系砧木遗传背景一致的要求。因此,明晰生产上常用的对萼猕猴桃资源遗传背景,可为选择优良且遗传背景清晰的砧木奠定基础。
猕猴桃的遗传多样性主要体现在形态性状多样性、营养成分及风味多样性、染色体倍性变异、同工酶水平遗传多样性和DNA 序列遗传多样性方面[16]。对表型性状多样性的研究是衡量物种多样性和检测遗传变异最主要且最直观的重要指标[17-18]。DNA分子标记是DNA序列水平遗传变异的直接反映,它既不受环境和其他因素的影响,也不受基因表达的限制,多态性高且遗传相对稳定[17]。简单重复序列(simple sequence repeats,SSR)是研究植物遗传多样性的优异的分子标记之一,已被用于多种植物的遗传多样性研究[19]。研究发现黑龙江野生软枣猕猴桃遗传多样性丰富,具有很大的育种选择潜力[20]。猕猴桃绝大多数是雌雄异株果树,必须通过授粉才能实现猕猴桃果实的高产优质,寻求早期鉴定性别的方法以达到人为控制植物性别分化的目的,在农业生产上具有重要的应用价值[21],生产实践表明用对萼猕猴桃雄株作砧木嫁接美味猕猴桃,亲和力最好[11],对萼猕猴桃的雄性优系有望成为猕猴桃嫁接砧木首选[22]。猕猴桃雌雄的形态特征只能通过观察花器官进行识别,而猕猴桃实生播种至开花结果需4 a(年)以上[23]。因此,使用DNA 分子标记早期鉴定猕猴桃植株性别是必要的。
笔者在本研究中以62 份对萼猕猴桃种质为试材,结合分析其表型性状多样性和使用SSR 标记技术,对研究的对萼猕猴桃种质进行遗传多样性分析,以明晰这些种质的遗传背景和种内遗传关系,同时使用性别相关标记鉴定这些种质的植株性别,为选育优良对萼猕猴桃雄性营养性砧木提供材料。
1 材料和方法
1.1 试验材料
试验于2022 年10 月至2024 年5 月在湖南省湖南农业大学长安基地进行,所用的62份对萼猕猴桃种质均从湖南省湘西土家族苗族自治州凤凰县收集而来,均通过扦插繁育保存在湖南农业大学长安基地猕猴桃资源圃中,分别对这62份材料进行编号。
1.2 表型性状观测
按照中华人民共和国行业标准(NY/T 2933—2016)《猕猴桃种质资源描述规范》[24]共选取36个表型性状进行观测和记录。同时在对萼猕猴桃花期通过观察花器官状态对花性进行形态性别鉴定,雄蕊败育则判定为雌株;雌蕊败育不形成胚珠则判定为雄株[25-26](图1)。在2023年先对其中19个枝叶性状进行观测与记录,62份对萼猕猴桃种质中有34份于2024年4月开花,在花期对这34份对萼猕猴桃的17个花器官性状进行观测与记录。共观测了36种表型性状,其中26个描述性性状根据分级标准进行观测并赋值(表1)。10种数值型性状包括1年生枝节间长度、1 年生枝粗度、叶片长度、叶片宽度、叶柄长度、花冠直径、花瓣数量、花萼数量、花柱数和雄蕊数。
表1 对萼猕猴桃描述性性状及其分级标准
Table 1 Descriptive traits and classification of A.valvata
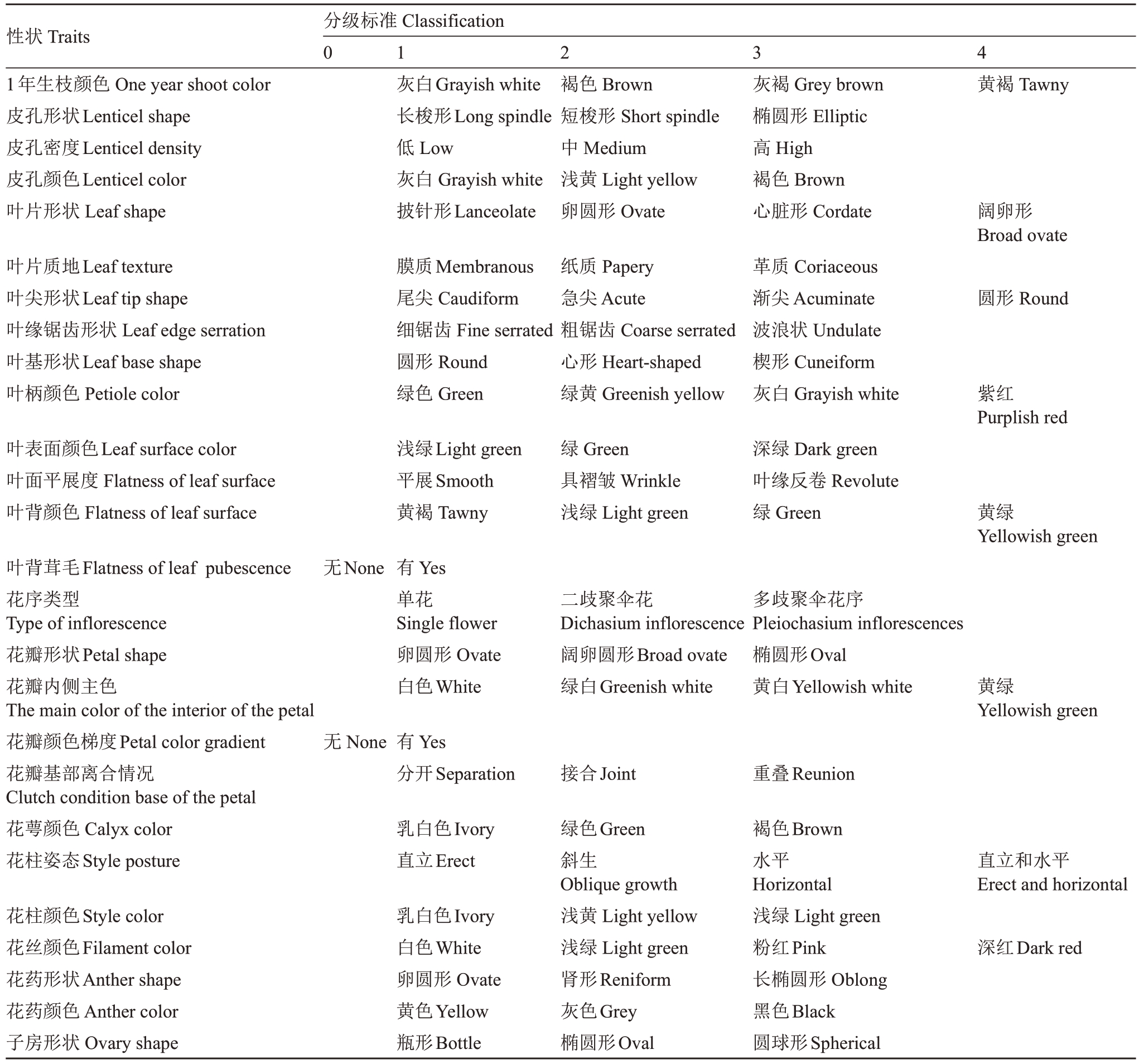
性状Traits 1年生枝颜色One year shoot color皮孔形状Lenticel shape皮孔密度Lenticel density皮孔颜色Lenticel color叶片形状Leaf shape分级标准Classification 0 1 2 3 4灰白Grayish white长梭形Long spindle低Low灰白Grayish white披针形Lanceolate褐色Brown短梭形Short spindle中Medium浅黄Light yellow卵圆形Ovate灰褐Grey brown椭圆形Elliptic高High褐色Brown心脏形Cordate黄褐Tawny阔卵形Broad ovate叶片质地Leaf texture叶尖形状Leaf tip shape叶缘锯齿形状Leaf edge serration叶基形状Leaf base shape叶柄颜色Petiole color膜质Membranous尾尖Caudiform细锯齿Fine serrated圆形Round绿色Green纸质Papery急尖Acute粗锯齿Coarse serrated心形Heart-shaped绿黄Greenish yellow革质Coriaceous渐尖Acuminate波浪状Undulate楔形Cuneiform灰白Grayish white圆形Round紫红Purplish red叶表面颜色Leaf surface color叶面平展度Flatness of leaf surface叶背颜色Flatness of leaf surface浅绿Light green平展Smooth黄褐Tawny绿Green具褶皱Wrinkle浅绿Light green深绿Dark green叶缘反卷Revolute绿Green 黄绿Yellowish green叶背茸毛Flatness of leaf pubescence花序类型Type of inflorescence花瓣形状Petal shape花瓣内侧主色The main color of the interior of the petal花瓣颜色梯度Petal color gradient花瓣基部离合情况Clutch condition base of the petal花萼颜色Calyx color花柱姿态Style posture无None 有Yes单花Single flower卵圆形Ovate白色White二歧聚伞花Dichasium inflorescence阔卵圆形Broad ovate绿白Greenish white多歧聚伞花序Pleiochasium inflorescences椭圆形Oval黄白Yellowish white 黄绿Yellowish green无None 有Yes分开Separation 接合Joint 重叠Reunion乳白色Ivory直立Erect 直立和水平Erect and horizontal花柱颜色Style color花丝颜色Filament color花药形状Anther shape花药颜色Anther color子房形状Ovary shape乳白色Ivory白色White卵圆形Ovate黄色Yellow瓶形Bottle绿色Green斜生Oblique growth浅黄Light yellow浅绿Light green肾形Reniform灰色Grey椭圆形Oval褐色Brown水平Horizontal浅绿Light green粉红Pink长椭圆形Oblong黑色Black圆球形Spherical深红Dark red

图1 对萼猕猴桃不同性别的花
Fig.1 Different flower sex of the A.valvata
采用游标卡尺测量1年生枝节间长度、1年生枝粗度、叶片长度、叶片宽度、叶柄长度和花冠直径,花瓣数量、花萼数量、花柱数和雄蕊数则直接计数,10次重复。
1.3 基因组DNA的提取
分别采取对萼猕猴桃幼嫩叶3~4 枚,置于冰盒带回实验室,将叶片保存于-80 ℃冰箱。采用试剂盒(北京奥博来科技有限责任公司)提取DNA。所提取DNA经1%琼脂糖凝胶电泳和紫外分光光度计检测其质量和浓度,-20 ℃保存备用,DNA 提取同时用于SSR分析和性别鉴定。
1.4 PCR体系与毛细管电泳检测
参照Lai 等[27]筛选出的15 个SSR 标记,根据多态性等信息从中选择多态性较好且扩增效率高的7对SSR 引物进行PCR(表2)。7 对引物由生工生物工程(上海)股份有限公司合成。PCR扩增反应总体积为10 μL,包含5 μL Mix酶、上下游引物各0.35 μL、1 μL 30 ng·mL-1 DNA 模板,3.3 μL ddH2O。PCR 扩增程序为:94 ℃5 min;94 ℃30 s;55 ℃30 s;72 ℃40 s;72 ℃7 min,共35 个循环,10 ℃保存。取PCR产物0.3 μL、分子质量内标0.5 μL 和去离子甲酰胺9.5 μL 混合加入PCR 板,95 ℃变性5 min,4 ℃冷却后离心,1×Buffer 缓冲液上机进行毛细管电泳检测。具体操作步骤和流程参考仪器操作说明。
表2 所用SSR 标记引物信息
Table 2 The information of SSR markers

注:a 指的是引物信息均来自Lai 等[27],b 指的是引物在62 份对萼猕猴桃中扩增出的片段大小。下同。
Note: a indicates primer information came from published article Lai et al.[27], b indicates the allele size amplified by seven SSR markers used to evaluate 62 A.valvata accessions.The same below.
引物名称a Primer name UDK-096重复单元Repeat motif(CT)4(GT)14片段大小b Allele size/bp 99~163 UDK-103(TC)9 114~138 UDK-125(CA)18 204~254 UDK-128(GT)7GC(GT)7(GA)11 141~185 UDK-143(AC)18 110~150 UDK-153(TG)11 146~172 UDK-158引物序列(5'-3')Primer sequence(5'-3')F:CCCAAAGTTCCTCACTCTTCC R:TAAACAAAAACCAAATCTGGCA F:TCTTCTTCCCTTTCTTGGCA R:GCTGTCTAGTCATTTCCCTCAA F:ACGAGCCCAAAATAGAGTTCA R:TGAGTGCAGCATAGCTACTTCC F:GCTCTCGGGACTGTTTGGTA R:GCAACGTAAACTCCGTTAACG F:TGGTGTAAAGTCAAAAACAGCC R:AGAAGATTTCATTGTCCTCCCT F:CCCCAGTGGAGATCACTTTC R:TGGATATCTTGCCCATCTCC F:GCCCATCTAATCCGTACTCTG R:TCAATTGAAGCAACTCTTCTTGA(GT)16 115~131
1.5 性别分子标记鉴定
利用SyGI 和FrBy 基因设计引物进行性别分子鉴定,区分对萼猕猴桃雌雄株,以Ank marker作为对照,以测试PCR扩增是否成功。通过存在/不存在来区分雌株和雄株,雄株能扩增出3种PCR产物,而雌性植物仅扩增出对照[28]。引物由生工生物工程(上海)股份有限公司合成。取PCR产物0.3 μL、分子质量内标0.5 μL和去离子甲酰胺9.5 μL混合加入PCR板,95 ℃变性5 min,4 ℃冷却后离心,1×Buffer缓冲液上机检测(表3)。
表3 性别相关标记引物信息
Table 3 Primer sequences used in sex identification

引物名称a Primer name SyGI-select片段大小b Allele size/bp 86~90 FrBy-UD 289~297 Ank-UD引物序列(5'-3')Primer sequence(5'-3')F:ATACGAAGTTTGAATCGGTGATTCGTC R:CTAAGCCCTAGGGAAATATTTTAAAA F:ATTCCATTCTCATTACTAACAACTC R:CCTAAAATAAACCAACCAAGAAAAC F:TTTGCCTAAAGAAAGTAGTAGTCAT R:AATTATGAATGGGAGGCTTCTT 152
1.6 数据处理
根据描述性性状的分级标准,使用MicrosoftExcel 2010 对枝叶性状进行频率和变异系数分析。使用SPSS 23.0 软件对数值型性状进行相关性分析。使用R语言[29]计算表型欧式距离并用非加权组配对算术平均法(UPGMA)进行聚类分析;用GenAlex[30]计算扩增后的等位基因数(Na)、有效等位基因数(Ne)、观测杂合度(Ho)和期望杂合度(He);用Power Marker V 3.25[31]计算引物多态信息含量(PIC)。根据遗传距离利用R语言进行UPGMA聚类分析。
2 结果与分析
2.1 对萼猕猴桃表型性状多样性分析
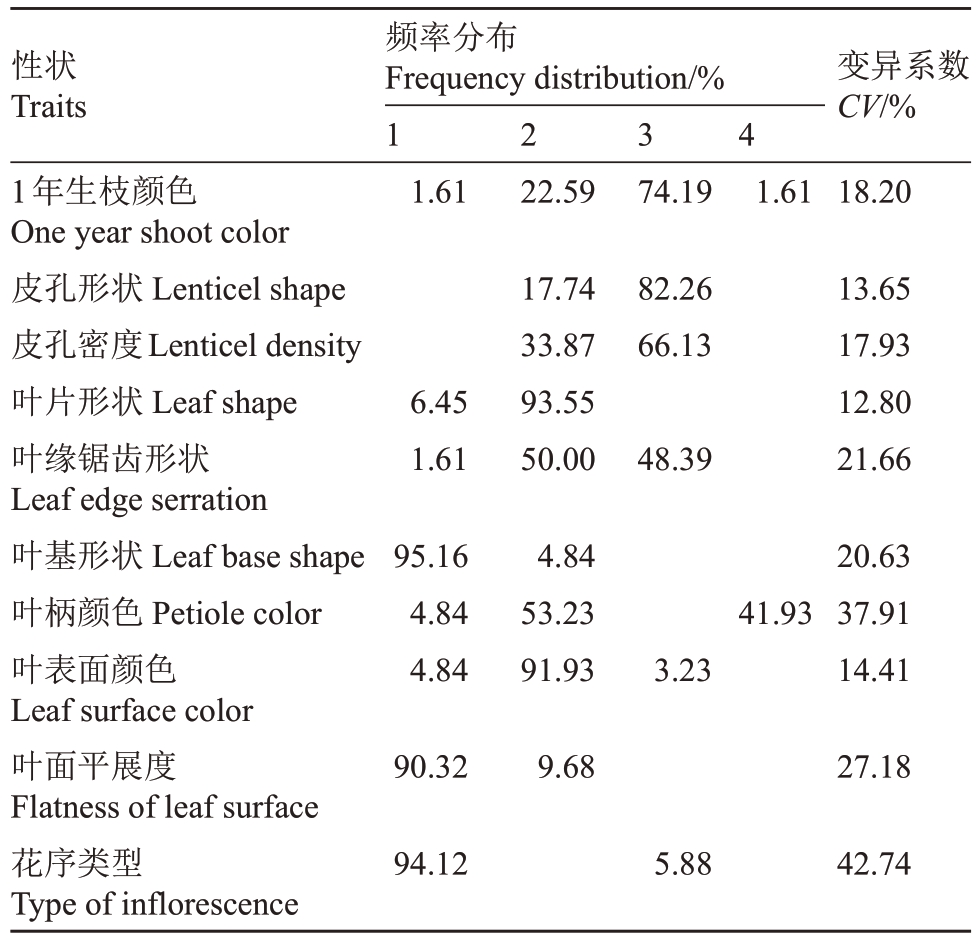
2.1.1 对萼猕猴桃描述性性状的频率分布和多样性 对萼猕猴桃的表型多样性丰富,种内变异较大。观察的26种描述性性状中,共有10种性状有变异幅度,共检测到25个变异类型。分别是1年生枝颜色、皮孔形状、皮孔密度、叶片形状、叶缘锯齿形状、叶基形状、叶柄颜色、叶表面颜色、叶面平展度和花序类型,其中花序类型的变异系数最高(42.74%),而叶片形状的变异系数最小(12.80%)。其余的16种描述性性状都没有变异,皮孔颜色都为灰白色;叶片都是膜质;叶尖均为急尖;叶背颜色都为绿色;叶背均无茸毛;花瓣都是卵圆形;花瓣内侧主色均为白色;花瓣基部都是重叠;花萼都是绿色;雌花花柱都是斜生、乳白色;子房瓶形;雄花花丝均为白色;花药长椭圆形、黄色;花瓣均无颜色梯度(表4)。
表4 对萼猕猴桃描述性性状的频率分布和多样性
Table 4 Frequency distribution and diversity of descriptive traits of A.valvata
性状Traits 2 3 4变异系数CV/%1年生枝颜色One year shoot color皮孔形状Lenticel shape皮孔密度Lenticel density叶片形状Leaf shape叶缘锯齿形状Leaf edge serration叶基形状Leaf base shape叶柄颜色Petiole color叶表面颜色Leaf surface color叶面平展度Flatness of leaf surface花序类型Type of inflorescence频率分布Frequency distribution/%1 1.61 22.59 74.19 1.6118.20 17.74 33.87 93.55 50.00 82.26 66.13 6.45 1.61 48.39 13.65 17.93 12.80 21.66 95.16 4.84 4.84 4.84 53.23 91.93 41.93 3.23 20.63 37.91 14.41 90.32 9.68 27.18 94.12 5.88 42.74
1年生枝颜色有4种,即灰白色、褐色、灰褐色和黄褐色。其中灰褐色的1年生枝最多,占74.19%,其次是褐色,占22.58%,灰白色和黄褐色最少,均仅占1.61%。皮孔形状多为椭圆形,占82.26%;其余17.74%均为短梭形。皮孔密度都较高,其中66.13%皮孔多数,33.87%皮孔密度中等。叶片形状93.55%是卵圆形,仅6.45%为披针形。叶缘锯齿形状有3类,细锯齿叶缘占1.61%,波浪状和粗锯齿分别占48.39%和50.00%。叶基形状为圆形的个体最多,占95.16%,少数为心形。叶柄颜色有绿色、绿黄色和紫红色,分别占4.84%、53.23%和41.93%。叶表面91.93%是绿色,浅绿和深绿分别占4.84%和3.23%。叶面多数平展,仅9.68%具褶皱,花序类型有94.12%是单花,其余5.88%是多岐聚伞花序(表4)。
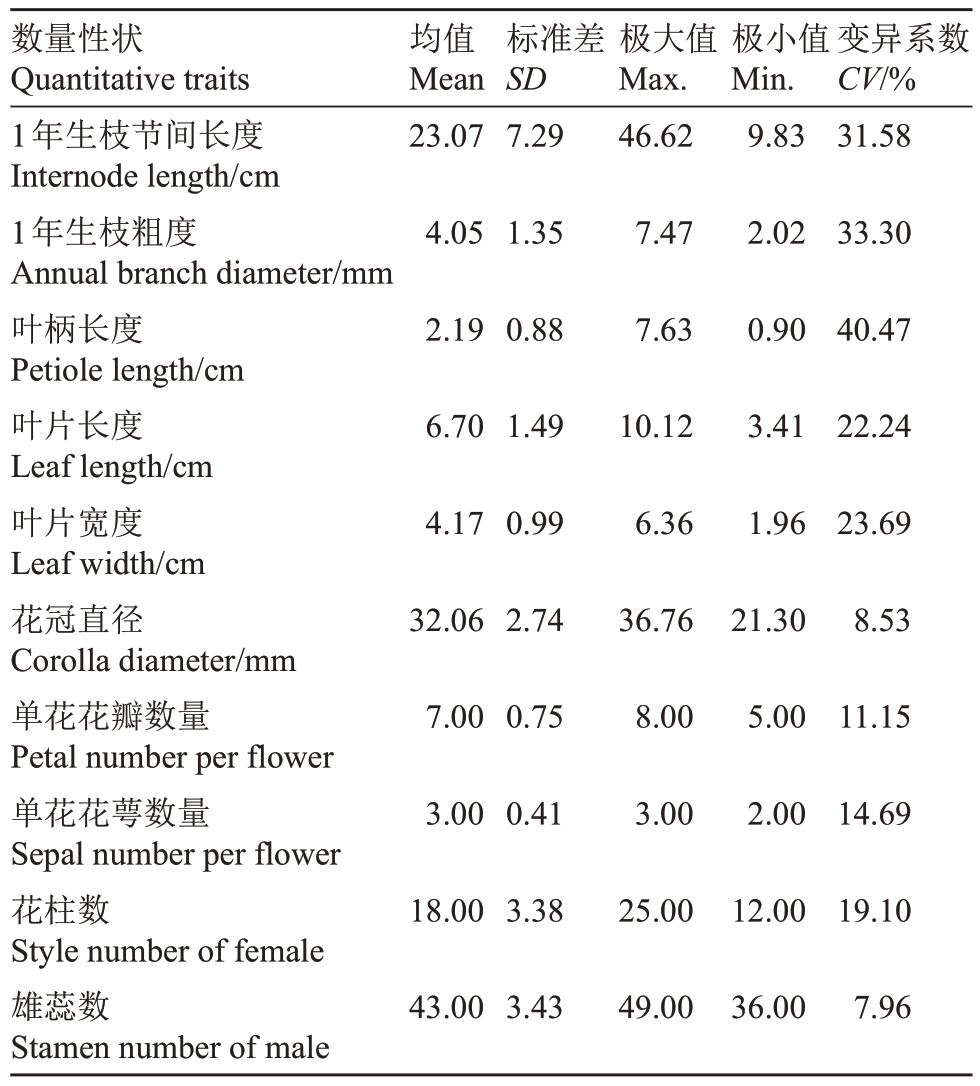
2.1.2 数值型性状的多样性和相关性分析 观测对萼猕猴桃的10个数值型性状变异系数范围为7.96%~40.47%,平均变异系数为21.27%,表明其数值型性状多样性较丰富。叶柄长度的变异系数最大,为40.47%,雄蕊数的变异系数最小,为7.96%,枝叶数值型性状平均变异系数为30.26%,花器官数值型性状平均变异系数为12.29%(表5)。
表5 对萼猕猴桃数值型性状多样性
Table 5 Diversity of numeric traits of A.valvata
数量性状Quantitative traits 1年生枝节间长度Internode length/cm 1年生枝粗度Annual branch diameter/mm叶柄长度Petiole length/cm叶片长度Leaf length/cm叶片宽度Leaf width/cm花冠直径Corolla diameter/mm单花花瓣数量Petal number per flower单花花萼数量Sepal number per flower花柱数Style number of female雄蕊数Stamen number of male均值Mean 23.07标准差SD 7.29极大值Max.46.62极小值Min.9.83变异系数CV/%31.58 4.051.35 7.47 2.02 33.30 2.190.88 7.63 0.90 40.47 6.701.49 10.12 3.41 22.24 4.170.99 6.36 1.96 23.69 32.062.74 36.76 21.30 8.53 7.000.75 8.00 5.00 11.15 3.000.41 3.00 2.00 14.69 18.003.38 25.00 12.00 19.10 43.003.43 49.00 36.00 7.96
对对萼猕猴桃枝叶的5个数值型性状进行相关性分析,5 个数值型性状间均呈现极显著正相关(p<0.01)。其中叶片长度与叶片宽度的相关系数最高(0.860),1 年生枝粗度与叶柄长度的相关系数最小(0.678)(表6)。
表6 对萼猕猴桃数值型性状相关性分析
Table 6 Correlation among numeric traits of A.valvata

注:**表示在0.01 水平(双尾)呈显著相关性。
Note:**indicated significant correlation at p<0.01 levels.
项目Item 1年生枝节间长度Annual branch internode length 1年生枝粗度Annual branch diameter叶柄长度Petiole length叶片长度Leaf length叶片宽度Leaf width 1年生枝节间长度Annual branch internode length 1 1年生枝粗度Annual branch diameter叶柄长度Petiole length叶片长度Leaf length叶片宽度Leaf width 0.678**0.352**0.497**0.436**1 0.325**0.548**0.500**1 0.682**0.550**1 0.860**1
2.1.3 基于枝叶性状的聚类分析 根据62 份对萼猕猴桃枝叶性状间的欧式距离,采用UPGMA 法进行聚类分析,在欧式距离为7.5 处可将62 份对萼猕猴桃种质分为5组(图2)。
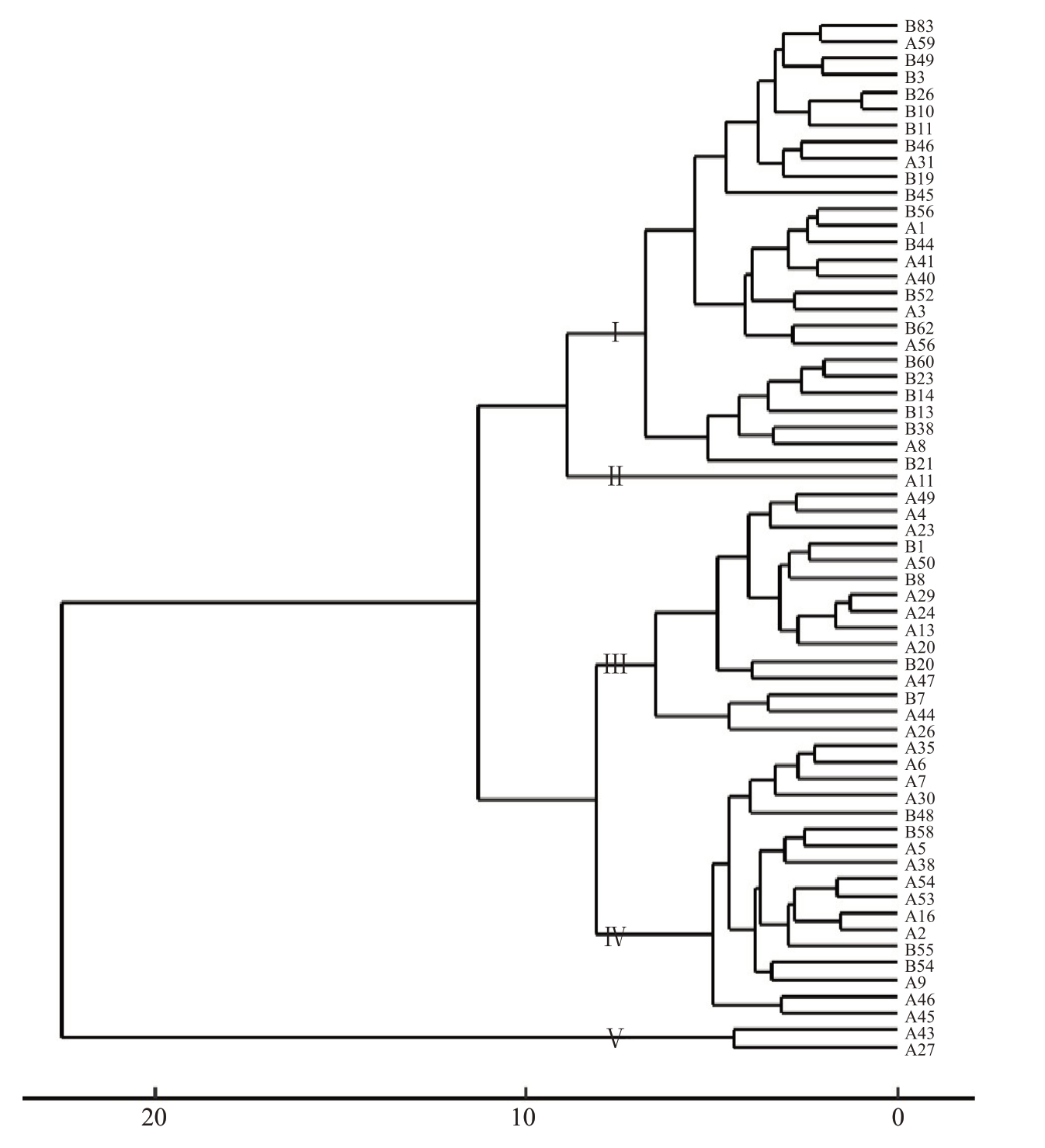
图2 对萼猕猴桃表型性状UPGMA 聚类分析
Fig.2 UPGMA analysis of A.valvata based on phenotypic trait
第一组包括:B63、A59、B49、B3、B26等共27个单株,该组枝叶性状遗传变异最丰富。1 年生枝颜色灰褐和褐色,叶片形状卵圆形和阔卵形,叶缘波浪状、粗锯齿和细锯齿,叶基圆形和心形,叶柄颜色紫红色、黄绿色和绿色,叶表面颜色浅绿、绿和黄绿,叶面多平展少数具褶皱,1 年生枝节间长度均低于总样本平均值。
第二组仅A11 一个单株,该组1 年生枝节间长度和1年生枝粗度均低于总样本平均值,1年生枝颜色褐色,皮孔数量中,皮孔形状短梭形,叶片形状卵圆形,叶缘粗锯齿,叶基圆形,叶柄黄绿色,叶表面绿色,叶面平展,叶背绿色,叶柄长度是所有样本中最高的。
第三组包括A49、A4、A23、B1、A50 等15 个单株,该组1 年生枝节间长度均高于总样本平均值,1年生枝粗度均低于总样本平均值,1 年生枝颜色多灰褐,少数褐色;皮孔椭圆或短梭,皮孔密度中或多,叶片形状均为卵圆形,叶缘波浪状或粗锯齿,叶基除A26 是心形外,其余均为圆形;叶柄紫红或黄绿色,叶表面均为绿色。
第四组包括A35、A6、A7、A30、B48 等17 个单株。该组1年生枝节间长度仅次于第三组,1年生枝颜色灰褐和褐色,叶片多卵圆形、少数披针形,叶缘波浪状和粗锯齿,叶柄长度多数高于平均值,叶柄多紫红色,少数黄绿色;叶表面均为绿色,叶片长度均高于总样本平均值,叶片宽度大多数高于平均值。
第五组只有A43和A27两个单株。该组1年生枝节间长度是所有样本中最大的,1 年生枝粗度均高于总样本平均值,1年生枝颜色灰褐色,皮孔均椭圆形,叶片形状卵圆形,叶缘均波浪状,叶基均圆形,叶柄长度均低于总样本平均值,叶柄颜色均黄绿色,叶片长度均高于总样本平均值。
2.2 基于SSR标记的对萼猕猴桃多样性分析
用筛选的7对多态性高的SSR引物分析62份对萼猕猴桃种质的多样性,试验所用的7 对SSR 标记在62份对萼猕猴桃资源中共扩增出69个等位基因,每个标记位点的平均等位基因数为9.857,变异范围为2~18。其中等位基因数最丰富的引物是UDK-125,扩增出18个等位基因,而引物UDK-103只扩增出2 个等位基因。平均有效等位基因数(Ne)为3.977;平均观测杂合度(Ho)为0.994;平均期望杂合度(He)为0.696;SSR 多态信息含量(PIC)的变化范围为0.375~0.848,所筛选的引物中UDK-096的多态性最高(0.848),UDK-103 的多态性最低(0.375),平均多态信息含量为0.626(图3,表7)。
表7 SSR 引物扩增多态性信息
Table 7 Polymorphic information of SSR primers

引物名称Prime name UDK-096 UDK-103 UDK-125 UDK-128 UDK-143 UDK-153 UDK-158平均值Mean等位基因数No.of different alleles,Na 15.000 2.000 18.000 12.000 12.000 6.000 4.000 9.857有效等位基因数No.of effective alleles,Ne 7.515 2.000 5.766 3.890 3.669 2.932 2.066 3.977观测杂合度Observed heterozygosity,Ho 0.976 1.000 0.991 0.992 1.000 1.000 1.000 0.994期望杂合度Expected heterozygosity,He 0.862 0.500 0.826 0.720 0.727 0.649 0.516 0.686多态信息含量Polymorphism information content,PIC 0.848 0.375 0.816 0.672 0.687 0.581 0.399 0.626
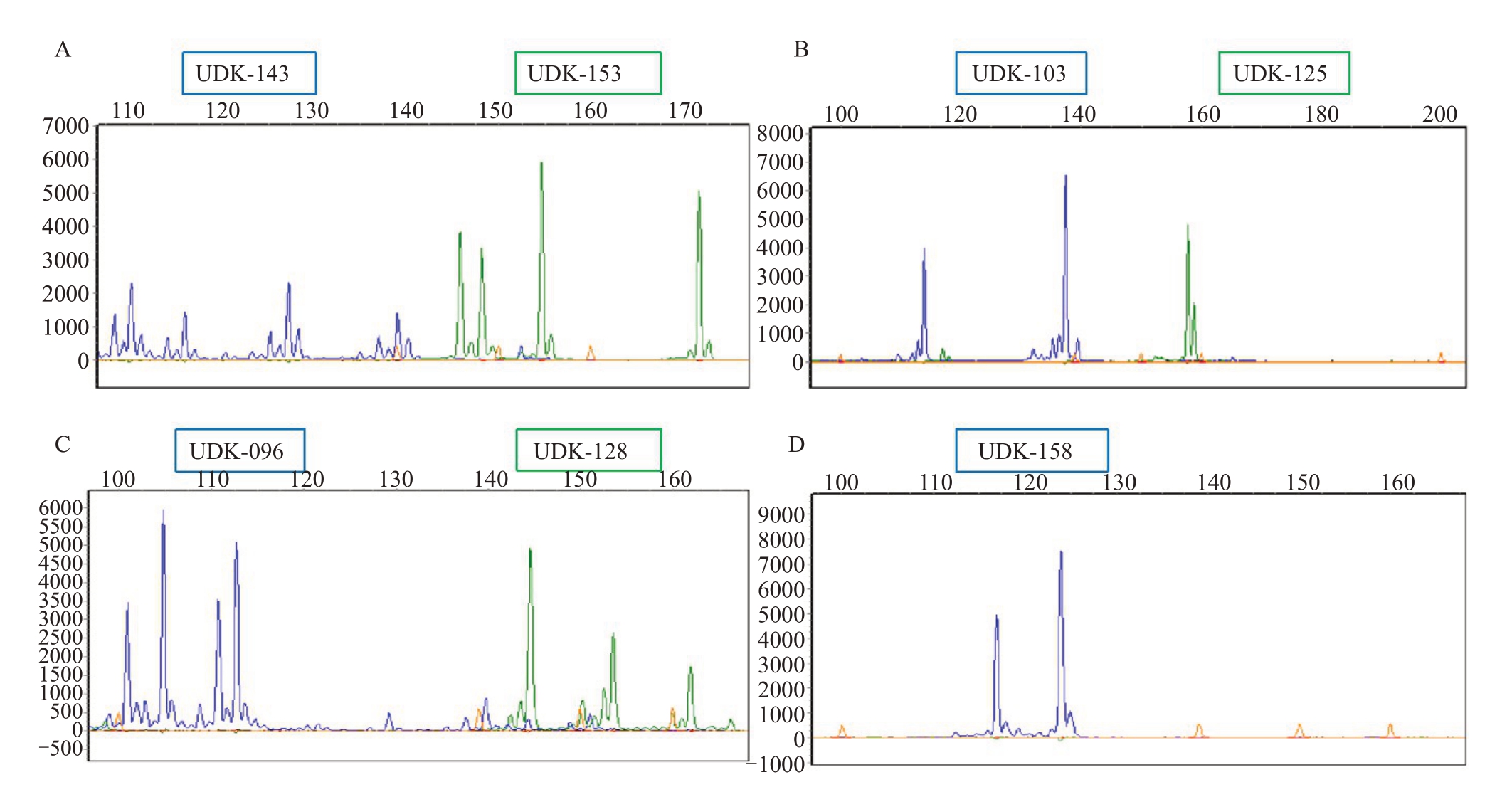
图3 对萼猕猴桃单株A1 在7 个SSR 位点的毛细管电泳峰图示例
Fig.3 Capillary electrophoresis peak map of A.valvata at 7 SSR loci
2.3 SSR遗传距离及聚类分析
通过7 对SSR 引物分析,62 株对萼猕猴桃单株的遗传距离变异范围为0.06~0.71,平均值为0.39。其中B21 和B62 等遗传距离最大(0.71),而A23 和B58等的遗传距离最小(0.05)。
根据材料间的遗传距离,采用UPGMA 法对62份特异性单株进行聚类分析(图4),最终可将62 份对萼猕猴桃种质分为4 个组,第Ⅰ组包括B21、A27和B11 等16 个单株;第Ⅱ组包括A38、A5 和B52 等24 个单株;第Ⅲ组包括A54、B62 和A7 共16 个单株。第Ⅳ组包括B7、B20和A1等6个单株。

图4 对萼猕猴桃SSR 标记聚类分析
Fig.4 Cluster analysis of A.valvata based on SSR markers
2.4 性别鉴定
62株对萼猕猴桃单株中,由于A11未成活,只能对剩余61株进行性别分子鉴定,进行分子性别鉴定的61株单株中有18株为雌株,其余43株为雄株,在对萼猕猴桃盛花期(2024年4月22日—30日),61株中有34株开花,可进行形态观察。花器官形态观察结果表明,34份对萼猕猴桃种质中共有13份雌株,21份雄株。这34份对萼猕猴桃种质的性别分子标记鉴定结果为9份雌株和25份雄株(表8)。34份对萼猕猴桃种质分子性别鉴定和形态观察鉴定结果一致性为79.14%。
表8 61 份对萼猕猴桃种质性别鉴定结果
Table 8 Result of sex identification for 61 A.valvata
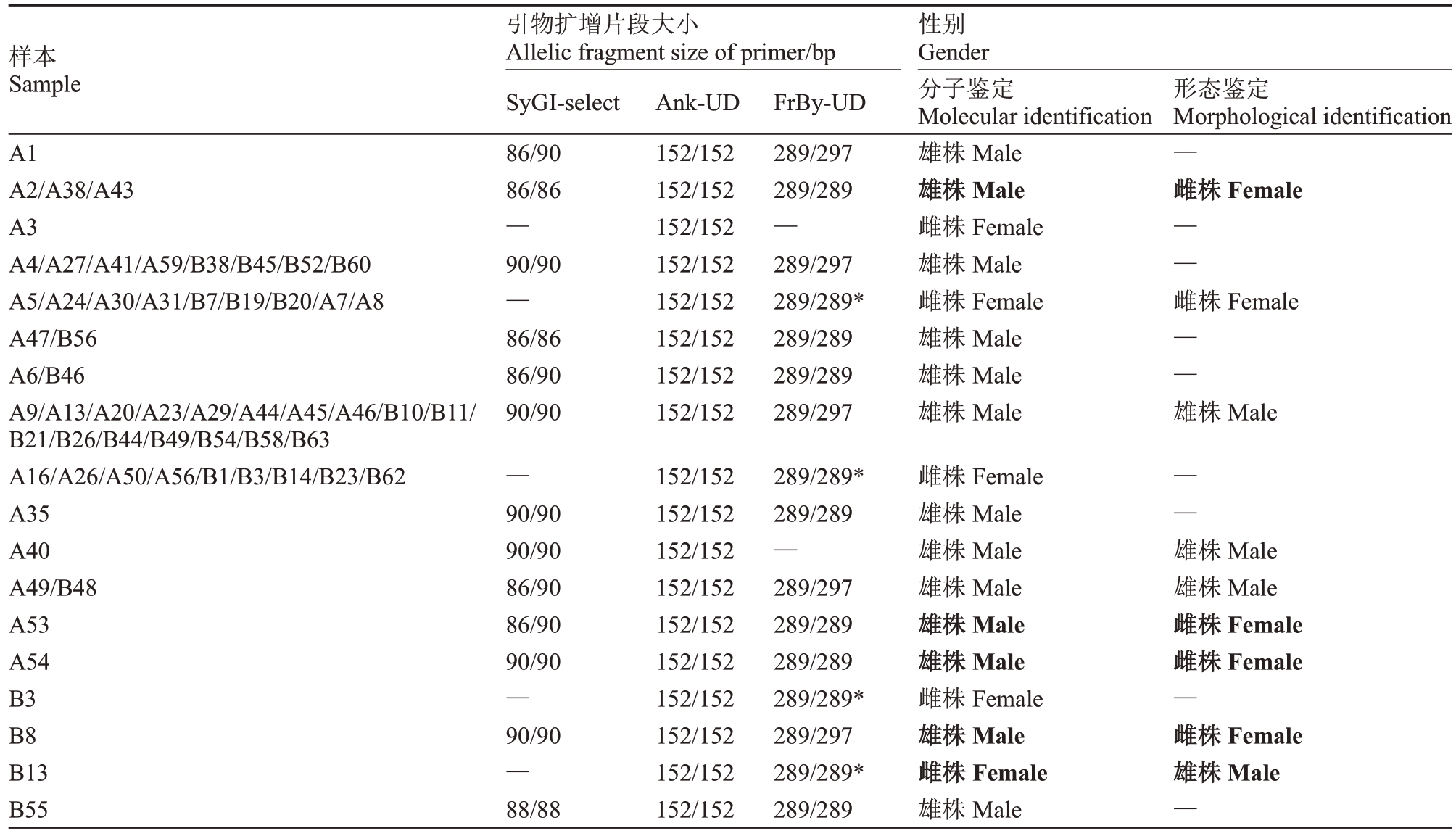
注:粗体表示分子鉴定与形态观察结果不一致单株;“—”在形态鉴定列表示未开花、在引物扩增列表示未扩增出片段;*表示雌株FrBy 的意外扩增。
Note:Bold indicates molecular identification is inconsistent with morphological observations;“—”indicates no flowering in the morphology identification column and no amplification fragment in the primer amplification column;* indicates unexpected amplification of the FrBy marker in female genotypes.
样本Sample A1 A2/A38/A43 A3 A4/A27/A41/A59/B38/B45/B52/B60 A5/A24/A30/A31/B7/B19/B20/A7/A8 A47/B56 A6/B46 A9/A13/A20/A23/A29/A44/A45/A46/B10/B11/B21/B26/B44/B49/B54/B58/B63 A16/A26/A50/A56/B1/B3/B14/B23/B62 A35 A40 A49/B48 A53 A54 B3 B8 B13 B55引物扩增片段大小Allelic fragment size of primer/bp SyGI-select 86/90 86/86—90/90—86/86 86/90 90/90—90/90 90/90 86/90 86/90 90/90—90/90—88/88 Ank-UD 152/152 152/152 152/152 152/152 152/152 152/152 152/152 152/152 152/152 152/152 152/152 152/152 152/152 152/152 152/152 152/152 152/152 152/152 FrBy-UD 289/297 289/289—289/297 289/289*289/289 289/289 289/297 289/289*289/289—289/297 289/289 289/289 289/289*289/297 289/289*289/289性别Gender分子鉴定Molecular identification雄株Male雄株Male雌株Female雄株Male雌株Female雄株Male雄株Male雄株Male雌株Female雄株Male雄株Male雄株Male雄株Male雄株Male雌株Female雄株Male雌株Female雄株Male形态鉴定Morphological identification—雌株Female——雌株Female——雄株Male——雄株Male雄株Male雌株Female雌株Female—雌株Female雄株Male—
3 讨 论
生产上使用的对萼猕猴桃种质混杂,基于对萼猕猴桃枝叶性状多样性和SSR 标记位点多态性分析,可鉴别其多样性。根据对萼猕猴桃的36个表型性状进行多样性分析,有20 个性状存在变异,不同性状间的变异系数介于7.96%~42.74%,平均变异系数为21.99%,表明对萼猕猴桃单株性状变异类型较多、变异幅度较大,存在较丰富的多样性。根据表型性状也确定了收集的种质符合对萼猕猴桃的生物学特征[32]。观测的62 份种质的平均枝叶变异系数为23.98%,其中34份种质的花器性状平均变异系数为17.36%,对萼猕猴桃种内枝条和叶片的变异幅度比花器性状更为丰富,根据枝条和叶片表型可将62份对萼猕猴桃资源分为5 组,同样可以看出不同对萼猕猴桃单株间存在明显的表型差异。62 份对萼猕猴桃种质枝叶的5 个数值型性状间显著相关,其中叶片长度和叶片宽度相关性最高,这与苹果[33]和荔枝[34]中叶片长度与叶片宽度强相关的结果一致。
本研究中利用SSR 分子标记技术,分析对萼猕猴桃的遗传多样性,研究结果表明挑选的7个SSR标记,平均多态性信息含量(PIC)为0.626。根据多态性信息含量评价体系(高:PIC≥0.5;适中:0.5>PIC≥0.25;低:PIC<0.25),表明本试验所用的7对SSR引物多态性较丰富。62份对萼猕猴桃种质单株间的平均遗传距离为0.39,高于5个毛花猕猴桃群体间的平均遗传距离(0.25)[35],说明对萼猕猴桃有丰富的遗传多样性。平均有效等位基因数(Ne)低于等位基因数(Na),说明本研究所用材料间亲缘关系较近,有效等位基因较少;平均观测杂合度(Ho)为0.994;平均期望杂合度(He)为0.686,观测杂合度高于期望杂合度,可能是因为本试验进行的是个体间的多样性分析,材料间的杂合度较低。根据遗传距离,对62份种质特异性单株进行聚类分析,共将这些材料聚为4组,其中每组材料里面的枝叶性状有一定的多样性,可能是在基因型相似的情况下,枝叶性状受环境影响的结果,而SSR聚类结果表明的是遗传背景相似度,与品种类型有一定的相关性[36]。表型是遗传背景和环境共同作用的结果,由于62份种质中仅观察到34份种质的花器性状,因此,只能根据枝叶性状进行表型聚类。表型聚类与SSR标记聚类结果相比,两种聚类方法的结果一致性仅30.65%,这可能是本研究的表型聚类是基于枝叶形状,而枝叶性状更容易受环境及栽培管理的影响。将表型性状分析与SSR分析结合起来,能更准确地反映出对萼猕猴桃的多样性,表型和分子两者都能作为分类依据,但DNA标记不易受环境影响,因此,可以通过表型为辅,DNA标记为主的方法对植株进行多样性分析。
猕猴桃早期性别鉴定一般用于育种群体的早期筛选,雌株的经济价值高于雄株,但雄株在抗性等方面优于雌株,软枣猕猴桃雄株的抗寒性强于雌株[37],此外软枣猕猴桃雄株平均株高显著高于雌株[38],对山杨的雌株和雄株进行的抗寒性差异研究同样发现雄株更能适应低温的变化[39]。沙棘的耐冻性研究发现,雄株对低温的反应比雌株更强烈,雄株比雌株更抗寒[40]。目前猕猴桃性别鉴定的方法主要有形态学标记[35]、生理生化[41]、同工酶鉴定[42-43]和DNA分子标记[44]等,但生理生化和同工酶鉴定主要针对成熟植株[45],而猕猴桃的童期长,因此可以采用DNA 分子标记在童期对猕猴桃性别进行鉴定,节约育种成本。本研究中,既进行分子性别鉴定又有形态观察的34个单株中有79.14%鉴定结果一致,其中7个分子鉴定结果与形态观察不一致,B13 的两种性别鉴定结果不一致可能是它的SyGI-select引物没有扩增出条带导致分子鉴定为雌株;A2、A38、A43、A53、A54 和B8 分子鉴定为雄株但形态观察表明这些植株的雌蕊可育,具有结果能力,这可能是由于所选取的引物只能鉴定稳定的雌雄之分,不能区分雄株和可结果雄株[28],这些材料是否为可结果雄株,还需进一步授粉验证。SyGI在61个单株中共扩增出86、88和90 bp 三个等位基因片段,FrBy 共扩增出289 和297 bp 两个等位基因片段,但在相关研究中所用对萼猕猴桃在SyGI 位点仅扩增出89 bp,FrBy 仅扩增出292 bp[28],这可能是由于两个研究所用材料的遗传背景不同。FrBy在雌株中会发生意外扩增,这与该标记在某些猕猴桃种如毛花猕猴桃雌株中扩增出282 bp一致[28],61份材料中标记鉴定为雌株的18份中有17 份在FrBy 位点发生了意外扩增,且发生意外扩增的都是289和289这个等位基因型,这也为在早期使用标记判断性别时提供参考。标记FrBy 在不同种间扩增情况不同,在实际应用中要先进行验证,相较于FrBy,SyGI 的准确性可能更高。试验下一步将观察此次未完成花器官形态鉴定的植株,分析花器官形态鉴定与性别鉴定的一致性,也会进一步研究对萼猕猴桃耐涝性与性别的相关性。
4 结 论
观测的36 个表型性状中有20 个性状发生变异。选取的7 对SSR 引物,平均多态性信息含量(PIC)为0.65,结合表型和分子聚类结果,发现对萼猕猴桃不同单株之间存在较大的遗传差异,由于表型性状受环境较大,从分子水平上进行的SSR 聚类不受环境影响,更具可靠性。针对其中的34份对萼猕猴桃种质进行早期性别鉴定,形态学观察与分子标记鉴定结果79%一致,表明选取的标记可以在猕猴桃童期对性别进行初步鉴定,若需要对性别精确鉴定还需要在花期对生殖器官进行观察。本研究结果表明了生产上应用的对萼猕猴桃种质遗传背景较为混乱,根据聚类分析结果,初步明确了不同类群的特征,可以依据分类结果分析每个类群的利用价值,同时应用性别分子标记和形态观察对性别进行鉴定,为选育优质对萼猕猴桃雄性砧木提供参考和材料。
[1] 徐小彪,张秋明.中国猕猴桃种质资源的研究与利用[J].植物学通报,2003,38(6):648-655.XU Xiaobiao,ZHANG Qiuming.Researches and utilizations of germplasm resource of kiwifruit in China[J].Chinese Bulletin of Botany,2003,38(6):648-655.
[2] WARRINGTON I J,WESTON G C.Kiwifruits:Science and management[M].New Zealand:Ray Richards Publisher,1990:183-204.
[3] 黄宏文.猕猴桃研究进展[M].北京:科学出版社,2000.HUANG Hongwen.Advances in Actinidia research[M].Beijing:Science Press,2000.
[4] WEBSTER A D.Rootstock and interstock effects on deciduous fruit tree vigour,precocity,and yield productivity[J].New Zealand Journal of Crop and Horticultural Science,2010,23(4):373-382.
[5] 王莉,王圣梅,黄宏文.猕猴桃属种间嫁接亲和性试验研究及抗根结线虫砧木的初步筛选[J].武汉植物学研究,2001,19(1):47-51.WANG Li,WANG Shengmei,HUANG Hongwen.Graft compatibility among Actinidia species and screening rootstocks resistant to root-knot nematodes[J].Journal of Wuhan Botanical Research,2001,19(1):47-51.
[6] MORAES A F G,MICHELETTI L B,SANTORO M B,TEIXEIRA DOS SANTOS N,AVILÉS T C,DA SILVA S R.Horticultural performance of‘Hass’avocado grafted onto seedling and clonal rootstocks under tropical wet-dry climate conditions[J].Scientia Horticulturae,2022,302:111155.
[7] 钟彩虹,刘小莉,李大卫,韩飞,张琼.不同猕猴桃种硬枝扦插快繁研究[J].中国果树,2014(4):23-26.ZHONG Caihong,LIU Xiaoli,LI Dawei,HAN Fei,ZHANG Qiong.Research on fast propagation of hard branch cutting of different kiwifruit species[J].China Fruits,2014(4):23-26.
[8] 张琛,张慧琴,肖金平,马常念,谢鸣.三个品种猕猴桃实生苗的耐涝性比较[J].浙江农业学报,2013,25(5):1007-1012.ZHANG Chen,ZHANG Huiqin,XIAO Jinping,MA Changnian,XIE Ming.Comparison on seedling waterlogging tolerance of three cultivars of Actinidia chinensis Planch.[J].Acta Agriculturae Zhejiangensis,2013,25(5):1007-1012.
[9] 陈环,马幸幸,贾德翠,周德勇,彭书明,王元顺.猕猴桃砧木研究进展[J].北方园艺,2022(5):125-133.CHEN Huan,MA Xingxing,JIA Decui,ZHOU Deyong,PENG Shuming,WANG Yuanshun.Research progress on rootstock of kiwifruit[J].Northern Horticulture,2022(5):125-133.
[10] 郭兴利,魏远新,张振营,李金良,张金伟,孙继中.猕猴桃新型砧木水杨桃及其在河南西峡的应用实践[J].西北园艺,2022(6):58-61.GUO Xingli,WEI Yuanxin,ZHANG Zhenying,LI Jinliang,ZHANG Jinwei,SUN Jizhong.A new type of kiwifruit rootstock and its application in Xixia,Henan Province[J].Northwest Horticulture,2022(6):58-61.
[11] 郭晓成,杨莉,段眉会,陈春晓.再说猕猴桃新型砧木水杨桃[J].西北园艺(果树),2019(6):4-6.GUO Xiaocheng,YANG Li,DUAN Meihui,CHEN Chunxiao.A new rootstock of kiwi fruit[J].Northwest Horticulture(Fruit),2019(6):4-6.
[12] 李大卫,刘小莉,韩飞,吕海燕,解潇冬,张琦,田华,钟彩虹.猕猴桃新型砧木对金梅猕猴桃果实品质的影响[J].果树学报,2023,40(10):2160-2169.LI Dawei,LIU Xiaoli,HAN Fei,LÜ Haiyan,XIE Xiaodong,ZHANG Qi,TIAN Hua,ZHONG Caihong.Effect of new rootstocks on the fruit quality in Jinmei kiwifruit[J].Journal of Fruit Science,2023,40(10):2160-2169.
[13] 白丹凤,李志,齐秀娟,陈锦永,顾红,黄武权,任建杰,钟云鹏,方金豹.4 种基因型猕猴桃对淹水胁迫的生理响应及耐涝性评价[J].果树学报,2019,36(2):163-173.BAI Danfeng,LI Zhi,QI Xiujuan,CHEN Jinyong,GU Hong,HUANG Wuquan,REN Jianjie,ZHONG Yunpeng,FANG Jinbao.Physiological responses and tolerance evaluation of four species of Actinidia to waterlogging stress[J].Journal of Fruit Science,2019,36(2):163-173.
[14] 高敏霞,冯新,赖瑞联,陈文光,陈义挺.淹水胁迫对不同品种猕猴桃生理特性的影响[J].中国南方果树,2022,51(4):114-118.GAO Minxia,FENG Xin,LAI Ruilian,CHEN Wenguang,CHEN Yiting.Effects of flooding stress on physiological characteristics of different kiwifruit varieties[J].South China Fruits,2022,51(4):114-118.
[15] 宋云云,吕岩,马康利.水杨桃砧木在陕西周至的生产表现与推广建议[J].西北园艺,2022(2):54-55.SONG Yunyun,LÜ Yan,MA Kangli.Production performance and promotion suggestions of Shui Yangtao rootstock in Zhouzhi,Shaanxi province[J].Northwest Horticulture,2022(2):54-55.
[16] 黄宏文,龚俊杰,王圣梅,何子灿,张忠慧,李建强.猕猴桃属(Actinidia)植物的遗传多样性[J].生物多样性,2000,8(1):1-12.HUANG Hongwen,GONG Junjie,WANG Shengmei,HE Zican,ZHANG Zhonghui,LI Jianqiang.Genetic diversity in the genus Actinidia[J].Chinese Biodiversity,2000,8(1):1-12.
[17] 陈万秋,李思光,罗玉萍.分子标记技术在猕猴桃属植物中的研究进展[J].江西科学,2001,19(3):162-165.CHEN Wanqiu,LI Siguang,LUO Yuping.Application of molecular markers on Actinidia[J].Jiangxi Science,2001,19(3):162-165.
[18] 辛景树,郭景伦,张软斌.几种常用分子标记技术在种子纯度和品种真实性鉴定方面的比较与分析[J].种子,2005,24(1):58-60.XIN Jingshu,GUO Jinglun,ZHANG Ruanbin.Comparison and analysis of several commonly used molecular marker techniques in seed purity and variety authenticity identification[J].Seed,2005,24(1):58-60.
[19] 杨进.SSR 标记技术在植物遗传多样性研究上的应用[J].中国农学通报,2006,22(7):90-94.YANG Jin.The application of microsatellite DNA marker in plant genetic diversity research[J].Chinese Agricultural Science Bulletin,2006,22(7):90-94.
[20] 李红莉,王澎,李雪,陶双勇,孙强,逄宏扬,张跃新,孙向辉.黑龙江野生软枣猕猴桃种质资源表型性状的遗传多样性[J].经济林研究,2022,40(1):150-158.LI Hongli,WANG Peng,LI Xue,TAO Shuangyong,SUN Qiang,PANG Hongyang,ZHANG Yuexin,SUN Xianghui.Genetic diversity of phenotypic traits of wild Actinidia arguta germplasm resources in Heilongjiang[J].Non-wood Forest Research,2022,40(1):150-158.
[21] 杨妙贤,梁红,贺苏丹.猕猴桃性别分化与鉴定研究进展[J].仲恺农业工程学院学报,2009,22(1):57-60.YANG Miaoxian,LIANG Hong,HE Sudan.Research progress in sex differentiation and identification of Actinidia[J].Journal of Zhongkai University of Agriculture and Technology,2009,22(1):57-60.
[22] 段眉会,陈春晓.“水杨桃”作猕猴桃砧木行不行?[J].果树实用技术与信息,2019(4):13-14.DUAN Meihui,CHEN Chunxiao.Is it feasible to use“Shui Yang Tao”as a Actinidia rootstock?[J].Practical Techniques and Information on Fruit Trees,2019(4):13-14.
[23] 周玲艳,秦华明,梁红.分子标记在猕猴桃性别基因研究中的应用[J].河南农业科学,2007,36(8):10-12.ZHOU Lingyan,QIN Huaming,LIANG Hong.Application of molecular markers in the study of sex genes in Actinidia[J].Journal of Henan Agricultural Sciences,2007,36(8):10-12.
[24] 中华人民共和国农业部.猕猴桃种质资源描述规范:NY/T 2933—2016[S].北京:中国标准出版社,2016.Ministry of Agriculture of the People’s Republic of China.Descriptors for kiwifruit germplasm resources:NY/T 2933—2016[S].Beijing:China Standards Press,2016.
[25] 王立军,张友民,贾伟平,谷安根.狗枣猕猴桃的解剖学研究[J].吉林农业大学学报,1994,16(3):55-58.WANG Lijun,ZHANG Youmin,JIA Weiping,GU Angen.Anatomical studies of Actinidia kolokikta[J].Journal of Jilin Agricultural University,1994,16(3):55-58.
[26] 王立军.软枣猕猴桃的解剖学研究[J].吉林农业大学学报,1990,12(4):34-38.WANG Lijun.Studies of the anatomy of Actinidia arguta (Sieb et Zucc.) Planch ex Miquel[J].Journal of Jilin Agricultural University,1990,12(4):34-38.
[27] LAI J J,LI Z Z,MAN Y P,LEI R,WANG Y C.Genetic diversity of five wild Actinidia arguta populations native to China as revealed by SSR markers[J].Scientia Horticulturae,2015,191:101-107.
[28] DE MORI G,TESTOLIN R,CIPRIANI G.A molecular protocol for early sex discrimination(ESD)in Actinidia spp.[J].Journal of Berry Research,2022,12(2):249-266.
[29] IHAKA R,GENTLEMAN R.R:A language for data analysis and graphics[J].Journal of Computational and Graphical Statistics,1996,5(3):299.
[30] PEAKALL R,SMOUSE P E.GenAlEx 6.5:Genetic analysis in excel.population genetic software for teaching and research:An update[J].Bioinformatics,2012,28(19):2537-2539.
[31] LIU K J,MUSE S V.PowerMarker:An integrated analysis environment for genetic marker analysis[J].Bioinformatics,2005,21(9):2128-2129.
[32] 黄宏文.猕猴桃属分类资源驯化栽培[M].北京:科学出版社,2013.HUANG Hongwen. Actinidia taxonomy germplasm domestication cultivation[M].Beijing:Science Press,2013.
[33] 李昕蔓,杨开宇,柳俊明,王立成,李清泉,张军.基于形态指标和叶片生理指标对新疆野苹果无性系的综合评价[J].林业与生态科学,2021,36(4):418-427.LI Xinman,YANG Kaiyu,LIU Junming,WANG Licheng,LI Qingquan,ZHANG Jun.Comprehensive evaluation of Xinjiang wild apple clones based on morphological and physiological indicators[J].Forestry and Ecological Sciences,2021,36(4):418-427.
[34] 林祺英,李芳,蔡汝鹏,张蕾,黎瑶,李焕苓,王家保.海南荔枝资源叶片性状多样性分析[J].热带生物学报,2023,14(6):628-635.LIN Qiying,LI Fang,CAI Rupeng,ZHANG Lei,LI Yao,LI Huanling,WANG Jiabao.Diversity analysis of leaf traits of litchi genetic resources in Hainan[J].Journal of Tropical Biology,2023,14(6):628-635.
[35] 钟敏,陶俊杰,黄春辉,黄清,邹梁峰,廖光联,陈璐,徐小彪.江西野生毛花猕猴桃群体SSR 遗传多样性研究[J].核农学报,2019,33(5):863-869.ZHONG Min,TAO Junjie,HUANG Chunhui,HUANG Qing,ZOU Liangfeng,LIAO Guanglian,CHEN Lu,XU Xiaobiao.Analysis of genetic diversity of populations in Actinidia eriantha Benth.based on simple sequence repeat (SSR) markers[J].Journal of Nuclear Agricultural Sciences,2019,33(5):863-869.
[36] 殷纪伟,韩贝贝,马莹雪,武星廷,徐振江,姜建福,陈昌文,韩瑞玺.基于SSR 分子标记的154 份桃品种遗传多样性分析[J].江苏农业科学,2023,51(16):18-26.YIN Jiwei,HAN Beibei,MA Yingxue,WU Xingting,XU Zhenjiang,JIANG Jianfu,CHEN Changwen,HAN Ruixi.Analysis of genetic diversity of 154 peach cultivars based on SSR markers[J].Jiangsu Agricultural Sciences,2023,51(16):18-26.
[37] 金君,辛树权,韦欣霈,宋任锋,万楚.自然越冬期软枣猕猴桃雌雄株的生理生化响应差异[J].长春师范大学学报,2023,42(10):86-91.JIN Jun,XIN Shuquan,WEI Xinpei,SONG Renfeng,WAN Chu.Analysis of cold resistance difference between male and female plants of Actinidia arguta during over-wintering period[J].Journal of Changchun Normal University,2023,42(10):86-91.
[38] 李旭,曹万万,姜丹,刘迪,朴一龙.基于形态观察法和生理生化法的软枣猕猴桃性别鉴别研究[J].北方园艺,2014(24):6-9.LI Xu,CAO Wanwan,JIANG Dan,LIU Di,PIAO Yilong.Study on sex identification of Actinidia arguta by morphology and physiological biochemical[J].Northern Horticulture,2014(24):6-9.
[39] 高露双,赵秀海,王晓明,张春雨.雌雄异株植物山杨的气候响应差异[J].应用生态学报,2014,25(7):1863-1869.GAO Lushuang,ZHAO Xiuhai,WANG Xiaoming,ZHANG Chunyu.Sexual differences in climatic response of dioecious Populus davidiana tree[J].Chinese Journal of Applied Ecology,2014,25(7):1863-1869.
[40] LI C Y,YANG Y Q,JUNTTILA O,PALVA E T.Sexual differences in cold acclimation and freezing tolerance development in sea buckthorn (Hippophae rhamnoides L.) ecotypes[J].Plant Science,2005,168(5):1365-1370.
[41] KHUKHUNAISHVILI R G,DZHOKHADZE D I.Electrophoretic study of the proteins from Actinidia leaves and sex identification[J].Prikladnaia Biokhimiia i Mikrobiologiia,2006,42(1):117-120.
[42] 晁无疾,张铜会.猕猴桃雌雄株间同工酶差异研究[J].中国果树,1987(2):42-44.CHAO Wuji,ZHANG Tonghui.Study on isozyme differences between male and female plants of Actinidia[J].China Fruits,1987(2):42-44.
[43] 王妹清,赵英琪,刘建朝,杜香莉.猕猴桃雌雄植株过氧化物酶同工酶的研究[J].经济林研究,1989,7(2):30-33.WANG Meiqing,ZHAO Yingqi,LIU Jianchao,DU Xiangli.Electrophoretic study of peroxidase isoenzymes in male and female plants of Actinidia[J].Economic Forest Researches,1989,7(2):30-33.
[44] SHIRKOT P,SHARMA D R,MOHAPATRA T.Molecular identification of sex in Actinidia deliciosa var. deliciosa by RAPD markers[J].Scientia Horticulturae,2002,94(1/2):33-39.
[45] 吕正鑫,刘青,廖光联,黄春辉,贾东峰,徐小彪.性别分子标记在毛花猕猴桃中的通用性验证[J].江西农业大学学报,2021,43(2):261-269.LÜ Zhengxin,LIU Qing,LIAO Guanglian,HUANG Chunhui,JIA Dongfeng,XU Xiaobiao.General validation of kiwifruit sex molecular markers in Actinidia eriantha Benth.[J].Acta Agriculturae Universitatis Jiangxiensis,2021,43(2):261-269.