植物内生菌(plant endophyte)是在其生活史一定阶段或全部阶段生活于植物组织、组织间隙和器官内部的微生物类群[1]。植物内生菌在与宿主植物长期的协同进化中建立互惠共生关系,一方面宿主为内生菌提供生长所需的营养物质和能量,另一方面内生菌通过自身的次级代谢产物或借助于信号传导作用影响植物的生长发育,促进宿主生长[2]。与此同时,内生菌还能通过调节植物的免疫系统或者直接产生活性物质抑制病原菌,来增强植物的抗病性[3-4]。植物内生真菌普遍存在于植物组织中,形成了植物体内的微生态体系[5],其种类的多样性,受植物自身生理生化特性、气候条件、温度、湿度等环境因素的影响[6]。一般情况下,随着寄主植物年龄的增长,植株内生真菌的种类和丰度也随之增加。因为随着植株年龄增加,真菌反复侵染植株的机会增加。同时,随着植株年龄的增长,其生理状况和表皮结构更有利于真菌的侵入[7]。
核桃腐烂病主要是无性类真菌壳囊孢属侵染所致[8],对新疆核桃产业的健康发展构成了严重威胁。核桃腐烂病又称为烂皮病、黑水病,主要发生在新疆核桃产区,山西、山东、安徽等省零星发生。病害主要危害皮层,一般发病株率为50%左右,严重时发病株率达100%,导致枯枝甚至整株死亡[9]。针对核桃腐烂病的防治方法有物理防治、生物防治和化学防治,其中以化学防治为主,然而化学防治存在农药残留、对人畜不安全、环境污染等问题[10]。而生物防治具有安全、经济、高效等优势,能有效避免化学防治带来的系列问题。此外,生物防治除了能够控制病害,往往还能起到促进植物生长的作用,郝芳敏等[11-12]通过筛选获得的1株多黏类芽孢杆菌和1株铜绿假单胞菌,不仅能有效抑制甜瓜多种真菌病害的发生与发展,还对甜瓜幼苗的健康生长起着积极的促进作用。因此,为了充分挖掘核桃内生真菌资源,为核桃腐烂病的生物防治提供菌株资源,笔者从健康核桃不同组织中分离内生真菌,采用形态特征和分子生物学手段鉴定其分类地位,统计分析评价其多样性,筛选出对核桃腐烂病菌具有抑制效果的拮抗菌株,采用室内盆栽试验探究拮抗菌株对核桃幼苗的促生作用,运用离体枝条接种法研究拮抗菌株对核桃腐烂病的防治效果,以期为新疆核桃产业的健康发展作出贡献。
1 材料和方法
1.1 试验材料
1.1.1 供试材料 供试的核桃组织材料采集于新疆生产建设兵团第一师三团(N 40°22'33",E 80°03'45"),核桃品种为温185,采用棋盘式采样法,选择10株健康、长势良好的核桃树(树龄50年),对其根、茎、枝(1年生)分别进行采样,每株树不同组织分别采集5 份。采集前用75%乙醇对刀片、枝剪和采集的部位进行消毒。剪取长度为20 cm的1年生枝条;在30~50 cm 土层内,剪取粗度约1 cm、长10 cm 的根;用刀片刻取茎的树皮组织50 cm2。样品装入自封袋,编号密封后置于4 ℃下保存。
1.1.2 供试的病原菌 核桃腐烂病菌(Cytospora chrysosperma)保存于南疆农业有害生物综合治理兵团重点实验室。
1.1.3 培养基 PDA 培养基:马铃薯200 g,D-葡萄糖20 g,琼脂粉20 g,蒸馏水1000 mL;PDB 培养基:马铃薯200 g,D-葡萄糖20 g,蒸馏水1000 mL;孟加拉红培养基:蛋白胨5 g,D-葡萄糖10 g,无水磷酸二氢钾1 g,硫酸镁0.5 g,琼脂粉20 g,1/3000孟加拉红溶液100 mL,蒸馏水1000 mL,氯霉素0.1 g。
1.2 试验方法
1.2.1 核桃内生真菌的分离纯化(1)样品表面消毒和检测。将采集的组织块分别用蒸馏水冲洗干净后自然晾干,在超净工作台下用灭菌剪刀将根、茎、枝剪成1.5 cm长的小段,然后放入烧杯中,无菌水冲洗3 次后用75%乙醇浸泡2 min,再用无菌水冲洗3次,然后用0.6%次氯酸钠消毒2 min,用无菌水冲洗3次后再在75%乙醇中浸泡30 s,最后用无菌水冲洗3 次,将最后一次冲洗的无菌水取100 µL 接种至PDA平板,于28 ℃恒温培养1周。如果PDA平板上面没有长菌,表明表面消毒到位,可以进行下一步试验。
(2)内生真菌的分离与纯化。在超净工作台用灭菌刀片将根、茎、枝样品组织分解成5 mm×5 mm的组织块各70块,分别接种到PDA和孟加拉红培养基中,每个培养皿接种5~8 块,28 ℃恒温培养1~2周,待切口处长出菌丝后,菌丝转接至新的PDA 平板上进行纯化,菌株纯化后在4 ℃下斜面保存。
1.2.2 核桃内生真菌的鉴定(1)内生真菌的形态学鉴定。为了从宏观上分析内生真菌特征,将内生真菌接种于PDA平板上,28 ℃恒温培养7 d,观察记录菌落形态、颜色、基底等生长特性。为了从微观上弄清内生真菌特征,采用插片培养法观察真菌的菌丝及孢子的形态特征,将无菌盖玻片45°斜插于平板菌落周边,于28 ℃的培养箱中黑暗培养7 d,然后取出盖玻片镜检。根据观察结果,参照《真菌鉴定手册》[13]的方法进行初步鉴定。
(2)内生真菌的分子鉴定。将菌株接种至PDA平板上,28 ℃恒温培养,待菌株直径长至平板的2/3,轻轻刮取约0.1 g 新鲜菌丝,利用真菌基因组DNA快速抽提试剂盒提取DNA。以真菌通用引物ITS1和ITS4 扩增ITS 基因序列。反应体系为25 µL:PCRmix 12.5µL,上下引物各1µL,模板DNA 2µL,ddH2O 补足8.5 µL。PCR 扩增条件:94 ℃预变性5 min,94 ℃变性35 s,48 ℃退火40 s,72 ℃延伸1 min,共35 个循环,最后72 ℃终延伸10 min。PCR 扩增产物经1.2%琼脂糖凝胶电泳检测,电泳条带达到预期要求的,送交上海生工生物技术有限公司进行测序。将测序获得的ITS序列进行DNA序列比对后,根据同源性相似度的差异,采用MEGA5.1软件构建系统发育树。
1.2.3 内生真菌的多样性分析 参照易航等[14]的方法,计算内生真菌的分离率IR、分离频率IF、香农指数H'、均匀度指数E、辛普森指数D、丰富度指数M和相似性系数Cs。基于核桃内生真菌的种类组成,分析不同部位的内生真菌,评价核桃内生真菌的多样性、分布均匀程度、丰富度,以及不同部位间的相似水平。
(1)内生真菌的分离率(isolation rates,IR)是指从培养组织块中分离得到的总菌株数与全部培养的组织块数的比值,即分离率(IR)/%=样本组织块中得到的菌株数/全部供试样本组织块数×100。
(2)分离频率(relative frequency,IF)是为获得某一类内生真菌的菌株数量在植物样品中分离菌株总数中所占的百分比,反映不同种类的内生真菌在总菌群中所占据的优势程度。
分离频率(IF)/%=某一类菌株的菌株数量/总菌株数×100。
(3)内生真菌群落种类多样性采用香农指数(Shannon-Weiner diversity index,H')公式计算,即:![]() 。其中k 指某种植物或组织中内生真菌种类的总数,Pi为某种属内生真菌的菌株数量占分离到的所有总菌株数量的百分数。
。其中k 指某种植物或组织中内生真菌种类的总数,Pi为某种属内生真菌的菌株数量占分离到的所有总菌株数量的百分数。
(4)内生真菌丰富度,采用丰富度指数(Margalef’s index,M)公式计算,即:M=(S-1)/log2N。其中S为物种数,N为菌株总数。
(5)内生真菌在群落中分布的均匀程度采用均匀度指数(Pielou’s evenness index,E)公式计算,即:E=H'/1nS。其中H'是多样性指数,S为物种数。
(6)内生真菌群落间的相似程度采用相似性指数(Srenson's similarity coefficients,Cs)公式计算,即:Cs=2j/(a+b)。其中j 是两种组织中具有的相同内生真菌种类数,a 是一种组织中内生真菌的种类数,b是另一组织中内生真菌的种类数。
1.2.4 生防菌的筛选 在PDA 平板(直径为9 cm)中央接种直径0.5 cm 的病原菌菌饼,在距离菌饼2.5 cm 处的4 个角点处接种一个测试真菌的菌饼,以在培养基中央单纯接种病原菌为对照,均设置3个重复,28 ℃12 h光照/12 h黑暗交替培养并观察抑菌情况。菌落抑制率/%=(对照病原菌直径-处理病原菌直径)/(对照病原菌落直径-菌饼直径)×100。
1.2.5 生防菌发酵液对核桃离体枝条腐烂病的防治效果 发酵液的制备:将活化的生防菌菌株接种于250 mLPDA液体培养基上,在28 ℃下200 r·min-1振荡培养7 d,然后用灭菌的纱布过滤,4 ℃下8000 r·min-1离心10 min得到上清液,即为发酵液。
枝条的处理:将粗细均匀的1 年生枝条剪成长度约20 cm 的枝段,在超净工作台用0.6%次氯酸钠消毒3 min,用无菌水清洗3~4次直至无次氯酸钠气味后晾干,用水浴锅融化的石蜡封住枝条两端保湿晾干备用。
预防试验:将处理好的枝条用孔径为5 mm的灭菌打孔器打一个接种点,然后涂布生防菌发酵液于打孔处,晾干以后再涂布3次,用灭菌打孔器打取直径5 mm的核桃腐烂病菌菌饼,接种于枝条打孔处,以未涂布发酵液的枝条作为空白对照,病原菌接种15 d 后测量核桃枝条病斑直径,并计算防治效果。每种生防菌处理5根枝条,试验设置3次重复。
治疗试验:将处理好的枝条用孔径为5 mm的打孔器打一个接种点,用灭菌打孔器取直径5 mm的核桃腐烂病菌进行接种处理,3 d 后取掉菌饼,然后用生防菌发酵液涂布打孔部位,晾干以后继续涂布3次,以未涂布发酵液的枝条为空白对照,15 d后测量核桃枝条病斑直径,计算发酵液对核桃腐烂病的防治效果。每种生防菌处理5根枝条,试验3次重复。防治效果/%=(空白对照平均病斑直径-处理平均病斑直径)/空白对照平均病斑直径×100。
1.2.6 生防菌发酵液对核桃幼苗的促生作用 选取种仁饱满,无病虫,单果质量大于15 g的干果作为试验材料。将核桃种子浸泡10 d(每天换1次水)后用清水洗净,在自然条件下晾干后播种。将土壤高压灭菌,放入直径15 cm的花盆中,土层厚度12 cm,每盆放入2 粒核桃种子。在25 ℃下,光暗交替培养,等核桃苗出齐后,对核桃幼苗进行生防菌发酵液灌根处理。每次每盆浇灌10 mL,每隔7 d 浇灌1 次,一共浇灌6次,以浇灌10 mL蒸馏水为对照,每种生防菌处理10 株幼苗,试验设置3 次重复。60 d 后对幼苗的生长情况进行观测,测定核桃幼苗的株高、根长、茎粗、叶片数并称量植株鲜质量。然后在60 ℃下持续烘干96 h,测量干质量,并对测得数据进行统计分析。
1.2.7 生防菌的促生能力 参照邴辉[15]的方法:将生防真菌用灭菌的5 mm打孔器打菌饼接种到脱脂奶粉、无机磷、有机磷、铁载体培养基上,每个菌株设置3 个重复,28 ℃培养7 d,出现透明圈表示菌株具有产蛋白酶、溶解磷和产铁载体能力,通过计算透明圈直径(D)与菌直径(d)的比值(D/d)来判断其活性的强弱。
1.3 数据分析
采用Microsoft Excel 记录和整理数据,并使用SPSS 26.0 进行方差分析和差异显著性分析,使用MEGA5.1软件构建系统进化树。
2 结果与分析
2.1 内生真菌的分离结果
从210块组织内共分离到内生真菌129株,内生真菌的分离率为61.4%,其中茎部分离出58 株,IR=27.6%,IF=44.9%;根部分离出42 株,IR=20%,IF=32.5;枝部分离出29 株,IR=13.8%,IF=22.4%。不同组织部位的内生真菌的分离率和分离频率从高到低依次为茎>根>枝(表1)。129 株真菌隶属于3 门18 属。其中子囊菌门122 株,占比达94.57%,接合菌门5株,占3.88%,担子菌门2株,仅占1.55%。129株内生真菌分别属于镰刀菌属(Fusarium)、链格孢属(Alternaria)、曲霉属(Aspergillus)、球毛壳菌属(Chaetomium)、青霉菌属(Penicillium)、茎点霉菌属(Phoma)、座坚壳菌属(Rosellinia)、帚枝霉菌属(Sarocladium)、小球腔菌属(Leptosphaeria)、Dactylon-ectria、踝节菌属(Talaromyces)、暗球腔菌属(Phaeosphaeria)、棒孢菌属(Corynespora)、小穴壳菌属(Dothiorella)、角担菌属(Ceratobasidium)、枝顶孢菌属(Acremonium)、丛赤壳菌属(Nectria)、被孢菌属(Mortierella)等18个属。其中镰刀菌属和链格孢属为优势菌属,分离率分别为18.1%、12.3%;其次为丛赤壳菌属,占分离菌数的4.76%;小穴壳菌属分离率最低,仅为0.48%。
表1 核桃内生真菌的种类分布及分离情况
Table 1 The species distribution and isolation of endophytic fungi in walnuts

注:“-”表示此部位未分离菌株。
Note:“-”indicates that no strains were isolated from this part.
组织Tissue茎Stem根Root枝Branch分离率Isolation rates,IR/%分离频率Relative frequency,IF/%组织Tissue茎Stem根Root枝Branch分离率Isolation rates,IR/%分离频率Relative frequency,IF/%镰刀菌属Fusarium 16 12 10 18.10 29.40暗球腔菌属Phaeosphaeria 312 2.86 4.65链格孢菌属Alternaria 12 86 12.30 20.10棒孢菌属Corynespora 21-1.43 2.33球毛壳菌属Chaetomium 521 3.81 6.20青霉菌属Penicillium 22-1.90 3.10茎点霉属Phoma 2--0.95 1.55曲霉菌属Aspergillus 1-2 1.43 2.33座坚壳菌属Rosellinia 2--0.95 1.55小穴壳菌属Dothiorella 1--0.48 0.78帚枝霉菌属Sarocladium 111 1.43 2.33角担菌属Ceratobasidium 11-0.95 1.55小球腔菌属Leptosphaeria 311 2.38 3.88枝顶孢菌属Acremonium 12-1.43 2.33 Dactylonectria 113 2.38 3.88丛赤壳属Nectria 262 4.76 7.75踝节菌属Talaromyces 21-1.43 2.33被孢菌属Mortierella 131 2.38 3.88
2.2 核桃内生真菌的多样性分析
采用香农指数H'、辛普森指数D、丰富度指数M、均匀度指数E 等指标,分析内生真菌多样性,结果如表2 所示,不同部位所分离的内生真菌多样性指数不同,香农指数从高到低的顺序为茎(2.452)>根(2.067)>枝(1.804);丰富度指数为茎(8.129)>根(5.847)>枝(3.993);均匀度指数为茎(0.603)>根(0.553)>枝(0.535)。因此,从香农指数、丰富度指数和均匀度指数来看,核桃茎部内生真菌的多样性高于根部和枝部。
表2 核桃茎、根、枝中的内生真菌多样性指数
Table 2 Endophytic fungal diversity index in walnut stems,roots and branches
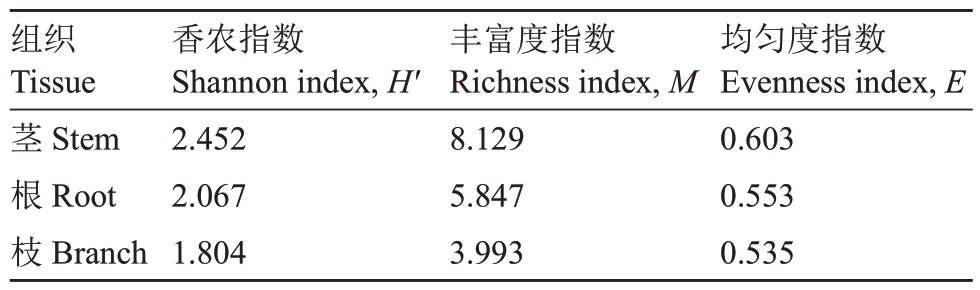
组织Tissue茎Stem根Root枝Branch香农指数Shannon index,H'2.452 2.067 1.804丰富度指数Richness index,M 8.129 5.847 3.993均匀度指数Evenness index,E 0.603 0.553 0.535
2.3 核桃内生真菌的相似性分析
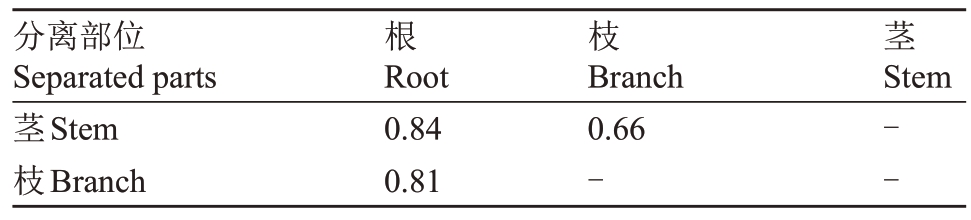
通过计算相似性系数(表3)可知,根部与茎部内生真菌类群最为相似,相似性Cs 茎-根=0.84;茎部与枝部之间内生真菌差异比较大,相似性系数Cs 茎-枝=0.66;而根与枝内生真菌相似性Cs 根-枝=0.81。从整体来看各组织部位之间内生真菌类群差异较大。
表3 不同部位内生真菌的相似性系数
Table 3 Similarity coefficient of endophytic fungi in different parts
注:“-”表示无。下同。
Note:“-”Indiates no.The same below.
分离部位Separated parts茎Stem枝Branch根Root 0.84 0.81枝Branch 0.66-茎Stem--
2.4 生防菌的筛选
从129 株内生真菌中经过筛选获得3 株对核桃腐烂病菌具有较好拮抗效果的内生真菌,分别命名为SF01、SF05、SF08(图1)。从抑菌图来看,SF01和SF05 分泌的抑菌物质能够快速通过PDA 培养基进行扩散,使得培养基整体上可抑制病原菌菌丝的生长;而SF08 分泌的抑菌物质仅分布在菌株周围,不能在培养基中快速扩散,因此仅在菌株周围形成。经过测定,3 株内生真菌的抑菌率分别为71.2%、73.5%、68.5%,抑菌效果相对较好,因此,选择菌株SF01、SF05、SF08作为目标生防菌进行后续试验。

图1 3 株生防菌对核桃腐烂病菌的抑菌效果
Fig.1 Antifungal effect of 3 strains of biocontrol fungi against C.chrysosperma
2.5 生防菌株的鉴定
2.5.1 形态学鉴定 SF01 在PDA 培养基上生长速度较慢,为0.56 cm·d-1,菌落中央为白色菌丝,随后菌落边缘出现咖啡色至深褐色,菌丝绒毛状,培养基颜色逐渐变褐色,未形成孢子。SF05在PDA培养基上生长速度相对较快,为1.14 cm·d-1,菌落灰褐色,菌丝密实、绒毡状,未见孢子产生。SF08 在PDA 培养基上生长速度较慢,为0.47 cm·d-1,菌落棉絮状,中央略隆起,正面呈白色,背面呈橙褐色,未见孢子产生(图2)。

图2 3 株生防菌菌株的菌落形态和菌丝显微镜图
Fig.2 The colony morphology and mycelium microscope of 3 biocontrol strains
2.5.2 分子生物学鉴定 SF01菌株rDNA-ITS基因经测序后,得到的序列长度为554 bp,提交GenBank获得登录号为PP301358;SF05 菌株rDNA-ITS 序列长度为540 bp,提交GenBank 获得登录号为PP301359;SF08菌株rDNA-ITS序列长度为552 bp,登录号为PP301360。利用MEGA5.1 软件使用Neighbor-Joining法构建基于ITS基因序列的系统发育树。结果表明,SF01 菌株与Dactylonectria torresensis 位于同一分支(图3),亲缘关系最近;SF05 菌株与Chaetomium globosum 位于同一分支(图4);SF08 菌株与Penicillium rubens 位于同一分支(图5)。因此,结合形态学特征将SF01菌株鉴定为D.tor-resensis,将SF05菌株鉴定为球毛壳菌C.globosum,将SF08菌株鉴定为产红青霉P.rubens。
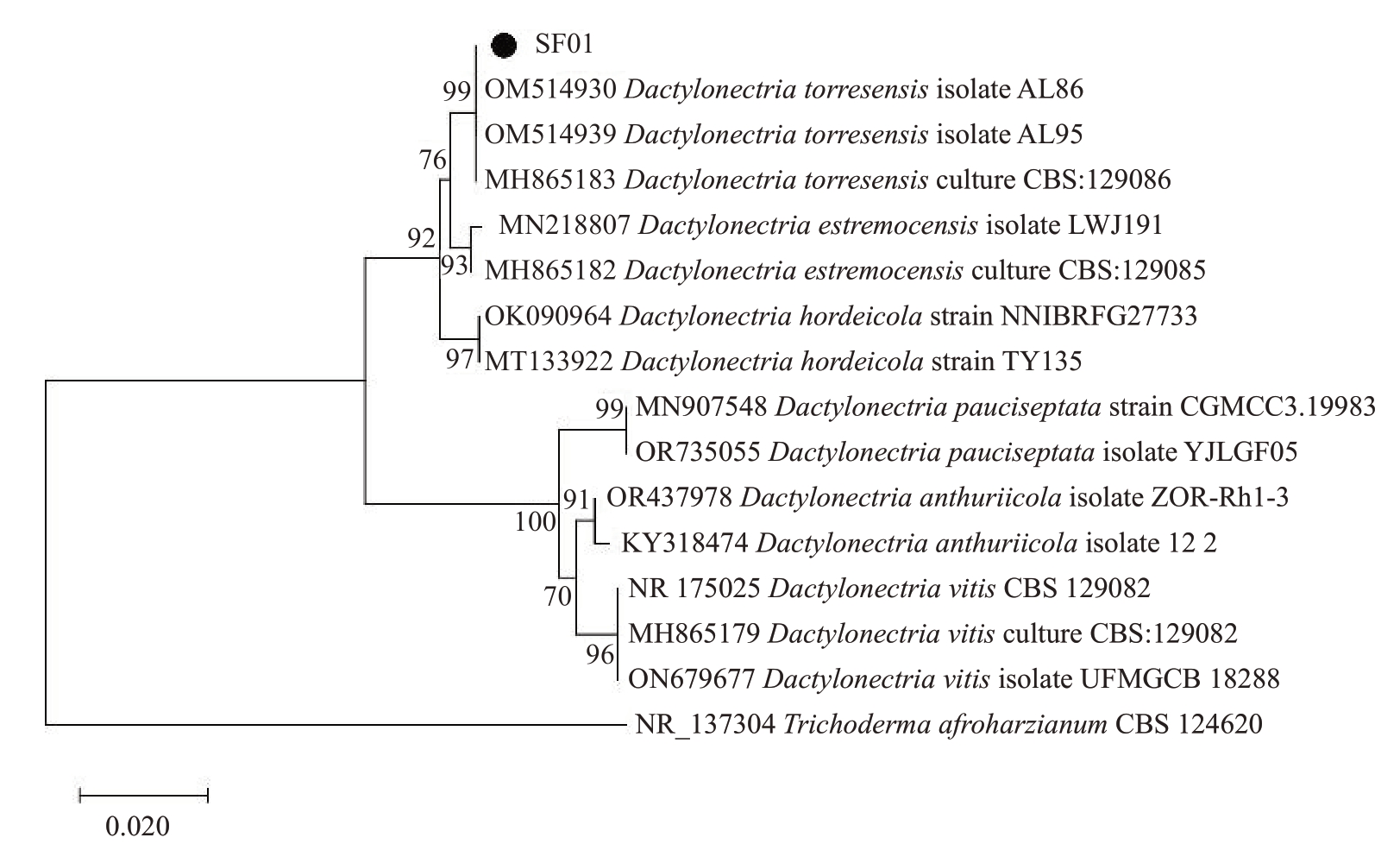
图3 菌株SF01 基于rDNA-ITS 基因序列构建的系统发育树
Fig.3 Phylogenetic trees of SF01 based on rDNA-ITS
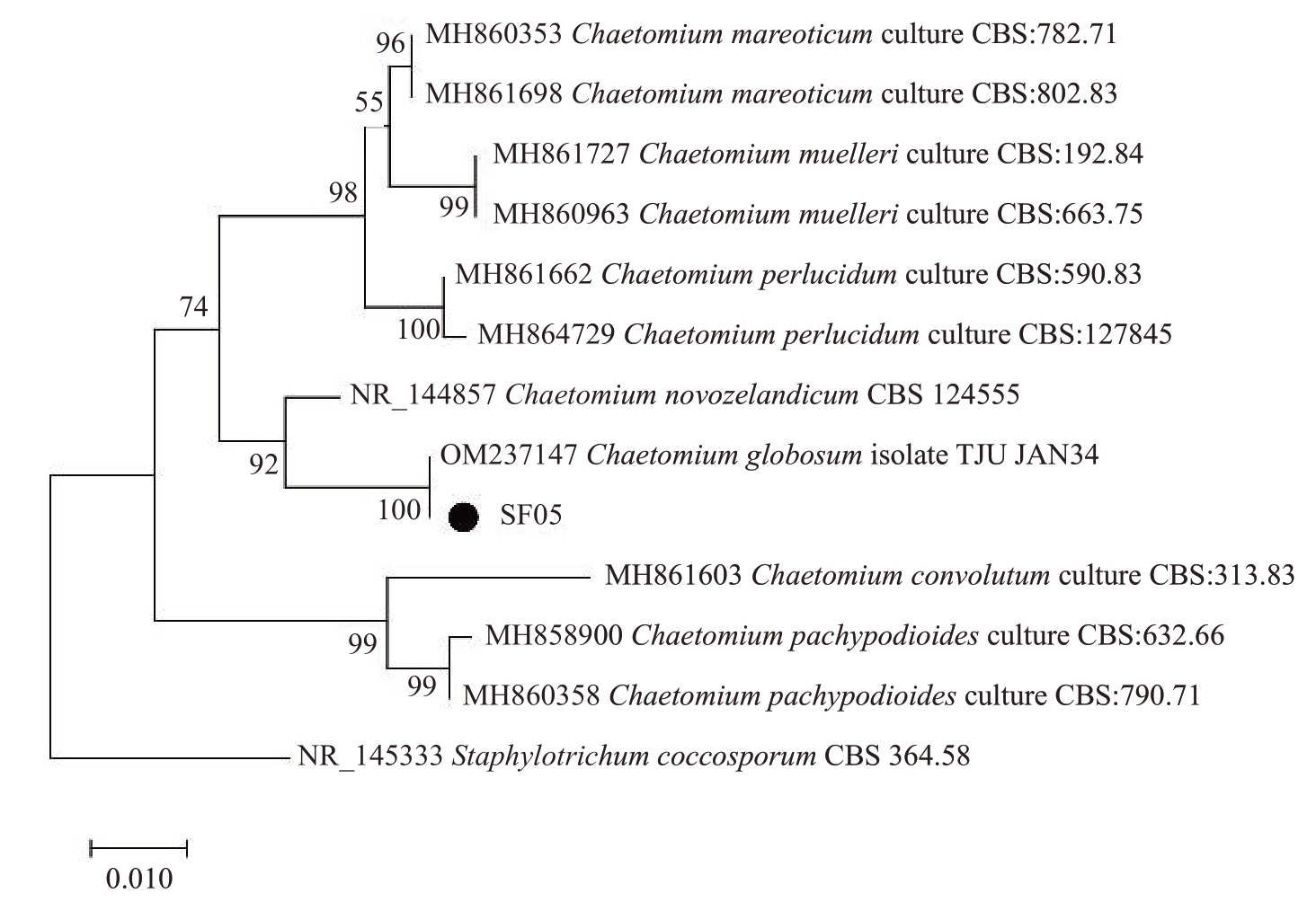
图4 菌株SF05 基于rDNA-ITS 基因序列构建的系统发育树
Fig.4 Phylogenetic trees of SF05 based on rDNA-ITS
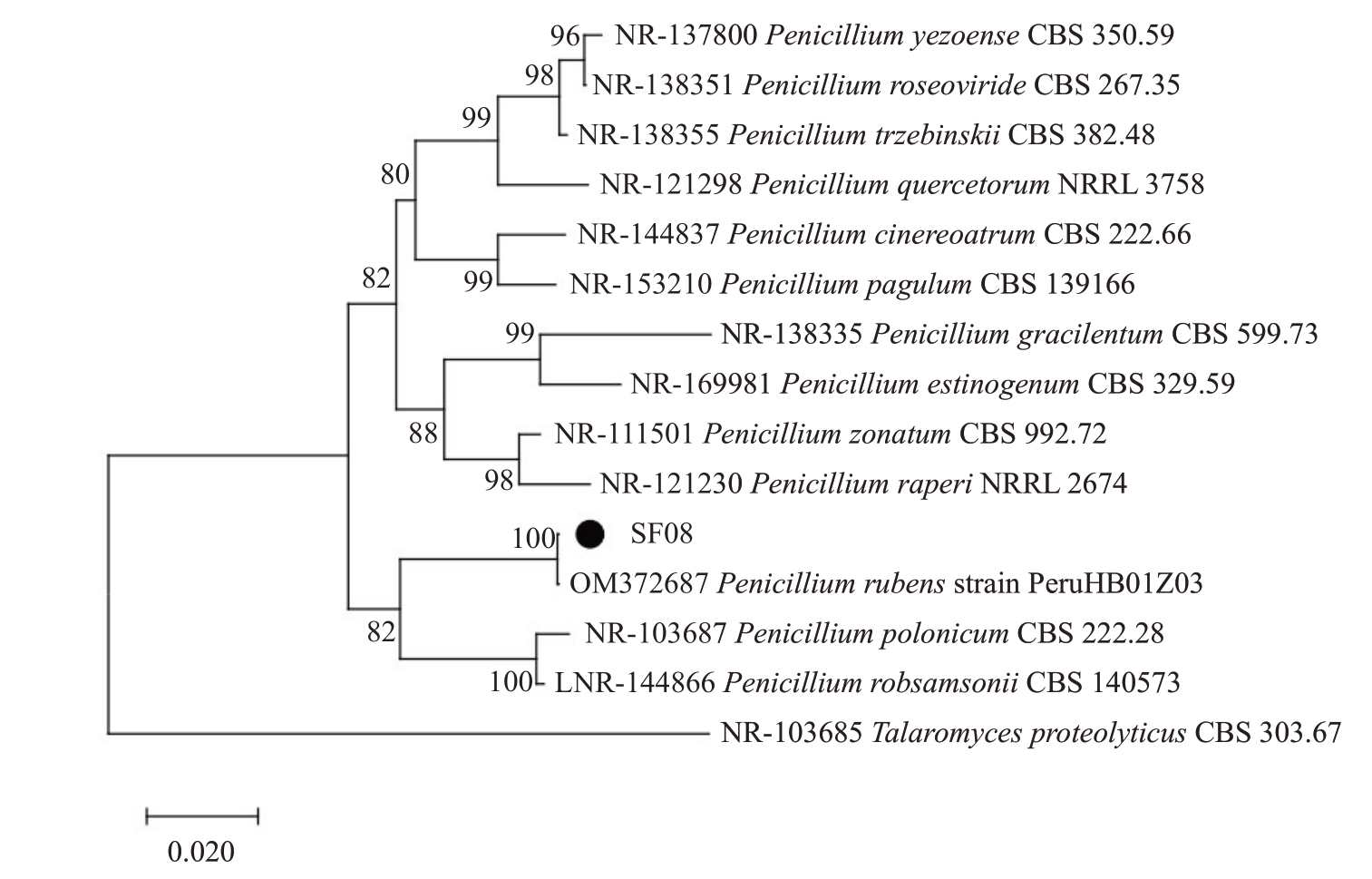
图5 菌株SF08 基于rDNA-ITS 基因序列构建的系统发育树
Fig.5 Phylogenetic trees of SF08 based on rDNA-ITS
2.6 生防菌对核桃腐烂病的防治效果
2.6.1 生防菌对核桃腐烂病的预防效果 生防菌对核桃腐烂病的预防效果见图6,可以看出,经生防菌发酵液处理过的核桃离体枝条,能够明显降低核桃腐烂病病斑直径。由表5数据可以看出,3株生防菌对核桃腐烂病菌的预防效果在77.06%~80.10%之间,其中D.torresensis 发酵液对核桃腐烂病的离体预防效果最好,防效达到80.10%。

图6 3 株生防菌发酵液对核桃腐烂病的预防效果
Fig.6 Prevention effect of three strains of biocontrol fungi on walnut canker disease
表5 生防菌发酵液对核桃枝条离体试验腐烂病的预防效果
Table 5 Preventive effect of biocontrol fungi fermentation solution on walnut branches canker disease in vitro test

注:表中数据为平均值±标准差,每列中字母不同者表示差异达显著水平(p<0.05)。下同。
Note:Data in the table are means±standard deviations,the different small letters in the same column indicates significant difference at 0.05 level.The same below.
菌株Strain D.torresensis SF01 C.globosum SF05 P.rubens SF08对照Control病斑平均直径Average diameters of lesions/cm 1.01±0.11 b 1.32±0.18 b 1.11±0.21 b 4.97±0.24 a预防效果Preventive effect/%80.10±2.21 a 73.40±3.12 a 77.60±3.78 a
2.6.2 生防菌对核桃腐烂病的治疗效果 由图7可以看出,接种病原菌的核桃离体枝条经生防菌发酵液处理后,能够明显降低病斑直径。由表6 可知,3株生防菌对核桃腐烂病的治疗效果在77.30%~83.40%之间,其中P.rubens 发酵液对核桃腐烂病的治疗效果最好,防效达到83.4%。

图7 3 株生防菌发酵液对核桃腐烂病的治疗效果
Fig.7 Treatment effect of walnut canker disease by fermentation broth of three strains of biocontrol fungi
表6 生防菌发酵液对核桃枝条离体试验腐烂病的治疗效果
Table 6 Therapeutic effect of biocontrol fungi fermentation solution on walnut branches canker disease in vitro test

菌株Strain D.torresensis SF01 C.globosum SF05 P.rubens SF08对照Control病斑平均直径Average diameters of lesions/cm 1.01±0.19 b 1.15±0.21 b 0.86±0.28 b 5.07±0.24 a治疗效果Therapeutic outcome/%80.07±4.01 a 77.30±4.21 a 83.40±3.38 a
2.7 生防菌发酵液对核桃幼苗的促生作用
从图8可以看出,3株生防菌对核桃幼苗均有较好的促生效果。由表7 数据可知,相比对照而言,3株生防菌对核桃幼苗的根长、株高、鲜质量、干质量、茎粗和叶片数等农艺指标有显著促进作用(p<0.05)。

图8 生防菌发酵液对核桃幼苗的促生作用
Fig.8 Growth promotion effect of biocontrol fungi fermentation solution on walnut seedlings
表7 生防菌发酵液对核桃幼苗的促生作用
Table 7 Growth promotion effect of biocontrol fungi fermentation solution on walnut seedlings
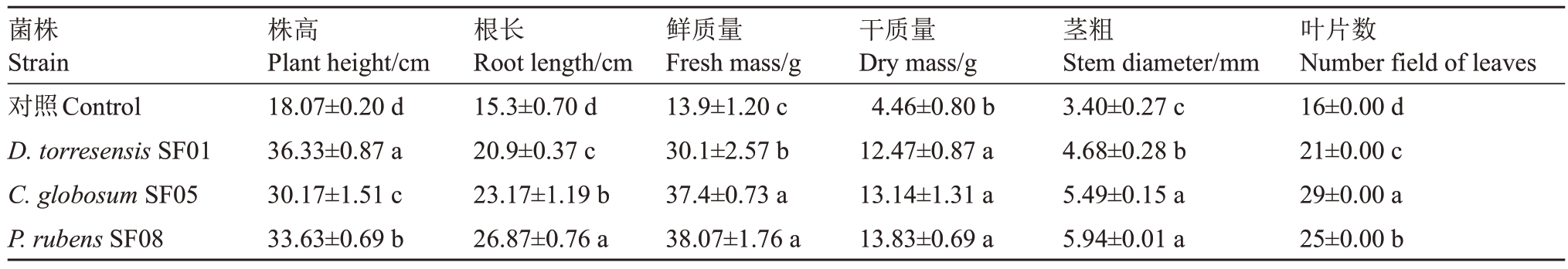
菌株Strain对照Control D.torresensis SF01 C.globosum SF05 P.rubens SF08株高Plant height/cm 18.07±0.20 d 36.33±0.87 a 30.17±1.51 c 33.63±0.69 b根长Root length/cm 15.3±0.70 d 20.9±0.37 c 23.17±1.19 b 26.87±0.76 a鲜质量Fresh mass/g 13.9±1.20 c 30.1±2.57 b 37.4±0.73 a 38.07±1.76 a干质量Dry mass/g 4.46±0.80 b 12.47±0.87 a 13.14±1.31 a 13.83±0.69 a茎粗Stem diameter/mm 3.40±0.27 c 4.68±0.28 b 5.49±0.15 a 5.94±0.01 a叶片数Number field of leaves 16±0.00 d 21±0.00 c 29±0.00 a 25±0.00 b
2.8 生防菌的促生能力
研究表明,SF01 具有溶磷、解磷和产铁载体能力;SF05 具有解磷和产铁载体能力;SF08 具有产蛋白酶、溶磷和产铁载体能力(表8)。
表8 生防菌菌株的促生能力
Table 8 Growth promoting capacity characteristics of biocontrol strains

菌株Strain D.torresensis SF01 C.globosum SF05 P.rubens SF08产蛋白酶Producing protease--0.52±0.04溶磷Phosphate solubilization 0.15±0.01-0.38±0.06解磷Dissolve phosphorus 0.21±0.02 0.56±0.03-产铁载体Siderophore 0.11±0.01 0.35±0.04 0.33±0.02
3 讨 论
本研究结果表明,不同组织部位内生真菌种群组成表现出差异性,茎内生真菌多样性指数、丰富度指数、均匀度指数高于根和枝条,说明内生真菌对寄主植物具有一定组织偏好性,这也印证了Hoffman等[16]的研究结论,即植物内生真菌多样性受到寄主植物自身不同组织生理生化特性差异的影响。从相似性比较来看,茎与根相似度最高,推测是茎与根在空间距离上相隔较近,更有利于内生真菌的相互交流与转移。而茎与枝相似度最低,推测与新疆果园的栽培管理方式相关,为提高果园产出效率,每年对核桃园枝条进行修剪翻新,以塑造良好树形从而培养更多结果枝组,最终导致枝条内生真菌种类相对较少,多样性也相对较低。本研究结果表明,镰刀菌属和链格孢菌属仍然是核桃内生真菌的优势菌群,这与一些学者的研究结论一致[17-18],并且这两类真菌能够增强寄主植物对不良环境的抵抗力[19]。同时也说明这两类真菌相较其他属真菌具有更强的生存能力,更容易在寄主中生长。但镰刀菌和链格孢菌是常见的植物病原菌,在与寄主共生过程中,特别是在寄主衰弱时是否会转化为致病菌还有待进一步研究。
开发生防菌资源是进行植物病害生物防治的基础[20]。新疆是中国最大的盐碱地区,土地盐碱化已成为新疆农业可持续发展的重要障碍[21]。减少农药化肥的投入量,采用高效环保的生物菌剂是保障新疆农业健康发展的重要措施之一。笔者从核桃不同组织分离获得3 株不仅对核桃腐烂病具有很好防效,而且对核桃幼苗具有很好促生作用的内生真菌,经鉴定分别为D.torresensis、C.globosum、P.rubens,3 株真菌对核桃腐烂病离体枝条防效均超过77%。研究发现经过3 株真菌发酵液处理的核桃幼苗,相比对照在根长、株高,鲜质量、干质量、茎粗直径等农艺指标上均有显著促进作用(p<0.05)。促生研究表明,D.torresensis具有解磷、溶磷、产铁载体能力,但无产蛋白酶能力;C.globosum 具有解磷、产铁载体能力,但无溶磷和无产蛋白酶能力;P.rubens具有溶磷、产蛋白酶和产铁载体能力,但无解磷能力。3株真菌在促生功能上表现出了互补性,但真菌之间混合后能否增强对核桃腐烂病的防治效果,能否增强对核桃幼苗的促生作用以及菌株的应用方式还有待进一步研究。
已有研究表明,大多数土壤中的有效磷含量较低,95%以上为难溶形态[22],可用的磷酸盐阴离子要么被黏土表面吸附[23],要么与阳离子形成不溶性络合物[24]。同样,土壤中大多数铁溶解度极低,以氧化态或氢氧化态形式存在,不能被植物利用[25]。蛋白酶是能够水解蛋白质中肽键结构并产生氨基酸或多肽的一类酶的总称,能够分解有机质和矿物质,促进土壤形成与发育,对调节植物生长发挥着重要作用,是土壤肥力指标体系中生物学指标之一。新疆盐碱化土壤面积大,土壤肥力相对贫瘠,因此,发掘具有解磷溶磷、产铁载体和蛋白酶特性的微生物资源并进行开发利用,对提高土壤营养元素利用率,降低化肥的投入量,从而推动农业绿色发展具有重要意义。
4 结 论
笔者从10 株50 年生核桃不同组织部位中共分离到129株内生真菌,经过鉴定属于3门18属,其中优势菌属为镰刀菌属和链格孢菌属。对不同组织部位的内生真菌进行多样性分析的结果表明,茎内生真菌的多样性指数H'、丰富度指数M和均匀度指数E最高,而枝内生真菌多样性指数、丰富度指数和均匀度指数相比最低。不同组织内生真菌存在差异性的同时,也表现出一定程度的相似性,其中茎与根的内生真菌相似性最高,其次为根和枝,而枝条中内生真菌的多样性指数和丰富度指数均低于茎,且二者的相似度最低。从129 株内生真菌中筛选出了3 株对核桃腐烂病具有较好防效且对核桃幼苗具有显著促生作用的生防真菌。促生特性研究表明,3 株真菌均有产铁载体的能力,同时在解磷、溶磷及产蛋白酶能力方面,菌株间又存在差异。
[1] 张晓婧,刘润进.广义与狭义植物内生生物的定义及其研究进展[J].微生物学通报,2014,41(3):560-571.ZHANG Xiaojing,LIU Runjin. Broad and narrow definition of endophytes and related advances in the study[J]. Microbiology China,2014,41(3):560-571.
[2] LYONS P C,EVANS J J,BACON C W.Effects of the fungal endophyte Acremonium coenophialum on nitrogen accumulation and metabolism in tall fescue[J]. Plant Physiology,1990,92(3):726-732.
[3] SANTOYO G,MORENO- HAGELSIEB G,DEL CARMEN OROZCO-MOSQUEDA M,GLICK B R. Plant growth-promoting bacterial endophytes[J]. Microbiological Research,2016,183:92-99.
[4] HAIDAR R,FERMAUD M,CALVO-GARRIDO C,ROUDET J,DESCHAMPS A. Modes of action for biological control of Botrytis cinerea by antagonistic bacteria[J]. Phytopathologia Mediterranea,2016,55(3):301-322.
[5] 吴婷,王梦迪,黄情儿,朱波,秦路平.延胡索不同组织器官中内生真菌菌群结构与多样性分析[J]. 中草药,2023,54(16):5372-5378.WU Ting,WANG Mengdi,HUANG Qinger,ZHU Bo,QIN Luping. Fungal community and diversity of endophytic fungi in different tissues of Corydalis yanhusuo[J]. Chinese Traditional and Herbal Drugs,2023,54(16):5372-5378.
[6] 唐青,周思旋,雷帮星,文庭池,钱一鑫,康冀川.贵州西南部艾纳香内生真菌多样性研究[J]. 菌物学报,2017,36(11):1498-1503.TANG Qing,ZHOU Sixuan,LEI Bangxing,WEN Tingchi,QIAN Yixin,KANG Jichuan. Diversity of endophytic fungi from Blumea balsamifera in southwest Guizhou[J]. Mycosystema,2017,36(11):1498-1503.
[7] 郭良栋. 内生真菌研究进展[J]. 菌物系统,2001,20(1):148-152.GUO Liangdong.Advances of researches on endophytic fungi[J].Mycosystema,2001,20(1):148-152.
[8] 徐莎莎.新疆核桃腐烂病的发生规律、病原结构组成及遗传多样性研究[D].阿拉尔:塔里木大学,2022.XU Shasha. The occurrence,pathogenic structural composition and genetic diversity of walnut canker disease in Xinjiang[D].Alar:Tarim University,2022.
[9] 孔婷婷,岳朝阳,刘爱华,张静文,克热曼,努尔古丽,阿衣夏木.核桃腐烂病的发生和综合防控研究进展[J].防护林科技,2016(10):65-66.KONG Tingting,YUE Chaoyang,LIU Aihua,ZHANG Jingwen,Kereman,Nuerguli,Ayixiamu. Research progress on occurrence and comprehensive control of walnut rot disease[J]. Protection Forest Science and Technology,2016(10):65-66.
[10] 王瀚,卓平清,王让军,王明霞.核桃腐烂病研究进展[J].东北农业科学,2019,44(3):23-27.WANG Han,ZHUO Pingqing,WANG Rangjun,WANG Mingxia.Progress of researches on the canker disease of walnut[J]. Journal of Northeast Agricultural Sciences,2019,44(3):23-27.
[11] 郝芳敏,臧全宇,马二磊,丁伟红,王毓洪,黄芸萍.甜瓜多种真菌病害拮抗细菌NBmelon-1 的鉴定及其促生和生防效果[J].中国瓜菜,2021,34(7):14-19.HAO Fangmin,ZANG Quanyu,MA Erlei,DING Weihong,WANG Yuhong,HUANG Yunping. Identification,biocontrol and growth promoting effects of antagonistic bacteria NBmelon-1 of various fungal diseases in melon[J].China Cucurbits and Vegetables,2021,34(7):14-19.
[12] 郝芳敏,董文杰,臧全宇,马二磊,丁伟红,王毓洪.一株甜瓜枯萎病拮抗菌的筛选、鉴定及生防效果[J].中国瓜菜,2023,36(12):26-32.HAO Fangmin,DONG Wenjie,ZANG Quanyu,MA Erlei,DING Weihong,WANG Yuhong. Screening,identification and biocontrol effect of antagonistic bacteria against melon Fusarium wilt[J].China Cucurbits and Vegetables,2023,36(12):26-32.
[13] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.WEI Jingchao.Molecular identification of Fungi[M].Shanghai:Shanghai Science Technology Press,1979.
[14] 易航,何静,杨希,荣姝恬,王丽.小黄花茶内生真菌的多样性分析及抑菌活性初筛[J].广西植物,2024,44(2):382-395.YI Hang,HE Jing,YANG Xi,RONG Shutian,WANG Li. Diversity analysis of endophytic fungi and preliminary screening of antibacterial activity in Camellia luteoflora[J]. Guihaia,2024,44(2):382-395.
[15] 邴辉.生姜根际促生菌的促生效应[D].泰安:山东农业大学,2020.BING Hui. Promoting effect of ginger from rhizosphere probioties[D].Tai’an:Shandong Agricultural University,2020.
[16] HOFFMAN M T,ARNOLD A E. Geographic locality and host identity shape fungal endophyte communities in Cupressaceous trees[J].Mycological Research,2008,112(3):331-344.
[17] 毛光瑞,翟梅枝,史冠昭,阿依佳玛丽·依玛尔,刘泽星.陕西不同生境核桃内生真菌多样性[J]. 微生物学通报,2016,43(6):1262-1273.MAO Guangrui,ZHAI Meizhi,SHI Guanzhao,Yimaer·Ayijiamali,LIU Zexing. Diversity of fungat endophytes from Juglans regia under different habitats in Shaanxi[J].Microbiology China,2016,43(6):1262-1273.
[18] 白周艳,王晓炜,马荣,田呈明.新疆杏树(Armeniaca Mill.)内生真菌多样性分析[J]. 新疆农业大学学报,2011,34(4):321-327.BAI Zhouyan,WANG Xiaowei,MA Rong,TIAN Chengming.Analysis on diversity of endophytic fungi from apricot (Armeniaca mill.)in Xinjiang[J].Journal of Xinjiang Agricultural University,2011,34(4):321-327.
[19] HELLWIG V,GROTHE T,MAYER- BARTSCHMID A,ENDERMANN R,GESCHKE F U,HENKEL T,STADLER M.Altersetin,a new antibiotic from cultures of endophytic Alternaria spp. taxonomy,fermentation,isolation,structure elucidation and biological activities[J].Journal of Antibiotics,2002,55(10):881-892.
[20] 符晓,丁俊园,焦嘉卉,钟思雨,孙孟娇,付家佳,唐光辉,李培琴.陕西地区花椒主要病害的生防菌筛选与鉴定[J].干旱地区农业研究,2024,42(2):222-230.FU Xiao,DING Junyuan,JIAO Jiahui,ZHONG Siyu,SUN Mengjiao,FU Jiajia,TANG Guanghui,LI Peiqin.Screening and identification of biocontrol strains for major diseases of Zanthoxylum bungeanum in Shaanxi Province[J]. Agricultural Research in the Arid Areas,2024,42(2):222-230.
[21] 王斌,马兴旺,单娜娜,杨涛,刘骅,牛新湘.新疆盐碱地土壤改良剂的选择与应用[J]. 干旱区资源与环境,2014,28(7):111-115.WANG Bin,MA Xingwang,SHAN Nana,YANG Tao,LIU Hua,NIU Xinxiang.The selection and application of saline alkali soil amendment in Xinjiang[J]. Journal of Arid Land Resources and Environment,2014,28(7):111-115.
[22] 孟祥坤,于新,朱超,胡兆平,范玲超.解磷微生物研究与应用进展[J].华北农学报,2018,33(增刊1):208-214.MENG Xiangkun,YU Xin,ZHU Chao,HU Zhaoping,FAN Lingchao.Research and application advances in phosphate-solubilizing-microorganisms[J]. Acta Agriculturae Boreali-Sinica,2018,33(Suppl.1):208-214.
[23] HALAJNIA A,HAGHNIA G H,FOTOVAT A,KHORASANI R. Phosphorus fractions in calcareous soils amended with P fertilizer and cattle manure[J].Geoderma,2009,150(1/2):209-213.
[24] YADAV H,FATIMA R,SHARMA A,MATHUR S. Enhancement of applicability of rock phosphate in alkaline soils by organic compost[J].Applied Soil Ecology,2017,113:80-85.
[25] 邓凌韦,张丽艳,马军韬,王永力,李琬,王利军,郑德刚.机理Ⅰ植物根系铁吸收及缺铁感应信号研究进展[J].黑龙江农业科学,2015(9):140-146.DENG Lingwei,ZHANG Liyan,MA Juntao,WANG Yongli,LI Wan,WANG Lijun,ZHENG Degang. Research progress on the iron uptake of strategy Ⅰplant and iron sensors to iron deficiency[J].Heilongjiang Agricultural Sciences,2015(9):140-146.