中国拥有丰富多样、分布广泛的葡萄遗传资源,其中蕴藏着大量抗逆性优异的种质[1]。据新疆维吾尔自治区工业和信息化厅报道,新疆酿酒葡萄种植面积达2万hm2,占全国24.50%,是中国最大的葡萄原酒生产基地[2]。天山北麓产区,地处北纬44°,是酿酒葡萄生产的“黄金地带”,该产区以赤霞珠、马瑟兰、小味儿多、品丽珠、烟73、贵人香为主栽品种,均为欧亚种葡萄(Vitis vinifera),其品质优良,但抗寒抗抽干能力较差[3-4]。新疆地区受大陆性季风气候影响,冬季寒冷干燥,尤其是近年来低温冻害频繁发生,对酿酒葡萄的产量和品质造成严重影响,个别年份甚至出现绝产,导致葡萄酒原料供应不稳定[5]。因此,为确保葡萄安全越冬,生产上普遍采用埋土防寒栽培技术,但此方法不仅会破坏地表,引发土壤风蚀,对生态环境保护不利,同时也会增加劳动成本,降低市场竞争力。酿酒葡萄品种的抗寒能力很大程度上影响着植株的存活和生长,且不同种群、不同品种(系)的抗寒性也不尽相同[6-7]。近年来,中国的葡萄育种工作者将山葡萄与欧亚种葡萄进行种间杂交,培育出了北冰红、北馨、凌丰红等抗寒葡萄新品种[8-10]。由此可见,引进东北地区高抗寒葡萄种质资源,是拓展新疆酿酒葡萄抗寒性遗传背景的有效手段,对培育高抗寒性酿酒葡萄新品种具有十分重要的意义。
在开展此项研究工作时,如何准确地鉴定酿酒葡萄的抗寒性是首要问题。目前,已有相关研究报道,相对电导率(REC)、半致死温度(LT50)、渗透调节物质含量、抗氧化酶活性等指标广泛应用于植物抗寒性评价[11]。曹建东等[12]通过对葡萄砧木和栽培品种的生理生化指标进行主成分分析,筛选出REC、丙二醛(MDA)含量、脯氨酸(Pro)含量、可溶性糖(SS)含量、可溶性蛋白质含量、萌芽率、产生愈伤组织的比率等指标作为评价葡萄抗寒性的重要指标,并根据各指标不同低温处理下的变化趋势,得出各品种抗寒性强弱。郭艳兰等[13]根据Logistic 方程拟合计算出LT50,并结合隶属函数法对葡萄营养系进行综合评价,得出CS-VCR11、CS-VCR19、PNVCR9、CS-15 的抗寒性较强,平均隶属度值与LT50相关性达极显著水平(p<0.01),二者均可作为有效评价葡萄抗寒性的指标。杨豫等[14]对4个酿酒葡萄生理生化指标相关分析的结果表明,REC、过氧化氢酶活性和MDA、SS、可溶性蛋白含量与抗寒性呈负相关,枝条萌芽率、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性与抗寒性呈正相关,恢复生长法、LT50可作为判断酿酒葡萄枝条抗寒性强弱的单项指标。贾金辉等[15]通过测定REC、POD 活性、枝条萌发率、Pro 和SS 含量评价了8 个酿酒葡萄品种的抗寒性。
植物抗寒性是数量性状,单一指标往往难以准确地反映其抗寒性的程度,通过采用多种分析方法进行综合评价,可以提高其准确性[16]。任静等[17]结合主成分分析法、聚类分析法以及相关性分析,评价了河西走廊贵人香葡萄7个砧穗组合的抗寒性。罗尧幸等[18]利用隶属函数法评价了7个鲜食葡萄品种的抗寒能力强弱。目前有关酿酒葡萄抗寒性的研究多集中于欧亚品种,对山葡萄和山欧杂种(系)的研究报道较少。因此,为进一步研究酿酒葡萄种质资源的抗寒能力,笔者通过高低温交变箱模拟低温环境,对75 份酿酒葡萄种质1 年生枝条设置不同温度处理,测定不同低温下REC、POD活性、Pro含量、SS含量和MDA含量,利用Logistic方程计算出LT50,并结合隶属函数法和聚类分析,在短期内筛选出抗寒力强的酿酒葡萄种质资源,为加快酿酒葡萄抗寒育种、降低育种成本提供理论依据。
1 材料和方法
1.1 试验地概况
枝条采自新疆昌吉州玛纳斯县中信国安葡萄酒业有限公司自建基地资源圃(44°14′15″ N,86°14′54″E),该基地位于新疆天山北麓玛纳斯河流域,属于温带大陆性干旱半干旱气候区,具有冬季严寒、夏季酷热、日照充足、昼夜温差大、干旱少雨等特点。年日照时数2600~2900 h,年均温度7.2 ℃,年降水量110~200 mm,年蒸发量1500~2000 mm,极端最高气温39.6 ℃,极端最低气温-37.4 ℃,无霜期150~204 d。
1.2 试验材料与处理
供试材料为75份酿酒葡萄种质(表1),G1~G39为欧亚种,G40~G41 为欧美杂种,G42~G75 为山欧杂种,其中山欧杂种由中国农业科学院特产研究所提供后引种于新疆玛纳斯县,其亲本不详。试验于2023 年11 月进行,每份试材采集6 个粗细均匀、生长健壮的1年生枝条,采后带回实验室,用自来水冲洗去除枝条表面灰尘,再用去离子水冲洗3 遍后用吸水纸吸干水分。将枝条剪成10~15 cm的枝段,两端用保鲜膜封口,每份试材分为7 份,每份10 段,使用高低温交变箱(LW-100C)进行低温处理,以4 ℃作为对照,降温速率为4 ℃·h-1,低温处理温度分别为-10、-15、-20、-25、-30 和-35 ℃。将分装好的枝段放入冰箱中,以4 ℃·h-1的速率降温,到达目标温度后维持12 h,再以相同速率升温至4 ℃后取出于室温下放置2 h,测定其各项生理指标,每份试材的不同处理均设置3个重复。
表1 供试酿酒葡萄品种(系)
Table 1 Wine grape cultivars(lines)for test

编号Code G1 G2 G3 G4 G5 G6 G7 G8 G9 G10 G11 G12 G13 G14 G15 G16 G17 G18 G19 G20 G21 G22 G23 G24 G25种质名称Germplasm长相思Sauvignon Blanc烟73 Yan 73小芒森Petit Manseng霞多丽Chardonnay西拉Syrah晚红蜜Saperavi塔夫里斯Taвpиц琼瑶浆Gewurztraminer品丽珠Cabernet Franc捏布盖Neuburgske梅鹿辄Merlot玫瑰香Muscat Hamburg马瑟兰Marselan雷司令Cray Riesling克里木波西Kelimuboxi酒白Jiubai佳美Gamay佳利酿Carignan红巴克特Bacator Red黑比诺Pinot Noir贵人香Italian Riesling歌海娜Grenache盖吾沙Гeʜyca Чибил法国蓝Blue French二号白香Early Madeleine来源Source欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera编号Code G26 G27 G28 G29 G30 G31 G32 G33 G34 G35 G36 G37 G38 G39 G40 G41 G42 G43 G44 G45 G46 G47 G48 G49 G50种质名称Germplasm赤霞珠Cabernet Sauvignon赤霞珠品系1 Cabernet Sauvignon 1赤霞珠品系169 Cabernet Sauvignon 169赤霞珠品系170 Cabernet Sauvignon 170赤霞珠品系191 Cabernet Sauvignon 191赤霞珠品系338 Cabernet Sauvignon 338宝石解百纳Ruby Cabernet白玉霓Ugni Blanc白诗南Chenin Blanc白艮地Baigendi爱格丽Ecolly爱费立奥Aifeiliao 60-1 1-62黑虎香Black Muscat巴柯Blanc北馨Beixin北玺Beixi北玫Beimei北红Beihong北冰红Beibinghong公酿1号Gongniang 1左优红Zuoyouhong 11-5-3 11-5-17来源Source欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧亚种V.vinifera欧美杂种V.vinifera×V.labrusca欧美杂种V.vinifera×V.labrusca山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera编号Code G51 G52 G53 G54 G55 G56 G57 G58 G59 G60 G61 G62 G63 G64 G65 G66 G67 G68 G69 G70 G71 G72 G73 G74 G75种质名称Germplasm 11-5-26 11-5-32 11-5-36 11-5-68 11-6-28 11-6-52 11-7-6 11-7-11 11-14-16 11-14-45 11-23-23 11-30-31 12-3-6 12-3-19 12-3-23 12-5-6 12-6-5 12-6-32 12-6-42 12-10-60 12-10-70 12-12-23 12-16-9 12-16-95 12-16-96来源Source山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera山欧杂种V.amurensis×V.vinifera
1.3 试验方法
1.3.1 相对电导率测定及半致死温度确定 将不同低温处理后的枝条剪成3~5 mm 厚的薄片,并且避开芽眼位置,用天平称取薄片1 g,放至15 mL 试管中,标记后加入10 mL去离子水,在室温下浸泡12 h,随后用DDS-307型电导率仪测定浸提液初电导率,然后将样品置于沸水浴中煮沸15 min,再将浸提液定容至10 mL,待冷却至室温时,摇匀,测定浸提液终电导率,计算相对电导率:
半致死温度:用REC拟合Logistic方程,可获得曲线的拐点温度lna/b,即LT50,并求出方程的拟合度。拟合方程如下:
其中,其中k、a、b 为常数,y 为实测REC,x 为处理温度。
y1、y2、y3分别是等距处理温度下的REC,在实际应用中,常令y'=ln[(k-y)/y],y'=lna-bx,即REC y转换成y'后,与处理温度x 之间的关系可以用线性方程表示,故可以按一般的直线相关法求出a 和b。在数学上,拐点为d2y/dx2=0 时的x 值,即为LT50值。
1.3.2 生理生化指标的测定 采用愈创木酚法测定POD 活性[14],采用酸性茚三酮比色法测定Pro 含量[14],采用蒽酮比色法测定SS 含量[15],采用硫代巴比妥酸法测定MDA含量[15]。
1.3.3 葡萄抗寒性的隶属函数法评价 在综合各项生理指标的基础上,对75 份试材的抗寒性进行评价,其计算公式[16]为:
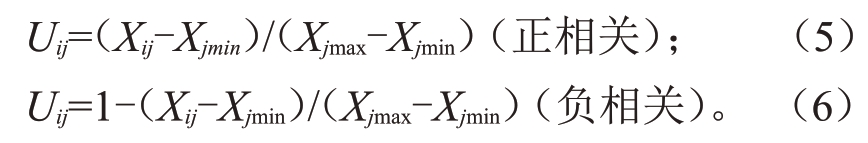
式中:Uij表示指标的隶属度值;Xij表示指标测定值,其中i 代表不同试材,j 代表抗寒指标,Xjmax和Xjmin分别为j指标的最大值和最小值。
1.4 数据处理
采用Excel 2010对试验数据进行整理,用SPSS 26.0 对数据进行非线性回归拟合、相关性分析,用Origin 2022进行聚类分析及作图。
2 结果与分析
2.1 Logistic方程的拟合及葡萄枝条低温半致死温度的确定
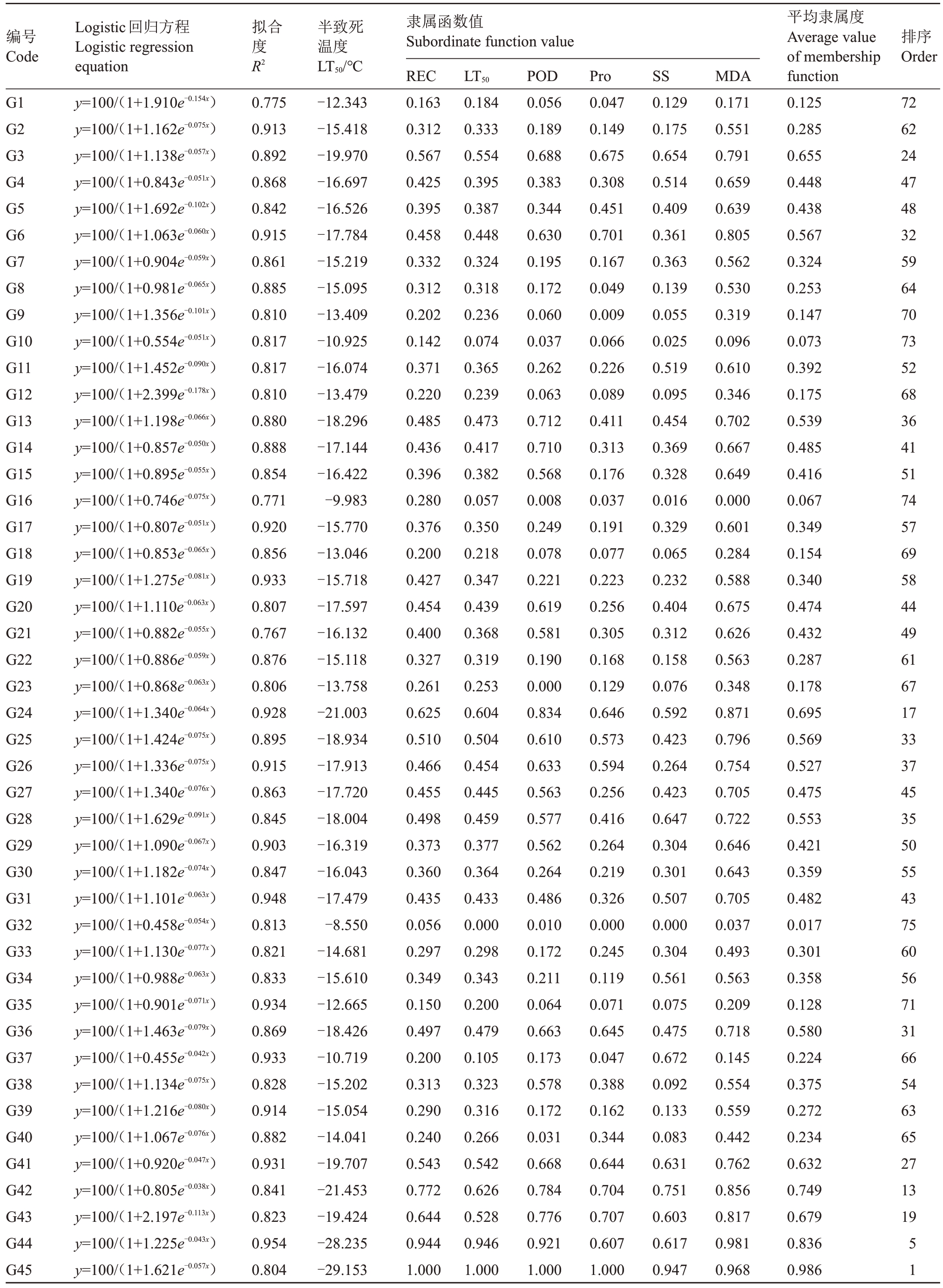
以温度为自变量x,枝条的相对电导率为因变量y,对供试酿酒葡萄种质进行Logistic 方程拟合回归分析,并计算各种质的低温LT50,结果见表2。各品种(系)的Logistic 方程拟合度R2为0.764~0.996,表明所拟合方程具有较高的可靠性,由此计算的LT50真实可用。各品种(系)的LT50在-8.550~-29.153 ℃,LT50值越小,说明抗寒性越强。39 份欧亚种葡萄品种的LT50在-8.550~-21.003 ℃,2份欧美杂种葡萄品种的LT50在-14.041~-19.707 ℃,34份山欧杂种葡萄品种的LT50在-15.935~-29.153 ℃。
表2 供试75 份酿酒葡萄种质半致死温度及抗寒性隶属函数评价
Table 2 Evaluation of LT50 and cold resistance affiliation function of 75 wine grape germplasms
G1 G2 G3 G4 G5 G6 G7 G8 G9 G10 G11 G12 G13 G14 G15 G16 G17 G18 G19 G20 G21 G22 G23 G24 G25 G26 G27 G28 G29 G30 G31 G32 G33 G34 G35 G36 G37 G38 G39 G40 G41 G42 G43 G44 G45 y=100/(1+1.910e-0.154x)y=100/(1+1.162e-0.075x)y=100/(1+1.138e-0.057x)y=100/(1+0.843e-0.051x)y=100/(1+1.692e-0.102x)y=100/(1+1.063e-0.060x)y=100/(1+0.904e-0.059x)y=100/(1+0.981e-0.065x)y=100/(1+1.356e-0.101x)y=100/(1+0.554e-0.051x)y=100/(1+1.452e-0.090x)y=100/(1+2.399e-0.178x)y=100/(1+1.198e-0.066x)y=100/(1+0.857e-0.050x)y=100/(1+0.895e-0.055x)y=100/(1+0.746e-0.075x)y=100/(1+0.807e-0.051x)y=100/(1+0.853e-0.065x)y=100/(1+1.275e-0.081x)y=100/(1+1.110e-0.063x)y=100/(1+0.882e-0.055x)y=100/(1+0.886e-0.059x)y=100/(1+0.868e-0.063x)y=100/(1+1.340e-0.064x)y=100/(1+1.424e-0.075x)y=100/(1+1.336e-0.075x)y=100/(1+1.340e-0.076x)y=100/(1+1.629e-0.091x)y=100/(1+1.090e-0.067x)y=100/(1+1.182e-0.074x)y=100/(1+1.101e-0.063x)y=100/(1+0.458e-0.054x)y=100/(1+1.130e-0.077x)y=100/(1+0.988e-0.063x)y=100/(1+0.901e-0.071x)y=100/(1+1.463e-0.079x)y=100/(1+0.455e-0.042x)y=100/(1+1.134e-0.075x)y=100/(1+1.216e-0.080x)y=100/(1+1.067e-0.076x)y=100/(1+0.920e-0.047x)y=100/(1+0.805e-0.038x)y=100/(1+2.197e-0.113x)y=100/(1+1.225e-0.043x)y=100/(1+1.621e-0.057x)0.775 0.913 0.892 0.868 0.842 0.915 0.861 0.885 0.810 0.817 0.817 0.810 0.880 0.888 0.854 0.771 0.920 0.856 0.933 0.807 0.767 0.876 0.806 0.928 0.895 0.915 0.863 0.845 0.903 0.847 0.948 0.813 0.821 0.833 0.934 0.869 0.933 0.828 0.914 0.882 0.931 0.841 0.823 0.954 0.804-12.343-15.418-19.970-16.697-16.526-17.784-15.219-15.095-13.409-10.925-16.074-13.479-18.296-17.144-16.422-9.983-15.770-13.046-15.718-17.597-16.132-15.118-13.758-21.003-18.934-17.913-17.720-18.004-16.319-16.043-17.479-8.550-14.681-15.610-12.665-18.426-10.719-15.202-15.054-14.041-19.707-21.453-19.424-28.235-29.153 0.163 0.312 0.567 0.425 0.395 0.458 0.332 0.312 0.202 0.142 0.371 0.220 0.485 0.436 0.396 0.280 0.376 0.200 0.427 0.454 0.400 0.327 0.261 0.625 0.510 0.466 0.455 0.498 0.373 0.360 0.435 0.056 0.297 0.349 0.150 0.497 0.200 0.313 0.290 0.240 0.543 0.772 0.644 0.944 1.000 0.184 0.333 0.554 0.395 0.387 0.448 0.324 0.318 0.236 0.074 0.365 0.239 0.473 0.417 0.382 0.057 0.350 0.218 0.347 0.439 0.368 0.319 0.253 0.604 0.504 0.454 0.445 0.459 0.377 0.364 0.433 0.000 0.298 0.343 0.200 0.479 0.105 0.323 0.316 0.266 0.542 0.626 0.528 0.946 1.000 0.056 0.189 0.688 0.383 0.344 0.630 0.195 0.172 0.060 0.037 0.262 0.063 0.712 0.710 0.568 0.008 0.249 0.078 0.221 0.619 0.581 0.190 0.000 0.834 0.610 0.633 0.563 0.577 0.562 0.264 0.486 0.010 0.172 0.211 0.064 0.663 0.173 0.578 0.172 0.031 0.668 0.784 0.776 0.921 1.000 0.047 0.149 0.675 0.308 0.451 0.701 0.167 0.049 0.009 0.066 0.226 0.089 0.411 0.313 0.176 0.037 0.191 0.077 0.223 0.256 0.305 0.168 0.129 0.646 0.573 0.594 0.256 0.416 0.264 0.219 0.326 0.000 0.245 0.119 0.071 0.645 0.047 0.388 0.162 0.344 0.644 0.704 0.707 0.607 1.000 0.129 0.175 0.654 0.514 0.409 0.361 0.363 0.139 0.055 0.025 0.519 0.095 0.454 0.369 0.328 0.016 0.329 0.065 0.232 0.404 0.312 0.158 0.076 0.592 0.423 0.264 0.423 0.647 0.304 0.301 0.507 0.000 0.304 0.561 0.075 0.475 0.672 0.092 0.133 0.083 0.631 0.751 0.603 0.617 0.947 0.171 0.551 0.791 0.659 0.639 0.805 0.562 0.530 0.319 0.096 0.610 0.346 0.702 0.667 0.649 0.000 0.601 0.284 0.588 0.675 0.626 0.563 0.348 0.871 0.796 0.754 0.705 0.722 0.646 0.643 0.705 0.037 0.493 0.563 0.209 0.718 0.145 0.554 0.559 0.442 0.762 0.856 0.817 0.981 0.968 0.125 0.285 0.655 0.448 0.438 0.567 0.324 0.253 0.147 0.073 0.392 0.175 0.539 0.485 0.416 0.067 0.349 0.154 0.340 0.474 0.432 0.287 0.178 0.695 0.569 0.527 0.475 0.553 0.421 0.359 0.482 0.017 0.301 0.358 0.128 0.580 0.224 0.375 0.272 0.234 0.632 0.749 0.679 0.836 0.986 72 62 24 47 48 32 59 64 70 73 52 68 36 41 51 74 57 69 58 44 49 61 67 17 33 37 45 35 50 55 43 75 60 56 71 31 66 54 63 65 27 13 19 51编号Code Logistic回归方程Logistic regression equation拟合度R2半致死温度LT50/℃隶属函数值Subordinate function value RECLT50PODProSSMDA平均隶属度Average value of membership function排序Order
表2 (续) Table 2 (Continued)

G46 G47 G48 G49 G50 G51 G52 G53 G54 G55 G56 G57 G58 G59 G60 G61 G62 G63 G64 G65 G66 G67 G68 G69 G70 G71 G72 G73 G74 G75 y=100/(1+1.219e-0.049x)y=100/(1+1.189e-0.066x)y=100/(1+0.909e-0.039x)y=100/(1+1.012e-0.045x)y=100/(1+1.312e-0.079x)y=100/(1+0.960e-0.051x)y=100/(1+0.769e-0.047x)y=100/(1+1.359e-0.059x)y=100/(1+0.678e-0.037x)y=100/(1+1.309e-0.062x)y=100/(1+0.991e-0.046x)y=100/(1+0.738e-0.036x)y=100/(1+0.920e-0.043x)y=100/(1+1.270e-0.070x)y=100/(1+1.247e-0.054x)y=100/(1+1.282e-0.063x)y=100/(1+1.229e-0.061x)y=100/(1+1.114e-0.051x)y=100/(1+1.129e-0.059x)y=100/(1+0.988e-0.040x)y=100/(1+0.921e-0.036x)y=100/(1+1.243e-0.058x)y=100/(1+0.942e-0.049x)y=100/(1+1.088e-0.057x)y=100/(1+1.027e-0.041x)y=100/(1+1.439e-0.066x)y=100/(1+0.811e-0.051x)y=100/(1+1.316e-0.074x)y=100/(1+1.196e-0.046x)y=100/(1+1.055e-0.060x)0.933 0.794 0.810 0.939 0.764 0.889 0.947 0.850 0.866 0.982 0.964 0.956 0.895 0.880 0.972 0.915 0.770 0.923 0.985 0.890 0.847 0.916 0.896 0.921 0.788 0.948 0.918 0.780 0.826 0.826-24.819-18.096-23.610-22.739-16.675-18.704-16.301-23.066-18.228-21.043-21.488-20.792-21.339-18.268-22.923-20.258-20.154-21.851-19.136-24.937-25.372-21.580-19.071-19.127-24.881-21.737-15.935-17.712-25.887-17.577 0.773 0.497 0.534 0.669 0.439 0.508 0.394 0.741 0.486 0.619 0.612 0.573 0.603 0.469 0.702 0.599 0.610 0.648 0.515 0.730 0.810 0.646 0.521 0.522 0.761 0.649 0.377 0.489 0.793 0.467 0.790 0.463 0.731 0.689 0.394 0.493 0.376 0.705 0.470 0.606 0.628 0.594 0.621 0.472 0.698 0.568 0.563 0.646 0.514 0.795 0.824 0.632 0.511 0.513 0.792 0.640 0.358 0.445 0.842 0.432 0.682 0.604 0.872 0.746 0.803 0.559 0.727 0.784 0.554 0.794 0.707 0.757 0.750 0.742 0.812 0.761 0.794 0.693 0.789 0.798 0.729 0.767 0.604 0.697 0.779 0.620 0.694 0.617 0.840 0.689 0.838 0.434 0.854 0.737 0.040 0.613 0.261 0.816 0.585 0.663 0.478 0.663 0.671 0.904 0.903 0.663 0.610 0.428 0.609 0.714 0.934 0.589 0.615 0.562 0.913 0.412 0.236 0.307 0.948 0.328 0.917 0.847 0.901 0.858 0.342 0.053 0.457 0.852 0.968 0.709 0.776 0.589 0.741 0.976 0.846 0.677 0.661 0.828 0.411 0.946 1.000 0.351 0.397 0.462 0.899 0.794 0.020 0.393 0.770 0.386 0.943 0.786 0.887 0.890 0.685 0.739 0.679 0.903 0.717 0.835 0.858 0.869 0.841 0.823 0.896 0.823 0.816 1.000 0.797 0.945 0.975 0.894 0.744 0.750 0.939 0.887 0.626 0.719 0.962 0.719 0.824 0.605 0.796 0.765 0.451 0.494 0.482 0.800 0.630 0.704 0.676 0.674 0.704 0.731 0.809 0.682 0.676 0.707 0.606 0.821 0.879 0.647 0.565 0.584 0.847 0.667 0.385 0.495 0.859 0.503 6 28 9 11 46 40 42 10 26 16 20 21 15 12 8 18 22 14 29 72 25 34 30 4 23 53 39 3 38编号Code Logistic回归方程Logistic regression equation拟合度R2半致死温度LT50/℃隶属函数值Subordinate function value RECLT50PODProSSMDA平均隶属度Average value of membership function排序Order
2.2 不同葡萄品种抗寒性隶属函数评价及抗寒指标筛选
选用6 个生理指标作为枝条抗寒性评价指标,通过隶属函数法进行综合评价,结果(表2)表明,75份酿酒葡萄种质的隶属函数值在0.061~0.986之间,其中北玫、北红、北冰红、左优红、11-5-36、11-14-45、12-3-23、12-5-6、12-10-60 和12-16-95 的综合评价值在0.8~1.0 之间,抗寒性较强;马瑟兰、赤霞珠和12-16-96 综合评价值分别为0.539、0.527 和0.503,抗寒性中等;佳丽酿、品丽珠、白艮地、长相思、捏布盖、酒白和宝石解百纳的综合评价值介于0.0~0.2,抗寒性较差。
根据75 份种质的抗寒性评价指标进行聚类分析(图1),75 份种质可以分为4 个等级,其中Ⅰ级包括11份种质,均为山欧杂种,为高度抗寒性种质;Ⅱ级包括27份种质,其中山欧杂种占66.667%,为抗寒性种质;Ⅲ级包括27 份种质,其中欧亚种居多(21份),山欧杂种次之(5份),为中度抗寒性种质;Ⅳ级包括10 份种质,均为欧亚种,为低温敏感性种质。根据隶属函数法和聚类分析可以得出,欧亚种中法国蓝、小芒森、二号白香、爱格丽、马瑟兰、赤霞珠169、赤霞珠和晚红蜜抗寒性较好,山欧杂种相较于欧亚种抗寒性更佳。

图1 75 份酿酒葡萄种质聚类分析
Fig.1 Cluster analyses of 75 wine grape germplasms
为进一步研究不同葡萄品种枝条对不同低温胁迫生理响应的差异,根据75份酿酒葡萄种质抗寒性分类结果,从中筛选出12个葡萄品种进行抗寒生理生化指标差异分析。其中包括:北红、12-5-6、12-16-95、12-10-60、北红和北冰红6 个高度抗寒种质和品丽珠、白艮地、长相思、捏布盖、酒白和宝石解百纳6个低温敏感种质,用于各抗寒生理指标比较分析。
2.3 低温处理对不同葡萄枝条相对电导率的影响
随着低温处理时间的延长,葡萄枝条细胞的膜透性增大,电解质渗透随之增加,REC 呈不同程度的“S”形上升趋势(图2)。在4~-35 ℃的各低温梯度中,高度抗寒性和低温敏感性的种质REC增幅明显不同,长相思和品丽珠的REC 增幅较大,分别为75.097%和65.653%;12-10-60和12-5-6的增幅较小,分别为24.994%和36.020%。

图2 低温处理对不同酿酒葡萄枝条相对电导率的影响
Fig.2 Effect of low-temperature treatments on the relative conductivity of branches of different wine grapes
高度抗寒种质的REC 呈现持续上升趋势。在4~-20 ℃枝条受寒害程度较小,REC 呈缓慢增长趋势,整体增长幅度在0.368%~8.648%之间;在-25~-35 ℃时增长幅度较大,在0.177%~26.270%之间,其中在-25 ℃时,北冰红REC大于50%,此时为该品种抗寒能力敏感期。
低温敏感种质的REC 呈现慢-快-慢的增长趋势。在4~-15 ℃处理时,增幅在1.460%~12.486%之间,其中白艮地REC 增长幅度最大。在-15~-25 ℃处理时,REC 呈快速增长趋势,其中在-25 ℃处理时,品丽珠、白艮地、酒白的REC 大于70%,细胞膜系统功能受损严重,导致电解质大量外渗;而长相思在此温度下REC为90.013%,细胞膜已完全破裂,失去渗透调节功能。在-25~-35 ℃处理时,除捏布盖外,其他品种REC 均在70%以上,各品种枝条REC的增高趋于平缓。
2.4 低温处理对不同葡萄枝条生理生化指标的影响
2.4.1 过氧化物酶活性 由图3 可知,随着低温胁迫的加剧,高度抗寒种质枝条POD 活性呈先升后降的趋势,在4~-15 ℃处理时,呈现缓慢升高趋势;在-15~-20 ℃处理时,12-5-6、12-16-95、12-10-60和北冰红枝条POD活性快速升高,在-20 ℃时达到最大值,分别为0.684、0.624、0.587和0.636 ng·g-1,较对照升高24.720%、24.347%、24.897%和16.963%;其后随着低温胁迫加剧,POD 活性呈现下降趋势,而北红和北玫POD活性在-25 ℃达到高峰,分别为0.789和0.649 ng·g-1,较对照升高了36.620%和28.827%。
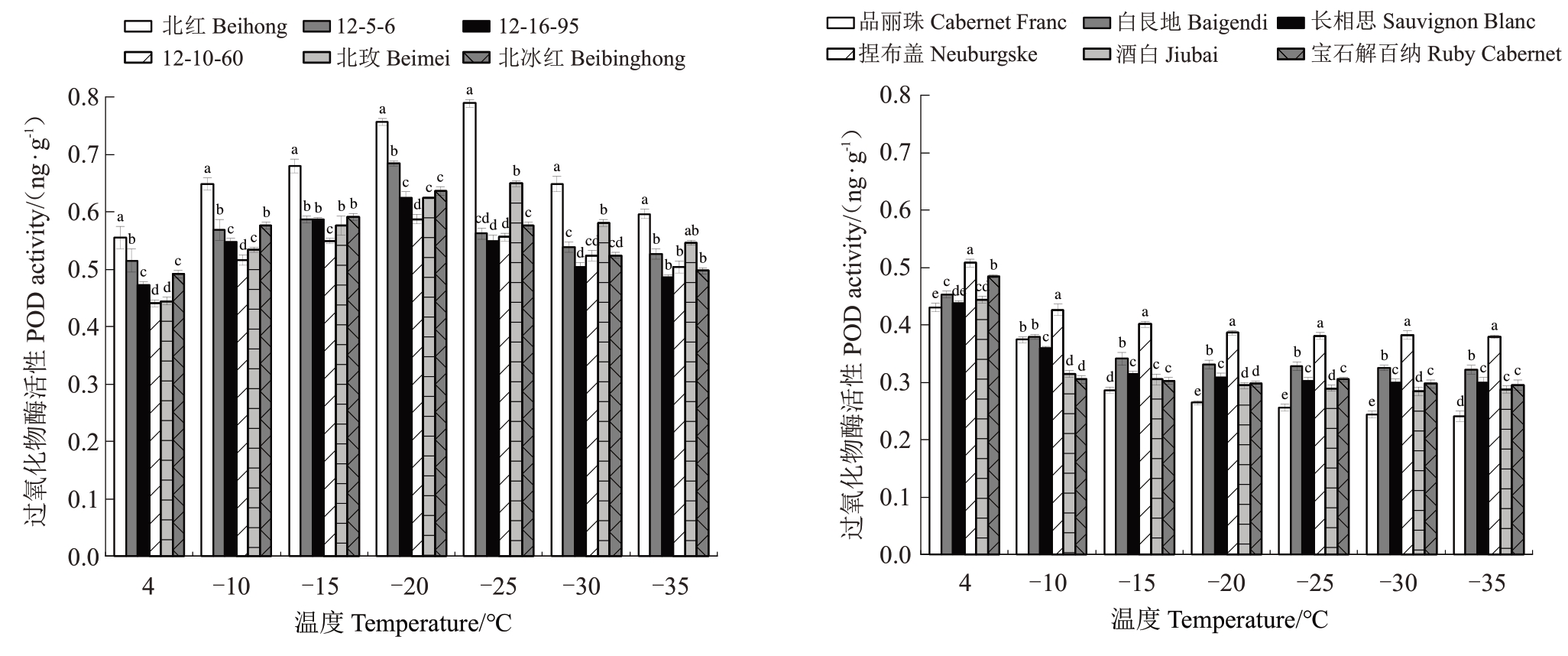
图3 低温处理对不同酿酒葡萄枝条过氧化物酶活性的影响
Fig.3 Effect of low temperature treatments on peroxidase activity in different wine grape shoots
低温敏感种质枝条POD活性呈下降趋势,品丽珠、白艮地、长相思和捏布盖枝条POD 活性在4~-15 ℃下降较快,其后趋于平缓;而宝石解百纳和酒白枝条POD活性在4~-10 ℃处理下迅速下降,降幅最大,分别达到58.718%和40.784%。
2.4.2 脯氨酸含量 由图4 可知,随着处理温度的降低,12 个葡萄品种枝条的Pro 含量(w,后同)呈现先升后降的趋势,但峰值存在差异。高度抗寒种质北红在-20~-25 ℃和-25~-30 ℃增幅最大,分别达到43.164%和43.661%,在-30 ℃达到最大值,为64.895 ng·g-1,表明该温度对北红枝条的胁迫程度较大,枝条为维持细胞渗透平衡,从而加快了Pro的积累;其他品种均在-15~-25 ℃增幅较大,在-25 ℃达到高峰,其后Pro 含量下降并趋于平缓。低温敏感种质枝条Pro 含量在4~-10 ℃增幅最大,其范围在28.551~74.057 ng·g-1之间。品丽珠、白艮地和长相思枝条Pro含量在-15 ℃达到最大值后开始降低,而捏布盖、酒白和宝石解百纳枝条Pro含量在-10 ℃达到最高,抗寒能力相对较低。

图4 低温处理对不同酿酒葡萄枝条脯氨酸含量的影响
Fig.4 Effect of low-temperature treatments on proline content in branches of different wine grapes
2.4.3 可溶性糖含量 SS作为渗透调节物质,可增加细胞液浓度,提高渗透压,从而使组织细胞免受冰冻伤害。随着低温胁迫的加剧,12份葡萄种质枝条SS 含量呈增加趋势(图5)。高度抗寒种质枝条SS含量在-20~-30 ℃快速增加,较对照增加65.172%~110.122%,在-30~-35 ℃时其含量仍处于上升趋势,说明细胞仍在合成糖类物质,增加胞液浓度。低温敏感种质枝条SS含量在4~-15 ℃增加幅度较大,说明其对低温更为敏感,通过提高渗透压以抵抗低温。其中品丽珠枝条SS含量在-10~-15 ℃时达到最高,较对照增加89.302%;白艮地和长相思枝条SS 含量在4~-10 ℃增幅最高,分别较对照增加了96.380%和98.738%,宝石解百纳枝条SS 含量增幅较小,较对照增加了65.755%。此结果与LT50结果一致。

图5 低温处理对不同酿酒葡萄可溶性糖含量的影响
Fig.5 Effect of low temperature treatment on soluble sugar content of different wine grapes
2.4.4 丙二醛含量 低温处理对不同葡萄枝条MDA 含量的影响见图6。在不同低温胁迫条件下,12个葡萄品种枝条的MDA含量均高于对照。高度抗寒种质呈现上升趋势,在不同低温处理下增长幅度相近,在4~-15 ℃处理时枝条MDA含量均较低且稳定,变化量最小,说明其细胞内抗氧化酶活性较高,可抑制自由基对膜脂的伤害,细胞膜受伤害最小,抗寒性强。在-15~-35 ℃处理时,枝条MDA 含量随温度的降低,增长幅度较大。低温敏感种质枝条MDA含量呈现先升后降的趋势,品丽珠、白艮地和长相思枝条MDA 含量(b)在-20 ℃时达到最高,分别为8.952、8.872 和8.451 μmol·g-1,表明达到此温度时,枝条细胞膜脂过氧化程度高,受冻害严重;捏布盖、酒白和宝石解百纳枝条MDA 含量在-15 ℃时达到最高,在-10 ℃时较对照增幅最大,分别为58.739%、64.850%和75.185%。
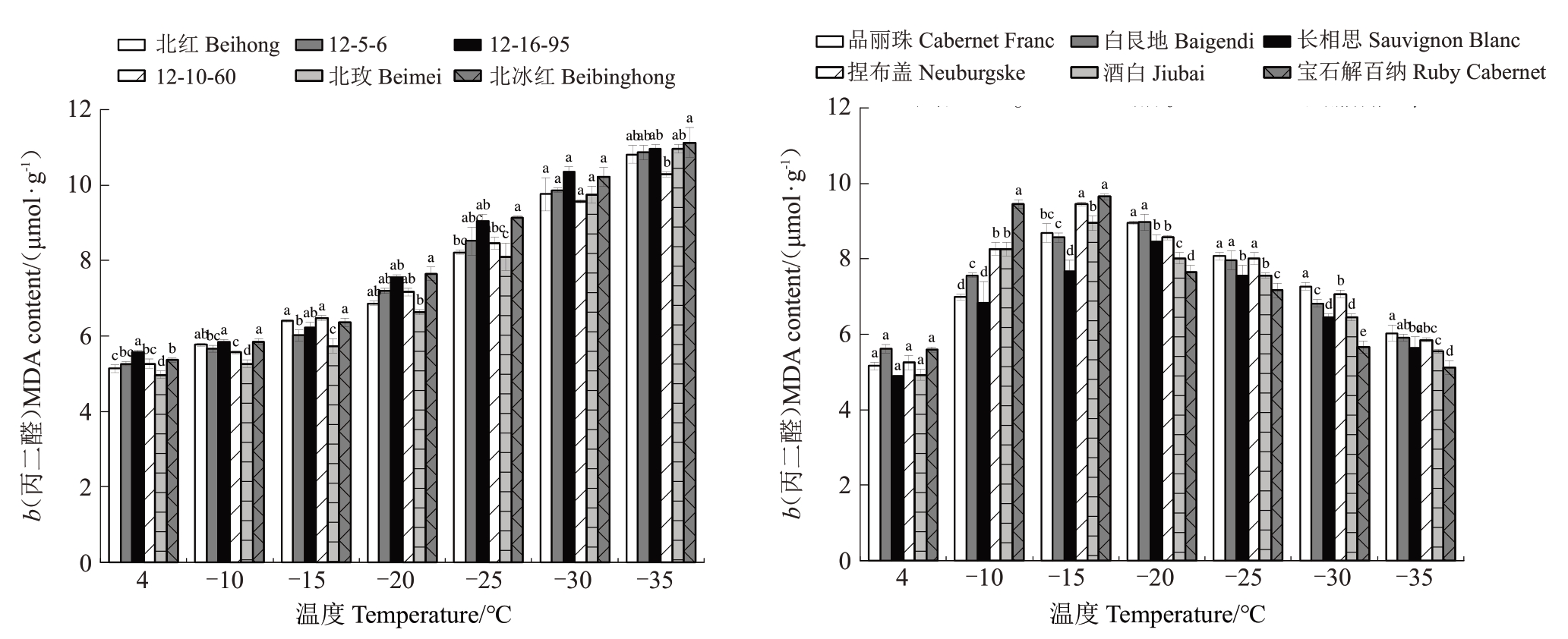
图6 低温处理对不同酿酒葡萄丙二醛含量的影响
Fig.6 Effect of low temperature treatment on malondialdehyde content in different wine grapes
3 讨 论
3.1 酿酒葡萄种质抗寒性综合评价
REC是衡量细胞内不溶性物质是否向外扩散,也是衡量细胞质膜是否受损的一种生理症状[22]。本研究结果表明,酿酒葡萄枝条REC曲线随温度下降呈“S”形上升趋势;基于REC建立Logistic曲线回归方程,可准确计算出LT50。相关研究表明,LT50是反映植物抗寒性的重要指标之一,已被广泛应用于抗寒性评价及相关研究[23]。张倩等[24]对5 个葡萄种群的半致死温度与抗寒性的研究表明,不同葡萄种群抗寒性差异很大,其抗寒性强弱排序依次为:美洲种>山欧杂种>法美杂种>欧美杂种>欧亚种。逯恺凡等[25]在北京地区通过调查136份葡萄种质的自然越冬情况,发现山葡萄及杂种的自然越冬能力最强,欧美杂种次之,欧亚种最差。本研究中山欧杂种葡萄品种的LT50为-15.054~-29.153 ℃,欧亚种葡萄品种的LT50为-8.550~-21.003 ℃,表明山欧杂种>欧亚种。
植物的生理过程受多种因素影响,采用隶属函数法对多个指标进行综合评价,可以克服只利用少数指标进行评价的局限性,以揭示酿酒葡萄种质间对低温响应的实质,从而提高抗寒性鉴定的准确性[26-27]。在本研究中,测定不同低温梯度酿酒葡萄种质的REC、LT50、POD 活性,以及Pro、SS 和MDA 含量,利用隶属函数法综合评价抗寒性,得到了抗寒性排序;同时利用聚类分析将75份酿酒葡萄种质划分为高度抗寒性(Ⅰ)、抗寒性(Ⅱ)、中度抗寒性(Ⅲ)和低温敏感性(Ⅳ)4 个等级,并且得出抗寒性较好的欧亚种,与沈甜等[28]和陈勇等[29]报道的欧亚种抗寒性结果基本一致。
3.2 高度抗寒种质和低温敏感种质抗寒生理指标分析
根据隶属函数法和聚类分析法筛选出6个高度抗寒种质和6 个低温敏感性种质进行REC、POD 活性,以及Pro、SS和MDA含量的进一步分析,以此揭示葡萄枝条对低温胁迫做出的响应。在低温胁迫下,植株细胞膜透性增加,从而引起了大量的电解质渗透,抗寒性强的植株,其膜透性的改变相对较小[30]。本研究中,高度抗寒性种质和低温敏感性种质枝条REC随温度的降低而呈现上升趋势,其变化幅度有所差异;高度抗寒性种质总体增幅相较于低温敏感性种质较缓,在-20~-35 ℃增幅较大达到最大值,表明在该温度期间枝条受伤害程度最大;低温敏感性种质随着温度降低增幅较大,受伤害程度大,抗寒性较差。
POD是植物抗氧化酶系统的关键酶类,能高效地分解细胞中过剩的自由基,POD 活性越高,抵御逆境的能力越强[31]。本研究中高度抗寒性种质POD活性呈现先升后降的趋势,这是由于枝条在低温初始阶段,枝条会启动自我保护反应,以此减缓受损程度和速率,使POD活性增强;然而,随着低温胁迫的加剧,植物体内大量自由基积累,超过了其自身防御体系统的清除能力范围,导致保护性酶系统遭到破坏,最终使POD活性急剧下降。低温敏感性种质由于抵御低温的能力较弱,呈现出持续下降趋势,这一研究结果与施明等[32]、杨豫等[14]的结果一致。
SS和Pro对调节植物细胞中渗透压具有重要影响,低温胁迫下可以通过提高SS 含量来提高渗透势,从而避免细胞的过度脱水,降低原生质体的冻结温度[33]。已有研究表明,Pro含量越高,抗寒性越强,但当超过植物自身渗透调节能力极限时,植物的渗透调节就会失效[34]。植物中SS 含量较高的品种通常表现出更强的抗寒性,并且其峰值出现也较晚[35]。本研究表明,随着低温胁迫加剧,高度抗寒性种质SS含量呈先慢后快的上升趋势,在-20~-30 ℃增幅最大,而低温敏感性种质呈先快后慢的上升趋势,在4~-10 ℃增幅最大。这一结果表明,低温处理下,SS一方面对酿酒葡萄种质产生了明显的渗透调控效应,另一方面通过为还原糖的氧化分解提供能量,进而促进了其细胞内含量的增加。高度抗寒性种质和低温敏感性种质枝条Pro含量随温度的降低而呈现先上升后下降趋势,表明在低温胁迫条件下,Pro参与提高细胞液的浓度,同时降低细胞冰点,从而增强抗寒性。-25 ℃处理下,高度抗寒性种质Pro含量较高,降幅小,表现出较强抗寒性;而低温敏感性种质Pro 含量均下降,表明超过自身渗透调节极限。
MDA 是逆境胁迫下细胞膜中多不饱和脂肪酸分解的产物,其含量越高,植物受到伤害的程度越严重[36]。在本研究中,随着胁迫温度降低,酿酒葡萄种质枝条膜脂过氧化作用加剧,细胞内MDA 含量逐渐上升,表明低温胁迫使得高度抗寒性种质和低温敏感性种质的细胞膜都受到了不同程度的氧化损伤;其中高度抗寒性种质在4~-20 ℃枝条MDA含量变幅较小,受膜脂过氧化作用损伤较轻,而在-20~-30 ℃处理时变幅最大,细胞膜脂质过氧化程度的加剧。低温敏感性种质在-20 ℃时均呈下降趋势,由此推测-35 ℃低温未达到高度抗寒性种质抵御外界低温的最低限度,因此MDA 含量未出现下降趋势。本研究中通过测定不同低温处理下酿酒葡萄1 年生枝条的生理生化指标,以评价酿酒葡萄的抗寒性,鉴于植物的抗寒性受多种因素影响,下一步计划连续多年测定生理生化指标,并进行田间观测一致性验证,从而为酿酒葡萄抗寒性研究提供理论依据。
4 结 论
笔者测定75 份酿酒葡萄种质在不同低温胁迫下REC、POD活性,以及Pro、SS和MDA含量5个指标,结合Logistic方程计算出LT50。并利用隶属函数法与聚类分析法对75 份酿酒葡萄种质抗寒性进行综合评价,以此得出山欧杂种>欧亚种葡萄,并将75 份酿酒葡萄种质资源抗寒性分为4 个等级,即高度抗寒性、抗寒性、中度抗寒性和低温敏感性种质。同时筛选出高度抗寒性种质和低温敏感性种质,高度抗寒性种质抗寒能力强弱顺序依次为北红>12-5-6>12-16-95>12-10-60>北玫>北冰红,低温敏感性种质抗寒能力强弱顺序依次为品丽珠>白艮地>长相思>捏布盖>酒白>宝石解百纳。
[1] 左倩倩,郑婷,纪薇,房经贵.中国地方葡萄品种分布及收集利用现状[J].中外葡萄与葡萄酒,2019(5):76-80.ZUO Qianqian,ZHENG Ting,JI Wei,FANG Jinggui.The present situation of distribution and collection and utilization of grape varieties in China[J]. Sino-Overseas Grapevine  Wine,2019(5):76-80.
Wine,2019(5):76-80.
[2] 赵晓丽,叶伟,张晶晶,李岩.基于SWOT 分析的新疆葡萄酒文化旅游发展研究[J].农村经济与科技,2024,35(1):109-111.ZHAO Xiaoli,YE Wei,ZHANG Jingjing,LI Yan. Based on SWOT analysis research on the development of wine culture tourism in Xinjiang[J]. Rural Economy and Science-Technology,2024,35(1):109-111.
[3] 吴铎思,王薇,杜林峰. 小葡萄酿出大产业[N]. 工人日报,2023-05-23(7).WU Duosi,WANG Wei,DU Linfeng.Small grapes make big industries[N].Workers'Daily,2023-05-23(7).
[4] 谢发兵.玛纳斯县葡萄酒产业发展的思考[J].新疆林业,2023(5):32-33.XIE Fabing. Reflections on the development of the wine industry in Manas County[J].Forestry of Xinjiang,2023(5):32-33.
[5] 师琼.新疆酿酒葡萄基地建设现状与发展建议[J].新疆林业,2019(5):23-26.SHI Qiong. The current situation and development suggestions of the construction of wine grape base in Xinjiang[J]. Forestry of Xinjiang,2019(5):23-26.
[6] GU B,ZHANG B,DING L,LI P Y,SHEN L,ZHANG J X.Physiological change and transcriptome analysis of Chinese wild Vitis amurensis and Vitis vinifera in response to cold stress[J]. Plant Molecular Biology Reporter,2020,38(3):478-490.
[7] WANG Z L,WANG Y,WU D,HUI M,HAN X,XUE T T,YAO F,GAO F F,CAO X,LI H,WANG H.Identification and regionalization of cold resistance of wine grape germplasms(V.vinifera)[J].Agriculture,2021,11(11):1117.
[8] 宋润刚.酿酒葡萄新品种‘北冰红’[J].北方果树,2008(5):68.SONG Rungang.A new ice-red brewing grape cultivar‘Beibinghong’[J].Northern Fruits,2008(5):68.
[9] 范培格,李绍华. 酿酒葡萄新品种北馨[J]. 中国果业信息,2015,32(3):65.FAN Peige,LI Shaohua. A new ice-red brewing grape cultivar‘Beixin’[J].China Fruit News,2015,32(3):65.
[10] 林洪.优质抗寒葡萄新品种‘凌丰红’[J].北方果树,2022(1):41.LIN Hong. A new high-quality cold-resistant grape cultivar‘Lingfenghong’[J].Northern Fruits,2022(1):41.
[11] WANG Z L,WU D,HUI M,WANG Y,HAN X,YAO F,CAO X,LI Y H,LI H,WANG H. Screening of cold hardiness-related indexes and establishment of a comprehensive evaluation method for grapevines (V. vinifera)[J]. Frontiers in Plant Science,2022,13:1014330.
[12] 曹建东,陈佰鸿,王利军,毛娟,赵鑫.葡萄抗寒性生理指标筛选及其评价[J].西北植物学报,2010,30(11):2232-2239.CAO Jiandong,CHEN Baihong,WANG Lijun,MAO Juan,ZHAO Xin. Cold resistance indexes identification and comprehensive evaluation of grape varieties[J]. Acta Botanica Boreali-Occidentalia Sinica,2010,30(11):2232-2239.
[13] 郭艳兰,牟德生,赵连鑫,王鑫,马宗桓,张兆铭,张利年.六个葡萄砧木品种(系)的抗寒性评价[J].中外葡萄与葡萄酒,2022(3):38-43.GUO Yanlan,MU Desheng,ZHAO Lianxin,WANG Xin,MA Zonghuan,ZHANG Zhaoming,ZHANG Linian. Analysis of cold resistance of six wine grape rootstock varieties[J]. Sino-Overseas Grapevine Wine,2022(3):38-43.
Wine,2022(3):38-43.
[14] 杨豫,张晓煜,陈仁伟,丁琦,冯蕊,李芳红,范锦龙.贺兰山东麓4 个酿酒葡萄品种枝条抗寒性鉴定[J].干旱区资源与环境,2021,35(3):183-189.YANG Yu,ZHANG Xiaoyu,CHEN Renwei,DING Qi,FENG Rui,LI Fanghong,FAN Jinlong. Evaluation on cold resistance of four wine grape varieties at the eastern foothills of Helan Mountain[J].Journal of Arid Land Resources and Environment,2021,35(3):183-189.
[15] 贾金辉,徐凌,刘慧纯,蔡智军,田晓玲,张海涛.8 个酿酒葡萄品种的抗寒性比较[J].中国果树,2021(7):39-44.JIA Jinhui,XU Ling,LIU Huichun,CAI Zhijun,TIAN Xiaoling,ZHANG Haitao. Comparison of cold resistance of eight wine grape varieties[J].China Fruits,2021(7):39-44.
[16] 丁思悦,王雨婷,赵佳琪,王文,惠竹梅.葡萄种质抗寒性鉴定及综合评价[J].西北农林科技大学学报(自然科学版),2024,52(6):106-120.DING Siyue,WANG Yuting,ZHAO Jiaqi,WANG Wen,XI Zhumei. Identification and comprehensive evaluation of cold resistance among grape germplasm[J]. Journal of Northwest A  F University(Natural Science Edition),2024,52(6):106-120.
F University(Natural Science Edition),2024,52(6):106-120.
[17] 任静,郝燕,白耀栋,朱燕芳,张思成.河西走廊‘贵人香’7 个葡萄砧穗组合抗寒性的综合评价[J]. 甘肃农业大学学报,2019,54(4):60-68.REN Jing,HAO Yan,BAI Yaodong,ZHU Yanfang,ZHANG Sicheng. Comprehensive evaluation on cold resistance of seven grape rootstock-scion combinations of Italian Riesling in Hexi Corridor[J]. Journal of Gansu Agricultural University,2019,54(4):60-68.
[18] 罗尧幸,郭荣荣,李雪雪,刘榕晨,王跃进,纪薇.基于隶属函数法评价7 个鲜食葡萄品种的抗寒性[J]. 贵州农业科学,2018,46(6):38-44.LUO Yaoxing,GUO Rongrong,LI Xuexue,LIU Rongchen,WANG Yuejin,JI Wei.Cold resistance of seven table grape varieties evaluated by subordinate function method[J]. Guizhou Agricultural Sciences,2018,46(6):38-44.
[19] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.LI Hesheng. Principles and techniques of plant physiological biochemical experiment[M]. Beijing:Higher Education Press,2000.
[20] 邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000.ZOU Qi. Plant physiology lab instruction[M]. Beijing:China Agriculture Press,2000.
[21] LU S J,HE J Q,YI S H,YI L,LI C H.YANG S G,YIN J M.Establishment and application of a comprehensive assessment system for cold resistance in Denphal-group Dendrobium cultivars[J].European Journal of Horticultural Science,2021(3):86.
[22] CHEN L J,XIANG H Z,MIAO Y,ZHANG L,GUO Z F,ZHAO X H,LIN J W,LI T L.An overview of cold resistance in plants[J].Journal of Agronomy and Crop Science,2014,200(4):237-245.
[23] 刘兴禄,王红平,孙文泰,董铁,牛军强,马明.5 个砧木苹果枝条的抗寒性评价[J].果树学报,2021,38(8):1264-1274.LIU Xinglu,WANG Hongping,SUN Wentai,DONG Tie,NIU Junqiang,MA Ming. Cold resistance evaluation of the shoots of 5 apple rootstocks[J]. Journal of Fruit Science,2021,38(8):1264-1274.
[24] 张倩,刘崇怀,郭大龙,姜建福,樊秀彩,张颖.5 个葡萄种群的低温半致死温度与其抗寒适应性的关系[J].西北农林科技大学学报(自然科学版),2013,41(5):149-154.ZHANG Qian,LIU Chonghuai,GUO Dalong,JIANG Jianfu,FAN Xiucai,ZHANG Ying. Relationship between LT50 and cold adaptability of five grape varieties[J]. Journal of Northwest A F University(Natural Science Edition),2013,41(5):149-154.
F University(Natural Science Edition),2013,41(5):149-154.
[25] 逯恺凡,方梓庄,卢江,朱磊,张雅丽.136 份葡萄种质资源在北京地区自然越冬情况调查[J].中外葡萄与葡萄酒,2019(6):1-11.LU Kaifan,FANG Zizhuang,LU Jiang,ZHU Lei,ZHANG Yali.Investigation of 136 grape germplasms overwintering without burying in Beijing[J]. Sino-Overseas Grapevine  Wine,2019(6):1-11.
Wine,2019(6):1-11.
[26] 王涵雅,李欣,毛娟,马宗桓,陈佰鸿.15 种1 年生鲜食葡萄枝条的抗寒性评价[J].甘肃农业大学学报,2023,58(5):95-105.WANG Hanya,LI Xin,MAO Juan,MA Zonghuan,CHEN Baihong. Evaluation on cold resistance of annual branches of 15 table-grape varieties[J].Journal of Gansu Agricultural University,2023,58(5):95-105.
[27] 张晓婷,庄赟,董嘉辉,周碧燕.荔枝种质资源抗寒性综合评价[J].果树学报,2024,41(3):403-425.ZHANG Xiaoting,ZHUANG Yun,DONG Jiahui,ZHOU Biyan.Comprehensive evaluation of cold tolerance in Litchi germplasm resources[J]. Journal of Fruit Science,2024,41(3):403-425.
[28] 沈甜,牛锐敏,黄小晶,许泽华,陈卫平.酿酒葡萄抗寒性评价及分类[J].中外葡萄与葡萄酒,2021(1):1-7.SHEN Tian,NIU Ruimin,HUANG Xiaojing,XU Zehua,CHEN Weiping.Evaluation and classification of cold resistance of wine grapes[J].Sino-Overseas Grapevine Wine,2021(1):1-7.
Wine,2021(1):1-7.
[29] 陈勇,董新平,史应武. 新天资源圃葡萄叶片抗寒性调查[J].中外葡萄与葡萄酒,2004(4):29-30.CHEN Yong,DONG Xinping,SHI Yingwu. Investigation of cold resistance of grape leaves in Xintian Resource Garden[J].Sino-overseas Grapevine Wine,2004(4):29-30.
Wine,2004(4):29-30.
[30] QI W L,WANG F,MA L,QI Z,LIU S Q,CHEN C,WU J Y,WANG P,YANG C R,WU Y,SUN W C.Physiological and biochemical mechanisms and cytology of cold tolerance in Brassica napus[J].Frontiers in Plant Science,2020,11:1241.
[31] 刘瑞琳,苗阳,张云程,陈建华,董煜天,董胜君.引种野杏无性系及家系的抗寒性[J].经济林研究,2023,41(2):137-149.LIU Ruilin,MIAO Yang,ZHANG Yuncheng,CHEN Jianhua,DONG Yutian,DONG Shengjun. Cold resistance of introduced Prunus armeniaca var. ansu clones and families[J]. Non-Wood Forest Research,2023,41(2):137-149.
[32] 施明,谢军,徐美隆,王佳.贺兰山东麓8 个酿酒葡萄品种抗寒性比较[J].江苏农业科学,2017,45(5):137-140.SHI Ming,XIE Jun,XU Meilong,WANG Jia. Comparison of cold resistance of eight wine-making grape varieties at the eastern foot of Helan Mountain[J]. Jiangsu Agricultural Sciences,2017,45(5):137-140.
[33] KEUNEN E,PESHEV D,VANGRONSVELD J,VAN DEN ENDE W,CUYPERS A. Plant sugars are crucial players in the oxidative challenge during abiotic stress:extending the traditional concept[J]. Plant,Cell  Environment,2013,36(7):1242-1255.
Environment,2013,36(7):1242-1255.
[34] 陈卫东,张玉霞,夏全超,滕泽,孙昊,张庆昕,杜晓艳.冷冻胁迫下磷肥对紫花苜蓿根颈含水量及氨基酸代谢的影响[J].中国草地学报,2022,44(1):58-63.CHEN Weidong,ZHANG Yuxia,XIA Quanchao,TENG Ze,SUN Hao,ZHANG Qingxin,DU Xiaoyan. Effects of phosphate fertilizer on root crown water content and amino acid metabolism of alfalfa under freezing stress[J].Chinese Journal of Grassland,2022,44(1):58-63.
[35] 金龙飞,杨蒙迪,周丽霞,冯美利,曹红星.9 个油棕品种抗寒性的生理生化鉴定[J].江苏农业科学,2021,49(8):132-136.JIN Longfei,YANG Mengdi,ZHOU Lixia,FENG Meili,CAO Hongxing. Physiological and biochemical identification of cold resistance of 9 oil palm varieties[J].Jiangsu Agricultural Sciences,2021,49(8):132-136.
[36] 包俊宏,包敖民,杨荣,李今普,王宝侠,郑东生,何炎红.寒地苹果龙丰、岳艳及其两个杂交优系抗寒性综合评价[J].果树学报,2024,41(2):241-251.BAO Junhong,BAO Aomin,YANG Rong,LI Jinpu,WANG Baoxia,ZHENG Dongsheng,HE Yanhong.Comprehensive evaluation of cold resistance of apple Longfeng,Yueyan and their two hybrid strains in cold region[J]. Journal of Fruit Science,2024,41(2):241-251.