君迁子(Diospyros lotus L.)系柿科(Ebenaceae)柿属(Diospyros)高大落叶乔木,又名黑枣、软枣等[1],是柿属植物中经济价值较高的种类[2],因其实生发芽率和幼苗移栽成活率高、出苗健壮生长快,且具有较强的综合抗逆性(抗旱性、抗寒性、耐盐碱),常作为柿(D.kaki)优良抗性砧木在南北方地区广泛应用[3]。
与中国主要柿资源涩柿相比,甜柿成熟后无需任何人工处理即可脆食,经济价值更高,然而其主栽品种均源于日本。富有系甜柿品质好,但与中国常用的君迁子砧木嫁接亲和性较差,难以成活,严重制约了优良甜柿品种的推广和发展,因此筛选广亲和优良甜柿砧木迫在眉睫。国家柿种质资源圃的柿园中偶然发现一株以君迁子为砧木的富有成龄树,将该砧木命名为L938。经多年研究表明其与部分优良甜柿品种,如富有、太秋等,嫁接后亲和性表现良好,且耐寒性强,较适宜作为中国北方地区甜柿砧木进行推广应用[4]。但L938 为雄性植株,自身不能产生种子(采用实生繁殖其优良性状难以保留,且后代与甜柿嫁接后表现出较差的亲和性),使其规模化繁殖应用成为难题。因此,利用组培快繁技术建立君迁子优系L938再生体系,高效繁殖其无性系自根砧木,对柿专用砧木的品种形成及其规模化生产和应用具有重要意义。
与其他木本树种相比,柿属植物在组培过程中易出现外植体褐变、再生诱导率低[5]、生根诱导难等现象,污染、褐变和玻璃化是影响其离体快繁技术建立的三大因素,相较于污染和玻璃化,褐化现象更难控制[6]。虽然目前已有部分柿属植物再生体系的研究,但仍存在实验操作繁琐、培养周期过长、遗传稳定性差且再生效率低等问题[7]。
笔者在本研究中以柿砧木L938为试材,重点探讨了不同外植体材料、消毒时间、植物生长调节剂浓度配比组合对其再生过程的影响,旨在建立柿广亲和砧木L938离体快繁体系,为其规模化应用奠定基础。
1 材料和方法
1.1 材料
试验在河北农业大学进行,试材为研究基地定植的柿砧木优系L938君迁子(国家柿种质资源圃);外植体采自生长旺盛、无病虫害的L938的新梢和休眠芽;继代培养材料为株高1.5 cm左右的组培苗;生根材料为长势健壮的2~3 cm幼嫩组培苗。
1.2 方法
1.2.1 启动培养 (1)不同外植体对君迁子优系L938启动培养的影响。12月下旬剪取1年生枝条,放入冷库(0 ℃)储藏,翌年3月底将枝条剪成长15~20 cm、含3~4 个芽的茎段,将茎段插入含有细蛭石的育苗穴盘中,置于薄膜小拱棚保湿培养,不定期喷水,保持基质湿润,当新梢休眠芽萌动时,用手术刀剥除芽外侧2~3 个鳞片,切下休眠芽作为外植体使用。4 月中旬,当新梢长至1~2 cm 时切下新梢茎段作为外植体使用。5 月中旬剪取L938 新梢,作为外植体使用。
以上3 种外植体经洗衣粉漂洗后,置于自来水下冲洗30 min,在超净工作台中,用0.1%HgCl2消毒40 min,消毒期间数次摇晃使外植体与HgCl2溶液充分接触,之后用灭菌水将外植体冲洗4~5次,用滤纸将表面的水轻轻擦干,接种至1/2MS(1.0 mg·L-1 6-BA+0.1 mg·L-1 IAA+30 g·L-1蔗糖+7.5~8.0 g·L-1琼脂)培养基上进行培养。每瓶放置1个外植体材料,每个处理接种50瓶,3次重复,30 d后统计外植体的污染率、褐化率和成活率。
(2)不同消毒时间对君迁子优系L938新梢启动培养的影响。以生长期中的L938茎段为试材,剪取新梢的中上部,每节切成一个枝段,置于洗衣粉水(含量为5%)中浸泡5 min 后流水下冲洗30 min,用滤纸擦干表面水分后在超净工作台中用0.1 g·L-1 HgCl2 进行消毒,设5 个时间处理(10、20、30、40、50 min),处理期间数次摇晃,使试材与HgCl2溶液充分接触,之后用无菌水将表面残留的HgCl2冲洗干净,接种至1/2MS培养基上进行启动培养,每瓶放置1个外植体材料,每个处理接种20瓶,3次重复,30 d后统计外植体的污染率、褐化率、成活率。
1.2.2 继代培养 为探究不同基本培养基对君迁子优系L938 继代培养的影响,选取生长在1/2MS+1.0 mg·L-1 6-BA+0.1 mg·L-1 NAA 培养基中、株高1.5 cm 左右的君迁子组培苗,进行继代培养。在超净工作台中将君迁子组培苗腋芽切下接种到分别含有0.1 mg·L-1 IAA+2.0 mg·L-1 ZT的1/2MS、(1/2N)MS、1/4MS 基本培养基中。每个处理60 瓶,设3 次重复,30 d 后统计组培苗的新梢增殖系数和新梢分级。以下是增殖新梢高度分级标准:
一级新梢:新梢高度0~1.0 cm;
二级新梢:新梢高度>1.0~2.0 cm;
三级新梢:新梢高度>2.0 cm。
1.2.3 生根培养 为探究不同生长调节剂种类及质量浓度组合对君迁子优系L938 生根的影响,以1/2MS 为基本培养基,采用NAA(0.5、1.0 mg·L-1)和IBA(1.0、2.0、4.0 mg·L-1)不同组合,共6种培养基处理(表1)。
表1 生根培养生长调节剂质量浓度组合配比
Table 1 Combination ratio of growth regulators for rooting culture
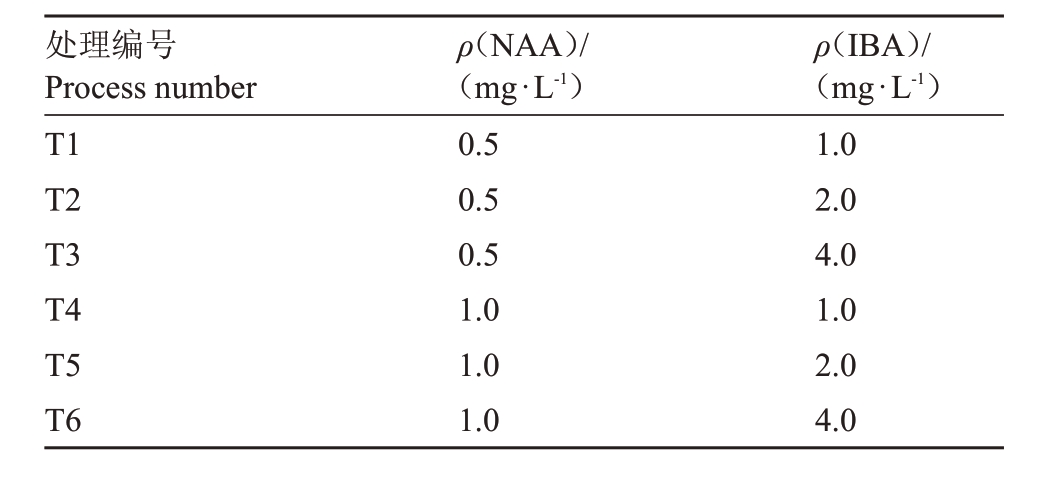
处理编号Process number ρ(NAA)/(mg·L-1)ρ(IBA)/(mg·L-1)Contamination rate 褐化率新梢(4月份 18.6710.00 T1 T2 T3 T4 T5 T6 0.5 0.5 0.5 1.0 1.0 1.0 1.0 2.0 4.0 1.0 2.0 4.0
选取株高为2.0~3.0 cm、长势健壮的君迁子优系L938组培苗单芽,分别接种到6种不同培养基中进行生根诱导培养,每个组培瓶中放置4株外植体,每个处理接种5瓶,设3次重复,暗培养7 d后置于正常光照下培养。接种45 d后开始每隔5 d统计一次生根率并观察记录其生根状态,直至90 d后测定其生根根系的长度、表面积和体积(采用Epson Scan根系扫描仪)。
1.2.4 培养条件 研究中所使用的培养基中均含有30 g·L-1蔗糖和7.5~8.0 g·L-1琼脂,pH 为5.8~6.0;植物培养室温度26 ℃,光照度2000~3000 lx,相对湿度70%,每天光照培养时间为16 h,黑暗培养时间为8 h。
1.2.5 数据处理 试验中的数据汇总及其整理使用Microsoft Excel 2010软件,方差分析使用SPSS 26.0统计分析软件,多重比较(显著水平为0.05)使用邓肯复极差法。采用隶属函数法对不同处理中的各项生根评判指标进行综合评价,加和计算不同处理的各项指标的隶属函数值,从而得出排名。隶属函数值的计算公式为R(Xi)=(Xi-Xmin)/(Xmax-Xmin),i=1,2,3,…,n(Xi为同一指标在不同处理中的测定值,Xmax和Xmin为该指标在不同处理中的最大值和最小值)[8]。
增殖系数=分化的新梢数/接种数;
污染率/%=污染的外植体数/接种的总外植体数×100;
褐化率/%=褐化的外植体数/接种的总外植体数×100;
成活率/%=成活的外植体数/接种的总外植体数×100;
生根率/%=生根的外植体数/接种的总外植体数×100。
2 结果与分析
2.1 不同外植体对君迁子优系L938启动培养的影响
在君迁子L938启动培养中,选取外植体既是首要环节也是进行育苗的核心步骤。由图1的试验结果可知,取材时期的不同,致使外植体的污染率、褐化率、成活率存在显著差异,其中休眠芽的污染率和褐化率最高,均显著高于新梢(5 月份)、新梢(4 月份),分别为32.67%、41.33%,成活率最低,仅为22%。新梢(4 月份)的污染率(18.67%)和褐化率(10.00%)均最低,且成活率显著高于新梢(5 月份)和休眠芽,可达71.33%。综合污染率、褐化率、成活率3 项指标分析,新梢(4 月份)是最适宜君迁子L938启动培养的外植体材料。
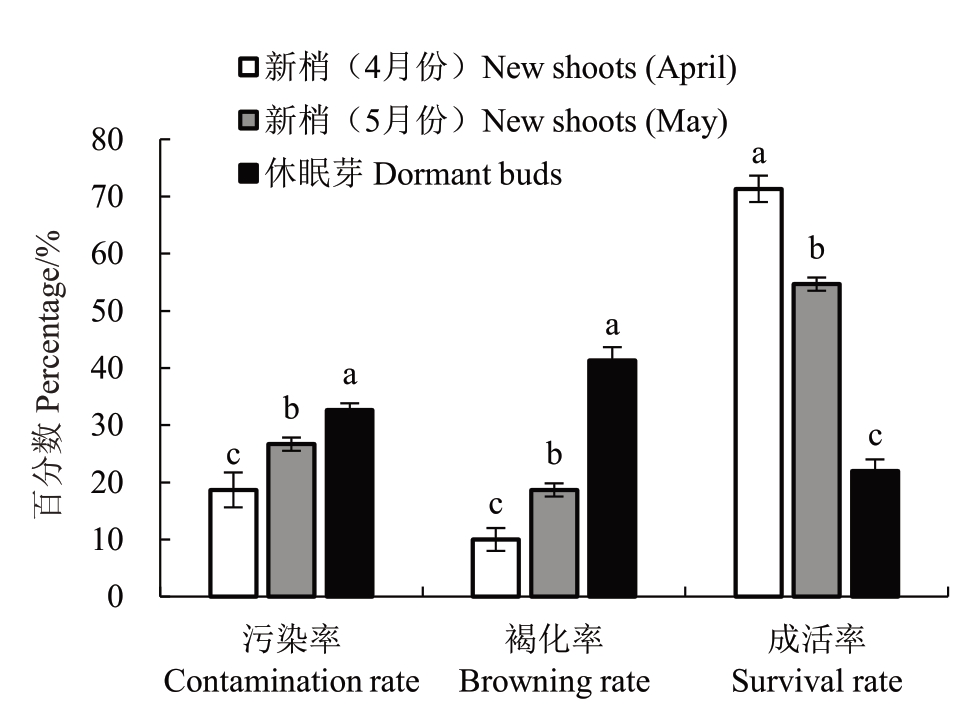
图1 不同外植体对君迁子优系L938 启动培养的影响
Fig.1 Effect of different explants on the initiation culture of L938 date plum
不同小写字母表示差异显著(p<0.05)。下同。
Different small letters indicate significant differences among treatments(p<0.05).The same below.
2.2 不同消毒时间对君迁子优系L938启动培养的影响
外植体消毒效果对后续无菌苗的获得起决定性作用,因此,适宜的消毒时间对君迁子优系L938 启动培养至关重要。由表2可知,随着HgCl2灭菌时间的延长,新梢外植体的污染率整体呈下降趋势,采用0.1 g·L-1 HgCl2灭菌10 min,污染率高达50.0%,将消毒时间延长到50 min时,污染率降至16.7%,但随着HgCl2消毒时间的延长,外植体褐化率整体呈上升趋势,植物组织损伤情况逐渐严重,说明延长HgCl2灭菌时间在降低污染率的同时,对外植体也产生了不可逆伤害。就成活率而言,各处理间呈现先上升后下降的趋势,HgCl2灭菌10 min时成活率最低,仅为11.7%,显著低于其他处理。随着灭菌时间的延长,成活率开始逐渐上升,当HgCl2处理为40 min时,外植体成活率达到最高(35.3%),显著高于其他处理组,而当将灭菌时间进一步延长至50 min时,成活率下降至20.0%。因此,综合污染率、褐化率、成活率3项指标,最适宜君迁子优系L938 新梢(4 月份)的灭菌时间为0.1 g·L-1 HgCl2灭菌40 min。
表2 不同HgCl2消毒时间对君迁子优系L938 新梢启动培养的影响
Table 2 Effects of different HgCl2 disinfection times on the initiation culture of L938 date plum
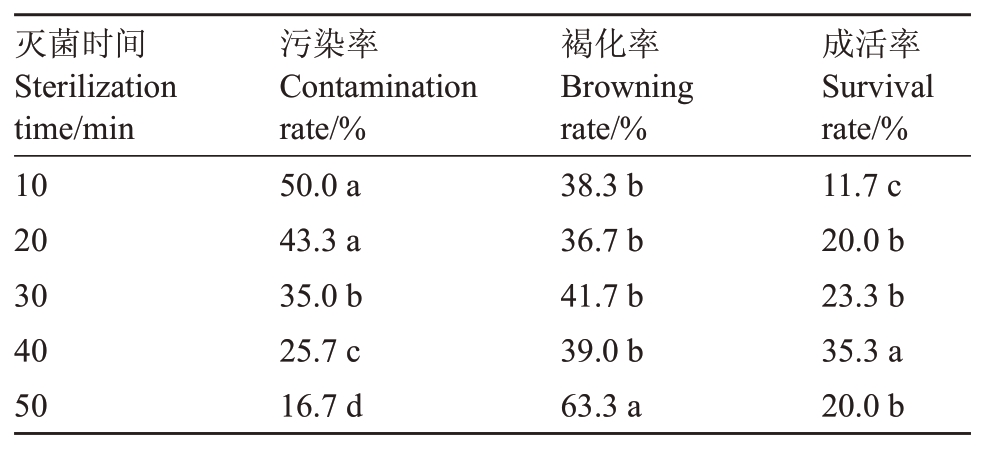
灭菌时间Sterilization time/min 10 20 30 40 50污染率Contamination rate/%50.0 a 43.3 a 35.0 b 25.7 c 16.7 d褐化率Browning rate/%38.3 b 36.7 b 41.7 b 39.0 b 63.3 a成活率Survival rate/%11.7 c 20.0 b 23.3 b 35.3 a 20.0 b
2.3 不同基本培养基对君迁子优系L938继代培养的影响
图2 为君迁子优系L938 组培苗在不同继代培养基中的生长状态,可以看出1/2MS(图2-B)中组培苗的植株高度以及生长状态明显优于(1/2N)MS(图2-C)和1/4MS(图2-D)。表3 结果显示,组培苗在1/2MS 和(1/2N)MS中新梢增殖系数无明显差异,但均显著高于1/4MS;在一级新梢数方面,1/2MS显著高于1/4MS,(1/2N)MS 和1/4MS 差异不显著;二级新梢数与一级新梢数结果相同;,3 个处理间的三级新梢数无显著差异。试验结果表明,1/2MS 培养基较适宜进行君迁子L938组培苗的继代培养,新梢增殖系数达到了4.40。

图2 君迁子优系L938 继代培养状态
Fig.2 Subculture status of date plum superior line L938
A.继代培养所使用的高度为1.5 cm 左右的L938 组培苗;B~D.30 d 统计时,1/2MS(B)、(1/2N)MS(C)、1/4MS(D)中组培苗的生长状态,标尺=1 cm。
A. L938 tissue culture seedlings with a height of about 1.5 cm were used for subculture; B-D. 30 d timing, growth status of in vitro seedlings in 1/2MS(B),(1/2N)MS(C)and 1/4MS(D),bars=1 cm.
表3 不同培养基类型对君迁子优系L938 新梢增殖的影响
Table 3 Effects of different media on shoot proliferation of L938 date plum

注:不同小写字母在同一列中表示差异显著(p<0.05)。
Note:Different small letters in the same column indicate significant differences among treatments(p<0.05).
培养基类型Medium type 1/2MS(1/2N)MS 1/4MS三级新梢数Number of tertiary shoots 0.23 a 0.15 a 0.08 a新梢增殖系数New shoot growth coefficient 4.40 a 4.08 a 3.36 b一级新梢数Number of first-order shoots 3.53 a 3.28 ab 2.87 b二级新梢数Number of secondary shoots 0.78 a 0.62 ab 0.43 b
2.4 NAA 和IBA 质量浓度组合处理对君迁子优系L938生根培养的影响
NAA+IBA 不同质量浓度组合对君迁子优系L938生根影响显著。由君迁子优系L938生根状态结果(图3)可知,T4、T5、T6的根系数量及长度显著优于T1、T2、T3,但叶片却出现一定程度的黄化。

图3 不同植物生长调节剂组合处理后君迁子优系L938 生根状态
Fig.3 Rooting status of L938 buds after treatment with different plant growth regulator combinations
由图4可知,不同处理间生根率、根长、根表面积、根系体积均有显著差异。其中,T4处理(1.0 mg·L-1 NAA+1.0 mg·L-1 IBA)相较于其余处理根系最长(29.08 cm),且生根率高达93.33%,显著高于其他处理组。其次是T5 处理(1.0 mg·L-1 NAA+2.0 mg·L-1 IBA),T5 处理的根长、根系表面积、根系体积与T4无明显差异。T4、T5、T6 处理的生根率、根长、根表面积和根系体积均高于T1、T2、T3 处理,说明采用1.0 mg·L-1 NAA 诱导君迁子优系L938 生根的效果要优于0.5 mg·L-1 NAA。在NAA 质量浓度相同的情况下,随着IBA质量浓度增加,生根率、根长、根表面积、根系体积逐渐呈下降趋势。

图4 不同植物生长调节剂组合处理对君迁子优系L938 生根培养的影响
Fig.4 Effects of different concentrations of plant growth regulators on rooting index of superior line L938 of date plum
不同处理生根指标的综合隶属函数值排序为:T4>T5>T6>T1>T2>T3(表4),因此综合各处理的生根状态及综合隶属函数值排名,最适宜君迁子优系L938 诱导生根的植物生长调节剂质量浓度组合为T4(1.0 mg·L-1 NAA+1.0 mg·L-1 IBA)。
表4 君迁子L938 的各项生根指标隶属函数值
Table 4 Affiliation function values of rooting indexes of L938 date plum
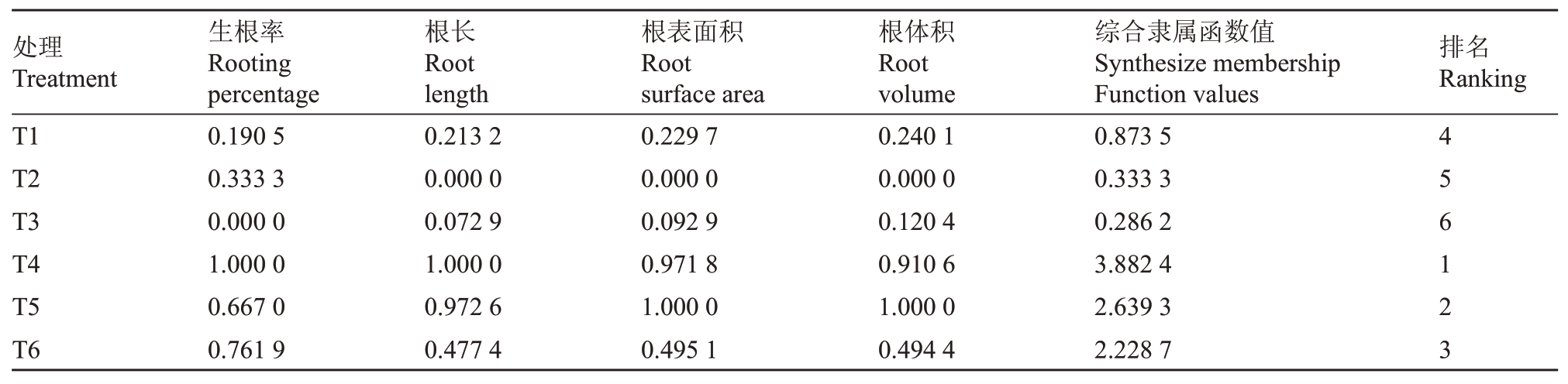
处理Treatment T1 T2 T3 T4 T5 T6生根率Rooting percentage 0.190 5 0.333 3 0.000 0 1.000 0 0.667 0 0.761 9根长Root length 0.213 2 0.000 0 0.072 9 1.000 0 0.972 6 0.477 4根表面积Root surface area 0.229 7 0.000 0 0.092 9 0.971 8 1.000 0 0.495 1根体积Root volume 0.240 1 0.000 0 0.120 4 0.910 6 1.000 0 0.494 4综合隶属函数值Synthesize membership Function values 0.873 5 0.333 3 0.286 2 3.882 4 2.639 3 2.228 7排名Ranking 456123
3 讨论
在植物组织培养过程中,外植体的选取既是基础环节也是培育出优质再生植株的核心步骤。根据细胞全能性学说,在适宜的生长条件下,植物所有器官、组织均具备成长为完整植株的能力,然而不同植物的不同组织、同一组织的不同部位,其再生分化的能力存在差异[9]。在木本植物中,常用的外植体有茎尖和茎段(带腋芽/不带腋芽)[10]、叶片、叶柄、上/下胚轴等。另外,也有部分植物通过培养花药[11]、胚[12]、子叶[13]等方式获得再生植株。吕中一等[8]以君迁子的萌动芽、春梢、腋芽、休眠芽作为外植体,筛选最适合的外植体材料,结果发现萌动芽的成活率显著高于其余3 种外植体,达到60%。谢启鑫等[14]以君迁子叶片作为外植体,研究了不同叶片部位(顶部、中部、基部、叶柄、全叶)对愈伤组织形成及不定芽诱导的影响,结果表明叶片部位不同,其愈伤组织形成及不定芽诱导存在差异,叶片基部的愈伤组织发生率、不定芽诱导率以及平均不定芽的数量都显著高于其余部位,分别为100%、19.0%和(2.0±0.5)个。外植体的不同部位及取材时期在再生过程中存在差异。笔者在本研究中对外植体选择方面进行研究,发现4月份新梢最适宜作为君迁子优系L938的外植体,不仅成活率高,而且污染、褐化程度轻微,这与前人相关研究结果有所差异,多数柿属植物组培通常都采用休眠芽作为外植体,因为休眠芽细胞分裂能力强且增殖速度快。但在本试验中休眠芽在启动培养阶段褐化死亡率极高,这可能是由于L938与其他柿品种基因型不同,需要长时间升汞灭菌。
外植体消毒彻底与否直接影响组织培养的结果:消毒时间过短,病菌存在导致外植体污染现象严重不利于无菌材料的获得;消毒时间过长又会对外植体产生毒害作用,组织损伤过大从而导致褐化或者死亡,因此,适宜的消毒液种类和恰当的消毒时间对无菌苗的获取有着至关重要的作用。常用的消毒剂有75%乙醇、升汞(HgCl2)、次氯酸钠(NaClO)、硝酸银、多菌灵等,在试验中可选用一种或几种消毒剂组合配比施用。覃换玲等[15]采用75%乙醇(10、30 s)和0.1%HgCl2(6、8、10 min)组合的方式对小果甜柿当年生带芽嫩枝茎段进行消毒,结果表明将外植体用75%乙醇处理10 s、0.1%HgCl2消毒8 min 成活率为76.67%,显著高于其余组合处理。刘彬等[16]以小果甜柿的休眠芽为外植体,经75%乙醇消毒30 s,再使用不同浓度次氯酸钠(0.5%、1.0%、2.0%、2.5%)消毒6 min,结果表明休眠芽经75%乙醇消毒30 s,再使用1%次氯酸钠消毒6 min,消毒效果最佳,成活率为62.56%。在本研究中外植体最佳灭菌处理为0.1 g·L-1 HgCl2消毒40 min,较前人研究中消毒时间明显延长,可能是由于外植体的来源不同,其携带的病菌种类及数量也不同,导致消毒时间延长。
基础培养基对组培苗的生长发育影响较大,外植体不同其培养基类型也存在差异,因此选择适宜的培养基对再生体系的建立具有重要意义。植物组织培养过程中大多会使用MS、(1/2N)MS、WPM、DKW等基本培养基。刘一凤[17]以1/2MS、1/2MS(1/2N)和1/2DKW 为基本培养基,探究不同培养基类型对小果甜柿生根的影响,结果表明小果甜柿在1/2MS(1/2N)培养基中生长健壮,生根率和根平均条数均高于其他两种培养基。刘晓娜等[18]以上西早生柿的组培苗为外植体,比较MS、1/2MS、(1/2N)MS、DKW、WPM 5种基本培养基对其快繁增殖的影响。结果表明DKW 培养基中N、P、K 含量高于(1/2N)MS 培养基,组培苗的生长状态优于其余4 种培养基,这与Kochanová等[19]的结果相似。李晶等[20]以君迁子的休眠芽为外植体,接种到1/2MS、(1/2N)MS、DKW 基本培养基中进行初代培养,研究发现DKW培养基最适宜君迁子初代培养。笔者在本研究中以1/2MS、(1/2N)MS、1/4MS 为基本培养基进行继代培养,结果表明1/2MS为君迁子L938组培苗继代培养的最适培养基,与前人的结论不相符,可能是试材的差异造成的。
柿属植物普遍存在生根难的问题,笔者在本试验中采用不同质量浓度的NAA+IBA组合进行处理,发现生根效果好的T4、T5、T6 处理组为1.0 mg·L-1的NAA,而生根效果较差的T1、T2、T3 处理组为0.5 mg·L-1 NAA,说明高质量浓度的NAA对L938组培苗的生根有利,但对其地上部代谢可能产生一定影响,例如叶绿素的合成等,导致叶片发黄。刘洋[21]在君迁子生根培养中发现在IBA质量浓度固定的条件下,随NAA 浓度增高叶片出现发黄现象;张彦妮等[22]在复叶槭中的研究发现,增加NAA质量浓度可有效提高茎段生根率,但质量浓度过大其长势会下降,与本研究中结果类似。
目前,国内外学者在柿属植物组培快繁方面开展了大量工作,也取得了一定的成果,但生产上实质性进展仍比较缓慢。分析其原因,笔者认为主要为以下两个方面。一是柿属植物生根难,主要表现在生根率低、生根慢。刘一凤[17]以添加1.0 mg·L-1 IBA的1/2MS 为基本培养基,对小果甜柿的组培苗进行生根诱导,生根率仅为40.5%。影响生根的因素有很多,包括品种自身遗传特性、培养基类型、继代次数[23]、培养条件,激素组合等。此外,还有一些生长素类似物,如4-三氟甲基吲哚、4-氯吲哚-3-乙酸[24]等。其中植物激素的种类及浓度配比是影响生根的重要因素之一。艾鹏飞等[25]及Martini等[26]的研究表明,IAA 更适合生根培养,且所生根系发育健壮,有利于后期的炼苗移栽。刘聪娟等[27]采用正交的方法,研究了不同浓度的IBA+IAA组合处理对三种甜柿品种生根的影响,结果表明将外植体接种到含有1.0 mg·L-1 IBA+1.0 mg·L-1 IAA的1/2 MS培养基中,生根率可达90%。本试验中,在1.0 mg·L-1 NAA+1.0 mg·L-1 IBA 处理条件下,L938 生根率虽然达到93.33%,相较于部分柿属植物略高,但其生长速度仍较慢,转移到生根培养基后约50 d 才开始生根。二是组培苗移栽成活率低。周瑞金等[28]以无核君迁子生根苗为试材进行大田移栽,其移栽成活率为63%。此过程受环境因素影响特别大,同时品种间存在明显差异,笔者课题组也进行了相关试验,然而效果均不理想,目前该部分研究仍在持续重点进行中。
4 结论
新梢(4 月份)相较于新梢(5 月份)、休眠芽成活率高,可达71.33%,为君迁子优系L938 启动培养的最适宜外植体。以生长期中的君迁子L938 茎段作为外植体,经0.1 g·L-1 HgCl2处理40 min 后灭菌效果最佳,外植体的成活率达35.3%,显著优于其余处理。以株高达1.5 cm 左右的君迁子组培苗为外植体,采用1/2MS培养基进行继代培养,新梢增殖系数达到了4.4,为君迁子L938 组培苗继代培养的最适培养基。T4(1.0 mg·L-1 NAA、1.0 mg·L-1 IBA)为君迁子优系L938 最适生根组合,生根率达93.33%,根长29.08 cm,根表面积19.53 cm2、根系体积1.05 cm3。
[1] 韩卫娟,刁松锋,张悦,傅建敏,李华威,孙鹏,索玉静,李芳东.无核君迁子果实发育成熟过程中生理指标变化规律[J].浙江农林大学学报,2022,39(3):554-561.HAN Weijuan,DIAO Songfeng,ZHANG Yue,FU Jianmin,LI Huawei,SUN Peng,SUO Yujing,LI Fangdong. Variation patterns of physiological indices of seedless Diospyros lotus during fruit development and ripening[J]. Journal of Zhejiang A & F University,2022,39(3):554-561.
[2] 艾鹏飞,罗正荣.柿和君迁子试管苗缓慢生长法保存及其遗传稳定性研究[J].园艺学报,2004,31(4):441-446.AI Pengfei,LUO Zhengrong. Conservation of in vitro shoots of persimmon and date plum by slow growth and genetic stability of recovered plantlets[J].Acta Horticulturae Sinica,2004,31(4):441-446.
[3] 艾鹏飞,罗正荣.柿和君迁子试管苗茎尖玻璃化法超低温保存及再生植株遗传稳定性研究[J]. 中国农业科学,2004,37(12):2023-2027.AI Pengfei,LUO Zhengrong.Cryopreservation of in vitro shoottips of persimmon and date plum by vitrification and genetic stability of regenerated plantlets[J]. Scientia Agricultura Sinica,2004,37(12):2023-2027.
[4] 龙海涛.‘太秋’甜柿不同砧木类型初期筛选及抗寒性评价[D].杨凌:西北农林科技大学,2023.LONG Haitao. Initial screening of different rootstock types and evaluation of cold resistance in sweet persimmo‘Taishu’[D].Yangling:Northwest A&F University,2023.
[5] LI X H,JIANG Z Y,SHEN Y Y,LI F H,YU X Y,QU S C. In vitro regeneration and Agrobacterium tumefaciens-mediated genetic transformation of D. lotus (Diospyros lotus L.)[J]. Scientia Horticulturae,2018,236:229-237.
[6] 吕中一,关长飞,李家艳,丁瑜,范芝蕊,杨勇.柿属植物组织培养技术研究进展[J].北方园艺,2023(12):129-137.LÜ Zhongyi,GUAN Changfei,LI Jiayan,DING Yu,FAN Zhirui,YANG Yong.Research progress on tissue culture of Diospyros[J].Northern Horticulture,2023(12):129-137.
[7] LIU Y,LU X Y,ZHANG H,LI S Z,LI Z. Establishment of a highly efficient in vitro propagation system of Diospyros lotus[J].Forests,2023,14(2):366.
[8] 吕中一,闻家乐,刘泽远,张馨予,胡碧春,范芝蕊,关长飞,杨勇.君迁子组培体系的建立及优化[J/OL].西北农林科技大学学报(自然科学版),2024,52(5):1-8.(2023-11-01).https://link.cnki.net/urlid/61.1390.S.20231031.1639.010.LÜ Zhongyi,WEN Jiale,LIU Zeyuan,ZHANG Xinyu,HU Bichun,FAN Zhirui,GUAN Changfei,YANG Yong. Establishment and optimization of a tissue culture and rapid propagation system of Diospyros lotus L.[J/OL].Journal of Northwest A&F University (Natural Science Edition),2024,52(5):1-8. (2023-11-01).https://link.cnki.net/urlid/61.1390.S.20231031.1639.010.
[9] 许智宏,张宪省,苏英华,胡玉欣,徐麟,王佳伟.植物细胞全能性和再生[J].中国科学:生命科学,2019,49(10):1282-1300.XU Zhihong,ZHANG Xiansheng,SU Yinghua,HU Yuxin,XU Lin,WANG Jiawei. Plant cell totipotency and regeneration[J].Scientia Sinica:Vitae,2019,49(10):1282-1300.
[10] 冯晓晖,闫学彤,郑珂媛,周强,张伟中,王权勇,朱木兰.富含紫杉烷类红豆杉的离体培养[J]. 植物学报,2023,58(6):917-925.FENG Xiaohui,YAN Xuetong,ZHENG Keyuan,ZHOU Qiang,ZHANG Weizhong,WANG Quanyong,ZHU Mulan. In vitro culture of Taxus rich in taxanes[J]. Chinese Bulletin of Botany,2023,58(6):917-925.
[11] BANSAL Y,MUJIB A,MAMGAIN J,DEWIR Y H,RIHAN H Z. Phytochemical composition and detection of novel bioactives in anther callus of Catharanthus roseus L.[J]. Plants,2023,12(11):2186.
[12] 薛婉钰,刘娜,苑鑫,张婷婷,曹云娥,陈书霞.黄瓜胚性愈伤组织的诱导保存和再生[J/OL].西北农林科技大学学报(自然科学版),2024,52(7):1-7.(2024-01-05).https://doi.org/10.13207/j.cnki.jnwafu.2024.07.011.XUE Wanyu,LIU Na,YUAN Xin,ZHANG Tingting,CAO Yun’e,CHEN Shuxia. Induction and preservation of cucumber embryogenic callus[J/OL].Journal of Northwest A&F University (Natural Science Edition),2024,52(7):1-7. (2024-01-05).https://doi.org/10.13207/j.cnki.jnwafu.2024.07.011.
[13] NAKAJIMA I,ITO A,MORIYA S,SAITO T,MORIGUCHI T,YAMAMOTO T. Adventitious shoot regeneration in cotyledons from Japanese pear and related species[J]. In Vitro Cellular &Developmental Biology-Plant,2012,48(4):396-402.
[14] 谢启鑫,黄美连,吴晓萍,庄东红.君迁子叶片培养再生植株的研究[J].中国农业科学,2008,41(2):607-612.XIE Qixin,HUANG Meilian,WU Xiaoping,ZHUANG Donghong.Plant regeneration from leaves of date plum(Diospyros lotus L.)[J].Scientia Agricultura Sinica,2008,41(2):607-612.
[15] 覃换玲,高营营,黄丽辉,陈淑媛,黄天琨,李贤高,周晓璇,关长飞,杨勇.小果甜柿组织培养快繁技术[J].果树学报,2023,40(9):1992-2000.QIN Huanling,GAO Yingying,HUANG Lihui,CHEN Shuyuan,HUANG Tiankun,LI Xiangao,ZHOU Xiaoxuan,GUAN Changfei,YANG Yong.Study on tissue culture and rapid propagation of Xiaoguo Tianshi as a sweet persimmon rootstock[J].Journal of Fruit Science,2023,40(9):1992-2000.
[16] 刘彬,杜晓云,陈文兴,郭大勇,徐莉清,张青林,罗正荣.广亲和砧木小果甜柿离体快繁技术建立及优化[J]. 果树学报,2023,40(9):1980-1991.LIU Bin,DU Xiaoyun,CHEN Wenxing,GUO Dayong,XU Liqing,ZHANG Qinglin,LUO Zhengrong. Establishment and optimization of in vitro rapid propagation technology of Xiaoguo Tianshi as compatible rootstock for persimmon[J].Journal of Fruit Science,2023,40(9):1980-1991.
[17] 刘一凤.完全甜柿砧木小果甜柿繁殖技术研究[D].武汉:华中农业大学,2017.LIU Yifeng. Establishment of propagation technology for PCNA rootstock Xiaoguo Tianshi[D]. Wuhan:Huazhong Agricultural University,2017.
[18] 刘晓娜,马俊莲,张子德,宋春丽.上西早生甜柿离体快繁技术研究[J].河北农业大学学报,2004,27(1):61-63.LIU Xiaona,MA Junlian,ZHANG Zide,SONG Chunli. Study on micropropagation in vitro of Uenishiwase persimmon[J].Journal of Agricultural University of Hebei,2004,27(1):61-63.
[19] KOCHANOVÁ Z,ONUS N,BRINDZA J. Adventitious shoot regeneration from dormant buds of persimmon (Diospyros kaki Thunb.) cv. Hachiya[J]. Journal of Agrobiology,2011,28(2):113-118.
[20] 李晶,罗玉洁,张青林,罗正荣,刘继红.君迁子休眠芽及叶片离体培养体系优化及植株再生[J].华中农业大学学报,2016,35(4):14-19.LI Jing,LUO Yujie,ZHANG Qinglin,LUO Zhengrong,LIU Jihong. In vitro culture system optimization and regeneration of date plum (Diospyros lotus Linn.) dormant buds and leaves[J].Journal of Huazhong Agricultural University,2016,35(4):14-19.
[21] 刘洋.君迁子组织培养再生体系的建立及遗传转化研究[D].长沙:中南林业科技大学,2022.LIU Yang. Establishment of Diospyros lotus L. tissue culture regeneration system and genetic transformation research[D].Changsha:Central South University of Forestry & Technology,2022.
[22] 张彦妮,董亚茹,卓丽环,张远东.激素对复叶槭茎段和叶片愈伤组织诱导及再生的影响[J].林业科学研究,2012,25(4):516-520.ZHANG Yanni,DONG Yaru,ZHUO Lihuan,ZHANG Yuandong.Effect of plant hormones on callus induction and regeneration of stem segment and leaf from Acer negundo[J]. Forest Research,2012,25(4):516-520.
[23] ZHANG X,LIU J R,JIA W J,ZHAO J H,XU R Q. Thymol modulates in vitro plant regeneration and gene expression in sesame[J].In Vitro Cellular&Developmental Biology-Plant,2022,58(2):240-255.
[24] PINCELLI-SOUZA R P,TANG Q,MILLER B M,COHEN J D.Horticultural potential of chemical biology to improve adventitious rooting[J].Horticulture Advances,2024,2(1):12.
[25] 艾鹏飞,罗正荣.甜柿试管苗生根条件的研究[J].华中农业大学学报,2002,21(2):154-157.AI Pengfei,LUO Zhengrong. Studies on rooting conditions of nonastringent persimmon in vitro[J]. Journal of Huazhong Agricultural,2002,21(2):154-157.
[26] MARTINI A N,VLACHOU G,PAPAFOTIOU M. Effect of explant origin and medium plant growth regulators on in vitro shoot proliferation and rooting of Salvia tomentosa,a native sage of the northeastern Mediterranean Basin[J]. Agronomy,2022,12(8):1889.
[27] 刘聪娟,唐霞,刘恺,马俊莲.甜柿组培苗生根条件的研究[J].河北林果研究,2006,21(2):185-188.LIU Congjuan,TANG Xia,LIU Kai,MA Junlian. Studies on rooting conditions of nonastringent persimmon in vitro[J].Hebei Journal of Forestry and Orchard Research,2006,21(2):185-188.
[28] 周瑞金,张晓娜,扈惠灵,李桂荣,宋如慧.无核君迁子离体叶片的植株再生[J].北方园艺,2016(22):104-106.ZHOU Ruijin,ZHANG Xiaona,HU Huiling,LI Guirong,SONG Ruhui. Plant regeneration from leaves of seedless date plum (Diospyros lotus L.)[J]. Northern Horticulture,2016(22):104-106.