枣(Zizyphus Jujuba Mill.)为鼠李科(Rhamnaceae)枣属(Zizyphus Mill.)植物[1],营养价值高。灰枣是新疆重要的干食品种,果肉致密,汁液少,品质上等。冬枣是华北地区的一个优质鲜食品种,果肉酥脆,汁液多。研究灰枣和冬枣果实质地差异形成的机制,可为改良果实品质的育种工作提供理论依据。
质地作为果实重要的内在品质指标,其形成和变化受细胞大小、形态等微观因素的影响较大[2]。细胞壁组分主要包括果胶、纤维素(cellulose,CE)、半纤维素(hemicellulose,HCE)等,其合成、转移和水解等过程需要多种细胞壁相关酶的参与和协同调控[3]。不同品种枣果实的卸载途径相似,转化酶在细胞壁的定位量也随着果实的发育而变化[4]。因此研究枣果实发育及成熟过程中细胞壁组分含量及相关酶活性的变化规律,对探讨枣果实质地差异具有重要的指导意义。已有研究表明,植物细胞壁的结构对果实的质地起决定性作用,尤其果实的软化过程,主要源于细胞间中胶层的降解,使得细胞逐渐分离[5]。不同细胞类型和果实的生长发育阶段可能导致细胞壁成分的差异,但中胶层的降解在果实软化过程中具有普遍性,果实成熟过程中半纤维素和纤维素共同导致细胞壁结构的变化。此外,细胞与细胞间果胶的溶解,使果肉组织力学特性发生改变,这是导致质地变化的主要原因[6]。在枇杷(Eriobotrya japonica)[7]、苹果(Malus pumila)[8]、桃(Prunus persica)[9]、杏(Prunus armeniaca)[10]、辣椒(Capsicum annuum)[11]等作物中,果实中纤维素含量随着果实的发育和成熟逐渐降低是常见现象之一,与果肉质地间存在极显著正相关。在果实的成熟过程中,随着物质分解与转化,细胞壁代谢酶微妙地调整着果肉内如果胶、半纤维素和纤维素等关键成分的平衡。当果实渐趋成熟,这些微妙变化最终塑造出各品种独特的质地特征[12]。不同物种间的果实蕴含着多样性的酶表达模式且表达时期也有较大差异;果实的成熟过程涉及多种酶的相互作用,共同调控果实质地的变化[13]。虽然人们已经对果实发育成熟过程中质地变化的生理机制进行了大量研究,但果实质地差异的机制尚不明确,对导致果实质地的关键酶或者基因仍需要进一步的研究。
笔者以灰枣和冬枣两种不同质地的枣果实为试验材料,探讨两个品种发育过程中枣果实水分含量、硬度、果肉细胞壁组分含量、代谢酶活性以及细胞显微结构动态的变化规律,分析不同质地的枣果实差异性和相关性,找出影响枣果实质地差异的关键因素,为进一步研究枣生长发育调控机制和品质改良提供依据。
1 材料和方法
1.1 试验地概况
试验在麦盖提县央塔克乡鲜食枣生产示范园进行,该地属于温带大陆性气候,其特点是夏季炎热,平均年降水量42.3 mm。试验园株行距为1.5 m×4 m,试验品种于2020年高接换头改接到10年生的骏枣上。
1.2 试验材料
以制干枣灰枣、鲜食枣冬枣为试验品种,均选择树势基本一致、无病虫害的30 株枣树为试验树,10株枣树为1 个小区,3 次重复。采集花后31 d(幼果期S1)、63 d(膨大期S2)、78 d(白熟期S3)、98 d(半红期S4)、108 d(全红期S5)五个时间节点大小均匀、无机械伤、无病虫害的果实作为试验果样。
1.3 测定指标与方法
1.3.1 果实水分含量和硬度的测定 硬度通过在果胴部位均匀选3 个点并削去外果皮,用手持硬度计进行测定[14]。
水分含量通过用烘干称质量法测定[15],称取约2 g 鲜样于称量皿中,先放入105 ℃的烘箱中杀青20 min,再降至80 ℃恒温烘至恒质量(约6 h),取出冷却后称质量并计算。
1.3.2 果实细胞壁物质含量及酶活性的测定 细胞壁组分果胶和纤维素含量均使用试剂盒测定(G0717W48,G0715W48,格锐思生物)。
细胞壁代谢相关酶果胶酯酶(PE)、果胶裂解酶(PL)、多聚半乳糖醛酸酶(PG)、纤维素酶(Cx)、α-L-阿拉伯呋喃糖苷酶(α-Af)以及β-半乳糖苷酶(β-Gal)活性均使用试剂盒测定(G0707D,G0702W,G0701W,G0533W,G0714W,G0524W,格锐思生物)。以上测定均设3次重复。
1.3.3 果实细胞解剖结构观察 将新鲜采集外观与内部生理结构均无损坏的灰枣和冬枣果实切成小块后迅速投入70%FAA固定液、2.5%戊二醛固定液中固定保存,经脱水、透明、浸蜡、包埋、切片、展片及粘片、脱蜡与染色、封片后,置于电子显微镜下进行显微镜检、透射电镜下进行超显微镜检、图像采集以及数据测定[16]。
1.4 数据统计与处理
运用Excel 22.0 进行数据初步处理,使用SPSS 28.0对数据进行差异显著性分析,利用Image J软件进行数据测定,利用Origin 2021绘制图形。
2 结果与分析
2.1 在生长发育过程中水分含量与硬度的动态变化
结果(图1)表明,S2 时期前灰枣和冬枣水分含量呈急剧上升趋势,S2时期后两个品种果实的水分含量呈下降趋势。S5 时期两个品种果实水分含量持续下降,此时灰枣水分含量相比冬枣较大。在S2时期,灰枣和冬枣水分含量达到最高值,且冬枣高于灰枣,但差异不显著。在整个发育成熟过程中,灰枣和冬枣的水分含量比较相似,均呈先升高后下降趋势。随着果实发育,灰枣和冬枣硬度均呈下降趋势,且灰枣硬度持续高于冬枣。
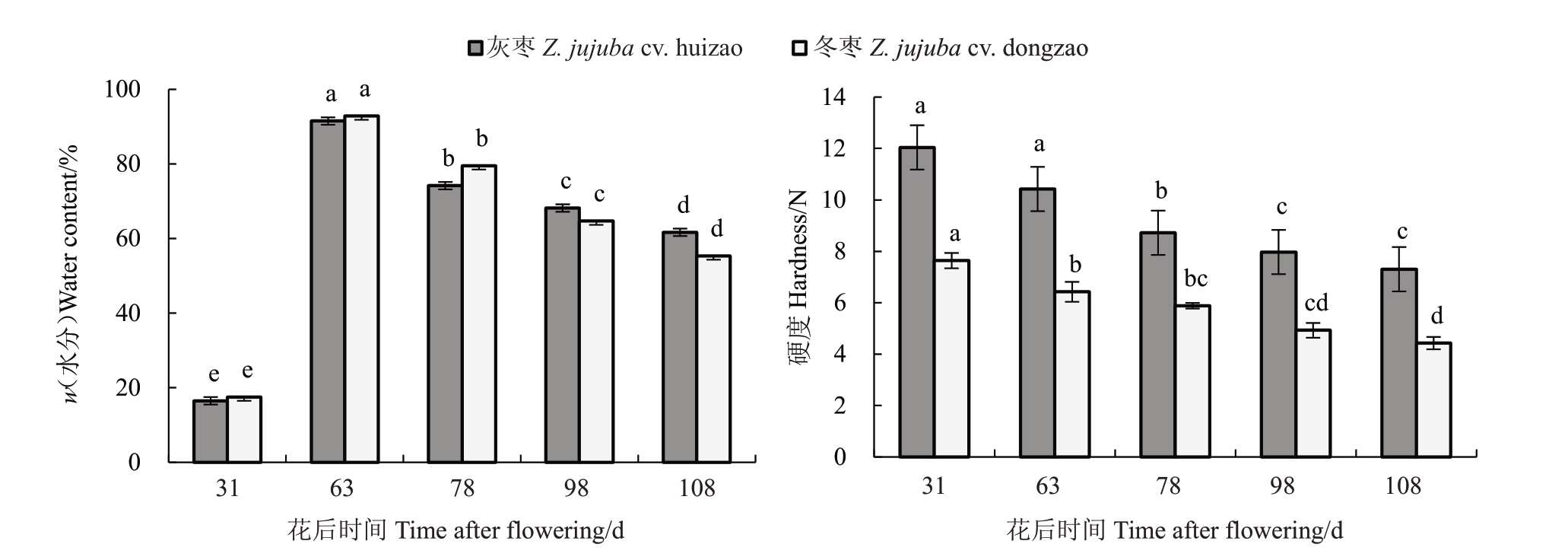
图1 两个品种果实在生长发育过程中水分含量、硬度的动态变化
Fig.1 The moisture content and hardness of the two varieties changed dynamically during the growth and development
不同小写字母表示同一品种在0.05 水平上的显著性差异。下同。
Different small letters represent significant difference among the same variety at 0.05 level.The same below.
2.2 在生长发育过程中细胞显微结构的变化
随着枣果实生长发育,灰枣和冬枣果肉细胞面积、长径和宽径均呈增大趋势,均表现S2 时期前急速增大,S2 时期后缓慢增大,但不同品种间增大数值存在差异(图2)。S1 时期,灰枣和冬枣果肉细胞排列紧密,细胞大小差异不明显,灰枣果肉细胞长径主要集中在54.65~63.47 μm,冬枣果肉细胞长径主要集中在64.34~75.04 μm。相比S1,S2 时期细胞显著增大,细胞间隙变大,灰枣和冬枣果肉细胞面积分别增大了3.76、4.84 倍。至S5 时期,各品种枣果肉细胞面积达到最大,但增长幅度变缓,相比S2时期,灰枣和冬枣果肉细胞面积分别增大了2.80、2.56倍。全红期时灰枣和冬枣果肉细胞面积相近,冬枣果肉细胞面积仍旧大于灰枣。
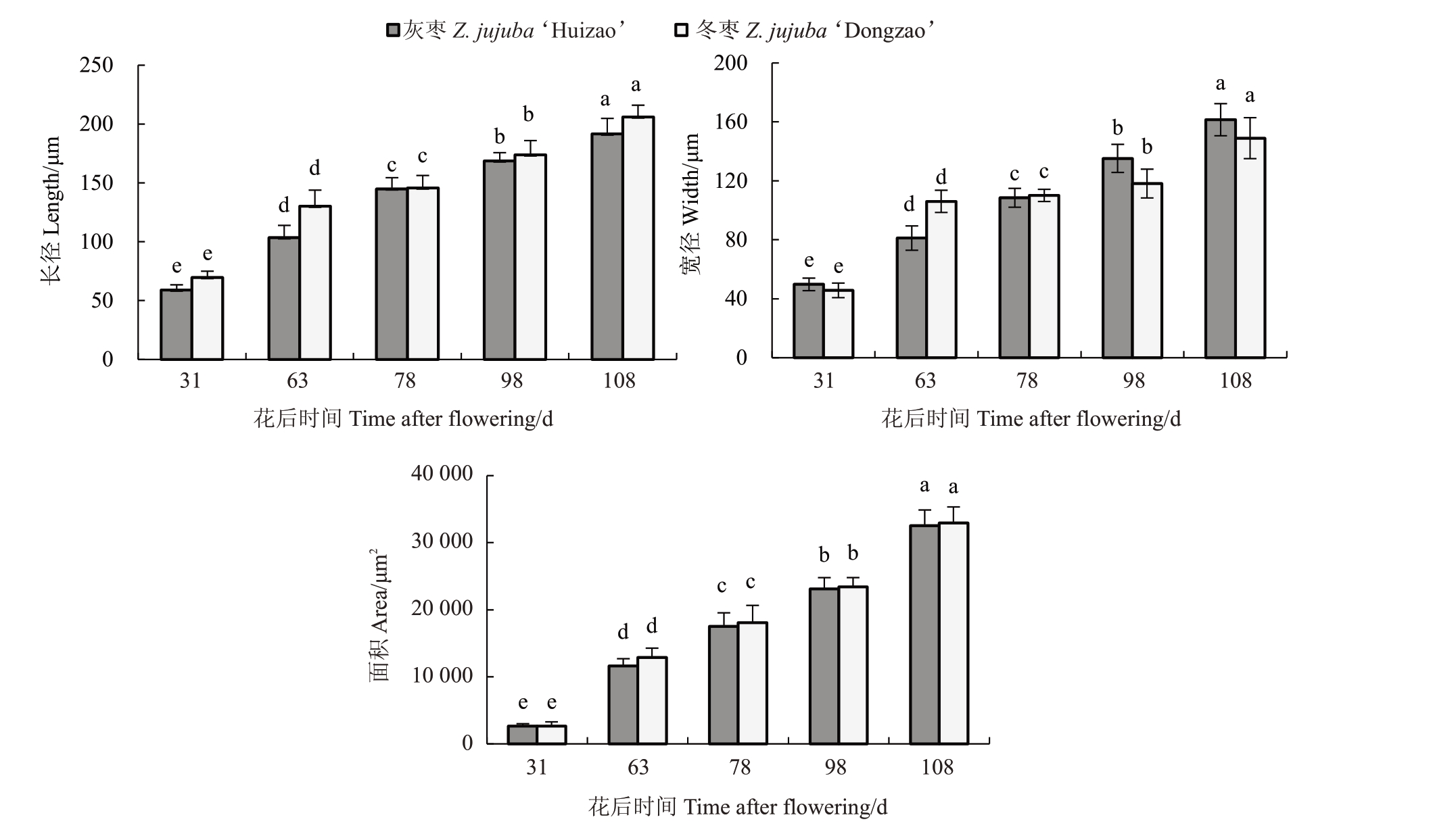
图2 两个品种果实在生长发育过程中果肉细胞形态参数动态变化
Fig.2 The morphological parameters of pulp cells changed dynamically during the growth and development of the two varieties
两个品种随着生长发育,果肉细胞的变化均呈现先迅速增大后缓慢增大趋势(图3)。在S1 时期,灰枣和冬枣果肉薄壁细胞均排列紧密,细胞大小无明显差异。S2时期与S1时期相比,此时观察到显著增大的果肉薄壁细胞以及变大的细胞间隙。在S5时期时,两个品种果肉薄壁细胞达到最大面积,但相比S2 时期时增长幅度变缓。全红期时灰枣和冬枣果肉薄壁细胞面积相近,但冬枣果肉薄壁细胞面积较大,灰枣和冬枣果肉薄壁细胞形状不同,都呈不规则多边形。S2时期前果肉薄壁细胞排列紧密,而后细胞排列相对疏松,甚至S3时期时薄壁细胞大多为不规则形状,轮廓模糊,边缘破碎,排列松散。
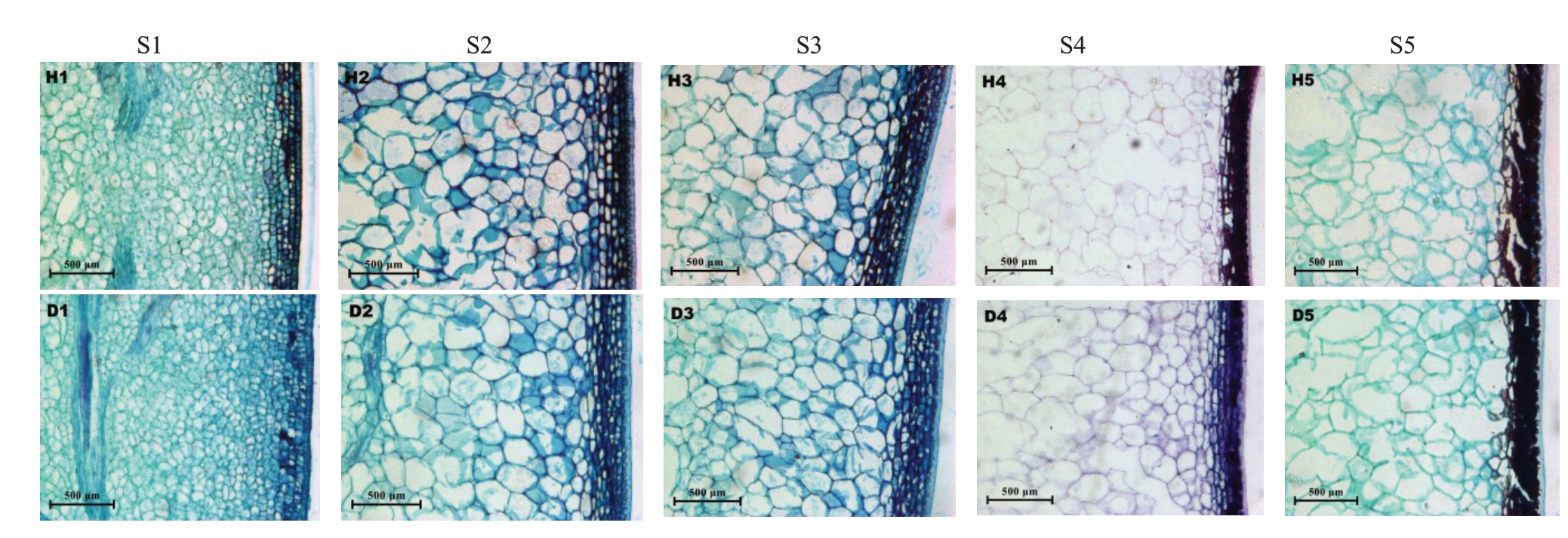
图3 两个品种果实在生长发育过程中果肉细胞显微结构
Fig.3 Microstructure of pulp cells during the growth and development of two varieties
H1~H5.灰枣S1~S5;D1~D5.冬枣S1~S5。
H1-H5.Z.jujuba‘Huizao’S1-S5;D1-D5.Z.jujuba‘Dongzao’S1-S5.
2.3 在生长发育过程中细胞超显微结构的变化
灰枣和冬枣果肉细胞超显微结构观测结果(图4)表明,S1 时期时果肉细胞壁结构紧密,中胶层和初生壁不易区别开;S2时期时能观察到极薄的中胶层分层,以及位于其两边的初生壁;S3 时期后细胞壁结构开始降解,中胶层解体,还能看到细胞壁明-暗-明的分层结构。到S4时期,细胞壁明显松散,相邻细胞壁分离,细胞器慢慢溶解,与此同时果实硬度处于低值。在S5 时期,灰枣和冬枣果肉细胞壁、中胶层已经明显降解,冬枣相较灰枣中胶层、内含物降解较慢,S4时期仍能观察到。
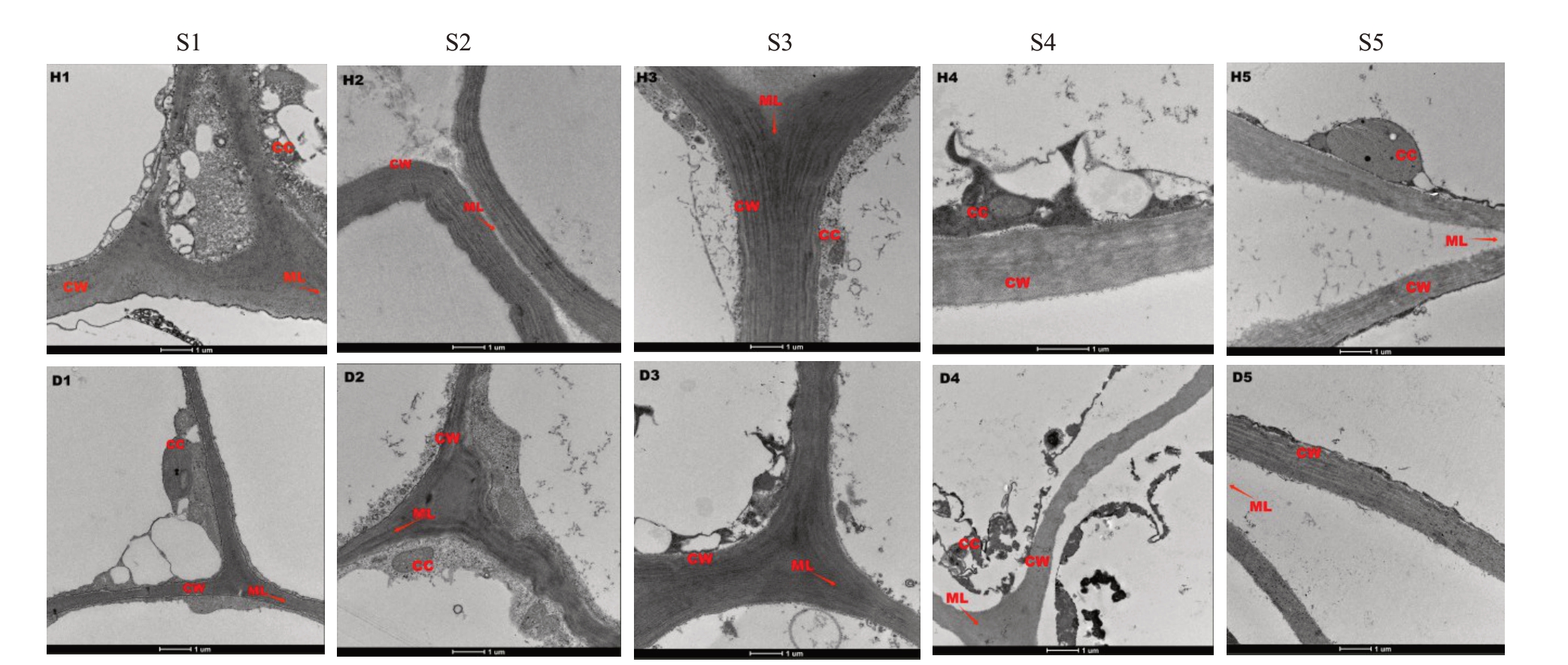
图4 两个品种果实在生长发育过程中果肉细胞超显微结构
Fig.4 Ultramicroscopic structure of pulp cells during the growth and development of two varieties
H1~H5.灰枣S1~S5;D1~D5.冬枣S1~S5;CW.细胞壁;ML.中胶层;CC.细胞内含物。
H1-H5.Z.jujuba‘Huizao’S1-S5;D1-D5.Z.jujuba‘Dongzao’S1-S5;CW.Cell wall;ML.Middle lamella;CC.Cell inclusion.
2.4 在生长发育过程中细胞壁主要物质含量及细胞壁代谢酶活性的变化
在果实发育过程中细胞壁组分含量动态变化(图5)表明,灰枣和冬枣果实的总果胶以及纤维素含量整体呈降低趋势,与果实硬度变化趋势一致。通过两个品种不同发育期细胞壁成分的差异分析,发现灰枣果实总果胶含量呈下降-上升趋势,S3 时期前总果胶含量急剧下降,S3时期后总果胶含量呈持续上升趋势;冬枣果实总果胶含量呈横“S”形趋势,S2 时期前总果胶含量呈逐渐降低的趋势,S2 时期后总果胶含量呈先缓慢上升后缓慢下降趋势,且冬枣总果胶含量一直低于灰枣。灰枣和冬枣果实纤维素含量呈相似的动态变化趋势,二者的含量在果实发育初期均由高到低逐渐减少。就纤维素而言,灰枣的含量较高,而灰枣和冬枣果实纤维素含量高峰期均在S1 时期;虽然二者纤维素含量高峰期相同,变化趋势相似,但含量变化时期存在差异,灰枣果实纤维素含量在S2~S3 时期下降趋势较快,而冬枣果实在S1~S2时期下降趋势较快。
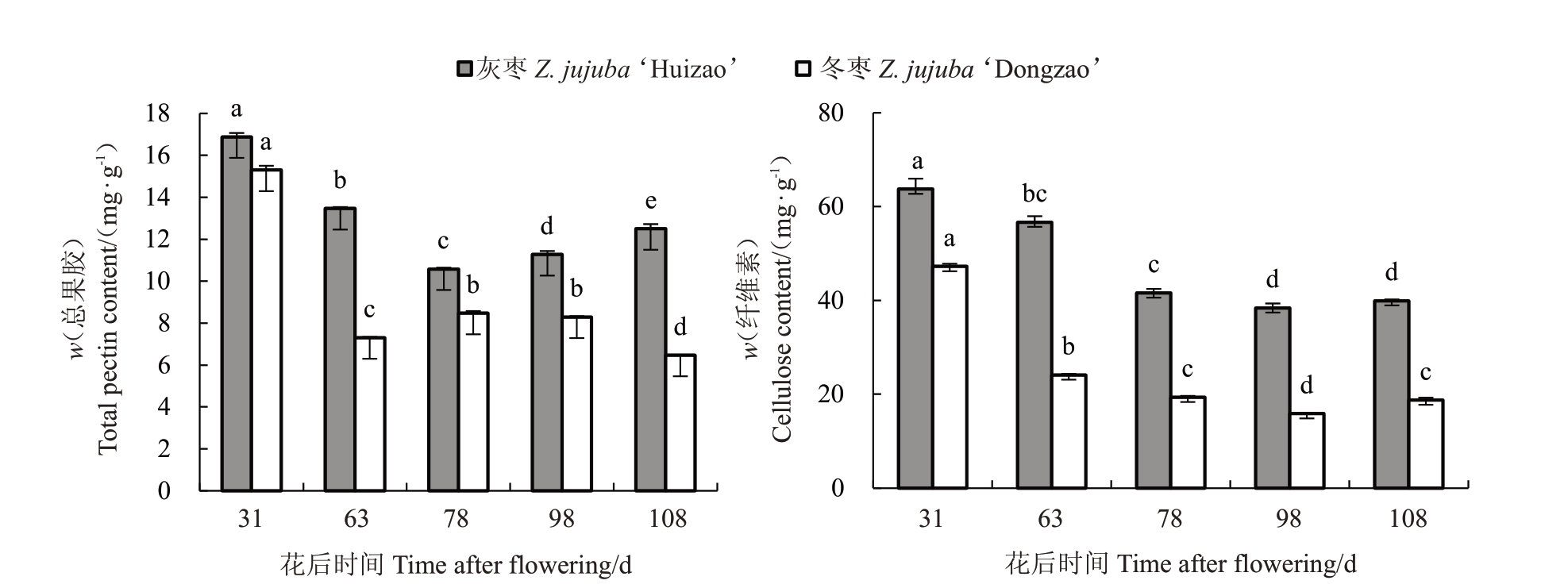
图5 两个品种果实在生长发育过程中细胞壁组分含量的动态变化
Fig.5 The content of cell wall components in the two varieties changed dynamically during fruit growth and development
在果实发育过程中,灰枣和冬枣果实的α-Af、β-Gal以及PL活性基本上呈增加趋势,而PE、Cx以及PG 活性在两个品种间的变化趋势相反(图6),推测PE、Cx 以及PG 活性的不同变化模式导致枣果实质地变化差异性。通过比较两个品种细胞壁代谢酶活性的差异,发现灰枣果实PE活性呈下降-上升-下降-上升趋势,在S3时期活性达到最高;冬枣果实PE酶活性呈下降-上升-下降趋势,在S4时期活性达到最高。灰枣和冬枣果实β-Gal 活性呈相似的动态变化趋势,均在S2 时期前活性急剧升高。灰枣果实的Cx和PL活性均呈上升-下降-上升-下降趋势,且均在S4 时期时达到最高值;而冬枣果实的Cx 活性呈上升-下降-上升趋势,PL活性呈持续上升趋势。灰枣和冬枣果实的PG 活性动态变化趋势相反。就β-Gal、Cx、α-Af 活性而言,灰枣的活性较高,而冬枣PG活性仅在S1时期高于灰枣。
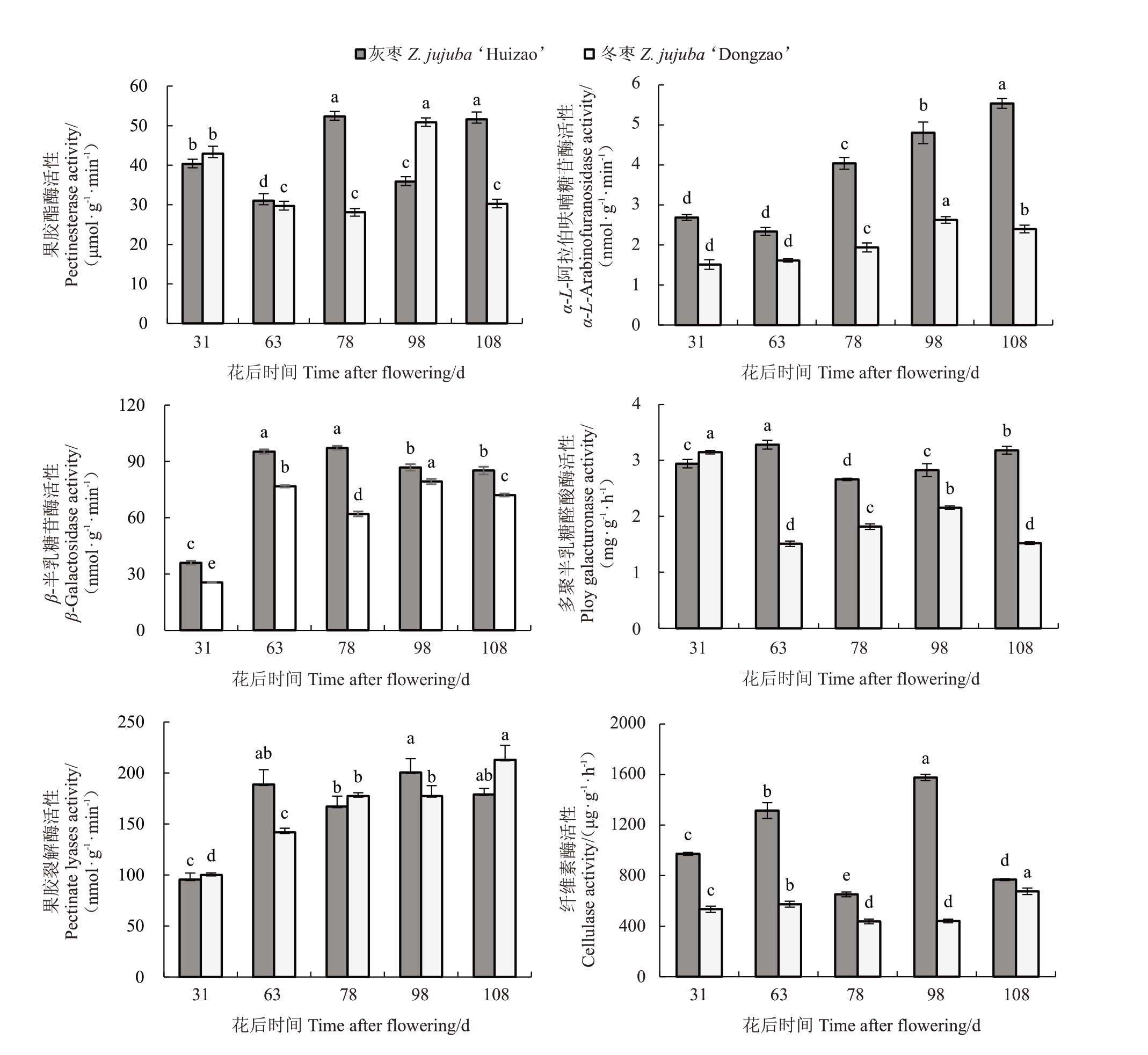
图6 两个品种果实在生长发育过程中细胞壁代谢酶活性的动态变化
Fig.6 The activities of cell wall degradation enzymes changed dynamically during the growth and development of the two varieties
2.5 枣果细胞壁物质含量与细胞壁酶活性的相关性分析
灰枣和冬枣果实细胞壁物质含量与细胞壁酶活性的相关性分析结果(表1)表明,果实发育过程中,灰枣和冬枣硬度与β-Gal、α-Af、PL活性呈极显著负相关,与总果胶和纤维素含量呈极显著正相关,冬枣硬度与PG 活性呈显著正相关;灰枣水分含量与β-Gal、PL活性呈极显著正相关,与总果胶含量呈极显著负相关,冬枣水分含量与β-Gal活性呈极显著正相关,与PG 活性、总果胶和纤维素含量呈极显著负相关;灰枣总果胶和纤维素含量均与β-Gal、α-Af、PL活性呈极显著或显著负相关;冬枣总果胶含量与β-Gal和PL活性呈极显著负相关,与PG活性呈极显著正相关,冬枣纤维素含量与β-Gal、α-Af、PL 活性呈极显著负相关,与PG活性呈极显著正相关。
表1 两个品种果实在发育过程中细胞壁组分含量及其代谢酶活性的相关性
Table 1 Correlation between cell wall components and metabolic enzyme activities during fruit development of the two varieties

注:**在0.01 水平上极显著相关。*在0.05 水平上显著相关。左下角数据表示灰枣果实的相关性分析;右上角表示冬枣。
Note:**Extremely significantly correlated at the 0.01 level.*Significant correlation at the 0.05 level.The data in the lower left corner represents the correlation analysis of the fruit of Z.jujuba‘Huizao’,and the upper right corner shows Z.jujuba‘Dongzao’.
指标Targets硬度Hardness水分含量Water content PE activity β-Gal activity Cx activity PG activity α-Af activity PL activity总果胶含量Total pectin content纤维素含量Cellulose content硬度Hardness 1.000-0.576*水分含量Water content-0.310 1.000果胶酯酶活性PE activity-0.040-0.490 β-半乳糖苷酶活性β-Gal activity-0.736**0.812**纤维素酶活性Cx activity-0.110-0.130多聚半乳糖醛酸酶活性PG activity 0.595*-0.842**α-L-阿拉伯呋喃糖苷酶活性α-Af activity-0.902**0.140果胶裂解酶活性PL activity-0.923**0.420总果胶含量Total pectin content 0.753**-0.806**纤维素含量Cellulose content 0.836**-0.748**-0.420-0.739**0.070 0.080-0.815**-0.729**0.843**-0.150 0.957**0.230 0.190 0.110 0.851**-0.733**1.000 0.100-0.872**-0.380 0.584*-0.090-0.330-0.170 1.000 0.070 0.020 0.340 0.868**-0.882**-0.420 0.050 1.000 0.190-0.170 0.370 0.010 0.634*-0.859**-0.300 1.000-0.190 0.110 0.360 0.330 0.614*-0.050-0.340 1.000 0.450-0.601*-0.280 0.711**0.170-0.723**0.760**1.000-0.783**0.440-0.944**-0.210 0.965**-0.551*-0.817**1.000 0.200-0.930**0.100 0.824**-0.730**-0.856**0.928**0.930**-0.460-0.470-0.669**0.050 0.340-0.875**-0.690**0.887**1.000
3 讨论
3.1 果实水分含量、硬度动态变化及差异分析
果实细胞壁结构、细胞壁组成物质、细胞间隙大小、内含物等多种因素共同决定果实硬度。对这些因素的综合分析可以更好地理解果实的质地特征。呼吸跃变型果实成熟时主要体现硬度变化的显著特征,而枣为典型的呼吸跃变型果实。果实质地是一个综合性状,反映了果实的内部结构状态以及在食用时所产生的直观感受[17]。在果实发育过程中木枣的水分含量呈线性下降,从白熟期的76.80%降至完熟后期的59.00%[18],本研究中的灰枣和冬枣硬度均呈持续下降趋势,这与前人的研究结果一致。果实在发育过程中灰枣和冬枣果实水分含量动态变化趋势相似,随着果实的发育,灰枣和冬枣果实S2 时期急剧增加,而后持续下降直至S5 时期达到最低值。由此表明,两个品种在果实发育过程中水分含量和硬度的动态变化差异性导致果实质地的差异。
3.2 果肉细胞显微及超显微结构变化及差异分析
前人研究认为植物细胞排列、大小和分布及细胞壁的厚薄与果实质地具有密不可分的关系[19]。自S2 时期开始,果实的细胞形状、轮廓以及排列方式均发生了显著的变化。结合细胞形态相关参数的结果分析,发现S2(花后63 d,即膨大期)时期细胞面积变化较显著。中国樱桃果实细胞形态相关参数显著变化的时期也是膨大期[20],与本研究结果一致。本研究结果表明,灰枣和冬枣在果实发育过程中细胞大小都表现出S2 时期前后迅速-缓慢增大的趋势,与果实硬度S2 时期前后快速-缓慢减小幅度相对应,由此表明影响果实硬度变化的重要因素之一是细胞大小,这与前人对葡萄果实发育过程中质地差异的细胞学研究相似[21]。可以推断果实硬度发生改变可能是由于果肉细胞大小改变,进一步影响细胞壁的相对含量、细胞间的接触面积和内容物含量的变化。在显微结构研究结果中,灰枣细胞排列与冬枣相比较紧密,一般认为排列越紧密的细胞,细胞间接触面积越大,果实越硬,这与本研究灰枣硬度高于冬枣相对应,有研究推测这可能与胞间果胶有关[22]。
果实细胞超微结构的变化在发育过程中是一个重要特征。果实细胞超微结构的变化与果实的硬度下降在发育过程中同时发生,并且可能相互关联。树莓(Rubus idaeus)成熟后期,中胶层电子密度降低,细胞壁变得不均一,细胞壁微纤丝变得松散无序[16]。番茄(Solanum lycopersicum)在果实成熟过程中也观察到细胞壁网络结构发生降解[23]。这与本研究结果一致,本研究中两个品种发育过程中果实细胞超显微结构逐渐溶解。由此表明,发育过程中果实细胞壁结构的变化影响果实质地。水分含量的增加可以促进枣果实发育成熟,在影响细胞膨大和增长、促进物质代谢、维持细胞壁稳定性以及调控植物激素等方面发挥作用[16]。本研究S2时期细胞内含物的密度降低,可能是枣果肉细胞水分含量增加造成的,这与前人的研究结果一致。冬枣果肉细胞内含物相较灰枣较多,且中胶层、内含物降解较慢,S4时期冬枣仍能观察到。两个品种果实细胞内含物、中胶层降解快慢可能是造成品种间果实质地差异的重要因素。因此,细胞破损不仅引发了细胞内部压力的下降,更直观地揭示了果肉质地变化的细胞学基础。
3.3 果肉细胞壁物质含量及细胞壁代谢酶活性分析
细胞壁结构和成分的改变是引起果实质地变化的主要原因,果实发育成熟期间,原果胶的降解以及纤维素的水解是导致果实质地变化的关键因素[24]。纤维素是果实细胞壁的骨架,在枣果实成熟过程中,纤维素含量与硬度变化呈显著相关[25]。在杏成熟过程中,纤维素含量逐渐降低,并且易软化的果实降解速率更高[10]。在玉露香梨果实发育过程中,共价结合型果胶含量呈现先升后降的变化趋势,纤维素含量呈先升后降再稳定的变化趋势[26]。在库尔勒香梨果实发育过程中,纤维素及半纤维素含量在进入快速生长期前上升而后下降,成熟期较平缓[27]。而笔者在本研究中的结果表明,两个枣品种果实发育过程中总果胶和纤维素含量呈先下降后平缓趋势。在细胞壁的结构物质中,总果胶和纤维素含量均与枣果实硬度动态变化有关,尤其是总果胶和纤维素含量在两个不同质地枣品种中差异较明显,这进一步表明了枣果实质地变化与总果胶和纤维素降解均有关系,是细胞壁组分解聚综合作用的结果。
细胞壁代谢酶在果实发育和成熟过程中的活性变化,直接影响了果实的质地特性[28]。笔者在本研究中发现,PG、PE和Cx酶活性在两个品种枣果实发育过程中动态变化趋势相反。在苹果早熟品种(系)中,PE 酶活性呈先下降后上升又下降的趋势[29],与本研究中冬枣PE活性的变化趋势一致。PG活性在猕猴桃的成熟软化过程中呈先上升后下降趋势[30]。本研究结果表明,在枣果实的成熟软化过程中,两个品种的PG 和PL 活性变化差异显著,这表明枣果实中果胶降解可能是PE、PG、PL等降解酶综合作用的结果。在桃果实成熟软化过程中,α-Af 活性在成熟前期变化平缓,而在成熟中后期明显上升[31]。研究结果表明,在枣果实的成熟软化过程中,两个品种的α-Af活性变化趋势相反,灰枣α-Af活性前期下降后期上升,而冬枣α-Af活性前期上升后期下降。在苹果果实发育过程中,4 个品种的PG、β-Gal、PL 活性逐渐升高[32]。本研究结果表明,在枣果实的成熟软化过程中,两个品种的β-Gal 活性变化趋势前期一致,均为先上升后下降。以上结果表明,果实细胞壁代谢酶活性在发育过程中,其活性变化趋势的不同是导致两个品种枣果实质地差异的重要原因之一,尤其两个品种中PG、α-Af活性变化趋势相反。
细胞壁组分含量与代谢酶活性之间存在极显著或显著相关性[33],这与本研究结果一致。本研究中两个品种枣果实总果胶含量与β-Gal、PL 活性均呈极显著负相关,纤维素含量与β-Gal、α-Af、PL 活性均呈极显著负相关;而灰枣总果胶含量与α-Af活性呈显著负相关;冬枣总果胶含量与PG活性呈极显著正相关。由此推测两个品种细胞壁组分含量与代谢酶活性之间不同的相关性造成质地差异。
4 结论
灰枣和冬枣质地品质的差异与细胞壁组分总果胶及纤维素含量、果肉细胞显微结构上不同有关;灰枣硬度持续高于冬枣,灰枣较冬枣果肉较紧实,硬度较高,而冬枣果肉较酥脆,硬度较低;冬枣和灰枣总果胶以及纤维素含量整体呈逐渐降低趋势,且冬枣一直低于灰枣。此外,灰枣和冬枣质地品质的差异还与细胞壁代谢相关酶β-Gal、α-Af、PL有关,PG在冬枣质地变化中也发挥关键作用。
[1] 刘孟军,王玖瑞. 新中国果树科学研究70年:枣[J]. 果树学报,2019,36(10):1369-1381.LIU Mengjun,WANG Jiurui. Fruit scientific research in New China in the past 70 years:Chinese jujube[J]. Journal of Fruit Science,2019,36(10):1369-1381.
[2] 付燕,杨芩,林炘.8 个蓝莓品种果实质地品质差异分析[J].中国南方果树,2023,52(3):144-148.FU Yan,YANG Qin,LIN Xin. Analysis of differences in fruit texture quality of eight blueberry varieties[J]. South China Fruits,2023,52(3):144-148.
[3] 连政,黄圆博,贾佳林,朴一龙,曹丽.不同采收期对软枣猕猴桃采后品质和细胞壁降解的影响[J].中国果树,2019(4):69-71.LIAN Zheng,HUANG Yuanbo,JIA Jialin,PIAO Yilong,CAO Li. Effects of different harvest time on postharvest quality and cell wall degradation of Actinidia argute[J]. China Fruits,2019(4):69-71.
[4] NIE P X,WANG X Y,HU L P,ZHANG H Y,ZHANG J X,ZHANG Z X,ZHANG L Y. The predominance of the apoplasmic phloem-unloading pathway is interrupted by a symplasmic pathway during Chinese jujube fruit development[J]. Plant &Cell Physiology,2010,51(6):1007-1018.
[5] 朱楠.枇杷采后果肉细胞非标记多组分同步成像及木质素特异性积累研究[D].杭州:浙江大学,2019.ZHU Nan.Study on cellular label-free multicomponent synchronous imaging of the flesh and the specific accumulation of lignin in postharvest loquat[D].Hangzhou:Zhejiang University,2019.
[6] 裘波音,林珲,张前荣,李永平,温庆放,朱海生,李大忠.苦瓜果实不同发育时期细胞壁组分及相关酶活性的差异分析[J].热带亚热带植物学报,2024,32(1):134-142.QIU Boyin,LIN Hui,ZHANG Qianrong,LI Yongping,WEN Qingfang,ZHU Haisheng,LI Dazhong. Differences of cell wall components and related enzyme activities in Momordica charantia fruits at different development stages[J]. Journal of Tropical and Subtropical Botany,2024,32(1):134-142.
[7] 高欢欢.红白果肉枇杷细胞壁代谢差异的生理分子机理[D].福州:福建农林大学,2020.GAO Huanhuan. Physiological and molecular mechanism of cell wall differential metabolism in loquat with red-fleshed and white-fleshed[D]. Fuzhou:Fujian Agriculture and Forestry University,2020.
[8] 雷琴,任小林.秦冠和富士苹果果实成熟过程中的质地变化特性[J].西北农业学报,2007,16(1):213-216.LEI Qin,REN Xiaolin. Characteristics of texture change with Qinguan and fuji apples during ripening[J]. Acta Agriculturae Boreali-Occidentalis Sinica,2007,16(1):213-216.
[9] KAN J,LIU J,JIN C H.Changes in cell walls during fruit ripening in Chinese‘Honey’peach[J]. The Journal of Horticultural Science&Biotechnology,2013,88(1):37-46.
[10] 李萍,廖康,赵世荣,安晓芹,刘娟,李楠,成小龙.杏果实发育成熟过程中细胞壁组分和水解酶活性的变化[J].新疆农业大学学报,2013,36(4):298-303.LI Ping,LIAO Kang,ZHAO Shirong,AN Xiaoqin,LIU Juan,LI Nan,CHENG Xiaolong.Variation of cell wall and hydrolases in apricot fruit during development and maturing process[J]. Journal of Xinjiang Agricultural University,2013,36(4):298-303.
[11] 刘周斌,毛莲珍,黄宇,戴云花,李紫瑜,欧立军.5 种不同基因型辣椒果实发育期品质变化[J].食品科学,2021,42(23):18-26.LIU Zhoubin,MAO Lianzhen,HUANG Yu,DAI Yunhua,LI Ziyu,OU Lijun. Changes of fruit quality in five different genotypes of pepper (Capsicum annuum L.) during development[J].Food Science,2021,42(23):18-26.
[12] 白牡丹,刘晓宇,杨盛,郝国伟,张晓伟,王燕平,付宝春.2 种优质梨果实质地差异的显微观察及与细胞壁代谢酶的相关性[J].福建农业学报,2023,38(8):917-923.BAI Mudan,LIU Xiaoyu,YANG Sheng,HAO Guowei,ZHANG Xiaowei,WANG Yanping,FU Baochun. Correlation with cell wall metabolizing-related enzymes and microstructure observation in texture differences of two kinds of high-quality pear fruit[J]. Fujian Journal of Agricultural Sciences,2023,38(8):917-923.
[13] 王倩,郏艳红,孙海波,吉立柱.不同耐贮性粉果番茄贮藏期间果实软化相关酶活性的研究[J].保鲜与加工,2020,20(1):72-77.WANG Qian,JIA Yanhong,SUN Haibo,JI Lizhu. Research on the activities of enzymes involved in fruits softening of pink tomato with different storage property during storage[J]. Storage and Process,2020,20(1):72-77.
[14] 侯聚敏.基于微观结构和模态分析的苹果质地研究[D].长春:吉林大学,2017.HOU Jumin. Research of apple texture based on microstructure and modal analysis[D].Changchun:Jilin University,2017.
[15] 南玉玉.不同质地苹果品种果实采后组织结构和生理变化的差异比较[D].杨凌:西北农林科技大学,2019.NAN Yuyu.Comparison of postharvest tissue structure and physiological changes of apple cultivars with different texture[D].Yangling:Northwest A&F University,2019.
[16] 杨国慧,王冰,谢娟,韩德果.树莓果实显微及超显微结构观察[J].湖北农业科学,2015,54(8):1919-1922.YANG Guohui,WANG Bing,XIE Juan,HAN Deguo. Observation on micro structure and ultra micro structure of raspberry fruit[J].Hubei Agricultural Sciences,2015,54(8):1919-1922.
[17] 薛晓芳,焦文丽,苏万龙,任海燕,王永康,石美娟,李登科,赵爱玲.枣种质资源果实质地品质特性分析[J].西北农业学报,2024,33(7):1318-1328.XUE Xiaofang,JIAO Wenli,SU Wanlong,REN Haiyan,WANG Yongkang,SHI Meijuan,LI Dengke,ZHAO Ailing.Characteristic analysis of fruit texture quality in jujube germplasm resources[J].Acta Agriculturae Boreali-Occidentalis Sinica,2024,33(7):1318-1328.
[18] 李欢. 枣果实成熟软化的细胞壁物质代谢及其基因表达研究[D].杨凌:西北农林科技大学,2017.LI Huan. The metabolism of cell wall materials and gene expression during fruit ripening and softening in Ziziphus jujuba Mill.[D].Yangling:Northwest A&F University,2017.
[19] 齐红岩,刘勇,衣宁宁,张建红.薄皮甜瓜组织结构、纤维素及果胶含量与果实感官品质的关系[J]. 中国蔬菜,2010(8):36-40.QI Hongyan,LIU Yong,YI Ningning,ZHANG Jianhong. Relationship between sensory quality of oriental sweet melon and its tissue structure,contents of cellulose and pulp pectin[J]. China Vegetables,2010(8):36-40.
[20] 马蓝.中国樱桃果实质地评价及质地变化关键基因挖掘[D].雅安:四川农业大学,2023.MA Lan. Evaluation of fruit texture of chinese cherry [Cerasus pseudocerasus (Lindl.) G. Don] and identification of key genes related to fruit texture changes during fruit development[D].Yaan:Sichuan Agricultural University,2023.
[21] 张雯,马依努尔·加马力,王敏,韩守安,谢辉,潘明启.不同葡萄品种果肉质地和细胞结构及生理指标分析[J].西北植物学报,2022,42(11):1870-1879.ZHANG Wen,Mayinur·Jiamali,WANG Min,HAN Shouan,XIE Hui,PAN Mingqi.Analysis on the flesh texture,cell architecture and its physiological characteristics of different grape varieties[J]. Acta Botanica Boreali-Occidentalia Sinica,2022,42(11):1870-1879.
[22] 陈瑶瑶,严良文,刘建汀,刘智成,余洁,郑作芸,朱海生.黄秋葵果实发育过程中细胞壁组成成分、糖代谢及相关酶活性的变化[J].江苏农业学报,2023,39(5):1217-1224.CHEN Yaoyao,YAN Liangwen,LIU Jianting,LIU Zhicheng,YU Jie,ZHENG Zuoyun,ZHU Haisheng. Developmental changes of okra fruits in cell wall composition,saccharometabolism and related enzymatic activities[J].Jiangsu Journal of Agricultural Sciences,2023,39(5):1217-1224.
[23] BALDAZZI V,GÉNARD M,BERTIN N. Cell division,endoreduplication and expansion processes:Setting the cell and organ control into an integrated model of tomato fruit development[J].Acta Horticulturae,2017(1182):257-264.
[24] 沈颖,李芳东,王玉霞,张序,李延菊,赵慧,张福兴.甜樱桃果实发育过程中细胞壁组分及其降解酶活性的变化[J].果树学报,2020,37(5):677-686.SHEN Ying,LI Fangdong,WANG Yuxia,ZHANG Xu,LI Yanju,ZHAO Hui,ZHANG Fuxing.A study on the variation of cell wall components and activities of their degradation enzymes in sweet cherry during fruit development[J]. Journal of Fruit Science,2020,37(5):677-686.
[25] 马永辉.灵武长枣细胞壁组分及细胞形态与硬度的多元统计分析研究[D].银川:宁夏大学,2022.MAYonghui.Multiple statistical analysis of cell wall components and cell morphology with hardness in Lingwu long jujube[D].Yinchuan:Ningxia University,2022.
[26] 杨盛,白牡丹,郝国伟,张晓伟,杜海燕,高鹏,郭黄萍.‘玉露香梨’果实发育中细胞壁组分和水解酶活性的变化[J].中国南方果树,2019,48(2):110-111.YANG Sheng,BAI Mudan,HAO Guowei,ZHANG Xiaowei,DU Haiyan,GAO Peng,GUO Huangping. Changes on cell wall components and hydrolase activity of‘Yulu Xiangli’pear during fruit developing[J]. South China Fruits,2019,48(2):110-111.
[27] 许娟,李疆,张校立,李鹏.‘库尔勒香梨’果实发育中细胞壁组分和水解酶活性的变化[J].果树学报,2015,32(6):1114-1117.XU Juan,LI Jiang,ZHANG Xiaoli,LI Peng. Variations of cell wall components and hydrolase activity of‘Korla fragrant pear’during the fruit developmental stage[J].Journal of Fruit Science,2015,32(6):1114-1117.
[28] 曾文芳,王小贝,潘磊,牛良,鲁振华,崔国朝,王志强.桃Aux/IAA 家族基因鉴定及在果实成熟过程中的表达分析[J].园艺学报,2017,44(2):233-244.ZENG Wenfang,WANG Xiaobei,PAN Lei,NIU Liang,LU Zhenhua,CUI Guochao,WANG Zhiqiang.Identification and expression profiling of Aux/IAA family gene during peach fruit ripening[J].Acta Horticulturae Sinica,2017,44(2):233-244.
[29] 李世军,尹宝颖,李佳,李中勇,张学英,徐继忠.早熟苹果果实软化过程中乙烯、相关酶及其基因表达变化[J].华北农学报,2019,34(6):104-109.LI Shijun,YIN Baoying,LI Jia,LI Zhongyong,ZHANG Xueying,XU Jizhong.Changes of ethylene,related enzymes and their genes expression during softening of premature apple fruits[J].Acta Agriculturae Boreali-Sinica,2019,34(6):104-109.
[30] HUANG W J,CHEN M Y,ZHAO T T,HAN F,ZHANG Q,LIU X L,JIANG C Y,ZHONG C H. Genome-wide identification and expression analysis of polygalacturonase gene family in kiwifruit (Actinidia chinensis) during fruit softening[J]. Plants,2020,9(3):327.
[31] 金昌海,阚娟,索标,汪志君,陆兆新,郁志芳.桃果实成熟软化过程中α-L-阿拉伯呋喃糖苷酶活性和乙烯合成相关因子的变化[J].食品科学,2006,27(1):61-64.JIN Changhai,KAN Juan,SUO Biao,WANG Zhijun,LU Zhaoxin,YU Zhifang. Changes of α-L-arabinofuranosidase activity and relevant factors of ethylene biosynthesis during peach ripening and softening[J].Food Science,2006,27(1):61-64.
[32] LI X L,SU Q F,JIA R J,WANG Z D,FU J H,GUO J H,YANG H J,ZHAO Z Y.Comparison of cell wall changes of two different types of apple cultivars during fruit development and ripening[J]. Journal of Integrative Agriculture,2023,22(9):2705-2718.
[33] FU C C,HAN Y C,QI X Y,SHAN W,CHEN J Y,LU W J,KUANG J F.Papaya CpERF9 acts as a transcriptional repressor of cell-wall-modifying genes CpPME1/2 and CpPG5 involved in fruit ripening[J].Plant Cell Reports,2016,35(11):2341-2352.