葡萄是世界性重要果树,因其适应性强、果实形态美观、多汁味美、营养价值高等特点而深受大众喜爱。随着人民生活水平的提高,消费者对葡萄外在和内在品质均提出了更高要求。葡萄果锈是果实遭受不良环境刺激产生的一种生理性病害,表现为果实表面呈现条状或不规则状黄褐色锈斑,严重时连成片,致使果实表皮形成木栓化组织[1-2],严重影响其外观品质和经济价值,该病在黄绿色葡萄品种上尤为凸显[3],在近年来中国大面积种植的阳光玫瑰葡萄品种上更为严重,成为降低其商品性的重要原因。
果锈是一层褐色的木栓化次生保护组织,果锈的形成主要是果皮角质的减少和木质素、木栓质的积累[4-6],木质素、酚类、芪类、木栓质等物质含量的变化与果锈的形成密切相关[5-7]。王慧等[8]在翠冠梨上的研究表明,果锈主要是破碎的角质膜、木质化加厚的表皮和亚表皮细胞以及果点上较易剥落的物质。还有研究表明,翠冠梨果锈的形成与角质(主要是C16-C18 ω-羟基脂肪酸)的减少和木栓质(包括阿魏酸、C19-C23 脂肪酸、C22-C26 脂肪醇、C16-C22 α,ω-二羧基脂肪酸、C22、C26 ω-羟基脂肪酸、α,ω-二羧酸和ω-羟基酸等)含量的增加有关[9-10]。与Reinders品种相比,Rugiada品种苹果(感锈品种)果锈果皮中的中链羟基脂肪酸(C16-9/10,16-DHFA)、末端羟基化脂肪酸(C16-ω-HFA)、环氧脂肪酸(C18:1-9,10-环氧-19-ω-HFA)含量降低,而C20-ω-HFAs、C22-ω-HFAs、饱和脂肪酸(C22:0 FA)及酚类、阿魏酸、苯甲酸、肉桂酸等代谢物的含量较高[11]。与金冠和Smoothee 苹果(非感锈品种)相比,Rugiada 苹果果皮中乌索酸、齐墩果酸含量显著降低,而三萜类(桦木酸、羽扇豆醇、桦木蛋白、咖啡酸三萜衍生物)、二氢查耳酮类、酚酸含量升高[12]。另外,果锈的发生与苯丙烷代谢、木质素合成、酚类物质代谢、脂肪酸合成、乙烯代谢、转录调节、细胞外聚合和运输等有关,与其代谢相关的苯丙氨酸解氨酶(PAL)、肉桂酸-4-羟化酶(C4H)、4-香豆酸-辅酶A连接酶(4CL)、过氧化物酶(POD)、肉桂醇脱氧酶(CAD)、多酚氧化酶(PPO)、过氧化氢酶(CAT)、咖啡酸-O-甲基转移酶、肉桂酰辅酶A 还原酶、白藜芦醇合成酶等的活性与果锈的形成相关[13-15]。在阳光玫瑰葡萄上的研究表明,赤霉酸和氯吡脲处理缓解阳光玫瑰葡萄果锈发生与果皮中白藜芦醇、总酚、木质素、咖啡酸、香豆酸、丁香酸等含量的下降及苯丙烷合成、类黄酮合成、苯丙氨酸代谢有关[16-17]。套袋降低阳光玫瑰葡萄果锈的发生主要是降低了果皮中木质素、酚类化合物及酚组分含量[18]。那么在相同管理条件下,有果锈与无果锈的葡萄果皮物质成分及相关酶活性发生怎样的变化呢?至今尚没有明确报道。代谢组学为研究代谢物及生物过程提供了很好的方法,因此,通过比较果锈发生过程中的代谢组学变化,有助于弄清哪些代谢物和生物过程在葡萄果锈形成中起关键作用。
因此,笔者在本研究中以无果锈、轻度果锈(果锈刚发生)和严重果锈(果锈发生后期)的阳光玫瑰葡萄果粒为对象,分析比较其果皮物质、相关酶活性及代谢组的变化,以期找出影响葡萄果锈形成的关键代谢物和生物过程,为探明葡萄果锈形成的机制奠定基础,也为果锈有效防治技术开发提供科学的指导建议。
1 材料和方法
1.1 试验材料
试验于2023年在河南现代农业研究开发基地(35.00°N、113.07°E)进行。以6年生阳光玫瑰葡萄植株为试材,自根砧,南北行向,株行距1.5 m×3.0 m,高宽平架式,简易避雨栽培。花果和肥水管理参考娄玉穗等[19]的方法,于见花时修整花穗,留穗尖6 cm,盛花后1~3 d(5月11—13日)分批次用25 mg·L-1 赤霉酸(GA3)+2 mg·L-1氯吡脲(CPPU)进行保花保果处理,2周后用25 mg·L-1 GA3+2 mg·L-1 CPPU进行膨大处理。在果粒黄豆粒大小时疏果至60粒左右,控制单穗质量700 g左右。
1.2 样品采集
在果实成熟期(8 月21 日),采集无果锈和有果锈的果粒样品,按照果锈发生程度分成无果锈(NR,no russet)、轻度果锈(MR,mild russet,果锈面积<10%且果锈颜色浅)和重度果锈(SR,severe russet,果锈面积≥25%且果锈颜色深)3 组(图1)。先用刀片划出取样部位(无果锈样品划出表皮光滑、无斑点部位,轻度果锈和重度果锈样品划出有果锈部位),然后用镊子分别夹取3 组果皮样品,置于液氮中快速冷冻,带回实验室用于以下指标的测定。

图1 不同果锈程度的阳光玫瑰葡萄果粒样品
Fig.1 Berry samples of different russet levels in Shine Muscat grape
图中红线框内为取样部位。
The red box in the picture represents the sampling location.
1.3 果皮物质含量、相关酶活性的测定
1.3.1 果皮物质含量检测 叶绿素含量采用分光光度法测定,纤维素含量采用蒽酮比色法测定,半纤维素含量采用酶解法测定,总果胶含量采用咔唑比色法测定,木质素含量采用乙酰化法测定,总酚含量采用福林酚法测定,总黄酮含量采用NaNO2-Al(NO3)3-NaOH显色法测定。
1.3.2 果皮相关酶活性测定 过氧化物酶活性采用愈创木酚法测定,多酚氧化酶活性采用邻苯二酚法测定,苯丙氨酸解氨酶活性、肉桂酸4-羟基化酶活性、4-香豆酸:辅酶A 连接酶活性、肉桂醇脱氢酶活性和过氧化氢酶活性采用分光光度法测定。
1.3.3 数据处理 试验数据用SPSS 20软件进行统计分析。
1.4 果皮广泛靶向代谢组检测与分析
1.4.1 样品提取 将样品置于冻干机(Scientz-100F)中真空冷冻干燥,研磨仪(MM 400,Retsch)研磨(30 Hz,1.5 min)至粉末状,用电子天平(MS105DM)称取50 mg 粉末,加入1200 μL-20 ℃预冷的70%甲醇内标提取液中,每30 min 涡旋一次,每次持续30 s,共涡旋6次;然后在12 000 r·min-1下离心3 min,取上清液,用微孔滤膜(0.22µm)过滤样品,保存于进样瓶中,用于超效液相色谱-质谱联用(UPLC-MS/MS)分析。
1.4.2 UPLC-MS/MS 采集条件 液相条件:色谱柱为Agilent SB-C18(2.1 mm×100 mm,1.8µm);流动相:A 相为超纯水(加入0.1%甲酸),B 相为乙腈(加入0.1%甲酸);洗脱梯度:0 min B相比例为5%,9 min内B 相比例线性增加到95%,并维持在95%1 min,10~11 min B相比例降为5%,并以5%平衡至14 min;流速0.35 mL·min-1;柱温40 ℃;进样量2 μL。质谱条件:电喷雾离子源(ESI)温度550 ℃;离子喷雾电压(IS)5500 V(正离子模式)/-4500 V(负离子模式);离子源气体Ⅰ(GSⅠ)、气体Ⅱ(GSⅡ)和气帘气(CUR)分别设置为50、60和25 psi,碰撞诱导电离参数设置为高。三重四级杆(QQQ)扫描使用MRM模式,并将碰撞气体(氮气)设置为中等。通过进一步的去簇电压(DP)和碰撞能(CE)优化,完成了各个MRM 离子对的DP 和CE。根据每个时期内洗脱的代谢物,在每个时期监测一组特定的MRM离子对。
1.4.3 代谢物定性与定量分析 代谢物的定性基于武汉迈维生物技术有限公司自建数据库(Metware database,MWDB)及代谢物信息公共数据库,根据二级谱信息进行物质定性,分析去除同位素信号和重复信号。代谢物定量分析利用三重四级杆质谱的多反应监测模式(multiple reaction monitoring,MRM)分析完成。利用软件Analyst 1.6.3 处理质谱数据。根据代谢物保留时间与峰型信息,对每个代谢物在不同样本中检测到的质谱峰进行校正,以确保定性定量的准确。
1.4.4 数据分析 将代谢物数据进行无监督的主成分分析(principal component analysis,PCA)和有监督的正交偏最小二乘法判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA),以观察分组之间和组内样本之间的变异度大小。根据获得的多变量分析OPLS-DA 模型的变量重要性投影VIP 值(variable importance in projection,VIP>1)和差异倍数值(fold change≥2 和fold change≤0.5,FC)筛选差异代谢物。将差异代谢物映射到KEGG 数据库和Metware database 中进行注释,根据注释结果,按照通路中的类型进行分类。
2 结果与分析
2.1 不同果锈程度的阳光玫瑰葡萄果皮物质含量
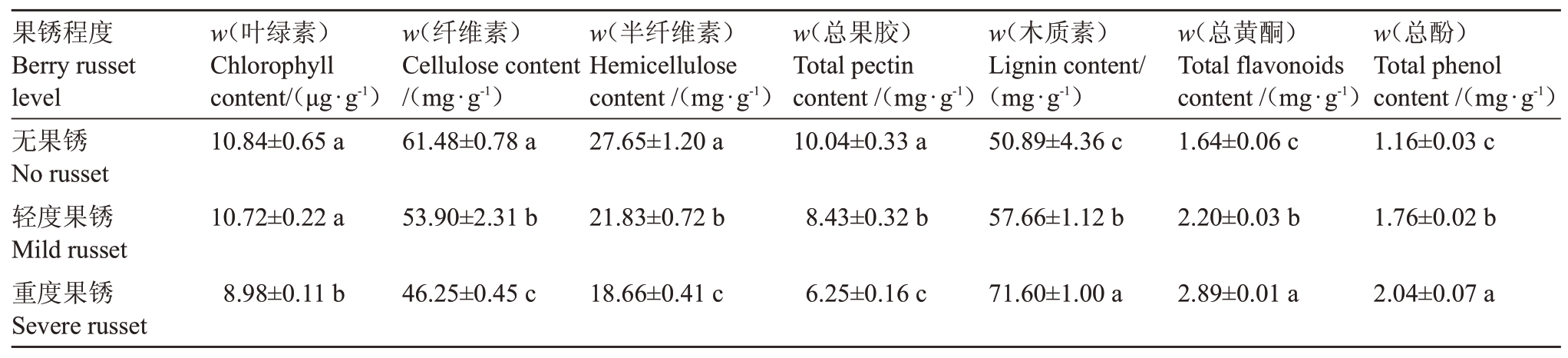
由表1可知,随着果锈程度的增加,阳光玫瑰葡萄果皮的叶绿素、纤维素、半纤维素和总果胶含量逐渐降低,而木质素、总黄酮和总酚含量逐渐增加。其中,无果锈和轻度果锈的果皮叶绿素含量之间差异不显著,且均显著高于重度果锈果皮。无果锈、轻度果锈和重度果锈果皮的纤维素、半纤维和总果胶含量之间差异均显著,重度果锈果皮的纤维素含量为46.25 mg·g-1。无果锈、轻度果锈和重度果锈果皮的木质素、总黄酮和总酚含量之间差异也均显著,且重度果锈果皮的木质素、总黄酮和总酚含量分别为71.60、2.89和2.04 mg·g-1。
表1 不同果锈程度的阳光玫瑰葡萄果皮物质含量
Table 1 Substances content of peel in different berry russet levels in Shine Muscat grape
注:表中数据为平均值±标准差,数值后不同小写字母表示同一列中不同果锈程度之间差异显著(p<0.05)。下同。
Note:The data in the table are means±standard deviation.Different small letters indicate significant difference among different berry russet levels in the same column at 0.05 level.The same below.
果锈程度Berry russet level无果锈No russet轻度果锈Mild russet重度果锈Severe russet w(叶绿素)Chlorophyll content/(μg·g-1)10.84±0.65 a w(纤维素)Cellulose content/(mg·g-1)61.48±0.78 a w(半纤维素)Hemicellulose content/(mg·g-1)27.65±1.20 a w(总果胶)Total pectin content/(mg·g-1)10.04±0.33 a w(木质素)Lignin content/(mg·g-1)50.89±4.36 c w(总黄酮)Total flavonoids content/(mg·g-1)1.64±0.06 c w(总酚)Total phenol content/(mg·g-1)1.16±0.03 c 10.72±0.22 a 53.90±2.31 b 21.83±0.72 b 8.43±0.32 b 57.66±1.12 b 2.20±0.03 b 1.76±0.02 b 8.98±0.11 b 46.25±0.45 c 18.66±0.41 c 6.25±0.16 c 71.60±1.00 a 2.89±0.01 a 2.04±0.07 a
2.2 不同果锈程度的阳光玫瑰葡萄果皮相关酶活性
由表2可知,随着果锈程度的增加,阳光玫瑰葡萄果皮的过氧化物酶、多酚氧化酶、苯丙氨酸解氨酶、肉桂醇脱氢酶、4-香豆酸:辅酶A 连接酶的活性逐渐增高,而过氧化氢酶活性先升高后降低,肉桂酸-4-羟基化酶活性先降低后升高。轻度果锈和重度果锈果皮的过氧化氢酶活性分别为88.37 U·g-1和84.16 U·g-1,两者之间差异不显著,且均显著高于无果锈果皮。重度果锈、轻度果锈和无果锈果皮的过氧化物酶、多酚氧化酶、4-香豆酸:辅酶A 连接酶的活性之间差异均显著。轻度果锈和无果锈果皮的苯丙氨酸解氨酶、肉桂醇脱氢酶和肉桂酸-4-羟基化酶的活性之间差异不显著,但重度果锈果皮的这3 种酶活性显著高于轻度果锈和无果锈果皮。
表2 不同果锈程度的阳光玫瑰葡萄果皮相关酶活性
Table 2 Related enzyme activities of different berry russet levels in Shine Muscat grape peel
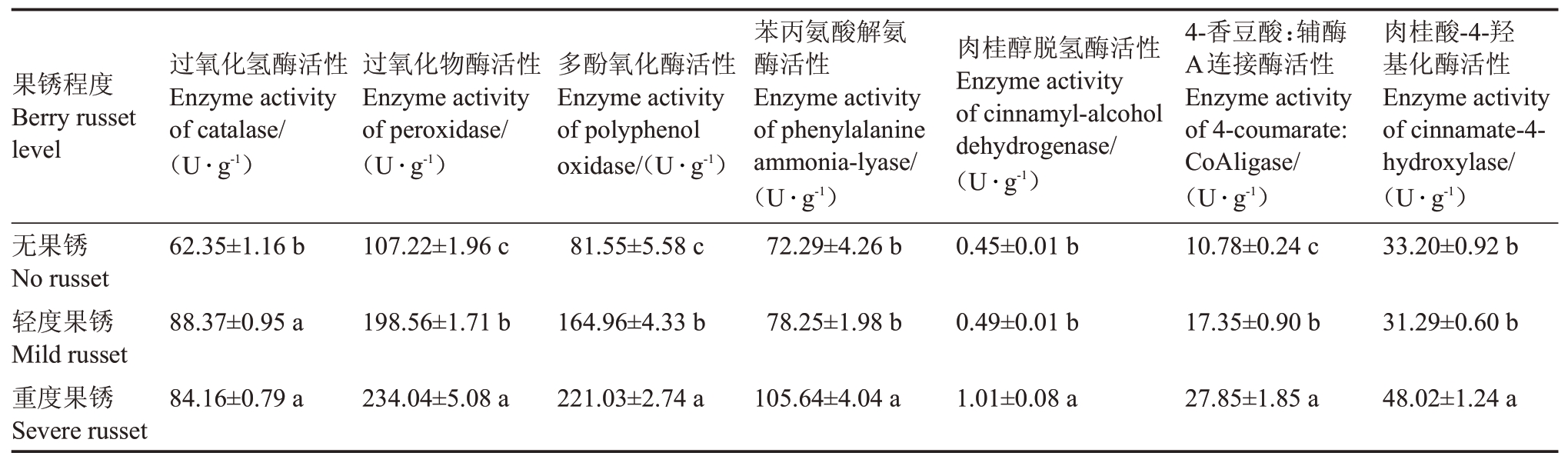
果锈程度Berry russet level过氧化氢酶活性Enzyme activity of catalase/(U·g-1)过氧化物酶活性Enzyme activity of peroxidase/(U·g-1)多酚氧化酶活性Enzyme activity of polyphenol oxidase/(U·g-1)肉桂醇脱氢酶活性Enzyme activity of cinnamyl-alcohol dehydrogenase/(U·g-1)无果锈No russet轻度果锈Mild russet重度果锈Severe russet 62.35±1.16 b 107.22±1.96 c 81.55±5.58 c苯丙氨酸解氨酶活性Enzyme activity of phenylalanine ammonia-lyase/(U·g-1)72.29±4.26 b 0.45±0.01 b 4-香豆酸:辅酶A连接酶活性Enzyme activity of 4-coumarate:CoAligase/(U·g-1)10.78±0.24 c肉桂酸-4-羟基化酶活性Enzyme activity of cinnamate-4-hydroxylase/(U·g-1)33.20±0.92 b 88.37±0.95 a 198.56±1.71 b 164.96±4.33 b 78.25±1.98 b 0.49±0.01 b 17.35±0.90 b 31.29±0.60 b 84.16±0.79 a 234.04±5.08 a 221.03±2.74 a 105.64±4.04 a 1.01±0.08 a 27.85±1.85 a 48.02±1.24 a
2.3 不同果锈程度的阳光玫瑰葡萄果皮代谢组成分总体分析
不同果锈程度的阳光玫瑰葡萄果皮经UPLCMS/MS 分析,共鉴定出1372 种代谢物,按照物质一级分类属于13 类、二级分类属于52 类(表3),包括270 种黄酮、223 种萜类、188 种其他类、163 种酚酸类、127 种氨基酸及其衍生物、115 种脂质、106 种生物碱、53种木脂素和香豆素、37种有机酸、36种核苷酸及其衍生物、29种鞣质、15种醌类、10种甾体。其中,与无果锈相比,轻度果锈上调代谢物有690 种,下调代谢物有682种;与轻度果锈相比,重度果锈上调代谢物有920 种,下调代谢物有452种;与无果锈相比,重度果锈上调代谢物有835种,下调代谢物有537种。
表3 不同果锈程度的阳光玫瑰葡萄果皮代谢物种类与数量
Table 3 Class and number of metabolites in different berry russet levels of Shine Muscat grape peel
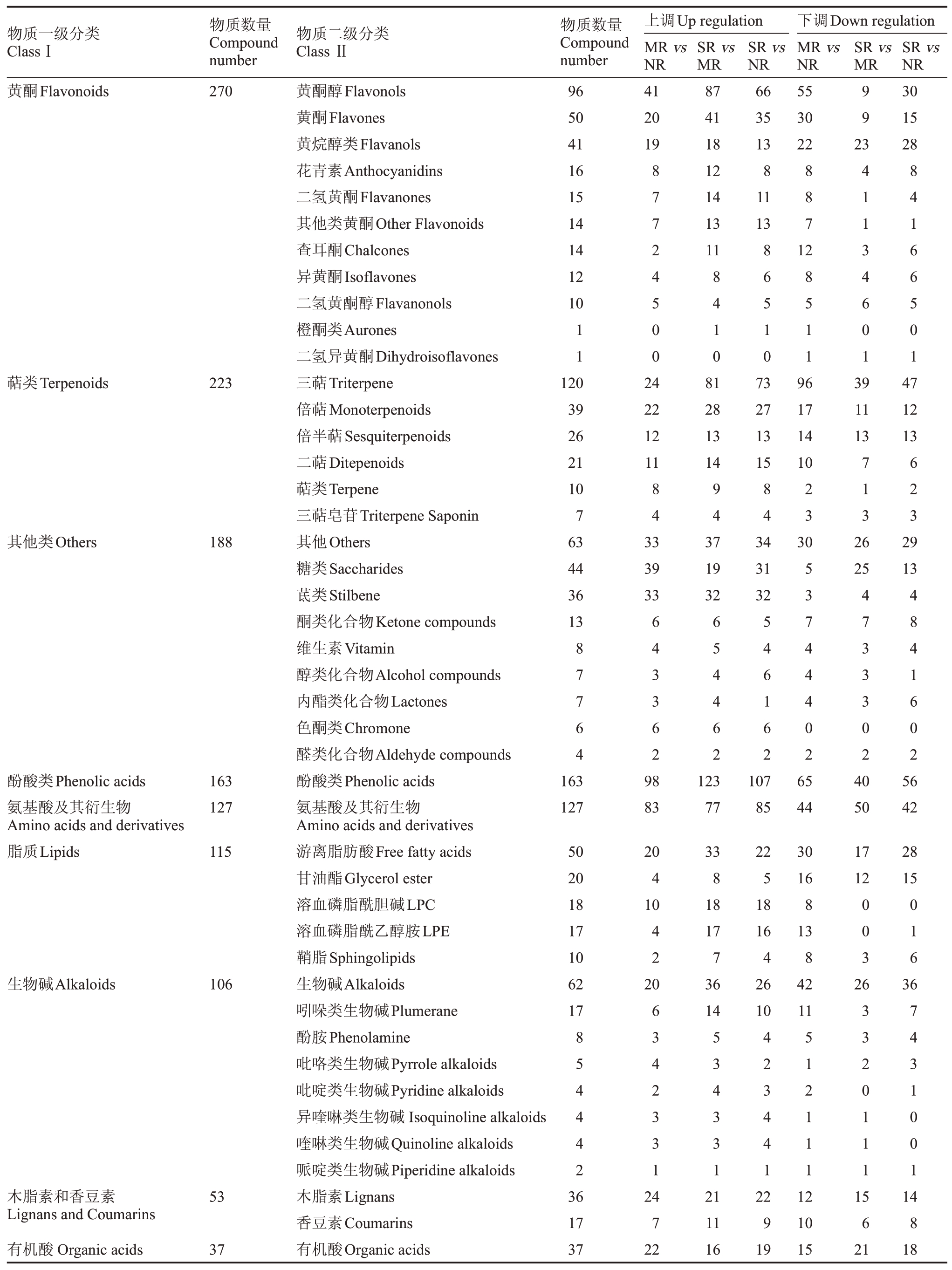
物质一级分类ClassⅠ物质数量Compound number物质二级分类Class Ⅱ物质数量Compound number上调Up regulation MR vs NR SR vs MR SR vs NR下调Down regulation MR vs NR SR vs MR SR vs NR黄酮Flavonoids 27096 50 41 16 15 14 14 12 10 41 20 19黄酮醇Flavonols黄酮Flavones黄烷醇类Flavanols花青素Anthocyanidins二氢黄酮Flavanones其他类黄酮Other Flavonoids查耳酮Chalcones异黄酮Isoflavones二氢黄酮醇Flavanonols橙酮类Aurones二氢异黄酮Dihydroisoflavones三萜Triterpene倍萜Monoterpenoids倍半萜Sesquiterpenoids二萜Ditepenoids萜类Terpene三萜皂苷Triterpene Saponin其他Others糖类Saccharides茋类Stilbene酮类化合物Ketone compounds维生素Vitamin醇类化合物Alcohol compounds内酯类化合物Lactones色酮类Chromone醛类化合物Aldehyde compounds酚酸类Phenolic acids氨基酸及其衍生物Amino acids and derivatives游离脂肪酸Free fatty acids甘油酯Glycerol ester溶血磷脂酰胆碱LPC溶血磷脂酰乙醇胺LPE鞘脂Sphingolipids生物碱Alkaloids吲哚类生物碱Plumerane酚胺Phenolamine吡咯类生物碱Pyrrole alkaloids吡啶类生物碱Pyridine alkaloids异喹啉类生物碱Isoquinoline alkaloids喹啉类生物碱Quinoline alkaloids哌啶类生物碱Piperidine alkaloids木脂素Lignans香豆素Coumarins有机酸Organic acids 87 41 18 12 14 13 11 66 35 13 8 11 13 55 30 22 99 23 30 15 28 87724500 887 86510 12 11 8410 8511 41134601 84166501萜类Terpenoids 223 24 22 12 11 81 28 13 14 120 39 26 21 10 7 63 44 36 13 73 27 13 15 96 17 14 10 39 11 13 47 12 13 84 94 84 23 713 623其他类Others 188 33 39 33 37 19 32 34 31 32 30 26 25 29 13 87764 643362 654462 546162 53744402 4733302 4841602酚酸类Phenolic acids氨基酸及其衍生物Amino acids and derivatives脂质Lipids 163 127 163 127 98 83 123 77 107 85 65 44 40 50 56 42 115 20 4 10 17 12 50 20 18 17 10 62 17 28 15 42 003 016生物碱Alkaloids 106 20 33 8 18 17 7 36 14 22 5 18 16 4 26 10 30 16 8 13 8 42 11 26 36 854442 6342331 534331 423441 512111 3320111 7431001木脂素和香豆素Lignans and Coumarins有机酸Organic acids 53 37 36 17 37 24 7 22 21 11 16 22 9 19 12 10 15 15 6 21 14 8 18
表3 (续) Table 3 (Continued)
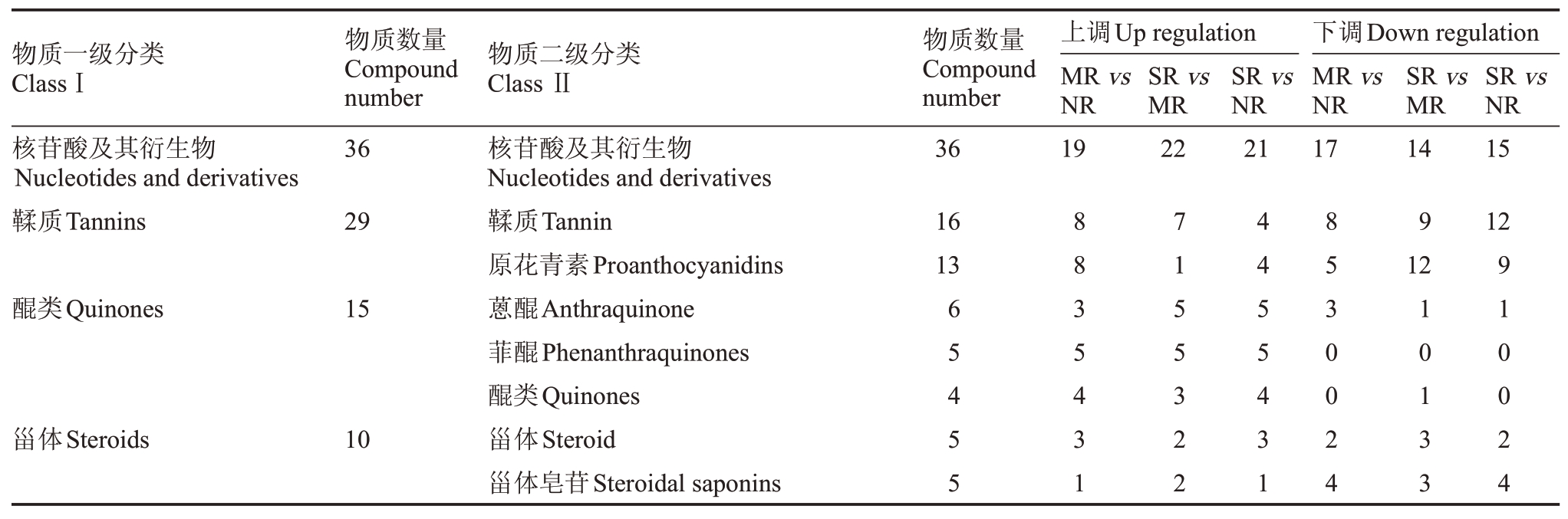
物质一级分类ClassⅠ物质数量Compound number物质二级分类Class Ⅱ物质数量Compound number上调Up regulation MR vs NR SR vs MR SR vs NR下调Down regulation MR vs NR SR vs MR SR vs NR核苷酸及其衍生物Nucleotides and derivatives鞣质Tannins 36 36 19 22 21 17 14 15 29 16 13 9 12核苷酸及其衍生物Nucleotides and derivatives鞣质Tannin原花青素Proanthocyanidins蒽醌Anthraquinone菲醌Phenanthraquinones醌类Quinones甾体Steroid甾体皂苷Steroidal saponins 8835431 7155322 4455431 8530024 12醌类Quinones 15甾体Steroids 10 65455 10133 910024
2.4 不同果锈程度的阳光玫瑰葡萄果皮代谢组学差异分析
2.4.1 主成分分析 通过对样本进行主成分分析,初步了解不同果锈程度阳光玫瑰葡萄果皮的总体代谢组差异和组内样本之间的变异度大小。由图2可知,PCA 分析结果得到13 个主成分,其中主成分1(PC1)的贡献率为41.20%,主成分2(PC2)的贡献率为18.84%,且3 组样本在二维图上表现出明显的分离趋势,从总体上反映出3 组样品之间的代谢物差异。
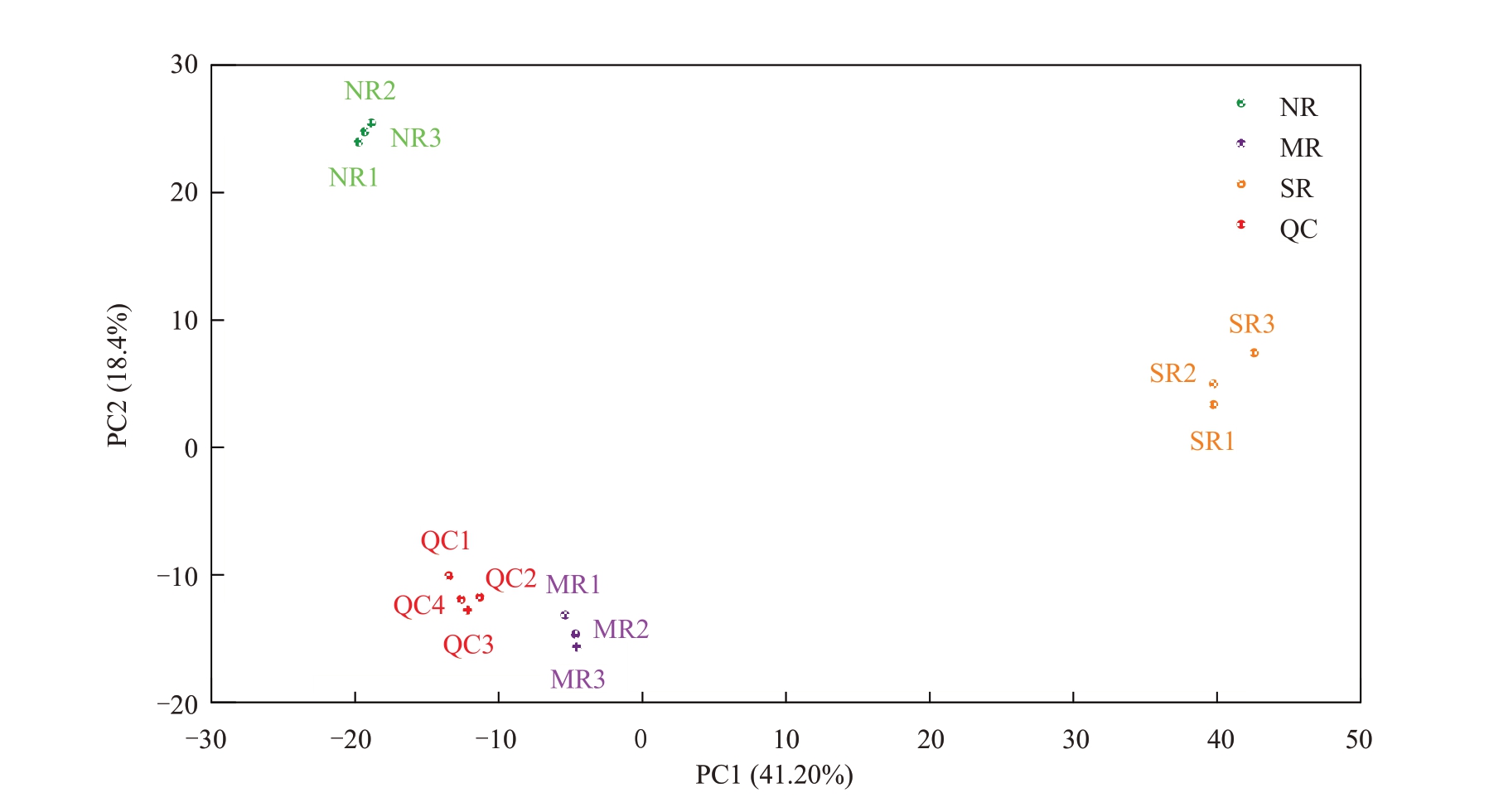
图2 不同果锈程度的阳光玫瑰葡萄果皮样本及质控的PCA 结果
Fig.2 PCA results of different berry russet levels in Shine Muscat grape and quality control
2.4.2 差异代谢物筛选 不同程度果锈的阳光玫瑰葡萄果皮差异代谢物有485种,其中,轻度果锈与无果锈果皮间显著差异的代谢物有247 种,显著下调代谢物有65种,显著上调代谢物有182种;重度果锈与轻度果锈果皮间显著差异的代谢物有287 种,显著下调代谢物有31种,显著上调代谢物有256种;重度果锈与无果锈果皮间显著差异的代谢物有386种,显著下调代谢物有65种,显著上调代谢物有321种(表4)。对3组差异代谢物进行韦恩图分析,发现3组中共有的差异代谢物有110种(图3)。
表4 不同果锈程度的阳光玫瑰葡萄果皮显著差异代谢物数量
Table 4 Numbers of significant differential metabolites of different berry russet levels in Shine Muscat grape peel
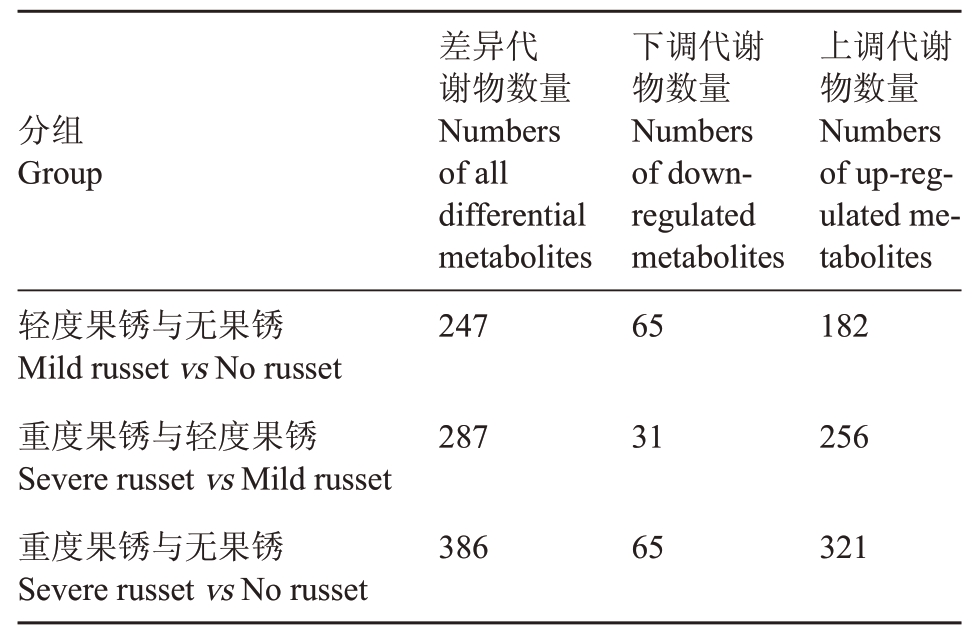
分组Group轻度果锈与无果锈Mild russet vs No russet重度果锈与轻度果锈Severe russet vs Mild russet重度果锈与无果锈Severe russet vs No russet差异代谢物数量Numbers of all differential metabolites 247下调代谢物数量Numbers of downregulated metabolites 65上调代谢物数量Numbers of up-regulated metabolites 182 287 31 256 386 65 321

图3 不同果锈程度的阳光玫瑰葡萄果皮组间共同差异代谢物韦恩图
Fig.3 Common differential metabolites Wayne diagram between groups of different berry russet levels in Shine Muscat grape berry peel
2.4.3 差异代谢物热图分析 如图4所示,对3组中共有的110种差异代谢物进行热图分析,发现有105种差异代谢物在3 组中均上调表达,占所有差异代谢物的95.45%,包括37种酚酸类、31种黄酮(1种异黄酮、2种其他类黄酮、1种黄烷醇类、19种黄酮醇、4种黄酮、2种花青素、2种二氢黄酮)、22种其他类(包括17种茋类、1种色酮类和4种其他)、5种醌类(2种醌类、3种菲醌)、3种萜类(2种三萜皂苷、1种倍萜)、3 种氨基酸及其衍生物、2 种木脂素和香豆素(木脂素)、1 种生物碱和1 种鞣质(原花青素);2 种在3 组中均下调表达,包括1种脂质(4-羟基鞘氨醇)和1种核苷酸及其衍生物(N6-异戊烯腺嘌呤);3种黄酮类物质(1 种黄酮、1 种查耳酮、1 种黄酮醇)在MR 与NR 中下调表达,在SR 与MR 和SR 与NR 中均上调表达。

图4 不同果锈程度的阳光玫瑰葡萄果皮组间共同差异代谢物热图
Fig. 4 The heat map of common differential metabolites between groups of different berry russet levels in Shine Muscat grape berry peel
2.4.4 差异代谢物通路分析 通过KEGG数据库和MetMap 数据库对差异代谢物质进行通路富集分析,结果以气泡图的形式展现,气泡代表代谢通路,气泡所在横坐标和气泡大小表示影响值,气泡越大,表示通路越重要;纵坐标和气泡颜色表示富集分析的P 值,颜色越深,P 值越小,富集程度越显著。由图5 可知,上述110 种差异代谢物质中有33 种被注释到17条代谢途径中,其中,被注释到山柰酚苷元Ⅱ的生物合成(biosynthesis of kaempferol aglycones Ⅱ)有6种,被注释到山柰酚苷元Ⅰ的生物合成(biosynthesis of kaempferol aglyconesⅠ)和次生代谢物的生物合成(biosynthesis of secondary metabolites)各有4种,被注释到代谢途径(metabolic pathways)有3种,被注释到槲皮素苷元Ⅰ的生物合成(biosynthesis of quercetin aglyconesⅠ),二苯乙烯、二芳基庚烷和姜酚的生物合成(stilbenoid,diarylheptanoid and gingerol biosynthesis)和酪氨酸代谢(tyrosine metabolism)各有2 种,被注释到花青素的生物合成(anthocyanin biosynthesis)、槲皮素苷元Ⅱ的生物合成(biosynthesis of quercetin aglycones Ⅱ)、槲皮素苷元Ⅲ的生物合成(biosynthesis of quercetin aglycones Ⅲ)、黄酮和黄酮醇的生物合成(flavone and flavonol biosynthesis)、糖酵解/糖异生(glycolysis/gluconeogenesis)、泛醌和其他萜类醌的生物合成(ubiquinone and other terpenoid-quinone biosynthesis)、辅因子的生物合成(biosynthesis of cofactors)、鞘脂代谢(sphingolipid metabolism)、玉米素的生物合成(Zeatin biosynthesis)、植物激素信号转导(plant hormone signal transduction)各有1种。以上结果说明阳光玫瑰葡萄果锈发生对山柰酚苷元Ⅱ的生物合成的影响最显著。
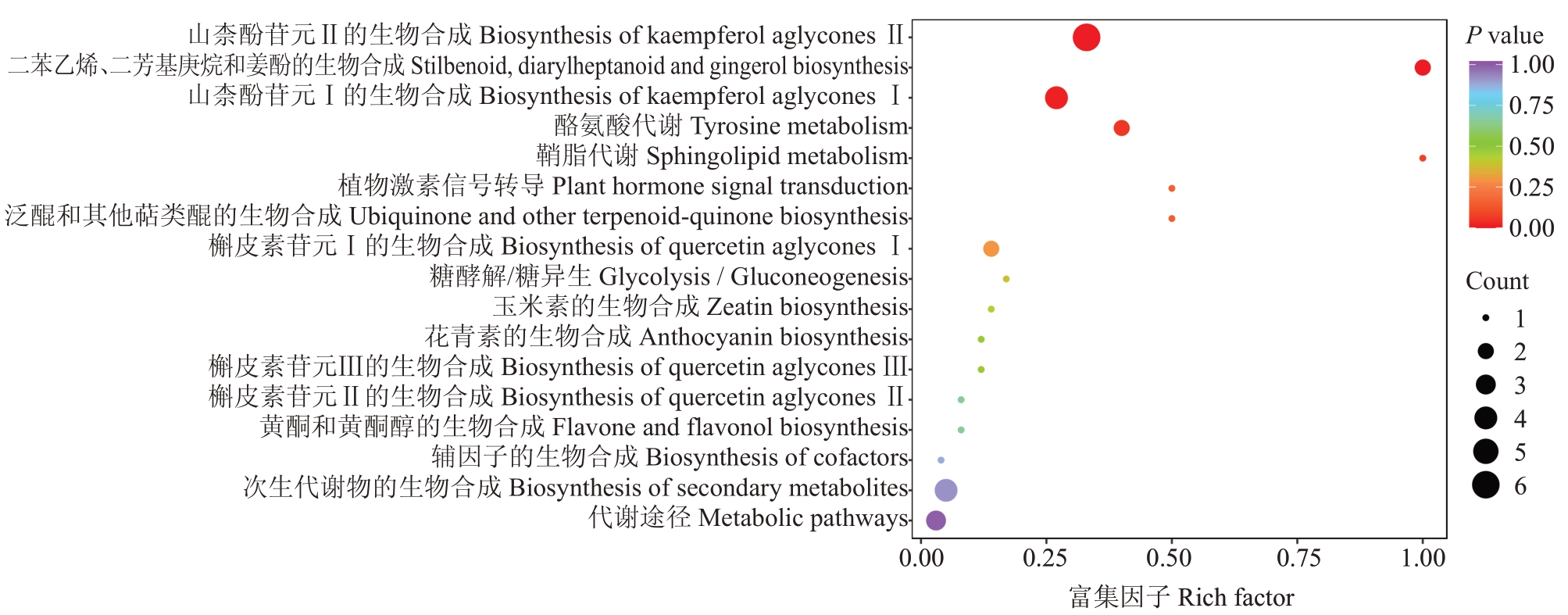
图5 不同果锈程度的阳光玫瑰葡萄果皮组间差异代谢物的KEGG 富集图
Fig.5 Differential metabolite KEGG enrichment map of Shine Muscat grape berry peel of different berry russet levels
2.4.5 山柰酚苷元Ⅱ的生物合成途径分析 如图6所示,在山柰酚苷元Ⅱ的生物合成途径中,被注释到的6种差异代谢物均属于黄酮类,其中,6-羟基山柰酚-3,7,6-O-三葡萄糖苷(6-hydroxykaempferol-3,7,6-O-triglycoside)、6-羟基山柰酚-7,6-O-二葡萄糖苷(6-hydroxykaempferol-7,6-O-diglucoside)、6-羟基山柰酚-3,6-O-二葡萄糖苷(6-hydroxykaempferol-3,6-Odiglucoside)、6-羟基山柰酚-3,6-O-二葡萄糖苷-7-O-葡萄糖醛酸(6-hydroxykaempferol-3,6-O-diglucoside-7-O-glucuronic acid)和6-甲氧基山柰酚-3-O-葡萄糖苷(6-methoxykaempferol-3-O-glucoside)在3 组中均上调表达,而山柰酚-4'-O-葡萄糖苷(kaempferol-4'-O-glucoside)在MR与NR中下调表达,在SR与MR和SR与NR中均上调表达。
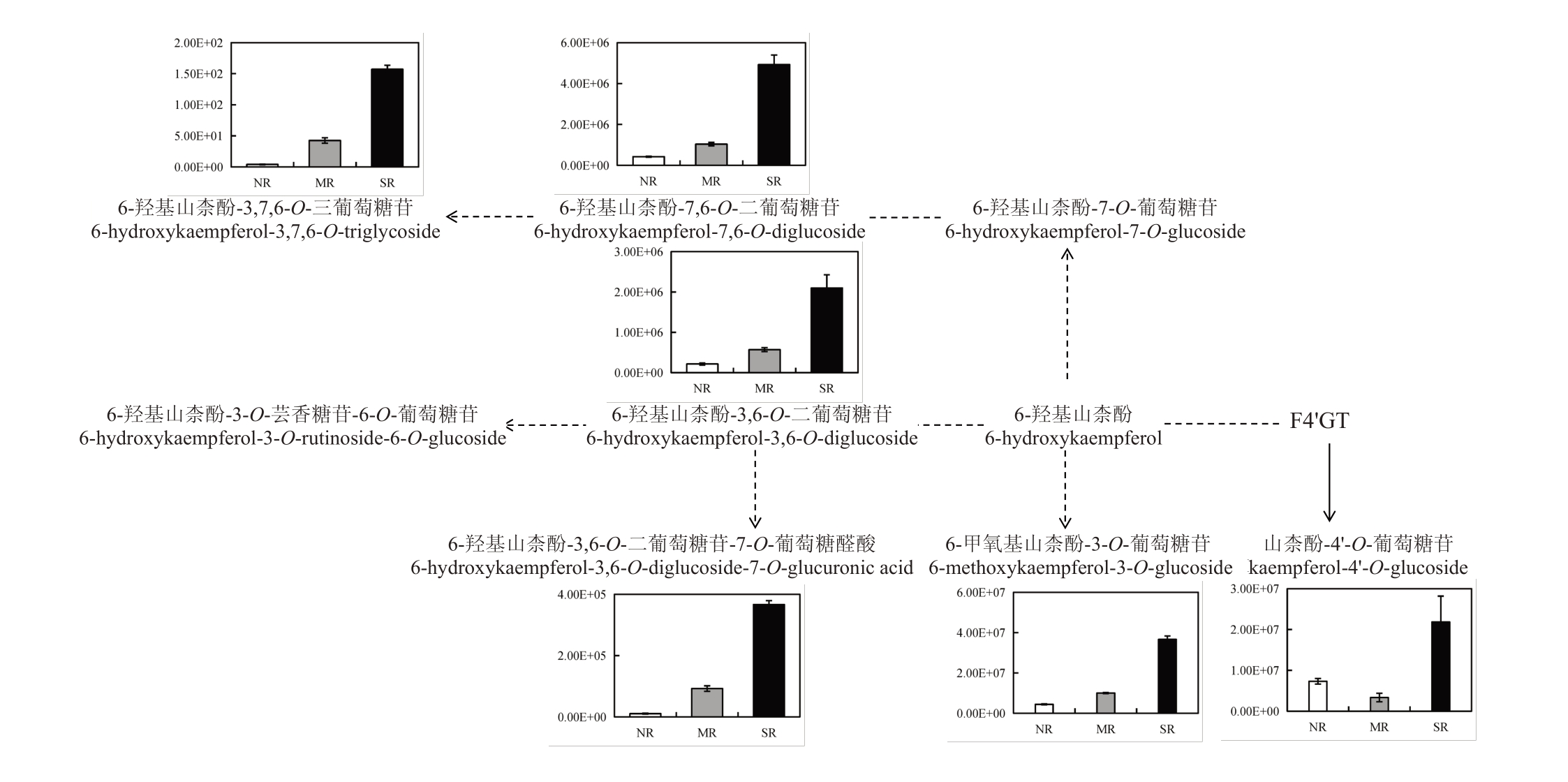
图6 部分山柰酚苷元Ⅱ的生物合成途径
Fig.6 Part of the biosynthesis of kaempferol aglycones Ⅱ
3 讨论
果锈是果实发育过程中的一种生理紊乱现象,黄绿色的葡萄、苹果、梨等更容易发生果锈,如阳光玫瑰葡萄、金冠苹果、翠冠梨等[1,4,8],成为降低其商品性的重要原因。生产上常用套袋、植物生长调节剂处理、施钙肥等方法来降低果锈的发生[3,16-18],而这些方法只能在一定程度上起作用,还不能完全解决果锈发生的问题,究其原因是还没有完全掌握果锈的发生机制。
叶绿素是果实发育早期的主要呈色色素,随着果实的发育,葡萄果皮呈现出典型的叶绿素降解特征[20]。在本研究中,发生果锈的阳光玫瑰葡萄果皮呈黄褐色,且随着果锈程度的增加,果锈颜色越深,叶绿素含量越低,只有重度果锈的果皮叶绿素含量显著低于无果锈果皮,说明轻度果锈的果皮叶绿体还没有遭到严重破坏。植物细胞壁分为初生壁与次生壁,初生壁主要由纤维素、半纤维素、果胶和糖蛋白组成;次生壁主要由纤维素、半纤维素和木质素组成,因此,纤维素、半纤维素、果胶和木质素含量对维持细胞壁的稳定性具有重要作用[21]。黄艳等[18]的研究表明,阳光玫瑰葡萄有锈果皮的角质层细胞不明显,角质膜结构被破坏,表皮蜡质层相对稀疏,表皮细胞壁次生加厚,木质素和总酚含量显著提高。笔者在本研究中的结果与其相似,随着果锈发生程度的增加,果皮中的纤维素、半纤维素和总果胶含量逐渐降低,木质素、总黄酮和总酚含量逐渐升高,且无果锈、轻度果锈和重度果锈的这些指标之间差异显著,说明果锈一经发生,果皮的细胞壁结构就遭到破坏,次生细胞壁加厚。
研究表明,果锈的发生主要是次生代谢的结果[13-14],与苯丙烷代谢、木质素合成、酚类物质代谢、脂肪酸合成等有关,与其代谢相关的PAL、C4H、4CL、POD、CAD、PPO、CAT等的活性与果锈的形成有关[13-15]。李晶[22]的研究表明,维纳斯黄金苹果果锈指数与果实PAL、PPO、4CL、C4H 的活性呈负相关,与POD、CAD、CCR的活性呈正相关;华金苹果果锈指数与PAL、PPO、CAD、CCR、C4H 的活性呈负相关,与POD、4CL的活性呈正相关。刘鹿宁等[23]的研究表明,琯溪蜜柚果实汁胞粒化过程中与木质素合成相关酶PAL、C4H、4CL、CAD、PPO的活性明显上升,木质素含量显著积累。在本研究中,随着果锈程度的增加,阳光玫瑰葡萄果皮的POD、PPO、PAL、CAD、4CL 的活性逐渐升高,而CAD 活性先升高后降低,C4H活性先降低后升高,说明阳光玫瑰葡萄果锈发生与POD、PPO、PAL、CAD、4CL的活性呈正相关,CAD 在果锈形成早期起作用,C4H 在果锈形成后期起作用。这与Hou 等[16]的研究结果略有不同,其研究中阳光玫瑰葡萄果锈的减少与PAL、POD 活性的降低和4CL活性的升高有关。
果锈的形成是一个复杂的生物学过程,主要涉及木栓质在果皮中的积累,木质素和脂肪酸代谢是两个重要的代谢途径,为木栓质及其他物质合成提供前体物质[15]。代谢组学是对某一生物或细胞在特定生理时期内所有低分子量代谢产物进行定性和定量分析的一门学科,为研究生物代谢物及生物过程提供了很好的方法。杨王莉等[24]利用代谢组学方法比较了苏翠1 号(无或极少锈品种)及其父本翠冠(有锈品种)、母本华酥(无锈品种)的代谢物差异,发现差异代谢物主要是酚酸类、脂质类和黄酮类物质。Wang 等[25]比较了有锈和无锈苹果果皮的代谢组差异,发现肉桂酸及其衍生物、苯丙烷、酚酸在有锈果皮中显著积累,黄酮、氨基酸及其衍生物在两个样品中均富集。在本研究中,在无果锈、轻度果锈和重度果锈的阳光玫瑰葡萄果皮代谢组的两两比较中,发现有110种共有差异代谢物,其中,有105种随着果锈发生程度的增加而上调表达,2种下调表达,这105种上调表达的代谢物中有37种酚酸、31种黄酮、17 种茋类、5 种醌类、3 种萜类等,下调表达的2种代谢物为1 种脂质(4-羟基鞘氨醇)和1 种核苷酸及其衍生物(N6-异戊烯腺嘌呤),说明在阳光玫瑰葡萄果锈发生过程中,酚酸、黄酮、茋类等物质在果皮中积累,而脂质和核苷酸及其衍生物在果皮中减少,这与前人的研究结果相似[24-25]。Huang 等[26]在阳光玫瑰葡萄无锈果皮与有锈果皮中发现有60 种差异代谢物,其中,43 种上调表达、17 种下调表达,上调表达的代谢物中有29种酚类物质,包括10种槲皮素相关糖苷,笔者在本研究中也发现有4 种槲皮素相关的糖苷在有果锈果皮中上调表达。在葡萄中,芪类物质的生物合成途径受非生物胁迫响应,且芪合酶位于果皮细胞壁上[27],Suehiro等[2]的研究表明,阳光玫瑰葡萄芪合酶基因VvSTS type B的上调表达与果锈形成相关。
通过对差异代谢物的功能注释及富集分析有助于了解特定条件下的生物代谢途径。Wang 等[25]的研究表明,代谢过程,嘌呤代谢、苯丙烷类生物合成,类黄酮生物合成,丙烷、哌啶和吡啶生物碱的生物合成参与苹果果锈的发生。还有研究表明,苯丙烷代谢,乙烯代谢,次生代谢,卟啉和叶绿素代谢,黄酮的生物合成,油菜素甾醇的生物合成,类胡萝卜素的生物合成,亚油酸代谢,α-亚油酸代谢,角质、木栓质和蜡质的生物合成等参与梨果锈的形成[24,28-30]。苯丙烷的生物合成、植物信号转导和谷胱甘肽代谢参与阳光玫瑰葡萄果锈形成[26]。在本研究中,通过对110种共有差异代谢物进行注释分析,发现有33种差异代谢物质被注释到17 条代谢途径中,其中,被注释到差异代谢物较多的代谢途径有山柰酚苷元Ⅱ的生物合成,山柰酚苷元Ⅰ的生物合成,次生代谢物的生物合成,代谢途径,槲皮素苷元Ⅰ的生物合成,二苯乙烯、二芳基庚烷和姜酚的生物合成,酪氨酸代谢等。在山柰酚苷元Ⅱ的生物合成途径中,6 种差异代谢物均属于黄酮类物质,其中,6-羟基山柰酚-3,7,6-O-三葡萄糖苷、6-羟基山柰酚-7,6-O-二葡萄糖苷、6-羟基山柰酚-3,6-O-二葡萄糖苷、6-羟基山柰酚-3,6-O-二葡萄糖苷-7-O-葡萄糖醛酸和6-甲氧基山柰酚-3-O-葡萄糖苷随着果锈程度的增加均上调表达,而山柰酚-4'-O-葡萄糖苷在MR 与NR 中下调表达,在SR 与MR 和SR 与NR 中均上调表达。山柰酚糖苷属于黄酮醇类物质,存在于许多蔬菜、水果及中草药中,具有广泛的药理活性,包括抗肿瘤、抗炎、抗氧化、抗菌、保护损伤组织等,因其毒副作用小,越来越受到人们的关注[31],如香石竹中有山柰酚三糖苷、山柰酚-3-O-新橙皮苷[32]。本研究中山柰酚苷元Ⅱ的生物合成和山柰酚苷元Ⅰ的生物合成均参与到阳光玫瑰葡萄果锈形成过程中,且多个山柰酚糖苷在果皮中积累,说明山柰酚苷元的生物合成和这几种山柰酚糖苷可能在阳光玫瑰葡萄果锈形成中发挥着重要作用。
4 结论
在阳光玫瑰葡萄果锈发生过程中,果皮叶绿素、纤维素、半纤维素和总果胶含量逐渐降低,木质素、总黄酮和总酚含量逐渐升高,过氧化物酶、多酚氧化酶、苯丙氨酸解氨酶、肉桂醇脱氢酶和4-香豆酸:辅酶A 连接酶的活性逐渐升高,过氧化氢酶活性先升高后降低,肉桂酸-4-羟基化酶活性先降低后升高。3 组果锈等级的果皮之间共有的差异代谢物有110种,其中,有105种差异代谢物在3组中均表达上调,包括37 种酚酸类、31 种黄酮、17 种芪类和5 种醌类等;2种在3组中均表达下调,包括1种脂质和1种核苷酸及其衍生物。上述差异代谢物质主要分布在17 条代谢途径中,包括山柰酚苷元Ⅱ的生物合成、山柰酚苷元Ⅰ的生物合成和次生代谢物的生物合成等。总之,酚酸类和黄酮类物质对阳光玫瑰葡萄果锈的发生影响最大,且山柰酚苷元Ⅱ的生物合成途径可能在果锈的形成中发挥重要作用。
[1] 娄玉穗,尚泓泉,樊红杰,李政,张柯,吕中伟,张晓锋,吴文莹.不同果锈等级的阳光玫瑰葡萄果皮结构及相关物质变化[J].河南农业科学,2022,51(9):105-113.LOU Yusui,SHANG Hongquan,FAN Hongjie,LI Zheng,ZHANG Ke,LÜ Zhongwei,ZHANG Xiaofeng,WU Wenying.Changes in berry peel structure and related substances of Shine Muscat grape with different berry russet levels[J]. Journal of Henan Agricultural Sciences,2022,51(9):105-113.
[2] SUEHIRO Y,MOCHIDA K,ITAMURA H,ESUMI T. Skin browning and expression of PPO,STS,and CHS genes in the grape berries of‘Shine Muscat’[J]. Journal of the Japanese Society for Horticultural Science,2014,83(2):122-132.
[3] 吴江,程建徽,张月华,蒋飞荣.黄绿色葡萄品种果皮锈斑问题及防治措施[J].中外葡萄与葡萄酒,2006(6):41-42.WU Jiang,CHENG Jianhui,ZHANG Yuehua,JIANG Feirong.Problems and prevention measures of fruit russet spot in yellowgreen grape varieties[J].Sino-Overseas Grapevine&Wine,2006(6):41-42.
[4] YUAN G P,BIAN S X,HAN X L,HE S S,LIU K,ZHANG C X,CONG P H.An integrated transcriptome and proteome analysis reveals new insights into russeting of bagging and non-bagging“Golden Delicious”apple[J]. International Journal of Molecular Sciences,2019,20(18):4462.
[5] FALGINELLA L,ANDRE C M,LEGAY S,WANG K L,DARE A P,DENG C,REBSTOCK R,PLUNKETT B J,GUO L,CIPRIANI G,ESPLEY R V. Differential regulation of triterpene biosynthesis induced by an early failure in cuticle formation in apple[J].Horticulture Research,2021,8(1):75.
[6] 张伊凡.PpyMYB144 调控梨果锈木栓质形成的机制研究[D].扬州:扬州大学,2022.ZHANG Yifan.Study on the mechanism of PpyMYB144 regulating the formation of suberin in pear rust wood[D]. Yangzhou:Yangzhou University,2022.
[7] 刘子毓.PpyNAC381 转录调控砂梨果锈木栓质形成的机制[D].扬州:扬州大学,2023.LIU Ziyu.PpyNAC381 transcriptionally regulates exocarp suberization of russeted sand pear fruit[D].Yangzhou:Yangzhou University,2023.
[8] 王慧,安玉艳,汪良驹.‘翠冠’梨果锈形成的形态解剖学观察[J].果树学报,2017,34(11):1415-1425.WANG Hui,AN Yuyan,WANG Liangju.Morphological and anatomic observation on fruit russet formation of pear(Pyrus pyrifolia Nakai‘Cuiguan’)[J]. Journal of Fruit Science,2017,34(11):1415-1425.
[9] 张鹏飞.‘翠冠’梨果锈形成机制及关键过氧化物酶基因挖掘[D].扬州:扬州大学,2020.ZHANG Pengfei. Mechanism of russet formation and mining of key PRX genes in‘Cuiguan’pear fruit[D]. Yangzhou:Yangzhou University,2020.
[10] ZHANG J,ZHANG Y F,ZHANG P F,BIAN Y H,LIU Z Y,ZHANG C,LIU X,WANG C L. An integrated metabolic and transcriptomic analysis reveals the mechanism through which fruit bagging alleviates exocarp semi-russeting in pear fruit[J].Tree Physiology,2021,41(7):1306-1318.
[11] LASHBROOKE J,COHEN H,LEVY- SAMOCHA D,TZFADIA O,PANIZEL I,ZEISLER V,MASSALHA H,STERN A,TRAINOTTI L,SCHREIBER L,COSTA F,AHARONI A.MYB107 and MYB9 homologs regulate suberin deposition in angiosperms[J].The Plant Cell,2016,28(9):2097-2116.
[12] BUSATTO N,MATSUMOTO D,TADIELLO A,VRHOVSEK U,COSTA F. Multifaceted analyses disclose the role of fruit size and skin-russeting in the accumulation pattern of phenolic compounds in apple[J].PLoS One,2019,14(7):e0219354.
[13] TONG N N,PENG L P,LIU Z A,LI Y,ZHOU X Y,WANG X R,SHU Q Y. Comparative transcriptomic analysis of genes involved in stem lignin biosynthesis in woody and herbaceous Paeonia species[J].Physiologia Plantarum,2021,173(3):961-977.
[14] HU S,KAMIMURA N,SAKAMOTO S,NAGANO S,TAKATA N,LIU S,GOEMINNE G,VANHOLME R,UESUGI M,YAMAMOTO M,HISHIYAMA S,KIM H,BOERJAN W,RALPH J,MASAI E J,MITSUDA N,KAJITA S. Rerouting of the lignin biosynthetic pathway by inhibition of cytosolic shikimate recycling in transgenic hybrid aspen[J].The Plant Journal,2022,110(2):358-376.
[15] JIANG S H,CHEN M,WANG Z Q,REN Y X,WANG B,ZHU J,ZHANG Y G.Advances in understanding the causes,molecular mechanism,and perspectives of russeting on tree fruit[J].Frontiers in Plant Science,2022,13:834109.
[16] HOU X D,WEI L L,XU Y S,KHALIL-UR-REHMAN M,FENG J,ZENG J J,TAO J M.Study on russet-related enzymatic activity and gene expression in‘Shine Muscat’grape treated with GA3 and CPPU[J]. Journal of Plant Interactions,2018,13(1):195-202.
[17] 冯娇,侯旭东,董礼花,陶建敏.GA3与CPPU 对葡萄果锈相关物质合成及基因表达的影响[J].江苏农业学报,2018,34(3):642-650.FENG Jiao,HOU Xudong,DONG Lihua,TAO Jianmin. Effects of GA3 and CPPU on the synthesis of related substances and gene expression of berry russet of grapes[J]. Jiangsu Journal of Agricultural Sciences,2018,34(3):642-650.
[18] 黄艳,王铤,刘磊,梁东,王进,吕秀兰,黄科文.不同果袋对阳光玫瑰葡萄果锈形成及酚类物质的影响[J]. 中国果树,2023(12):53-58.HUANG Yan,WANG Ting,LIU Lei,LIANG Dong,WANG Jin,LÜ Xiulan,HUANG Kewen. Effects of different fruit bags on fruit russet formation and phenolic substances in‘Shine Muscat’grape[J].China Fruits,2023(12):53-58.
[19] 娄玉穗,张晓锋,樊红杰,王鹏,吴文莹,张柯,吕中伟.黄河故道地区阳光玫瑰葡萄合理产量负载研究[J].河南农业科学,2018,47(12):110-115.LOU Yusui,ZHANG Xiaofeng,FAN Hongjie,WANG Peng,WU Wenying,ZHANG Ke,LÜ Zhongwei. Study on the proper yield load of shine Muscat grape in the old flooded area of Yellow River[J]. Journal of Henan Agricultural Sciences,2018,47(12):110-115.
[20] MENDES- PINTO M M,SILVA FERREIRA A C,CARISVEYRAT C,GUEDES DE PINHO P. Carotenoid,chlorophyll,and chlorophyll-derived compounds in grapes and port wines[J].Journal of Agricultural and Food Chemistry,2005,53(26):10034-10041.
[21] 陈瑶瑶,严良文,刘建汀,刘智成,余洁,郑作芸,朱海生.黄秋葵果实发育过程中细胞壁组成成分、糖代谢及相关酶活性的变化[J].江苏农业学报,2023,39(5):1217-1224.CHEN Yaoyao,YAN Liangwen,LIU Jianting,LIU Zhicheng,YU Jie,ZHENG Zuoyun,ZHU Haisheng. Developmental changes of okra fruits in cell wall composition,saccharometabolism and related enzymatic activities[J]. Jiangsu Journal of Agricultural Sciences,2023,39(5):1217-1224.
[22] 李晶.主要黄绿色苹果品种果锈发生机制与防控研究[D].烟台:烟台大学,2022.LI Jing. Research on fruit rust occurrence mechanism and prevention and control of main yellow-green apple varieties[D].Yantai:Yantai University,2022.
[23] 刘鹿宁,赵秋月,葛聪,田志娇,周晓俐,阮翥龙,庄木来,李延,王平.木质素生物合成途径相关基因调控琯溪蜜柚汁胞粒化的研究[J].果树学报,2023,40(3):432-441.LIU Luning,ZHAO Qiuyue,GE Cong,TIAN Zhijiao,ZHOU Xiaoli,RUAN Zhulong,ZHUANG Mulai,LI Yan,WANG Ping.The genes related to lignin biosynthesis pathway regulate juice sac granulation in Guanxi pomelo[J]. Journal of Fruit Science,2023,40(3):432-441.
[24] 杨王莉,李晓刚,杨青松,蔺经,盛宝龙,常有宏,王宏.早熟砂梨苏翠1 号与其亲本成熟期果皮差异代谢产物鉴定及相关差异基因表达分析[J].果树学报,2022,39(11):1989-2006.YANG Wangli,LI Xiaogang,YANG Qingsong,LIN Jing,SHENG Baolong,CHANG Youhong,WANG Hong. Comparative metabolic and transcriptomic analysis of the pericarp of Sucui 1,Cuiguan and Huasu pears[J]. Journal of Fruit Science,2022,39(11):1989-2006.
[25] WANG Z Q,LIU S S,HUO W P,CHEN M,ZHANG Y G,JIANG S H. Transcriptome and metabolome analyses reveal phenotype formation differences between russet and non-russet apples[J].Frontiers in Plant Science,2022,13:1057226.
[26] HUANG Y,LIANG D,XIA H,LIN L J,WANG J,LÜ X L.Lignin and quercetin synthesis underlies berry russeting in‘Sunshine Muscat’grape[J].Biomolecules,2020,10(5):690.
[27] FORNARA V,ONELLI E,SPARVOLI F,ROSSONI M,AINA R,MARINO G,CITTERIO S. Localization of stilbene synthase in Vitis vinifera L. during berry development[J]. Protoplasma,2008,233(1/2):83-93.
[28] SHI C H,WANG X Q,XU J F,ZHANG Y X,QI B X,JUN L.Dissecting the molecular mechanism of russeting in sand pear(Pyrus pyrifolia Nakai) by metabolomics,transcriptomics,and proteomics[J].The Plant Journal,2021,108(6):1644-1661.
[29] HENG W,LIU L,WANG M D,JIA B,LIU P,YE Z F,ZHU L W.Differentially expressed genes related to the formation of russet fruit skin in a mutant of‘Dangshansuli’pear (Pyrus bretch-nederi Rehd.) determined by suppression subtractive hybridization[J].Euphytica,2014,196(2):285-297.
[30] WANG Q,WU X Y,LIU L,YAO D Z,LI J C,FANG J,CHEN X N,ZHU L W,LIU P,YE Z F,JIA B,HENG W. Transcriptome and metabolomic analysis to reveal the browning spot formation of‘Huangguan’pear[J].BMC Plant Biology,2021,21(1):321.
[31] 梁迪,杨晓虹,王娜,孙烨.黄酮醇类化合物药理活性的研究进展[C]//刘淑莹.吉林省第四届科学技术学术年会论文集.长春:吉林大学出版社,2006:979-981.LIANG Di,YANG Xiaohong,WANG Na,SUNYe.Research progress on the pharmacological activity of flavonol compounds[C]//LIU Shuying.The 4th Jilin Province Science and Technology Academic Annual Conference. Changchun:Jilin University Press,2006:979-981.
[32] 李赵菊,沈秋雨,周旭红,王苗苗,郑永仁.不同花色香石竹在发育过程中花青素、总黄酮及山奈酚糖苷的含量变化[J].现代园艺,2024,47(7):43-47.LI Zhaoju,SHEN Qiuyu,ZHOU Xuhong,WANG Miaomiao,ZHENG Yongren. Changes of anthocyanin,total flavonoids and kaempferol glycoside contents during the development of carnation with different flower colors[J]. Contemporary Horticulture,2024,47(7):43-47.