柿(Diospyros kaki Thunb.)一般通过嫁接繁殖[1]。但果实品质优良的富有系甜柿,如太秋、早秋等与中国传统产区的常用砧木君迁子(D. lotus L.)嫁接后表现早期成活率低、生长慢或后期不亲和的问题,导致该类品种未能在中国规模生产[2-4]。胡梦珏等[5]通过田间观察、离体茎段劈接和愈伤组织的靠接试验,发现小果甜柿(D. kaki Thunb.‘Xiaoguo Tianshi’)与富有系品种嫁接亲和,可望作为优质甜柿的广亲和砧木。目前已经开始在中国柿的主产区逐步推广,但小果甜柿在北方产区表现出抗冻力较差[6],亟待进行抗冻性遗传改良。
1997 年,Tao 等[7]将苏云金芽孢杆菌的cryIA(c)基因导入日本甜柿,获得抗虫的再生植株。2001年,Gao 等[8]将苹果的S6PDH 基因超表达到次郎柿中,发现超表达株系的抗盐性显著增强。因此,利用稳定遗传转化进行抗性分子育种可望缩短育种年限和提高育种效率。稳定遗传转化的前提是建立外植体的再生体系,Tao 等[9]以柿叶片诱导愈伤组织和不定芽。此后还陆续有君迁子(D. lotus L.)、油柿(D.oleifera Cheng)、磨盘柿(D.kaki Thunb.)等再生体系和稳定遗传转化体系的报道[10-14]。
君迁子原产于中国黄河流域,在中国各地广泛分布,对冬季低温胁迫抵抗能力强,是栽培柿的重要砧木[2]。研究君迁子的抗寒机制对提高柿属植物的抗寒性具有重要的意义。CBF(CRT/DRE-binding factor)是低温响应途径中重要的转录因子,CBF依赖的低温信号通路在过去20 a(年)得到广泛研究,在各物种中具有很高的同源性[15]。目前,CBF同源基因在许多物种中都进行了克隆,包括苹果、大豆、水稻、番茄、小麦、大麦和玉米等,研究表明它们对植物低温响应都具有重要功能[16-19]。小果甜柿再生体系和稳定转化体系技术尚未成熟,因此建立其叶片再生和稳定遗传转化体系,并将君迁子抗寒基因DlCBF1在小果甜柿再生植株中超表达,可为培育与主栽品种嫁接亲和性良好和环境适用性强的甜柿砧木新种质提供科学依据。
1 材料和方法
1.1 植物材料、菌株和载体
以继代培养2 a 的小果甜柿无菌试管苗和君迁子实生苗为试验材料;菌株为大肠杆菌菌株DH5α和根癌农杆菌(Agrobacterium tumefaciens)菌株GV3101;双元表达载体pBI-121GN2。上述试材均由华中农业大学果蔬园艺作物种质创新与利用全国重点实验室提供。
1.2 愈伤组织与不定芽诱导
取继代苗龄30 d 的组培苗,切下顶端分生组织前4~5枚叶片,保留叶脉,将其切为5 mm×5 mm大小叶盘,叶面朝上接种在愈伤培养基中,以MS(1/2N)为基础培养基,含不同质量浓度的植物生长调节剂ZT(1.0、2.0、4.0 mg·L-1)和TDZ(0.5、1.0、2.0 mg·L-1),分析不同质量浓度的ZT 与TDZ 组合对叶片愈伤组织诱导的影响。
将生长状态基本一致的愈伤组织接种在不定芽诱导培养基中,以MS(1/2N)为基础培养基,含不同质量浓度的植物生长调节剂ZT(1.0、2.0、3.0、4.0 mg·L-1)和IAA(0.1 mg·L-1),分析不同质量浓度的ZT与IAA组合对不定芽诱导的影响。
所有培养基均含有PVP(0.6 g·L-1)、蔗糖(30.0 g·L-1)和琼脂(6.5 g·L-1),每个处理接种20~35个外植体,每个试验3 次重复。叶片诱导愈伤组织暗培养20 d 后,培养条件更换为光照时间12 h·d-1,其他培养条件为相对湿度70%、培养条件为(25±2)℃,每20 d更换1次培养基,45 d后分别统计愈伤组织形成率、不定芽再生率和叶片平均不定芽数。
叶片存活率/%=存活叶片数/接种叶片数×100;愈伤形成率/%=形成愈伤叶片数/接种叶片数×100;不定芽再生率/%=不定芽再生叶片数/接种叶片数×100;叶片平均不定芽数=不定芽总数/再生叶片数;污染率/%=污染外植体个数/接种外植体个数×100。
1.3 稳定遗传转化条件优化
将用农杆菌侵染后的叶盘共培养后接种到含有不同质量浓度头孢霉素(cefotaxime,Cef)的愈伤诱导培养基中,质量浓度分别为0、100、200、400、600 mg·L-1,45 d后观察农杆菌生长情况并计算农杆菌生长率,试验不同头孢霉素质量浓度对农杆菌抑制效果。
将叶盘直接接种到含有不同质量浓度抗生素的愈伤诱导培养基中,头孢霉素质量浓度分别为0、100、200、400、600 mg·L-1,卡那霉素(kanamycin,Kan)质量浓度分别为0、5、10、20、40 mg·L-1,每个处理接种40~60个外植体,每个试验3次重复。每20 d更换1次培养基,叶盘接种45 d后统计叶片存活率、愈伤形成率。愈伤诱导培养基为MS(1/2N)含有ZT(2.0 mg·L-1)、TDZ(2.0 mg·L-1)、PVP(0.6 g·L-1)、蔗糖(30 g·L-1)和琼脂(6.5 g·L-1)。
1.4 君迁子DlCBF1基因克隆和超表达载体构建
RNA 提取方法参考Hipure HP Plant RNA Mini Kit试剂盒(Magen公司)说明,采集君迁子实生苗叶片提取RNA,参考PrimeScriptTM RT reagent Kit with gDNA Eraser(TaKaRa 公司)反转录试剂盒进行cD‐NA 反转录。利用Primer Premier 5.0 软件设计Dl‐CBF1 基因特异引物。由上海生工生物技术有限公司合成,浓度5 pmol·μL-1。
以君迁子基因组数据库(http://persimmon.kazu‐sa.or.jp/blast.html)中Dio0206440.1(对应拟南芥AtCBF1基因同源基因)的序列为模板设计CDS克隆引物,采用PrimeSTAR Max DNA Polymerase高保真酶(TaKaRa,日本)进行扩增,以DlCBF1-F(5'-ATG‐GATGTGTCCTCTCACTTTTCCG-3')和DlCBF1-R(5'-CTACATTGAGAAACTCCACAGTGGGA-3')为引物,PCR扩增程序:预变性95 ℃3 min,95 ℃30 s,58 ℃30 s,72 ℃1 min,34个循环,延伸72 ℃5 min,进行PCR扩增,克隆君迁子DlCBF1基因。以克隆获得的君迁子DlCBF1基因为模板,以DlCBF1-XbaⅠ-F(5'- GAGAACACGGGGGACTCTAGAATGGAT‐GTGTCCTCTCACTT-3')和DlCBF1-Sma Ⅰ-R(5'-CATAGGGACTGACCACCCGGGCATTGAGAAACTCCACAGTG-3')为引物,PCR 扩增程序:预变性95 ℃3 min,95 ℃30 s,62 ℃30 s,72 ℃1 min,34个循环,延伸72 ℃5 min,进行PCR 扩增,回收目的片段,连接至XbaⅠ和SmaⅠ双酶切后的pBI121GN2植物表达载体,获得35S::DlCBF1 超表达载体。采用冻融法将pBI121GN2-DlCBF1载体导入根癌农杆菌菌株GV3101中。
1.5 DlCBF1遗传转化及转基因阳性植株鉴定
小果甜柿叶片侵染流程参照前期报道[12]并对浸染液浓度、共培养时间等稍作修改。取继代苗龄30 d的组培苗切下顶端分生组织前4~5 枚叶片,去除叶边缘,保留叶脉,在无菌的条件下,将其切为5 mm×5 mm 的叶盘,叶背朝下接种于预培养培养基[(1/2N)MS+ZT 1.0 mg·L-1+IAA 0.1 mg·L-1]中,黑暗预培养3 d。将根癌农杆菌菌液OD600值调至0.75,配置好的悬浮液于黑暗条件下静置1 h 后侵染预培养3 d 后的叶片,侵染15 min,用无菌吸水纸吸干叶片上的菌液,叶背朝下置于共培养培养基([1/2N)MS+ZT 1.0 mg·L-1+IAA 0.1 mg·L-1+AS 20 mg·L-1]上暗培养3 d,将叶片用头孢霉素水(400 mg·L-1)清洗3 次,并用无菌水清洗3 次,将叶片取出后置于无菌吸水纸中吸干叶片表面的水分,叶背朝下置于筛选愈伤诱导培养基([1/2N)MS+ZT 2.0 mg·L-1+TDZ 2.0 mg·L-1+Kan 10 mg·L-1+Cef 400 mg·L-1]中,25 ℃黑暗培养30 d,愈伤继代于筛选不定芽再生培养基([1/2N)MS+ZT 2.0 mg·L-1+IAA 0.1 mg·L-1+Kan 10 mg·L-1+Cef 400 mg·L-1]中,25 ℃光照培养20~30 d诱导不定芽再生,待抗性再生芽长到1 cm时,将再生芽切下,转移到[DKW+ZT 1.0 mg·L-1+IAA 0.01 mg·L-1+Cef 400 mg·L-1]的抗性继代培养基上,经PCR 阳性鉴定后筛选阳性植株,以小果甜柿叶片DNA 为模板,以35S-F(5'-GACGCACAATCCCACTATCC-3')和DlCBF1-SmaⅠ-R 为引物进行PCR 分析,阳性植株扩繁保存用于下一步研究。阳性植株再生芽长至1.5 cm 后,先在含1/2MS+NAA 0.5 mg·L-1 +IBA 0.2 mg·L-1的生根培养基中25 ℃黑暗培养10 d,之后转入不含任何激素的1/2MS 培养基中25 ℃光照培养,30 d后可再生出不定根。
1.6 基因相对表达量
切取小果甜柿阳性苗叶片,提取其RNA 后反转录,以其cDNA 为模板,利用qRT-PCR 检测DlCBF1基因在转录水平上的表达,此操作在QuantStudio™7 Flex 实时荧光定量PCR 系统(Applied Biosys‐tems)上完成,参考TB Green® Premix Ex Taq Ⅱ(TaKaRa,日本)说明书,以QDlCBF1- F(5'-AGAAGTTCAGGGAGACGCGG-3')和QDlCBF1-R(5'-TGCCCAGCCATATCCTCGAC-3')为引物,PCR反应程序:95 ℃5 min;45 个循环包括95 ℃10 s,60 ℃15 s,72 ℃30 s。每个样品3 次重复,DkActin用作内参基因[20]。
1.7 低温胁迫下表型观察及理化指标的测定
将生长一致的小果甜柿DlCBF1 超表达株系和野生型(WT)株系于低温培养箱(HP400G-E 型,瑞华公司,中国)中进行低温处理,-4 ℃处理8 h 后观察其表型并拍照。使用叶绿素荧光成像系统(IM‐AGING-PAM)观察整个植株的光合活性,根据其叶绿素成像来反映其生理状态的异质性,利用Imag‐ing WinGegE 软件(Walz,德国)进行Fv/Fm 值的计算。使用DSS-307 型电导率仪(SPSIC,中国)测量生物电导率;采集-4 ℃处理的小果甜柿叶片,采用二氨基联苯胺(DAB)染色法分析H2O2的含量,采用氯化硝基四氮唑蓝(NTB)染色法分析O2-的含量,丙二醛(MDA)含量测定步骤具体参照南京建成试剂盒(A003-1)说明书。
1.8 数据分析
所有检测3 次重复。采用SPSS 18.0(SPSS,Chicago,USA)软件进行方差分析。
2 结果与分析
2.1 小果甜柿叶片愈伤和不定芽的诱导
在叶片培养过程中,随着接种时间增加,叶片面积逐渐长大,叶边缘向中心卷曲,叶脉周围长出致密黑色愈伤组织且体积迅速增大;接种8周左右,愈伤组织上出现芽点,芽点逐渐变绿伸长,待其长到2 cm时可切下不定芽进行继代培养。
2.2 不同激素组合对小果甜柿叶片愈伤组织诱导的影响
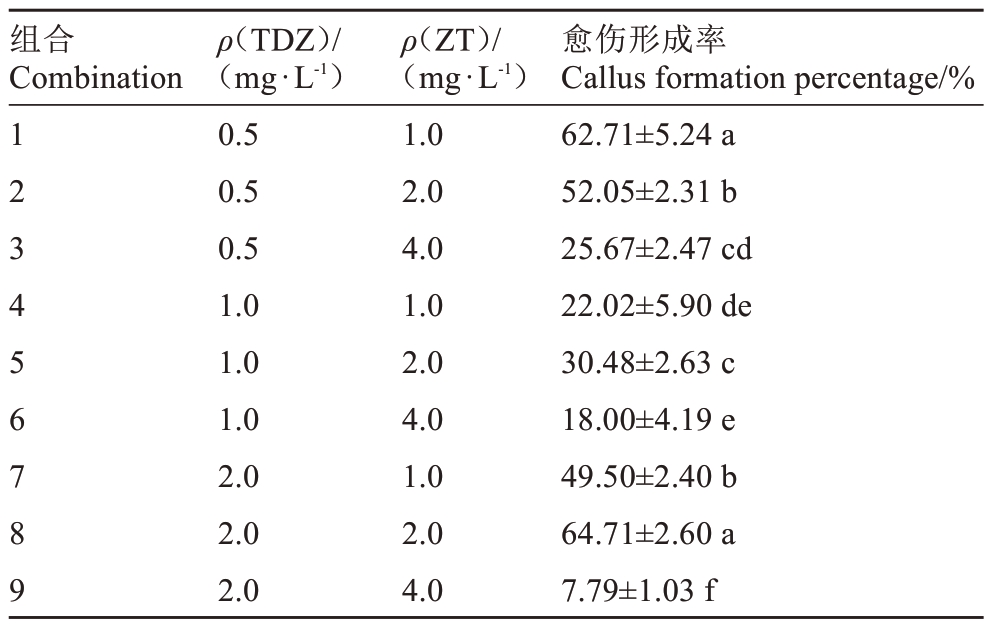
由表1 可知,最适合小果甜柿叶片愈伤诱导的激素组合为ZT 2.0 mg·L-1+ TDZ 2.0 mg·L-1,愈伤组织形成率达64.71%;其次为ZT 1.0 mg·L-1+TDZ 0.5 mg·L-1,愈伤组织形成率达62.71%。当ZT 质量浓度过高时,会抑制叶片愈伤组织形成。当TDZ 质量浓度一定时,愈伤组织形成率会随着ZT质量浓度增加先升高后降低。不同激素组合,愈伤生长状态也不同,组合1、7、8 的叶片大且绿,与培养基接触生长的愈伤组织为黑色,与空气接触的为浅褐色,其余组合的叶片为浅绿色,愈伤组织小且不成形。
表1 不同质量浓度的TDZ 和ZT 组合对小果甜柿愈伤组织诱导的影响
Table 1 Effect of TDZ and ZT with different concentrations on callus formation of Xiaoguo Tianshi persimmon
注:同一列中的不同小写字母表示差异显著(p<0.05)。下同。
Note:Different small letters in the same column refer to significant difference(p<0.05).The same below.
愈伤形成率Callus formation percentage/%62.71±5.24 a 52.05±2.31 b 25.67±2.47 cd 22.02±5.90 de 30.48±2.63 c 18.00±4.19 e 49.50±2.40 b 64.71±2.60 a 7.79±1.03 f组合Combination 1 2 3 4 5 6 7 8 9 ρ(TDZ)/(mg·L-1)0.5 0.5 0.5 1.0 1.0 1.0 2.0 2.0 2.0 ρ(ZT)/(mg·L-1)1.0 2.0 4.0 1.0 2.0 4.0 1.0 2.0 4.0
2.3 不同激素组合对小果甜柿不定芽再生的影响
由表2 可知,最适合小果甜柿不定芽诱导的激素组合为ZT 2.0 mg·L-1+ IAA 0.1 mg·L-1,不定芽再生率和叶片平均不定芽数分别达到31.11%和2.37 个。当IAA 质量浓度一定时,不定芽再生率和平均不定芽再生数会随着ZT 质量浓度的增加而先升高后下降。ZT 质量浓度太高会抑制不定芽再生且不定芽长势差,ZT 质量浓度为4.0 mg·L-1时,不定芽再生率仅为5.00%。在不定芽诱导过程中,叶片的酚类分泌物的释放会抑制不定芽再生,需20 d 更换一次培养基。
表2 不同质量浓度的IAA 和ZT 组合对小果甜柿不定芽再生的影响
Table 2 Effect of IAA and ZT with different concentrations on shoot regeneration of Xiaoguo Tianshi persimmon
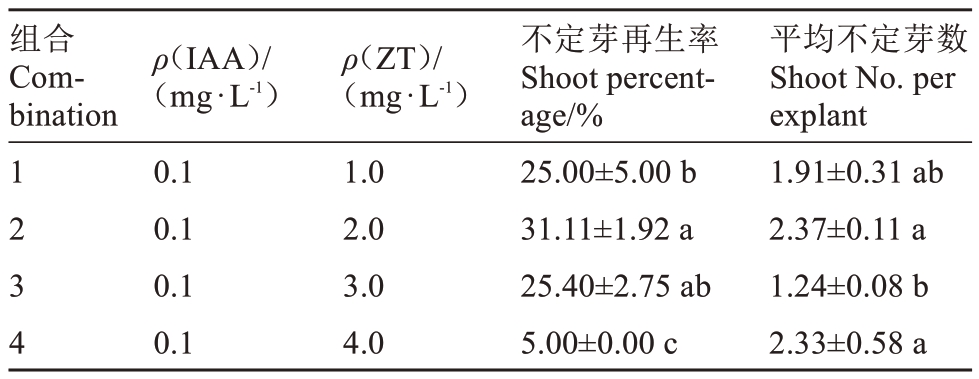
组合Combination ρ(IAA)/(mg·L-1)ρ(ZT)/(mg·L-1)1 2 3 4 0.1 0.1 0.1 0.1 1.0 2.0 3.0 4.0不定芽再生率Shoot percentage/%25.00±5.00 b 31.11±1.92 a 25.40±2.75 ab 5.00±0.00 c平均不定芽数Shoot No.per explant 1.91±0.31 ab 2.37±0.11 a 1.24±0.08 b 2.33±0.58 a
2.4 不同质量浓度的头孢霉素对农杆菌的抑菌效果
为了确定能抑制农杆菌生长的最佳头孢霉素质量浓度,试验对比了不同质量浓度的头孢霉素对农杆菌生长的抑制效果,200 mg·L-1及以下质量浓度的头孢霉素均无法抑制农杆菌生长,农杆菌污染率为50%以上;头孢霉素质量浓度400 mg·L-1和600 mg·L-1时,农杆菌污染率分别为23.74%和5.00%(图1)。因此,400 mg·L-1及以上质量浓度的头孢霉素可以抑制农杆菌污染,头孢霉素质量浓度越高,抑制农杆菌污染效果越好。
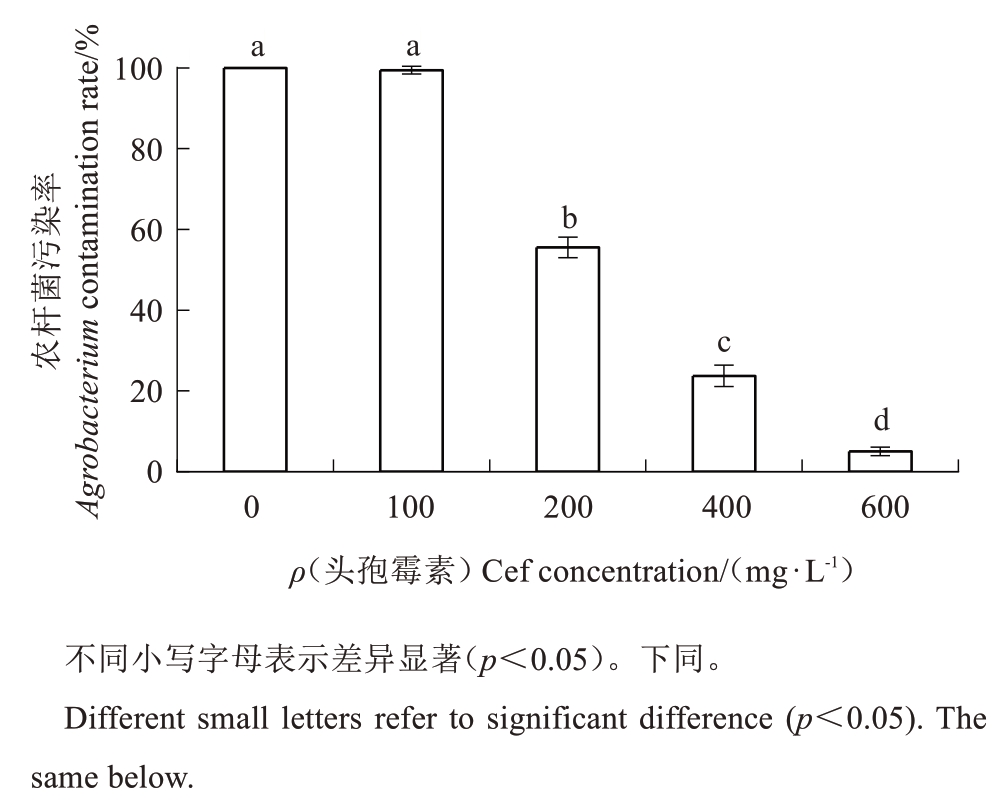
图1 不同质量浓度的头孢霉素对农杆菌的抑菌效果
Fig.1 Effects of different Cef concentrations for growth inhibition of A.tumefaciens
2.5 不同质量浓度的头孢霉素对小果甜柿叶片再生的影响
为确定适合小果甜柿遗传转化的头孢霉素质量浓度,将叶盘接种到含有不同质量浓度头孢霉素的再生培养基中。由表3 可见,随着头孢霉素质量浓度的增加,叶片的存活率逐步降低,叶片黄化且不分化(图2),愈伤组织形成率也随之降低,当头孢霉素质量浓度为400 mg·L-1时,愈伤组织形成率极低,为9.84%。因此结合头孢霉素对农杆菌的抑菌试验发现,400 mg·L-1以下、200 mg·L-1以上质量浓度的头孢霉素适合叶片稳定遗传转化。

图2 头孢霉素质量浓度对小果甜柿叶片再生的影响
Fig.2 Effect of different cefxime sodium concentrations on leaf regeneration of Xiaoguo Tianshi persimmon
表3 头孢霉素质量浓度对小果甜柿叶片及愈伤组织再生的影响
Table 3 Effect of different cefxime sodium concentration on leaf regeneration and callus formation of Xiaoguo Tianshi persimmon
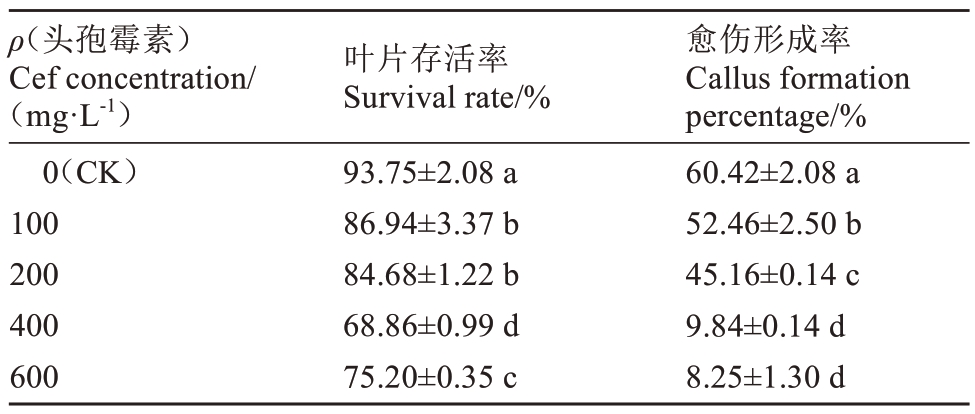
ρ(头孢霉素)Cef concentration/(mg·L-1)0(CK)100 200 400 600叶片存活率Survival rate/%93.75±2.08 a 86.94±3.37 b 84.68±1.22 b 68.86±0.99 d 75.20±0.35 c愈伤形成率Callus formation percentage/%60.42±2.08 a 52.46±2.50 b 45.16±0.14 c 9.84±0.14 d 8.25±1.30 d
2.6 不同质量浓度的卡那霉素对小果甜柿叶片再生的影响
卡那霉素能够显著抑制叶片生长,为确定适合小果甜柿遗传转化的卡那霉素质量浓度,将叶盘直接接种到含有不同质量浓度卡那霉素的愈伤诱导培养基中。由表4 可知,随着卡那霉素质量浓度的增加,叶片存活率显著降低,叶片黄化并逐渐褐化死亡(图3)。当卡那霉素质量浓度为20 mg·L-1时,叶片存活率为82.64%,愈伤组织形成率显著降低,仅为11.57%。卡那霉素质量浓度为10 mg·L-1最适宜叶片遗传转化筛选,其愈伤组织诱导率为62.28%,且能在一定条件下抑制非阳性愈伤组织生长。

图3 卡那霉素质量浓度对小果甜柿叶片再生的影响
Fig.3 Effect of different kanamycin sodium concentration on leaf regeneration of Xiaoguo Tianshi persimmon
表4 卡那霉素质量浓度对小果甜柿叶片及愈伤组织再生的影响
Table 4 Effect of different kanamycin concentrations on leaf regeneration and callus formation of Xiaoguo Tian‐shi persimmon
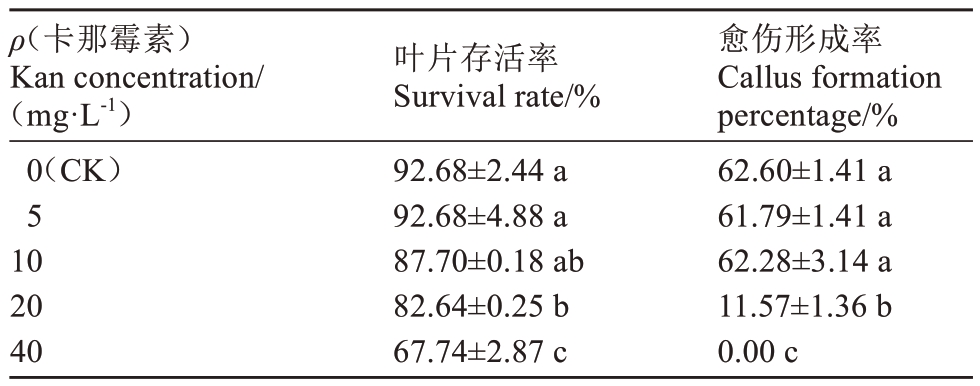
ρ(卡那霉素)Kan concentration/(mg·L-1)0(CK)5 10 20 40叶片存活率Survival rate/%92.68±2.44 a 92.68±4.88 a 87.70±0.18 ab 82.64±0.25 b 67.74±2.87 c愈伤形成率Callus formation percentage/%62.60±1.41 a 61.79±1.41 a 62.28±3.14 a 11.57±1.36 b 0.00 c
2.7 小果甜柿遗传转化DlCBF1及阳性鉴定
对小果甜柿进行超表达DlCBF1 基因稳定遗传转化(图4),获得再生植株73株,阳性植株5株(#1、#2、#3、#47和#49),经过提取其叶片DNA,进行PCR检测,琼脂糖凝胶电泳发现阳性率为6.85%(图5);并且根据荧光定量结果分析,阳性植株#1和#47中DlCBF1基因表达量高,分别为WT的13倍和11倍(图6)。
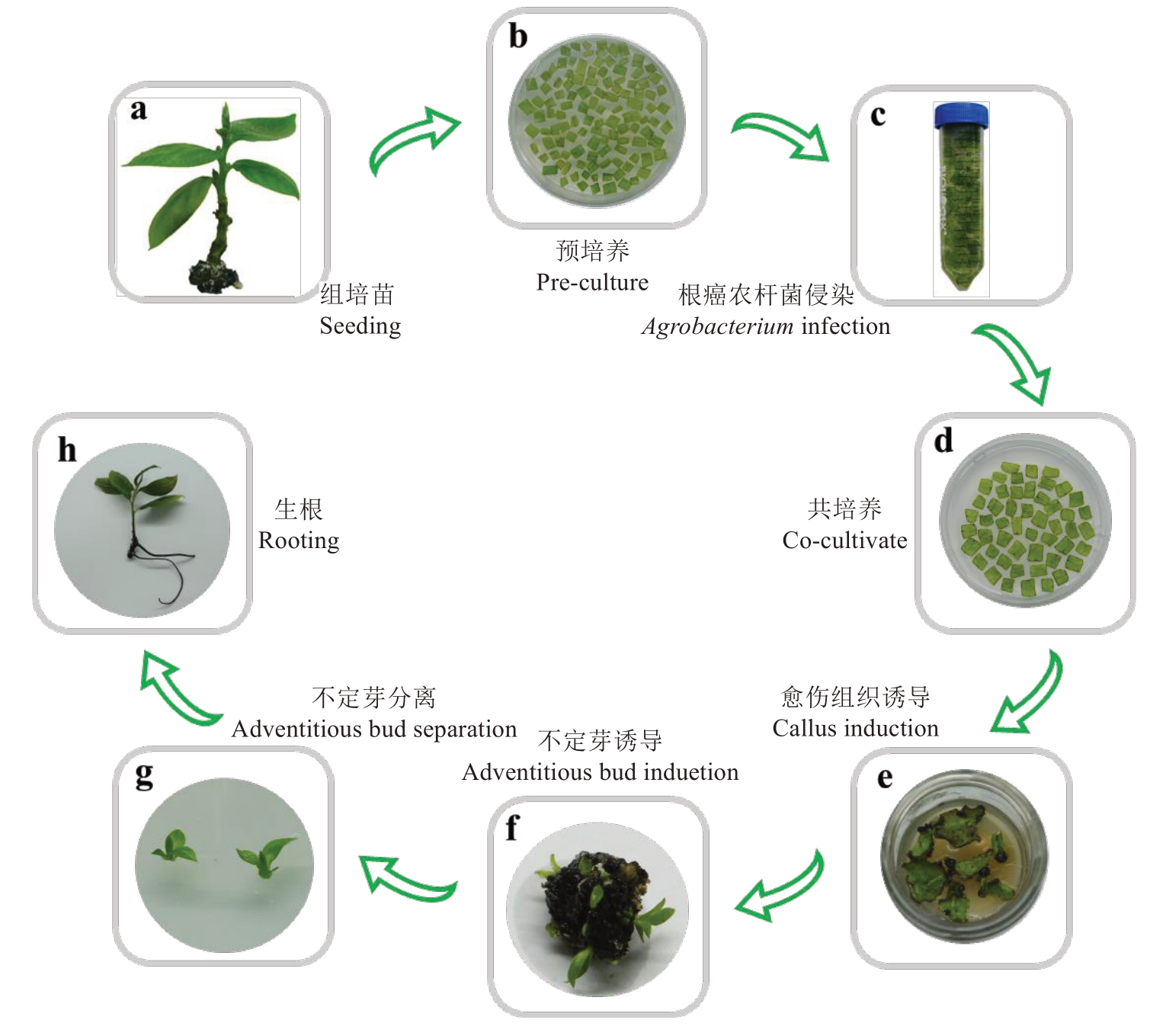
图4 小果甜柿稳定遗传转化流程
Fig.4 The process of genetic transformation Xiaoguo Tianshi persimmon
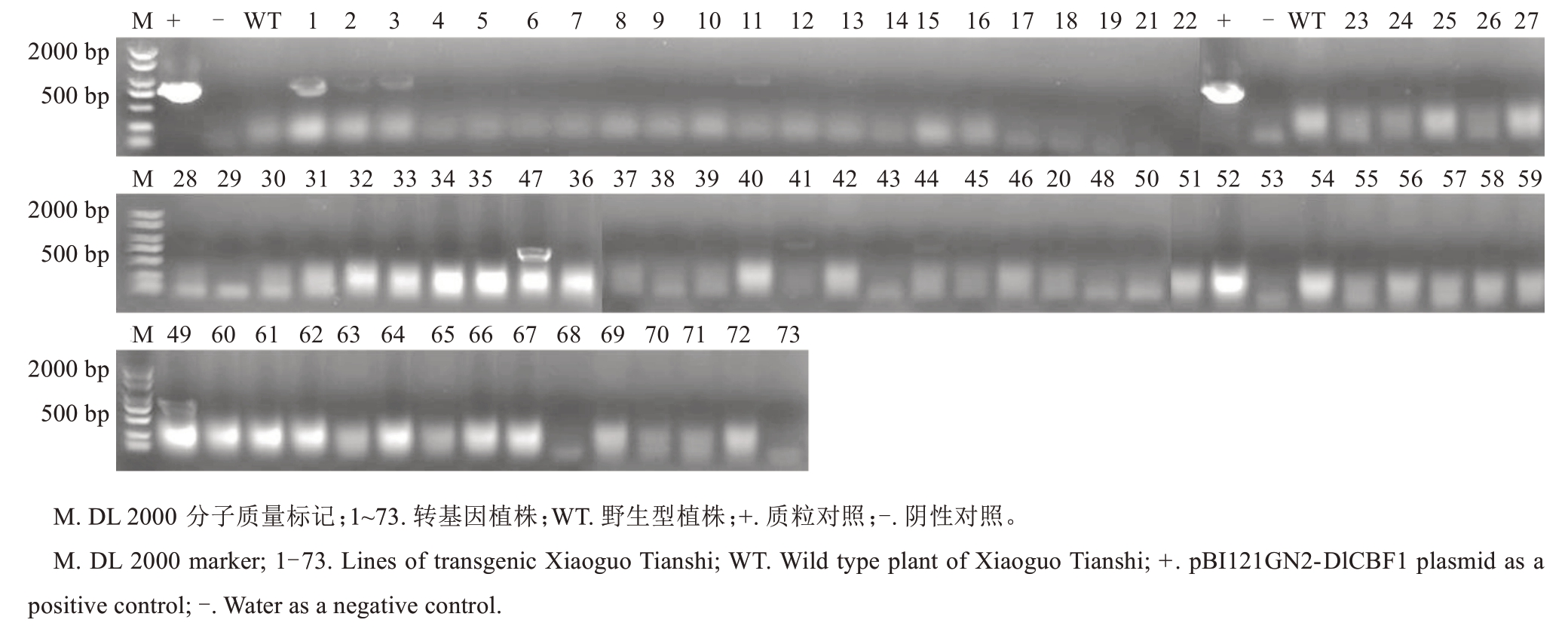
图5 小果甜柿遗传转化植株的PCR 鉴定Fig.5 PCR identification of transgenic Xiaoguo Tianshi persimmon plants
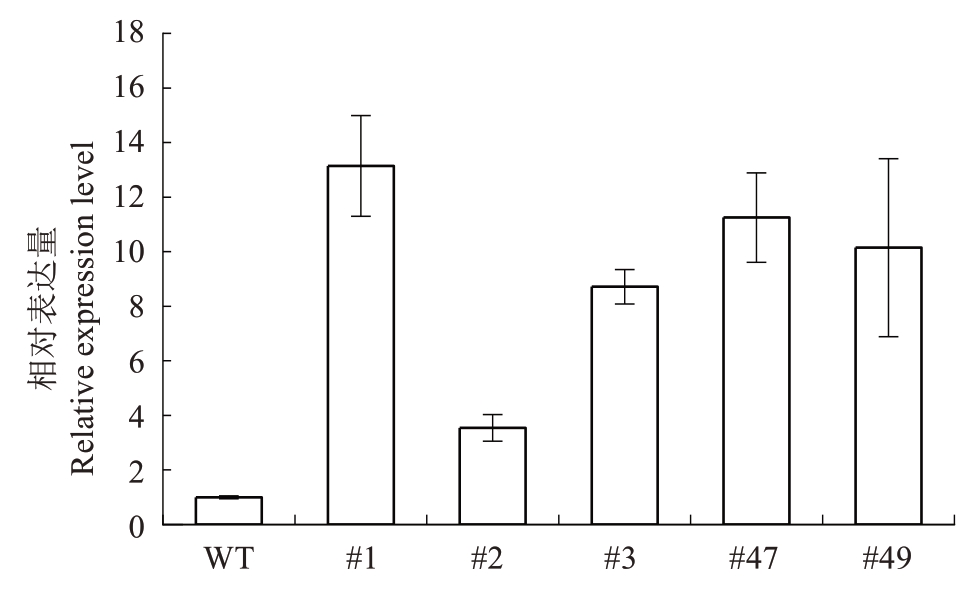
图6 转基因小果甜柿植株的DlCBF1 相对表达量分析
Fig.6 Relative expression level of DlCBF1 in the transgenic Xiaoguo Tianshi persimmon leaves
2.8 超表达DlCBF1增强小果甜柿再生植株抗冻性
将野生型株系(WT)和DlCBF1 转基因小果甜柿株系(#1、#3 和#47)进行抗冻性分析,经过低温处理(-4 ℃,8 h)后,发现WT 植株叶片变褐,出现失水萎蔫情况,超表达株系相较于WT 株系受伤害程度小(图7-A)。低温处理后,WT 株系叶绿素荧光信号微弱,超表达株系叶片有较强蓝色荧光信号(图7-B),与最大光合效率Fv/Fm值变化一致(图7-E)。同时,采用DAB 和NBT 染色法对低温处理后的小果甜柿植株叶片进行染色,两者分别代表H2O2和O2-在组织中的积累,结果表明超表达DlCBF1 株系相较于WT 株系染色范围少且染色程度浅(图7-C)。相对电导率和MDA 含量测定显示,与WT 株系相比,低温处理后,超表达植株相对电导率和MDA 含量较低(图7-D、F)。以上结果表明,超表达DlCBF1基因能提高小果甜柿再生植株抗冻性。
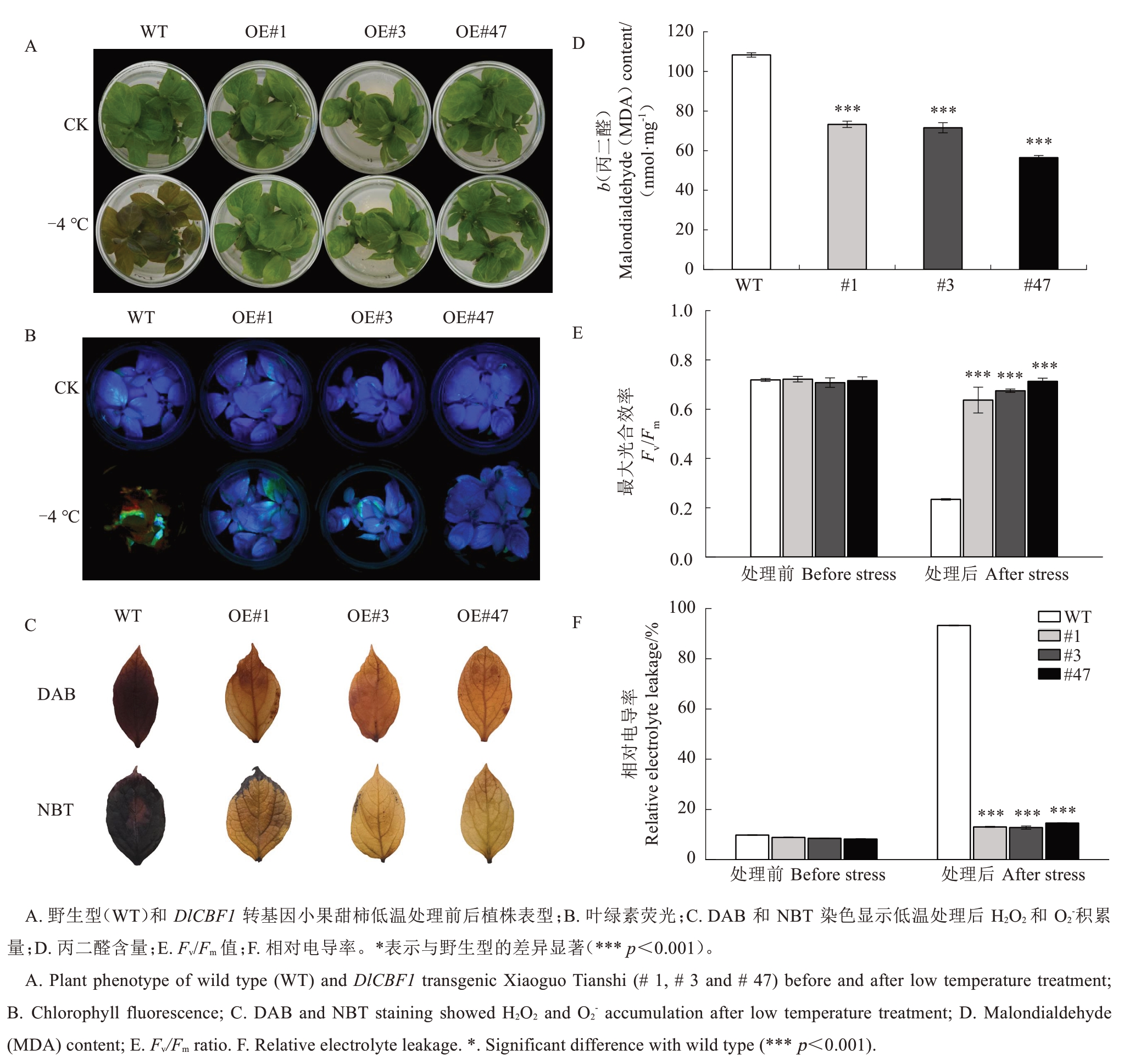
图7 转基因小果甜柿和野生型幼苗的抗冻性鉴定
Fig.7 Frost tolerance identification of transgenic Xiaoguo Tianshi and wild type
3 讨 论
柿属植物不同基因型的再生条件差异大,君迁子(D. lotus L.)愈伤组织诱导率可达100%,平均不定芽数为4.26 个[11];油柿(D.oleifera Cheng)愈伤组织诱导率也可达88.90%,不定芽诱导率为(64.33±7.02)%,平均不定芽数为3.7 个[10];磨盘柿(D. kaki Thunb.)愈伤组织诱导率100%,不定芽诱导率达36.9%[14]。可见柿不同基因型愈伤组织和不定芽诱导能力不同。目前还没有对小果甜柿(D. kaki Thunb.)叶片再生体系的研究,笔者在本研究中成功建立小果甜柿叶片再生体系和优化根癌农杆菌介导的遗传转化体系,为小果甜柿的进一步稳定遗传转化和抗性分子育种奠定基础。根据前人研究,可将根癌农杆菌和发根农杆菌接种在柿外植体上以诱导植株再生。Tao 等[21]研究发现以日本甜柿(D. kaki Thunb.)富有、次郎和西村为材料,发根农杆菌均能诱导愈伤形成。Tao 等[22]发现也可利用根癌农杆菌对柿进行遗传转化,不同菌株如A281、C58 和K12,接种后均能诱导出愈伤组织。
前人还对柿(D.kaki Thunb.)进行稳定遗传转化条件的优化,如不同部位、培养基类型、激素组合、预培养时间、暗培养时间、侵染时间和根癌农杆菌菌液OD600值[10-11,14]。以君迁子叶片为外植体,优化不同遗传转化条件,发现预培养4 d,OD600为0.5,侵染10 min,君迁子叶片的遗传转化效率最高,达14.27%[11];以恭城水柿叶片为外植体,通过对不同基本培养基和激素组合的优化,建立了高效的转化体系和离体再生体系,再生苗阳性率达17.9%[12];以油柿的下胚轴和胚根为试材,确定愈伤组织的最佳诱导培养基和愈伤组织诱导不定芽的最适培养基,分别为1/2MS+2.0 mg·L-1 TDZ+1.5 mg·L-1 ZT+0.1 mg·L-1 NAA和1/2MS+2.0 mg·L-1 TDZ+1.0 mg·L-1 2iP+0.5 mg·L-1 NAA[10]。柿属植物稳定遗传转化体系正在逐步完善,不同品种和不同外植体部位诱导条件差异大。笔者在本研究中以小果甜柿叶片为外植体,研究不同激素配比对其愈伤诱导和丛生芽再生的影响,优化了叶片再生体系;愈伤组织形成率达64.71%,不定芽再生率和不定芽数分别为31.11%和2.37 个。再通过根癌农杆菌介导法进行稳定遗传转化,200~400 mg·L-1的头孢霉素和10 mg·L-1的卡那霉素适合小果甜柿叶片遗传转化;与其他柿稳定遗传转化体系相比,本研究中使用更低的卡那霉素质量浓度(10 mg·L-1),但筛选阳性愈伤组织和阳性不定芽的效率较低,再生的不定芽极大可能为阴性。因小果甜柿稳定遗传转化体系尚未得到完全优化,可以通过根癌农杆菌介导法,研究适合其稳定遗传转化的根癌农杆菌菌液质量浓度、侵染时间、预培养时间、暗培养时间、共培养时间和乙酰丁香酮质量浓度等条件。
相较于传统育种手段,通过转基因手段,可明显提高育种效率。因此,在特定潜在有益的基因已经被鉴定的情况下,稳定遗传转化技术为育种提供了最佳的替代方案。Tao 等[23]和Tamura 等[24]利用根癌农杆菌EHA101 将编码梨果实多聚半乳糖醛酸酶抑制蛋白(PGIP)基因转化到日本甜柿次郎,转化植株抗真菌能力显著提高。将抗性基因转化到柿植株的方法有效可行,小果甜柿抗寒性较弱,将君迁子抗性基因DlCBF1 转入小果甜柿中,有望提高其抗冻性并获得抗冻能力强的广亲和砧木新种质。
4 结 论
培养基MS(1/2N)+ ZT(2.0 mg·L-1)+ TDZ(2.0 mg·L-1)和MS(1/2N)+ZT(2.0 mg·L-1)+IAA(0.1 mg·L-1)的二次诱导体系适宜小果甜柿叶片外植体再生;头孢霉素质量浓度200 mg·L-1<Cef<400 mg·L-1和卡那霉素质量浓度10 mg·L-1适宜其叶片稳定遗传转化筛选。在小果甜柿中超表达君迁子抗寒基因DlCBF1,可增强其对低温胁迫的耐受性。研究结果可为柿抗性砧木新种质的创制提供科学依据。
[1] 罗正荣,蔡礼鸿,胡春根.柿属植物种质资源及其利用研究现状[J].华中农业大学学报,1996,15(4):381-388.LUO Zhengrong,CAI Lihong,HU Chungen. Research devel‐opment of germplasm resources of Diospyros and their utiliza‐tion[J]. Journal of Huazhong Agricultural University,1996,15(4):381-388.
[2] 龚榜初,王劲风.柿不同砧木生物学特性的研究[J].经济林研究,1997,15(1):9-13.GONG Bangchu,WANG Jinfeng. Biological characteristics of several persimmon rootstocks[J]. Economic Forest Researches,1997,15(1):9-13.
[3] 王仁梓,杨勇. 甜柿推广中的若干问题[J].果树科学,1991,8(3):187-190.WANG Renzi,YANG Yong. Some issues in the popularization of sweet persimmon[J]. Journal of Fruit Science,1991,8(3):187-190.
[4] 王元裕,李伯均,周碧英,柳国华,郑显明.甜柿砧穗组合嫁接亲和力研究[J].园艺学报,1996,23(2):110-114.WANG Yuanyu,LI Bojun,ZHOU Biying,LIU Guohua,ZHENG Xianming. The graft compatibility of different root‐stock-scion combinations of sweet persimmons[J]. Acta Horti‐culturae Sinica,1996,23(2):110-114.
[5] 胡梦珏,陈莉,刘一凤,张青林,罗正荣.小果甜柿和牛眼柿作为完全甜柿砧木的应用潜力研究[J].果树学报,2017,34(1):50-58.HU Mengjue,CHEN Li,LIU Yifeng,ZHANG Qinglin,LUO Zhengrong. Potential of Xiaoguo Tianshi and Niuyanshi (Dios‐pyros kaki Thunb.) as novel rootstocks for PCNA persimmon[J].Journal of Fruit Science,2017,34(1):50-58.
[6] 刘一凤.完全甜柿砧木小果甜柿繁殖技术研究[D].武汉:华中农业大学,2017.LIU Yifeng.Establishment of propagation technology for PCNA rootstock Xiaoguo Tianshi[D]. Wuhan:Huazhong Agricultural University,2017.
[7] TAO R,DANDEKAR A M,URATSU S L,VAIL P V,TEB‐BETS J S.Engineering genetic resistance against insects in Japa‐nese persimmon using the cryIA(c) gene of Bacillus thuringien‐sis[J]. Journal of the American Society for Horticultural Sci‐ence,1997,122(6):764-771.
[8] GAO M,TAO R,MIURA K,DANDEKAR A M,SUGIURA A.Transformation of Japanese persimmon (Diospyros kaki Thunb.)with apple cDNA encoding NADP-dependent sorbitol-6-phos‐phate dehydrogenase[J].Plant Science,2001,160(5):837-845.
[9] TAO R,SUGIURA A. Adventitious bud formation from callus cultures of Japanese persimmon[J]. HortScience,1992,27(3):259-261.
[10] MAI Y N,LIU Y,YUAN J Y,YE L S,ZHANG Y,DIAO S F,HAN W J,SUO Y J,LI H W,HU R Y,SUN P,LI Z,FU J M.Establishment of an efficient genetic transformation system:A case study of RNAi-induced silencing of the transcription factor MeGI in Diospyros oleifera Cheng seedlings[J]. Scientia Horti‐culturae,2023,308:111560.
[11] LI X H,JIANG Z Y,SHEN Y Y,LI F H,YU X Y,QU S C. In vitro regeneration and Agrobacterium tumefaciens-mediated ge‐netic transformation of D. lotus (Diospyros lotus L.)[J]. Scientia Horticulturae,2018,236:229-237.
[12] ZHANG M,YANG S C,CHEN W X,XU L Q,GUO D Y,LUO Z R,ZHANG Q L. An efficient Agrobacterium-mediated genetic transformation system for persimmon (Diospyros kaki Thunb.)[J].Horticulturae,2022,8(5):422.
[13] 李晶,罗玉洁,张青林,罗正荣,刘继红. 君迁子休眠芽及叶片离体培养体系优化及植株再生[J]. 华中农业大学学报,2016,35(4):14-19.LI Jing,LUO Yujie,ZHANG Qinglin,LUO Zhengrong,LIU Ji‐hong. In vitro culture system optimization and regeneration of date plum (Diospyros lotus Linn.) dormant buds and leaves[J].Journal of Huazhong Agricultural University,2016,35(4):14-19.
[14] 师校欣,杜国强,马俊莲,高仪,王蕾.磨盘柿离体叶片愈伤组织发生及不定芽诱导[J].果树学报,2004,21(4):376-378.SHI Xiaoxin,DU Guoqiang,MA Junlian,GAO Yi,WANG Lei.Callus formation and adventitious bud regeneration from leaves in vitro in persimmon (Diospyros kaki)[J]. Journal of Fruit Sci‐ence,2004,21(4):376-378.
[15] RITONGA F N,CHEN S. Physiological and molecular mecha‐nism involved in cold stress tolerance in plants[J]. Plants,2020,9(5):560.
[16] CANELLA D,GILMOUR S J,KUHN L A,THOMASHOW M F.DNA binding by the Arabidopsis CBF1 transcription factor re‐quires the PKKP/RAGRxKFxETRHP signature sequence[J].Biochimica et Biophysica Acta,2010,1799(5/6):454-462.
[17] CARVALLO M A,PINO M T,JEKNIC Z,ZOU C,DOHERTY C J,SHIU S H,CHEN T H H,THOMASHOW M F.A compari‐son of the low temperature transcriptomes and CBF regulons of three plant species that differ in freezing tolerance:Solanum commersonii,Solanum tuberosum,and Arabidopsis thaliana[J].Journal of Experimental Botany,2011,62(11):3807-3819.
[18] HELLENS R P,ALLAN A C,FRIEL E N,BOLITHO K,GRAF‐TON K,TEMPLETON M D,KARUNAIRETNAM S,GLEAVE A P,LAING W A. Transient expression vectors for functional genomics,quantification of promoter activity and RNA silencing in plants[J].Plant Methods,2005,1:13.
[19] HU Z,BAN Q Y,HAO J,ZHU X X,CHENG Y H,MAO J L,LIN M L,XIA E H,LI Y Y. Genome-wide characterization of the C-repeat binding factor (CBF) gene family involved in the response to abiotic stresses in tea plant (Camellia sinensis)[J].Frontiers in Plant Science,2020,11:921.
[20] YANG X Y,WANG R,JING H H,CHEN Q Y,BAO X L,ZHAO J T,HU G B,LIU C M,FU J X. Three novel C-repeat binding factor genes of Dimocarpus longan regulate cold stress response in Arabidopsis[J]. Frontiers in Plant Science,2020,11:1026.
[21] TAO R,HANDA T,TAMURA M,SUGIURA A. Genetic trans‐formation of Japanese persimmon (Diospyros kaki L.) by Agro‐bacterium rhizogenes wild type strain A4[J].Journal of the Japa‐nese Society for Horticultural Science,1994,63(2):283-289.
[22] TAO R,URATSU S L,DANDEKAR A M.Relative virulence of Agrobacterium strains on persimmon (Diospyros kaki L.)[J].Ac‐ta Horticulturae,1995,392:171-178.
[23] TAO R.Agrobacterium-mediated genetic transformation in Japa‐nese persimmon[J].Acta Horticulturae,2003,601:57-63.
[24] TAMURA M,GAO M,TAO R,LABAVITCH J M,DANDEK‐AR A M.Transformation of persimmon with a pear fruit polyga‐lacturonase inhibiting protein (PGIP) gene[J]. Scientia Horticul‐turae,2004,103(1):19-30.