川西高原位于四川省西部横断山脉地区,因其具有光照充足、昼夜温差大、夏季凉爽、降雨少而蒸发量大等气候特点,非常适宜酿酒葡萄的生长,是中国酿酒葡萄优质产区。然而,该地区葡萄园管理技术普遍落后,病害管理松散,导致个别地块葡萄根癌病频发,难以有效控制。葡萄根癌病能导致树势减弱、叶片脱落、结果能力差、严重时整株枯死,川西高原部分发病园区内葡萄植株死亡率达40%,造成了巨大的经济损失。因此,明确川西高原地区酿酒葡萄根癌病病原菌类型,筛选具有针对性的防治药剂,能为当地葡萄根癌病的防治及酿酒葡萄健康生产提供依据。葡萄根癌病是一种由土壤杆菌引起的严重植物病害,病原菌进入根茎组织导致细胞大量增生,从而形成瘿瘤[1]。瘿瘤可在葡萄根茎、主枝、侧枝和结果母枝等部位形成,且瘿瘤内部木质化严重阻碍植株水分及营养物质运输,导致植株生长发育受限,最终干枯死亡[2-3]。根癌病在世界范围均有发生,在中国主要集中在北方地区,造成严重减产[4-6]。引起根癌病的病原菌属于土壤杆菌属(Agrobacterium spp.),包括根癌土壤杆菌(A. tumefaciens)、发根农杆菌(A. rhizogenes,亦命名为Rhizobium rhizo‐genes)、悬钩子土壤杆菌(A. rubi)和葡萄土壤杆菌(A. vitis,亦命名为Allorhizobium vitis)[7-9]。根癌土壤杆菌和葡萄土壤杆菌均能侵染葡萄引起根癌病,其中以葡萄土壤杆菌为主要致病菌[10-14]。此外,土壤杆菌属可依据生理生化性状分为3 种生物型:生物Ⅰ型,以根癌土壤杆菌为主;生物Ⅱ型,以悬钩子土壤杆菌及发根农杆菌为主;生物Ⅲ型,以葡萄土壤杆菌为主[7-10,15-19]。研究发现,不同生物型土壤杆菌的寄主范围不同,在植物中表现出的致病力存在差异[16-19],且杀菌剂及抗生素对其抑制效果不尽相同,乙蒜素和四霉素对分离自樱桃及欧李的生物Ⅰ型土壤杆菌有较强抑制效果[20-21],而福美双、青霉素、硫酸链霉素对生物Ⅲ型根瘤菌有较强抑制效果[22-23]。对不同地区病原菌菌株类型进行鉴定,可为筛选针对性药剂提供理论依据。现阶段根癌病的防治主要依赖于田间管理、化学药剂及生物防治,其中田间管理着重在加强栽培管理,增强树势,阻止病原引入及传播[24-25];化学药剂以硫酸铜液、石硫合剂、波尔多液等广谱杀菌剂的使用为主[24,26-27]。此外,生物防治中,非致病菌A. radiobacter K84、A. vitis E26、A. vitis VAR031,A. vitis ARK-1 和A. vitis F2/5 等可抑制土壤杆菌生长及根瘤的形成[28-33]。目前对中国川西高原地区葡萄根癌病的发生原因及主要致病菌情况不明,且现阶段针对葡萄根癌病防治措施的研究十分有限,商品化药剂对葡萄根癌病的防治效果尚不清晰,不利于生产上该病害的防治。笔者在本研究中以调查四川省甘孜州葡萄根癌病发生原因为切入点,通过明确川西高原地区葡萄根癌病致病菌类型及特征,探究商品化药剂对病原菌的抑制作用及对葡萄根癌病的防治效果,为研究出行之有效的葡萄根癌病防治措施提供理论依据及技术指导,为该地区酿酒葡萄产业的可持续发展作出贡献。
1 材料和方法
1.1 供试材料
1.1.1 病原菌的分离和培养 于四川省甘孜州乡城县酿酒葡萄园采集带有新生瘿瘤的赤霞珠葡萄根茎组织,清理瘿瘤表面的老化组织并用无菌水冲洗,以8%次氯酸钠溶液及75%乙醇先后进行3 min 和30 s的表面消毒,并以无菌水充分漂洗3 次。切取瘿瘤内部新鲜组织并进行低温研磨,研磨后加入YEB 培养基28 ℃振荡培养。培养4 h后,静置取上清液,按10、100、1000、10 000 倍梯度稀释,涂布于MW 筛选培养基板上,于28 ℃条件下培养5~8 d。观察并记录分离菌落的形态特征。选取表面光滑微凸、乳白色到白色、圆形的典型土壤芽孢杆菌菌落划线于YEB平板上,进行纯化培养。
供试阳性对照为葡萄土壤杆菌(Agrobacterium vitis)L3菌株,由河北农业大学园艺学院杜国强教授惠赠。
1.1.2 葡萄品种、培养基及供试药剂 葡萄品种:赤霞珠(Vitis vinifera‘Cabernet Sauvignon’)及马瑟兰(V.vinifera‘Marselan’)1年生盆栽幼苗。
培养基:MW 培养基(甘露醇15 g;NaNO3 7.5 g;KH2PO4 0.45 g;NaCl 0.3 g;MgSO4·7H2O 0.15 g;0.1%生物素0.15 mL;0.1% 结晶紫3 mL;0.1% Fe-EDTA 3 mL 加蒸馏水至1.5 L);YEB培养基(牛肉膏5 g;胰蛋白胨5 g;蔗糖5 g;酵母提取物1 g;MgSO4 0.5 g,加水至1 L,调pH 为7.2~7.5。固体培养基加10~12 g琼脂粉)。
供试药剂:0.3%四霉素水剂(辽宁微科生物工程有限公司,登记证号:PD20160345)、80%乙蒜素乳油(开封大地农化生物科技有限公司,登记证号:PD20101285)、50%福美双可湿性粉剂(河北冠龙农化有限公司,登记证号:PD85122-13)、50%多菌灵可湿性粉剂(四川国光农化股份有限公司,登记证号:PD85150-35)、75%百菌清可湿性粉剂(上海惠光环境科技有限公司,登记证号:PD20060203)、46%氢氧化铜水分散粒剂(美国杜邦公司,登记证号:PD85122-13)、33.5%喹啉铜悬浮剂(兴农药业有限公司,登记证号:PD20150445)、20%春雷霉素可湿性粉剂(乳山韩威生物科技有限公司,登记证号:PD20183246)、3%中生菌素可湿性粉剂(福建凯立生物制品有限公司,登记证号:PD20110113)、100亿活菌/克解淀粉芽孢杆菌KN-527 液体(武汉科诺生物科技股份有限公司,登记证号:微生物肥(2018)准字(3342)号)、100亿芽孢/克枯草芽孢杆菌可湿性粉剂( 德强生物股份有限公司,登记证号:PD20140340)。
1.2 试验方法
1.2.1 分离菌株的DNA 提取 将分离纯化得到的各个菌株的单一菌落接种至YEB 液体培养基中,于28 ℃恒温振荡培养48 h 后,参照Hi-DNAsecure Plant Kit 高效植物基因组DNA 提取试剂盒(天根,北京)说明书进行各菌株的DNA提取。
1.2.2 分离菌株的16s rDNA 扩增及系统发育树构建 以上述提取得到各菌株的DNA为模板,使用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')/1492R(5'-AAGGAGGTGATCCAGCCGCA-3')进行16s rD‐NA序列的扩增。扩增后利用琼脂糖凝胶DNA回收试剂盒(简石生物,北京)回收长度1500 bp左右的目的条带,并送至北京擎科生物科技股份有限公司(Beijing Tsingke Biotech Co.,Ltd.)进行测序。将测序所得序列在National Center for Biotechnology In‐formation(NCBI)网站中使用The Basic Local Align‐ment Search Tool(BLAST)工具进行比对,筛选出相似度高于98%的16s rDNA 序列,并利用MEGA(Version 11.0.13)软件构建分离菌株与其他标准菌株之间的系统发育树(最大似然法maximum-likeli‐hood)。
1.2.3 分离菌株的PCR 鉴定 以各菌株的DNA 为模板,利用下述引物完成PCR 鉴定,用于扩增章鱼碱型和胭脂碱型土壤杆菌T-DNA 上的iaaH 基因的引物 iaaH- F(5'- CATGCATGAGTTATCGTTTG‐GAAT- 3')/iaaH- R(5'- GCATCAGGTCATCGTA‐AAAGTAGGT-3')[22];用于扩增葡萄土壤杆菌含精氨酸型质粒(arginine plasmid,AP)T-DNA 上的iaaM 基因的引物AP-F(5'-CGCGTCCCCGTTTACACTA-3')/AP-R(5'-CGAGATCGCGCTTCAAGAT-3')[22];用以扩增章鱼碱型质粒(octopine plasmid,OP)OP-F(5'- ATGGCTAAAGTGGCAATTTTGGG- 3')/OP- R(5'-TCAGATTGAATTCGCCAACTCG-3');用以扩增胭脂碱型质粒(nopaline plasmid,NP)NP-F(5'-TGACAGGATATATTGGCGGGTAA- 3')/NP- R(5'-TGCTCCGTCGTCAGGCTTTCCGA-3')[18,34]。
1.2.4 分离菌株的生物型鉴定 根据《伯杰细菌鉴定手册》[35]和《植物病原细菌鉴定实验指导》[36]中的不同试验的表现指标来对分离出的具有致病性的菌株进行生物型的鉴定,具体包括3-酮基乳糖检测、石蕊牛乳产碱、耐盐性生长、35 ℃生长、乙醇产酸、柠檬酸盐利用、柠檬酸铁铵产褐色表膜和Kerr 培养基生长。
1.2.5 分离菌株的生长曲线的测定 将各菌株分别在YEB 培养基上活化,将活化后OD600值为0.8 的菌液接种20µL至2 mL YEB液体培养基中,28 ℃振荡培养24 h,每隔3 h 测1 次OD600值,每个菌株做3 管重复,试验3次重复。
1.2.6 分离菌株的致病性分析 将活化后的各分离菌株悬于PBS 缓冲液中(OD600=0.8),取200µL 涂抹于胡萝卜圆盘上,对照组接种等量PBS缓冲液,将接种后胡萝卜圆盘放在用无菌水浸湿的滤纸培养皿内,25 ℃光照条件下培养并随时观察是否有增生组织形成。于日光温室中培养葡萄盆栽苗,待葡萄盆栽幼苗长至5 枚叶片时进行划伤接种,用无菌针头轻轻划伤幼嫩主茎,迅速将100 µL 悬于PBS 缓冲液中(OD600=0.8)的A10 菌液接种在划伤处,对照组划伤接种等量PBS 缓冲液,每组接种8 盆植株。接种后每隔3 d 观察接种部位是否有肿大或突起形成。
1.2.7 不同药剂的皿内抑制试验 在直径为6 mm的圆形无菌滤纸滴加7µL 不同浓度的药剂,于超净台中吹干制成含药滤纸备用。于YEB 培养基上活化葡萄土壤杆菌A10菌株,吸取200µL OD600=0.1的菌液均匀涂布于YEB 平板上,在培养基表面均匀放上2 片含药滤纸,对照组放入滴加无菌水的滤纸片。将培养皿正置放入4°C条件下6~8 h,再倒置放入28°C培养2~5 d,观察到抑菌圈的出现后,采用十字交叉法测量滤纸的抑菌圈直径,试验3次重复。
1.2.8 不同药剂的盆栽苗抑制试验 将生长水平基本一致的盆栽赤霞珠葡萄苗用划伤接种法接种等量A10 菌株(OD600=0.8),置于日光温室内培养,每个处理接种30 株。接种后1 d,在葡萄茎部接种部位涂抹200 µL 500 倍稀释药剂,每周涂抹两次,对照组以等量清水处理,于药后第一周开始,观察结瘤情况,从第一次观察到细小突起开始,每隔3 d记录接种部位的发病情况,发病率/%=发病植株/总接种植株×100;同时记录接种部位出现突起或瘤状物的个数,根据瘿瘤数量及大小对病害严重度进行分级并赋分,0 级:植物健康,未出现瘿瘤,赋0 分;1级:出现瘿瘤,瘿瘤小,触摸有细微凸起,赋1 分;2级:瘿瘤可清楚观测,隆起明显,赋2 分;3 级:瘿瘤占着生部位截面直径1/3,观察到组织明显增生,赋3 分;4 级:瘿瘤占着生部位截面直径2/3,着生部位出现坏死,赋4 分;5 级:瘿瘤超过着生部位截面直径,周边组织大范围坏死,赋5 分。对于每个处理,病害严重度以该处理下所有接种部位病害严重度的平均值表示:病害严重度=Σ(各级病瘤的数量×各级分值)/总接种数量;病情指数=Σ(各级病害部位数量×相对级数值)/(总接种数量×5)×100;防治效果/%=(对照病情指数-处理病情指数)/对照病情指数×100。
1.3 数据处理
数据采用Excel 2016 和SigmaPlot 14.0 软件作图和统计分析,显著性检验采用Duncan氏新复极差法,p<0.05。
2 结果与分析
2.1 葡萄根癌病的危害及田间症状
对2020—2022 年川西高原地区酿酒葡萄根癌病的发生情况进行调查,发病葡萄园中平均植株病死率为20%~35%,严重地块的病死率为50%~80%。冬季时期带病葡萄植株的根茎部位能观察到表面粗糙、木质化、呈深褐色的瘿瘤,且瘿瘤多呈单侧分布(图1-A)。新生瘿瘤由春季开始形成,于6—7 月时表现为明显瘤状突起(图1-B),新生瘿瘤内部为黄白色或黄绿色,且尚未木质化。于7 月上旬在两处葡萄园内不同地块中采集带有新生瘿瘤的赤霞珠葡萄根茎组织(图1-C~D),进行葡萄根癌病的病原菌分离及鉴定。

图1 葡萄根癌病田间发病植株调查及采样
Fig.1 Field investigation and sampling of grape crown gall
2.2 病原菌的分离、鉴定及系统进化分析
通过对新鲜根瘤进行表面消毒、研磨、涂板等操作,于MW 筛选培养基上初步分离得到471 个单菌落。观察记录菌落形态特征后,筛选出乳白色、表面光滑、边缘整齐的圆形菌落共130 个,分别挑取于YEB 培养基上进行划线培养,对YEB 培养基上生长并符合土壤杆菌典型特征的菌株进一步分离纯化。最终挑选出48株符合土壤杆菌形态的菌株,分别提取DNA 并利用混合引物PCR 扩增土壤杆菌T-DNA 上iaaH及iaaM基因进行菌株的筛选,PCR初筛后得到9 株阳性疑似菌株。对这9 个菌株进行16s rDNA 片段的扩增,并成功获得长度约1500 bp 的目的片段(图2-A)。片段纯化测序后进行序列比对。结果表明,这9 个菌株与Genebank 中葡萄土壤杆菌(Agro‐bacterium vitis)相似度均大于98%。利用最大似然法(maximum-likelihood)进行系统发育树的构建(图2-B),发现分离所得9个菌株均聚类在一个分支上,且与数据库中A. vitis CG78(CP056047.1)、A. vitis CG678(CP056042.1)及A. vitis S4(CP000633.1)聚为一支,与根癌土壤杆菌(A. tumefaciens)ATCC13332(HQ735085.1)和悬钩子土壤杆菌(A.rubi)LMG294(FR828342.1)亲缘关系较近,与发根农杆菌(A. rhizogenes)K599(CP019702.1)亲缘关系较远。通过上述形态学及序列分析,确定分离所得9 个菌株均为葡萄土壤杆菌(A. vitis),分别命名为A10、A11、A18、A28、A30、A33、A38、A51 和A53。然后通过PCR 技术鉴定分离菌株是否属于含精氨酸型质粒(AP)、胭脂碱型质粒(NP)或章鱼碱型质粒(OP)的土壤杆菌,结果(图2-C)表明,9 个菌株及正对照菌株L3在精氨酸引物(AP-F/AP-R)的扩增下均获得约750 bp 的片段,而负对照并未出现条带,9 个菌株在胭脂碱引物(NP-F/NP-R)和章鱼碱(OP-F/OP-R)扩增下均无条带,仅章鱼碱类型的正对照菌株L3 在OP-F/OP-R 扩增下出现约300 bp 片段。因此,PCR 鉴定结果表明,分离所得9 个菌株均为精氨酸类型的葡萄土壤杆菌。
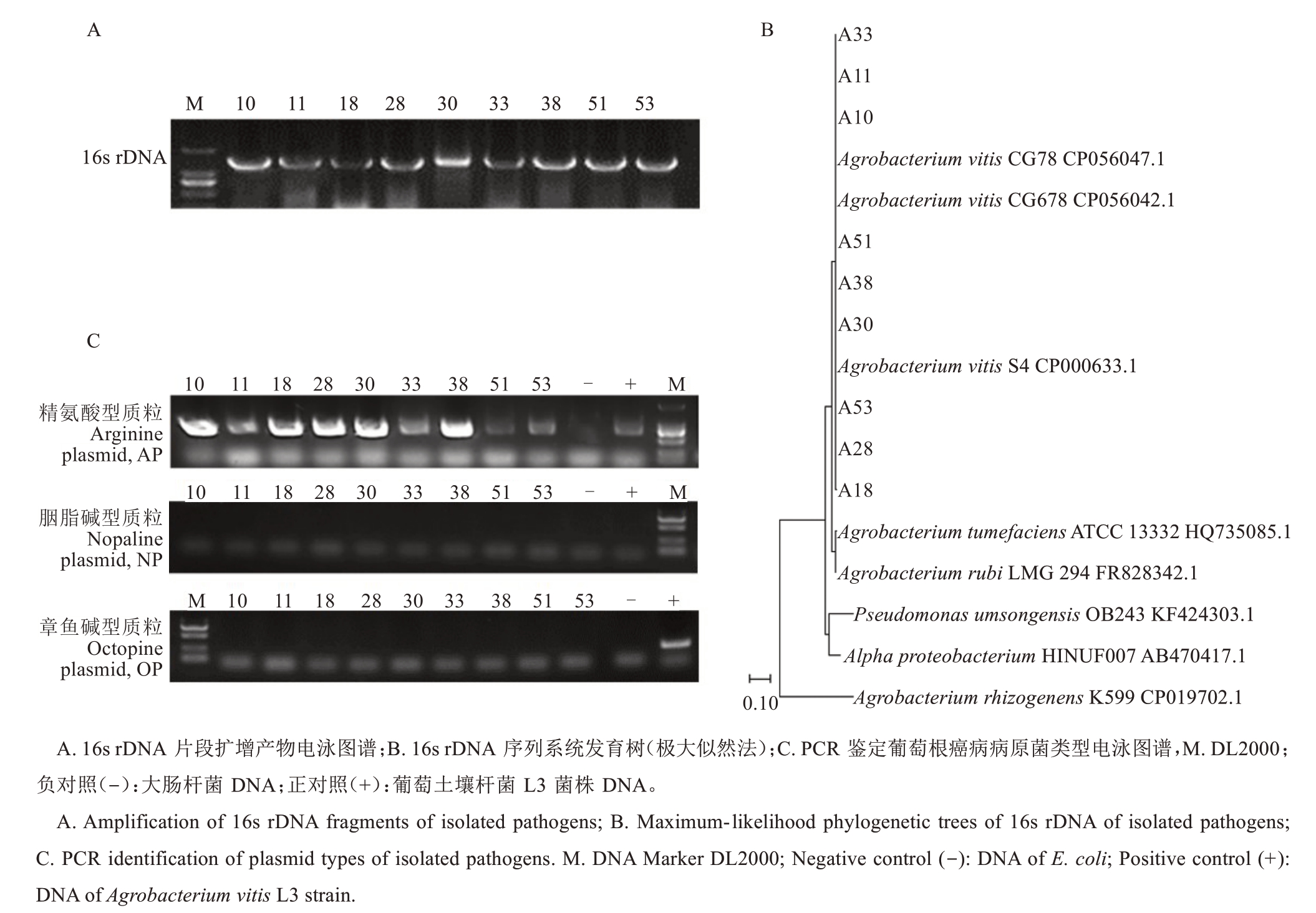
图2 分离病原菌的PCR 鉴定电泳图谱及16s rDNA 序列进化分析
Fig.2 PCR identification and phylogenetic trees of 16s rDNA of isolated pathogens
2.3 分离病原菌生长特性分析
为了明确各分离菌株的生长特性,通过测定9个菌株及对照菌株L3在YEB液体培养基中OD600的数值绘制各菌株生长曲线(图3)。结果表明,菌株A11、A28、A30、A38 及A51 在3~6 h 进入对数生长期,12 h后进入平台期,这5个菌株比L3菌株生长繁殖更快。A10、A18、A33、A53的生长适应期较长,3~6 h 时这些细菌的培养液仍然比较清澈,从9 h 后开始进入对数生长期,其中A10 生长最为缓慢,这4 个菌株比L3 菌株生长繁殖更慢。分离所得9 个菌株表现出不同的生长繁殖速度。
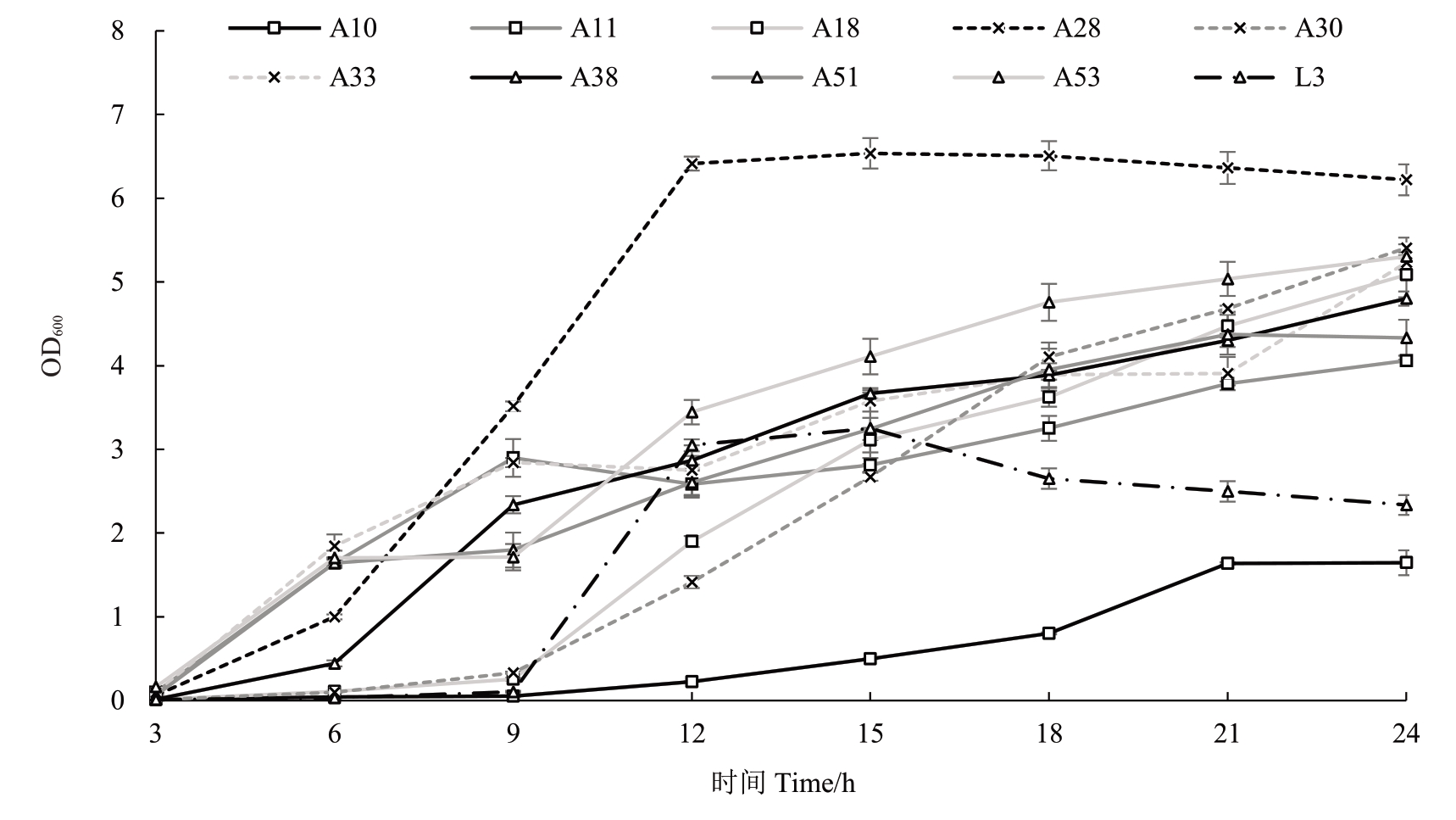
图3 分离病原菌的生长曲线
Fig.3 Growth curve of isolated pathogens
2.4 分离病原菌生理生化鉴定
对分离菌株进行生理生化鉴定,包括生成3-酮基乳糖检测、石蕊牛乳产碱、耐盐性生长、35 ℃生长、乙醇产酸、柠檬酸盐利用、柠檬酸铁铵产褐色表膜和Kerr培养基生长检测,检测结果如表1所示,根据根癌农杆菌生物型鉴定指标判断[35,37],其中A10、A11、A18、A28、A30、A33、A38、A51、A53 菌株与生物Ⅲ型菌株生理生化反应一致。分离所得菌株为生物Ⅲ型土壤杆菌。
表1 病原菌生理生化检测
Table 1 Bacteriological test of isolated strains
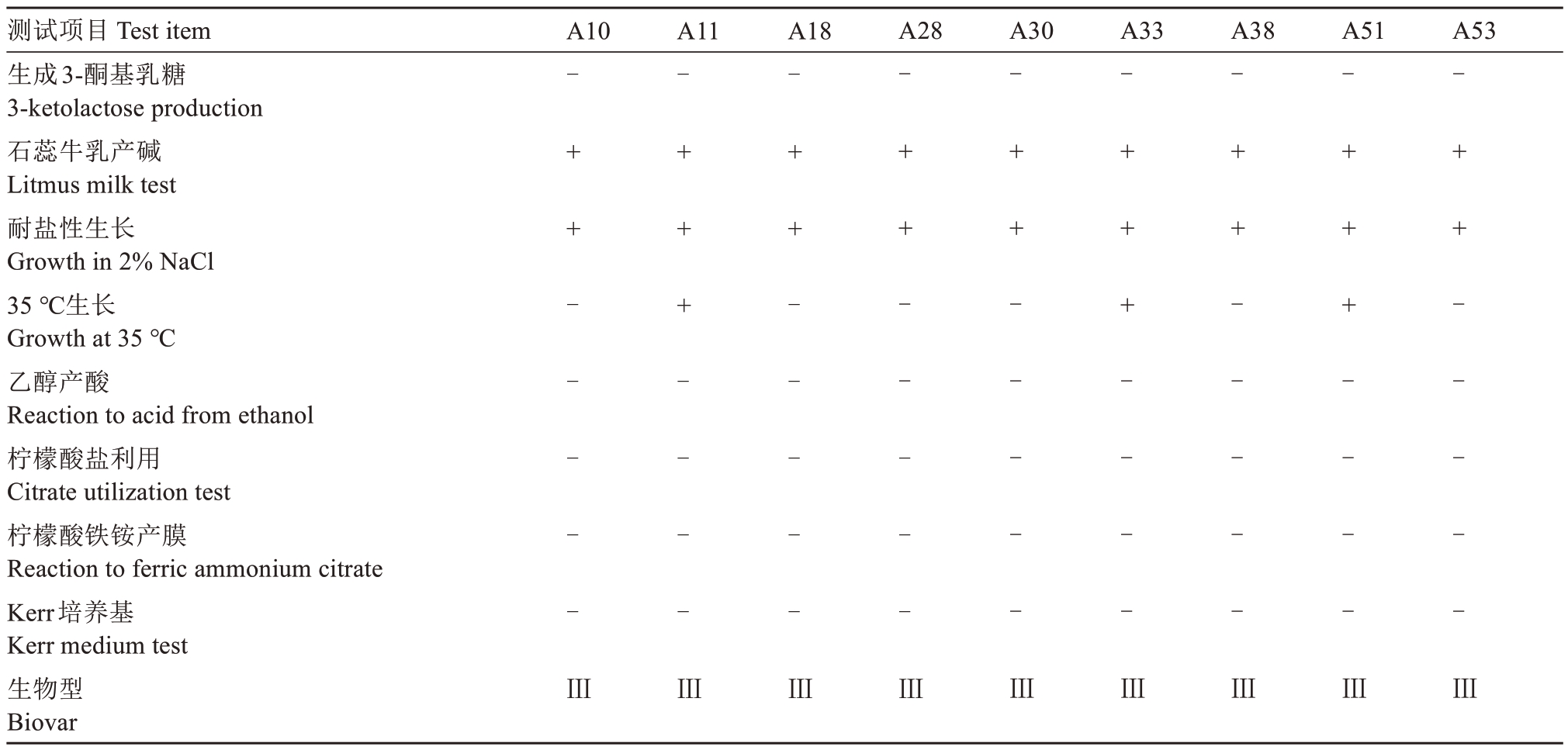
注:“+”为阳性,“-”为阴性。
Note:“+”is positive,“-”is negative.
测试项目Test item生成3-酮基乳糖3-ketolactose production石蕊牛乳产碱Litmus milk test耐盐性生长Growth in 2%NaCl 35 ℃生长Growth at 35 ℃乙醇产酸Reaction to acid from ethanol柠檬酸盐利用Citrate utilization test柠檬酸铁铵产膜Reaction to ferric ammonium citrate Kerr培养基Kerr medium test生物型Biovar A10 A11 A18 A28 A30 A33 A38 A51 A53-++-----Ⅲ-+++----Ⅲ-++-----Ⅲ-++-----Ⅲ-++-----Ⅲ-+++----Ⅲ-++-----Ⅲ-+++----Ⅲ-++-----Ⅲ
2.5 分离病原菌的致病性测定
为了明确分离出菌株的致病性,将9 个菌株分别接种于胡萝卜圆盘中心位置,并以接种PBS 缓冲液作为对照处理(CK)(图4)。分别接种9 个菌株的胡萝卜圆盘在7 d 后出现明显绿色增生组织,而CK组胡萝卜圆盘无增生组织出现,证明分离得到9 个菌株均具有致瘤性。为了进一步验证分离菌株在葡萄上的致病性,通过划伤接种法将A10 菌液(悬于PBS 缓冲液)分别接种在1 年生赤霞珠幼苗及马瑟兰幼苗的茎部,以接种等量PBS 缓冲液的葡萄幼苗为对照处理(CK)。接种后约1 个月,观察到赤霞珠及马瑟兰幼苗茎部接种部位出现明显乳白色瘤状突起,而CK 组葡萄仅有划伤后的细线状愈合痕迹,无任何增生或突起组织。这说明分离出的菌株能够在葡萄上形成瘿瘤,具有致病性。
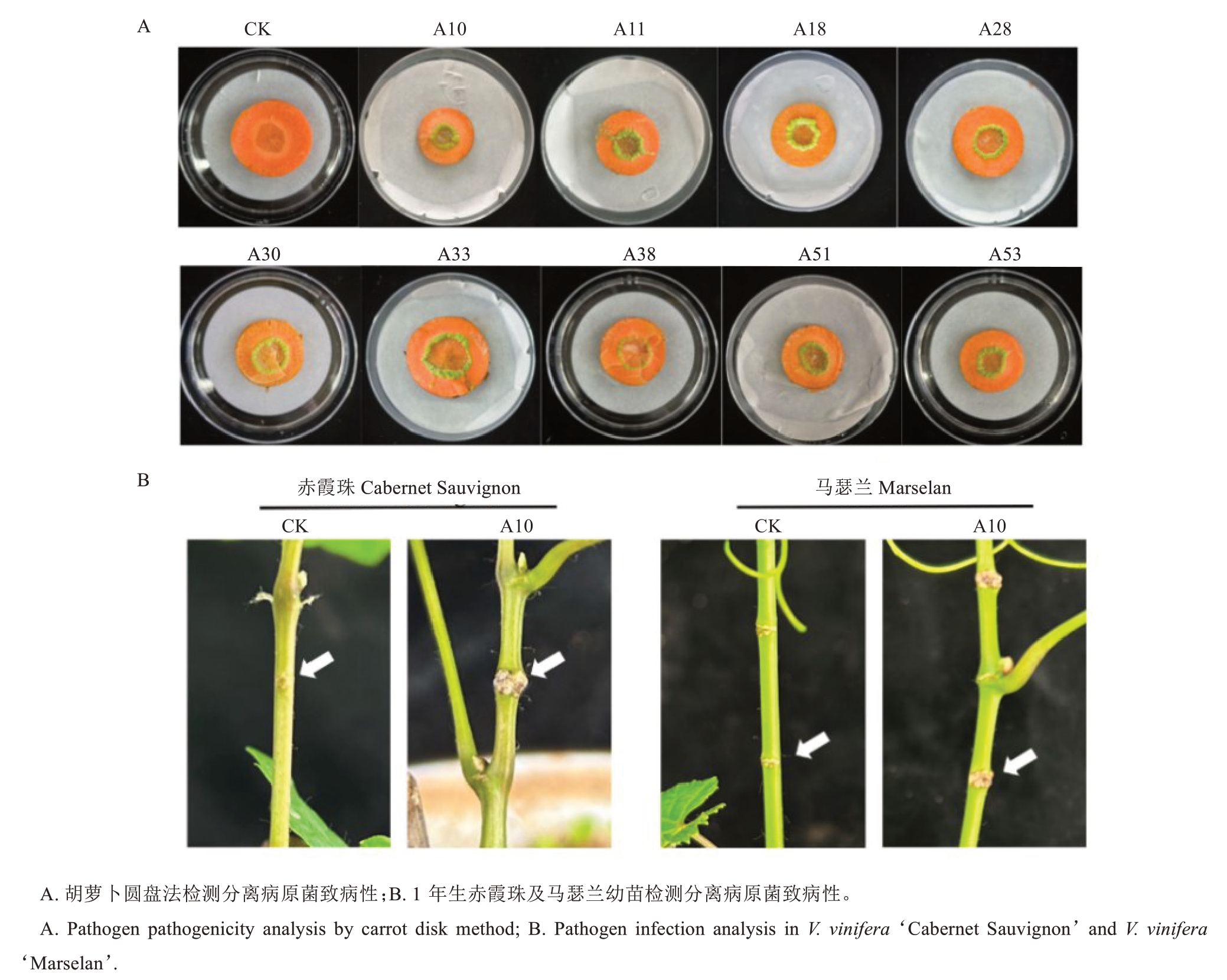
图4 胡萝卜圆盘法及葡萄幼苗检测分离病原菌的致病性
Fig.4 Pathogenicity analysis of isolated pathogens by carrot disk method and grape seedling infection
2.6 分离病原菌的皿内药剂防治研究
为了明确商品化药剂对分离所得葡萄土壤杆菌A10 菌株的抑制效果,选取商品化乙蒜素、四霉素、氢氧化铜、福美双、多菌灵、春雷霉素、百菌清、中生菌素、喹啉铜、枯草芽孢杆菌和解淀粉芽孢杆菌KN-527 这11 种药剂,采用滤纸片抑菌圈法分析不同稀释倍数下11 种药剂对A10 菌株的皿内抑制效果,观察各药剂形成的抑菌圈,并测量直径(表2)。结果表明,除氢氧化铜外,其余10 种供试药剂对葡萄土壤杆菌均有抑制作用,但抑制效果有明显差别。其中多菌灵和春雷霉素较弱,仅在250 倍有抑制效果;福美双在500 倍稀释范围内有抑制效果;中生菌素在750 倍稀释范围内有抑制效果;四霉素、百菌清及喹啉铜在1000 倍范围内均有抑制效果;乙蒜素在1500 范围内有抑制效果。通过对比各药剂的作用浓度及其产生的抑菌圈大小,发现9 种化学杀菌剂中,四霉素、百菌清、乙蒜素和喹啉铜对分离病原菌A10菌株的抑制效果较好。对比两种商品化生防菌剂的抑制效果,发现相同稀释倍数下,解淀粉芽孢杆菌KN-527的抑菌圈直径远大于枯草芽孢杆菌,因此商品化解淀粉芽孢杆菌KN-527 对病原菌的抑制效果优于商品化枯草芽孢杆菌。
表2 供试药剂对病原菌的抑菌效果
Table 2 The inhibitory effect of microbicides and biocontrol agents against A.vitis
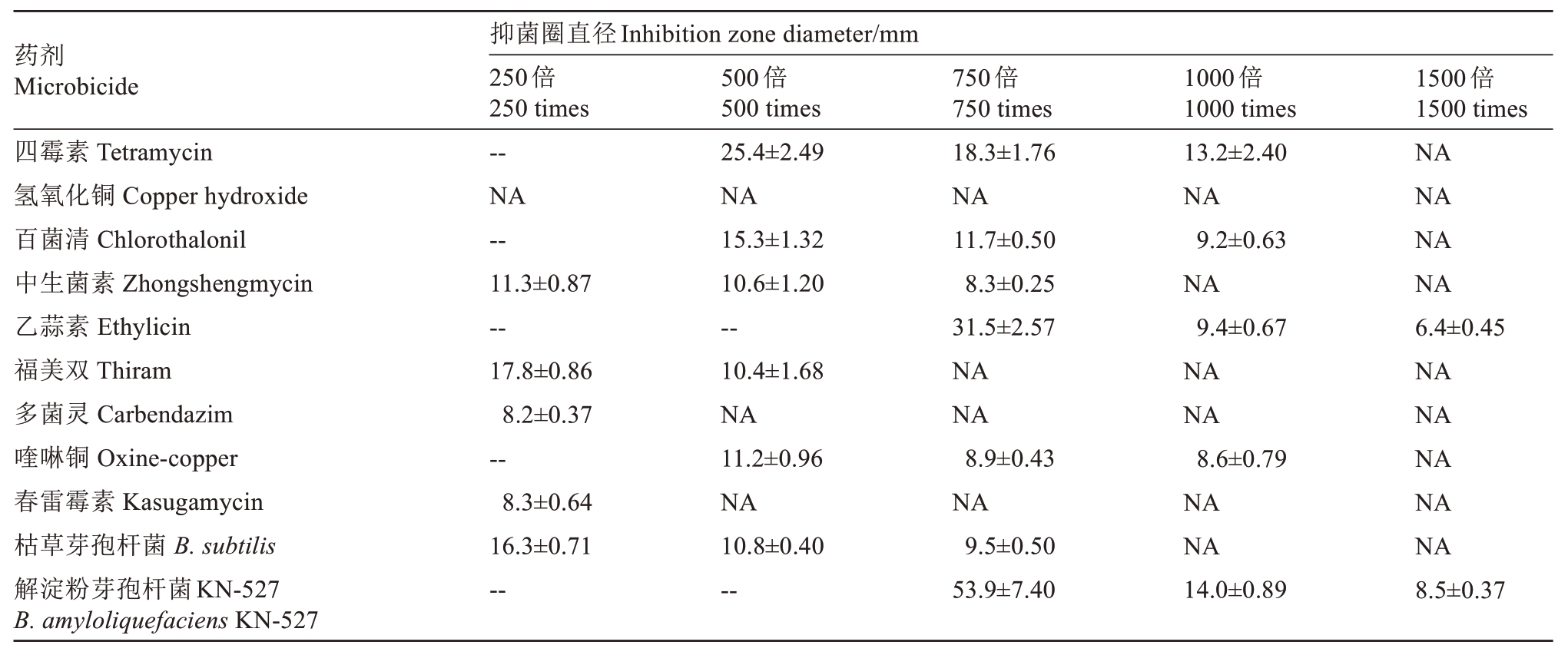
注:NA 表示没有抑菌圈出现,--表示有明显抑菌圈出现但超出测量范围。
Note:NA indicates there was no inhibitory zone;--indicates that a significant inhibitory zone that beyond the measurement range.
?
2.7 分离病原菌的盆栽苗药剂防治研究
选取皿内抑制效果较好的5 种药剂(四霉素、乙蒜素、百菌清、喹啉铜和解淀粉芽孢杆菌KN-527)进行盆栽苗葡萄根癌病防治试验。将A10菌株采用划伤接种法接种在1 年生赤霞珠幼苗茎部,接种后进行药剂处理并以清水处理为对照。处理后约3 周观察到接种部位开始形成细小突起,然后观察葡萄幼苗发病情况,记录发病率,依据瘿瘤数量及大小对病害严重度进行分级及赋值,并计算不同时间点各处理下植株病害严重度的平均值。结果(图5)表明,相比于对照处理,药剂处理均能够降低葡萄根癌病的发病率(图5-A),其中四霉素、乙蒜素、喹啉铜和解淀粉芽孢杆菌KN-527 处理后幼苗的发病率显著低于对照,乙蒜素处理将发病率控制在6%以内,四霉素处理下发病率约为12%,解淀粉芽孢杆菌KN-527处理下发病率约为12.5%,喹啉铜处理下发病率约为19%。百菌清处理虽然能将发病率控制在40%左右,但与对照组相比无统计学显著差异。对不同药剂处理下病害严重度随时间的变化进行分析,发现四霉素、乙蒜素、百菌清、喹啉铜和解淀粉芽孢杆菌KN-527 的病害严重度均低于对照组,且在后期差距更大(图5-B)。同时发现各药剂处理下病害严重度的变化趋势并不完全一致,喹啉铜处理下前期的病害严重度较高,但增加较为缓慢,而四霉素处理下前期的病害严重度较低,之后急剧增加,乙蒜素处理下的病害严重度较低,且上升趋势较为缓和。
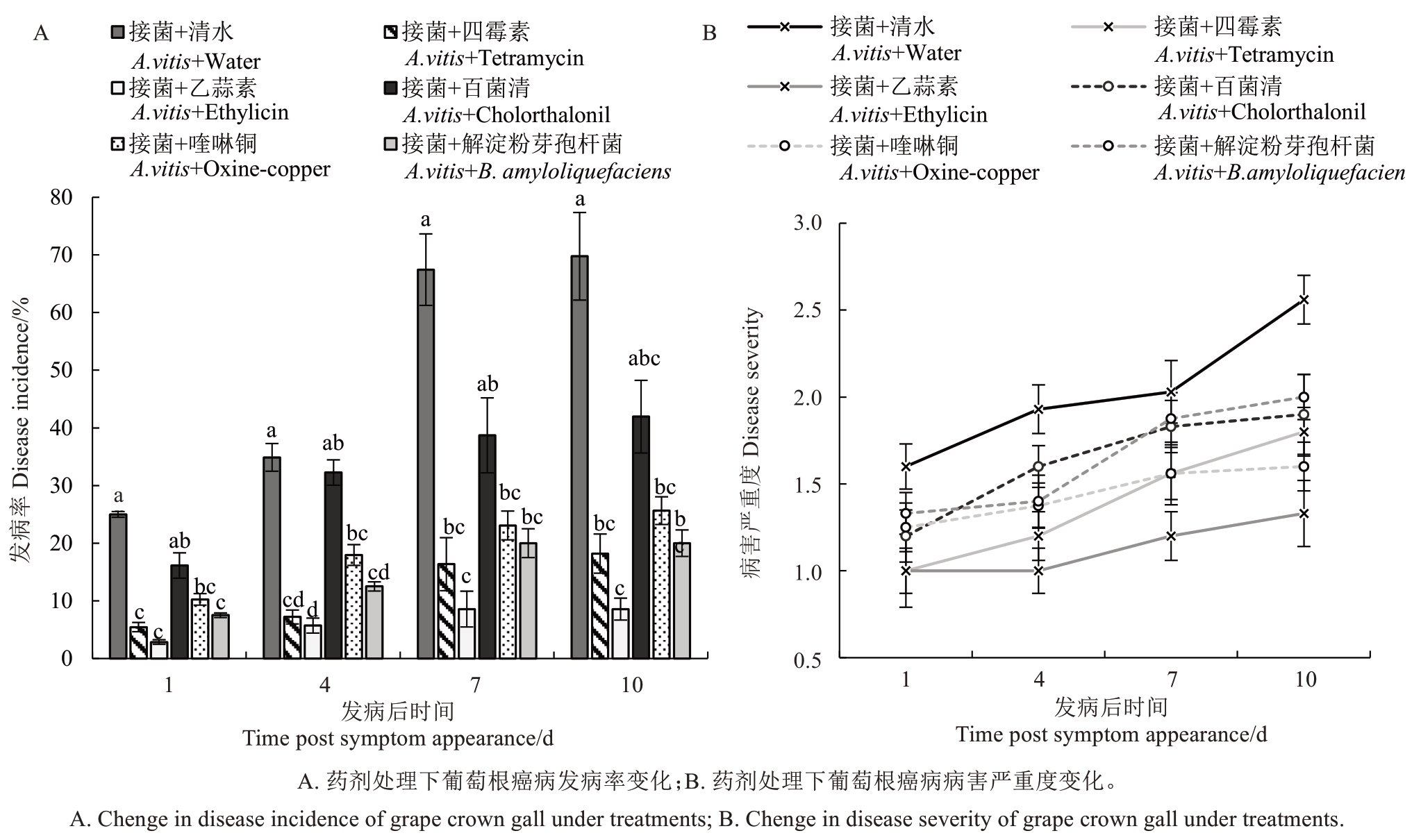
图5 药剂处理后葡萄根癌病发病率及病害严重度变化
Fig.5 Disease incidence and severity changes of grape crown gall under treatments
对各药剂处理后的病情指数及防治效果进行分析(表3),发现乙蒜素处理下病情指数为26.6,防治效果达48.05%;喹啉铜和四霉素略高于乙蒜素,但二者处理后病情指数分别为32和36,防治效果分别为37.50%和29.69%;百菌清和解淀粉芽孢杆菌KN-527 是相对效果较差的两种药剂,二者处理后病情指数分别为38 和40,防治效果分别达25.78%和21.88%。综上,对葡萄幼苗根癌病防治效果最好的药剂为乙蒜素,然后依次为四霉素、喹啉铜、百菌清及解淀粉芽孢杆菌KN-527。
表3 药剂处理后的病情指数及防治效果
Table 3 Disease index and control effect of microbicides
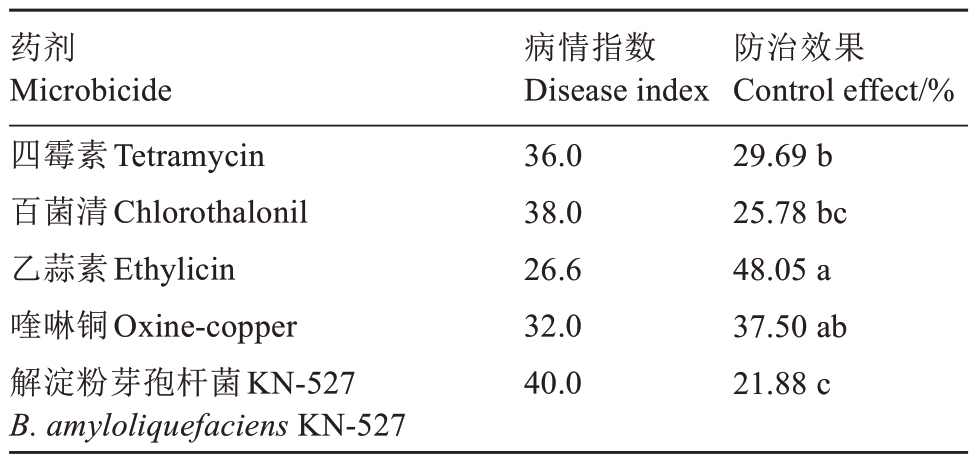
注:不同小写字母代表差异显著(p<0.05)。
Note:Different small letters represent significant difference at 0.05 level.
药剂Microbicide四霉素Tetramycin百菌清Chlorothalonil乙蒜素Ethylicin喹啉铜Oxine-copper解淀粉芽孢杆菌KN-527 B.amyloliquefaciens KN-527病情指数Disease index 36.0 38.0 26.6 32.0 40.0防治效果Control effect/%29.69 b 25.78 bc 48.05 a 37.50 ab 21.88 c
3 讨 论
土壤杆菌(Agrobacterium spp.)能侵染向日葵、樱桃、桃、欧李、葡萄等多种重要的经济作物并产生瘿瘤,研究认为,侵染不同植物的根癌病病原菌在生物型上存在差异[16-18],且造成同种植物根癌病的主要致病菌也会因地区或品种差异而不同[21-22,36]。尽管国内外研究认为葡萄根癌病主要由生物Ⅲ型土壤杆菌的侵染造成[10,14],但是引起不同地区或不同品种葡萄根癌病的主要病原菌并不一致。马德钦等[10]发现生物Ⅲ型土壤杆菌为玫瑰香葡萄的主要致病菌,生物Ⅰ型及Ⅱ型仅能导致部分植株发病。Genov等[38]由不同品种葡萄根瘤分离得到生物Ⅲ型及生物Ⅰ型土壤杆菌,均在葡萄植株上具有致瘤性。尹向田等[18]发现济南南部山区赤霞珠葡萄根癌病主要由生物Ⅰ型土壤杆菌引起。在本研究中,由川西高原地区赤霞珠葡萄发病植株中分离所得9 个菌株均符合生物Ⅲ型土壤杆菌的生理生化特征,且系统进化分析指出分离菌株均与生物Ⅲ型A. vitis S4(CP000633.1)菌株的亲缘关系较近,因此,可以明确川西高原地区赤霞珠葡萄根癌病的主要病原菌为生物Ⅲ型葡萄土壤杆菌,这一发现为该地区根癌病的针对性防治提供了理论基础。
为了明确市售商品化药剂对川西高原地区葡萄根癌病的防治效果,针对11 种商品化药剂对分离菌株的抑制作用及对葡萄根癌病的防治效果进行研究,综合得出针对葡萄根癌病防治效果较好的药剂依次为乙蒜素、四霉素、喹啉铜、百菌清及解淀粉芽孢杆菌KN-527。其中,乙蒜素作为一种能抑制多种真菌及细菌的生物源农药,对欧李和樱桃根癌病病原菌有一定的抑制生长作用[21-20]。在本研究中,乙蒜素在稀释250~1500 倍的条件下对分离葡萄土壤杆菌有明显抑制效果,乙蒜素500 倍液处理下葡萄幼苗病害严重度最低,且发病率仅为6%,防治效果达48.05%,为抑制效果最好的药剂。尽管在本研究中乙蒜素对病原菌的抑制效果不是最好的,但其在葡萄幼苗中防治效果突出,在田间使用中可能具有更大的潜力。此外,研究发现200~800 倍乙蒜素对巨峰葡萄根癌病病原菌仅具有轻微的抑制作用[22],这与本研究皿内试验结果略有不同,因此,乙蒜素针对酿酒葡萄及鲜食葡萄根癌病的防治效果是否一致,仍有待探索。值得注意的是,赵岩等[21]发现乙蒜素400~1000 倍液对向日葵幼苗有药害,然而本研究中使用乙蒜素500 倍涂抹葡萄幼茎,并未观察到药害现象,有效浓度乙蒜素在葡萄上的使用并不会引起植物损伤。四霉素对分离病原菌及葡萄幼苗根癌病有较好的抑制作用和防治效果,虽然四霉素对酿酒葡萄根癌病的防治效果鲜少报道,但四霉素对樱桃及欧李根癌病的病原菌具有抑制作用[20-21]。喹啉铜在葡萄根癌病的防治试验中与四霉素表现相似,均具有一定的防治效果。尽管百菌清、多菌灵及福美双等杀真菌剂对细菌性病害并不具有针对性,但这类药剂在葡萄园中的广泛使用对根癌病的防治是否有协同效果值得讨论。本研究结果表明,百菌清对分离病原菌有较好的抑制效果,对葡萄幼苗根癌病有防治效果,但相比其他待试药剂,防治效果欠佳,这一结论与前人研究[20,22]基本相符。尽管百菌清对细菌性病害不具有针对性,但其对根癌病病原菌有抑制作用,葡萄园中杀真菌剂的使用对根癌病的抑制存在一定的协同效果。由于分离菌株的特性差异,同种药剂对不同品种植物根癌病的防治效果并不一致,针对性地寻找酿酒葡萄根癌病的防治措施非常必要。此外,药剂对病原菌的抑制作用与其对葡萄根癌病的防治效果并不等同,药剂的选择不应单单以对病原菌的抑制效果做标准,更应该充分考虑在植物中的防治效果以及对植株的生长影响及药害情况。
在果树根癌病的防治中,生防菌因具有较好的针对性及防治效果,一直以来是研究的重点[39]。有研究表明,商品化枯草芽孢杆菌SR63可以有效抑制葡萄根癌病[5],然而本研究中使用的商品化枯草芽孢杆菌抑制效果并不明显。本研究中商品化解淀粉芽孢杆菌KN-527 在皿内抑制试验中能够形成抑制圈,对分离病原菌有抑制作用,且将葡萄幼苗根癌病的发病率控制在12.5%以下。尽管解淀粉芽孢杆菌KN-527 作为一种菌肥在病程后期的防治效果并不明显,但其对早期葡萄根癌病的发生有一定的抑制作用,因此推测商品化解淀粉芽孢杆菌KN-527 可能通过占据生态位影响病原菌的生长,从而起到抑制病害早期发生的作用。另有研究表明,解淀粉芽孢杆菌JK10 菌株对蓝莓根癌土壤杆菌有良好的拮抗效果,其发酵液的田间防病效果明显,能有效抑制瘿瘤的形成[40]。因此,解淀粉芽孢杆菌是一种潜在可用于葡萄根癌病的生物防治菌株,但其针对酿酒葡萄根癌病的生防菌株筛选及商业化应用研究仍需加强,且解淀粉芽孢杆菌在大田防治中的效果有待进一步探索。
4 结 论
川西高原酿酒葡萄根癌病的病原菌经鉴定为生物Ⅲ型葡萄土壤杆菌(Agrobacterium vitis),分离得到的9 株菌株生长特性略有差异,但均能致瘤,且在葡萄幼苗上有致病性,分离菌株与生物Ⅲ型A.vitis S4(CP000633.1)菌株的亲缘关系较近。进一步研究11 种商品化的药剂对葡萄根癌病的防治效果,发现中生菌素、福美双、多菌灵、春雷霉素、枯草芽孢杆菌和氢氧化铜对分离菌株抑制效果微弱或无效果,四霉素、百菌清、喹啉铜、乙蒜素及解淀粉芽孢杆菌KN-527对分离菌株抑制效果较好。综合对比发现,对酿酒葡萄根癌病防治效果较好的药剂依次为乙蒜素、喹啉铜、四霉素、百菌清及解淀粉芽孢杆菌KN-527。其中乙蒜素在根癌病田间防治中可能具有较广阔的应用前景,生防菌株解淀粉芽孢杆菌KN-527对早期葡萄根癌病的发生有抑制作用。
[1] FAIST H,KELLER A,HENTSCHEL U,DEEKEN R. Grape‐vine (Vitis vinifera) crown galls host distinct microbiota[J]. Ap‐plied and Environmental Microbiology,2016,82(18):5542-5552.
[2] BURR T J,OTTEN L.Crown gall of grape:Biology and disease management[J]. Annual Review of Phytopathology,1999,37:53-80.
[3] YAĞCI A,KESKIN N,SUCU S,KUNTER B,CANGI R,ALTINCI N. Effects of crown gall (Rhizobium vitis) disease on physical and biochemical characteristics of‘Narince’(Vitis vi‐nifera L.) grape berries[J].Acta Horticulturae,2020(1276):169-174.
[4] GAN H M,SZEGEDI E,FERSI R,CHEBIL S,KOVÁCS L,KAWAGUCHI A,HUDSON A O,BURR T J,SAVKA M A. In‐sight into the microbial co-occurrence and diversity of 73 grape‐vine (Vitis vinifera) crown galls collected across the northern hemisphere[J].Frontiers in Microbiology,2019,10:1896.
[5] 袁丽芳,尹向田,王鹏飞,李廷刚,蒋锡龙,汤小宁,韩金涛,魏彦锋. 葡萄根癌病研究进展及防治措施[J]. 中外葡萄与葡萄酒,2022(5):93-99.YUAN Lifang,YIN Xiangtian,WANG Pengfei,LI Tinggang,JIANG Xilong,TANG Xiaoning,HAN Jintao,WEI Yanfeng.Advances and prevention measures in grape crown gall[J]. Sino-Overseas Grapevine&Wine,2022(5):93-99.
[6] VOEGEL T M,MCGONIGAL P,NELSON L M,ÚRBEZ-TOR‐RES J R.Health status of ready-to-plant grapevine nursery materi‐al in Canada regarding crown gall and description of the first Allo‐rhizobium vitis strain OP-G1 isolated from British Columbia[J].Plant Disease,2023,107(12):3666-3673.
[7] FLORES- FÉLIX J D,MENÉNDEZ E,PEIX A,GARCÍAFRAILE P,VELÁZQUEZ E.History and current taxonomic sta‐tus of genus Agrobacterium[J].Systematic and Applied Microbi‐ology,2020,43(1):126046.
[8] 肖蓉,邓舒,张春芬,宋林昆,杜俊杰.果树根癌病病原菌的分类、命名变迁及抗根癌病果树种质的筛选[J].果树资源学报,2023,4(2):68-72.XIAO Rong,DENG Shu,ZHANG Chunfen,SONG Linkun,DU Junjie. Taxonomy and nomenclature of crown gall disease pathogens and screening of resistant germplasm in fruit tree[J].Journal of Fruit Resources,2023,4(2):68-72.
[9] KUZMANOVIĆ N,BIONDI E,OVERMANN J,PUŁAWSKA J,VERBARG S,SMALLA K,LASSALLE F.Genomic analysis provides novel insights into diversification and taxonomy of Al‐lorhizobium vitis (i.e.Agrobacterium vitis)[J].BMC Genomics,2022,23(1):462.
[10] 马德钦,林应锐,周娟,相望年,游积峰,谢雪梅,陈培民.我国葡萄根癌土壤杆菌的生化型与质粒类型的初步研究[J].微生物学报,1985,25(1):45-53.MA Deqin,LIN Yingrui,ZHOU Juan,XIANG Wangnian,YOU Jifeng,XIE Xuemei,CHEN Peimin. Biotype and plasmid type of Agrobacterium tumefaciens isolated from the crown gall of grapevine in north China[J].Acta Microbiologica Sinica,1985,25(1):45-53.
[11] NOUTOSHI Y,TOYODA A,ISHII T,SAITO K,WATANABE M,KAWAGUCHI A. Complete genome sequence data of non‐pathogenic strain Rhizobium vitis VAR03-1,a biological control agent for grapevine crown gall disease[J]. Molecular Plant-Mi‐crobe Interactions,2020,33(12):1451-1453.
[12] NOUTOSHI Y,TOYODA A,ISHII T,SAITO K,WATANABE M,KAWAGUCHI A.Complete genome sequence data of tumor‐igenic Rhizobium vitis strain VAT03-9,a causal agent of grape‐vine crown gall disease[J]. Molecular Plant-Microbe Interac‐tions,2020,33(11):1280-1282.
[13] CHEBIL S,FERSI R,CHENENAOUI S,ABDELLATIF E,DU‐RANTE G,ZACCHI E,RHOUMA A,MLIKI A. First report of Agrobacterium vitis as causal agent of crown gall disease of grapevine in Tunisia[J].Plant Disease,2013,97(6):836.
[14] 施文骁,王洪凯,郭庆元.葡萄根癌病研究进展[J].浙江农业科学,2013,54(11):1418-1421.SHI Wenxiao,WANG Hongkai,GUO Qingyuan.Research prog‐ress of grapevine crown gall disease[J]. Journal of Zhejiang Ag‐ricultural Sciences,2013,54(11):1418-1421.
[15] RIDÉ M,RIDÉ S,PETIT A,BOLLET C,DESSAUX Y,GAR‐DAN L.Characterization of plasmid-borne and chromosome-en‐coded traits of Agrobacterium biovar 1,2,and 3 strains from France[J]. Applied and Environmental Microbiology,2000,66(5):1818-1825.
[16] 郝峰鸽,李桂荣,王保全,蔡祖国,尤杨,牛生洋.不同地域来源桃根癌病病原菌及其致病性鉴定[J].广东农业科学,2019,46(7):86-91.HAO Fengge,LI Guirong,WANG Baoquan,CAI Zuguo,YOU Yang,NIU Shengyang. Identification of pathogens and their vir‐ulence of crown gall disease of peach from different peach pro‐duction regions[J]. Guangdong Agricultural Sciences,2019,46(7):86-91.
[17] 魏艳丽,MAARTEN R,李红梅,李纪顺,扈进冬,杨合同.泰安樱桃根癌病致病菌分离及生物型鉴定[J].植物保护,2020,46(6):22-29.WEI Yanli,MAARTEN R,LI Hongmei,LI Jishun,HU Jindong,YANG Hetong. Identification and characterization of pathogenic bacteria isolated from crown galls on cherry trees in Tai’an[J].Plant Protection,2020,46(6):22-29.
[18] 尹向田,魏彦锋,徐亮,杨阳. 葡萄根癌病病原菌的筛选及鉴定[J].农学学报,2019,9(2):24-30.YIN Xiangtian,WEI Yanfeng,XU Liang,YANG Yang. Isolation and identification of the pathogen causing crown gall in grape[J].Journal of Agriculture,2019,9(2):24-30.
[19] 李莹莹.大连地区大樱桃根癌病的研究[D].大连:辽宁师范大学,2008.LI Yingying.The research on root-cancer disease of cherry in re‐gion of Dalian[D].Dalian:Liaoning Normal University,2008.
[20] 田小曼,李朝红.樱桃根癌病病原菌鉴定及防治药剂筛选[J].贵州农业科学,2021,49(6):56-62.TIAN Xiaoman,LI Zhaohong. Pathogen identification of crown gall and screening of fungicides for control in cherry[J]. Gui‐zhou Agricultural Sciences,2021,49(6):56-62.
[21] 赵岩,白田田,顾欣,王新谱,马文礼,王昊,杨波.宁夏地区欧李根癌病病原菌鉴定及防治药剂筛选[J].东北林业大学学报,2023,51(3):130-135.ZHAO Yan,BAI Tiantian,GU Xin,WANG Xinpu,MA Wenli,WANG Hao,YANG Bo. Identification of causal agent of Cera‐sus humilis crown gall disease in Ningxia Region and screening of control agents[J]. Journal of Northeast Forestry University,2023,51(3):130-135.
[22] 张洁,师校欣,焦延静,杨丽丽,杜国强.葡萄根癌病病原菌类型鉴定及几种杀菌剂和抗菌素对其抑菌效果[J].河北农业大学学报,2013,36(3):77-81.ZHANG Jie,SHI Xiaoxin,JIAO Yanjing,YANG Lili,DU Guo‐qiang. Classification of bacteria collected from crown gall and efficacy of some bactericides and antibiotics to their control in grapes[J]. Journal of Agricultural University of Hebei,2013,36(3):77-81.
[23] 李健强,王慧敏,张桂火,王建辉.一些杀菌剂和抗菌素对根癌菌和根癌抑制菌的作用[J].中国农业大学学报,1996,1(5):74-78.LI Jianqiang,WANG Huimin,ZHANG Guihuo,WANG Jianhui.Effect of some bacteriocides and antibiotics on Agrobacterium tumefaciens and anti-gall bacteria[J]. Journal of China Agricul‐tural University,1996,1(5):74-78.
[24] 张建国,王杰明,张要战,董丽萍.葡萄根癌病的发生规律与综合防治[J].中外葡萄与葡萄酒,2003(3):34-36.ZHANG Jianguo,WANG Jieming,ZHANG Yaozhan,DONG Liping. Incidence and integrated control of grapevine crown gall[J].Sino-overseas Grapevine&Wine,2003(3):34-36.
[25] 王荣,安冬梅,刘玉娟,乔改霞,谢军,徐美隆.植物根癌病发病规律及防治技术研究进展[J]. 宁夏农林科技,2023,64(1):24-29.WANG Rong,AN Dongmei,LIU Yujuan,QIAO Gaixia,XIE Jun,XU Meilong. Study on pathogenesis of crown gall and re‐search progress in control of crown gall[J]. Ningxia Journal of Agriculture and Forestry Science and Technology,2023,64(1):24-29.
[26] 杨波,陈永伟,靳韦,张敏,徐灿,哈蓉,马文礼,王昊.不同药剂灌根对欧李根癌病的防治效果试验研究[J].宁夏农林科技,2023,64(2):31-34.YANG Bo,CHEN Yongwei,JIN Wei,ZHANG Min,XU Can,HA Rong,MA Wenli,WANG Hao. Experimental study on pre‐vention and control effect of different medications on Cerasus humilis crown gall disease[J]. Ningxia Journal of Agriculture and Forestry Science and Technology,2023,64(2):31-34.
[27] 钟奇,罗玲,刘伟,董丽.川西高原酿酒葡萄根癌病日灼病及酸腐病防治[J].农业与技术,2022,42(13):148-150.ZHONG Qi,LUO Ling,LIU Wei,DONG Li. Prevention and treatment of root cancer sunburn and sour rot of wine grape in western Sichuan Plateau[J]. Agriculture and Technology,2022,42(13):148-150.
[28] CLARE B G,KERR A,JONES D A. Characteristics of the no‐paline catabolic plasmid in Agrobacterium strains K84 and K1026 used for biological control of crown gall disease[J].Plas‐mid,1990,23(2):126-137.
[29] 李金云,陈凡,王建辉,王慧敏.根癌病生防菌:葡萄土壤杆菌E26 菌株在葡萄植株的定殖研究[J].植物病理学报,2005,35(1):78-83.LI Jinyun,CHEN Fan,WANG Jianhui,WANG Huimin. Coloni‐zation of crown gall biocontrol agent-Agrobacterium vitis strain E26 on grapevine[J].Acta Phytopathologica Sinica,2005,35(1):78-83.
[30] 王靖,郭岩彬,王建辉,李金云,王慧敏. 葡萄根癌生防菌株E26 生防效果的离体检测方法研究[J].中国农业科学,2007,40(7):1395-1402.WANG Jing,GUO Yanbin,WANG Jianhui,LI Jinyun,WANG Huimin. A comparative study of testing methods for the effect of biocontrolling Agrobacterium vitis E26 against grape crown gall in vitro[J]. Scientia Agricultura Sinica,2007,40(7):1395-1402.
[31] KAWAGUCHI A,INOUE K,NASU H. Biological control of grapevine crown gall by nonpathogenic Agrobacterium vitis strain VAR03-1[J].Journal of General Plant Pathology,2007,73(2):133-138.
[32] KAWAGUCHI A,INOUE K,TANINA K. Evaluation of the nonpathogenic Agrobacterium vitis strain ARK-1 for crown gall control in diverse plant species[J]. Plant Disease,2015,99(3):409-414.
[33] XI H W,GRIST J,RYDER M,SEARLE I R. Complete genome sequence data for the grapevine crown gall-inhibiting bacteria Allorhizobium vitis F2/5[J]. Molecular Plant-Microbe Interac‐tions,2022,35(2):174-176.
[34] 赵小兰,赵梁军. 月季根癌病病原菌分离及抗病资源初步筛选[J].植物保护,2006,32(6):54-58.ZHAO Xiaolan,ZHAO Liangjun. Isolation of the pathogenic bacteria from rose crown gall and selection of the resistance re‐sources from Rosa spp.[J].Plant Protection,2006,32(6):54-58.
[35] SCHAAD N W,JONES J B,CHUN W.植物病原细菌鉴定实验指导[M].赵廷昌,译.3 版.北京:中国农业科学技术出版社,1999.SCHAAD N W,JONES J B,CHUN W. Laboratory guide for identification of plant pathogenic bacteria[M]. ZHAO Tingchang,Trans. 3rd ed. Beijing:China Agricultural Science and Technology Press,1999.
[36] LI Q,GUO R J,LI S D,LI S F,WANG H Q. Determination of tumorigenic Agrobacterium density in soil by real-time PCR as‐say and its effect on crown gall disease severity[J]. European Journal of Plant Pathology,2015,142(1):25-36.
[37] BUCHANAN R E,GIBBONS N E.伯杰细菌鉴定手册[M].中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,译. 8版.北京:科学出版社,1984.BUCHANAN R E,GIBBONS N E. Bergey’s manual of deter‐minative bacteriology[M]. Translation group of Bergey’s manu‐al of determinative bacteriology in Institute of Microbiology,Chinese Academy of Sciences. 8th ed. Beijing:Science Press,1984.
[38] GENOV N,LLOP P,LÓPEZ M M,BOBEV S G,ÁLVAREZ B.Molecular and phenotypic characterization of Agrobacterium species from vineyards allows identification of typical Agrobac‐terium vitis and atypical biovar 1 strains[J]. Journal of Applied Microbiology,2015,118(6):1465-1477.
[39] 李金云,王慧敏,王建辉.根癌病生防菌E26 菌株产生细菌素的初步研究[J].中国农业科学,2004,37(12):1860-1865.LI Jinyun,WANG Huimin,WANG Jianhui.A bacteriocin with a broad spectrum activity produced by grapevine crown gall bio‐control strain E26[J]. Scientia Agricultura Sinica,2004,37(12):1860-1865.
[40] 姚博,张晋豪,何依璐,梁旭清,崔兴国,荣浪飞,周星海,魏方俊,何祖雷,姬广海,魏兰芳.解淀粉芽胞杆菌JK10 防治蓝莓根癌病的机理研究[J].中国生物防治学报,2022,38(3):613-625.YAO Bo,ZHANG Jinhao,HE Yilu,LIANG Xuqing,CUI Xing‐guo,RONG Langfei,ZHOU Xinghai,WEI Fangjun,HE Zulei,JI Guanghai,WEI Lanfang. Study on biocontrol mechanism of Bacillus amyloliquefaciens JK10 to control blueberry crown gall disease[J]. Chinese Journal of Biological Control,2022,38(3):613-625.