枇杷[Eriobotrya japonica(Thunb.)Lindl.]是蔷薇科苹果亚科枇杷属的常绿乔木植物,果实春末夏初成熟,正值鲜果淡季,果肉柔软多汁,风味鲜美,颇受广大消费者欢迎。生产枇杷的国家主要有中国、西班牙、日本、巴基斯坦等,目前中国枇杷栽培总面积近13.3 万hm2,年产量超90 万t,在全球枇杷产量中的比重超80%,是全球最大的枇杷生产国。近年来,全球气候变暖和极端天气频发[1],导致果实日灼发生日趋严重。枇杷果实日灼常发生在果实转色期,与品种、树姿、果实着生部位及着生方向有关,发病程度也与高温和持续时间有关,光照可促进日灼发生[2]。枇杷果实发生日灼时,枇杷果面产生黑褐色或凹陷斑块,鲜果失去商品价值,影响枇杷产业的可持续发展[3]。
日灼是环境中过度的光合有效辐射(PAR)、紫外线辐射以及高温共同造成的,而其他胁迫因素(如缺水)会加剧日灼的发生,导致果实表皮层蜡质结构降解等组织结构特异性变化,果实表现为更强的透水性[4]。日灼导致葡萄品种霞多丽果实细胞结构变化,生理代谢紊乱,随着日灼程度加重,果皮细胞损伤会更严重,最终导致果皮细胞死亡[5]。苹果果实日灼的发病部位主要为表皮及亚表皮[6],高温胁迫后的苹果果皮叶绿体膨胀、类囊体结构部分解体,线粒体周缘模糊,细胞质中含大量的空泡,靠近上表皮几层细胞解体,细胞壁加厚[7],破坏了照射部位的果实细胞组织结构,影响了生理生化代谢[8],使果实的抗氧化系统失衡,产生大量活性氧破坏细胞膜透性,细胞质大量外溢,多酚氧化酶(PPO)与表皮细胞液泡酚类化合物聚合,多酚物质被氧化,表现为果实褐变,而褐变也可能是外果皮细胞死亡所导致的[4,7]。褪黑素(melatonin,MT)是植物体内一种普遍存在的非生物胁迫调节剂[9],作为一种多效应信号分子参与各种非生物胁迫反应[10]。已有研究表明,褪黑素可提高果树的抗高温胁迫能力[11],适当浓度的褪黑素可有效缓解低温胁迫,褪黑素可以保持细胞组织不被破坏和降解[12];葡萄、西瓜幼苗叶面喷施褪黑素均能减轻高温胁迫下果实的膜脂过氧化程度,提高保护酶活性,对高温胁迫具有缓解效应[13-14];外源褪黑素处理高温胁迫下的苹果叶片,可维持叶肉细胞排列紧密,使其表皮细胞厚度增加且提高了叶片的保水能力[15]。笔者在本试验中研究了高温胁迫不同持续时间下,喷施外源褪黑素对新白8号枇杷果皮解剖结构的影响,探讨枇杷日灼发生的果皮细胞结构变化,旨在为应用褪黑素防控果实日灼发生提供参考依据。
1 材料和方法
1.1 试验材料
试验于2022—2023 年在福建省农业科学院果树研究所进行,供试品种为笔者团队选育的白肉枇杷新品种新白8号[E.japonica(Thunb.)Lindl.‘Xinbai No.8’],树龄17 a(年),株行距3 m×4 m。选择4株树冠外围西南向充分暴露的果穗99 个挂牌标记,疏除非转色期果实及病虫果备用。褪黑素(分子质量:232.28)购自上海麦克林生化科技股份有限公司。
1.2 试验处理
1.2.1 外源褪黑素浓度筛选 在果实转色期,根据天气预报,选择符合试验条件的晴朗天气,于早晨07:00 用手持喷壶分别向果面喷施50、100、150、200 μmol·L-1 的褪黑素(MT),以喷施清水为对照(Control),果面喷施均匀且以滴水为度,共设5 个处理,每个处理3 穗,3 次重复。喷施4 h 后,在光照度达1100 μmol·m-2·s-1以上时段,参照邓朝军等[2]的方法,将喷施褪黑素和清水的枇杷果穗放置到高温胁迫诱导箱中,进行枇杷果实高温胁迫诱导日灼防控试验(图1[2]),诱导温度设置为40 ℃。在胁迫0、10、30 和60 min 时,观察各处理果实日灼发生情况并拍照,根据枇杷果实日灼的病果率和病害等级筛选褪黑素最优浓度。

图1 枇杷果实的日灼诱导处理[2]
Fig.1 Treatment induced by sunburn on loquat pericarps[2]
枇杷果实日灼调查方法、日灼病果率、病斑的等级划分参照《枇杷种质资源描述规范和数据标准》[16]并稍加调整。采用目测法观察每个枇杷果实表面日灼情况(图2),计算日灼病果率,再依据枇杷果面日灼病斑面积占总果面的比重,对果实日灼情况进行分级。枇杷果实日灼症状如图2-B。日灼病果率的计算方法及病害等级划分依据标准如下:

图2 枇杷果实日灼对比图
Fig.2 Comparison chart of sun burning of loquat fruits
A.正常枇杷果;B.日灼枇杷果。
A.Normal loquat fruit clusters;B.Sunburn loquat fruit cluster.
日灼果率的计算公式为:DR/%=ni/N×100。
式中:DR 为日灼果率(%),ni 为日灼果数,N 为调查总果数。
果皮日灼分级:按日灼果面占总果面的比率分4 级,0 级无病斑;1 级病斑面积≤25.00%;2 级病斑面积>25.00%~50.00%;3级病斑面积>50.00%。
1.2.2 外源褪黑素处理枇杷果皮解剖结构观察样品的采集 根据预选出的最优褪黑素浓度,于晴朗天气的早晨07:00,用手持喷壶喷施150 μmol·L-1的褪黑素(MT),以喷施清水为对照(Control),进行验证试验。共设6 个处理,每个处理3 穗,3 次重复。喷施处理4 h 后,进行高温胁迫诱导试验,诱导温度设置为40 ℃。
于胁迫0、10、30 min 时,观察高温诱导时间内果面日灼病斑的发生情况并拍照,分别选取代表性果实3 粒,用双面刀片切取枇杷果实向阳面果皮0.5 cm×0.5 cm,立即放入FAA 固定液中,用于果皮显微结构及超微结构观察。
1.3 果皮显微结构观察
石蜡切片参照杜倩等[17]的方法稍作修改,乙醇梯度(50%、70%、80%、90%、100%)脱水1 h;乙醇-二甲苯溶液梯度(30%、50%、70%、100%)透明15 min;二甲苯-石蜡梯度(25%、50%、70%、100%)浸蜡30 min,纯蜡浸透过夜(恒温60 ℃);60 ℃环境下,每隔24 h更换一次纯蜡,共更换4次;使用浙江金华科迪公司生产的KB-BM Ⅲ型包埋机进行包埋,将枇杷果皮材料放置在包埋盒中并浸泡在40 ℃的石蜡中待用,用镊子快速夹取组织块,选择需要切取的方位,放置于包埋槽中并滴蜡至组织块完全浸没;使用科迪公司生产的KD-BL Ⅲ型冷冻台并设置-20 ℃,将包埋槽快速放置于冷冻台使其快速凝固;使用德国Leica公司生产的Leica rm2245 半自动轮转式切片机切片,厚7 μm;在40 ℃恒温水浴锅摊片;洗干净的载玻片上用玻璃棒蘸取蛋清甘油黏附剂,并快速捞片;将载玻片置于烘箱(60 ℃)过夜;将烘干的载玻片置于纯二甲苯中脱蜡30 min,纯二甲苯脱蜡两次后,乙醇-二甲苯梯度(70%、50%、20%)脱蜡10 min;乙醇梯度(100%、90%、80%、70%、50%)醇化10 min;番红染色12 h;乙醇梯度(50%、70%、80%、90%)洗脱5 min;固绿染色15~60 s;90%乙醇洗脱2 次5 min,95%乙醇洗脱5 min,无水乙醇洗脱10 min;乙醇-二甲苯梯度(25%、50%、70%)透明5 min,纯二甲苯透明2次10 min;中性树胶封片;使用日本Nikon 公司生产的ECLIPSE ci-L 正置光学显微镜观察果皮结构变化。用Image J 软件测量枇杷果皮角质层、表皮层、亚表皮层厚度及细胞大小等参数。
1.4 果皮超微结构观察
采用Formvar 膜制作方法[18]:选取各处理组的石蜡切片3 片。将聚乙烯醇缩甲醛溶于0.2%~0.5%的三氯甲烷中,即得Formvar 膜溶液。用玻璃棒将制作好待观察的石蜡切片以少许蛋清甘油黏附剂平展地粘贴在1/4 盖玻片上,45 ℃在恒温箱中烘干过夜。将烘好的盖薄片置于Formvar 膜溶液中,过9 s后用镊子提起,让膜液滴尽并立即对薄片表面呵气数口,雾滴越小,膜孔越小。再静置晾干,使切片上紧紧包裹一层多孔膜,包被着细胞内的非骨架性结构。再将盖玻片转入二甲苯溶液中60 ℃恒温条件下放置3 d,期间更换3 次二甲苯,浸泡脱蜡。后将盖玻片晾干,用双面碳导电胶带粘在样品台上,使用离子溅射仪喷金,用Hitachi TM 3030 PLUS 型台式扫描电镜观测。用Image J软件测量枇杷表皮细胞、亚表皮层细胞壁厚度。
1.5 数据分析
将获得的细胞形态学参数用Excel 2013 软件进行整理、Image J 软件测量,用SPSS 23.0 软件对数据进行方差分析。
2 结果与分析
2.1 不同浓度外源褪黑素对高温胁迫下枇杷果实日灼发生的影响
2.1.1 不同浓度外源褪黑素对高温胁迫下枇杷果实日灼发生时间的影响 由表1 可知,高温胁迫下,清水处理的果实,不到10 min 时就出现了日灼症状;浓度为50 μmol·L-1褪黑素处理的果实,在10 min时出现日灼症状;而浓度为100、200 μmol·L-1褪黑素处理在20 min时出现日灼症状,150 μmol·L-1褪黑素处理的果实在30 min时出现日灼现象,症状最轻,病斑小,日灼伤害程度最轻(图3)。可知,50~200 μmol·L-1褪黑素处理可延缓果实日灼的发生,其中150 μmol·L-1褪黑素处理可最大程度地延缓日灼的发生。
表1 不同浓度外源褪黑素处理的日灼发生时间
Table 1 The occurrence time of sunburn under different concentrations of exogenous melatonin treatment
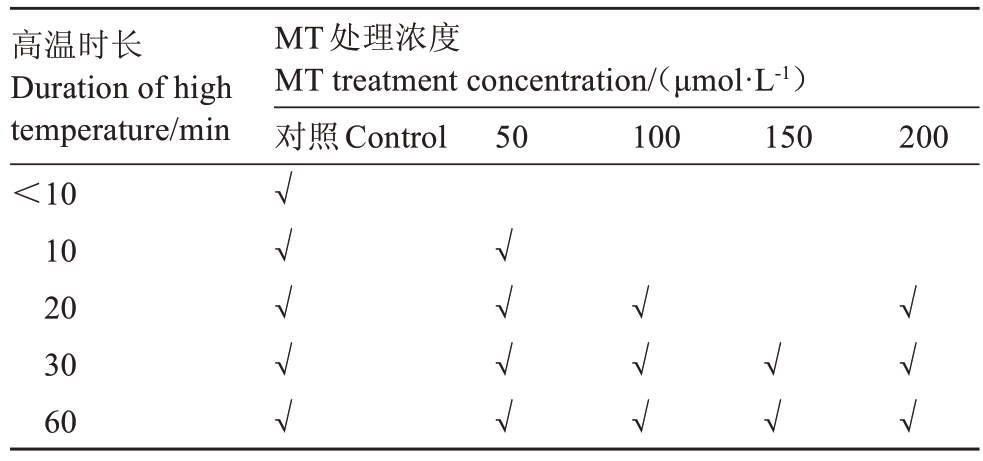
注:√表示此时间点有日灼病斑产生。
Note:√ indicates the occurrence of sunburn at this time point.
高温时长Duration of high temperature/min<10 10 20 30 60 MT处理浓度MT treatment concentration/(μmol·L-1)对照Control 50 100 150 200√√√√√√√√√√√√√√√√√
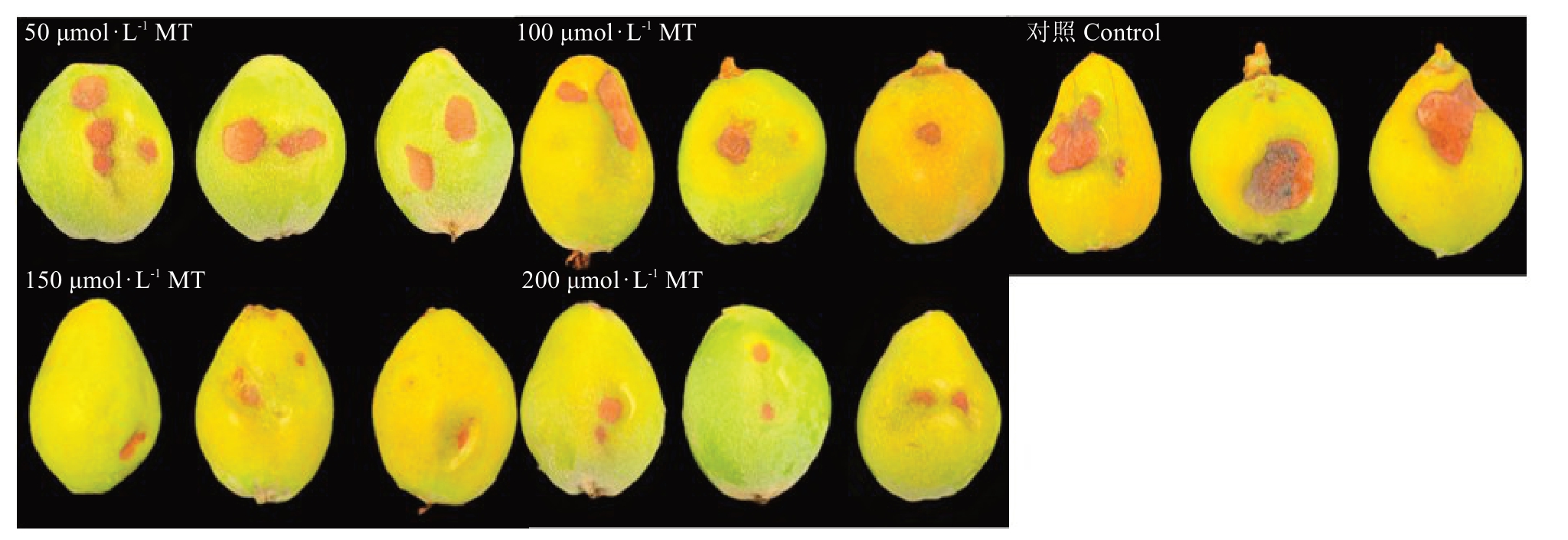
图3 不同浓度外源褪黑素处理枇杷果实日灼发生情况
Fig.3 The occurrence of sunburn in loquat fruits treated with exogenous melatonin of different concentrations
Control.清水处理;50 μmol·L-1 MT.50 μmol·L-1 褪黑素处理;100 μmol·L-1 MT.100 μmol·L-1 褪黑素处理;150 μmol·L-1 MT.150 μmol·L-1 褪黑素处理;200 μmol·L-1 MT.200 μmol·L-1 褪黑素处理。下同。
Control.High temperature stress treated with clean water;50 μmol·L-1 MT.50 μmol·L-1 melatonin treatment under high temperature stress;100 μmol·L-1 MT.100 μmol·L-1 melatonin; 150 μmol·L-1 MT.150 μmol·L-1 melatonin treatment under high temperature stress; 200 μmol·L-1 MT.200 μmol·L-1 melatonin treatment under high temperature stress.The same below.
2.1.2 不同浓度外源褪黑素对枇杷果实日灼病果率的影响 由图4 可以看出,在高温胁迫下对照(Control)的病果率为36.8%。褪黑素浓度50、100、150 和200 μmol·L-1的病果率分别为26.4%、21.8%、12.2%和17.0%,与对照相比,褪黑素处理的病果率分别显著降低28.3%、40.8%、66.8%和53.8%,其中150 μmol·L-1处理的枇杷果实日灼病果率最低。
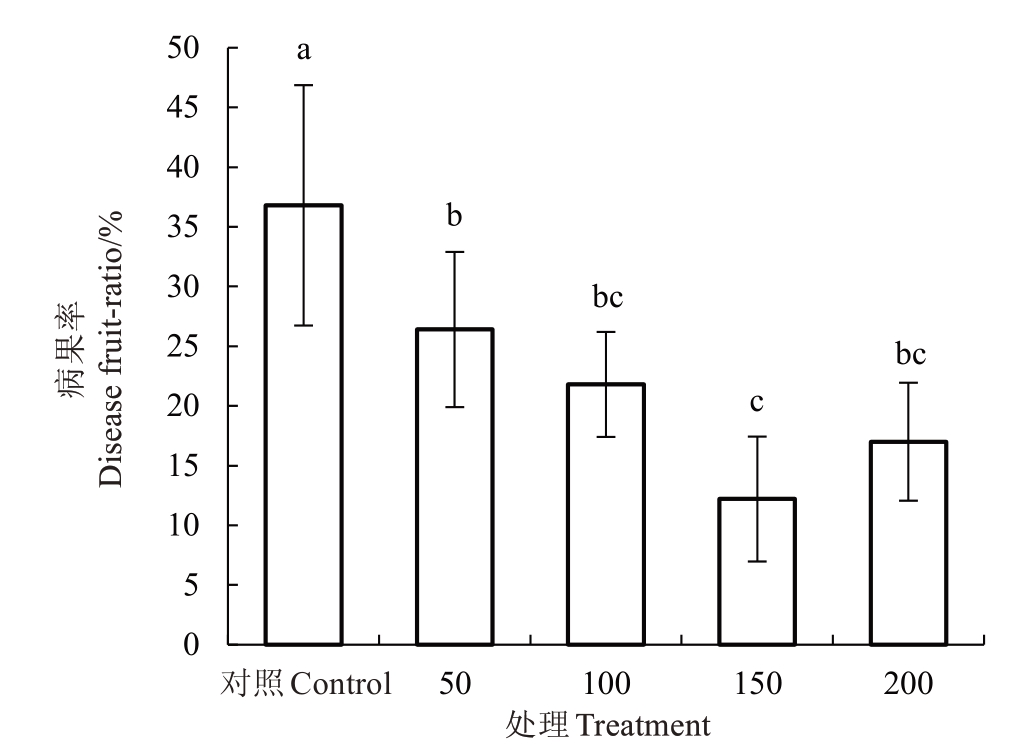
图4 不同浓度外源褪黑素对高温诱导枇杷果实日灼病果率的影响
Fig.4 The effect of different concentrations of exogenous melatonin on the rate of high temperature induced sun damage in loquat fruits
不同小写字母表示处理间差异显著(p<0.05)。下同。
Different small letters indicate significant differences between treatments(p<0.05).The same below.
2.1.3 不同浓度外源褪黑素处理对枇杷果实日灼病害等级的影响 由表2 可知,高温胁迫诱导60 min后,对照处理枇杷果实日灼0 级病害为63.33%,日灼1 级病害为36.67%;喷施50~200 μmol·L-1褪黑素处理对枇杷果实日灼的发生均有不同程度的缓解,其中150 μmol·L-1褪黑素处理的0 级果实日灼率最高,为87.80%,比50 μmol·L-1褪黑素处理高14.13 个百分点,比100 μmol·L-1褪黑素处理高9.60 个百分点,150 μmol·L-1处理的1 级病果率最低,均显著低于其他浓度处理和对照。可见,150 μmol·L-1外源褪黑素可缓解枇杷果实日灼症状。
表2 高温诱导不同浓度外源褪黑素处理枇杷果实日灼病害分级
Table 2 High temperature induced classification of loquat fruit sunburn disease treated with different concentrations of exogenous melatonin%
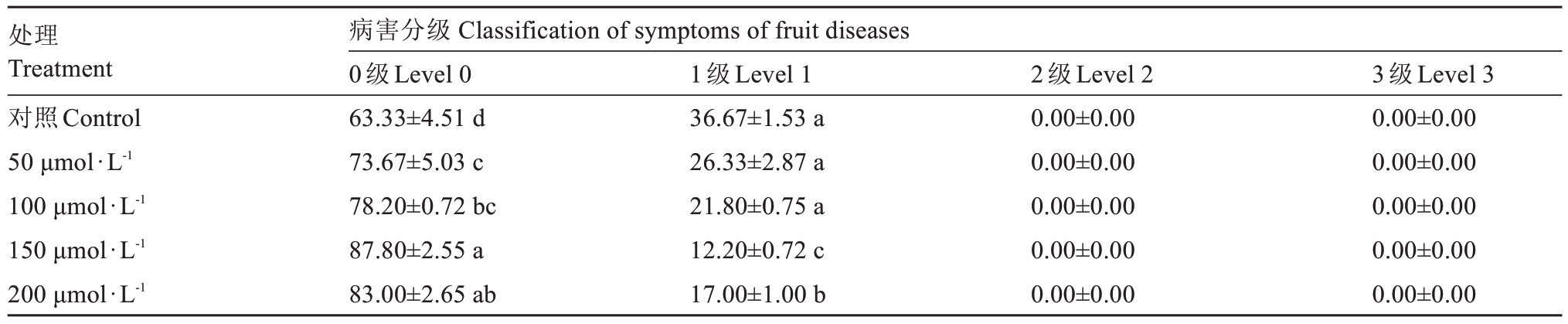
注:同列不同小写字母表示差异达显著水平(p<0.05)。
Note:Different small letters in the same column indicate significant differences(p<0.05).
处理Treatment对照Control 50 μmol·L-1 100 μmol·L-1 150 μmol·L-1 200 μmol·L-1病害分级Classification of symptoms of fruit diseases 0级Level 0 63.33±4.51 d 73.67±5.03 c 78.20±0.72 bc 87.80±2.55 a 83.00±2.65 ab 3级Level 3 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 1级Level 1 36.67±1.53 a 26.33±2.87 a 21.80±0.75 a 12.20±0.72 c 17.00±1.00 b 2级Level 2 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00
2.2 150 μmol·L-1外源褪黑素对高温胁迫下枇杷果实日灼发生的影响
进一步试验验证发现,高温诱导前(0 min)枇杷果实饱满圆润,果皮光洁、皮色均匀(图5-Control 0、P0)。高温胁迫10 min时,清水对照的枇杷果皮局部出现褐色小斑点,出现灼伤症状(图5-Control 1);150 μmol·L-1褪黑素处理组未出现灼伤症状(图5-P1)。高温胁迫30 min 时,对照组果皮灼伤部位数量增多且病斑变大,病斑颜色变深(图5-Control 2);150 μmol·L-1褪黑素处理的果实开始出现日灼病斑,呈浅棕色小斑点(图5-P2)。进一步证实,在同一光照和高温胁迫条件下,150 μmol·L-1外源褪黑素处理可延缓日灼发生,且减轻病害症状。
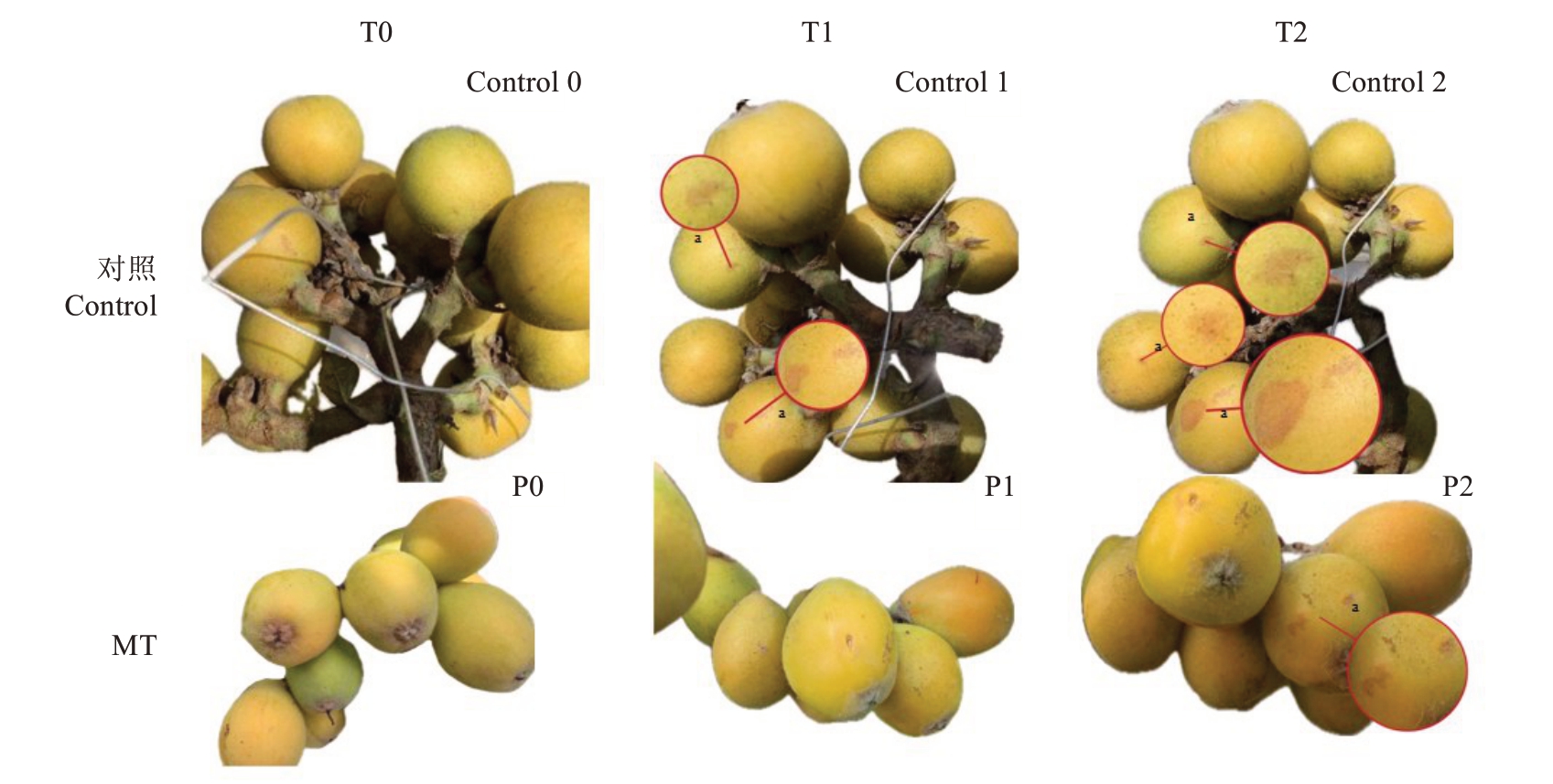
图5 喷施清水和150 μmol·L-1褪黑素处理的枇杷果实在不同高温胁迫时间后的日灼情况
Fig.5 Sunburn of loquat fruits treated with water spray and 150 μmol·L-1 melatonin at different high temperature stress times
Control 为清水处理;MT 为褪黑素处理;Control 0 为喷施清水后高温诱导0 min;Control 1 为喷施清水后高温诱导10 min;Control 2 为喷施清水后高温诱导30 min;P0 为喷施褪黑素后高温诱导0 min;P1 为喷施褪黑素后高温诱导10 min;P2 为喷施褪黑素后高温诱导30 min;T0为处理0 min;T1 为处理10 min;T2 为处理30 min。下同。a 为日灼病斑。
Control is the water treatment group; MT is the melatonin treated group; Control 0 is a high-temperature induction for 0 minutes after spraying clean water;Control 1 is a high-temperature induction for 10 minutes after spraying clean water;Control 2 is a 30 minute high-temperature induction after spraying clean water;P0 is a high-temperature induction for 0 minutes after spraying melatonin;P1 is a high-temperature induction for 10 minutes after spraying melatonin;P2 is a 30 minute high-temperature induction after spraying melatonin;T0 represents 0 minutes of processing;T1 is for processing for 10 minutes;T2 is treated for 30 minutes.The same below.a is a sunburn lesion.
2.3 150 μmol·L-1外源褪黑素对高温胁迫下枇杷果皮显微结构的影响
如图6-Control 0、P0 所示,高温胁迫处理前(0 min)的枇杷果皮角质层光滑完整、薄厚均匀;表皮、亚表皮细胞形状完整,大小均匀,排列整齐,层次分明;角质层与表皮细胞结合紧密。经高温胁迫处理10 min 时,清水处理(对照)的角质层部分区域开始出现褶皱、变薄,但未断裂,角质层内侧与表皮细胞间形成小空腔,部分区域的表皮细胞壁断裂,细胞变形,亚表皮层细胞明显变形,出现空腔(图6-Control 1);高温胁迫处理10 min 时,150 μmol·L-1褪黑素处理(MT)的角质层平整、薄厚均匀,与表皮细胞结合紧密,外层亚表皮细胞部分发生可见变形,但表皮细胞形状仍完整、排列紧密(图6-P1)。高温胁迫30 min 时,清水处理(Control)的部分区域角质层变薄、褶皱变形明显且数量变多,角质层内侧与表皮细胞间形成空腔数量增多,亚表皮细胞均出现明显变形,排列疏松,部分细胞间的连接断裂,形成较大空腔(图6-Control 2);而150 μmol·L-1 褪黑素处理(MT)的角质层仅个别区域变薄、褶皱变形,表皮细胞形状仍完整,靠近表皮层的部分细胞有少数破裂,亚表皮层细胞间出现少数空腔,但未发现细胞多层断裂、形成较大空腔的情况(图6-P2)。
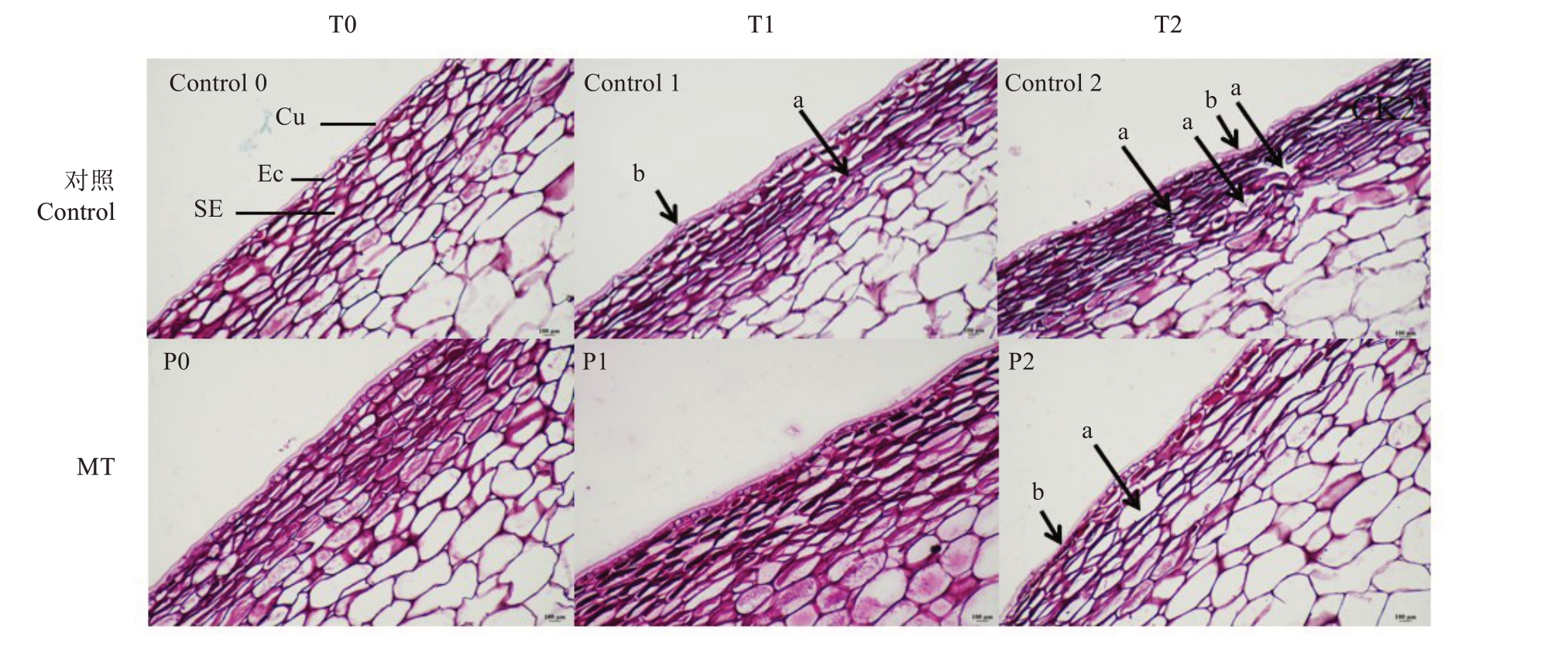
图6 喷施清水和褪黑素后枇杷果实组织在高温胁迫不同时间的显微切片(200×)
Fig.6 Microscopic slices of loquat fruit tissue under high temperature stress at different times after spraying with water and melatonin(200×)
Cu.角质层;Ec.表皮细胞;SE.亚表皮细胞;箭头a 表示细胞破裂形成断层与空腔;箭头b 表示角质层薄厚不均,出现褶皱、凹陷;比例尺100 μm。
Cu.Stratum corneum; Ec.Epidermal cells; SE.Subepidermal cells;Arrow a indicates the formation of faults and cavities due to cell rupture;Arrow b indicates uneven thickness of the stratum corneum with wrinkles and indentations;The scale is 100 μm.
由图7-A~C可知,高温胁迫10 min时,清水处理(Control)的角质层厚度、表皮层厚度、亚表皮层厚度分别减少32.96%、47.62%、15.06%;高温胁迫30 min时,角质层厚度、表皮层厚度、亚表皮层厚度分别减少57.99%、61.07%、26.78%。150 μmol·L-1外源褪黑素处理(MT),高温胁迫10 min 时,角质层与表皮层厚度分别减少7.65%和37.24%,亚表皮层厚度减少5.03%;高温胁迫30 min时角质层与表皮层厚度分别减少31.93%和57.02%,亚表皮层厚度减少16.76%。可见,高温胁迫后枇杷果皮的角质层、表皮层和亚表皮层厚度均减小,150 μmol·L-1外源褪黑素处理可减小角质层、表皮层及亚表皮层厚度变化的幅度。
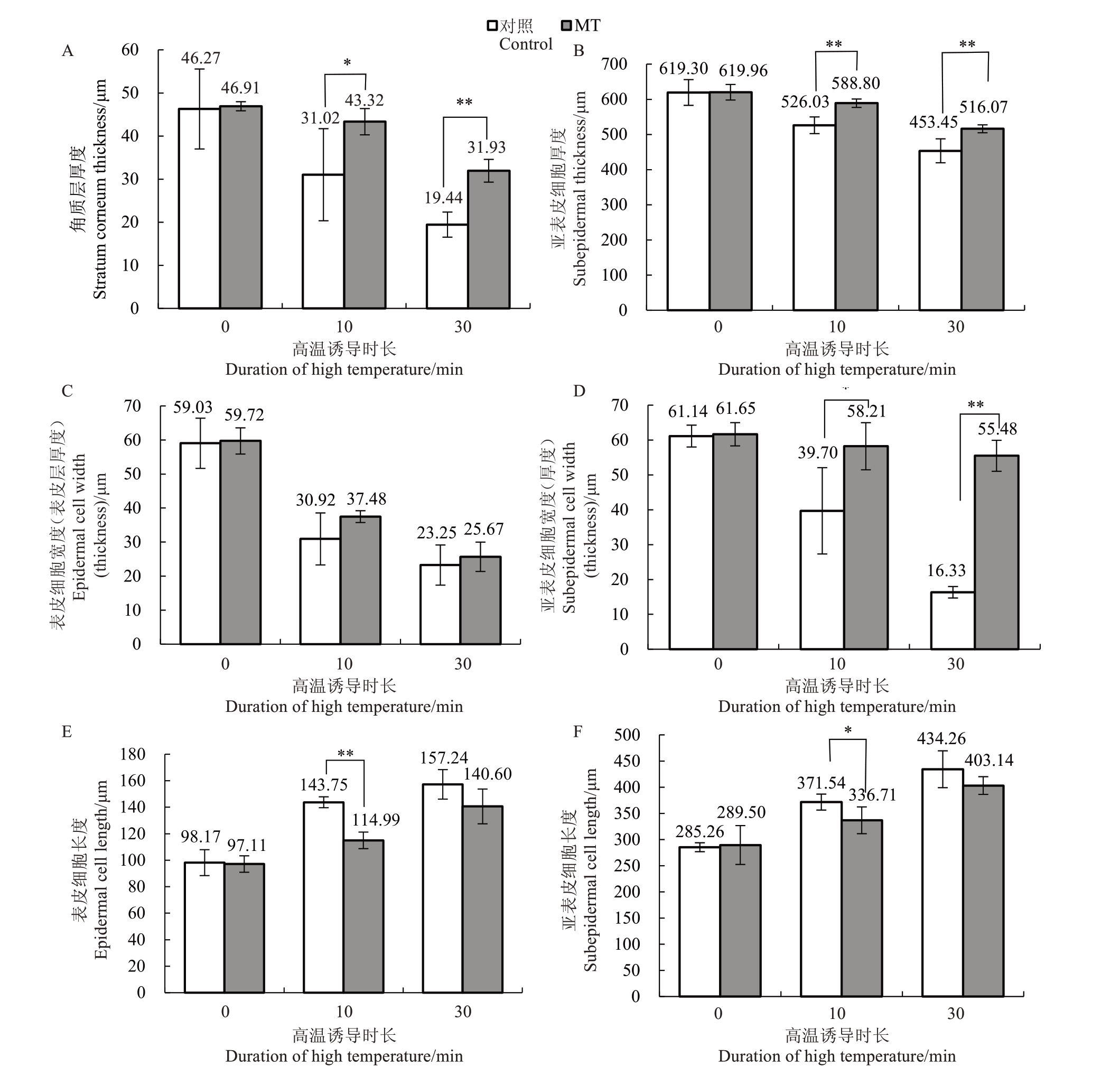
图7 不同处理组枇杷果皮细胞显微结构比较
Fig.7 Comparison of microstructure of loquat peel cells in different treatment groups
*和**分别表示处理间差异显著(p<0.05)和极显著(p<0.01)。
*and**indicated significant differences(p<0.05)and extremely significant differences(p<0.01)between treatments.

图7 (续) Fig.7 (Continued)
进一步对比发现(图7-D~J),高温胁迫10 min时,清水处理(Control)的亚表皮细胞长度增加30.25%、宽度减少47.62%,表皮及亚表皮细胞面积分别减少了48.92%和41.30%;高温胁迫30 min时,亚表皮细胞长度增加了52.23%,宽度减少了60.61%,表皮及亚表皮细胞面积分别减少51.22%和73.14%。150 μmol·L-1外源褪黑素处理高温胁迫10 min 时,亚表皮细胞长度增加了16.31%,表皮及亚表皮细胞面积分别减少了18.60%和29.62%;高温胁迫30 min 时,亚表皮细胞长度增加了39.25%,表皮及亚表皮细胞面积分别减少46.06%和23.99%,其下降幅度分别较清水处理下高温胁迫30 min 时低5.16 和49.15 个百分点。表皮及亚表皮细胞长宽比均呈增加趋势,清水处理下高温胁迫10 min 时表皮细胞长宽比变化幅度是外源褪黑素处理的2.17 倍,亚表皮细胞长宽比变化幅度是150 μmol·L-1外源褪黑素处理的4.72 倍,高温胁迫30 min 时表皮细胞长宽比变化幅度是外源褪黑素处理的1.37 倍,亚表皮细胞长宽比是外源褪黑素处理的8.58倍。由此可见,喷施150 μmol·L-1外源褪黑素,可增强高温胁迫下枇杷果皮表皮层、亚表皮层细胞的抗变形能力。
2.4 150 μmol·L-1外源褪黑素对高温胁迫下枇杷果皮超微结构的影响
从超微结构图8-Control 0、P0 可以更清晰地看出,高温胁迫之前(0 min),枇杷果皮解剖结构清晰、完整,角质层完整、平滑、厚度基本一致,表皮细胞、亚表皮细胞结构完整、结合紧密。高温胁迫10 min时,清水处理(Control)的角质层部分位置变薄(图8-Control 1),部分表皮细胞严重变形,表皮层细胞由近圆形变为不规则状,亚表皮层细胞由扁圆形或椭圆形变为长椭圆形或纺锤形(表3),表皮及亚表皮细胞壁厚度均呈显著增加趋势(图9),表皮细胞壁厚度增加了85.00%,亚表皮细胞壁厚度增加了83.53%;高温胁迫30 min时(图8-Control 2),角质层更明显变薄、变形,表皮细胞严重变形,表皮细胞壁厚度是正常果皮细胞壁厚度的2.00 倍(图9-A),亚表皮细胞呈不规则形,亚表皮细胞壁厚度是正常果皮细胞壁厚度的2.00 倍(图9-B)。150 μmol·L-1外源褪黑素处理,高温胁迫10 min 时枇杷表皮层、亚表皮层细胞形状基本不变(图8-P1),表皮细胞壁厚度增加了44.44%,亚表皮细胞壁厚度增加了44.90%;高温胁迫30 min 时(图8-P2)的表皮细胞壁厚度是正常果皮细胞壁厚度的1.94 倍,亚表皮细胞壁厚度是正常果皮细胞壁厚度的1.95倍。
表3 不同处理组枇杷果皮超微结构比较
Table 3 Comparison of ultrastructure of loquat peel in different treatment groups

处理Treatment对照Control MT处理时间Treatment time/min 0 10 20 0 10 20角质层Cuticle平整、光滑Flat and smooth表面较平整Relatively flat表面凹陷Surface dented平整、光滑Flat and smooth表面较平整Relatively flat表面较平整Relatively flat表皮层细胞形状Cell shape of epidermal layer近圆形Near circular不规则状Irregular shape不规则状Irregular shape近圆形Near circular扁圆形Flat circular shape多角形Polygon亚表皮层细胞形状Cell shape of subepidermal layer扁圆形Flat circular shape纺锤形Fusiform不规则状Irregular shape扁圆形Flat circular shape椭圆形Oval纺锤形Fusiform
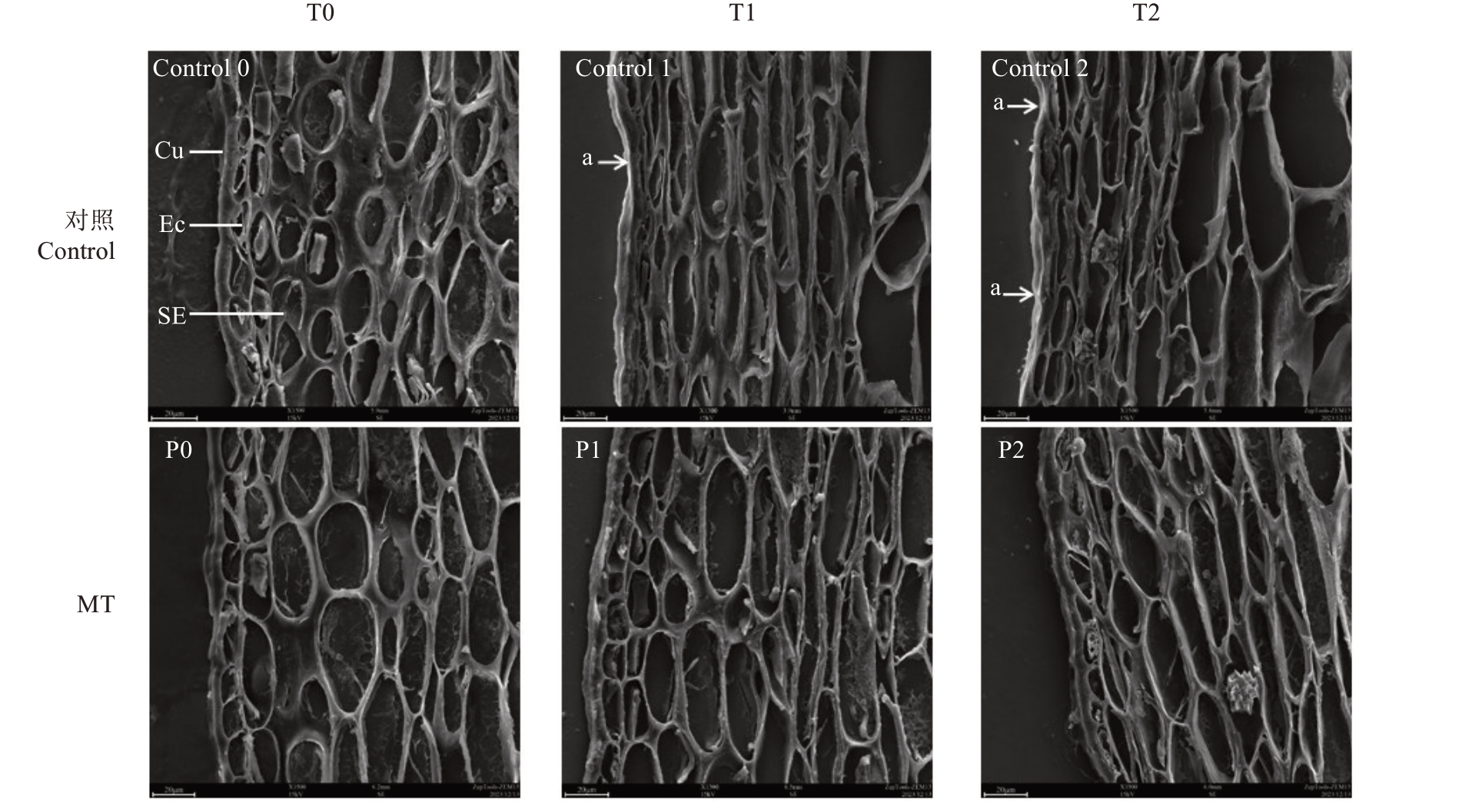
图8 高温胁迫下枇杷果实组织扫描电镜图(1500×)
Fig.8 Scanning electron microscopy image of loquat fruit tissue under high temperature stress(1500×)
Cu.角质层;Ec.表皮细胞;SE.亚表皮细胞;箭头a 表示角质层厚薄不均且表皮细胞变形。比例尺20 μm。
Cu.Stratum corneum;Ec.Epidermal cells;SE.Subepidermal cells;Arrow a indicates uneven thickness of the stratum corneum and deformation of epidermal cells.The scale bar is 20 μm.
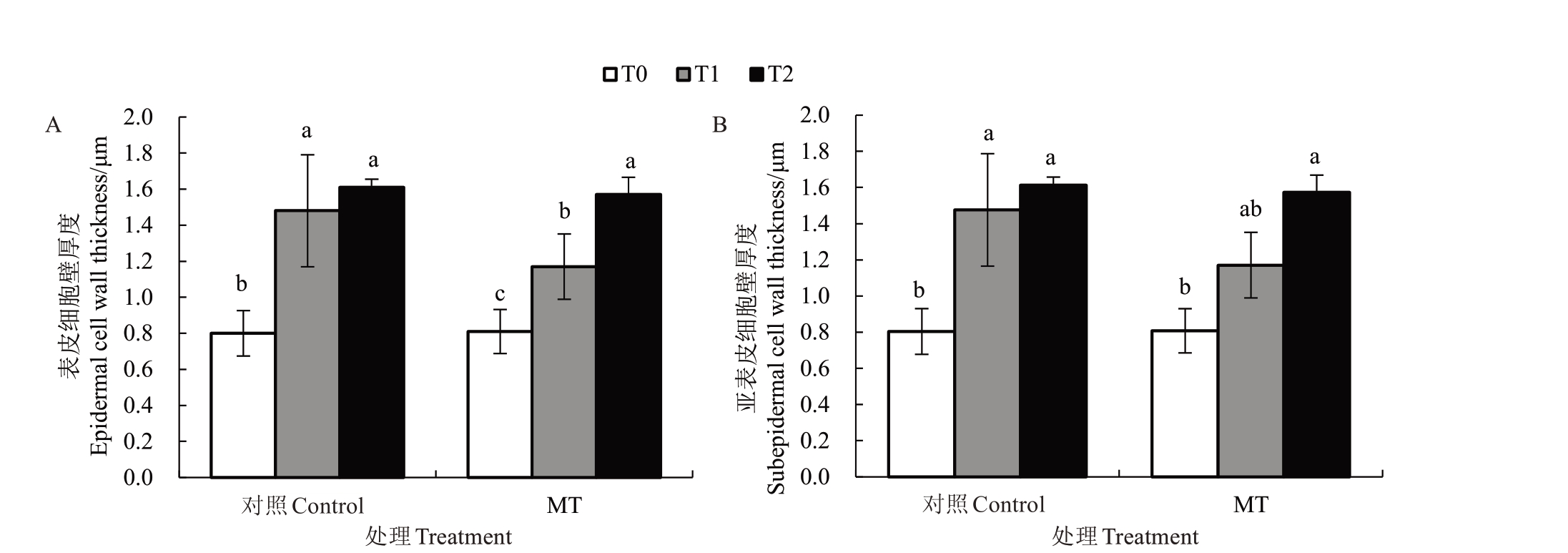
图9 不同处理组枇杷果皮细胞超微结构比较
Fig.9 Comparison of ultrastructure of loquat peel cells in different treatment groups
3 讨 论
3.1 外源褪黑素对果实抗高温胁迫的作用
果实日灼是因高温及强光引起植物光能吸收和利用之间的不平衡,损害电子传递活性,果实果皮超氧阴离子增加,活性氧积累,保护酶活性下降,细胞膜脂过氧化程度加重,细胞膜结构受到破坏,蛋白质变性和果实果皮细胞死亡[4,19-20],高温胁迫使果实的细胞死亡时间提前了约9 d[21],施用外源抗氧化剂可诱导果实抗氧化保护酶活性和内源抗氧化剂含量上升,促进苹果果实细胞膜抗性增强,缓解高温胁迫对果实造成的伤害[22]。已有研究表明,褪黑素也可平衡活性氧(ROS)和活性氮(RNS)的产生和清除,降低丙二醛含量、电解质渗透率和过氧化氢含量[23],有效缓解氧化应激对植物的氧化损伤[10],外源褪黑素会提高植物的酚类、类黄酮、脯氨酸、内源性褪黑素、水杨酸和多胺(精胺、亚精胺和腐胺)的含量,抑制非生物胁迫产生过量的过氧化氢、超氧化物和丙二醛,还可调节抗氧化剂参与渗透调节以及增强抗氧化酶活性[24],褪黑素还可通过积累次生代谢物来提高植物抗逆性,通过激素串扰增强枇杷对干旱胁迫的耐受性[25]。在植物敏感阶段施用外源褪黑素会增强非生物胁迫耐受性,提高植物抗高温胁迫能力[26],而且外源褪黑素的应用不具有基因型特异性,易适用于大规模作物生产[24],在非生物胁迫发生前施用褪黑素是一种相对有效的解决方案,可最大限度地减少因非生物胁迫造成的产量损失[27]。在本试验中,浓度为50~200 μmol·L-1外源褪黑素处理枇杷果实,均可降低枇杷果实日灼的病果率及日灼病害等级,提高果实对日灼的抗性,其中150 μmol·L-1处理效果最好,肉眼可见日灼症状比喷清水对照处理推迟20 min 发生,而且褐变症状更轻,说明果实喷施150 μmol·L-1外源褪黑素对果实日灼症状有明显缓解作用。
3.2 外源褪黑素对果皮结构的保护作用
植物角质层主要由角质基体和可溶性蜡构成,其主要功能之一是保护植物免受有害辐射、高温等环境胁迫,以及机械损伤和水分流失的影响[28]。蜡合成基因(CER1)、角质单体基因(GPAT4/8)和水通道蛋白基因(PIP14、PIP27 和PIP22)可调控角质层生物合成,影响角质层的表面屏障能力[29]。研究表明,番茄果实角质层通过酚类物质的积累和角质层膜厚度的改变来保护果皮细胞免受有害紫外线的伤害;在果实发育期酚类化合物含量较少,阻挡紫外线的能力主要取决于角质层的厚度[30];角质层较薄且果皮细胞层数较少的葡萄品种更容易受到非生物胁迫的影响[31]。高温强光照条件会导致果皮角质层蜡质发生变化,果皮细胞酚类物质氧化,角质层失去弹性;蜡质熔化,角质层膜框架填充物减少,整体框架松弛,多糖分解,从而影响果皮细胞水分平衡,引起果实日灼病发生[32-34]。不同外源物质处理,对植物细胞的影响不同,喷施外源Ca可增加果皮角质层、表皮细胞及亚表皮细胞厚度,使果皮角质层保持完整,减少龟裂的发生[35],喷施20 mmol·L-1 Ca 和0.1 μmol·L-1 EBR耦合可促进果实对Ca的吸收和利用,增强细胞延展性,增加果实硬度[36],喷施外源激素氨基乙酰丙酸(ALA)、茉莉酸甲酯(MeJA)能使叶片角质层中蜡质含量增加,蜡质组分改变[37]。枇杷果皮由角质层及其附属绒毛和数层表皮细胞构成,角质层是果皮的最外层区域,在枇杷果实的发育中作为果肉与外界环境之间的重要物理屏障[38]。笔者在本研究中发现,枇杷果皮的角质层厚度随高温胁迫时间的延长出现角质层皱缩、凹陷或部分变薄现象,施用外源褪黑素可使角质层变薄或褶皱现象出现的时间推迟、症状减轻,推测在高温胁迫条件下,外源褪黑素通过促进植物蜡合成基因的表达,从而增加植物角质层蜡的积累[39],提高对高温胁迫的抗性。
在高温胁迫条件下植物产生大量活性氧(ROS),使其充当信号分子,触发植物细胞壁组织中的木质素和木栓素合成,以维持细胞壁结构[40]。在高温胁迫条件下,细胞壁相关蛋白酶活性降低,细胞壁木质化(半纤维素和木质素沉积)使细胞壁增厚,细胞壁聚合物结构发生变化[41]。外源褪黑素处理通过抑制细胞壁裂解相关基因的相对表达,降低相关酶活性,从而抑制果胶、纤维素降解和细胞壁松弛[42-43]。笔者在本研究中发现,在高温胁迫条件下,枇杷果皮的细胞壁厚度显著增加,这与Pinski 等[41]的研究结果一致;在高温胁迫条件下,未施用外源褪黑素的枇杷果实高温胁迫10 min 时就出现外表皮细胞变形且向下塌陷,亚表皮层细胞多数破裂、皱缩,多层细胞断裂变形,随着胁迫程度的加重,枇杷果皮细胞形变幅度显著增大,这与Kim 等[44]和谢兆森等[5]的研究结果一致,经褪黑素处理后的枇杷果皮细胞形变程度显著低于对照组,说明褪黑素可减轻细胞的形变程度,保护细胞结构完整稳定[45]。
4 结 论
喷施浓度为150 μmol·L-1外源褪黑素处理可降低果实日灼病果率及病害等级,延缓枇杷果实日灼的发生,缓解高温胁迫对枇杷果皮细胞角质层、表皮细胞、亚表皮细胞形态结构的伤害,提高果实抗日灼能力。
致谢:笔者在本试验设计和实施过程中得到了陈秀萍研究员、苏文炳博士、郑文松等团队成员的大力帮忙,在此一并表示感谢。
[1] DEBAEKE P,PELLERIN S,SCOPEL E.Climate-smart cropping systems for temperate and tropical agriculture:Mitigation,adaptation and trade-offs[J].Cahiers Agricultures,2017,26(3):34002.
[2] 邓朝军,蒋际谋,张小艳,许奇志,章希娟,魏秀清,郑少泉.枇杷果皮热伤害发生影响因子研究[J].福建农业学报,2012,27(10):1081-1086.DENG Chaojun,JIANG Jimou,ZHANG Xiaoyan,XU Qizhi,ZHANG Xijuan,WEIXiuqing,ZHENG Shaoquan.Research on influence factors in heat injury of loquat peel[J].Fujian Journal of Agricultural Sciences,2012,27(10):1081-1086.
[3] 桑荣生,吴宝玉.枇杷果实日灼等非侵染性病害调查与分析[J].农业科技通讯,2020(2):173-177.SANG Rongsheng,WU Baoyu.Investigation and analysis of non-infectious diseases such as loquat fruit sunburn[J].Bulletin of Agricultural Science and Technology,2020(2):173-177.
[4] GAMBETTA J M,HOLZAPFEL B P,STOLL M,FRIEDEL M.Sunburn in grapes:A review[J].Frontiers in Plant Science,2020,11:604691.
[5] 谢兆森,BHASKAR.日灼对酿酒葡萄‘霞多丽’果实品质与解剖结构的影响[J].西北植物学报,2018,38(1):68-76.XIE Zhaosen,BHASKAR.Impacts of sunburn on the anatomical structure and quality of chardonnay grape berry[J].Acta Botanica Boreali-Occidentalia Sinica,2018,38(1):68-76.
[6] 郝燕燕.苹果果实日烧发生机理及果皮抗光氧化特性的研究[D].北京:中国农业大学,2004.HAO Yanyan.Study on the mechanism of sunburn development and the resistance to photo-oxidation in apple peel[D].Beijing:China Agricultural University,2004.
[7] OLIVARES-SOTO H,BASTÍAS R M,CALDERÓN-ORELLANA A,LÓPEZ M D.Sunburn control by nets differentially affects the antioxidant properties of fruit peel in‘Gala’and‘Fuji’apples[J].Horticulture,Environment,and Biotechnology,2020,61(2):241-254.
[8] FELICETTID A,SCHRADER L E.Changes in pigment concentrations associated with sunburn browning of five apple cultivars.II.Phenolics[J].Plant Science,2009,176(1):84-89.
[9] WANG Y P,REITER R J,CHAN Z L.Phytomelatonin:A universal abiotic stress regulator[J].Journal of Experimental Botany,2018,69(5):963-974.
[10] ZENG W,MOSTAFA S,LU Z G,JIN B.Melatonin-mediated abiotic stress tolerance in plants[J].Frontiers in Plant Science,2022,13:847175.
[11] 杨建帮,杨丽,姚文孔,冯美.果树中褪黑素的合成及其调控作用研究进展[J].中国果树,2024(3):13-20.YANG Jianbang,YANG Li,YAO Wenkong,FENG Mei.Research progress on synthesis and regulation of melatonin in fruit trees[J].China Fruits,2024(3):13-20.
[12] 汪卉.褪黑素提高枇杷幼苗响应寒冷胁迫能力的机理研究[D].重庆:西南大学,2020.WANG Hui.Response of melatonin at different concentrations to loquat seedlings under cold stress[D].Chongqing:Southwest University,2020.
[13] 李元生,徐珊珊,李强,杜海燕.外源褪黑素对高温胁迫下葡萄幼苗生理特性的影响[J].林业科技通讯,2021(4):66-69.LIYuansheng,XU Shanshan,LIQiang,DU Haiyan.Effects of exogenous melatonin on physiological characteristics of grape seedlings under high temperature stress[J].Forest Science and Technology,2021(4):66-69.
[14] 刘若溪,曹歌,王琪,张涵洋,李爱.外源褪黑素对高温胁迫下西瓜幼苗生理特性的影响[J].天津农业科学,2023,29(6):7-12.LIU Ruoxi,CAO Ge,WANG Qi,ZHANG Hanyang,LIAi.Effects of exogenous melatonin on physiological characteristics of watermelon seedlings under elevated temperature stress[J].Tianjin Agricultural Sciences,2023,29(6):7-12.
[15] 姚富文.苹果耐高温基因的鉴定及褪黑素对高温胁迫的缓解效应[D].郑州:河南农业大学,2021.YAO Fuwen.Identification the genes related to high temperature tolerance in apple and the alleviating effect of melatonin on high temperature stress[D].Zhengzhou:Henan Agricultural University,2021.
[16] 郑少泉.枇杷种质资源描述规范和数据标准[M].北京:中国农业出版社,2006:82-83.ZHENG Shaoquan.Descriptors and data standard for loquat(Er‐iobotrya spp.)[M].Beijing:China Agriculture Press,2006:82-83.
[17] 杜倩,李昌颖,宋贞富,钟思玲,周奎,文晓鹏.无籽刺梨果实生长发育的解剖结构观察[J].中国南方果树,2023,52(6):171-177.DU Qian,LI Changying,SONG Zhenfu,ZHONG Siling,ZHOU Kui,WEN Xiaopeng.Observation of anatomical structure of growth and development of Rosa sterilis fruits[J].South China Fruits,2023,52(6):171-177.
[18] 徐珍秀,胡春奎,兰盛银.植物组织石蜡切片的扫描电镜观察方法研究[J].武汉植物学研究,1992,10(4):377-380.XU Zhenxiu,HU Chunkui,LAN Shengyin.A technique of observation on paraffin sections with scanning electron microscope[J].Journal of Wuhan Botanical Research,1992,10(4):377-380.
[19] 邓朝军,许奇志,蒋际谋,魏秀清,章希娟,郑少泉.高温胁迫对枇杷果皮热伤害的抗氧化特性影响[J].热带亚热带植物学报,2012,20(5):439-444.DENG Chaojun,XU Qizhi,JIANG Jimou,WEI Xiuqing,ZHANG Xijuan,ZHENG Shaoquan.Changes in antioxidant properties induced by heat injury in loquat peel under high temperature stress[J].Journal of Tropical and Subtropical Botany,2012,20(5):439-444.
[20] 蒯传化,杨朝选,刘三军,吴国良,陈汉杰,郑先波.落叶果树果实日灼病研究进展[J].果树学报,2008,25(6):901-907.KUAIChuanhua,YANG Chaoxuan,LIU Sanjun,WU Guoliang,CHEN Hanjie,ZHENG Xianbo.Advances in research on fruit sunburn of deciduous fruit crops[J].Journal of Fruit Science,2008,25(6):901-907.
[21] BONADA M,SADRAS V O,FUENTES S.Effect of elevated temperature on the onset and rate of mesocarp cell death in berries of Shiraz and Chardonnay and its relationship with berry shrivel[J].Australian Journal of Grape and Wine Research,2013,19(1):87-94.
[22] 陈少春.高温、强光胁迫对苹果果实表皮组织抗氧化特性的影响[D].保定:河北农业大学,2006.CHEN Shaochun.Effect of high-temperature and intense-light stresses on antioxidative properties in apple peel tissues[D].Baoding:Hebei Agricultural University,2006.
[23] 陈楠,张维,张晓明.褪黑素调控辣椒幼苗响应盐胁迫下的叶片生理特性[J].中国瓜菜,2023,36(5):84-90.CHEN Nan,ZHANG Wei,ZHANG Xiaoming.Melatonin regulates physiological characteristics of pepper seedlings in response to salt stress[J].China Cucurbits and Vegetables,2023,36(5):84-90.
[24] COLOMBAGE R,SINGH M B,BHALLA P L.Melatonin and abiotic stress tolerance in crop plants[J].International Journal of Molecular Sciences,2023,24(8):7447.
[25] 王丹.外源褪黑素对干旱胁迫下枇杷叶片的生理及其分子调控研究[D].重庆:西南大学,2021.WANG Dan.Physiological and molecular regulation of exogenous melatonin treatment in loquat (Eriobotrya japonica Lindl.)leaves under drought stress[D].Chongqing:Southwest University,2021.
[26] 徐向东,孙艳,郭晓芹,孙波,张坚.褪黑素对高温胁迫下黄瓜幼苗抗坏血酸代谢系统的影响[J].应用生态学报,2010,21(10):2580-2586.XU Xiangdong,SUN Yan,GUO Xiaoqin,SUN Bo,ZHANG Jian.Effects of exogenous melatonin on ascorbate metabolism system in cucumber seedlings under high temperature stress[J].Chinese Journal of Applied Ecology,2010,21(10):2580-2586.
[27] WANG K X,XING Q F,AHAMMED G J,ZHOU J.Functions and prospects of melatonin in plant growth,yield,and quality[J].Journal of Experimental Botany,2022,73(17):5928-5946.
[28] HEREDIA-GUERRERO J A,GUZMAN-PUYOL S,BENÍTEZ J J,ATHANASSIOU A,HEREDIA A,DOMÍNGUEZ E.Plant cuticle under global change:Biophysical implications[J].Global Change Biology,2018,24(7):2749-2751.
[29] MIRANDA S,VILCHES P,SUAZO M,PAVEZ L,GARCÍA K,MÉNDEZ M A,GONZÁLEZ M,MEISEL L A,DEFILIPPIB G,DEL POZO T.Melatonin triggers metabolic and gene expression changes leading to improved quality traits of two sweet cherry cultivars during cold storage[J].Food Chemistry,2020,319:126360.
[30] BENÍTEZ J J,MORENO A G,GUZMÁN-PUYOL S,HEREDIAGUERRERO J A,HEREDIA A,DOMÍNGUEZ E.The response of tomato fruit cuticle membranes against heat and light[J].Frontiers in Plant Science,2022,12:807723.
[31] 姜寒玉,雷天翔,李唯,何百鋆.低温胁迫下‘贝达’和‘赤霞珠’葡萄不同组织糖含量及细胞结构的变化[J].果树学报,2015,32(4):604-611.JIANG Hanyu,LEITianxiang,LIWei,HE Baijun.Changes of sugar contents in different tissues and cell structure in two grape(Vitis vinifera L.)varieties under low temperature stress[J].Journal of Fruit Science,2015,32(4):604-611.
[32] MAKEREDZA B,SCHMEISSER M,LÖTZE E,STEYN W J.Water stress increases sunburn in‘Cripps’pink’apple[J].Hort-Science,2013,48(4):444-447.
[33] WOOLF A B,FERGUSON IB.Postharvest responses to high fruit temperatures in the field[J].Postharvest Biology and Technology,2000,21(1):7-20.
[34] MATAS A J,CUARTERO J,HEREDIA A.Phase transitions in the biopolyester cutin isolated from tomato fruit cuticles[J].Thermochimica Acta,2004,409(2):165-168.
[35] 寸丽芳,房立媛,林敏娟,王振磊.喷施外源钙对骏枣裂果和相关生理特性及显微结构的影响[J].果树学报,2023,40(9):1894-1903.CUN Lifang,FANG Liyuan,LIN Minjuan,WANG Zhenlei.Effects of spraying calcium on fruit cracking and related physiological characteristics and microstructure of Junzao jujube[J].Journal of Fruit Science,2023,40(9):1894-1903.
[36] 姚棋,韩天云,梁祎,石玉,侯雷平,张毅.外源钙和EBR 处理对番茄果实品质特性的影响[J].中国瓜菜,2021,34(10):74-79.YAO Qi,HAN Tianyun,LIANG Yi,SHIYu,HOU Leiping,ZHANG Yi.Effects of exogenous calcium and EBR on fruit quality characteristics of tomato[J].China Cucurbits and Vegetables,2021,34(10):74-79.
[37] 吴潇,陈杨杨,石新杰,齐开杰,曹鹏,殷豪,张绍铃.喷施外源激素对‘玉露香’梨叶片表皮蜡质组分、结构及渗透性的影响[J].南京农业大学学报,2018,41(4):647-654.WU Xiao,CHEN Yangyang,SHIXinjie,QIKaijie,CAO Peng,YIN Hao,ZHANG Shaoling.Effects of spraying exogenous hormones on cuticular wax composition,structure and permeability of the leaves in‘Yuluxiang’pear[J].Journal of Nanjing Agricultural University,2018,41(4):647-654.
[38] 林建城,林河通,郭振国,陈素英,梁杰.枇杷不同品种果实形态结构的比较及其与耐贮藏性的关系[J].热带作物学报,2009,30(1):53-58.LIN Jiancheng,LIN Hetong,GUO Zhenguo,CHEN Suying,LIANG Jie.Morphology and structure and their relationships to storability of loquat fruits(Eriobotrya japonica Lindl.)[J].Chinese Journal of Tropical Crops,2009,30(1):53-58.
[39] DING F,WANG G,WANG M L,ZHANG S X.Exogenous melatonin improves tolerance to water deficit by promoting cuticle formation in tomato plants[J].Molecules,2018,23(7):1605.
[40] TORRES C A,SEPULVEDA A,GONZALEZ- TALICE J,YURIJ A,RAZMILIC I.Fruit water relations and osmoregulation on apples (Malus domestica Borkh.) with different Sun exposures and Sun-injury levels on the tree[J].Scientia Horticulturae,2013,161:143-152.
[41] PINSKI A,BETEKHTIN A,SKUPIEN- RABIAN B,JANKOWSKA U,JAMET E,HASTEROK R.Changes in the cell wall proteome of leaves in response to high temperature stress in Brachypodium distachyon[J].International Journal of Molecular Sciences,2021,22(13):6750.
[42] 赵朋飞,骆世超,许佩轩,孙晓峰,徐伟敏,马辉,许建锋,张海霞.褪黑素处理对采后梨果实品质及相关生理指标的影响[J].华北农学报,2023,38(增刊):211-218.ZHAO Pengfei,LUO Shichao,XU Peixuan,SUN Xiaofeng,XU Weimin,MA Hui,XU Jianfeng,ZHANG Haixia.Effects of melatonin treatments on the fruit quality and related physiological indexes of postharvest pears[J].Acta Agriculturae Boreali-Sinica,2023,38(Suppl.1):211-218.
[43] 千春录,罗迎秋,张云,孙琰,邵豫阳,张蓓,齐晓花.外源褪黑素对采后冷藏番茄硬度变化的影响及调控机制[J].美食研究,2023,40(3):92-98.QIAN Chunlu,LUO Yingqiu,ZHANG Yun,SUN Yan,SHAO Yuyang,ZHANG Bei,QIXiaohua.Effects of exogenous melatonin on firmness of postharvest tomato during cold storage and its regulatory mechanism[J].Journal of Researches on Dietetic Science and Culture,2023,40(3):92-98.
[44] KIM M,PARK Y,YUN S K,KIM S S,JOA J,MOON Y E,DO G R.The anatomical differences and physiological responses of sunburned Satsuma mandarin (Citrus unshiu Marc.) fruits[J].Plants,2022,11(14):1801.
[45] ZHAO D Q,WANG R,MENG J S,LIZ Y,WU Y Q,TAO J.Ameliorative effects of melatonin on dark-induced leaf senescence in Gardenia(Gardenia jasminoides Ellis):Leaf morphology,anatomy,physiology and transcriptome[J].Scientific Reports,2017,7(1):10423.