EXO(EXORDIUM)是一个能促进植物生长并响应油菜素内酯(BR)诱导的基因,在拟南芥中被首次发现并命名[1],EXO 的过量表达可以使野生型植物的芽和根生长更强[2]。基因启动子通常认为是基因结合转录因子的位点,位于结构基因5'端上游的DNA 序列,能活化RNA 聚合酶,使之与模板DNA准确地结合并具有转录起始的特异性[3]。启动子包含两大区域,一是含有核心启动子元件(TATA-box)和转录起始位点(TSS)的核心区;二是调控元件区,包括应答顺式作用元件和增强元件。启动子上的顺式作用元件可以和转录因子基因结合,调控下游基因的转录。基因发挥功能的第一步是转录为mRNA,而启动子与转录因子调控特定基因表达是植物发挥自身调控能力最重要的方式之一[4]。Farrar 等[5]克隆了拟南芥中EXO 基因及启动子,并验证了二者的活性。EXO 是一种细胞外蛋白,蛋白质组学方法确定拟南芥EXO/EXL 蛋白家族的成员,如EXO、EXL1、EXL2、EXL3 和EXL4 蛋白是细胞壁蛋白组的一部分[6-9]。目前还没有关于EXO/EXL 基因家族对低温胁迫或其他非生物胁迫反应的详细报道。Wei 等[10]分析了桑寄生[Taxillusi chinensis(DC.)Danser]种子在低温胁迫下的转录组,在普遍上调的基因中发现了3 个共同上调表达的编码EX‐ORDIUM的基因。在拟南芥中,EXL3在低温胁迫时上调表达;EXL1 和EXO 在干旱胁迫时上调表达,EXL6下调表达;此外,EXL5在两种胁迫下都上调表达,EXL2、EXL4 下调表达,表明EXO/EXL 基因家族对非生物胁迫有反应,并且还参与了干旱和低温胁迫共表达网络的调控[11]。然而,关于该蛋白家族在葡萄中的成员数量,EXO 蛋白的功能以及对低温胁迫反应的表达模式,目前还没有系统的报道。
葡萄是世界上栽培范围广、经济效益高的水果之一。葡萄产业的稳定和可持续发展持续受到各种外部环境压力的挑战,包括生物和非生物胁迫。其中,低温成为影响葡萄的生长和发育、果实品质和产量的主要因素。因此,提高葡萄的抗寒性被视为育种计划的一个重要目标,以防止冬季严重的冷害或者冻害。山葡萄(Vitis amurensis)是常见的野生葡萄种类,可以承受-40 ℃的低温,已被广泛用于传统育种和培育耐寒栽培品种[12]。然而,由于葡萄的生命周期长,酿酒葡萄的遗传背景复杂,通过传统的杂交育种来改善葡萄种质面临挑战[13],基因工程在育种过程中提供了另一种可行策略。为此,明确山葡萄抗寒性的冷反应机制,并研究有价值的冷反应基因,在葡萄遗传改良中具有重要作用。通过对笔者实验室前期研究结果分析发现,在低温条件下,玫瑰香葡萄中有6 个VvEXO 家族成员上调表达,其中VvEXO11 上调最为显著。对VvEXO 的表达谱分析发现,VvEXO11 在葡萄中能对低温胁迫做出快速反应,可以进一步研究其在相应低温胁迫中的作用。山葡萄作为一个抗寒性极强的葡萄种类被广泛研究,因此克隆山葡萄中VaEXO11 基因及其启动子序列并进行生物信息学分析,对VaEXO11 的功能做出初步预测,从而为进一步的基因功能验证提供线索。
1 材料和方法
1.1 植物材料
供试材料为中国科学院武汉植物园园艺作物逆境生物学课题组保存的山葡萄组培苗,培养基为1/2 MS 培养基+30 g·L-1 蔗糖+7 g·L-1 琼脂+0.1 mg·L-1 IAA,光周期为16 h光照/8 h黑暗,光照度为100 μmol·m-2·s-2,培养温度为26 ℃。
本氏烟草种子保存在4 ℃冰箱中,使用前将其取出播种至蛭石与泥炭土1∶2(体积比)的花盆中,盖上薄膜黑暗培养2 h 后在16 h 光照/8 h 黑暗的光周期条件下生长,培养温度为25 ℃,随后用于LUC检测的瞬时转化。
1.2 方法
1.2.1 DNA提取、总RNA提取与cDNA合成 以山葡萄为试材,使用天根生化技术有限公司生产的DNAsecure 新型植物基因组DNA 提取试剂盒和RNAprep Pure 多糖多酚植物总RNA 提取试剂盒分别提取DNA和总RNA,按产品说明书进行操作并稍作改动。以检测合格的葡萄总RNA 为模板,采用全式金生物技术有限公司生产的TransScript 一步法gDNA去除及cDNA合成试剂盒并按说明书将RNA反转录为cDNA。反转录体系为:RNA样品1 μg(根据测得的RNA浓度计算所用RNA体积),oligo(dT)18 1 μL,2×TS Reaction Mix 10 μL,TransScript RT/RIEnzyme Mix 1 μL,gDNA Remover 1 μL,RNase-free Water 补足到20 μL,42 ℃孵育50 min,85 ℃加热5 s 使逆转录酶失活。提取的DNA和合成的cDNA在-20 ℃存储备用。
1.2.2 引物合成 以中国科学院武汉植物园园艺作物逆境生物学课题组未发表的山葡萄转录组数据库中得到的VaEXO11 序列片段为基础,结合已公布的黑比诺葡萄基因组注释信息,运用Primer Premier 5.0 软件设计扩增VaEXO11 编码区全长的引物和编码区ATG 上游2000 bp 启动子引物,引物合成与测序均由北京擎科生物科技有限公司(武汉)完成。本文所用到的引物如下:
含有EcoRI同源臂的扩增VaEXO11 编码区的引物:
VaEXO11- F: GACACTAGTGGATCCAAAGAATTCATGGCATCTTTCGTTCCTACTCAAT,
VaEXO11-R: TCCCTCGAGAAGCTTTTTGAATTCGACCAGAGTAGAACAGGTGGAAGTT。
含有Spe I同源臂的扩增VaEXO11 启动子PVaEXO11的引物:
PVaEXO11-F: CCCGGGGGATCCACTAGTTCATATATTAGTCCCACCGATATCC,
PVaEXO11- R: GGCCGCTCTAGAACTAGTGGCAGTTAGGACTTAAGAGTGCAGT。
1.2.3 PCR 扩增与质粒提取 分别以山葡萄RNA反转录得到的cDNA 和提取的山葡萄DNA 为模板,根据山葡萄转录组测序得到的EXORDIUM 序列片段并结合设计引物VaEXO11-F/VaEXO11-R,PVaEXO11-F/PVaEXO11-R 进行目的基因ORF 和启动子的扩增。克隆该基因全长用1.2%琼脂糖凝胶电泳和DNA Marker DL2000 检测PCR 扩增产物,将扩增得到的DNA 和cDNA 片段回收并连接克隆载体,然后利用热激法将连接产物转化到DH5α 大肠杆菌感受态中,经抗生素筛选和菌落PCR 检测,挑取阳性克隆送往北京擎科生物科技有限公司(武汉)进行测序。将测序正确的菌液接种于10 mL 含10 μL Spe/Kan(100 mg·L-1)的LB液体培养基中,在37 ℃、220 r·min-1摇床上振荡培养12~14 h,利用质粒小提试剂盒提取质粒,操作参考说明书并稍作改动。用1.2%琼脂糖凝胶电泳检测质粒质量,将合格的质粒置于-20 ℃储存备用。
1.2.4 序列生物信息学分析 采用SMART 7(https://smart.embl.de/)和 Pfam(http://pfam- legacy.xfam.org/)确认VaEXO11 蛋白的结构域,采用ExPASy-ProtParam(https://web.expasy.org/protparam/)分析VaEXO11 蛋白的物理化学特性。使用基因结构显示服务器2.0(http://gsds.gao-lab.org/)分析VaEXO11基因内含子/外显子结构。采用SignalP-6.0(https://services.healthtech.dtu.dk/services/SignalP-6.0/)预测信号肽种类。利用NetPhos 3.1 Server(https://services.healthtech.dtu.dk/services/NetPhos- 3.1/) 预 测VaEXO11 蛋白磷酸化位点。通过DNAMAN9 进行DNA和氨基酸序列比对分析,利用MEGA11构建系统进化树。利用BDGP(https://fruitfly.org/seq_tools/promoter.html)分析核心启动子。通过网络分析工具PlantCare(https://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析VaEXO11 起始密码子上游启动子序列中的顺式作用元件。最后,采用TBtools10 软件分析可视化启动子序列的顺式作用元件。
1.2.5 PVaEXO11启动子瞬时表达分析 用冻融法将获得的重组质粒pGreen 0800-PVaEXO11-LUC 和空载pGreen 0800-LUC 转入根癌农杆菌GV3101,并检测LUC 荧光活性,将检测正确的阳性克隆用于烟草瞬时转化,瞬时转化主要参考Sheludko等[14]的方法。将瞬时转化得到的烟草置于低温光照培养箱中8 ℃处理2 h,室温恢复15 min 后进行LUC 观察。以1∶200(体积比)配置荧光素酶钾盐溶液3 mL,用毛笔涂在烟草叶片背面,背面朝上,放入多功能成像系统中拍照,选择化学发光,曝光时间为5 min。
2 结果与分析
2.1 VaEXO11和PVaEXO11序列的获得
分别以山葡萄RNA 反转录得到的cDNA 和提取的山葡萄DNA 为模板,根据山葡萄转录组测序得到的EXORDIUM 序列片段并结合设计引物VaEXO11-F/VaEXO11-R,PVaEXO11-F/PVaEXO11-R 进行目的基因ORF 和启动子的扩增,得到该基因全长和启动子(图1)。经测序分析,PCR 扩增得到的目的基因的序列长度为957 bp,利用DNAMAN9 进行序列比对,发现该基因与Phytozome 上葡萄基因组中编号为VvEXO11 的基因序列相似度高达99.37%(图2),蛋白相似度达98.75%(图3)。启动子长度为1938 bp,与VvEXO11 启动子序列相似度达65.02%(图4),与预测结果基本一致,故将山葡萄中扩增得到的目的基因命名为VaEXO11,其启动子为PVaEXO11。

图1 山葡萄VaEXO11 和启动子PVaEXO11扩增结果
Fig.1 Amplification of VaEXO11 and promoter sequences in V.amurensis

图2 VvEXO11 和VaEXO11 核苷酸序列比对
Fig.2 Nucleotide sequence alignment of VvEXO11 and VaEXO11

图3 VvEXO11 和VaEXO11 氨基酸序列比对
Fig.3 Amino acid sequence alignment of VvEXO11 and VaEXO11

图4 PVvEXO11和PVaEXO11启动子核苷酸序列比对
Fig.4 Nucleotide sequence alignment of promoters of VvEXO11 and VaEXO11
2.2 VaEXO11基因序列特征分析
该基因的cDNA 序列全长为957 bp,开放阅读框为957 bp,编码318 个氨基酸。对VaEXO11 的DNA 序列分析发现,VaEXO11 仅由1 个外显子(exon)构成,与VvEXO11 序列比对发现,二者仅有6 个核苷酸差异(图2)。对VaEXO11蛋白进行保守结构域分析表明,该蛋白仅含有一个保守结构域,即Phi_1结构域(Phosphate-induced protein 1 domain),同时,该蛋白前25 个氨基酸形成一个信号肽Sec/SPI,是一种由Sec 转座运输并由信号肽酶I(Lep)裂解的“标准”分泌性信号肽(图5),裂解点位于A25~A26之间(图6-A)。通过NetPhos 3.1 Server 预测该蛋白共71 个磷酸化位点(图6-B),其中阳性结果36 个,包括丝氨酸(Serine)25个,苏氨酸(Threonine)9个和酪氨酸(Tyrosine)2 个。VaEXO11 与VvEXO11 蛋白序列比对发现,二者仅有3 个氨基酸差异(图3)。用Protparam 对VaEXO11 蛋白的基本理化性质分析,结果显示,该蛋白的分子质量为33 855.58 Da,理论等电点(pI)为9.15;在氨基酸组成上,丝氨酸(Ser)含量最高,达12.3%,其次为亮氨酸(Leu)和甘氨酸(Gly),分别为11.3%和8.8%;不稳定系数(instability index,Ⅱ)为31.75,表明该蛋白稳定性较好;平均疏水性系数(grand average of hydropathicity,GRAVY)为-0.082,脂溶指数(aliphatic index)为85.03,表明其为疏水性脂溶蛋白。另外,对葡萄基因组数据分析显示,EXL11 存在于葡萄第18 条染色体上。
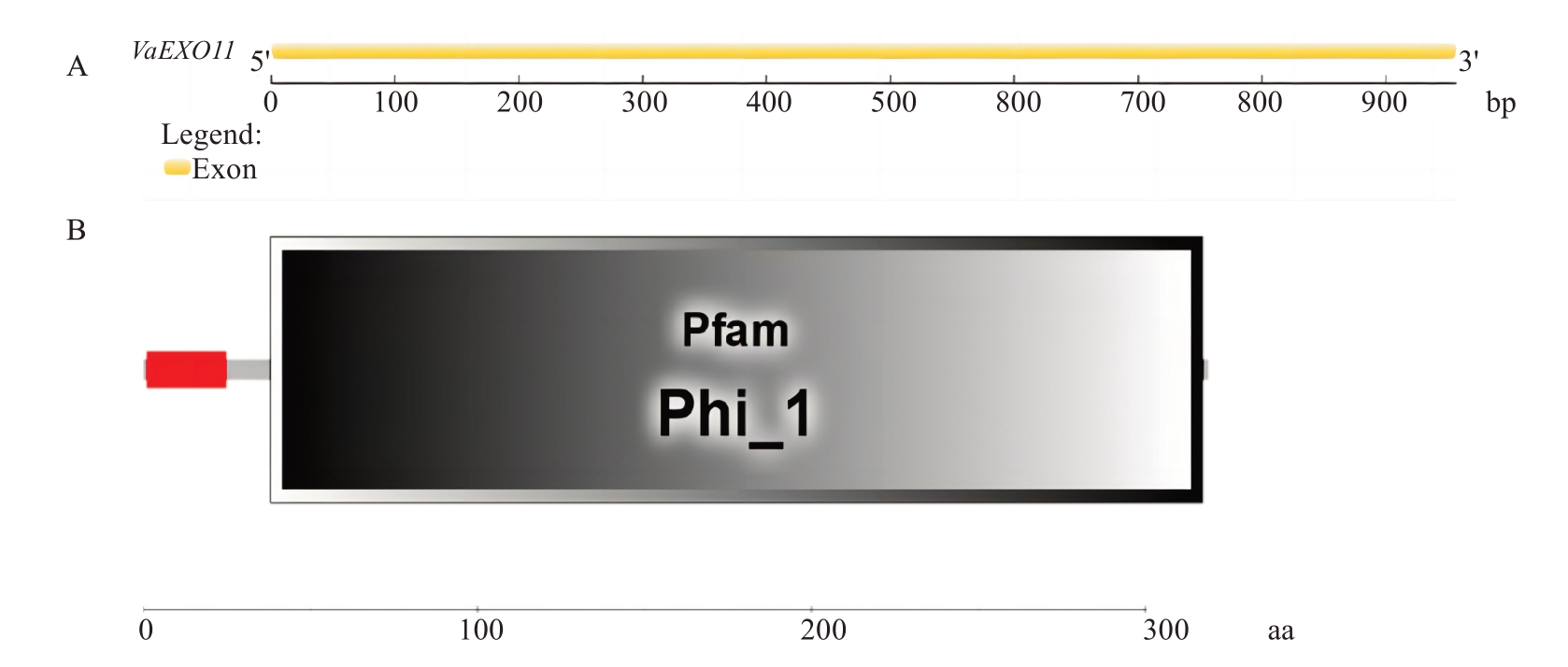
图5 VaEXO11 基因和蛋白序列分析
Fig.5 Gene and protein sequence analyses of VaEXO11
A.VaEXO11 基因核苷酸序列分析结果;B.VaEXO11 蛋白氨基酸序列结构域分析结果。红框代表信号肽(Sec/SPI),Phi_1 代表结构域。
A.Results of nucleotide sequence analysis of VaEXO11 gene; B.Results of structural domain analysis of amino acid sequence of VaEXO11 protein.The red box represents the signal peptide(Sec/SPI),and Phi_1 represents the structural domain.
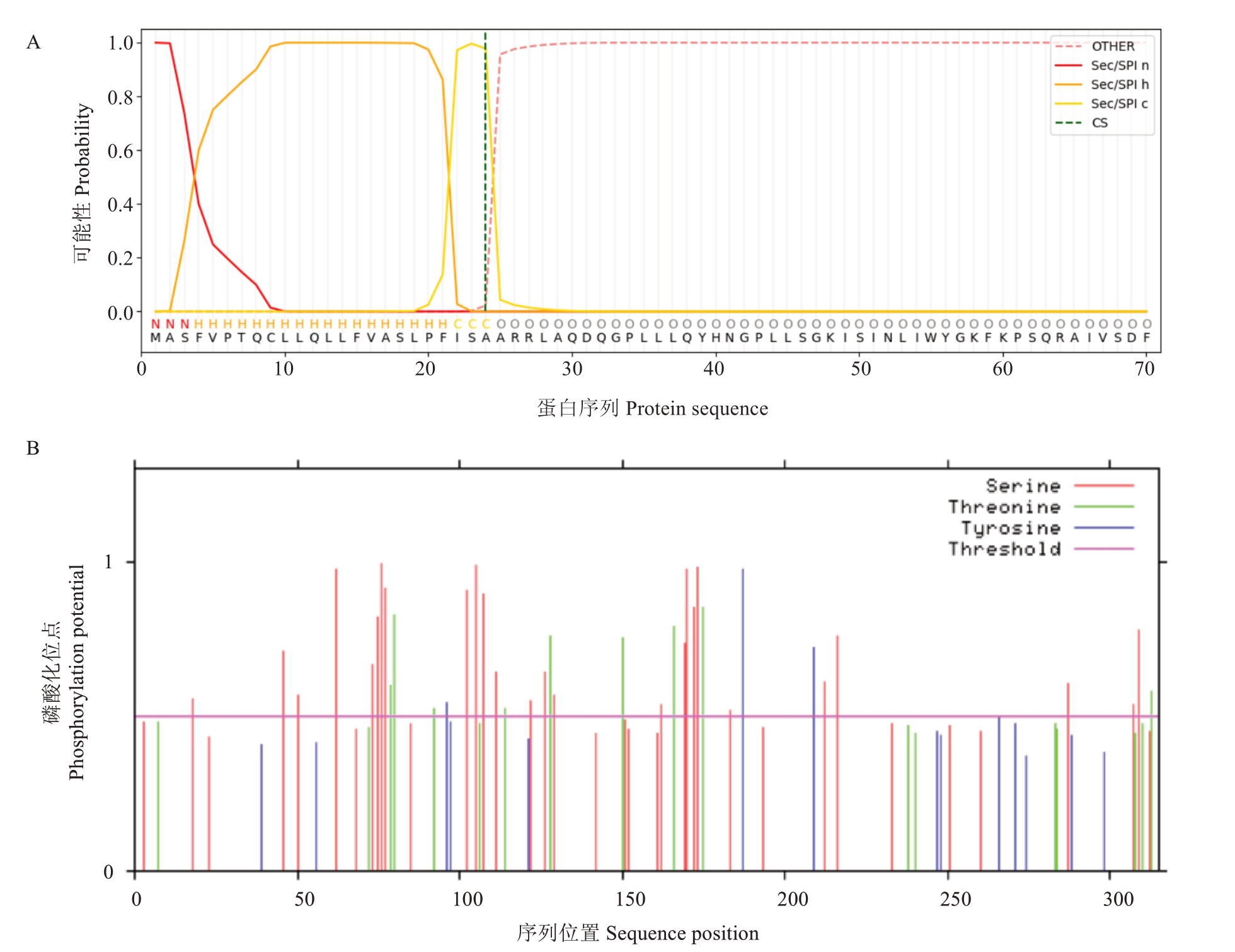
图6 VaEXO11 信号肽和磷酸化位点预测
Fig.6 VaEXO11 protein signal peptide and phosphorylation sites prediction
A.VaEXO11 蛋白信号肽预测;B.VaEXO11 蛋白磷酸化位点预测。
A.VaEXO11 protein signal peptide prediction;B.Prediction of phosphorylation sites of VaEXO11 protein.
2.3 VaEXO11系统发育分析
为了探究山葡萄中VaEXO11 蛋白与其他物种的EXO 蛋白的关系,用VaEXO11 蛋白在NCBI进行blastn,选择不同物种中相似度最高的序列,共筛选到27 个EXO11 蛋白序列。对已克隆的VaEXO11 与27 个其他物种的EXO11 基因的氨基酸序列进行多序列比对分析,并构建系统发育树。通过氨基酸序列比对发现(图7),包括VaEXO11 在内的28 个EXO11 氨基酸长度相近,序列相似度达77.99%,均含有相似的结构域,序列较为保守,尤其是N 端FAYIWVGNSETQCFGQCAWPFHQFIYGFQ比例极高。从系统发育分析来看(图8),与VaEXO11 关系较近的除了酿酒葡萄(V.vinifera)和河岸葡萄(V.ri‐paria)外,还有雷公藤(Tripterygium wilfordii)。

图7 不同物种EXO 氨基酸序列比对
Fig.7 Alignment of amino acid sequences of EXO of different species
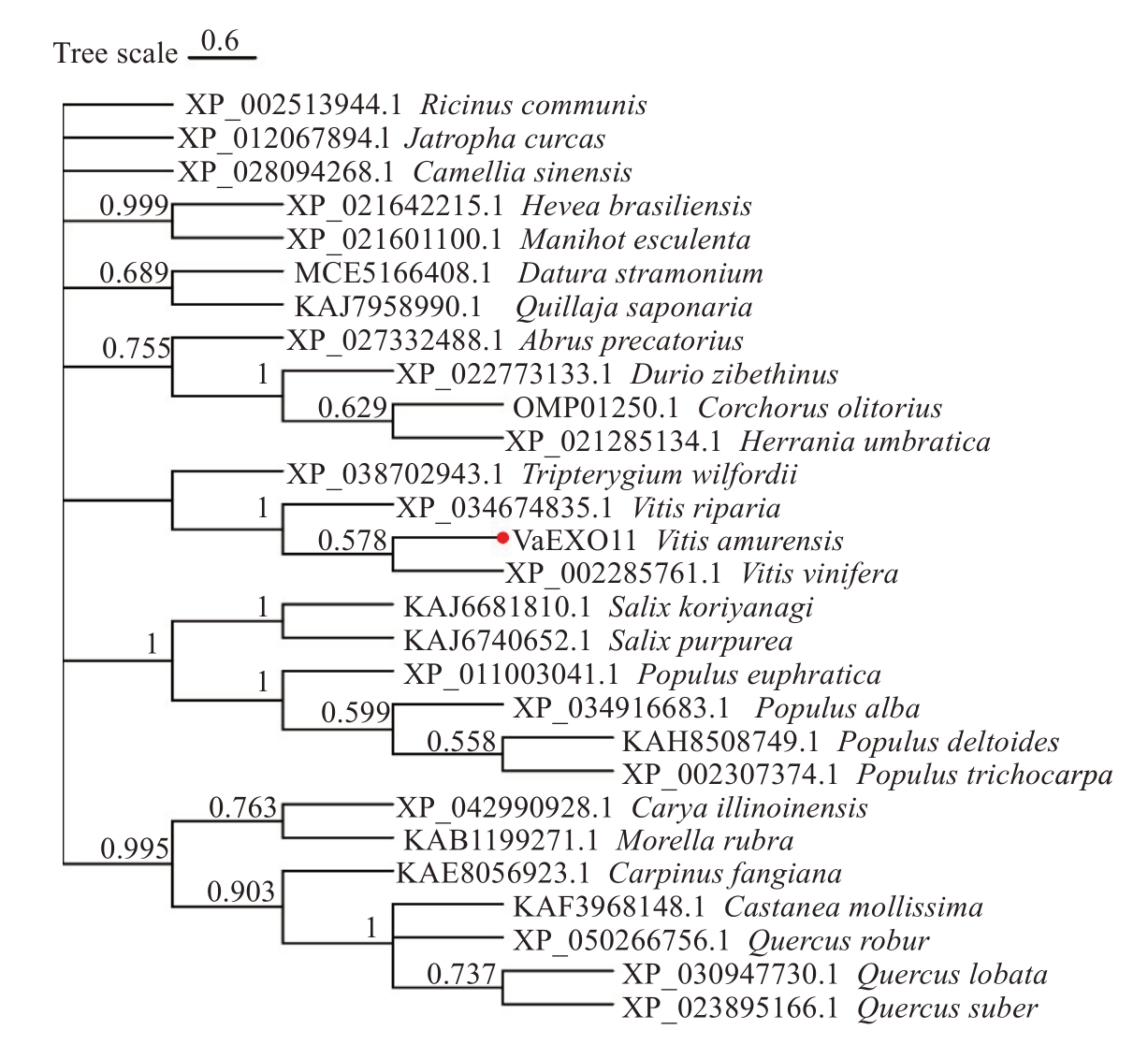
图8 不同物种中EXO 系统发育树
Fig.8 Phylogenetic analysis of EXO proteins from different species
2.4 低温处理下VaEXO11的表达分析
转录组的结果表明,VvEXO11 能被低温诱导表达,为了进一步研究其详细的表达模式,笔者利用荧光定量PCR 对山葡萄中VaEXO11 在低温处理24 h内的表达模式进行分析(图9)。山葡萄VaEXO11 基因在4 ℃低温下不同冷处理时间点的定量RT-PCR分析表明,冷处理早期(0~2 h),该基因的表达量就发生明显的变化,并且在2 h达到最高值,约为0 h的4250 倍,说明VaEXO11 基因能够快速响应冷胁迫。RNA-Seq 与qRT-PCR 获得的基因表达模式高度一致,表明本研究中VaEXO11 基因可能在山葡萄的低温响应中发挥作用。
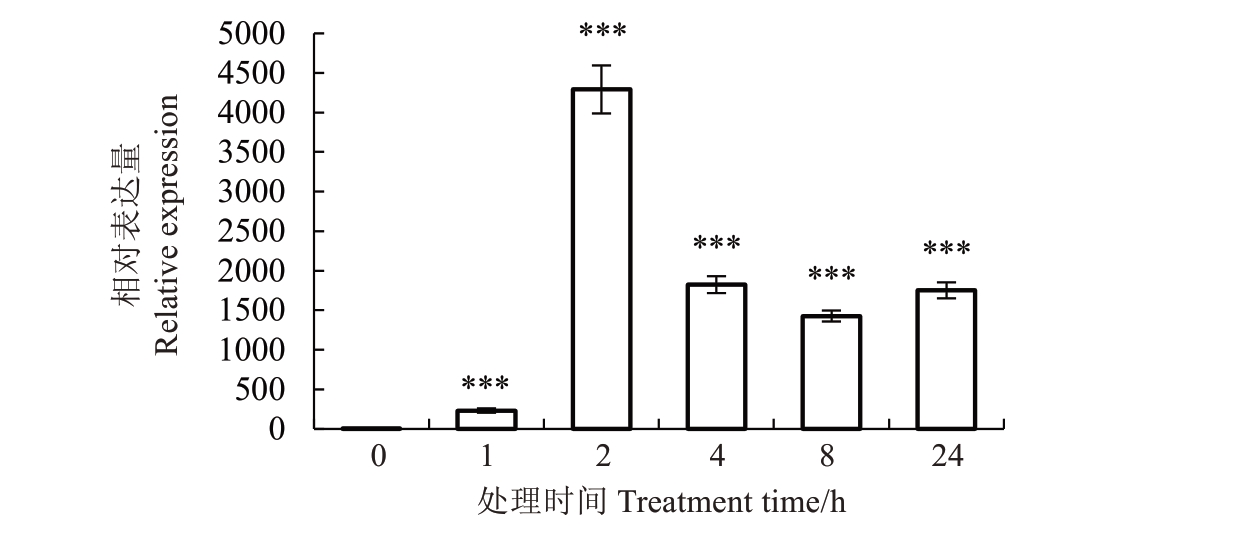
图9 低温处理下VaEXO11 在山葡萄中的相对表达量
Fig.9 Relative expression of VaEXO11 in V.amurensis under low temperature treatment
***表示极显著差异(p<0.001)。
***indicates extremely significant difference(p<0.001).
2.5 启动子PVaEXO11序列分析
以山葡萄转录组数据库中的VaEXO11 基因上游一段-2000 bp 序列为模板设计引物,以提取的山葡萄DNA 为模板扩增VaEXO11 的启动子PVaEXO11,得到一段长1938 bp 的DNA 序列,与VvEXO11 起始密码子上游-2000 bp启动子比对(图4)发现,二者相似度达65.02%。核心启动子分析表明(图10),其位于-1833~1883 bp 之间,转录起始位点在-1873 bp处,进一步证明克隆的VaEXO11 基因cDNA 序列的5'端是完整的。

图10 PVaEXO11核心启动子分析
Fig.10 Core promoter analysis of PVaEXO11
红色方框代表核心启动子区域,黑色箭头代表转录起始位点。
The red box represents the core promoter region and the black arrow represents the transcription start site.
通过Plant CARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测启动子顺式作用元件,结果表明,VaEXO11 的启动子PVaEXO11含有激素响应元件如P-box(赤霉素元件)、TGACG-motif(茉莉酸甲酯元件)、TCA(水杨酸元件)、ERE(乙烯元件)、AAGAA-motif(脱落酸元件),胁迫响应元件如MYB(MYB 响应元件)、MYC(MYC 响应元件)、Wbox(WRKY 转录因子结合位点)、STRE(胁迫响应元件)、WUN-motif(创伤响应元件)等,另外还有参与昼夜节律调控顺式调节元件和无氧诱导所必需的顺式调节元件,相关预测结果如表1所示。
表1 PVaEXO11启动子顺式作用元件预测
Table 1 Prediction of promoter cis-acting elements
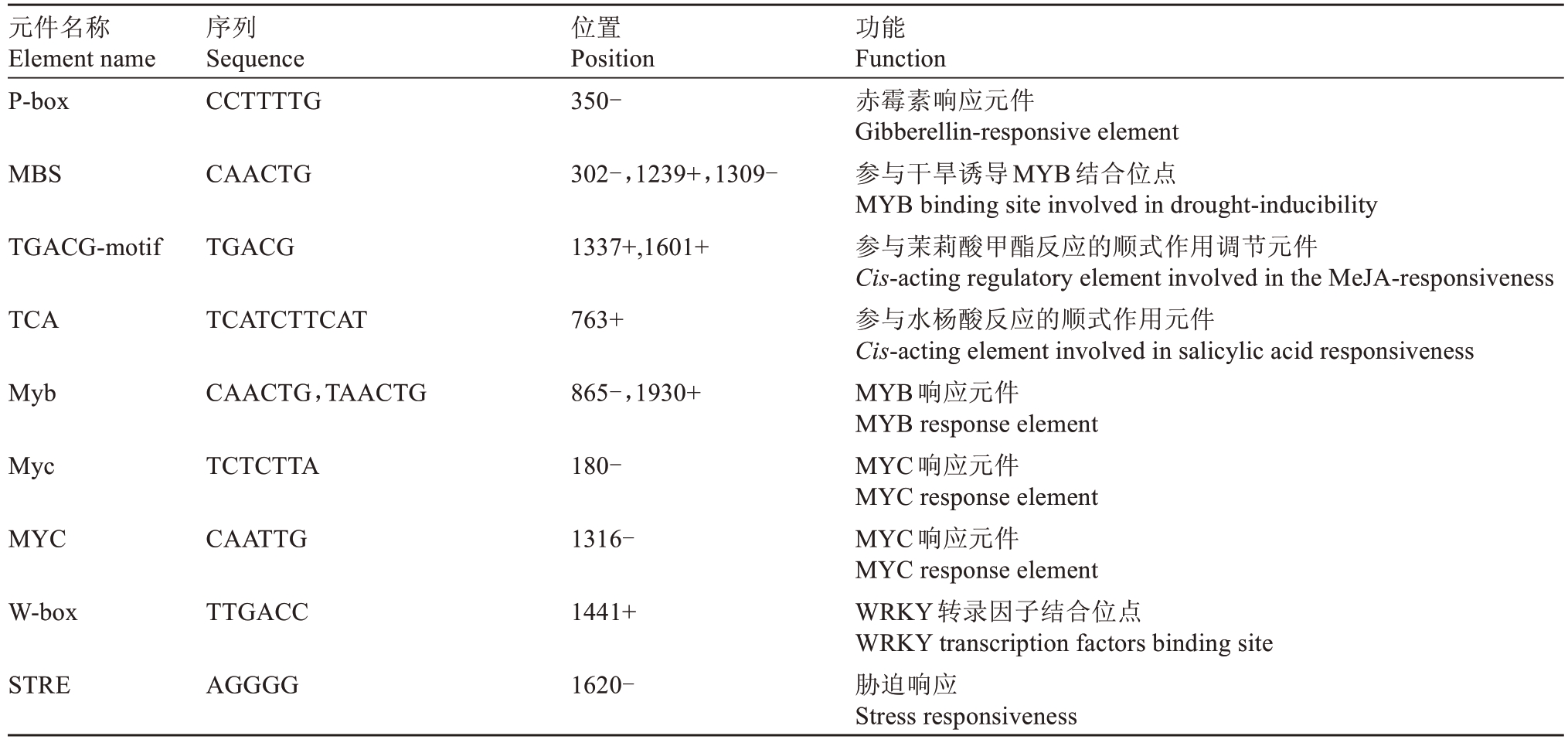
元件名称Element name序列Sequence位置Position功能Function P-box CCTTTTG 350-MBS CAACTG 302-,1239+,1309-TGACG-motif TGACG 1337+,1601+TCA TCATCTTCAT 763+Myb CAACTG,TAACTG 865-,1930+Myc TCTCTTA 180-MYC CAATTG 1316-W-box TTGACC 1441+STRE AGGGG 1620-赤霉素响应元件Gibberellin-responsive element参与干旱诱导MYB结合位点MYB binding site involved in drought-inducibility参与茉莉酸甲酯反应的顺式作用调节元件Cis-acting regulatory element involved in the MeJA-responsiveness参与水杨酸反应的顺式作用元件Cis-acting element involved in salicylic acid responsiveness MYB响应元件MYB response element MYC响应元件MYC response element MYC响应元件MYC response element WRKY转录因子结合位点WRKY transcription factors binding site胁迫响应Stress responsiveness
表1 (续) Table 1 (Continued)
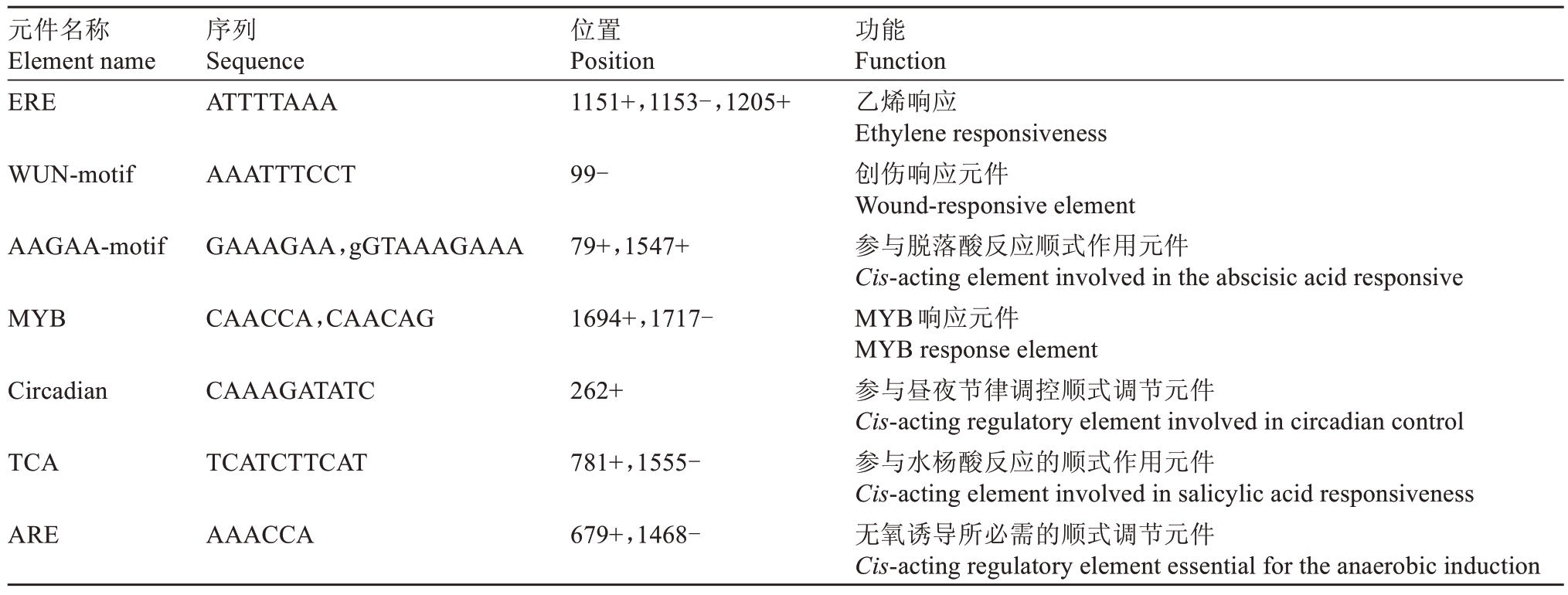
元件名称Element name序列Sequence位置Position功能Function ERE ATTTTAAA 1151+,1153-,1205+WUN-motif AAATTTCCT 99-AAGAA-motif GAAAGAA,gGTAAAGAAA 79+,1547+MYB CAACCA,CAACAG 1694+,1717-Circadian CAAAGATATC 262+TCA TCATCTTCAT 781+,1555-ARE AAACCA 679+,1468-乙烯响应Ethylene responsiveness创伤响应元件Wound-responsive element参与脱落酸反应顺式作用元件Cis-acting element involved in the abscisic acid responsive MYB响应元件MYB response element参与昼夜节律调控顺式调节元件Cis-acting regulatory element involved in circadian control参与水杨酸反应的顺式作用元件Cis-acting element involved in salicylic acid responsiveness无氧诱导所必需的顺式调节元件Cis-acting regulatory element essential for the anaerobic induction
2.6 启动子瞬时表达分析
为了探究启动子是否响应低温胁迫,将构建好的pGreen 0800-PVaEXO11-LUC重组载体和pGreen0800-LUC 空载进行农杆菌(GV3101)转化,将空载和包含重组载体的农杆菌液注射本氏烟草叶片,用Dual-LUC 报告系统评估转录活性。研究结果如图11 所示,4 ℃处理后pGreen 0800Ⅱ-PVaEXO11活性大于空载,说明低温能激活VaEXO11启动子活性。

图11 在烟草中瞬时表达分析启动子活性
Fig.11 Transient expression analysis of promoter activity in tobacco
3 讨 论
利用生物信息学手段对克隆到的基因序列与不同物种中的已知基因进行比对分析,可以对新基因的功能做出初步预测,通过系统进化树推测其进化过程,从而为进一步的基因功能验证提供线索。张宇等[15]克隆了双红F3′H 基因并进行生物信息学分析,发现该基因与双丰中的F3′H 基因序列相似性达到99.67%。Farrar等[5]克隆了拟南芥中长度为945 bp的EXO基因,编码314个氨基酸,生物信息学分析发现该蛋白的N端存在一个信号肽,与烟草中的PHI-1蛋白在氨基酸水平上有76%的同源性。将桉树中EgPHI-1氨基酸序列和其他43个同源氨基酸序列进行比对,表明这些序列高度保守,EgPHI-1 与水稻(Oryza sativa)的AAM08535 有64%的相似性,与酿酒葡萄(V.vinifera)的CAO61694 有75%的相似性[16]。笔者从山葡萄中克隆到VaEXO11 基因,仅由1 个外显子(exon)构成,与黑比诺中的VvEXO11 序列相似度达99.37%,蛋白序列相似度达98.75%,其蛋白含有一个高度保守的Phi-1 结构域和一个信号肽,丝氨酸含量丰富,经预测其为疏水脂溶性蛋白。与其他27个物种的EXO11蛋白序列比对分析,发现氨基酸长度相近,序列相似度达77.99%,均含有相似的结构域,序列较为保守。系统发育分析表明,与VaEXO11 关系较近的除了酿酒葡萄和河岸葡萄外,还有雷公藤。
启动子包含两大区域,一是含有核心启动子元件(TATA-box)和转录起始位点(TSS)的核心区;二是调控元件区,包括应答顺式作用元件和增强元件,调控元件的种类和数量直接影响基因的表达模式和表达强度[17]。张宇等[15]克隆了双红F3′H 基因上游1051 bp 启动子序列并预测启动子可能存在的顺式作用元件,分析发现,F3′H 基因启动子除含有典型的TATA-box、CAAT-box 和参与光反应的顺式作用元件GT1-motif、TCCC-motif、Box4 外,还有参与缺氧特异性诱导性的增强子元件(GC-motif),以及与分生组织表达有关的顺式作用调控元件(CATbox)、参与水杨酸反应的顺式作用元件(TCA-element)和伤口反应元件(WUN-motif)等。薛竟一等[18]克隆了酿酒葡萄VvMT2 上游783 bp 启动子序列,顺式作用元件预测分析表明,序列中有TATAbox、CAAT-box、ARE、GAG-motif、Box-4 等12 个可能的启动子上游调控元件,推测将参与响应胁迫与激素等过程。据报道,AtEXL1的启动子区域也存在受光照、昼夜节律周期和厌氧条件调控的顺式元件,同时发现其在低辐照度、长期黑暗和缺氧条件下表达量升高[19]。将本试验克隆到的启动子序列进行顺式作用元件预测,发现葡萄PVaEXO11启动子含有多个作用元件,除了CAAT-box、TATA-box等核心启动子外,还有一些功能响应元件,包括激素类响应元件、参与干旱胁迫的作用元件、参与昼夜节律调控的元件和创伤响应元件等。葡萄VaEXO11 基因的启动子含有多种顺式作用元件,推测VaEXO11 基因参与葡萄复杂的调控网络,与葡萄生长发育及逆境响应等多种生命活动有密切联系。
植物在遭受低温胁迫时会产生各种生理和分子变化,包括影响某些蛋白质、代谢物和植物激素水平的转录、翻译和代谢变化[20]。Zheng 等[21]和Degenkolbe 等[22]分析山葡萄在低温胁迫下转录组数据,发现有1000 多个转录本的表达量在低温胁迫下上调,同时还发现膜脂质成分的动态变化,而膜的稳定性是低温胁迫条件下细胞生存的必要条件。以前的研究已经注意到EXO 对植物细胞的重要性[2,5]。EXO基因家族的成员已被证明在拟南芥中执行其他功能,拟南芥中的EXO 定位于细胞壁并介导细胞扩张,而exo 突变体的叶片大小、根长和生物量减少,外生叶尺寸减小是由于表皮细胞和薄壁细胞的扩张减少[1]。有研究表明,拟南芥在合成培养基中的低糖供应条件,土壤中的有限光照、延长黑暗期以及缺氧条件下,其正常生长离不开EXL1,该基因促进拟南芥在上述生长条件下对新陈代谢和生长进行全面的适应[23]。然而EXO 基因家族在低温胁迫下的研究还未见报道。
通过对笔者实验室前期研究结果分析,发现在低温条件下,玫瑰香葡萄中有6 个VvEXO 家族成员上调表达,其中VvEXO11 上调最为显著。山葡萄是耐寒性极强的葡萄种类,通过研究VvEXO11 在山葡萄中的同源基因VaEXO11 的表达及功能,以期为揭示葡萄抗寒分子通路、培育新的抗寒葡萄品种提供理论依据。经测序分析,笔者发现了一个有趣的现象,即PCR扩增得到的目的基因的序列长度为957 bp,利用DNAMAN9 进行序列比对,发现该基因与Phytozome 上葡萄基因组中编号为VvEXO11 的基因序列相似度高达99.37%,蛋白相似度达98.75%;但是克隆得到的启动子PVaEXO11长度为1938 bp,与启动子PVvEXO11序列相似度只有65.02%。分析发现,克隆得到的启动子序列靠近起始密码子ATG 的500 bp 启动子序列相似性达93.3%,其余部分差异较大,可能是葡萄种间进化的差异所造成的[24]。通过LUC验证了低温能激活VaEXO11的启动子PVaEXO11的活性,因此推测,低温通过激活VaEXO11 上游启动子的活性来提高VaEXO11的表达量,从而提高葡萄的耐寒性。
4 结 论
笔者初步推测低温能够激活启动子活性从而诱导VaEXO11 的相对表达量迅速上升,直接或间接促进细胞内抗氧化酶的产生,减轻低温对细胞的伤害,提高葡萄抗寒性。研究还发现PVaEXO11含有多种与逆境胁迫相关的元件,说明该基因可能参与多种逆境胁迫的调控。
[1] SCHRÖDER F,LISSO J,LANGE P,MÜSSIG C.The extracellular EXO protein mediates cell expansion in Arabidopsis leaves[J].BMC Plant Biology,2009,9:20.
[2] COLL-GARCIA D,MAZUCH J,ALTMANN T,MÜSSIG C.EXORDIUM regulates brassinosteroid- responsive genes[J].FEBS Letters,2004,563(1/2/3):82-86.
[3] 周浩.钩藤STR 基因及其启动子的克隆与分析[D].贵阳:贵州大学,2022.ZHOU Hao.Cloning and analysis of STR gene and its promoter from U.rhynchophylla[D].Guiyang:Guizhou University,2022.
[4] THALLINGER B,PRASETYO E N,NYANHONGO G S,GUEBITZ G M.Antimicrobial enzymes:An emerging strategy to fight microbes and microbial biofilms[J].Biotechnology Journal,2013,8(1):97-109.
[5] FARRAR K,EVANS IM,TOPPING J F,SOUTER M A,NIELSEN J E,LINDSEY K.EXORDIUM:A gene expressed in proliferating cells and with a role in meristem function,identified by promoter trapping in Arabidopsis[J].The Plant Journal,2003,33(1):61-73.
[6] BORDERIES G,JAMET E,LAFITTE C,ROSSIGNOL M,JAUNEAU A,BOUDART G,MONSARRAT B,ESQUERRÉTUGAYÉ M T,BOUDET A,PONT-LEZICA R.Proteomics of loosely bound cell wall proteins of Arabidopsis thaliana cell suspension cultures:A critical analysis[J].Electrophoresis,2003,24(19/20):3421-3432.
[7] FEIZ L,IRSHAD M,PONT-LEZICA R F,CANUT H,JAMET E.Evaluation of cell wall preparations for proteomics:A new procedure for purifying cell walls from Arabidopsis hypocotyls[J].Plant Methods,2006,2:10.
[8] JAMET E,CANUT H,BOUDART G,PONT-LEZICA R F.Cell wall proteins:A new insight through proteomics[J].Trends in Plant Science,2006,11(1):33-39.
[9] BAYER E M,BOTTRILL A R,WALSHAW J,VIGOUROUX M,NALDRETT M J,THOMAS C L,MAULE A J.Arabidopsis cell wall proteome defined using multidimensional protein identification technology[J].Proteomics,2006,6(1):301-311.
[10] WEIS G,MA X J,PAN L M,MIAO J H,FU J E,BAIL H,ZHANG Z L,GUAN Y H,MO C M,HUANG H,CHEN M S.Transcriptome analysis of Taxillusi chinensis (DC.) danser seeds in response to water loss[J].PLoS One,2017,12(1):e0169177.
[11] SHARMA R,SINGH G,BHATTACHARYA S,SINGH A.Comparative transcriptome meta-analysis of Arabidopsis thaliana under drought and cold stress[J].PLoS One,2018,13(9):e0203266.
[12] WAN Y,SCHWANINGER H,LID,SIMON C,WANG Y J,ZHANG C H.The eco-geographic distribution of wild grape germplasm in China[J].Vitis,2008,47:77-80.
[13] GRAY D J,LIZ T,DHEKNEY S A.Precision breeding of grapevine (Vitis vinifera L.) for improved traits[J].Plant Science,2014,228:3-10.
[14] SHELUDKO Y V,SINDAROVSKA Y R,GERASYMENKO IM,BANNIKOVA M A,KUCHUK N V.Comparison of several Nicotiana species as hosts for high-scale Agrobacterium-mediated transient expression[J].Biotechnology and Bioengineering,2007,96(3):608-614.
[15] 张宇,徐智慧,任邵琦,杨铭慧,陈蒙,刘海峰.山葡萄F3’H 基因及其启动子的克隆与表达分析[J].农业生物技术学报,2021,29(11):2099-2108.ZHANG Yu,XU Zhihui,REN Shaoqi,YANG Minghui,CHEN Meng,LIU Haifeng.Cloning and expression analysis of F3′H gene and promoter from Vitis amurensis[J].Journal of Agricultural Biotechnology,2021,29(11):2099-2108.
[16] SOUSA A O,CAMILLO L R,ASSIS E T C M,LIMA N S,SILVA G O,KIRCH R P,SILVA D C,FERRAZ A,PASQUALIG,COSTA M G C. EgPHI-1,a PHOSPHATE-INDUCED-1 gene from Eucalyptus globulus,is involved in shoot growth,xylem fiber length and secondary cell wall properties[J].Planta,2020,252(3):45.
[17] RUSHTON P J,REINSTÄDLER A,LIPKA V,LIPPOK B,SOMSSICH IE.Synthetic plant promoters containing defined regulatory elements provide novel insights into pathogen- and wound-induced signaling[J].The Plant Cell,2002,14(4):749-762.
[18] 薛竟一,代伟娜,王玲,刘静,张静茹,张朝红.葡萄VvMT2 基因和启动子的克隆及表达分析[J].农业生物技术学报,2018,26(11):1856-1864.XUE Jingyi,DAIWeina,WANG Ling,LIU Jing,ZHANG Jingru,ZHANG Chaohong.Cloning and expression analysis of VvMT2 gene and promoter in grape (Vitis vinifera)[J].Journal of Agricultural Biotechnology,2018,26(11):1856-1864.
[19] SCHRÖDER F,LISSO J,MÜSSIG C.Expression pattern and putative function of EXL1 and homologous genes in Arabidopsis[J].Plant Signaling&Behavior,2012,7(1):22-27.
[20] NAKAMINAMIK,MATSUIA,NAKAGAMIH,MINAMIA,NOMURA Y,TANAKA M,MOROSAWA T,ISHIDA J,TAKAHASHIS,UEMURA M,SHIRASU K,SEKIM.Analysis of differential expression patterns of mRNA and protein during coldacclimation and de-acclimation in Arabidopsis[J].Molecular &Cellular Proteomics,2014,13(12):3602-3611.
[21] ZHENG G W,TIAN B,ZHANG F J,TAO F Q,LIW Q.Plant adaptation to frequent alterations between high and low temperatures:Remodelling of membrane lipids and maintenance of unsaturation levels[J].Plant,Cell & Environment,2011,34(9):1431-1442.
[22] DEGENKOLBE T,GIAVALISCO P,ZUTHER E,SEIWERT B,HINCHA D K,WILLMITZER L.Differential remodeling of the lipidome during cold acclimation in natural accessions of Arabi‐dopsis thaliana[J].The Plant Journal,2012,72(6):972-982.
[23] SCHRÖDER F,LISSO J,MÜSSIG C.EXORDIUM-LIKE1 promotes growth during low carbon availability in Arabidopsis[J].Plant Physiology,2011,156(3):1620-1630.
[24] DONG Y,DUAN S C,XIA Q J,LIANG Z C,DONG X,MARGARYAN K,MUSAYEV M,GORYSLAVETS S,ZDUNIĆ G,BERT P F,LACOMBE T,MAUL E,NICK P,BITSKINASHVI-LIK,BISZTRAY G D,DRORIE,DE LORENZIS G,CUNHA J,POPESCU C F,ARROYO- GARCIA R,ARNOLD C,ERGÜL A,ZHU Y F,MA C,WANG S F,LIU S Q,TANG L,WANG C P,LID W,PAN Y B,LIJ X,YANG L,LIX Z,XIANG G S,YANG Z J,CHEN B Z,DAIZ W,WANG Y,ARAKELYAN A,KULIYEV V,SPOTAR G,GIROLLET N,DELROT S,OLLAT N,THIS P,MARCHAL C,SARAH G,LAUCOU V,BACILIERIR,RÖCKEL F,GUAN P Y,JUNG A,RIEMANN M,UJMAJURIDZE L,ZAKALASHVILIT,MAGHRADZE D,HÖHN M,JAHNKE G,KISS E,DEÁK T,RAHIMIO,HÜBNER S,GRASSIF,MERCATIF,SUNSERIF,EIRAS-DIAS J,DUMITRU A M,CARRASCO D,RODRI-GUEZ-IZQUIERDO A,MUÑOZ G,UYSAL T,ÖZER C,KAZAN K,XU M L,WANG Y Y,ZHU S S,LU J,ZHAO M X,WANG L,JIU S T,ZHANG Y,SUN L,YANG H M,WEISS E,WANG S P,ZHU Y Y,LIS H,SHENG J,CHEN W.Dual domestications and origin of traits in grapevine evolution[J].Science,2023,379(6635):892-901.