石榴(Punica granatum L.)为石榴科(Punicaceae)石榴属(Punica L.)[1]亚热带植物,喜温畏寒,耐贫瘠,适宜在温暖气候条件下生长[2],在低温气候条件下容易发生冻害,冻害原因包括但不仅限于寒潮降温、持续低温、霜冻及“倒春寒”等[3],当温度低于-15 ℃时,石榴易遭受冻害,而-19 ℃是其露地越冬的临界低温[4]。突尼斯软籽石榴早熟、籽粒大、色泽鲜艳、籽粒软,深受消费者欢迎,但是该品种抗寒性弱,幼苗在气温-10 ℃以下易受冻[5]。近几年,中国北方石榴主产区在冬季出现异常低温的情况时有发生,导致石榴种植业损失惨重,中国石榴生产与发展的影响因素之一在于其耐寒性[6],因此如何采取切实有效的措施降低冻害发生,已成为石榴生产急需解决的难题。
国内外学者针对石榴抗寒生理特性进行了大量研究,Soloklui 等[7]认为随着低温胁迫的加剧,石榴的抗寒性与可溶性糖含量之间的相关性显著高于脯氨酸,同时其电导率、丙二醛(MDA)含量以及脯氨酸(Pro)含量均呈上升趋势。唐海霞等[8]从生理、形态和解剖方面结合田间越冬率对3种抗寒差异显著的石榴品种进行越冬期抗寒性研究,结果发现突尼斯软籽抗寒性最差,田间越冬率为0。雷梦瑶等[9]将4个石榴品种枝条在4 ℃~-15 ℃下低温下处理24 h,结合渗透调节物质含量及抗氧化酶活性等指标,运用隶属函数法对石榴枝条抗寒性进行综合评价。罗华等[10]通过模拟低温胁迫环境,测定0 ℃~-20 ℃低温处理下1年生休眠枝条的电导率随温度的变化情况,配合Logistic 方程计算LT50,综合MDA、Pro 含量变化,评价9 个石榴新品种的抗寒性。王庆军等[11]对24个石榴品种进行了抗寒性综合评价,发现突尼斯软籽石榴的半致死温度最高,达到了-7.95 ℃,且抗寒能力最差。
目前,对石榴各品种的抗寒性已进行了较全面的研究,但研究采用的温度梯度过大,进而影响结果精确度,而石榴在低温环境中所能承受的低温胁迫持续时长往往被忽视。针对新疆石榴在生产过程中所遇到的实际问题,笔者在本试验中以休眠期的1年生突尼斯软籽和叶城酸枝条为试验材料,通过观察不同低温胁迫条件下,2 个品种不同时间的枝条生理指标变化,确定不同石榴品种在各种低温条件下的最长耐受时间,以便为其他地区的石榴引种、栽培和推广应用提供参考依据。
1 材料和方法
1.1 试验材料
供试材料为2 年生扦插繁育的突尼斯软籽和叶城酸(对照),均于2022年12月采自石河子大学农学院的试验站温室,选取同一休眠时间、直径1~2 cm、粗度一致、无机械损伤和无病害的1年生枝条,收集完毕后,迅速用湿润的纱布将其包裹并放入塑料袋中,然后迅速带回实验室备用,指标测定的在新疆生产建设兵团特色果蔬栽培生理与种质资源利用兵团重点实验室完成。
1.2 试验设计
将2个品种的枝条分别置于-4、-6、-8、-10、-12 ℃(5个温度梯度)的低温培养箱中,每隔6 h取出一组,每个温度各取8组(6、12、18、24、30、36、42、48 h),每个处理24 根枝条,以在室温条件下受冻时间为0 h的枝条作为对照。解冻8 h 后对样品进行生理生化分析。电导率的测定应立即进行,对其他指标的测定,枝条经标记后用液氮速冻,再置于-80 ℃冰箱内,根据需要进行取用和测量。在枝条测定时,选择枝条的韧皮部,并设置3次重复。
1.3 相关生理指标的测定方法
相对电导率采用电导法测定;超氧化物歧化酶(SOD)活性利用氮蓝四唑(NBT)光化还原的方法进行测定;过氧化物酶(POD)活性采用愈创木酚法测定;过氧化氢酶(CAT)活性采用紫外光吸收法测定;可溶性蛋白含量采用考马斯亮蓝法测定;可溶性糖含量采用蒽酮比色法测定[12]。
1.4 数据处理与分析
使用Microsoft Excel 2010软件进行数据统计和图表绘制。
2 结果与分析
2.1 不同低温处理对石榴枝条相对电导率的影响
植物受冻害后,部分细胞破裂使电解质渗出,可以间接表示受损细胞占比。细胞膜受损程度随温度下降而增大,导致膜透性增加,甚至细胞死亡,而电导率则逐渐趋于稳定[13]。如图1 所示,随温度下降,2 个石榴品种相对电导率均呈逐渐升高趋势,这说明温度下降破坏细胞膜通透性,促进电解质渗透使相对电导率升高。-12 ℃时相对电导率最高70%左右,表明该温度对石榴膜系统破坏最严重,电解质外渗较多。与叶城酸相比,突尼斯软籽相对电导率整体偏高,说明突尼斯软籽遭受了严重的低温损伤,抗寒能力较差。在-4 ℃和-6 ℃低温胁迫下,突尼斯软籽一年生枝条相对电导率36 h 前基本不变,36 h 后明显上升,48 h 到达最高,分别为54.73%、58.26%;-8 ℃处理下30 h 时的电导率最高,为62.48%,36 h 后变化不明显;-10 ℃处理下12 h 之前上升幅度变化较大,24 h 后缓慢上升,48 h到达最高67.65%;-12 ℃处理下12 h 之前相对电导率急剧上升至69.19%后基本不变。叶城酸一年生枝条相对电导率在-4 ℃低温胁迫下基本不变,48 h到达最高49.03%;-6 ℃和-8 ℃处理下42 h 后明显上升,48 h 分别到达最高55.55%、61.84%;-10 ℃处理下18 h前缓慢上升,30 h后急剧升高,36 h达到最高66.54%后基本不变;-12 ℃处理下相对电导率缓慢上升,至30 h 达最高70.54%后基本不变。叶城酸的相对电导率增幅均低于突尼斯软籽。
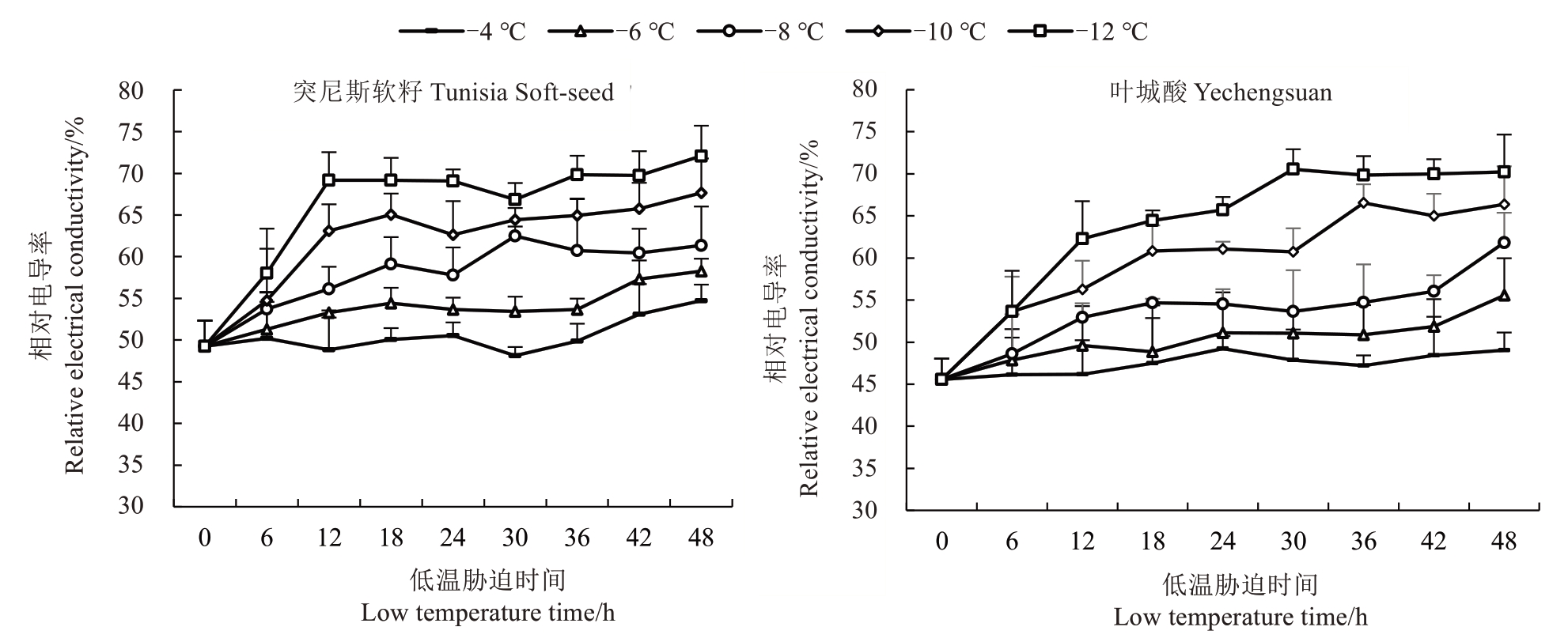
图1 不同低温胁迫下2 个品种石榴枝条相对电导率的变化
Fig.1 Changes of relative electrical conductivity of branches of two varieties of pomegranate under different low temperature stress
由此可见,突尼斯软籽在-4 ℃下能忍受48 h以上的低温胁迫,-6 ℃下能忍受36 h 的低温胁迫,-8 ℃下能忍受30 h,-10 ℃下能忍受18 h,-12 ℃下忍受12 h。叶城酸在-4 ℃和-6 ℃下能忍受48 h以上的低温胁迫,-8 ℃下忍受42 h,-10 ℃下忍受36 h,-12 ℃下忍受30 h。
2.2 不同低温处理对石榴枝条SOD 活性变化的影响
作为细胞内主要的抗氧化酶,SOD 在叶绿体、线粒体和细胞质中广泛分布,成为植物抗氧化系统的首要屏障。SOD 能消除细胞内多余的超氧根阴离子(O2-),促进O2-歧化生成H2O2和O2,通过降低细胞膜脂质的过氧化水平,有效地保护细胞膜不受自由基伤害,保持植物活性氧代谢的稳定[14]。如图2所示,2 个石榴品种在低温胁迫下,SOD 活性随温度的下降而上升。-4 ℃低温胁迫下突尼斯软籽枝条SOD活性变化不明显,42 h时到达最高138.90 U·g-1;在-6、-8、-10 和-12 ℃处理下,分别在36、30、18 和12 h 出现SOD 活性最高峰值,分别为178.32、209.76、222.87、269.05 U·g-1;这表明,低温已经启动了石榴体内的冻害防御机制,促使植株开始主动积累大量的SOD,以消除低温产生的自由基和活性氧。随后,SOD 活性不可逆转地下降,可能由于低温打破石榴冻害防御机制而使植物清除自由基能力降低,动态平衡失调而呈现危害,并最终打破机体代谢平衡[15]。而叶城酸枝条在-4、-6、-8、-10 和-12 ℃处理下,分别在48、42、42、36 和30 h 出现SOD 活性最高峰值,分别为174.19、193.99、228.67、234.68、281.53 U·g-1。SOD 活性能反映植物对冷逆境反应的强度,在相同低温逆境条件下,突尼斯软籽SOD活性始终低于叶城酸,表明叶城酸的抗寒性更强。

图2 不同低温胁迫下2 个石榴品种枝条SOD 活性变化
Fig.2 Changes of SOD activity in branches of two varieties of pomegranate under different low temperature stress
2.3 不同低温处理对石榴枝条POD 活性变化的影响
POD 是广泛存在于植物体内的氧化还原酶,其作用在于维持细胞结构的完整性,增强细胞的抗衰老能力和对抗不良环境的影响[16]。如图3 所示,2 个石榴品种枝条中POD 活性的变化趋势大致相同,都遵循“单峰”的变化曲线,即先升高后下降。突尼斯软籽枝条在-4、-6、-8、-10 和-12 ℃处理下,分别在42、36、30、18 和12 h 出现POD 活性最高峰值,分别较对照提高46.96%、106.87%、129.22%、134.00%、157.91%,然后下降,这与SOD 活性变化相同,表明持续低温可引起植物体内超氧自由基和其他活性氧含量升高,石榴枝条POD活性在低温持续一定时间后不可逆转地下降,石榴枝条表皮皱缩失水,表明受到冷害[17]。叶城酸枝条在-4、-6 及-8 ℃处理下,均在42 h 出现POD 活性最高峰值,分别较对照提高80.34%、97.13%、158.80%;在-10、-12 ℃处理下分别在36、30 h 出现POD 活性最高峰,分别较对照提高175.35%、183.35%。叶城酸POD 活性总体高于突尼斯软籽,在相同低温胁迫下,POD 活性峰值出现相对更晚,这说明叶城酸的抗寒性强于突尼斯软籽。
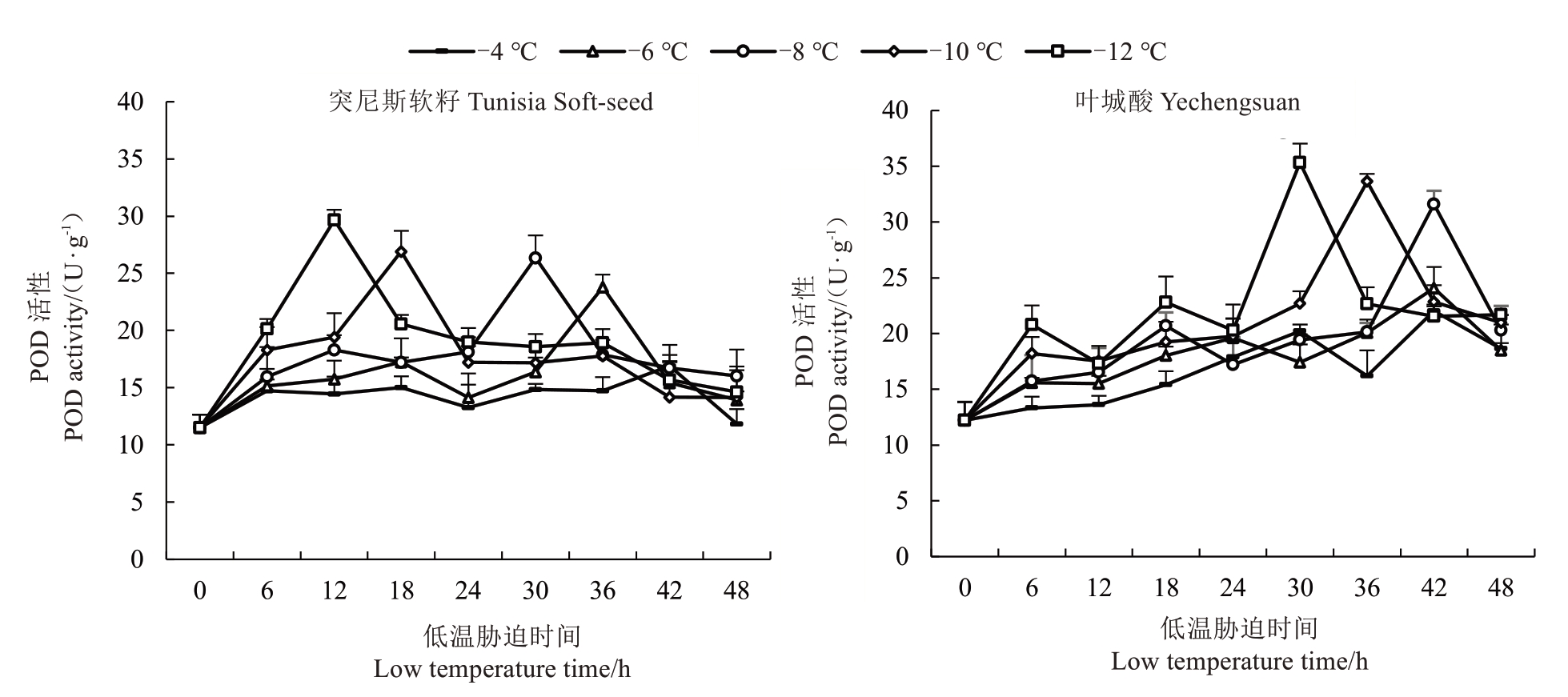
图3 不同低温胁迫下2 个品种石榴枝条POD 活性变化
Fig.3 Changes of POD activity in two varieties of pomegranate branches under different low temperature stress
2.4 不同低温处理对石榴枝条CAT 活性变化的影响
作为一种专门去除H2O2的保护酶,CAT 活性与植物的抗逆性息息相关,当H2O2积累时会引发破坏性氧化反应,而CAT与SOD 的协同作用则可有效去除植物体内的H2O2含量避免其对植物细胞膜系统造成破坏[18]。如图4 所示,不同低温胁迫下突尼斯软籽枝条CAT 活性的变化趋势一致,都是“单峰”曲线变化,呈先升高后降低的趋势,与SOD 及POD 活性变化相似,-4和-6 ℃处理下CAT活性最高值均出现在42 h,较对照分别提高183.50%、202.94%。-8、-10、-12 ℃处理下CAT 活性最高峰值分别出现在30、18 和12 h,温度越低越先出现峰值,分别较对照提高263.50%、286.71%、290.42%,随后CAT 活性明显降低,说明枝条已经受到严重冻害。在-8、-10和-12 ℃的低温胁迫下,叶城酸枝条CAT 活性变化呈“单峰”曲线变化,CAT 活性最高峰值分别出现在42、36 和30 h,分别较对照提高330.86%、347.00%、397.03%,在-4 ℃和-6 ℃低温胁迫下,42 h 前CAT活性缓慢上升,42 h 后急剧上升,48 h 达到最大值,且分别较对照提高187.78%和317.96%。叶城酸CAT 活性整体高于突尼斯软籽,且在相同低温胁迫下,CAT 活性峰值出现较晚,说明叶城酸的抗寒性强于突尼斯软籽。
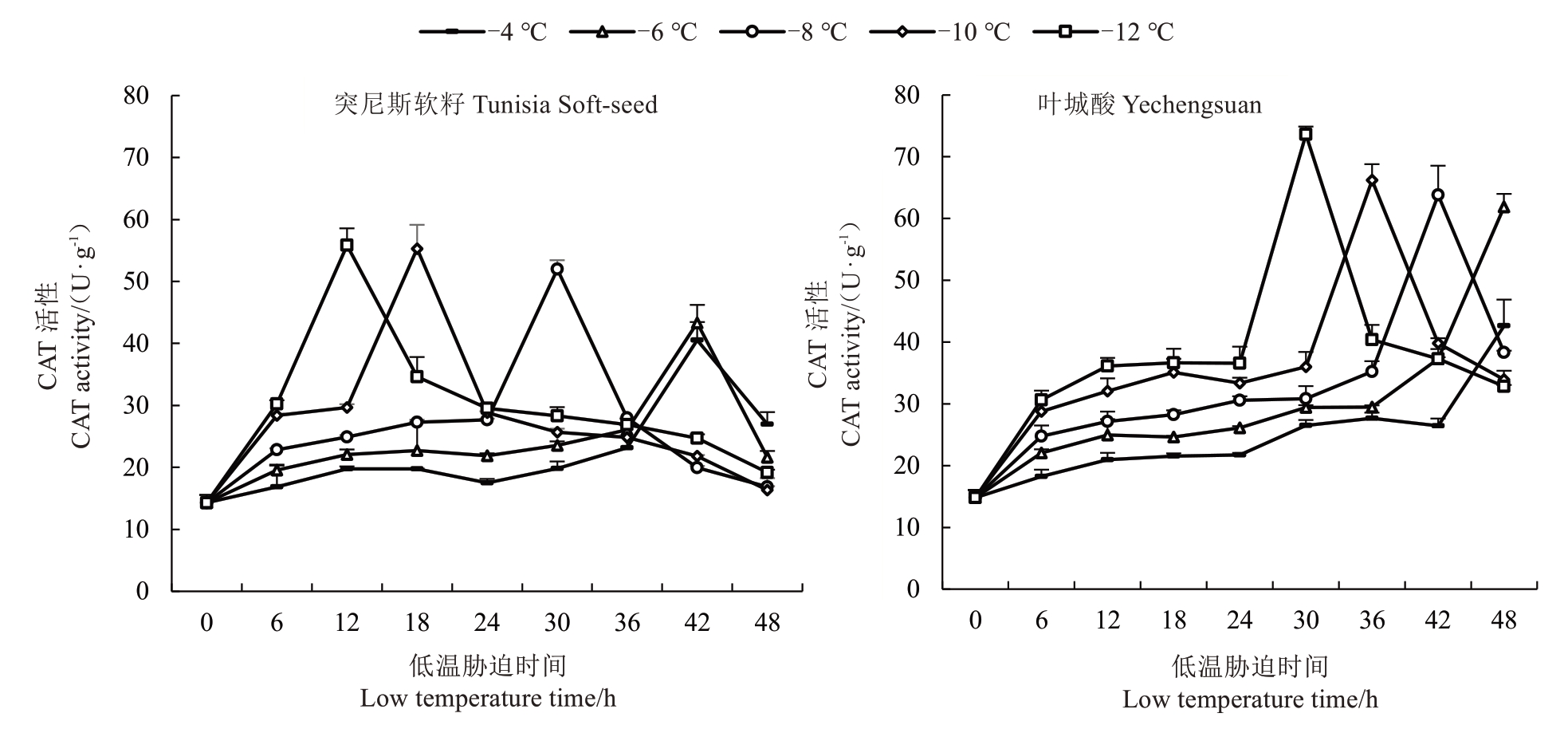
图4 不同低温胁迫下2 个品种石榴枝条CAT 活性变化
Fig.4 Changes of CAT activity in branches of two varieties of pomegranate under different low temperature stress
2.5 不同低温处理对石榴枝条可溶性蛋白含量变化的影响
植物的抗寒性与其可溶性蛋白含量密切相关,在低温条件下,通过激活相关蛋白质的合成,提高胞内束缚水含量,降低冰点、避免细胞冻结造成细胞脱水死亡[19]。如图5 所示,随着胁迫温度的降低,突尼斯软籽和叶城酸枝条可溶性蛋白含量均表现上升的趋势,但在相同低温处理下,随着处理时间的延长,其可溶性蛋白质含量逐渐降低。突尼斯软籽枝条在-4、-6、-8、-10、-12 ℃处理下,可溶性蛋白含量分别在42、36、30、36、42 h 有最大值,分别为45.73、47.51、49.92、52.29、53.74 mg·g-1,与对照相比分别升高了22.08%、26.83%、33.26%、39.59%、43.46%,可见,在低温条件下,石榴中可溶性蛋白的快速合成对植物具有一定的保护作用,后又缓慢降低,说明此时部分细胞结构及生理功能可能损坏,蛋白质合成系统受损,蛋白质合成受阻[20]。叶城酸枝条在-4、-6、-8、-10、-12 ℃低温处理下,可溶性蛋白含量分别在48、48、42、48、36 h 有最大值,分别为40.79、44.06、47.22、48.15、48.81 mg·g-1,与对照相比分别升高了13.46%、22.56%、31.35%、33.94%、35.77%。叶城酸可溶性蛋白含量总体及增幅均低于突尼斯软籽。
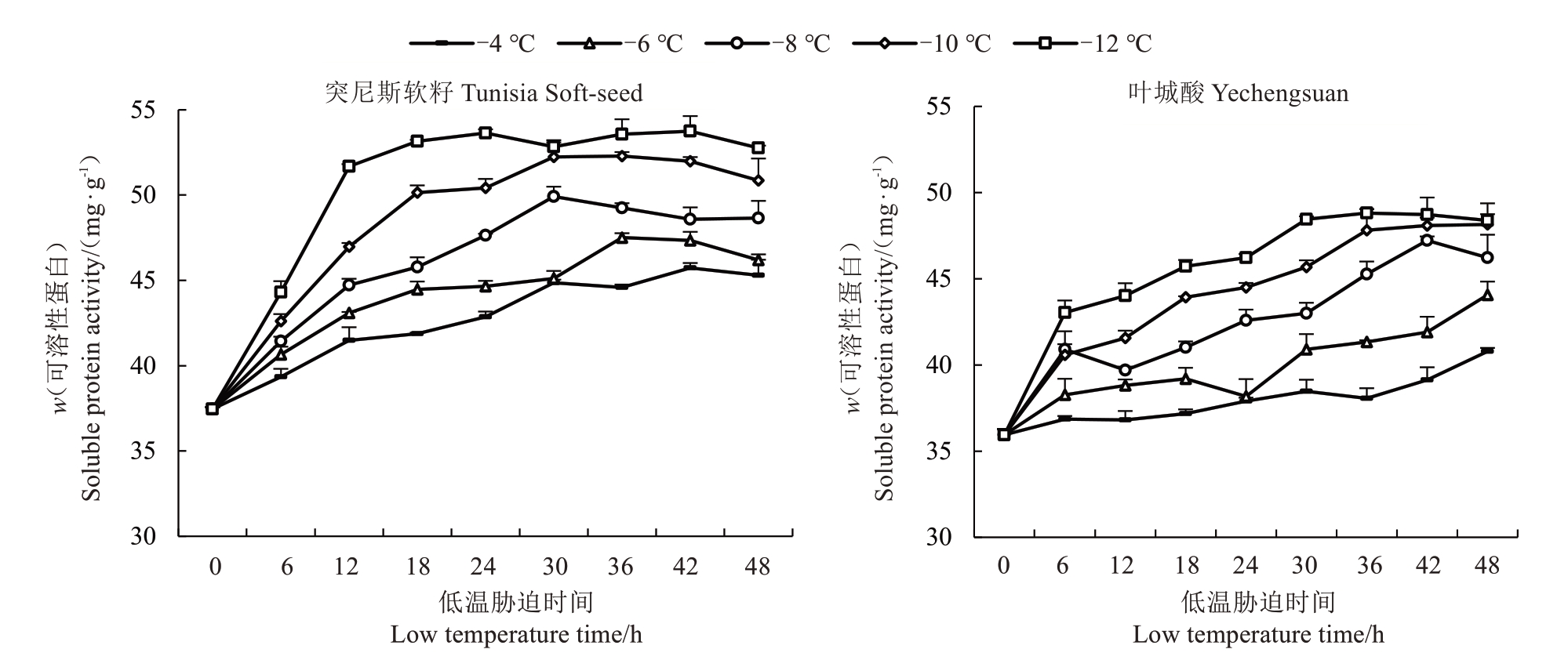
图5 不同低温胁迫下2 个品种石榴枝条可溶性蛋白含量变化
Fig.5 Changes of soluble protein content in branches of 2 varieties of pomegranate under different low temperature stress
2.6 不同低温处理对石榴枝条可溶性糖含量变化的影响
在植物抵抗寒冷的生理过程中,可溶性糖能够提高细胞的渗透浓度,降低水势并增强保水功能,从而使冰点降低。此外,可溶性糖还能保护细胞内的原生质体、线粒体和细胞膜上的敏感性耦联因子[21]。如图6 所示,突尼斯软籽和叶城酸枝条可溶性糖含量均随胁迫温度降低和时间延长而升高,在-4 ℃、-6 ℃、-8 ℃、-10 ℃、-12 ℃处理下,突尼斯软籽可溶性糖含量均在48 h有最大值,分别为5.88%、7.13%、7.10%、7.90%、9.01%,较对照分别显著升高了78.72%、116.71%、115.81%、140.12%、174.77%,叶城酸可溶性糖含量分别在42、48、48、42、48 h 有最大值,分别为5.05%、6.01%、6.57%、6.47%、7.17%,较对照分别显著升高了69.46%、101.68%、120.47%、117.11%、140.60%。结果表明,突尼斯软籽可溶性糖含量增长幅度大于叶城酸,在低温胁迫下,总体可溶性糖含量高于叶城酸。
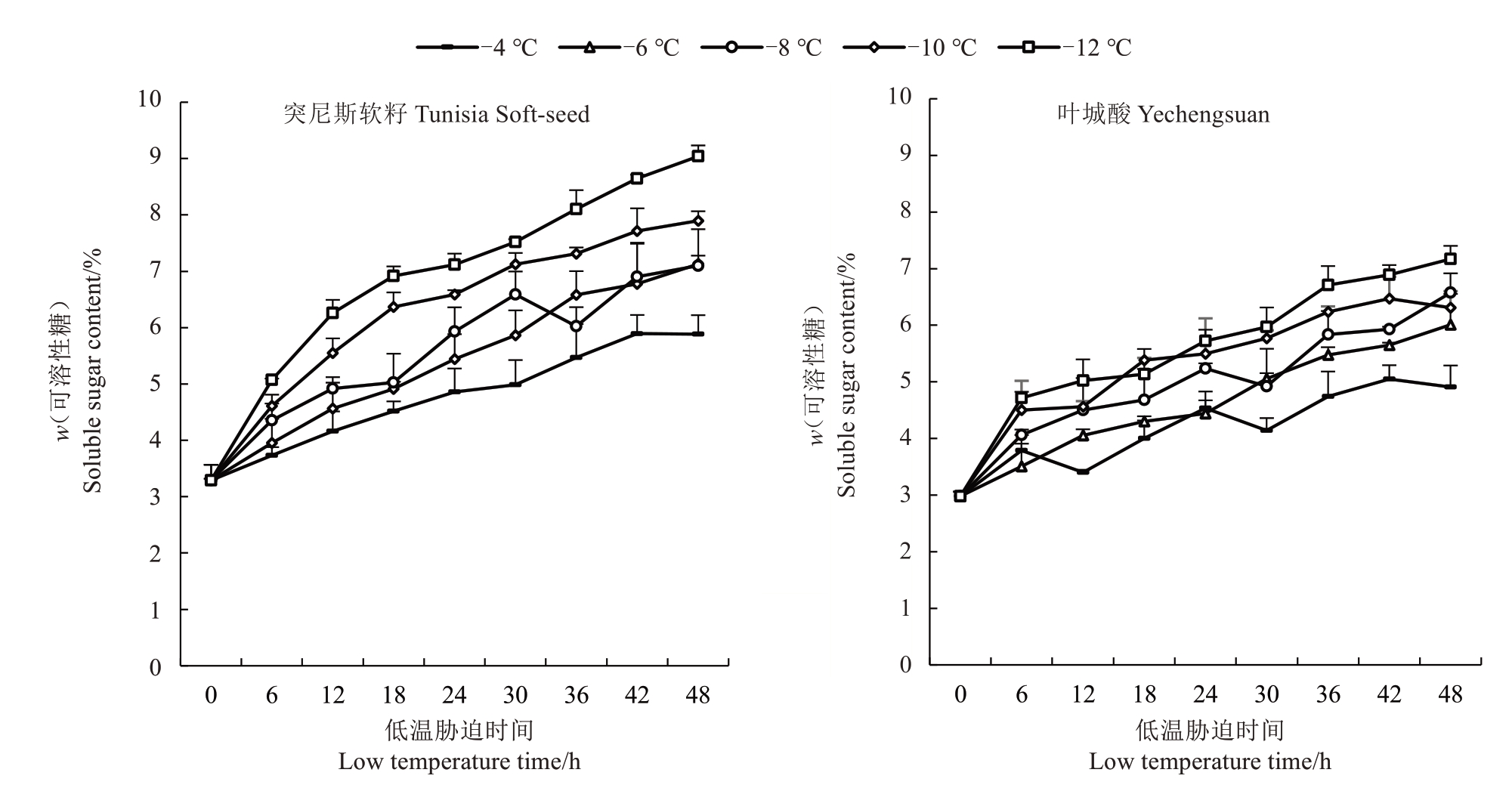
图6 不同低温胁迫下2 个品种石榴枝条可溶性糖含量变化
Fig.6 Changes of soluble sugar content in branches of two varieties of pomegranate under different low temperature stress
3 讨 论
3.1 相对电导率与抗寒性
植物受到低温胁迫时,细胞膜透性增加,溶液在细胞内不断向外渗透,从而引起细胞导电性的变化[22]。基于细胞外渗液导电性的差异确定膜透性,进而推测膜损伤程度及抗寒强度,是植物抗寒性检测最经典的实验方法,所以相对电导率可以作为植物抗寒性评价的一个可靠指标[23]。低温对植株的损伤程度可以通过电导率大小来反映,抗寒能力强的植株损害较小,且其相对电导率的改变较慢,并且可以恢复到正常水平。相反,抗寒能力弱的植株受害更严重,其相对导电性改变也更快,更难恢复[24]。突尼斯软籽与叶城酸在低温下,随低温胁迫程度的加剧以及低温持续时间的延长,相对电导率变化趋势一致,且两者都有升高的趋势,突尼斯软籽电导率变化幅度较大,表明其细胞膜的损伤程度较严重,抗寒能力较弱。这与王庆军等[11]研究结果一致,24 种石榴在低温胁迫下的相对电导率与对照温度处理相比均有所上升,但上升幅度不同,其中相对电导率最高的突尼斯软籽抗寒性最差。
3.2 保护酶与抗寒性
植物受低温胁迫后会释放出大量的活性氧自由基。植物在抵御低温胁迫时,会启动活性氧清除机制,阻止脂质过氧化作用,提高细胞膜的稳定性,缓解甚至消除低温对植株的危害[25]。超氧化物歧化酶(SOD)是植物体内最重要的一道防御屏障,可催化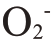 歧化为H2O2。为了适应低温环境,植物的代谢系统需要提高SOD 活性,以增强其抗寒能力;当植物的耐寒能力达到极限时,其保护酶合成系统将被破坏,从而导致SOD 活性的降低。POD 和CAT 均能有效地去除H2O2生成的水分,3 种酶的协同作用将自由基含量控制在较低水平,降低了对植株的毒性[26]。笔者在本研究中的结果表明,突尼斯软籽和叶城酸SOD、POD、CAT 活性在不同温度低温胁迫和时间胁迫处理下均表现为先上升后下降,这表明在一定程度上,石榴可通过增强其保护性酶的活性来抵抗低温胁迫,但当超出此阈值时,防卫机制将被打破,从而降低保护性酶的活性。这和关思慧等[27]对石榴低温处理后抗氧化酶活性变化趋势的研究结果一致。在适当低温范围内,植物可通过增强抗氧化酶活性来维持细胞稳态,然而持续低温则会导致抗氧化酶活性降低,石榴细胞的自由基生产和代谢平衡被破坏。叶城酸SOD、POD和CAT活性增幅较大,说明在低温环境中表现出极强的细胞抗氧化能力,与突尼斯软籽相比,叶城酸抗寒性更好,这与徐功勋等[28]的研究结果相一致,抗寒性越强的品种抗氧化酶活性越高,响应低温的速度越快。Wang等[29]在石榴耐冻性研究中也发现,石榴可通过激活抗氧化酶活性的方式使植株获得更强的抗寒性。
歧化为H2O2。为了适应低温环境,植物的代谢系统需要提高SOD 活性,以增强其抗寒能力;当植物的耐寒能力达到极限时,其保护酶合成系统将被破坏,从而导致SOD 活性的降低。POD 和CAT 均能有效地去除H2O2生成的水分,3 种酶的协同作用将自由基含量控制在较低水平,降低了对植株的毒性[26]。笔者在本研究中的结果表明,突尼斯软籽和叶城酸SOD、POD、CAT 活性在不同温度低温胁迫和时间胁迫处理下均表现为先上升后下降,这表明在一定程度上,石榴可通过增强其保护性酶的活性来抵抗低温胁迫,但当超出此阈值时,防卫机制将被打破,从而降低保护性酶的活性。这和关思慧等[27]对石榴低温处理后抗氧化酶活性变化趋势的研究结果一致。在适当低温范围内,植物可通过增强抗氧化酶活性来维持细胞稳态,然而持续低温则会导致抗氧化酶活性降低,石榴细胞的自由基生产和代谢平衡被破坏。叶城酸SOD、POD和CAT活性增幅较大,说明在低温环境中表现出极强的细胞抗氧化能力,与突尼斯软籽相比,叶城酸抗寒性更好,这与徐功勋等[28]的研究结果相一致,抗寒性越强的品种抗氧化酶活性越高,响应低温的速度越快。Wang等[29]在石榴耐冻性研究中也发现,石榴可通过激活抗氧化酶活性的方式使植株获得更强的抗寒性。
3.3 渗透调节物质与抗寒性
可溶性糖是植物的一种渗透调节物质,与植物的抗寒能力有着紧密的联系。在抗寒生理过程中,植物积累的可溶性糖能够增加细胞内的液体浓度,降低冰点,从而维持细胞内的渗透压平衡,同时也有助于维持细胞膜的正常功能。可溶性糖对线粒体及细胞膜上的偶联因子具有保护作用,是一种很好的保护剂。此外,可溶性糖还是一种有效的抗冻剂。低温锻炼后植物体内可溶性糖含量高于未经低温锻炼的植物[30]。Soloklui 等[31]研究结果表明,可溶性糖是研究石榴耐寒性最好的指标。笔者在本研究中发现,突尼斯软籽和叶城酸可溶性糖含量随着温度降低和胁迫时间延长而增加,在低温胁迫条件下,可溶性糖积累使细胞内的液体含量升高,从而增强了持水性能和对低温的耐受力。叶城酸可溶性糖含量增幅小于突尼斯软籽,低温胁迫下枝条细胞组织可溶性糖含量小幅度增加可减轻膜内细胞的低温损伤,这与刘贝贝等[32]的研究结果一致。
植物的抗寒性与可溶性蛋白质之间存在着密切的联系。一方面,随着气温的降低,植株的可溶性蛋白质含量也随之升高;另一方面,随着抗寒性的增强,植株中可溶性蛋白含量也随之增加[33]。可溶性蛋白质具有维持低渗透压、抑制离子吸收、保护细胞结构等功能。研究发现,随低温胁迫时间的延长,突尼斯软籽和叶城酸可溶性蛋白含量呈先升高后降低的变化趋势。低温胁迫后期因蛋白质合成系统遭到破坏而使可溶性蛋白含量降低,从而阻碍了蛋白质的正常合成,这与杨雪梅等[34]的研究结果一致。
通过耐寒机制的探究对引种和栽培新品种都具有十分重要的科学和实践意义,但其中涉及的调控机制有待进一步研究。今后笔者课题组将结合抗寒基因的鉴定、转录调控等方面对本研究中得到的结论进一步验证,为新疆地区石榴栽培和应用提供有效的数据支撑和理论参考。
4 结 论
突尼斯软籽在-4 ℃下能忍受48 h 以上的低温胁迫,-6 ℃下能忍受36 h 的低温胁迫,-8 ℃下能忍受30 h,-10 ℃下能忍受18 h,-12 ℃下能忍受12 h。而叶城酸在-4 ℃和-6 ℃下能忍受48 h 以上的低温胁迫,-8 ℃下能忍受42 h的低温胁迫,-10 ℃下忍受36 h,-12 ℃下忍受30 h。因此,突尼斯软籽抗寒性弱于叶城酸,抗寒机制主要与枝条的抗氧化和渗透调节能力有关。
[1] 刘威,刘博,蔡卫佳,王昊,陈芬,谭军.国内软籽石榴栽培品种及研究进展[J].北方农业学报,2020,48(4):75-82.LIU Wei,LIU Bo,CAI Weijia,WANG Hao,CHEN Fen,TAN Jun. Research progress of cultivars of soft-seed pomegranate in domestic[J]. Journal of Northern Agriculture,2020,48(4):75-82.
[2] 罗华,郝兆祥,侯乐峰,王庆军,马敏.国内外软籽石榴研究进展[J].山东农业科学,2017,49(4):157-163.LUO Hua,HAO Zhaoxiang,HOU Lefeng,WANG Qingjun,MA Min. Research progress of soft-seed pomegranate in domestic and foreign[J]. Shandong Agricultural Sciences,2017,49(4):157-163.
[3] 侯乐峰,郭祁,郝兆祥,罗华.我国软籽石榴生产历史、现状及其展望[J].北方园艺,2017(20):196-199.HOU Lefeng,GUO Qi,HAO Zhaoxiang,LUO Hua. History,present situation and prospects of soft-seed pomegranate in China[J].Northern Horticulture,2017(20):196-199.
[4] 焦其庆,冯立娟,尹燕雷,崔洪涛.石榴冻害及抗寒评价研究进展[J].植物生理学报,2019,55(4):425-432.JIAO Qiqing,FENG Lijuan,YIN Yanlei,CUI Hongtao. Research progress on evaluation of freezing injury and cold resistance of pomegranate[J]. Plant Physiology Journal,2019,55(4):425-432.
[5] 李全景,安广池,段宝敏,崔云鹏,王倩,胡园春.秋末石榴冻害气象预测预警模型的构建[J]. 山东林业科技,2023,53(2):34-38.LI Quanjing,AN Guangchi,DUAN Baomin,CUI Yunpeng,WANG Qian,HU Yuanchun. Construction of meteorological forecast and early warning model for pomegranate freezing injury in late autumn[J]. Journal of Shandong Forestry Science and Technology,2023,53(2):34-38.
[6] 邹红婷.软籽石榴栽培技术[J].云南农业,2020(11):58-60.ZOU Hongting. Cultivation technology of soft-seeded pomegranate[J].Yunnan Agriculture,2020(11):58-60.
[7]SOLOKLUI A A G,GHARAGHANI A,ORAGUZIE N,SAEDMOUCHESHI A. Heritability and combinig ability for cold hardiness from partial dialleles in iranian pomegranate cultivars[J].HortScience,2018,53(4):427-431.
[8] 唐海霞,杨雪梅,冯立娟,朱峰,周继磊,尹燕雷.3 个石榴品种越冬抗寒性及生理差异分析[J].园艺学报,2023,50(7):1563-1573.TANG Haixia,YANG Xuemei,FENG Lijuan,ZHU Feng,ZHOU Jilei,YIN Yanlei. Analysis of freezing tolerances and physiological differences of three pomegranate cultivars during the overwintering[J]. Acta Horticulturae Sinica,2023,50(7):1563-1573.
[9] 雷梦瑶,高小峰,白清敏,邓珂,左卫芳,李玉英.不同品种石榴枝条的抗寒性评价[J].河南农业科学,2023,52(6):120-130.LEI Mengyao,GAO Xiaofeng,BAI Qingmin,DENG Ke,ZUO Weifang,LI Yuying. Evaluation of cold resistance of pomegranate branches from different varieties[J]. Journal of Henan Agricultural Sciences,2023,52(6):120-130.
[10] 罗华,郝兆祥,陈颖,孟健,王庆军,赵丽娜,侯乐峰.石榴新品种(种质)抗寒性评价[J].中国果树,2018(1):51-54.LUO Hua,HAO Zhaoxiang,CHEN Ying,MENG Jian,WANG Qingjun,ZHAO Li’na,HOU Lefeng. Evaluation of cold resistance of new pomegranate varieties (germplasm) [J]. China Fruits,2018(1):51-54.
[11] 王庆军,罗华,赵丽娜,陈颖,王艳芹,王玉海,郝兆祥.24 个石榴品种的抗寒性评价[J].山东农业科学,2018,50(1):50-54.WANG Qingjun,LUO Hua,ZHAO Li’na,CHEN Ying,WANG Yanqin,WANG Yuhai,HAO Zhaoxiang. Evaluation on cold resistance of 24 pomegranate cultivars[J]. Shandong Agricultural Sciences,2018,50(1):50-54.
[12] 邹琦. 植物生理生化实验指导[M]. 北京:中国农业出版社,1995.ZOU Qi. Principles and techniques of plant physiology and biochemistry experiments[M]. Beijing:China Agriculture Press,1995.
[13] 曹燕燕,葛昌斌,齐双丽,廖平安,黄杰,王君,李雷雷,乔冀良,张振永.不同冬小麦品种(系)拔节期低温胁迫生理反应及抗寒性评价[J].江苏农业科学,2022,50(17):59-66.CAO Yanyan,GE Changbin,QI Shuangli,LIAO Ping’an,HUANG Jie,WANG Jun,LI Leilei,QIAO Jiliang,ZHANG Zhenyong. Physiological response to low temperature stress and evaluation of cold resistance of different winter wheat varieties(lines) at jointing stage[J]. Jiangsu Agricultural Sciences,2022,50(17):59-66.
[14] 黄祥,楚光明,徐迎春,王雪莲,杨梅花.2 种睡莲不同部位对低温胁迫的生理响应及抗寒性评价[J].江苏农业科学,2022,50(9):128-134.HUANG Xiang,CHU Guangming,XU Yingchun,WANG Xuelian,YANG Meihua. Physiological response and cold resistance evaluation of different parts of two water lilies under low-temperature stress[J]. Jiangsu Agricultural Sciences,2022,50(9):128-134.
[15] 孙艳,李敏敏,韩斌,尹勇刚,赵胜建,郭紫娟.六个葡萄品种根系抗寒性鉴定及综合评价[J].北方园艺,2021(17):30-37.SUN Yan,LI Minmin,HAN Bin,YIN Yonggang,ZHAO Shengjian,GUO Zijuan.Identification and comprehensive evaluation on root cold resistance of six grape varieties[J]. Northern Horticulture,2021(17):30-37.
[16] 黄一波,汪结明,李瑞雪,向言词,宋禹,颜玲玉.7 种木莲属植物抗寒性评价及其生理机制[J].热带亚热带植物学报,2021,29(5):519-529.HUANG Yibo,WANG Jieming,LI Ruixue,XIANG Yanci,SONG Yu,YAN Lingyu.Evaluation of cold resistance and physiological mechanism of seven Manglietia species[J]. Journal of Tropical and Subtropical Botany,2021,29(5):519-529.
[17] 井俊丽,刘铭潇,高美娜,徐继忠,张学英,周莎莎.不同苹果中间砧枝条在越冬期间的生理特性变化及抗寒性比较[J].河北农业大学学报,2022,45(4):25-31.JING Junli,LIU Mingxiao,GAO Meina,XU Jizhong,ZHANG Xueying,ZHOU Shasha.Comparison of physiological characteristics and cold resistance of branches of different apple interstocks during overwintering[J]. Journal of Hebei Agricultural University,2022,45(4):25-31.
[18] 位杰,张琦,林彩霞,蒋媛.不同梨品种(系)叶片解剖结构及其与抗寒性的关系[J].河南农业科学,2021,50(8):103-112.WEI Jie,ZHANG Qi,LIN Caixia,JIANG Yuan.Relationship between cold tolerance and leaf structure of different pear varieties(strains)[J]. Journal of Henan Agricultural Sciences,2021,50(8):103-112.
[19] 贾金辉,徐凌,刘慧纯,蔡智军,田晓玲,张海涛.8 个酿酒葡萄品种的抗寒性比较[J].中国果树,2021(7):39-44.JIA Jinhui,XU Ling,LIU Huichun,CAI Zhijun,TIAN Xiaoling,ZHANG Haitao. Comparison of cold resistance of eight wine grape varieties[J].China Fruits,2021(7):39-44.
[20] 舒启琼,罗小波,李飞,罗充.马铃薯抗寒研究进展[J].植物生理学报,2021,57(6):1171-1178.SHU Qiqiong,LUO Xiaobo,LI Fei,LUO Chong. Research progress on cold resistance of potato[J]. Plant Physiology Journal,2021,57(6):1171-1178.
[21] 韦霞霞,李玉梅,李彦彪,郭艳兰,贾进,马宗桓,毛娟,陈佰鸿. 葡萄抗寒性与韧皮部糖分及内源激素积累的相关性[J].西北农业学报,2021,30(3):386-394.WEI Xiaxia,LI Yumei,LI Yanbiao,GUO Yanlan,JIA Jin,MA Zonghuan,MAO Juan,CHEN Baihong. Correlation on grape cold tolerance,ddissoluble sugar and accumulation of endogenous hormones in phloem[J].Acta Agriculturae Boreali-occidentalis Sinica,2021,30(3):386-394.
[22] 陈登文,王飞,高爱琴,李嘉瑞.休眠期间低温累积对杏枝芽生理生化的影响[J].西北植物学报,2000,20(2):212-217.CHEN Dengwen,WANG Fei,GAO Aiqin,LI Jiarui. Effect of chilling accumuation on physio-biochemical of shoots and buds of apricot during dormant stage[J].Acta Botanica Boreali-Occidentalia Sinica,2000,20(2):212-217.
[23] 段景秀,侯禄晓,暴会会,汪雪梅,郑昊吉,祝光涛,郭磊.低温胁迫对马铃薯幼苗抗寒相关生理指标的影响[J].云南师范大学学报(自然科学版),2022,42(5):20-26.DUAN Jingxiu,HOU Luxiao,BAO Huihui,WANG Xuemei,ZHENG Haoji,ZHU Guangtao,GUO Lei. Effects of low temperature stress on physiological indexes related to cold resistance of potato seedlings[J].Journal of Yunnan Normal University(Natural Sciences Edition),2022,42(5):20-26.
[24] 安常蓉,韦小丽,叶嘉俊,王明丹,田肖箫.低温胁迫对闽楠幼苗形态及生理特性的影响[J].西部林业科学,2018,47(3):96-101.AN Changrong,WEI Xiaoli,YE Jiajun,WANG Mingdan,TIAN Xiaoxiao. Effect of low temperature on morphology and physiology characteristics of Phoebe bournei seedlings[J]. Journal of West China Forestry Science,2018,47(3):96-101.
[25] 章希娟,许玲,魏秀清,陈志峰,余东,许家辉.不同防寒措施对莲雾抗寒性的影响[J].中国南方果树,2019,48(5):24-27.ZHANG Xijuan,XU Ling,WEI Xiuqing,CHEN Zhifeng,YU Dong,XU Jiahui. Effects of different winter protection measures on cold resistance of wax apple[J]. South China Fruits,2019,48(5):24-27.
[26] 梁锁兴,孟庆仙,石美娟,罗钢铁,王贵珠.平欧榛枝条可溶性蛋白及可溶性糖含量与抗寒性关系的研究[J].中国农学通报,2015,31(13):14-18.LIANG Suoxing,MENG Qingxian,SHI Meijuan,LUO Gangtie,WANG Guizhu. Research on relationship between cold-resistance and soluble protein and sugar of Corylus heterophylla ×Corylus avellana branches[J].Chinese Agricultural Science Bulletin,2015,31(13):14-18.
[27] 关思慧,柴亚倩,杨元玲,刘慧英,郝庆,刁明.低温胁迫对石榴光合特性和抗氧化能力的影响[J]. 中国农学通报,2024,40(3):66-75.GUAN Sihui,CHAI Yaqian,YANG Yuanling,LIU Huiying,HAO Qing,DIAO Ming. Effects of low temperature stress on photosynthetic characteristics and antioxidant capacity of pomegranate[J]. Chinese Agricultural Science Bulletin,2024,40(3):66-75.
[28] 徐功勋,周佳,吕德国,秦嗣军.4 个苹果品种的抗寒性评价[J].果树学报,2023,40(4):669-679.XU Gongxun,ZHOU Jia,LÜ Deguo,QIN Sijun. Cold resistance evaluation of four apple varieties[J]. Journal of Fruit Science,2023,40(4):669-679.
[29] WANG L,WANG S,TONG R R,WANG S,YAO J N,JIAO J,WAN R,WANG M M,SHI J L,ZHENG X B. Overexpression of PgCBF3 and PgCBF7 transcription factors from pomegranate enhances freezing tolerance in Arabidopsis under the promoter activity positively regulated by PgICE1[J]. International Journal of Molecular Sciences,2022,23(16):9439.
[30] 张基德,李玉梅,陈艳秋,李莉.梨品种枝条可溶性糖、脯氨酸含量变化规律与抗寒性的关系[J].延边大学农学学报,2004,26(4):281-285.ZHANG Jide,LI Yumei,CHEN Yanqiu,LI Li. Relationship between the soluble sugar content,proline content and the hardiness of pear cultivars[J].Journal of Agricultural Science Yanbian University,2004,26(4):281-285.
[31] SOLOKLUI A A G,ERSHADI A,FALLAHI E. Evaluation of cold hardiness in seven Iranian commercial pomegranate (Punica granatum L.) cultivars[J]. HortScience,2012,47(12):1821-1825.
[32] 刘贝贝,陈利娜,牛娟,李好先,张杰,曹尚银.6 个石榴品种抗寒性评价及方法筛选[J].果树学报,2018,35(1):66-73.LIU Beibei,CHEN Li’na,NIU Juan,LI Haoxian,ZHANG Jie,CAO Shangyin. Selection of methods for evaluation on cold tolerance of six pomegranate varieties[J]. Journal of Fruit Science,2018,35(1):66-73.
[33] 刘兴禄,王红平,孙文泰,董铁,牛军强,马明.5 个砧木苹果枝条的抗寒性评价[J].果树学报,2021,38(8):1264-1274.LIU Xinglu,WANG Hongping,SUN Wentai,DONG Tie,NIU Junqiang,MA Ming. Cold resistance evaluation of the shoots of 5 apple rootstocks[J]. Journal of Fruit Science,2021,38(8):1264-1274.
[34] 杨雪梅,苑兆和,尹燕雷,冯立娟,招雪晴.不同石榴品种抗寒性综合评价[J].山东农业科学,2014,46(2):46-51.YANG Xuemei,YUAN Zhaohe,YIN Yanlei,FENG Lijuan,ZHAO Xueqing. Comprehensive evaluation on cold resistance of different pomegranate cultivars[J].Shandong Agricultural Sciences,2014,46(2):46-51.