随着核桃产业的发展,受品种特性及外界环境的影响,一些核桃品种出现了内果皮发育不完整、局部组织缺失的现象,导致核仁裸露,影响采后运输、加工和储藏等,进而影响种仁的品质与营养,其中新露核桃露仁特性较为突出(图1-A),果实形状近椭圆形,平均坚果壳厚度为1.28 mm,种仁易分离。
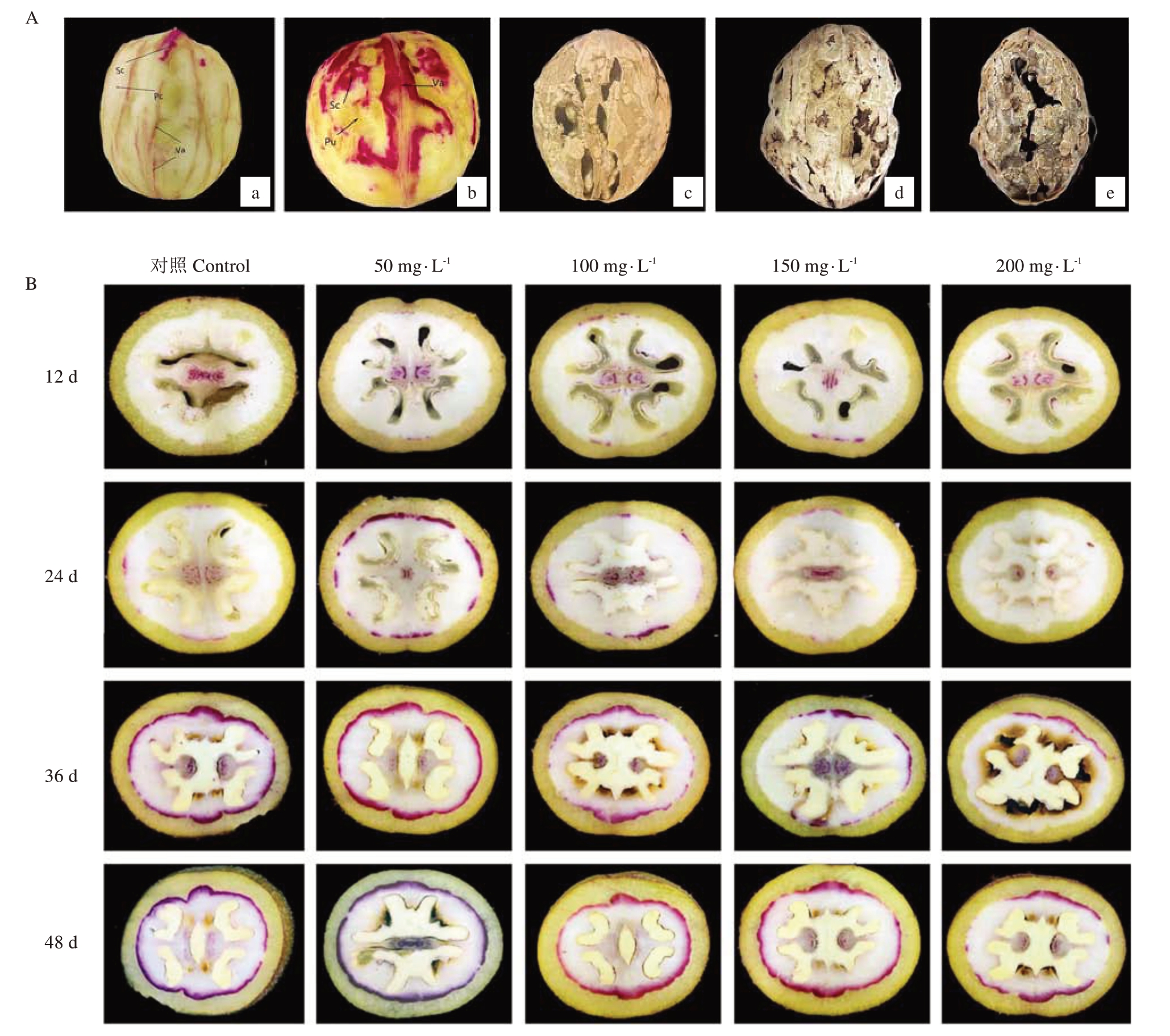
图1 核桃内果皮发育过程及内果皮木质素沉积变化
Fig.1 Development and changes in lignin deposition in walnut endocarp
A.新露核桃不同时期核桃内果皮发育的动态变化(a.硬化初期;b.硬化中期;c.硬化后期;d.成熟期;e.贮藏期;Pu.未硬化区;Sc.硬化区;Va.维管束);B.不同质量浓度IAA 处理后木质素沉积变化。
A.Dynamics of endocarp development in Xinlu walnuts in different periods(a.Early sclerotization;b.Middle sclerotization;c.Late sclerotization;d.Ripening; e.Storage; Pu.Pulpy;Sc.Sclerotic;Va.Vascular bundle); B.Changes in endocarp lignin deposition in walnuts after treatment with different concentrations of IAA.
木质素的积累是核桃内果皮生长发育的重要过程,也是植物细胞壁中发挥较强机械支撑作用的结构因子之一[1]。前期研究发现,影响细胞壁形成的因素众多,其中激素起突出作用[2-3],能够通过参与木质部发育对相应的基因进行表达和调节,进而影响到次生壁的形成[4-5]。乙烯和生长素可促进棉花胚珠细胞壁的沉积,此外,乙烯和生长素反应减少,会促进纤维素生物合成,促使细胞壁形成[6]。菊花茎节间中CmHLB基因的表达量与木质素含量、茎秆强度的增加趋势相一致[7]。AP2/ERF 可以调节木质素生物合成和木质部细胞分化,改变白杨木质素和纤维素的组成[8],转录因子ARF3、ARF6 结合编码4CL、CCoAOMT2 基因的启动子区域激活其转录水平,促进木质素的合成。不同浓度的生长素对细胞壁形成的影响程度不同,例如,在拟南芥和百日草中,生长素刺激叶肉细胞分化为木质部管状细胞,同时抑制花粉细胞壁的增厚[9];外源IAA 取代顶端茎诱导向日葵形成层细胞分裂和次生木质部分化;此外,生长素的浓度梯度在发育中的木材组织中保持不变,为分生组织的发育提供位置信息[10],已在拟南芥根和茎分生组织的发育中证实[11]。维管形成层是运输生长素的主要腔室[12],PttPIN1 和PttPIN2 基因表达位于形成层分生组织和扩张的木质部衍生物,而其在杨树茎生长素的极地运输中发挥关键作用[13]。蒋旭等[14]通过试验证明MsNS 能够调控植物木质素和纤维素的合成,对于白桦,外源GA3通过上调NAC 和MYB 转录因子调控CESA、PAL 和GA 氧化酶等基因的表达,从而促进木质部的发育[15],喷施适宜浓度的MeJA 和茉莉酸甲酯可提高根系内源激素和木质素含量,增强植株的抗逆性和PAL 活性,PAL、C4H、CCR1 和CAD2 基因在烟叶木质素的合成和积累中起关键调控作用[16-17];叶面喷施适宜浓度的多效唑[18],可通过阻抑IAA 合成,从而抑制幼苗纵向生长,使植株变矮,并增强抗性。IAA可提高临沧云烟和菜豆豆荚中木质素合成关键酶的活性从而促进木质素合成[19-20]。
前期研究表明,在早期新露核桃内果皮壳质态中IAA 浓度远低于肉质态中的浓度,硬化的后期又开始升高[21],且木质素对核桃内果皮的形成、核桃品质的改善起至关重要的作用,不同的外源激素处理对木质素积累作用不同。因此,笔者在本研究中探讨IAA 与核桃内果皮形成的关系,为减少露仁的发生提供理论依据,制定合理的生产措施。
1 材料和方法
1.1 试验材料
试验材料新露(露仁品种)采自于阿克苏地区温宿县实验林场。选取树龄均为16 a(年),株行距为5 m×6 m,生长健壮一致、水肥管理水平一致的树体。于花后约50 d(2022 年6 月3 日)硬化期刚开始时,使用不同质量浓度(0、50、100、150、200 mg·L-1 IAA)的生长素,选取果实大小基本一致的短结果枝,在靠近果实的短果枝顶部上侧,用手术刀刮去约0.5 cm×2.0 cm 大小的外表皮。用棉棒蘸取适量激素均匀涂抹在伤口上,并用浸泡过激素的脱脂棉将伤口填充,用封口膜包裹伤口,使伤口与外界环境隔离。从首次激素处理开始,每隔12 d采摘1次果实,直至硬化期结束,共采样4 次。采集的果实全部在低温无菌条件下分离出内果皮硬化组织作为试验样本,将各样本材料迅速切至颗粒状,液氮速冻后放至超低温冰箱保存,将部分样本送至深圳微科盟科技集团有限公司进行测序,并对所得的数据进行分析。
1.2 试验方法
1.2.1 木质素沉积变化分析 采用间苯三酚染色法[21]观察内果皮木质素沉积变化。
1.2.2 木质素、纤维素、半纤维素含量测定 分别取经不同质量浓度生长素IAA 处理后的内果皮硬化组织样本,参考赵玉雪等[22]的方法测定木质素、纤维素、半纤维素含量。
1.2.3 内源IAA 含量测定 参考燕雪蒙[23]的方法,测定IAA含量。
1.2.4 转录组测序 委托深圳微科盟科技集团有限公司对经50、100、150、200 mg·L-1 IAA 处理后的12 d核桃内果皮样品和对照组核桃内果皮进行转录组测序。
2 结果与分析
2.1 IAA对核桃内果皮木质素沉积变化的影响
采用间苯三酚染色法观察核桃硬化期内果皮木质素沉积的变化,如图1-B 所示,核桃内果皮在硬化过程中,木质素的沉积发生了显著变化。硬化初期,木质素从靠近维管束的位置先开始沉积,颜色从浅红转为深红,从局部染色转为整体染色,直到硬化期结束核桃的硬壳完全形成。在经过IAA处理12 d之后,低质量浓度IAA 处理和高质量浓度IAA 处理的效果存在明显差异,特别是在接近缝合线的区域,首次呈现出粉红色,而且这种颜色的深浅不一,这表明内果皮已经开始沉淀木质素。在24 d 时,木质素还未大量积累,仅在内果皮和中果皮的交界处呈现。相较于对照组,50 mg·L-1 IAA 和100 mg·L-1 IAA 处理后的核桃内果皮的木质素沉积染色区域明显增加,而高浓度IAA处理效果不显著,染色区域的面积较小。IAA 处理36 d,核桃的内部果皮已经大致呈现出粉红色,这表明此刻已经积累了大量的木质素,并且与对照组相比,在低质量浓度IAA处理后,木质素的积累不明显。处理后48 d,核桃内果皮完全硬化,并且明显变厚,颜色也更深。虽然核桃内果皮中有大量木质素沉积,但是发育并不完整,存在露仁的情况,表明50 mg·L-1 IAA处理后,前期可促进核桃内果皮木质素的积累,150 mg·L-1 IAA 和200 mg·L-1 IAA 处理后不同程度地抑制木质素的积累,后期作用并不明显。
2.2 IAA 对核桃内果皮木质素、纤维素、半纤维素含量的影响
核桃内果皮的生长发育主要包括细胞的分裂、木质化,以及木质素、纤维素和半纤维素等物质含量积累,最终形成厚壁组织。如图2所示,处理后12 d,与对照相比,50 mg·L-1 IAA 和100 mg·L-1 IAA 处理后内果皮木质素含量显著增加,200 mg·L-1 IAA 处理后,木质素含量与对照差异不明显。处理后期,低质量浓度IAA 处理促进木质素积累,木质素含量缓慢增加,高质量浓度IAA 处理后内果皮木质素含量低于对照。内果皮中纤维素含量整体呈上升趋势,与对照相比,不同质量浓度的IAA 处理后,前期纤维素含量均高于对照;24 d 时,50 mg·L-1 IAA 处理纤维素含量(w,后同)最高,达到12.49%,36 d 时,50 mg·L-1 IAA、100 mg·L-1 IAA 处理纤维素含量呈上升趋势,150 mg·L-1 IAA 和200 mg·L-1 IAA 处理纤维素含量显著低于对照;48 d时,IAA 处理纤维素含量均低于对照。内果皮中半纤维素含量整体呈上升趋势,与对照相比,不同质量浓度的IAA 处理后半纤维素含量高于对照,在36 d 时,200 mg·L-1 IAA处理半纤维素含量变化上升速率最大且含量最高,之后速率有所降低,在48 d 时,50 mg·L-1 IAA处理>100 mg·L-1 IAA 处理>150 mg·L-1 IAA 处理>200 mg·L-1 IAA 处理>对照,半纤维素含量在13%~16%范围内变化。
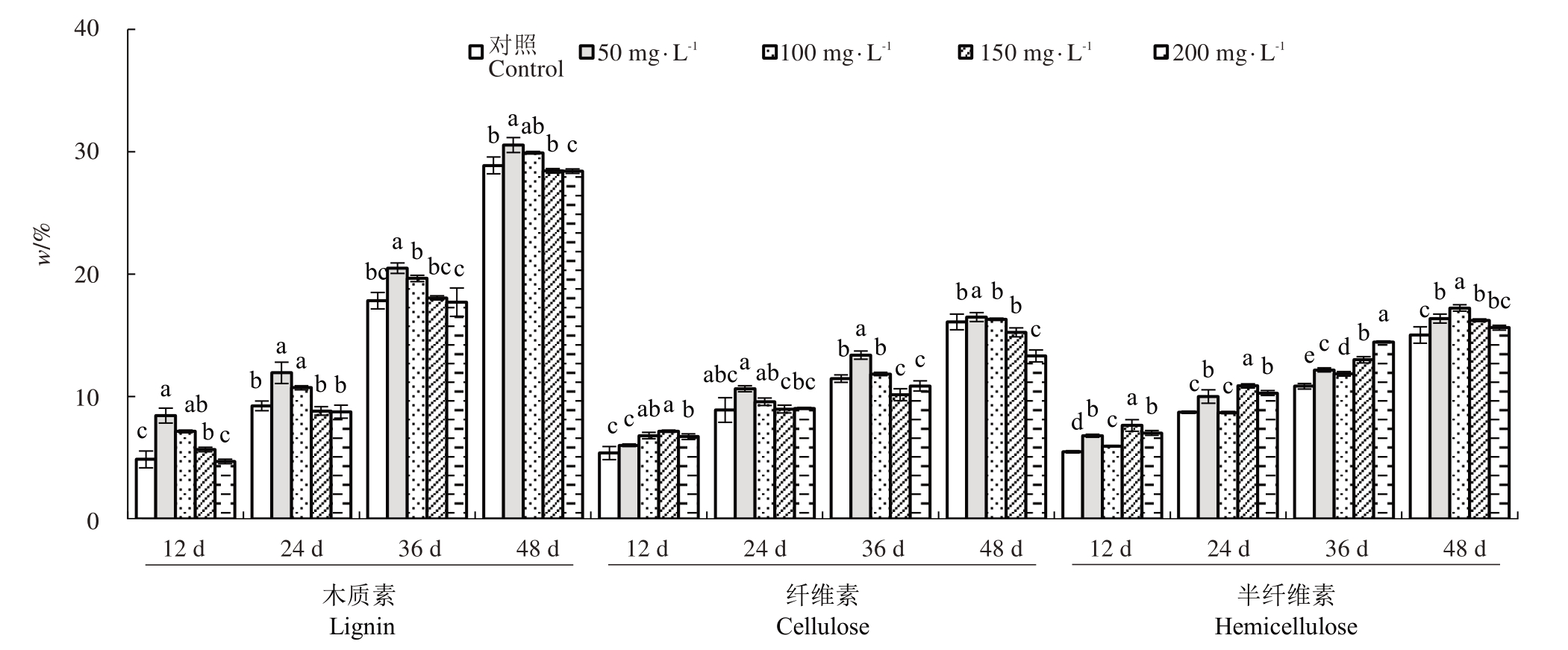
图2 核桃内果皮木质素、纤维素、半纤维素含量变化
Fig.2 Changes in lignin,cellulose and hemicellulose in walnut endocarp
不同小写字母表示同一处理时间不同质量浓度下差异显著(p<0.05)。下同。
Different small letters indicate significant differences at the same day among different concentrations(p<0.05).The same below.
2.3 IAA对核桃内果皮内源IAA含量的影响
不同质量浓度IAA处理后核桃内果皮的内源IAA含量整体呈上升趋势(图3)。处理后12 d,50 mg·L-1 IAA 和100 mg·L-1 IAA 处理后的核桃内果皮内源IAA 含量显著高于对照,50 mg·L-1 IAA 处理后内果皮中IAA 含量达到37.77 ng·g-1,比对照高24.2%,100 mg·L-1 IAA 处理后比对照高21.5%,150 mg·L-1 IAA和200 mg·L-1 IAA较对照低,且随着质量浓度的升高,IAA 含量呈下降趋势;处理后24 d,50 mg·L-1 IAA处理后,内果皮中IAA含量显著高于对照,比对照高8.4%;处理后期,各处理间与对照差异小,但均高于对照。总体来说,各处理间与对照差异小,表明外源激素对内源IAA含量在处理后前期有一定的作用,后期作用减弱。
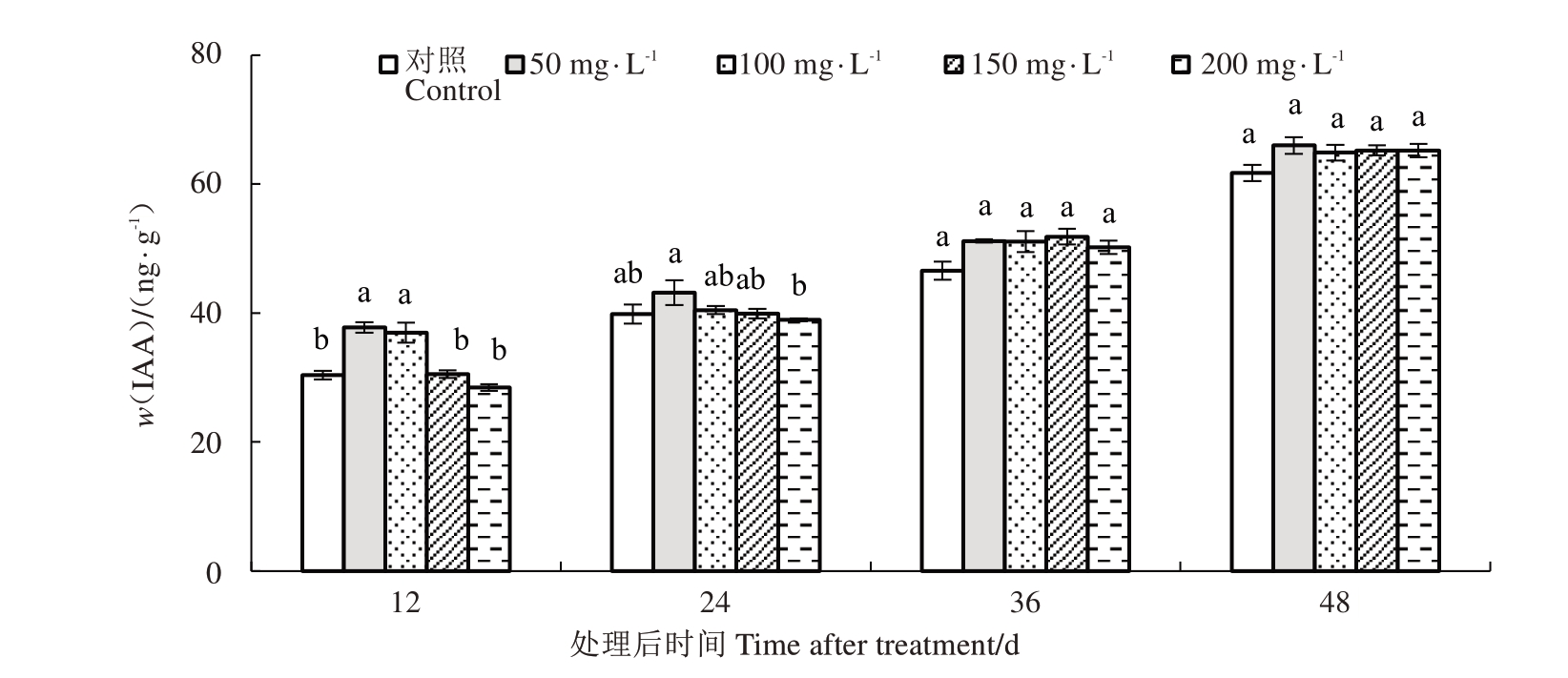
图3 核桃内果皮IAA 含量变化
Fig.3 Changes in IAA content in walnut endocarp
2.4 内果皮转录组数据质量评估
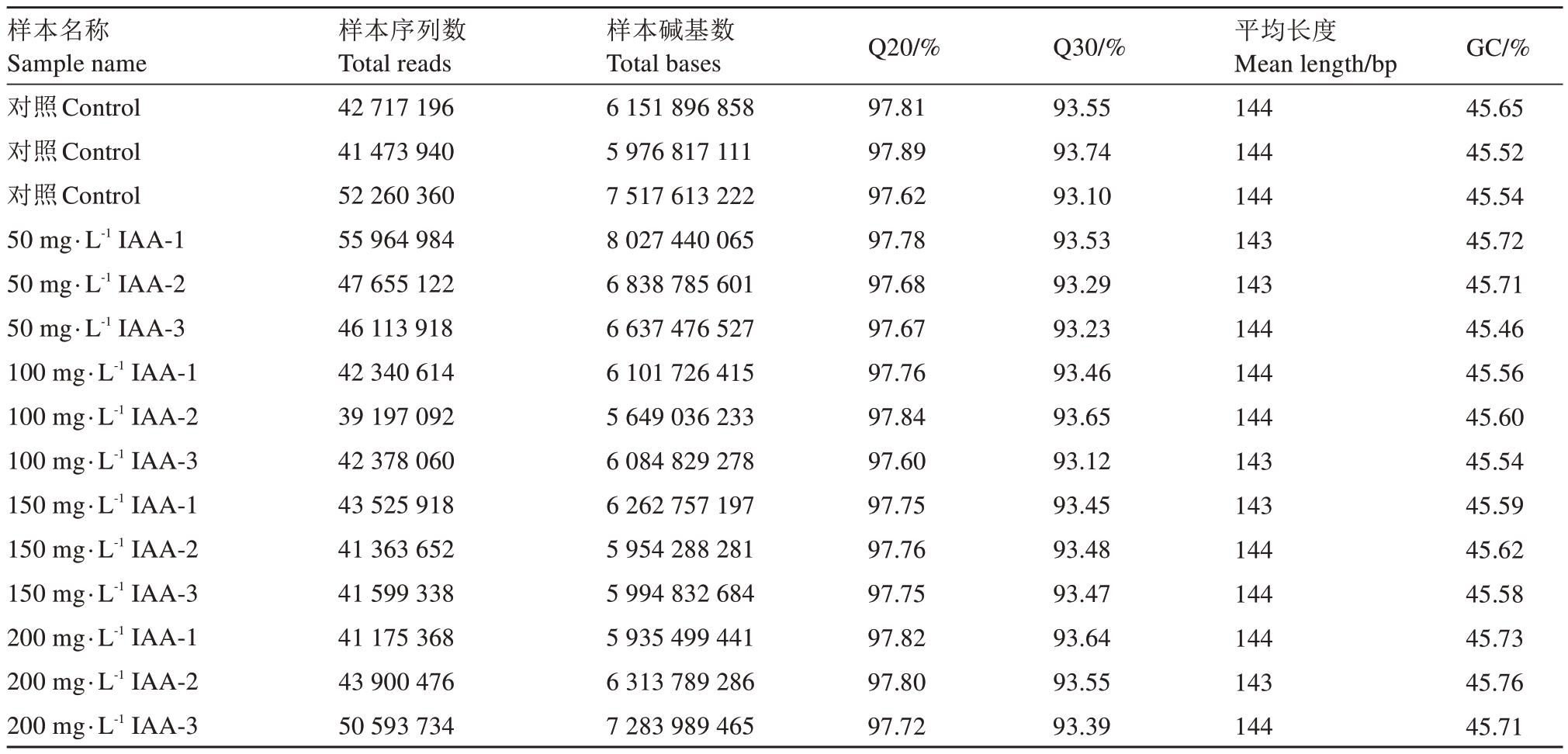
为了解经IAA 处理后核桃内果皮发育过程中基因的表达情况,以外源激素处理后12 d 的核桃内果皮为样品构建cDNA 文库,对3 个生物重复(总共15 个样本)进行RNA-Seq 分析,用fastp 软件对每一个样本的测序数据rawdata做质控处理,将测序得到的raw reads中的接头序列和低质量的reads去除后,获得clean reads,测序结果如表1 所示,Q30 的碱基比均大于93%,GC 含量在45.23%~45.76%,表明所获得的测序数据具有高品质和高可靠性。
表1 RNA 样品质量检测结果
Table 1 Results of RNA sample quality testing
样本名称Sample name对照Control对照Control对照Control 50 mg·L-1 IAA-1 50 mg·L-1 IAA-2 50 mg·L-1 IAA-3 100 mg·L-1 IAA-1 100 mg·L-1 IAA-2 100 mg·L-1 IAA-3 150 mg·L-1 IAA-1 150 mg·L-1 IAA-2 150 mg·L-1 IAA-3 200 mg·L-1 IAA-1 200 mg·L-1 IAA-2 200 mg·L-1 IAA-3样本序列数Total reads 42 717 196 41 473 940 52 260 360 55 964 984 47 655 122 46 113 918 42 340 614 39 197 092 42 378 060 43 525 918 41 363 652 41 599 338 41 175 368 43 900 476 50 593 734样本碱基数Total bases 6 151 896 858 5 976 817 111 7 517 613 222 8 027 440 065 6 838 785 601 6 637 476 527 6 101 726 415 5 649 036 233 6 084 829 278 6 262 757 197 5 954 288 281 5 994 832 684 5 935 499 441 6 313 789 286 7 283 989 465 Q20/%97.81 97.89 97.62 97.78 97.68 97.67 97.76 97.84 97.60 97.75 97.76 97.75 97.82 97.80 97.72 Q30/%93.55 93.74 93.10 93.53 93.29 93.23 93.46 93.65 93.12 93.45 93.48 93.47 93.64 93.55 93.39平均长度Mean length/bp 144 144 144 143 143 144 144 144 143 143 144 144 144 143 144 GC/%45.65 45.52 45.54 45.72 45.71 45.46 45.56 45.60 45.54 45.59 45.62 45.58 45.73 45.76 45.71
2.5 差异表达基因分析
分别以不同质量浓度的生长素IAA 与对照(清水)处理两两之间进行相互比较筛选差异基因,分别为50 mg·L-1 vs 对照、100 mg·L-1 vs 对照、150 mg·L-1 vs 对照、200 mg·L-1 vs 对照4 组。如图4所示,50 mg·L-1 IAA vs 对照处理后差异表达基因数量最多,为3292个,其中上调表达的基因有1922个,下调表达的基因有1370 个;200 mg·L-1 IAA 处理后差异表达基因总数最少,为2263 个,且上调表达的基因有1198 个,下调表达的基因有1265 个;通过Veen图进一步比较4个不同质量浓度的IAA 处理间的核心差异基因组,发现不同浓度间的共同差异表达基因有591个。
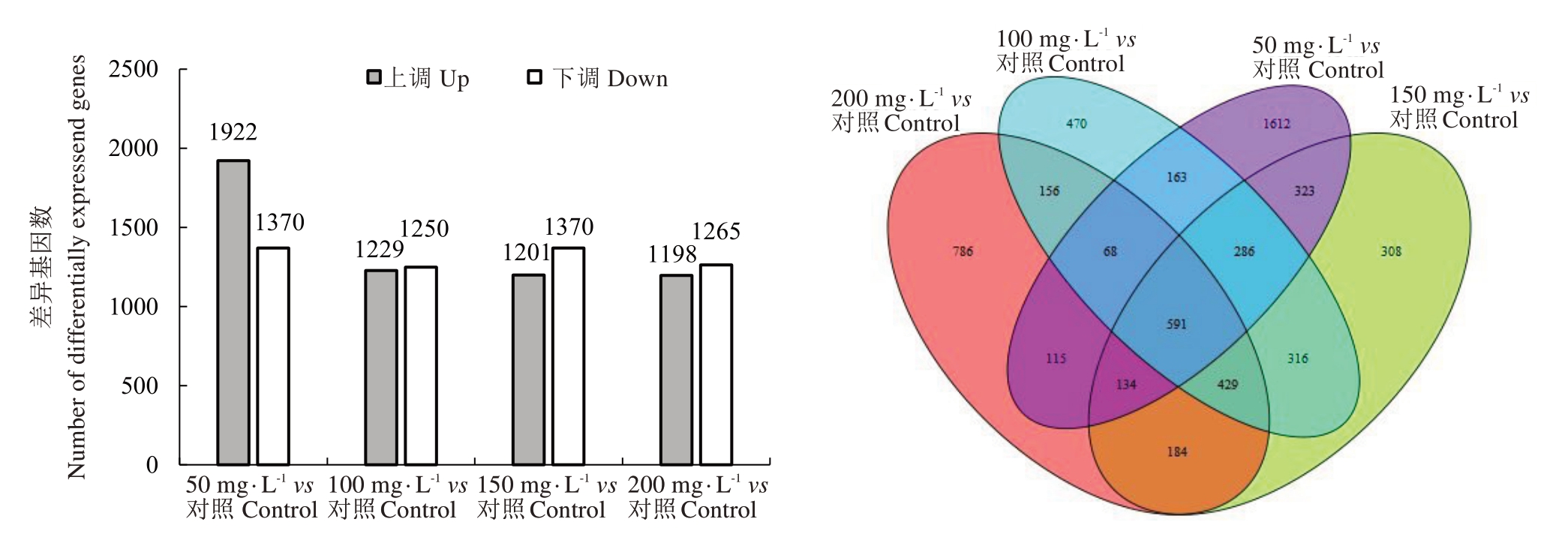
图4 不同IAA 处理之间差异表达基因数和差异表达基因Veen 图
Fig.4 Plot of number of differentially expressed genes and Veen of differentially expressed genes between different IAA treatments
2.6 差异基因富集分析
2.6.1 差异表达基因GO 富集分析 对差异基因进行GO 富集分析,如图5 所示,每个IAA 处理主要展示显著富集的15个条目,通过对比发现,4种处理后细胞组分均富集在膜的锚定成分。随着IAA 质量浓度的增加,生物过程富集条目发生了显著变化,50 mg·L-1 IAA 和100 mg·L-1 IAA 处理共同包含5个功能组分,分别是次生代谢产物生物合成过程、细胞壁生物生成、植物型细胞壁生物生成、木质素代谢和木质素生物合成过程;150 mg·L-1 IAA 处理包含有机阴离子转运、线粒体转运、侧根发育、碳水化合物衍生物转运、碳水化合物跨膜转运、脂质定位、有机磷酸酯转运、线粒体跨膜运输、种子成熟和线粒体蛋白质定位的建立;200 mg·L-1 IAA 处理包含碳水化合物生物合成过程、次生代谢过程、对光的反应、线粒体运输、碳水化合物衍生物运输、类固醇生物合成过程、细胞生长、线粒体跨膜转运和线粒体蛋白质定位的建立。50 mg·L-1 IAA 处理后分子功能富集在单氧化酶活性和氧化还原酶活性,100 mg·L-1 IAA处理包含转移糖基和转移己糖基功能,150 mg·L-1 IAA 处理包含羧酸跨膜转运体活性、碳水化合物衍生物跨膜转运体活性、核碱基跨膜转运体活性功能中,200 mg·L-1 IAA 处理后包含单氧化酶活性、碳水化合物衍生物结合和多糖结合功能组分。
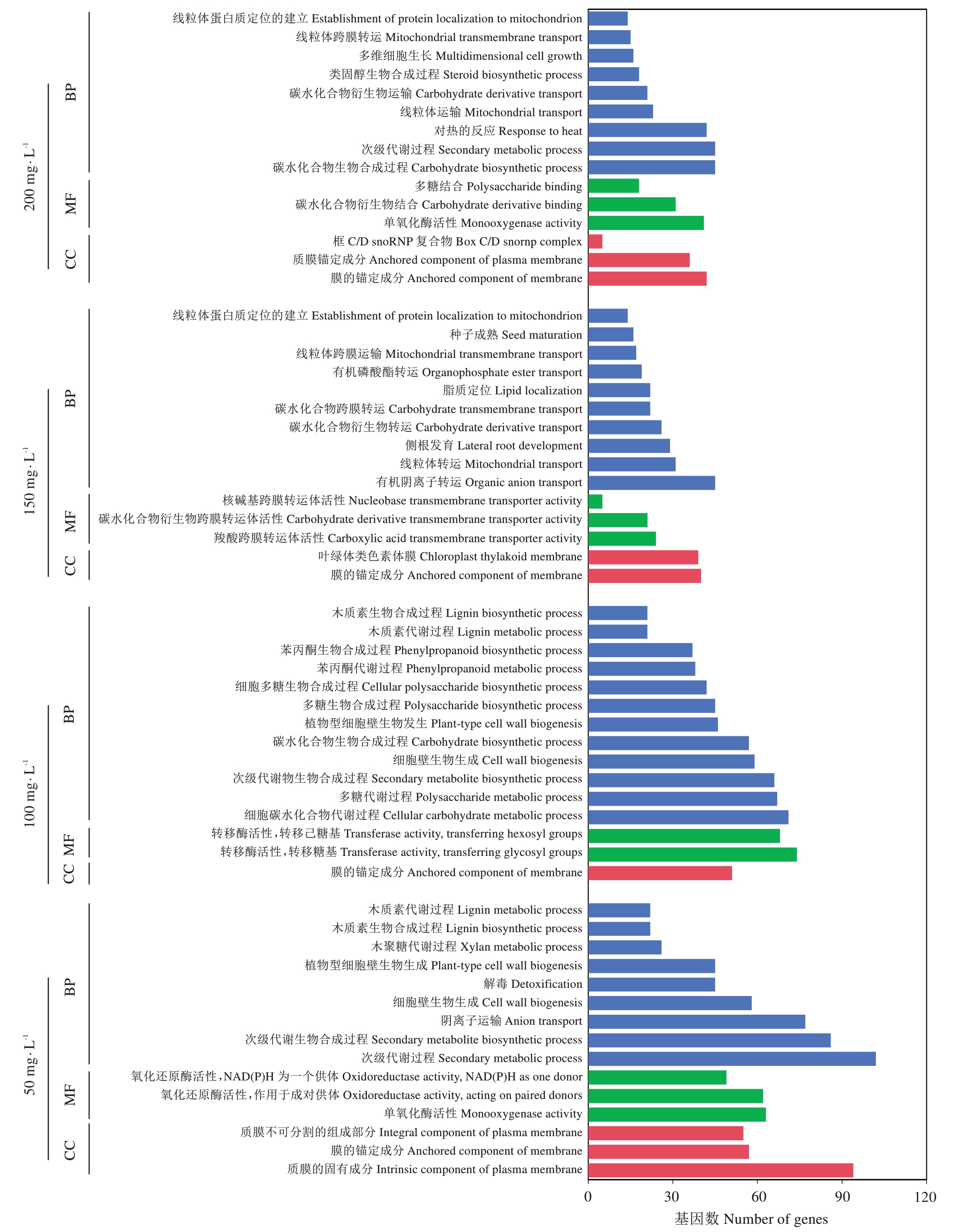
图5 差异表达基因GO 富集图
Fig.5 GO enrichment of differentially expressed genes
BP.生物过程;CC.细胞组分;MF.分子功能。
BP.Biological process;CC.cellular component;MF.Molecular function.
2.6.2 KEGG 富集分析 如图6 所示,不同质量浓度生长素IAA 处理后,核桃内果皮发育过程代谢途径发生了变化,随着质量浓度的升高,50 mg·L-1 IAA 处理后,差异基因较多富集在植物激素信号转导、苯丙烷生物合成、MAPK 信号通路—植物、淀粉和蔗糖代谢、ABC 转运体、半胱氨酸和蛋氨酸代谢等其他代谢途径;100 mg·L-1 IAA 处理后富集在植物激素信号转导、苯丙烷生物合成、淀粉和蔗糖代谢、MAPK 信号通路—植物和氨基酸糖和核苷酸糖代谢核苷酸糖的生物合成、黄酮类化合物的生物合成等其他代谢途径;150 mg·L-1 IAA 处理后,富集在植物激素信号转导、淀粉和蔗糖代谢、半胱氨酸和蛋氨酸代谢、核苷酸糖生物合成、类黄酮生物合成和光合作用等其他途径中;200 mg·L-1 IAA 处理后,富集在植物激素信号转导、内质网中蛋白质加工、碳代谢、淀粉和蔗糖代谢、MAPK 信号通路-植物和糖代谢等多个代谢途径中。
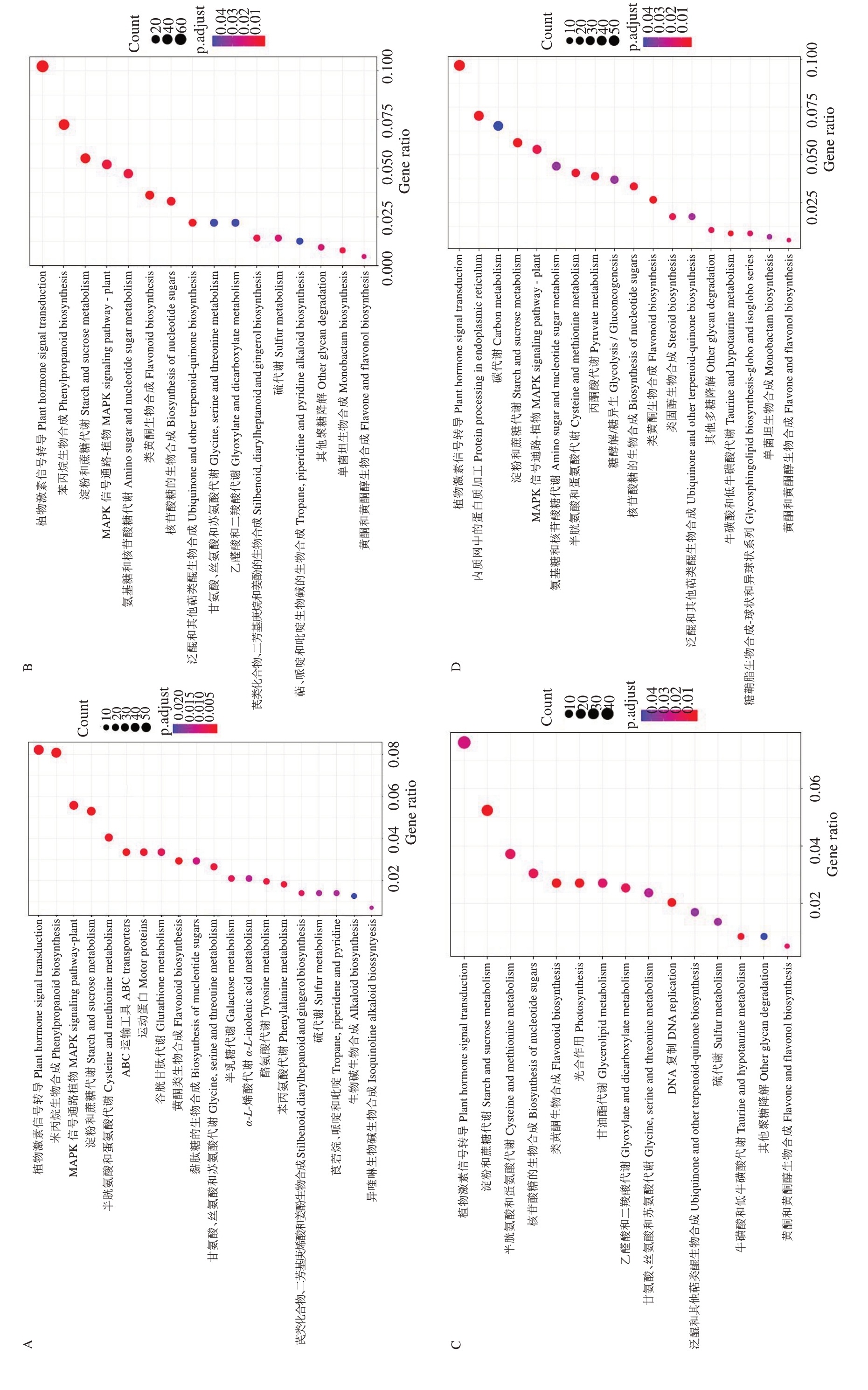
图6 差异基因KEGG 富集分析
Fig.6 Differential gene KEGG enrichment analysis
A.50 mg·L-1 IAA;B.100 mg·L-1 IAA;C.150 mg·L-1 IAA;D.200 mg·L-1 IAA。
综上所述,植物激素信号转导途径是共同代谢通路,随着质量浓度的增加,苯丙烷生物合成途径发生了显著改变,150 mg·L-1 IAA和200 mg·L-1 IAA处理中未富集,说明苯丙烷生物合成途径也是主要的代谢通路。
2.7 外源激素调控苯丙烷生物合成与植物激素信号转导相关基因筛选
根据前期的试验结果初步推测核桃内果皮经外源施加生长素后在植物激素信号转导和苯丙烷生物合成表达上存在明显的差异,因此对上述两条途径的相关基因进行统计分析。以log2FC 的绝对值≥1且q 值<0.05 作为标准,如图7-A 所示,50 mg·L-1 IAA 处理后,有60 个差异表达基因参与苯丙烷生物合成途径,48 个差异基因参与植物激素信号转导(图7-B);在参与苯丙烷生物合成途径的主要酶类基因(23 个)中,有2 个4-香豆素-CoA 连接酶基因(4CL)、2 个咖啡酸3-O-甲基转移酶(COMT)基因和6 个苯丙氨酸解氨酶(PAL)基因在不同质量浓度IAA处理下均上调,且随着质量浓度的升高,基因表达逐渐下调,其中COMT(LOC108984894)基因仅在50 mg·L-1 IAA 处理后显著上调表达,高质量浓度处理下不表达(图8-A)。4-单加氧酶样反式肉桂酸酯(LOC108996947)基因仅在50 mg·L-1 IAA 处理中下调表达,另一个C4H 基因在低质量浓度中不表达,高质量浓度中上调表达。所有参与苯丙烷代谢途径的差异基因中,有4 个过氧化物酶基因(LOC109007078、LOC109013790、LOC109011944 和LOC108981442)和1 个咖啡酸3-O-甲基转移酶基因(LOC109019627)在4种处理中均表达(图8-B)。
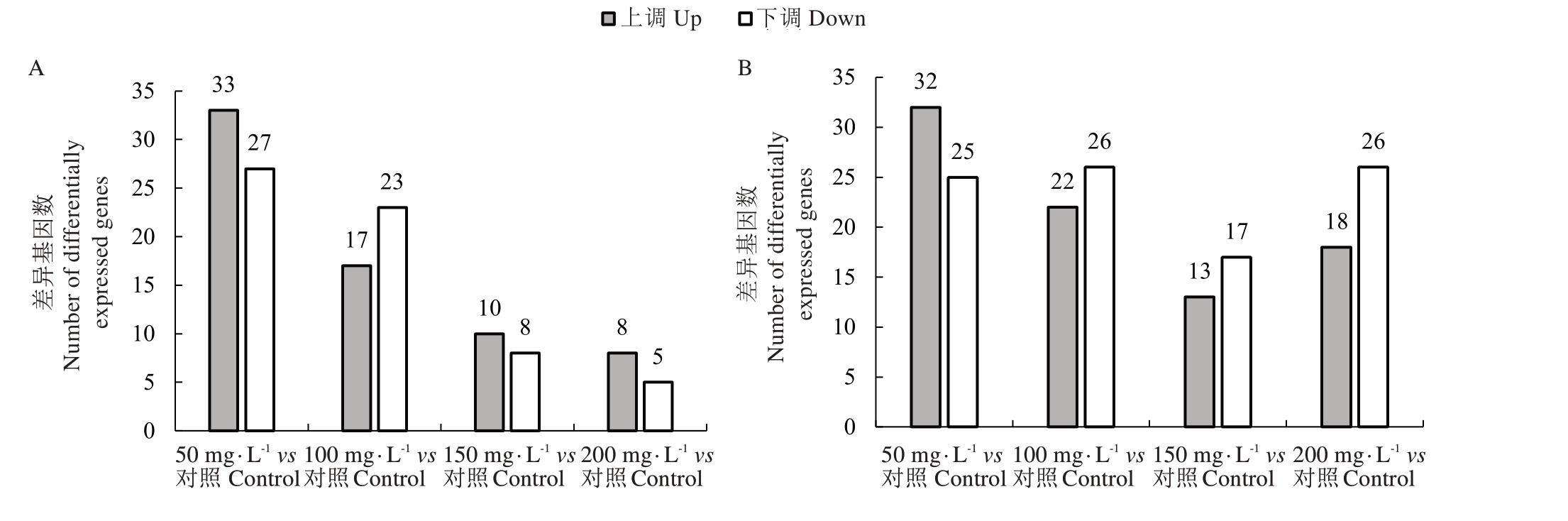
图7 可能与外源IAA 响应相关的差异表达基因
Fig.7 Differentially expressed genes associated with the response to exogenous IAA
A.木质素合成相关的差异表达基因;B.植物激素信号传导相关的差异表达基因。
A.Differentially expressed genes related to lignin synthesis;B.Differentially expressed genes related to plant hormone signaling.
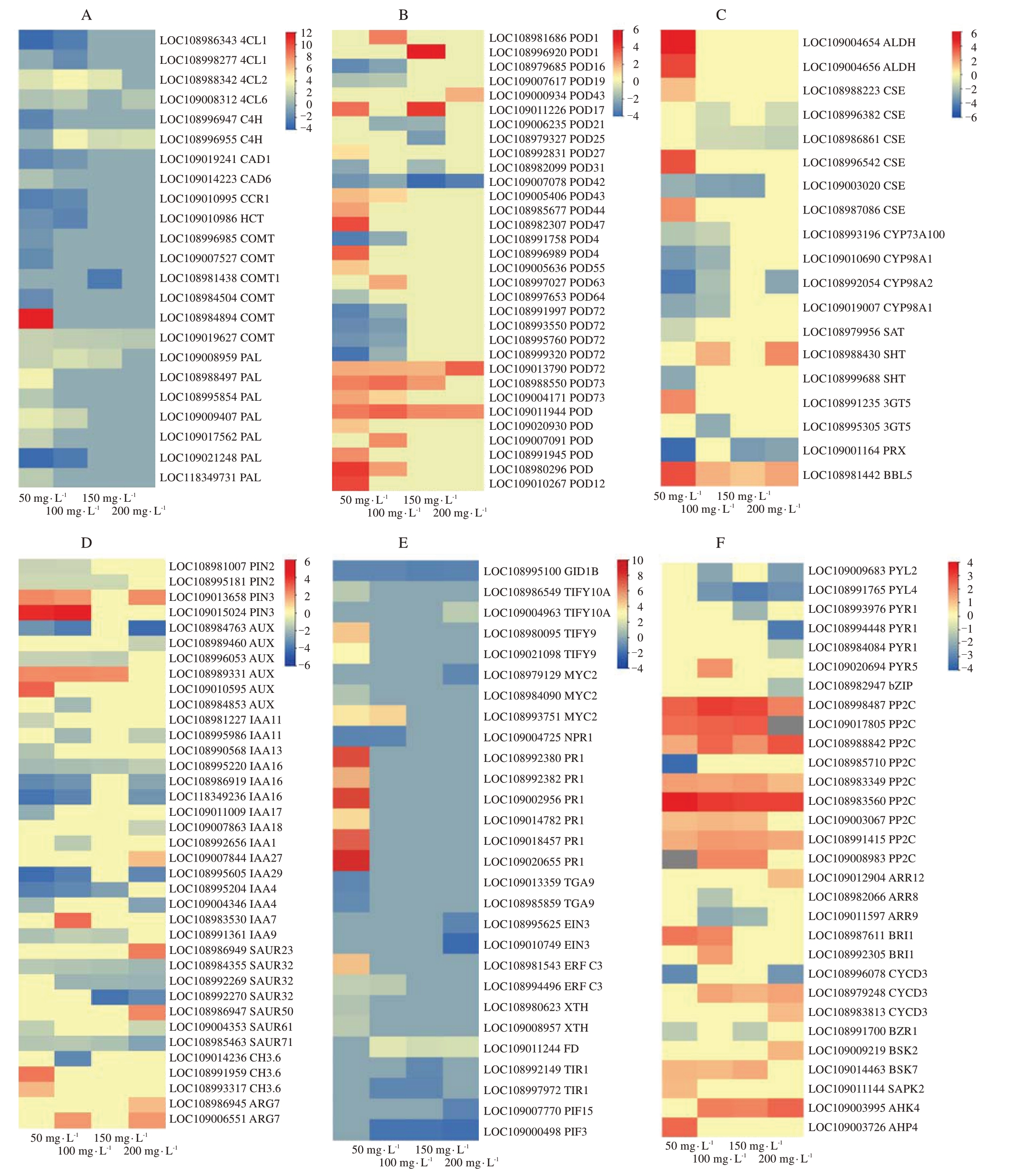
图8 不同质量浓度IAA 处理下与苯丙烷代谢途径和植物激素信号转导相关差异基因的log2 FC 变化值热图
Fig.8 Heat map of log2 FC change values of differential genes related to phenylpropanoid biosynthesis and plant hormone signal transduction under treatments at different concentrations of IAA
A.参与木质素合成主要酶类基因;B.过氧化物酶类基因;C.类黄酮途径细胞色素P450 类基因;D.生长素类基因;E.赤霉素、茉莉酸、水杨酸、乙烯类基因;F.脱落酸、油菜素甾体、细胞分裂素类基因。
A.Genes involved in major enzymes of lignin synthesis; B.Peroxidase genes; C.Flavonoids pathway cytochrome P450 class genes; D.Auxin genes;E.Gibberellin genes,jasmonic acid genes,salicylic acid genes,ethylene genes;F.Abscisic acid genes,brassinosteroid genes,cytokinin genes.
在生长素信号通路中,施加IAA 后,2 个生长素转运蛋白(PIN)、生长素诱导蛋白(AUX)、生长素反应因子(IAA)和1个SAUR上调,2个PIN、4个AUX、12 个IAA 和5 个SAUR 基因下调(图8-E)。在ABA信号通路中,5 个蛋白磷酸酶基因(PP2C-24、PP2C-75、PP2C-37、PP2C-51 和PP2C-56)在4 种质量浓度处理中均上调表达;丝氨酸/苏氨酸蛋白激酶BSK7基因在50 mg·L-1 IAA 处理、100 mg·L-1 IAA 处理和150 mg·L-1 IAA 处理中均上调表达,200 mg·L-1 IAA处理中不表达,另一个基因LOC109011144仅在50 mg·L-1 IAA 处理中上调(图8-D)。赤霉素受体GID1B在4个处理中均下调表达,3个蛋白质TIFY、1个MYC 转录因子、9个水杨酸PR 蛋白和1个乙烯反应因子ERF仅在50 mg·L-1 IAA处理中表达(图8-F)。
3 讨 论
生长素是一种在低浓度时促进植物生长发育的有机物质,调节植物的许多发育过程,包括细胞的扩张、根的起始、维管组织的分化、芽和花的生长;生长素也是控制根生长、根向地性和维管分化的主要植物激素[24]。核桃内果皮在坚果的生长发育、加工、运输及贮藏中起着重要的作用。郑志锋等[25]对核桃内果皮的化学成分检测结果表明,在核桃的内果皮中存在大量的木质素,同时说明木质素是构成核桃内果皮的重要成分;李夕勃等[26]根据对各个核桃品种的硬壳构造及硬壳中木质素浓度的检测数据进行分析,发现木质素浓度越高,核桃坚果的缝合线越严密、硬壳越硬、硬壳就越厚,笔者在本研究中通过间苯三酚染液对核桃切片进行染色后,发现前期与对照相比,经低质量浓度IAA 处理后内果皮着色部位及颜色均增加,在靠近缝合线的地方开始出现粉红色,且程度不同,说明内果皮中木质素开始沉积;处理后24 d,可观察到在内果皮与中果皮交接位置出现淡黄色果壳,但木质素尚未出现大量沉积,仅在坚果顶部和底端沉积,而高质量浓度IAA 处理后效果并不明显,相比之下,染色部位较少。生长素可以刺激木质部组织分化,外源IAA 诱导形成层分裂,从而促进木质部组织分化。在辣椒和茄属植物中,生长素促进了次生木质部的生长,而生长素抑制剂则完全或部分表现出相反的特征。本研究中,通过测定内果皮中木质素的含量,所得结果与间苯三酚染色结果基本一致。不同的激素处理对木质素含量有不同的影响,先前的研究表明,低质量浓度IAA处理会增加木质素含量。木质素沉积主要存在于增厚细胞壁,是植物细胞壁的重要组成部分,它的主要功能是提供机械支持和水的运输[27]。高沉积量阻碍了胡萝卜主根的味道、质地和质量,而木质素含量的下降可能会影响植物的生长和发育[28],IBA 处理降低了胡萝卜的木质素含量。当用NAA 处理大豆下胚轴时,也观察到了类似的结果,此外,经IBA 处理的肉桂扦插植株的木质素含量有所下降。在核桃内果皮生长发育过程中,纤维素也是构成次生壁的因子之一,在马尾松木质部组织中显著上调表达,外源IAA可显著增加纤维素含量和木质素含量[29]。在本研究中,内果皮中纤维素含量整体呈上升趋势,与对照相比,不同质量浓度IAA处理后,前期纤维素含量均高于对照;24 d 时,50 mg·L-1 IAA 处理纤维素含量最高。且笔者课题组通过前期研究发现,薄壳品种温185和新新2核桃在经不同浓度IAA处理后,核桃果壳厚度和硬壳机械强度均增加,其中50 mg·L-1 IAA处理效果最佳[30]。经高质量浓度的IAA 处理后核桃内果皮木质素含量增加趋势减缓,且根据转录组数据分析发现,低质量浓度IAA处理后,筛选出的与木质素途径相关的差异基因数量较高质量浓度多,推测IAA 处理对木质素的含量有一定的影响,但是IAA在核桃内果皮木质素相关基因表达和木质素积累中的机制尚不清楚。
生长素对植物次生生长有重要的影响,且与植物生长发育过程密切相关[31],外源施加IAA,短时间内显著影响高粱内源激素的含量。低质量浓度IAA处理促进杉木苗高生长,高质量浓度IAA 抑制苗高生长[32];喷施低质量浓度IAA 使叶用莴苣植株内源IAA含量显著增加,高质量浓度IAA处理后,作用并不明显,但促进IAA 含量达到峰值[33]。笔者在本研究中发现经不同质量浓度IAA 处理12 d 后,核桃内果皮中内源IAA 含量发生显著变化,其中50 mg·L-1 IAA 和100 mg·L-1 IAA 处理后,内源激素IAA 含量显著增加,150 mg·L-1 IAA 处理后与对照相比无明显作用,但200 mg·L-1 IAA处理后,内源IAA含量比对照低,推测可能是通过影响其他的内源激素含量来调控核桃内果皮的生长发育。处理36 d 开始,不同质量浓度IAA 处理核桃内果皮中内源IAA 含量均呈上升趋势,推测外源IAA 影响内源IAA 含量的变化,进而影响内果皮的发育。
通过前期的研究可知PAL、C4H、4CL、CAD是木质素合成过程中的关键酶基因,笔者在本研究中找到74 个差异显著基因,大部分基因编码参与苯丙烷生物合成途径的几个主要酶,从log2 倍变化值热图可看出,4CL、COMT 和PAL 基因在不同质量浓度IAA处理下均上调,且随着浓度的升高,基因的表达量呈下降趋势;在这些主要的酶基因中有4个COMT(LOC108996985、LOC109007527、LOC108984504、LOC108984894)基因、4 个PAL(LOC108988497、LOC108995854、LOC109017562、LOC118349731)基因、1 个C4H(LOC108996947)基因和1 个CAD(LOC109014223)基因仅在50 mg·L-1 IAA 处理后显著表达,高质量浓度处理下不表达,其中COMT(LOC108984894)基因在50 mg·L-1 IAA 处理后极显著高表达;推测这些在低质量浓度IAA 处理后表达,在高质量浓度IAA 处理后低表达或不表达的基因,可能就是调控木质素合成的主要基因。在所有参与该途径的差异基因中,有4 个POD 基因和COMT 基因在4 种处理中均参与调节。在对临沧云烟以及菜豆豆荚等试验中发现,赤霉素和生长素等激素能够提高木质素合成关键酶POD 和PAL活性,从而促进木质素合成,休眠期喷洒IAA 使花芽中PAL 活性增强[34]。通过抑制C4H 的表达,降低橄榄[35]、毛竹[36]等植物中S 型与G 型木质素单体比例,从而影响木质素含量。不同浓度烯效唑和赤霉素处理通过调控EjCAD5 的表达,延缓枇杷采后冷害木质化,导致木质素含量减少[37]。
植物生长调节剂可调控植物细胞和细胞壁的生长过程,影响植物的形态建成。许多植物基因组中的转录因子均参与多种生长发育过程,包括次生细胞壁的形成、生物和非生物胁迫反应等[38]。研究表明,生长素响应蛋白基因(IAA、ARF 和SAUR)、生长素反应蛋白基因(AUX1)、生长素反应阻遏子(AUX/IAA)是IAA 信号转导途径的关键基因[39]。笔者在本研究中通过分析转录组数据,发现与生长素相关的19 个基因,被注释在Auxin transporter-like protein、auxin-induced protein、auxin-responsive protein、auxin-responsive protein SAUR等上,低质量浓度IAA处理后,与生长素相关的大部分基因下调表达,随着质量浓度的升高,部分基因表达量降低或不表达。在拟南芥中,生长素通过“AtARF8.4-AtMYB26”途径调控内生植物的木质化[40]。AtARF17 通过在花药开裂过程中直接激活AtMYB108 来调控内皮质的木质化[41]。在杨树中,“PtoARF5-PtoHB7/8”信号级联介导了早期木材发育过程中生长素触发的木质部细胞分化[42];而AtARF2 的同源物PtrARF2.1 则影响木质素的生物合成[43]。在水稻中,OsARF6/17 通过调节叶片关节中次生细胞壁的生物合成来控制旗叶角[44]。
综上所述,笔者在本研究中明确了外源施用IAA 对核桃内果皮木质素积累的影响,并引起木质素、纤维素、半纤维素含量和内源激素含量的变化,促进内果皮的发育。在转录水平上,低质量浓度IAA处理下,诱导相关基因进行物质交流和信号转导途径,使得积累大量木质素,并引起MYC、PIF 等转录因子的变化。外源施用IAA 后,主要引起了植物激素信号途径和木质素合成途径的变化,诱导了相关基因的表达,但具体影响机制还有待于进一步研究。
4 结 论
通过对新露核桃进行不同质量浓度生长素IAA处理,与对照相比,发现50 mg·L-1 IAA和100 mg·L-1 IAA 对核桃内果皮木质素的积累起显著促进作用,150 mg·L-1 IAA 和200 mg·L-1 IAA 抑制木质素的合成,主要表现在木质素沉积、木质素、纤维素和内源IAA 含量等方面,表明外源IAA 对核桃内果皮的发育不完整有一定的作用。通过转录组测序,差异基因主要富集在苯丙烷生物合成途径和植物激素信号转导途径,且随着质量浓度的增加,与木质素合成和生长素相关的部分差异基因表达量降低或不表达。
[1] MEENTS M J,WATANABE Y,SAMUELS A L.The cell biology of secondary cell wall biosynthesis[J].Annals of Botany,2018,121(6):1107-1125.
[2] DIDI V,JACKSON P,HEJÁTKO J.Hormonal regulation of secondary cell wall formation[J].Journal of Experimental Botany,2015,66(16):5015-5027.
[3] LE GALL H,PHILIPPE F,DOMON J M,GILLET F,PELLOUX J,RAYON C.Cell wall metabolism in response to abiotic stress[J].Plants,2015,4(1):112-166.
[4] ZHAO Q,DIXON R A.Transcriptional networks for lignin biosynthesis:More complex than we thought?[J].Trends in Plant Science,2011,16(4):227-233.
[5] PARK E J,KIM H T,CHOI Y I,LEE C H,NGUYEN V P,JEON H W,CHO J S,FUNADA R,PHARIS R P,KUREPIN L V,KO J H.Overexpression of gibberellin 20-oxidase1 from Pinus densiflora results in enhanced wood formation with gelatinous fiber development in a transgenic hybrid poplar[J].Tree Physiology,2015,35(11):1264-1277.
[6] CECCHETTI V,ALTAMURA M M,FALASCA G,COSTANTINO P,CARDARELLI M.Auxin regulates Arabidopsis anther dehiscence,pollen maturation,and filament elongation[J].The Plant Cell,2008,20(7):1760-1774.
[7] WANG Y,LI Y,HE S P,XU S W,LI L,ZHENG Y,LI X B.The transcription factor ERF108 interacts with AUXIN RESPONSE FACTORs to mediate cotton fiber secondary cell wall biosynthesis[J].The Plant Cell,2023,35(11):4133-4154.
[8] ZHAO W Q,DING L,LIU J Y,ZHANG X,LI S,ZHAO K K,GUAN Y X,SONG A P,WANG H B,CHEN S M,JIANG J F,CHEN F D.Regulation of lignin biosynthesis by an atypical bHLH protein CmHLB in Chrysanthemum[J].Journal of Experimental Botany,2022,73(8):2403-2419.
[9] ZHAO X W,WANG Q,WANG D,GUO W,HU M X,LIU Y L,ZHOU G K,CHAI G H,ZHAO S T,LU M Z.PagERF81 regulates lignin biosynthesis and xylem cell differentiation in poplar[J].Journal of Integrative Plant Biology,2023,65(5):1134-1146.
[10] TUOMINEN H,PUECH L,FINK S,SUNDBERG B.A radial concentration gradient of indole-3-acetic acid is related to secondary xylem development in hybrid aspen[J].Plant Physiology,1997,115(2):577-585.
[11] SWARUP R,BENNETT M.Auxin transport:the fountain of life in plants?[J].Developmental Cell,2003,5(6):824-826.
[12] SCHRADER J,BABA K,MAY S T,PALME K,BENNETT M,BHALERAO R P,SANDBERG G.Polar auxin transport in the wood-forming tissues of hybrid aspen is under simultaneous control of developmental and environmental signals[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(17):10096-10101.
[13] LEYSER O.Auxin distribution and plant pattern formation:how many angels can dance on the point of PIN?[J].Cell,2005,121(6):819-822.
[14] 蒋旭,崔会婷,王珍,张铁军,龙瑞才,杨青川,康俊梅.紫花苜蓿MsNST 的克隆及对木质素与纤维素合成的功能分析[J].中国农业科学,2020,53(18):3818-3832.JIANG Xu,CUI Huiting,WANG Zhen,ZHANG Tiejun,LONG Ruicai,YANG Qingchuan,KANG Junmei.Cloning and function analysis of MsNST in lignin and cellulose biosynthesis pathway from alfalfa[J].Scientia Agricultura Sinica,2020,53(18):3818-3832.
[15] 刘佳欣,刘慧子,石晶静,于颖,王超.白桦MYB 基因响应激素及盐旱处理的表达研究[J].植物研究,2020,40(5):743-750.LIU Jiaxin,LIU Huizi,SHI Jingjing,YU Ying,WANG Chao.Expression of MYB genes of birch in response to hormones,salt and drought[J].Bulletin of Botanical Research,2020,40(5):743-750.
[16] 马海霞.茉莉酸对橡胶草乳管分化调控机制的研究[D].石河子:石河子大学,2017.MA Haixia.Study on the regulation of jasmonic acid on the laticifer differentiation of Taraxacum kok-saghyz Rodin[D].Shihezi:Shihezi University,2017.
[17] 高娅北,孙曙光,王胜雷,陈二龙,杨晓亮,孙占伟,宋朝鹏.烤烟成熟期烟叶木质素合成关键酶基因的转录分析[J].中国烟草学报,2019,25(3):43-51.GAO Yabei,SUN Shuguang,WANG Shenglei,CHEN Erlong,YANG Xiaoliang,SUN Zhanwei,SONG Zhaopeng.Transcriptional analysis of key enzyme genes in synthesis of lignin in fluecured tobacco leaves during maturity stage[J].Acta Tabacaria Sinica,2019,25(3):43-51.
[18] 何海丽.外源物质对临沧云烟87 烟叶折断率的影响及机制研究[D].昆明:云南大学,2017.HE Haili.Effect of exogenous substance on the mechanical strength of Nicotiana tabacum cv.Yunyan 87 leaves in Lincang and the proposed mechanism[D].Kunming:Yunnan University,2017.
[19] 谢国芳,刘娜,宋易,管春花,张明生.菜豆豆荚发育过程中内源激素与细胞壁代谢的关系[J].园艺学报,2021,48(2):289-299.XIE Guofang,LIU Na,SONG Yi,GUAN Chunhua,ZHANG Mingsheng.The relationship between changes of endogenous hormones and cell wall metabolism of common bean during bean development[J].Acta Horticulturae Sinica,2021,48(2):289-299.
[20] 梁任繁,苏义成,仇惠君,符志新.叶面喷施多效唑对网纹甜瓜幼苗农艺性状、内源激素的影响及其相互关系[J].中国瓜菜,2023,36(6):50-57.LIANG Renfan,SU Yicheng,QIU Huijun,FU Zhixin.Effects of spraying paclobutrazol (PP333) on agronomic characters of muskmelon seedlings and endogenous hormones,and their relationship[J].China Cucurbits and Vegetables,2023,36(6):50-57.
[21] 鱼尚奇,张锐,郭众仲,宋岩,付嘉智,武鹏雨,马治浩.核桃内果皮硬化期生长素动态变化及差异表达基因分析[J].园艺学报,2021,48(3):487-504.YU Shangqi,ZHANG Rui,GUO Zhongzhong,SONG Yan,FU Jiazhi,WU Pengyu,MA Zhihao.Dynamic changes of auxin and analysis of differentially expressed genes in walnut endocarp during hardening[J].Acta Horticulturae Sinica,2021,48(3):487-504.
[22] 赵玉雪,朱佳敏,杨霞,娄丽.核桃青皮中木质素、纤维素、半纤维素测定初报[J].贵州林业科技,2021,49(2):7-10.ZHAO Yuxue,ZHU Jiamin,YANG Xia,LOU Li.A preliminary report on the determination of lignin,cellulose and hemicellulose in walnut green husk[J].Guizhou Forestry Science and Technology,2021,49(2):7-10.
[23] 燕雪蒙.胡杨等三种杨树生根期间内源激素及酶活性变化分析[D].西宁:青海大学,2013.YAN Xuemeng.Studies on endogenous hormone levels and enzyme activity in cuttings of Populus euphratica Oliv three poplar species during rooting process[D].Xining:Qinghai University,2013.
[24] ALONI R,ALONI E,LANGHANS M,ULLRICH C I.Role of cytokinin and auxin in shaping root architecture:Regulating vascular differentiation,lateral root initiation,root apical dominance and root gravitropism[J].Annals of Botany,2006,97(5):883-893.
[25] 郑志锋,邹局春,陈浪,张宏健,凌敏.核桃壳木质素的1HNMR 分析[J].西北林学院学报,2007,22(2):131-133.ZHENG Zhifeng,ZOU Juchun,CHEN Lang,ZHANG Hongjian,LING Min.Analysis of walnut shell lignin by 1H-NMR by1HNMR[J].Journal of Northwest Forestry University,2007,22(2):131-133.
[26] 李夕勃,赵书岗,王红霞,高仪,张志华.核桃坚果硬壳结构与木质素和纤维素相关性研究[J].湖北农业科学,2012,51(22):5076-5079.LI Xibo,ZHAO Shugang,WANG Hongxia,GAO Yi,ZHANG Zhihua.Relationship between walnut shell structures and the content of lignin and cellulose[J].Hubei Agricultural Sciences,2012,51(22):5076-5079.
[27] NAKASHIMA K,TAKASAKI H,MIZOI J,SHINOZAKI K,YAMAGUCHI-SHINOZAKI K.NAC transcription factors in plant abiotic stress responses[J].Biochimica et Biophysica Acta,2012,1819(2):97-103.
[28] KHAN S,STONE J M. Arabidopsis thaliana GH3.9 influences primary root growth[J].Planta,2007,226(1):21-34.
[29] 周紫晶,范付华,尚先文,覃慧娟,王聪慧,丁贵杰,谭健晖.外源IAA 对马尾松幼苗茎干次生生长的影响[J].林业科学,2021,57(9):42-51.ZHOU Zijing,FAN Fuhua,SHANG Xianwen,QIN Huijuan,WANG Conghui,DING Guijie,TAN Jianhui.Effects of exogenous IAA on stem secondary growth of Pinus massoniana seedlings[J].Scientia Silvae Sinicae,2021,57(9):42-51.
[30] 鹿宏丽.外源激素IAA 和GA3 处理对核桃内果皮硬化的影响[D].阿拉尔:塔里木大学,2022.LU Hongli.The effects of exogenous hormones IAA and GA3 on endocarp hardening of walnut[D].Alar:Tarim University,2022.
[31] ZHENG L W,GAO C,ZHAO C D,ZHANG L Z,HAN M Y,AN N,REN X L.Effects of brassinosteroid associated with auxin and gibberellin on apple tree growth and gene expression patterns[J].Horticultural Plant Journal,2019,5(3):93-108.
[32] 孙麟钧,黄丽娜,江宇,李明,吴鹏飞,马祥庆.外源激素对杉木苗木生长及侧枝发育的影响[J].森林与环境学报,2023,43(3):240-249.SUN Linjun,HUANG Lina,JIANG Yu,LI Ming,WU Pengfei,MA Xiangqing.Effects of exogenous hormones spraying on growth and lateral branch development of Chinese fir[J].Journal of Forest and Environment,2023,43(3):240-249.
[33] 杨浠艺,李宗煦,姜春昱,张亿军,王昱卜,韩莹琰,刘超杰,郝敬虹.外源生长素对叶用莴苣抽薹过程中内源激素含量的影响[J].北京农学院学报,2023,38(4):40-44.YANG Xiyi,LI Zongxu,JIANG Chunyu,ZHANG Yijun,WANG Yubo,HAN Yingyan,LIU Chaojie,HAO Jinghong.Effects of exogenous auxin on endogenous hormone content and flower-related gene expression during leaf lettuce bolting[J].Journal of Beijing University of Agriculture,2023,38(4):40-44.
[34] 刘超,武云杰,张安乾,贺文俊,张思琦,陈芳,何佳,周方,杨铁钊,叶红朝.外源GA3 和IAA 对烤烟内源激素调控效应和常规化学成分的影响[J].中国农业科技导报,2019,21(8):153-160.LIU Chao,WU Yunjie,ZHANG Anqian,HE Wenjun,ZHANG Siqi,CHEN Fang,HE Jia,ZHOU Fang,YANG Tiezhao,YE Hongchao.Effects of exogenous GA3 and IAA on growth regulation and quality of flue-cured tobacco[J].Journal of Agricultural Science and Technology,2019,21(8):153-160.
[35] 王云梅.橄榄叶黄酮合成相关基因cDNA 的克隆[D].福州:福建农林大学,2009.WANG Yunmei.Cloning of cDNA encoding for associated genes of flavone biosynthesis in Chinese white olive (Canarium album Raeusch.cv.Changying) leaves[D].Fuzhou:Fujian Agriculture and Forestry University,2009.
[36] 李广柱,朱成磊,杨克彬,王新悦,高志民.毛竹C4H 基因的鉴定及其表达模式分析[J].热带亚热带植物学报,2022,30(2):151-160.LI Guangzhu,ZHU Chenglei,YANG Kebin,WANG Xinyue,GAO Zhimin.Identification and expression pattern analysis of C4H genes in Phyllostachys edulis[J].Journal of Tropical and Subtropical Botany,2022,30(2):151-160.
[37] 刘星贝.烯效唑和赤霉素浸种对甜荞抗倒伏性能的影响及其机理研究[D].重庆:西南大学,2017.LIU Xingbei.Effects of seed soaking with uniconazole and gibberellin on lodging resistance in common buckwheat (Fagopy‐rum esculentum M.)and its potential mechianism[D].Chongqing:Southwest University,2017.
[38] GHELLI R,BRUNETTI P,NAPOLI N,DE PAOLIS A,CECCHETTI V,TSUGE T,SERINO G,MATSUI M,MELE G,RINALDI G,PALUMBO G A,BAROZZI F,COSTANTINO P,CARDARELLI M.A newly identified flower-specific splice variant of AUXIN RESPONSE FACTOR8 regulates stamen elongation and endothecium lignification in Arabidopsis[J].The Plant Cell,2018,30(3):620-637.
[39] XU X F,WANG B,FENG Y F,XUE J S,QIAN X X,LIU S Q,ZHOU J,YU Y H,YANG N Y,XU P,YANG Z N.AUXIN RESPONSE FACTOR17 directly regulates MYB108 for anther dehiscence[J].Plant Physiology,2019,181(2):645-655.
[40] XU C Z,SHEN Y,HE F,FU X K,YU H,LU W X,LI Y L,LI C F,FAN D,WANG H C,LUO K M.Auxin-mediated Aux/IAA-ARF-HB signaling cascade regulates secondary xylem development in Populus[J].The New Phytologist,2019,222(2):752-767.
[41] FU Y Y,WIN P,ZHANG H J,LI C F,SHEN Y,HE F,LUO K M.PtrARF2.1 is involved in regulation of leaf development and lignin biosynthesis in poplar trees[J].International Journal of Molecular Sciences,2019,20(17):4141.
[42] HUANG G Q,HU H,VAN DE MEENE A,ZHANG J,DONG L,ZHENG S,ZHANG F L,BETTS N S,LIANG W Q,BENNETT M J,PERSSON S,ZHANG D B.AUXIN RESPONSE FACTORS 6 and 17 control the flag leaf angle in rice by regulating secondary cell wall biosynthesis of lamina joints[J].The Plant Cell,2021,33(9):3120-3133.
[43] SOMERVILLE C,BAUER S,BRININSTOOL G,FACETTE M,HAMANN T,MILNE J,OSBORNE E,PAREDEZ A,PERSSON S,RAAB T,VORWERK S,YOUNGS H.Toward a systems approach to understanding plant cell walls[J].Science,2004,306(5705):2206-2211.
[44] BONAWITZ N D,CHAPPLE C.The genetics of lignin biosynthesis:Connecting genotype to phenotype[J].Annual Review of Genetics,2010,44:337-363.